Элективная среда для брюшного тифа
Обновлено: 24.04.2024
Брюшной тиф – тяжелое острое инфекционное заболевание, характеризующееся глубокой общей интоксикацией, бактериемией и специфическим поражением лимфатического аппарата тонкого кишечника. Интоксикация проявляется сильной головной болью, помрачением сознания, бредом (тиф от греч. typhos – туман). Брюшной тиф как самостоятельную нозологическую единицу впервые попытался выделить русский врач А. Г. Пятницкий еще в 1804 г., но окончательно это сделал в 1822 г. Р. Бретонно, который дифференцировал эту болезнь от туберкулеза кишечника и высказал предположение о контагиозной природе брюшного тифа.
Возбудитель брюшного тифа – Salmonella typhi – был обнаружен в 1880 г. К. Эбертом, а выделен в чистой культуре в 1884 г. К. Гаффки. Вскоре были выделены и изучены возбудители паратифов А и В – S. paratyphi A и S. paratyphi B. Род Salmonella включает в себя большую группу бактерий, но только три из них – S. typhi, S. paratyphi A и S. paratyphi B – вызывают заболевание у человека с клинической картиной брюшного тифа. Морфологически они неразличимы – короткие грамотрицательные палочки с закругленными концами, длиной 1 – 3,5 мкм, диаметром 0,5 – 0,8 мкм (см. цв. вкл., рис. 100.2); спор и капсул не образуют, обладают активной подвижностью (перитрихи). Содержание Г + Ц в ДНК составляет 50 – 52 мол %.
Возбудители брюшного тифа и паратифов – факультативные анаэробы, температурный оптимум для роста 37 °C (но могут расти в диапазоне от 10 до 41 °C), рН 6,8 – 7,2; не требовательны к питательным средам. Рост на бульоне сопровождается помутнением, на МПА образуются нежные круглые, гладкие, полупрозрачные колонии диаметром 2 – 4 мм. Однако колонии S. typhi, имеющие Vi-антиген, мутные. Колонии S. paratyphi B более грубые, через несколько дней у них по периферии формируются своеобразные валики. На средах Эндо колонии всех трех сальмонелл бесцветны (см. цв. вкл., рис. 99б), на висмут-сульфит-агаре – черного цвета. В случае диссоциации на плотных средах вырастают колонии R-формы. Избирательной средой для возбудителей брюшного тифа и паратифов является желчь или желчный бульон.
Биохимические свойства. Возбудители брюшного тифа и паратифов дают положительную реакцию с MR, не образуют индола, не разжижают желатин, восстанавливают нитраты в нитриты, не образуют ацетоина. S. typhi не растет на голодном агаре с цитратом. Основные биохимические различия между возбудителями брюшного тифа и паратифов заключаются в том, что S. typhi ферментирует глюкозу и некоторые другие углеводы с образованием только кислоты, а S. paratyphi A и S. paratyphi B – с образованием и кислоты, и газа (табл. 33).
Биохимические свойства E. coli, S. typhi, S. paratyphi A и S. paratyphi B
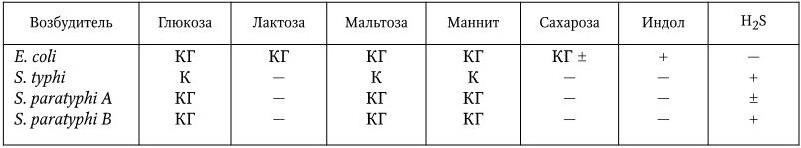
Примечание.К – образование кислоты; КГ – образование кислоты и газа; (+) – признак постоянный; (±) – признак непостоянный; ( – ) – признак отсутствует.
S. typhi по способности ферментировать ксилозу и арабинозу подразделяют на четыре биохимических типа:

Антигенное строение.
Сальмонеллы имеют О– и Н-антигены. По О-антигенам они разделяются на большое количество серогрупп, а по Н-антигенам – на серотипы (подробнее о серологической классификации сальмонелл см. в следующем разделе). S. typhi, S. paratyphi A и S. paratyphi B отличаются друг от друга как по О-антигенам (относятся к разным серогруппам), так и по Н-антигенам.
В 1934 г. А. Феликс и Р. Питт установили, что S. typhi помимо О– и Н-антигенов имеет еще один поверхностный антиген, который они назвали антигеном вирулентности (Vi-антигеном). По химической природе Vi-антиген отличается от О– и Н-антигенов, он состоит из трех различных фракций, но его основу составляет сложный полимер N-ацетилгалактозаминоуроновая кислота с м. м. 10 МД. Vi-антиген, как правило, обнаруживается у свежевыделенных культур, но он легко утрачивается под влиянием различных факторов (в частности, при выращивании при температуре выше 40 °C и ниже 20 °C, на средах с карболовой кислотой и т. п.), при длительном хранении культур, разрушается при температуре 100 °C в течение 10 мин. Поскольку он располагается более поверхностно, чем О-антиген, его наличие препятствует агглютинации культуры S. typhi О-специфической сывороткой, поэтому такую культуру обязательно проверяют в реакции агглютинации с Vi-сывороткой. Напротив, утрата Vi-антигена ведет к освобождению О-антигена и восстановлению О-агглютинации, но при этом утрачивается Vi-агглютинация. Количественное содержание Vi-антигена у S. typhi может сильно варьировать, поэтому Ф. Кауффманн предложил классифицировать S. typhi по содержанию Vi-антигена на три группы:
1) чистые v-формы (нем. viel – много);
2) чистые w-формы (нем. wenig – мало);
3) промежуточные vw-формы.
Обнаружены 3 необычных мутанта S. typhi: Vi-I – R-форма, клетки лишены Ни О-антигенов, но стойко сохраняют Vi-антиген; О-901 – лишен Н– и Vi-антигенов; Н-901 – содержит О– и Н-антигены, но лишен Vi-антигена. Все три антигена: О-, Ни Vi– имеют выраженные иммуногенные свойства. Наличие Vi-антигенов позволяет подвергать культуры S. typhi фаготипированию. Есть 2 типа фагов, лизирующих только те культуры, которые содержат Vi-антиген: Vi-I – универсальный фаг, лизирует большинство Vi-содержащих культур S. typhi; и набор Vi-II-фагов, лизирующих избирательно культуры S. typhi. Впервые это было показано в 1938 г. Дж. Крейджем и К. Иеном. С помощью Vi-фагов II типа они разделили S. typhi на 11 фаготипов. К 1987 г. было выявлено уже 106 различных Vi-фаготипов S. typhi. Чувствительность их к соответствующим фагам является стабильным признаком, поэтому фаготипирование имеет важное эпидемиологическое значение.
Разработаны также схемы фаготипирования S. paratyphi A и S. paratyphi B, по которым они разделяются на десятки фаготипов. Существенно, что фаготипы сальмонелл могут ни по каким другим признакам не отличаться друг от друга.
Резистентность. Возбудители брюшного тифа и паратифов во внешней среде (вода, почва, пыль) сохраняются, в зависимости от условий, от нескольких дней до нескольких месяцев. В проточной воде могут выживать до 10 дней, в застойной – до 4 нед., на овощах и фруктах – 5 – 10 дней, на посуде – до 2 нед., в масле, сыре – до 3 мес., во льду – до 3 мес. и больше; нагревание при температуре 60 °C убивает через 30 мин, а кипячение – мгновенно. Обычные химические дезинфектанты убивают их через несколько минут. Содержание в водопроводной воде активного хлора в дозе 0,5 – 1,0 мг/л или озонирование воды обеспечивают ее надежное обеззараживание как от сальмонелл, так и от других патогенных кишечных бактерий.
Факторы патогенности. Важнейшей биологической особенностью возбудителей брюшного тифа и паратифов А и В является их способность противостоять фагоцитозу и размножаться в клетках лимфоидной системы. Экзотоксинов они не образуют. Основным фактором патогенности их, помимо Vi-антигена, является эндотоксин, отличающийся необычно высокой токсичностью. Такие факторы патогенности, как фибринолизин, плазмокоагулаза, гиалуронидаза, лецитиназа и т. п., обнаруживаются у возбудителей брюшного тифа и паратифов очень редко. С наибольшей частотой встречается ДНК-аза (у 75 – 85 % изученных культур S. typhi и S. paratyphi B). Установлено, что штаммы S. typhi, имеющие плазмиду с м. м. 6 МД, обладают более высокой вирулентностью. Поэтому вопрос о факторах патогенности этих сальмонелл остается еще мало изученным.
Эпидемиология. Источником брюшного тифа и паратифа А является только человек, больной или бактерионоситель. Источником паратифа В, кроме человека, могут быть и животные, в том числе птицы. Механизм заражения – фекальнооральный. Заражающая доза S. typhi 105 клеток (вызывает заболевание 50 % добровольцев), заражающие дозы сальмонелл паратифов А и В значительно выше. Заражение происходит главным образом в результате прямого или непрямого контакта, а также через воду или пищу, особенно молоко. Наиболее крупные эпидемии вызывало инфицирование возбудителями водопроводной воды (водные эпидемии).
Особенности патогенеза и клиники. Инкубационный период при брюшном тифе 15 дней, но он может варьировать от 7 до 25 дней. Это зависит от заражающей дозы, вирулентности возбудителя и иммунного статуса больного. Патогенез и клиническая картина брюшного тифа и паратифов А и В очень сходны. В развитии болезни четко выявляются следующие стадии:
1) стадия вторжения. Возбудитель через рот проникает в тонкий кишечник;
2) через лимфатические пути сальмонеллы проникают в лимфоидные образования подслизистой оболочки тонкого кишечника (пейеровы бляшки и солитарные фолликулы) и, размножаясь в них, вызывают лимфангоит и лимфаденит (своеобразные брюшно-тифозные гранулы);
3) бактериемия – выход возбудителя в большом количестве в кровь. Стадия бактериемии начинается в конце инкубационного периода и может (в отсутствие эффективного лечения) продолжаться в течение всей болезни;
4) стадия интоксикации наступает вследствие распада бактерий под действием бактерицидных свойств крови и высвобождения эндотоксинов;
5) стадия паренхиматозной диффузии. Из крови сальмонеллы поглощаются макрофагами костного мозга, селезенки, лимфатических узлов, печени и других органов. В большом количестве возбудитель брюшного тифа накапливается в желчных ходах печени и в желчном пузыре, где он находит благоприятные условия для своего размножения и где бактерицидные свойства крови ослаблены влиянием желчи;
6) выделительно-аллергическая стадия. По мере формирования иммунитета начинается процесс освобождения от возбудителя. Этот процесс осуществляют все железы: слюнные, кишечника, потовые, молочные (во время кормления ребенка), мочевыделительная система и особенно активно – печень и желчный пузырь. Выделяющиеся из желчного пузыря сальмонеллы опять поступают в тонкий кишечник, откуда часть их выделяется с испражнениями, а часть вторгается вновь в лимфатические узлы. Вторичное внедрение в уже сенсибилизированные узлы вызывает в них гиперергическую реакцию, которая проявляется в виде некроза и образования язв (см. цв. вкл., рис. 100.1). Эта стадия опасна возможностью прободения стенки кишечника (язв), внутреннего кровотечения и развития перитонита;
7) стадия выздоровления. Процесс заживления язв происходит без возникновения обезображивающих рубцов на местах, очистившихся от некротических налетов. В свою очередь, в клинической картине болезни различают следующие периоды:
I – начальная стадия – stadium incrementi (1-я неделя): постепенное повышение температуры до 40 – 42 °C, нарастание интоксикации и других проявлений болезни.
II – стадия максимального развития всех симптомов – stadium acme (2 – 3-я недели болезни): температура держится на высоком уровне;
III – стадия спада болезни – stadium decrementi (4-я неделя болезни): постепенное снижение температуры и ослабление проявления других симптомов;
IV – стадия выздоровления.
На 8 – 9-й день болезни, а иногда и позднее, у многих больных появляется розеолезная сыпь на коже живота, груди и спины. Появление сыпи (мелких красных пятен) является следствием местных продуктивно-воспалительных процессов аллергической природы в поверхностных слоях кожи около лимфатических сосудов, которые в изобилии содержат возбудителя болезни. Клиническое выздоровление не всегда совпадает с бактериологическим. Примерно 5 % переболевших становятся хроническими носителями сальмонелл тифа или паратифов. Причины, лежащие в основе длительного (более 3 мес., а иногда многие годы) носительства сальмонелл, остаются неясными. Известное значение в формировании носительства играют местные воспалительные процессы в желчевыводящих (иногда в мочевыводящих) путях, которые часто возникают в связи с тифо-паратифозными инфекциями или обостряются в результате этих инфекций. Однако не менее важную роль в формировании длительного носительства сальмонелл брюшного тифа и паратифов А и В играет L-трансформация их. L-формы сальмонелл утрачивают Н-, частично Ои Vi-антигены, располагаются, как правило, внутриклеточно (внутри макрофагов костного мозга), поэтому становятся не доступными ни для химиопрепаратов, ни для антител и могут длительно персистировать в организме переболевшего человека. Возвращаясь в исходные формы и полностью восстанавливая свою антигенную структуру, сальмонеллы вновь становятся вирулентными, вновь проникают в желчные ходы, вызывают обострение процесса бактерионосительства, выделяются с испражнениями, а такой носитель становится источником заражения для окружающих. Не исключено также, что формирование бактерионосительства зависит от какого-то дефицита иммунной системы.
Постинфекционный иммунитет прочный, продолжительный, повторные заболевания брюшным тифом и паратифами бывают редко. Иммунитет обусловлен появлением антител к Vi-, O– и H-антигенам, клеток иммунной памяти и повышением активности фагоцитов. Поствакцинальный иммунитет, в отличие от постинфекционного, непродолжителен (около 12 мес.).
Лабораторная диагностика. Самым ранним и основным методом диагностики брюшного тифа и паратифов является бактериологический – получение гемокультуры или миелокультуры. С этой целью исследуют кровь или пунктат костного мозга. Кровь лучше засевать на среду Рапопорт (желчный бульон с добавлением глюкозы, индикатора и стеклянного поплавка) в соотношении 1: 10 (на 10 мл среды 1 мл крови). Посев следует инкубировать при температуре 37 °C не менее 8 дней, а с учетом возможного наличия L-форм – до 3 – 4 нед. Для идентификации выделенной культуры сальмонелл используют (с учетом их биохимических свойств) диагностические адсорбированные сыворотки, содержащие антитела к антигенам О2 (S. paratyphi A), О4 (S. paratyphi B) и О9 (S. typhi). Если выделенная культура S. typhi не агглютинируется О9-сывороткой, ее необходимо проверить с Vi-сывороткой.
Для выделения S. typhi можно использовать экссудат, полученный путем скарификации розеол – вырастают розеолокультуры.
Бактериологическое исследование испражнений, мочи и желчи проводят для подтверждения диагностики, контроля бактериологического выздоровления при выписке реконвалесцентов и для диагностики бактерионосительства. В этом случае материал предварительно засевают на среды обогащения (среды, содержащие химические вещества, например селенит, которые угнетают рост E. coli и других представителей микрофлоры кишечника, но не угнетают роста сальмонелл), а затем со среды обогащения – на дифференциально-диагностические среды (Эндо, висмут-сульфит-агар) с целью выделения изолированных колоний и получения из них чистых культур, идентифицируемых по указанной выше схеме. Для обнаружения О– и Viантигенов в сыворотке крови и испражнениях больных могут быть использованы РСК, РПГА с антительным диагностикумом, реакции коагглютинации, агрегат-гемагглютинации, ИФМ. Для ускоренной идентификации S. typhi перспективно применение в качестве зонда фрагмента ДНК, несущего ген Vi-антигена (время идентификации 3 – 4 ч).
С конца 1-й недели болезни в сыворотке больных появляются антитела, поэтому для диагностики брюшного тифа в 1896 г. Ф. Видалем была предложена реакция развернутой пробирочной агглютинации. Динамика содержания антител к S. typhi своеобразна: раньше всего появляются антитела к О-антигену, но титр их быстро снижается после выздоровления; Н-антитела появляются позднее, но зато сохраняются после болезни и прививок годами. С учетом этого обстоятельства реакцию Видаля ставят одновременно с раздельными О– и Н-диагностикумами (а также с паратифозными А– и В-диагностикумами) для исключения возможных ошибок, связанных с прививками или ранее перенесенным заболеванием. Однако специфичность реакции Видаля недостаточно высока, поэтому более предпочтительным оказалось применение РПГА, в которой эритроцитарный диагностикум сенсибилизирован либо О– (для обнаружения О-антител), либо Vi-антигеном (для обнаружения Vi-антител). Наиболее надежной и специфической является последняя реакция (Vi-гемагглютинации).
Диагностика бактерионосительства. Единственным доказательством бактерионосительства является выделение от носителя культур S. typhi, S. paratyphi A, S. paratyphi B. Материалом для исследования являются дуоденальное содержимое, испражнения и моча. Сложность проблемы заключается в том, что у носителей возбудитель не всегда выделяется с этими субстратами, бывают паузы, и довольно продолжительные. В качестве вспомогательных методов, которые позволяют сузить круг обследуемых лиц, используют серологические реакции (одновременное обнаружение О-, Н-, Vi– или О-, Vi-антител говорит о возможном присутствии возбудителя в организме) и аллергическую кожную пробу с Vi-тифином. Последний содержит Vi-антиген, который при взаимодействии с Vi-антителами дает местную аллергическую реакцию в виде покраснения и припухлости в течение 20 – 30 мин. Положительная реакция с Vi-тифином свидетельствует о наличии в организме Vi-антител и о возможном присутствии S. typhi. Для идентификации L-форм S. typhi предложены специальные иммунофлуоресцирующие антитела (к антигенам L-форм возбудителя). Оригинальный метод выявления бактерионосителей был предложен В. Муром. Он заключается в исследовании тампонов, одновременно забрасываемых в канализационные люки на всем протяжении канализационной сети населенного пункта.
Лечение. Для лечения больных брюшным тифом применяют различные антибиотики, к которым возбудители проявляют высокую чувствительность (левомицетин, ампициллин, тетрациклины и др.). Антибиотики снижают тяжесть течения болезни и сокращают ее продолжительность. Однако перенос R-плазмид сальмонеллам от E. coli или других энтеробактерий может привести к появлению среди них опасных эпидемических клонов.
Специфическая профилактика. Вместо семи различных брюшно-тифозных вакцин, применявшихся ранее, с 1978 г. в нашей стране выпускается только одна – химическая сорбированная брюшно-тифозная моновакцина. Однако в связи с тем, что брюшной тиф из эпидемического заболевания перешел в разряд спорадических (а это стало возможным, прежде всего, благодаря улучшению систем водоснабжения и канализации и повышению санитарной культуры населения), необходимость массовой иммунизации против него отпала. Поэтому прививки проводят только в случае эпидемических показаний.
Брюшной тиф (typhus abdominalis) - острое антропонозное инфекционное заболевание, вызываемое S. Enterica серотип Typhi, характеризующееся лихорадкой, симптомами общей интоксикации, бактериемией, язвенным поражением лимфатического аппарата преимущественно тонкой кишки, гепатолиенальным синдромом [1,2 ,3,4,5,11,12,18].
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Классификация
3. Редкие формы (пневмотиф, менинготиф, нефротиф, колотиф, аппендикотиф, холангиотиф, тифозный гастроэнтерит).
Основными критериями оценки степени тяжести течения брюшного тифа являются гемодинамические показатели (пульс, АД), длительность лихорадки в разгаре болезни и осложнения. Степень тяжести определяют не менее трех клинических показателей– Приложение А3
При развитии осложнений степень тяжести оценивается как тяжелая вне зависимости от других клинических показателей.
Этиология и патогенез
Возбудитель относится к семейству Enterobacteriaceae, роду Salmonella, виду enterica, подвиду I (enterica). Полное название возбудителя - Salmonella enterica serotype Typhi. В обычной практике возможно использование сокращенных вариантов названий: Salmonella ser. Typhi или Salmonella Typhi, или S. Typhi; [1, 2, 3, 4, 5, 12, 18].
Биологические свойства возбудителя: Популяция штаммов Salmonella enterica serotype Typhi включает подвижные грамотрицательные палочки, не образующие споры. Относятся к факультативным анаэробам, хорошо растут на обычных питательных средах. Вариабельно ферментируют ксилозу и арабинозу и по этой характеристике выделяют четыре ферментативных варианта S.Typhi (I-IV), которые служат эпидемиологическими маркерами штаммов [1, 2, 3, 4, 5, 12, 18]. При ее разрушении происходит освобождение эндотоксина. Антигенная структура S. Typhi представлена О-, Н- и Vi-антигенами, определяющими выработку соответствующих агглютининов. S. Typhi относительно хорошо сохраняется при низких температурах, чувствительна к нагреванию: при 56 °С погибает в течение 45–60 мин, при 60 °С — через 30 мин, при кипячении — за несколько секунд (при 100 °С почти мгновенно). Благоприятная среда для бактерий — пищевые продукты (молоко, сметана, творог, мясной фарш, студень), в которых они не только сохраняются, но и способны к размножению [1, 2, 3, 4, 5, 12, 18].
В организме человека бактерии, проникнув в клетки, под влиянием клеточных ферментов и других факторов трансформируются в L-формы. L-формы S. Typhi персистируют преимущественно в клетках костного мозга и ретикулоэндотелии. Иммуногенность L-форм резко снижена, что способствует пожизненному сохранению их в организме и формированию бактерионосительства [1, 2, 3, 4, 5, 12, 18].
Особенностью инфекционного процесса при брюшном тифе являются выраженный лимфотропизм S.Typhi, гиперергический характер воспаления в интестинальных очагах инфекции и высокая токсичность эндотоксина.
Оценка филогенетической близости штаммов S.Typhi, завезенных в 2005–2020 гг. на территорию РФ, показала, что 80% российских штаммов принадлежали к «успешному международному азиатскому клону, относящихся к одной генетической группе « гаплотипу (генотипу) Н58 и с большой вероятностью происходили из стран Юго-Восточной и Южной Азии. Такие штаммы вызывали заболевания брюшной тиф в разные годы на многих территориях РФ [47, 48, 49].
Для патогенеза брюшного тифа характерны цикличность и развитие определенных патофизиологических и морфологических изменений. Заражение происходит через рот, и первичным местом локализации возбудителей оказывается пищеварительный тракт. Особо следует отметить, что заражение не всегда влечет за собой развитие болезни. Возбудитель может погибнуть в желудке под влиянием бактерицидных свойств желудочного сока и даже в лимфоидных образованиях тонкой кишки. Преодолев желудочный барьер, возбудитель попадает в тонкую кишку, где происходят его размножение, фиксация солитарными и групповыми лимфоидными фолликулами с дальнейшим накоплением возбудителя, который по лимфатическим сосудам проникает в мезентериальные ЛУ. Эти процессы сопровождаются воспалением лимфоидных элементов тонкой, а нередко и проксимального отдела толстой кишки, лимфангитом и мезаденитом. Они развиваются в течение инкубационного периода, в конце которого возбудитель прорывается в кровяное русло, и развивается бактериемия, которая с каждым днем становится интенсивнее. Под влиянием бактерицидных систем крови лизируется возбудитель, высвобождаются ЛПС и развивается интоксикационный синдром, который проявляется лихорадкой, поражением ЦНС в виде адинамии, заторможенности, нарушений сна, поражением вегетативной нервной системы, характеризующимся бледностью кожных покровов, уменьшением частоты сердечных сокращений, парезом кишечника и задержкой стула. Этот период примерно соответствует первым 5–7 дням болезни. Воспаление лимфоидных элементов кишки достигает максимума и характеризуется как мозговидное набухание. Бактериемию сопровождает обсеменение внутренних органов, прежде всего печени, селезенки, почек, костного мозга, в них формируются специфические воспалительные гранулемы. Этот процесс сопровождается нарастанием интоксикации и появлением новых симптомов: гепатоспленомегалией, усилением нейротоксикоза, характерными изменениями картины крови. Одновременно происходят стимуляция фагоцитоза, синтез бактерицидных антител, специфическая сенсибилизация организма, резко возрастает выделение возбудителя в окружающую среду через желчь и мочевыделительную систему. Сенсибилизация проявляется появлением сыпи, элементы которой — очаг гиперергического воспаления в месте скопления возбудителя в сосудах кожи. Повторное проникновение возбудителя в кишечник вызывает местную анафилактическую реакцию в виде некроза лимфоидных образований. На третьей неделе отмечают тенденцию к снижению интенсивности бактериемии. Органные поражения сохраняются. В кишечнике происходит отторжение некротических масс и формируются язвы, с наличием которых связаны типичные осложнения брюшного тифа — перфорация язв с развитием перитонита и кишечное кровотечение. Следует подчеркнуть, что в развитии кровотечений существенную роль играют нарушения в системе гемостаза. На 4-й неделе резко снижается интенсивность бактериемии, активируется фагоцитоз, регрессируют гранулемы в органах, уменьшается интоксикация, снижается температура тела. Происходит очищение язв в кишечнике и начинается их рубцевание, острая фаза болезни завершается. Однако в силу несовершенства фагоцитоза возбудитель может сохраняться в клетках системы моноцитарных фагоцитов, что при недостаточном уровне иммунитета приводит к обострениям и рецидивам болезни, а при наличии иммунологической недостаточности — к хроническому носительству, которое при брюшном тифе рассматривают как форму инфекционного процесса. При этом из первичных очагов в системе моноцитарных фагоцитов возбудитель проникает в кровь, а затем в желчь и мочевыделительную систему с формированием вторичных очагов. В этих случаях возможны хронический холецистит, пиелит. Иммунитет при брюшном тифе длительный, но бывают повторные случаи заболевания через 20–30 лет. В связи с применением антибиотикотерапии и недостаточной прочностью иммунитета повторные случаи заболевания возникают в более ранние сроки [1, 2, 3, 4, 5, 12, 18].
4.2. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Бактериологическая диагностика брюшного тифа и паратифов А, В и С
Дата введения: с момента утверждения
1. РАЗРАБОТАНЫ: ФГУН Санкт-Петербургский НИИЭМ им. Пастера Роспотребнадзора (Л.А.Кафтырева, З.Н.Матвеева, Г.Ф.Трифонова); ГОУВПО "Санкт-Петербургская государственная медицинская академия им. И.И.Мечникова" Федерального агентства по здравоохранению и социальному развитию (А.Г.Бойцов).
2. РЕКОМЕНДОВАНЫ К УТВЕРЖДЕНИЮ Лабораторным Советом Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 24.12.07 N 11фц/5327).
3. УТВЕРЖДЕНЫ Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г.Онищенко 29 декабря 2007 г. 0100/13745-07-34
4. ВВЕДЕНЫ В ДЕЙСТВИЕ с момента утверждения.
5. ВВЕДЕНЫ ВПЕРВЫЕ.
1. Область применения
1.1. В методических рекомендациях изложены основные принципы и особенности бактериологической диагностики брюшного тифа и паратифов А, В и С; содержатся современные сведения о биологических свойствах возбудителей, резистентности к антибактериальным препаратам, о питательных средах для их выделения и особенностях дифференциации возбудителей брюшного тифа и паратифов от других серологических вариантов сальмонелл.
1.2. Методические рекомендации предназначены для специалистов микробиологических лабораторий, проводящих соответствующие исследования.
2. Список сокращений
АБП - антибактериальный препарат
ВСА - висмут-сульфит агар
ЛПУ - лечебно-профилактическое учреждение
МПК - минимальная подавляющая концентрация
РИФ - реакция иммунофлюоресценции
ЦНС - центральная нервная система
"+" - положительная реакция в первые сутки;
"-" - отрицательная реакция на 4-20 сутки;
"(+)" - замедленная положительная реакция на 2-20 сутки;
d - различные ферментативные реакции.
Возможна дифференциация на ферментативные варианты.
3. Общие положения
3.1. Брюшной тиф и паратифы А, В и С являются антропонозными кишечными инфекциями, вызываемыми микроорганизмами Salmonella Typhi, Salmonella Paratyphi A, Salmonella Paratyphi В и Salmonella Paratyphi С. В настоящее время чаще регистрируется брюшной тиф, реже - паратиф В, редко - паратиф А и крайне редко - паратиф С.
3.2. Заболевания характеризуются язвенным поражением лимфатической системы тонкой кишки, бактериемией, лихорадкой, циклическим клиническим течением с выраженной интоксикацией, розеолезной сыпью на кожных покровах туловища, гепато- и спленомегалией. Более характерен запор, нежели диарея. Изъязвление пейеровых бляшек подвздошной кишки примерно в 1% случаев приводит к кишечному кровотечению и прободению кишечника с самыми неблагоприятными последствиями для больного.
3.3. Диагноз брюшного тифа и паратифов А, В и С ставится на основании клинических признаков болезни с учетом эпидемиологического анамнеза и данных комплексного лабораторного обследования, которое включает классические бактериологический и серологический методы. Бактериологическая диагностика имеет приоритетное значение, т.к. в этом случае удается получить наиболее полную информацию о биологических свойствах возбудителя, включая его чувствительность к антибактериальным препаратам.
3.4. Применение антимикробных препаратов для этиотропной терапии брюшного тифа и паратифов позволило, с одной стороны, снизить летальность с 10-20% до уровня менее 1%, а с другой стороны - осложнило лабораторную диагностику, т.к. нередко забор материала для лабораторного исследования осуществляется уже после начала антибиотикотерапии. Этот факт заставляет более тщательно подходить к вопросу выбора материала для исследования, взятия исследуемого материала, техники исследования.
3.5. Современной особенностью эпидемиологии брюшного тифа является резкое увеличение частоты завоза (заноса) инфекции с эндемичных по этому заболеванию территорий, стран ближнего и дальнего зарубежья, а также заражение жителей России при выезде в эти страны и в процессе миграции внутри страны. Другой особенностью является наличие обширного контингента высокого эпидемиологического риска в виде лиц без определенного места жительства, среди которых регистрируется высокая заболеваемость брюшным тифом.
3.6. Данные методические рекомендации составлены с целью унификации методов бактериологической диагностики брюшного тифа и паратифов А, В и С, а также правильной интерпретации результатов лабораторного исследования с учетом современных особенностей клиники, лечения и эпидемиологической обстановки на конкретных территориях.
4. Показания к проведению бактериологической диагностики
Показанием к проведению бактериологического исследования биологического материала на наличие возбудителей брюшного тифа и паратифов А, В и С является необходимость обследования:
4.1) больных с подозрением на тифопаратифозное заболевание, а также с лихорадкой неясной этиологии, продолжающейся 5 и более дней;
4.2) лиц, общавшихся с больными брюшным тифом и паратифами А, В, С;
4.3) работников отдельных профессий, производств и организаций при поступлении на работу и по эпидемиологическим показаниям;
4.4) лиц перед поступлением в стационары и специализированные санатории по клиническим и эпидемиологическим показаниям;
4.5) лиц при оформлении на стационарное лечение в больницы (отделения) психоневрологического (психосоматического) профиля, дома престарелых, интернаты для лиц с хроническими психическими заболеваниями и поражениями ЦНС, в другие типы закрытых учреждений с круглосуточным пребыванием;
4.6) больных брюшным тифом и паратифами после исчезновения клинических симптомов перенесенного заболевания перед выпиской из стационара;
4.7) лиц, переболевших брюшным тифом и паратифами, во время диспансерного наблюдения;
4.8) хронических бактерионосителей, выявленных среди работников отдельных профессий, производств и организаций, при повторном поступлении на работу на указанные предприятия и объекты;
4.9) секционного материала при подозрении на заболевание брюшным тифом и паратифами.
5. Материально-техническое обеспечение метода
5.1. Стандартное испытательное и вспомогательное оборудование, средства измерения для микробиологических лабораторий.
5.2. Питательные среды, диагностические сыворотки и химические реагенты для культивирования, выделения, идентификации и определения чувствительности к антибактериальным препаратам возбудителей брюшного тифа и паратифов А, В и С.
5.3. Для лабораторной диагностики тифо-паратифозных заболеваний и выявления бактерионосителей должны использоваться питательные среды и реагенты, разрешенные к применению на территории Российской Федерации в установленном порядке.
6. Лабораторная диагностика брюшного тифа и паратифов
6.1. Принцип бактериологического метода основан на обнаружении живых микроорганизмов в различных биологических субстратах (кровь, моча, кал, желчь, костный мозг, розеолы) в зависимости от стадии заболевания. Для этого производят посев определенного количества биологического материала на специальные питательные среды с последующей инкубацией в термостате и идентификацией выросших колоний микроорганизмов, характерных для S. Typhi, S. Paratyphi A, S. Paratyphi В и S. Paratyphi С, по культурально-ферментативным свойствам и антигенной характеристике.
6.2. Только бактериологическое исследование может обеспечить точную постановку этиологического диагноза и контроль освобождения организма от возбудителя. В отношении дифференциальной диагностики брюшного тифа и паратифов единственным методом является лабораторное исследование биологического материала с выделением возбудителя и идентификация его до уровня серологического варианта, т.к. клиническое течение инфекционного процесса не всегда позволяет различить эти нозологические формы.
7. Бактериологическое исследование
7.1. Выделение возбудителей брюшного тифа и паратифов А, В и С проводят по одной и той же схеме бактериологического исследования биоматериалов.
7.2. Порядок сбора материала для лабораторных исследований на тифо-паратифозные заболевания определен СП 3.1.1.2137-06.
7.3. Техника сбора и транспортирования биоматериалов в микробиологические лаборатории описана в МУ 4.2.2039-05.
7.4. Материалом для бактериологического исследования с целью диагностики брюшного тифа и паратифов являются:
желчь (дуоденальное содержимое).
Возбудители могут быть также выделены из:
Материалом для бактериологического исследования с целью выявления бактерионосителей, согласно СП 3.1.1.2137-06, являются:
желчь (дуоденальное содержимое).
7.5. Исследование секционного материала проводится с целью уточнения диагноза.
7.6. Сбор биологического материала для лабораторных исследований осуществляется до начала этиотропного лечения: медицинским работником, заподозрившим тифо-паратифозную инфекцию; при групповой и вспышечной заболеваемости - специалистами учреждений Роспотребнадзора и персоналом лечебно-профилактических учреждений. От госпитализируемых больных материал для бактериологического исследования забирается в приемном отделении стационара.
7.7. От лиц, общавшихся с больными или носителями (контактными), сбор материала проводится медицинскими работниками ЛПУ и других организаций и учреждений по месту выявления больных.
7.8. Биоматериал для лабораторного исследования сопровождают специальным направлением. Доставка материала самими обследуемыми не допускается. При невозможности своевременной доставки материала используют консерванты и транспортные среды (табл.1).
8. Бактериологическое исследование крови
Показанием к исследованию крови является подозрение на тифо-паратифозные заболевания или лихорадочное состояние невыясненного происхождения (лихорадка неясного генеза), наблюдающееся в течение 5 и более дней (СП 3.1.1.2137-06).
Соотношение кровь - питательная среда должно быть 1:10-1:60. Количество независимо отбираемых проб крови и время их взятия определяется лечащим врачом согласно МУ 4.2.2039-05 при лихорадке неясного генеза или согласно МУ 04-723/3 МЗ СССР (1984) при подозрении на тифо-паратифозные заболевания. У больных, получающих антибактериальные препараты, пробы необходимо собирать непосредственно перед введением (приемом) следующей дозы препарата.
При наличии лихорадки оптимальным является взятие крови на фоне повышения температуры тела (но не на пике температуры!). Посев на питательные среды проводят непосредственно у постели больного.
При подозрении на тифо-паратифозные заболевания для посева крови можно использовать среду Рапопорт, 20%-й желчный бульон, мясопептонный бульон с добавлением 1%-й глюкозы (во флаконах по 100 мл). Ранее использовали посев крови в стерильную дистиллированную (водопроводную) воду. Однако предпочтительнее использовать специальные среды для посева крови.
Количество засеваемой крови в разгар лихорадки может составлять 10 мл, в более поздние сроки - до 20 мл (у детей - до 5 мл).
При лихорадке неясного генеза продолжительностью более 5 дней, как правило, должны исследоваться несколько проб крови. Взятие крови из вены проводят согласно МУ 4.2.2039-05. Это необходимо для дифференциации истинной бактериемии от случайной контаминации крови при венопункции (вероятность загрязнения пробы вследствие случайного прокола сальной или потовой железы составляет 3%). Для посева крови в этом случае используют две среды: 1) среду для аэробов и факультативных анаэробов и 2) среду для облигатных анаэробов (например, "двойная" среда + тиогликолевая среда согласно приказу МЗ СССР от 12.04.85 N 535) или универсальную среду для аэробов и анаэробов.
Предпочтительно использовать промышленно произведенные среды, разрешенные к применению в России.
Посевы инкубируют при 37 °С в течение 10 суток с ежедневным просмотром. При этом флаконы с "двойной" средой наклоняют, омывая плотную часть среды.
Брюшной тиф –острое инфекционное заболевание человека, вызванное Salmonellatyphi, характеризующееся длительной лихорадкой, интоксикацией, розеолезной сыпью, поражением лимфоидного аппарата кишечника и образованием язв в тонкой кишке.
Паратифы – инфекции тифо-паратифозной группы, протекающие с температурной реакцией, интоксикационным синдромом, кожными высыпаниями, диспепсическими расстройствами различной степени выраженности.
ВВОДНАЯ ЧАСТЬ
Код(ы) МКБ-10:
| МКБ-10 | |
| Код | Название |
| А01.0. | Брюшной тиф |
| A01.1 | Паратиф А |
| A01.2 | Паратиф В |
| A01.3 | Паратиф С |
| A01.4 | Паратиф неуточненный |
Дата разработки: 2017 год.
Сокращения, используемые в протоколе:
| АЛТ | аланинаминотрансфераза |
| АСТ | аспартатаминотрансфераза |
| АД | артериальное давление |
| ВОП | врач общей практики |
| ВЭБ | вирус Эпштейна Барр |
| ДНК | дезоксирибонуклеиновая кислота |
| ЖКТ | желудочно-кишечный тракт |
| ИФА | иммуноферментный анализ |
| ИТШ | инфекционно-токсический шок |
| МКБ | международная классификация болезней |
| ОАК | общий анализ крови |
| ОАМ | общий анализ мочи |
| ПЦР | полимеразная цепная реакция |
| РНГА | реакция непрямой гемагглютинации |
| СМЖ | спинномозговая жидкость |
| ССС | сердечно-сосудистая система. |
| СОЭ | скорость оседания эритроцитов |
| УЗИ | ультразвуковое исследование |
| в/в | внутривенно |
| IgG | иммуноглобулины класса G |
| IgM | иммуноглобулины класса М |
Пользователи протокола: врачи общей практики, детские инфекционисты, педиатры, фельдшера, врачи скорой медицинской помощи, хирурги.
Категория пациентов: дети.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты, которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследование случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование, или мнение экспертов. |
| GPP | Наилучшая фармацевтическая практика. |
Классификация
Брюшной тиф
По типу:
· типичные;
· атипичные: стертая и субклиническая формы; протекающие с преимущественным поражением отдельных органов –пневмотиф, нефротиф, колотиф, менинготиф, холанготиф.
По форме тяжести:
· легкая;
· среднетяжелая;
· тяжелая.
По характеру течения:
· гладкое;
· негладкое (обострения, рецидивы, формирование хронического носительства, осложнения: специфические -кишечное кровотечение, перфорация кишечника и неспецифические–пневмония, ИТШ, паротит, холецистит, тромбофлебит и др.).
Паратифы:
· по этиологии – А,В,С;
по типу:
· типичные;
· атипичные.
типичные формы:
· гастроинтестинальная;
· тифоподобная;
· септическая.
по тяжести:
· легкая;
· среднетяжелая;
· тяжелая.
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ [1,2,3,6]
Жалобы:
· повышение температуры тела;
· вялость, адинамия, анорексия;
· упорная головная боль, бессонница;
· бред, галлюцинации, потеря сознания;
· запоры;
· вздутие живота;
· судороги;
· рвота.
Анамнез:
У детей раннего возраста и новорожденных:
· острое начало заболевания;
· более короткий лихорадочный период;
· возможны катаральные явления;
· возможны менингеальный и энцефалитический
· синдромы при нормальном составе ликвора;
· реже наблюдается экзантема;
· не наблюдается относительная брадикардия, дикротия пульса;
· чем моложе ребенок, тем чаще регистрируется диарейный синдром;
· ангина Дюге не встречается;
· реже регистрируется лейкопения;
· редко наблюдаются кишечные кровотечения и перфорации;
· часто развиваются неспецифические осложнения;
· более тяжелое течение;
· возможен летальный исход.
NB! У детей старшего возраста:
· заболевание начинается с упорной головной боли, бессонницы, нарастающего повышения температуры тела, усиливающейся интоксикации;
· после возникает угнетение психической деятельности, а при тяжелых формах –тифозный статус. Последний проявляется оглушенностью больных, бредом, галлюцинациями, потерей сознания;
· периоды заболевания: нарастания клинических симптомов (5–7 дней), разгара (7–14 дней), угасания (14–21 день) и реконвалесценции (после 21 дня болезни);
· средняя продолжительность лихорадочного периода при брюшном тифе в современных условиях составляет 13–15 дней. В остром периоде у большинства заболевших температура тела повышается до 39–40 0 C;При тяжелых формах брюшного тифа лихорадка имеет постоянный характер. Следует отметить, что чем меньше суточные температурные размахи, тем тяжелее протекает заболевание. При легких и среднетяжелых формах наблюдается ремиттирующая или интермиттирующая лихорадка. В современных условиях преобладает лихорадка неправильного, или ремиттирующего, типа, что затрудняет клиническую диагностику инфекции. Изменения со стороны органов пищеварения
Атипичные формы брюшного тифа:
стертая форма брюшного тифа: выраженные симптомы интоксикации отсутствуют, температура тела повышается до субфебрильных цифр, может наблюдаться кратковременное разжижение стула. Диагностика возможна только на основании бактериологического и серологического исследований, а также при развитии специфических осложнений.
субклиническая форма брюшного тифа манифестных проявлений не имеет и обычно выявляется в очагах после проведения дополнительных обследований.
· пневмотиф;
· нефротиф;
· менинготиф;
· энцефалотиф;
· колотиф;
· тифозный гастроэнтерит;
· холанготиф.
NB!При перечисленных разновидностях заболевания в клинической картине на первый план выступают поражения отдельных органов.
Бактерионосители брюшного тифа подразделяются на категории:
1) транзиторные бактерионосители – лица, не болевшие брюшным тифом и паратифами, но выделяющие возбудителей брюшного тифа или паратифов;
2) острые бактерионосители – лица, переболевшие брюшным тифом и паратифами, у которых отмечается бактерионосительство в течение первых трех месяцев после выписки из больницы;
3) хронические бактерионосители – лица, переболевшие брюшным тифом и паратифами, у которых отмечается бактерионосительство в течение трех и более месяцев после выписки из больницы.
Паратиф В – инкубационный период составляет 5-10 дней. Заболевание начинается остро, характерно развитие гастроэнтерита с абдоминальными болями и повышением температуры тела. Температурная реакция носит неправильный характер и относительно укорочена по времени. Так же, как при паратифе А, сыпь может носить разнообразный характер, быть обильной и располагаться не только на туловище, но и на конечностях. Чаще заболевание протекает в среднетяжёлой форме, однако известны случаи тяжёлого течения паратифа В с развитием менингита, менингоэнцефалита и септикопиемии.
Паратиф C – в отличие от паратифа A или B протекает в следующих формах:
· в гастроэнтеритической форме, которая возникает при пищевом пути инфицирования, характеризуется коротким инкубационным периодом, который при массивной инвазии может продолжаться всего в течение нескольких часов. Для начала заболевания характерны многократная рвота, боли в животе и диарейный синдром. Испражнения жидкие, обильные, имеют резкий запах, нередко может отмечаться наличие мутной слизи, зелени, напоминающих болотную тину;
· в тифоподобной форме, не отличающейся клиническими проявлениями от таковых при брюшном тифе;
· в септической форме, которая характеризуется ремитирующей лихорадкой (суточные колебания температуры тела в пределах 1,5-2 С, но при этом температура не снижается до нормальных значений), тяжелым общим состоянием, а также высыпаниями на кожных покровах и наличием гнойных очагов во внутренних органах с частым развитием паренхиматозного гепатита, гнойного менингита, остеомиелита и др.
Инструментальные исследования:
Рентгенологические методы исследования грудной клетки (возможен пневмотиф) по показаниям;
· ЭКГ – для исключения миокардита при тяжелых формах брюшного тифа.
Показания для консультации специалистов:
· консультация хирурга при подозрении или развитии кишечного кровотечения, или перфорации кишечника;
· консультация других узких специалистов – по показаниям.

Диагностический алгоритм [10]:
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: исходя из особенностей патогенеза брюшного тифа, на 1-й неделе заболевания, в период бактериемии, возбудителей выделяют из крови (получение гемокультуры), со 2-й недели заболевания — из испражнений (получение копрокультуры), мочи или желчи.
Бактериологическое исследование(схема 13.2.1).
Получение гемокультуры. В 1-й день из локтевой вены больного берут 5—10 мл крови и засевают в колбу с 50—100 мл селективной среды Раппопорт, содержащей желчный бульон (для подавления роста других бактерий), глюкозу, индикатор Андреде и поплавок для обнаружения газа. Указанные соотношения крови и среды необходимы для подавления бактерицидного действия белков крови. Посевы инкубируют при 37 "С в течение 18—20 ч. На 2-й день при росте сальмонелл наблюдается помутнение и изменение цвета среды. При росте паратифозных бактерий (биовары paratyphi А, Си schottmuelleri) наряду с указанными изменениями появляются пузырьки газа в поплавке. Для ускорения ответа из среды Раппопорт делают мазки и препараты "висячая" капля. При наличии чистой культуры грамотрицательных подвижных палочек и изменении цвета среды (или наличии газа) дают первый предварительный ответ. Затем культуру из среды Раппопорт пересевают в пробирку со средой Ресселя, полагая при этом, что из крови выделена чистая культура и можно сразу приступить к ее идентификации. Одновременно со среды Раппопорт делают посевы на среду Эндо для получения изолированных колоний с целью проверки чистоты выделенной культуры.
На 3-й день отмечают ферментацию глюкозы на среде Ресселя и ставят ориентировочную реакцию агглютинации на стекле. На основании полученных данных дают второй предварительный ответ. Для дальнейшего исследования отбирают несколько бесцветных колоний со среды Эндо и пересевают их в среду Ресселя или скошенный питательный агар (для контроля полученных результатов). Чистую культуру пересевают на среды "пестрого" ряда и серотипируют в реакции агглютинации на стекле со смесью групповых сывороток, а затем с

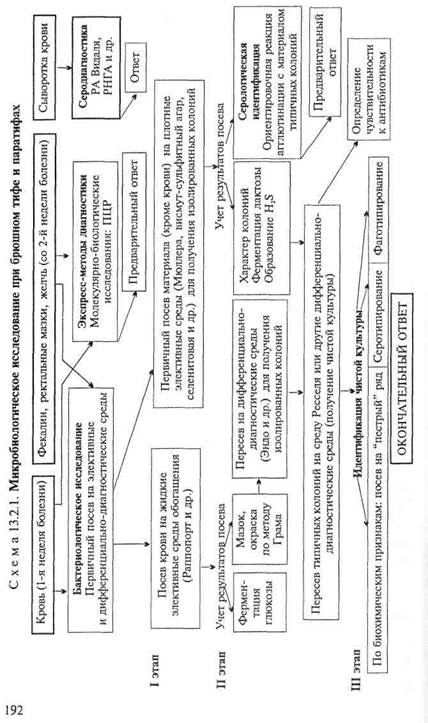 |
адсорбированными монорецепторными О- и Н-сальмонеллез-ными сыворотками. Окончательный диагноз устанавливают на основании биохимических (табл. 13.2.1) и антигенных свойств.
Таблица 13.2.1. Биохимические свойства сальмонелл — возбудителей брюшного тифа и паратифов
| Биовар S.enterica | Ферментация | Образование | |||||
| лактозы | глюкозы | мальтозы | сахарозы | ман-нита | H2S | NH3 | индола |
Typhi - К К - К + -
Paratyphi А - КГ КГ - КГ - -
Schottmuelleri — КГ КГ - КГ + +
Условные обозначения: К — образование кислоты; КГ — образование кислоты и газа; (+) — обнаружение признака; (—) — отсутствие признака.
Биохимические признаки (развернутый "пестрый" ряд) позволяют дифференцировать сальмонеллы от схожих сними энтеробактерий: Citrobacter, Hafnia (табл. 13.2.2).
Таблица 13.2.2. Дифференциация сальмонелл и других энтеробакте рий по биохимическим признакам
| Род | Лизин- декар- бокси- лаза | Ферментация углеводов | р- Галак-този-даза | ||
| дуль-цита | сорбита | ксилозы | рам-нозы | салицина | 4% лактозы |
Salmonella ± К(-) К К К - - -
Citrobacter - К(-) К К К К(±) К(±) К
Hafnia + - - К К К(+) - К
Условные обозначения: (+) — положительная реакция; (—) — отрицательная реакция; ± — вариабельная реакция; К — образование кислоты; К(—) — образование кислоты (редко); К(±) — образование кислоты (вариабельно).
Выделенную чистую культуру бактерий используют для определения чувствительности к антимикробным препаратам.
Фаготипирование. С помощью набора стандартных Vi-фагов определяют до 78 фаготипов S.enterica биовара typhi. При этом необходимым условием является наличие в культуре FZ-антигена. Культуры S.enterica биовара paratyphi В (schottmuelleri) дифференцируются на11 фаготипов и подтипов.
Получение копрокультуры. Испражнения засевают на одну из дифференциально-диагностических сред (Эндо или Левина) или элективные среды обогащения (Мюллера, селени-
товая или висмут-сульфит агар). Для посева петлю фекалий вносят в пробирку с изотоническим раствором хлорида натрия и готовят суспензию. После оседания крупных комочков суспензию петлей наносят на поверхность агаровой среды — на одну половину чашки. Материал тщательно растирают шпателем по одной, а затем по другой половине чашки для получения изолированных колоний. Посевы инкубируют при 37 °С в течение 18—20 ч. На 2-й день изучают характер колоний, выросших на чашках (рис. 13.2.1; на вклейке), пересевают 2—3 бесцветные колонии (со среды Эндо или Левина) или колонии черного цвета (висмут-сульфит агар) на среду Ресселя и в пробирки со скошенным питательным агаром. При отсутствии подозрительных колоний на чашках делают высевы из среды Мюллера или селенитовой среды на чашки со средой Эндо для получения изолированных колоний. Для ускорения ответа ставят ориентировочную реакцию агглютинации на стекле с материалом, взятым из бесцветной колонии. Далее поступают так же, как и при идентификации гемокультуры.

Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.Молеку-лярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика. Влабораторной практике широко применяют развернутую реакцию агглютинации Видаля, основанную на обнаружении в сыворотке крови людей антител — агглютининов, которые появляются в конце 1-й — начале 2-й недели заболевания. Реакцию ставят одновременно с четырьмя антигенами: О- и Н-брюшнотифозными, А- и В-паратифозными диагностикумами. Брюшнотифозные монодиагностикумы применяют для установления стадии болезни, так как содержание О- и Н-антител в разные ее периоды неодинаково. О-антитела появляются на 1-й неделе, накапливаются в разгар заболевания и исчезают к моменту выздоровления. Н-антитела появляются в разгар заболевания, накапливаются к концу заболевания и сохраняются у переболевших в течение длительного времени. У людей, вакцинированных против брюшного тифа и парати-фов, также наблюдается положительная реакция Видаля, причем в довольно высоком титре, поэтому "инфекционный Ви-даль" удается отличить от "прививочного" только по нарастанию титра агглютининов у больных в процессе заболевания. Реакцию Видаля ставят в четырех рядах пробирок по 7 пробирок в каждом ряду, из которых 5 опытных и 2 контрольные. Для контроля каждого диагностикума в пробирки вносят по 1 мл изотонического раствора хлорида натрия, в который добавляют 2 капли диагностикума. В контрольной пробирке с
1 мл сыворотки (без диагностикума) не должно быть хлопьев. При спонтанной агглютинации реакция не учитывается. Диагностический титр реакции Видаля равен 1:200. Для серологического исследования реконвалесцентов и выявления бактерионосителей широко используют реакцию непрямой И-гемаг-глютинации, с помощью которой в сыворотке крови людей определяют присутствие антител к К/-антигену. В качестве антигена используют эритроцитарный Р?-диагностикум, представляющий собой взвесь эритроцитов человека 1(0) группы, обработанных формалином и сенсибилизированных Fz'-антиге-ном S.enterica биовара typhi. Готовят разведения испытуемой сыворотки от 1:10 до 1:1280. При положительной реакции эритроциты покрывают дно пробирки в виде диска с зазубренными краями, а надосадочная жидкость остается прозрачной. При отрицательной реакции, так же как и в контроле, эритроциты осаждаются на дно пробирки и имеют виддиска с ровными краями ("пуговки"). Диагностическое значение имеет титр пассивной Й-гемагглютинации, начиная с 1:40 и выше. Всех лиц, сыворотка крови у которых дает положительный результат в РНГА с эритроцитарным F/f-диагностикумом, рассматривают как подозрительных на носительство S.enterica биовара typhi и подвергают многократному бактериологическому обследованию.
• Микробиологическая диагностика сальмонеллезов
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, при генерализованной форме — кровь.
МЕТОДЫ ДИАГНОСТИКИ: микробиологическая диагностика сальмонеллезов принципиально не отличается от диагностики брюшного тифа и паратифов. Серодиагностика не применяется по причине большого числа сероваров возбудителей.
• Микробиологическая диагностика кишечного иерсиниоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, при генерализованной форме — кровь, моча, спинномозговая жидкость.
МЕТОДЫДИАГНОСТИКИ:
Бактериологическое исследование.Посев материала на дифференциально-диагностические (среда Эндо, Мак-Конки, СБТС-агар с желчью и бромтимоловым синим) и селективные (CIN-arap с антибиотиками цефсулодином и новобиоцином) плотные среды или жидкие среды обогащения (буферно-казе-иново-дрожжевой бульон, 1 %, пептонная вода с рН 7,6—7,8). Посевы инкубируют при 25 "С в течение 24—48 ч. Идентификация чистой культуры осуществляется на основании морфологии, подвижности, тинкториальных свойств (грамотрица-

тельные палочки с закругленными концами и характерным биполярным окрашиванием, неспорообразующие, перитрихи), культуральных, биохимических признаков.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.Молеку-лярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР.В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика.Диагностическое значение имеет обнаружение антител к поверхностным антигенам возбудителей наиболее распространенных серотипов (03, 04, 05, 06, 08, 09) в РА. Положительной считается РА в титре не менее 1:160. Разработаны также ИФА-тесты.
• Микробиологическая диагностика кишечного дисбактериоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: фекалии. МЕТОДЫ ДИАГНОСТИКИ:
Бактериоскопическое исследование.Имеет ориентировочное значение. При резко выраженном дисбактериозе в мазках преобладают микроорганизмы определенных видов (например, дрожжеподобные грибы, стафилококки и др.) на фоне существенного уменьшения грамотрицательной микрофлоры.
Бактериологическое исследование.Проводится количественное исследование состава микрофлоры кишечника. Для этого из исследуемого материала готовят разведения Ю -2 , 10 -4 , Ю -6 и т.д. Первичные посевы по 0,1 мл каждого разведения производят параллельно на несколько питательных сред (Эндо, кровяной агар, ЖСА, агар Сабуро и др.) и инкубируют при 37 °С. Подсчитывают число выросших колоний и определяют число КОЕ в 1 г материала. Проводят отсев 2—3 колоний каждого вида для выделения и идентификации чистых культур микроорганизмов.
Дляобнаружения анаэробных Bifidobacterium spp. делают мерные посевы материала в разведениях 10" 7 и выше в пробирки с 13—15 мл модифицированной среды Блаурокка, в состав которой входит печеночный бульон, пептон — 1 %, лактоза — 1 %, хлорид натрия — 0,5 %, цистин — 0,01 %, агар-агар — 0,75%, твин-80 — 0,1 %. При росте Bifidobacterium spp. через 24—48 ч происходит помутнение всей среды с образованием тяжей или отдельных колоний. Готовят мазки и окрашивают по методу Грама. Выделение чистых культур Bifidobacterium spp. является весьма трудоемким и практически необязательным. При необходимости идентификацию представителей рода осуществляют по биохимическим свойствам.
Для оценки результатов бактериологического исследования
сопоставляют полученные данные с количественным содержанием микроорганизмов в норме. Ориентировочные критерии нормальной микрофлоры толстой кишки представлены в табл. 13.2.3.
Таблица 13.2.3. Критерии нормы кишечной флоры
Патогенные микробы сем. Enterobacteriaceae О
Общее количество E.coli, млн/г 300—400
E.coli со слабовыраженными ферментативными
свойствами, % До 10
E.coli с гемолитическими свойствами, % Нет
Энтеробактерии (лактозоотрицательные и лактозополо
жительные): Hafnia, Aerobacter, Citrobacter, Klebsiella,
Serratia, % До 5
Кокковые формы, % До 25
Гемолитический стафилококк по отношению ко
всем кокковым формам, % Нет
Bifidobacterium spp. (рост при посеве разведения) 10 и выше
Бактерии рода Proteus Нет
Грибы рода Candida Нет
При кишечном дисбактериозе происходит значительное снижение облигатной анаэробной микрофлоры, и в первую очередь Bifidobacterium spp., а также увеличение аэробных видов, в частности E.coli, содержание которых может превышать 10 11 микробных клеток в 1 г испражнений. Увеличивается частота обнаружения штаммов E.coli со слабой ферментацией лактозы и имеющих гемолитические свойства (до 30—40 %), гемолитических и негемолитических стафилококков, бактерий рода Proteus, грибов рода Candida (до 15—16 %). У лиц с дис-бактериозами более часто обнаруживают лактозоотрицательные и лактозоположительные энтеробактерии, относящиеся к родам Hafnia, Aerobacter, Citrobacter. Для микроорганизмов, в норме отсутствующих в испражнениях или имеющихся в небольшом количестве, показателем дисбактериоза будет содержание их 10 5 —10 6 и выше КОЕ в 1 г материала (Proteus spp., Klebsiella pneumoniae, Pseudomonas aeruginosa, Staphylococcus aureus, Candida spp.). Для окончательного заключения о кишечном дисбактериозе важное значение имеет повторное его выявление в динамике обследования больного.
• Диагностические, профилактические и лечебные препараты
Читайте также:

