Энцефалитный клещ у крс
Обновлено: 24.04.2024
Об авторах
Валентин Викторович Власов — академик РАН, доктор химических наук, профессор, директор Института химической биологии и фундаментальной медицины СО РАН. Лауреат Государственной премии РФ (1999). Автор и соавтор более 200 научных работ и девяти патентов.
Нина Викторовна Тикунова — доктор биологических наук, зав. лабораторией молекулярной микробиологии ИХБиФМ СО РАН (Новосибирск). Выпускница НГУ (1984).
Клещевой боррелиоз, или болезнь Лайма, — это переносимое иксодовыми клещами мультисистемное инфекционное заболевание с самыми разными проявлениями: кожными, суставными, неврологическими, кардиологическими и т. д. Первые симптомы возникают в течение нескольких дней или недель после укуса клеща, а поздние могут проявиться через месяцы и годы после заражения. При этом как симптомы, так и само течение болезни у разных людей могут значительно варьировать.
В месте укуса зараженного боррелиями клеща на коже появляется красное кольцо — первичная кольцевая мигрирующая эритема, результат воспалительной реакции на проникших в организм бактерий. Впоследствии на разных участках тела могут появиться множественные эритемы. Фото: James Gathany. Public Domain
В месте укуса инфицированного клеща через несколько дней может образоваться покраснение, которое расширяется в виде кольца и мигрирует по телу. Это так называемая мигрирующая эритема — яркое свидетельство локального размножения и распространения возбудителей инфекции, бактерий спирохет. Однако такое характерное покраснение развивается далеко не у всех заболевших, поэтому отсутствие эритемы не означает меньший риск развития болезни у человека, укушенного клещом. При этом 30–40% таких больных даже не замечают укус клеща, который стал причиной болезни.
В любом случае постановка клинического диагноза в ряде случаев невозможна без лабораторного подтверждения. Однако применяющиеся сегодня иммуноферментные тесты для диагностики боррелиоза несовершенны. Стандартный иммуноферментный тест регистрирует не самих боррелий, а антитела, вырабатываемые против них организмом, которые появляются лишь спустя 3–4 недели после заражения. Поэтому такие тесты часто оказываются ложноотрицательными, в первую очередь у пациентов, иммунная система которых не дала сильного иммунного ответа. Эти тест-системы нередко дают и ложноположительные результаты. Более трудоемкие анализы, основанные на определении нескольких бактериальных белков, также не дают абсолютно достоверных результатов.
Таким образом, лабораторные тесты могут подтвердить диагноз, но отрицательный результат не может считаться доказательством отсутствия боррелиоза. Поэтому врач должен проанализировать всю картину заболевания у конкретного пациента. Сделать это непросто, так как, к примеру, симптомы поражения головного мозга при боррелиозе похожи на симптомы нескольких нейродегенеративных заболеваний. А такие признаки, как слабость и головная боль, могут сопутствовать самым разным болезням, и не только инфекционным.
Считается, что у людей с нормально функционирующей иммунной системой заражение боррелиями вызывает активный иммунный ответ, так что бактерии могут погибнуть даже без стандартной для этого заболевания терапии. Для лечения болезни Лайма сегодня применяют антибиотики, наилучшие результаты дают цефтриаксон и доксициклин. Современная медицина предусматривает профилактическое применение антибиотиков для людей с высокой вероятностью заражения (укушенных клещом, с мигрирующей эритемой и т. п.) и двух-трехнедельный курс антибиотикотерапии при развитии заболевания.
Род Borrelia относится к спирохетам, ближняя родственница боррелий — бледная трепонема, возбудитель сифилиса. По внешнему виду боррелия напоминает длинную и тонкую закрученную спираль. Клетки бактерии имеют длину около 15–25 и толщину 0,2–0,3 мкм. Изображение: Janice Haney Carr, Public Domain
Несмотря на все эти меры, у некоторых больных болезнь переходит в хроническую форму, при которой не помогают даже повторные курсы антибиотиков. И здесь возникает трудность, связанная с определением причин этого болезненного состояния. Недостаточность знаний о механизмах повреждения организма в результате инфицирования боррелиями, об устойчивости бактерий к лекарствам, а также ненадежность современных методов клинической диагностики привели к появлению разных, полярных точек зрения на эту проблему.
Вакцины пока нет
Болезнь или синдром?
О проблеме клещевого боррелиоза спорят не только доктора — нет единства и среди ученых.
Согласно одной из точек зрения, с помощью стандартной антибиотикотерапии не удается уничтожить всех возбудителей болезни в организме пациентов со слабой иммунной системой. Это мнение подтверждается экспериментами на лабораторных животных: живые боррелии обнаруживались после лечения антибиотиками в организме инфицированных лабораторных мышей и обезьян. Результаты некоторых исследований говорят о том, что колонии боррелий, возможно, продолжают жить в органах и тканях в составе так называемых биопленок — сообществ микроорганизмов, заключенных в продуцируемый ими полимерный матрикс. В таком виде боррелии становятся практически недоступными для лекарств и клеток иммунной системы.
Согласно другой точке зрения, после курса антибиотикотерапии в организме не остается живых боррелий. Однако за время болезни бактерии успевают вызвать нарушения в работе иммунной системы, которые проявляются еще долгое время в виде аутоиммунных поражений. Сильными иммуногенами являются, к примеру, пептидогликаны клеточной стенки бактерий, которые могут долго сохраняться в организме. Долгосрочные токсические эффекты могут вызывать и остатки биопленок с погибшими боррелиями. Все эти бактериальные компоненты провоцируют воспалительные процессы, затрагивающие различные органы и ткани, что приводит, например, к артриту. Подобное болезненное состояние назвали пост-Лайм синдромом (Blaut-Jurkowska, Jurkowski, 2016).
Кстати сказать, ряд специалистов считает, что хроническая болезнь Лайма развивается в случае, когда пациент поражается одновременно боррелиями и другими патогенами, переносимыми клещами (например, риккетсиями). Клещи очень часто переносят одновременно возбудителей разных инфекций, и некоторые из них вызывают симптомы, клинически трудно различимые.
На ранней стадии заболевания клещевым боррелиозом люди могут испытывать самые разнообразные простудоподобные симптомы: лихорадку, усталость, нарушения сна, увеличение лимфатических узлов. В дальнейшем, при отсутствии лечения, могут отекать и болеть суставы, особенно коленные. Возникают неврологические проблемы (энцефалит, менингит, временный паралич лицевых мышц), а также нарушения функций мускулатуры, миозиты.
На поздних стадиях заболевания симптомы сильно варьируют. У некоторых больных появляются нарушения сердечного ритма, наблюдаются воспаления глаз, печени, появляется сильная слабость. Среди неврологических осложнений — тяжелая депрессия, нарушения памяти, бессонница, частая головная боль, непереносимость света или звуков, галлюцинации, энцефаломиелит и т. п.
Скрестили шпаги
С такой позицией не согласны тысячи людей в США, годами страдающие от тяжелых заболеваний, которые они связывают с последствиями клещевых инфекций. Хроническая болезнь Лайма впервые была отмечена в США еще 45 лет назад: по некоторым оценкам, число таких больных сегодня достигает 400 тыс. человек. Эти люди совместно с некоторыми врачами организовали Международное общество борьбы с болезнью Лайма и ассоциированными заболеваниями, которое предлагает применять агрессивную антибиотикотерапию при подозрении на то, что наблюдаемые болезненные симптомы вызваны боррелиозной инфекцией.
Защитники официальной точки зрения считают, что сама хроническая болезнь Лайма выдумана недобросовестными врачами, эксплуатирующими отчаянное состояние пациентов с неопределенным диагнозом. По их мнению, те пациенты, у которых современные методы диагностики не выявляют боррелий, нуждаются не в дополнительном лечении, а в помощи психиатра. В результате люди, считающие себя хроническими больными, вынуждены обращаться к врачам, несогласным с позицией медицинских властей, и лечиться за свой счет.
Как рукой снимет
Истина где-то посередине?
Таежный клещ Ixodes persulcatus — самый распространенный клещ на территории России: его ареал простирается от северо-западных районов до Дальнего Востока. Взрослые особи таежных клещей активизируются ранней весной и остаются активными до середины лета. Инфицирование людей может происходить в результате присасывания не только самок (справа), но и самцов, которые присасываются на непродолжительное время, и, в редких случаях, нимф, что может оставаться незамеченным. Фото В. Якименко (Омский НИИ природно-очаговых инфекций)
К примеру, недавно были получены экспериментальные доказательства, что пациенты с пост-Лайм синдромом страдают не какими-то психологическими расстройствами, а вполне конкретными поражениями головного мозга. В их крови, а также в восьми отделах мозга было обнаружено повышенное содержание белка, служащего маркером воспалительного процесса. При этом в течение полугода после курса антибиотикотерапии эти люди ощущали сильную слабость, неспособность концентрировать внимание; страдали нарушениями памяти и когнитивных функций (Coughlin, Yang, Rebman et al., 2018). Из-за воспалительных процессов и повреждений, связанных с боррелиозной инфекцией, подобные неврологические симптомы могут сохраняться неделями и месяцами даже после длительного начального курса антибиотиков.
Однако в редких случаях хронического боррелиоза дополнительная антибиотикотерапия все же оказывалась эффективной. Вероятно, у некоторых пациентов в организме после стандартного либо запоздалого или неполного курса лечения действительно могут сохраняться живые боррелии, т. е. речь идет именно о хронической инфекции. Напомним, что лабораторная диагностика боррелиоза сегодня ненадежна. Кроме того, в случае хронического боррелиоза инфекционные агенты могут находиться в основном внутри нейронов, т. е. за гематоэнцефалическим барьером. А диагностические системы обладают низкой чувствительностью и непригодны для использования у пациентов, у которых количество бактерий в крови невелико.
Так что все зависит от ситуации, и в некоторых случаях речь может идти о реальном хроническом инфекционном заболевании, а в некоторых — о развитии пост-Лайм синдрома после перенесенной болезни.
Боррелиоз — причина нейродегенеративных заболеваний?
Группа американских исследователей выдвинула гипотезу о связи между заражением боррелиозом и развитием нейродегенеративных заболеваний. Их натолкнуло на эту мысль сходство симптомов, наблюдаемых на поздних стадиях заболевания болезнью Лайма, с симптомами, характерными для болезни Альцгеймера, болезни Паркинсона и даже аутизма (MacDonald, 2006; Miklossy, 2008, 2015). В пользу этой гипотезы говорит и тот факт, что боррелии, как и их близкие родственники трепонемы — возбудители сифилиса, способны проникать в мозг и приводить к поражениям, характеризующимся как нейроборрелиоз (Lapenta, 2018).
Боррелии были действительно обнаружены в тонких срезах мозга пациентов, умерших от нейродегенеративных заболеваний. По мнению авторов этой работы, биопленки боррелий находились внутри амилоидных бляшек, аналогичных тем, что наблюдаются у пациентов с болезнью Альцгеймера (Miklossy, 2016). Было выдвинуто предположение, что именно иммунный ответ на эти биопленки и приводит к развитию болезни Альцгеймера, при этом человек может быть инфицирован трепонемами или боррелиями задолго до поражения мозга. Однако убедительных подтверждений эти предположения не получили.
Исследования в Национальных институтах здоровья США не выявили маркеров боррелиоза у таких больных. Но главным аргументом стал анализ распространения болезней по территории страны, так как болезнь Лайма, в отличие от нейродегенеративных болезней, встречается лишь в нескольких штатах на Восточном побережье США (Forrester, Kugeler, Perea et al., 2015). Не было получено убедительных данных и о связи боррелиоза с другими нейродегенеративными заболеваниями.
Биосенсор — для клеща, ПЦР — для людей
Одна из главных проблем с клещевым боррелиозом связана с его диагностикой на ранних стадиях развития болезни. Ведь чем раньше можно начать лечение, тем больше будет шансов избежать перехода болезни в хроническую форму.
Сегодня существует прямой метод обнаружения боррелий в крови на ранней стадии развития инфекции. Это ПЦР-диагностика, детекция бактериальной ДНК с помощью полимеразной цепной реакции. Однако простые варианты этого метода недостаточно чувствительны, а высокочувствительные, основанные на комбинации ПЦР и масс-спектрометрии, слишком сложны и дороги для применения в клинике. Недавно американская компания Ceres Nanosciences разработала еще один прямой метод обнаружения боррелий в организме. Для этого используются специальные наночастицы, на которые осаждаются бактериальные молекулы-антигены из больших объемов мочи пациента. После такого концентрирования антигены могут определяться с помощью обычного иммунного анализа (Magni, Espina, Shah et al., 2015).
Команда студентов Московского государственного университета имени М. В. Ломоносова совместно со специалистами из Института молекулярной биологии имени В. А. Энгельгардта РАН (Москва) и других исследовательских организаций приступила к разработке экспресс-диагностики зараженности боррелиозом самого переносчика болезни — иксодового клеща.
До сих пор клеща, снятого с тела, приносят в специализированную лабораторию, где инфекционный агент детектируется с помощью ПЦР или иммуноферментного анализа. Анализ занимает несколько часов и может быть выполнен только в условиях лаборатории. Принцип действия нового биосенсора основан на поиске ДНК боррелий в образце с помощью молекулярных генно-инженерных конструкций, созданных на базе системы, сконструированной из компонентов известного молекулярного комплекса для редактирования генома CRISPR/Cas.
В состав этой бинарной системы входят две молекулы РНК, комплементарные двум соседним последовательностям в бактериальной ДНК. Эти РНК несут два белка, которые являются составными частями фермента бета-лактамазы. Если в исследуемом образце есть ДНК боррелий, РНК свяжутся с ней, и белковые субъединицы сблизятся, сформировав комплекс с ферментативной активностью, в результате чего в присутствии определенного субстрата в растворе будет синтезироваться красящее вещество. Окрашивание раствора можно зарегистрировать с помощью простейшего портативного спектрофотометра.
На сегодня ситуация с хроническим боррелиозом остается тревожной. Слишком много нерешенных вопросов, связанных с диагностикой и рекомендациями по терапии пациентов, заболевших этой клещевой инфекцией.
Один из наиболее спорных вопросов: надо ли спешить с применением антибиотиков после укуса клеща. Среди официальных рекомендаций есть и такая: если клещ присасывался менее чем на сутки, опасности инфекции практически нет. Но все дело в том, что заболевшие боррелиозом порой вообще не помнят контакта с клещом — заразить могут и нимфы, которых можно просто не заметить, и самцы, которые наносят лишь кратковременные укусы. При этом большинство врачей в США и европейских странах считают, что если характерные симптомы заболевания в первые дни после заражения отсутствуют, то и антибиотикотерапию проводить не следует. С этим трудно согласиться, учитывая, что развитие инфекции может привести к долговременным нарушениям работы многих систем организма.
Ответы на все эти вопросы мы получим лишь тогда, когда ученые разберутся со сложными загадками коварной бактерии. До этих пор шарлатаны могут обирать пациентов, а страховые компании — уклоняться от выплат больным. Но для проведения полноценных научных исследований клещевых инфекций, разработки эффективных средств диагностики и терапии требуется достаточное финансирование.
В США сами больные совместными усилиями пытаются через Конгресс повлиять на ситуацию с финансированием работ по изучению болезни Лайма. Подобное движение в свое время возникло из-за эпидемии СПИДа, и в результате были приняты действенные меры по организации интенсивных исследований ВИЧ. И сегодня эта болезнь уже не является смертельным приговором. Если приложить аналогичные усилия к изучению клещевого боррелиоза, то очень скоро он уже не будет представлять такую угрозу для нашего здоровья, как сейчас.
Энцефалит (лат. наименование - encephalitis) - воспаление головного мозга. Самостоятельно процесс происходит редко и вовлекает в себя оболочки головного мозга, поэтому чаще заболевание называют менингоэнцефалит. Если присоединяется спинной мозг — энцефаломиелит.
Если при воспалении поражается белое мозговое вещество, то речь будет идти о лецкоэнцефалите, если серое — полиэнцефалите. Энцефалит может быть как диффузный, так и очаговый, а также гнойный, и не гнойный, первичный и вторичный. Заболеванию подвержены все виды сельскохозяйственных и домашних животных, в том числе кошки и собаки, а также птицы.
Некоторые заболевания к примеру, шотландский энцефалит овец, бешенство, являются антропозоонозными.
Патогенез
В зависимости от причины, вызвавшей воспалительный процесс, чаще всего рассматривается инфекционное начало. К специфическим инфекциям можно отнести заболевания, возбудитель которых местом локализации выбрал клетки и ткани головного мозга.
Специфические воспалительные процессы могут нести инфекционное начало разного происхождения:
- Вирусное (при этом возникает клещевой энцефалит, чума плотоядных, энцефалит Сан-Луи, японский энцефалит, болезнь Ньюкасла птиц, болезнь Ауески, бешенство, вирусный энцефалит тундровых животных, шотландский энцефалит овец, чума лошадей);
- Бактериальное (причиной воспаления становятся стафилококки, стрептококки);
- Простейшими (токсоплазмоз);
- Микроскопическими грибами (криптококкоз животных);
- Элементарными тельцами (пситакоз — спорадический энцефаломиелит КРС (Энцефалит Басса)).
Причиной энцефалита могу быть травмы, нанесённые в область черепа, а также осложнения после проведения хирургических вмешательств на головном мозге и органах головы.
Возможен энцефалит и при отравлении (к примеру, солями бария, которые применяются в качестве инсектицидов и зооцидов в сельском хозяйстве).
Симптомы
В зависимости от места локализации возбудителя, места нанесения травмы, дозы отравляющего вещества симптомы неврологического характера могут проявляться от лёгкого подёргивания конечностей до пареза и паралича. Животное может не узнавать владельца или обслуживающий персонал.
Наблюдаются изменения в координации движений: манежные движения, атаксия, прыжки со стороны в сторону, стремление вперёд. Возбуждение и агрессивность сменяется спокойствием и апатией.
Часто животные имеют обострённую реакцию на звуковые и световые раздражители. Условные рефлексы ослабевают до полного прекращения.
Иногда может происходить ослабление слуха и зрения, до полной слепоты, скрежет зубами и слюнотечение. Животное может стоять, упёршись головой в стену, падать и делать плавательные движения.
Приём корма может нарушаться от малого его потребления, до отказа. Иногда животное забывает о том, что в ротовой полости корм. При водопое погружение головы в воду может быть выше ноздрей, при этом всасывание воды отсутствует.
При отравлениях к неврологическим симптомам добавляются рвота, нарушение акта глотания и понос.
Изменение температуры тела не играет в симптоматике большую роль, поскольку возможно как понижение её, так и повышение, в зависимости от причины вызвавшей воспаление.
Диагноз
Диагностика основана на проведении клинических наблюдений, симптомов, эпизоотических данных, лабораторных исследований при подозрении на те, или иные инфекционные заболевания.
Лечение
Животных изолируют, обеспечивают большим количеством подстилочного материала во избежание травматизма.
Применяется симптоматическое лечение (сердечные, слабительные, мочегонные, жаропонижающие, витаминные препараты). Антибактериальные препараты, антибиотики и сульфаниламидные, первоначально применяют в ударных дозах, затем в максимальных.
При сильном возбуждении применяют успокоительные препараты, антидепрессанты и снотворные (аминазин, мединал, хлоралгидрат).
После установления точного диагноза и причины вызвавшей энцефалит назначают специальные препараты или действуют согласно с инструкцией по ликвидации заболевания.
При воспалении головного мозга прогноз, в большинстве случаев, сомнительный. Функции головного мозга возобновляются очень медленно и не всегда можно добиться первоначальной проводимости даже при проведённом своевременном лечении. Если болезнь прогрессирует прогноз неблагоприятный.
Профилактика
Профилактические мероприятия направленны на проведение своевременной вакцинации животных от инфекционных заболеваний, имеющих место в конкретной местности.
Недопущение травматизма особенно при групповом содержании животных.
Своевременные осмотры животных с выявлением первичных признаков и быстрым оказанием квалифицированной помощи.
Все виды обследования, вакцинации и лечения Вашего питомца, в том числе экстренная помощь и госпитализацию Вашего питомца.
Токсокароз - зоонозное заболевание, вызванное паразитированием круглых червей и характеризующееся…
Саркома - новообразование, которое характеризуется инфильтративным ростом клеток соединительной…
Фавус (парша) - заболевание грибковой природы, характеризующееся поражениями кожных покровов,…
Травмы головного мозга - патологическое состояние животного, проявившееся в результате механических…
Лишай - собирательное понятие заболеваний наружного покрова тела животного вызванного микроскопическими…
Тепловой удар и солнечный - острое расстройство функций центральной нервной системы в результате…
Тонзиллит - воспалительный процесс, проходящий в нёбных миндалинах, лимфоидных образованиях…
Туляремия - инфекционная болезнь бактериальной природы. Заболеванию подвержены сельскохозяйственные…
Хориоптоз - инвазионное заболевание вызываемое клещами-кожеедами рода Chorioptes. Заболеванию…
Чума крупного рогатого скота - вирусное, высоко контагиозное заболевание, имеющее острое течение…
Блефарит - заболевание воспалительного характера затрагивающее края век. Подвержены болезни…
Синовит - воспалительный процесс проходящий в синовиальной мембране выстилающей капсулу сустава.…
Все виды обследования, вакцинации и лечения Вашего питомца, в том числе экстренная помощь и госпитализацию Вашего питомца.
Энцефалит у собак - болезнь, поражающая центральную нервную систему. Признаки энцефалита проявляются…
Спорадический энцефаломиелит КРС (энцефалит Басса; Encephalomyelitis sporadica bovium — лат.; Sporadic bovine encephalomyelitis— англ.) - инфекционная болезнь крупного рогатого скота, протекающая с симптомами энцефаломиелита, атипичной пневмонии, генерализованного серозно-фибринозного плеврита, перитонита, полиартрита и другими неспецифичными признаками.
Распространенность. В 1940 г. Мак Нутт впервые сообщил о наличии в США (штат Айова) болезни молодняка крупного рогатого скота, известного под названием энцефалита Басса. Симптомы ее были сходны с признаками листериоза, однако бактериологическое исследование дало отрицательный результат.
Инфекционная природа болезни установлена в 1953 г. Менгесом, Харшфилдом и Веннером. Возбудитель выделен из суспензии головного мозга, селезенки и перитонеального экссудата больных животных, а также из желточного мешка инфицированных этими материалами куриных эмбрионов.
Микроорганизмы, выделенные в других зонах земного шара, по морфологическим, культуральным и антигенным свойствам хотя и были очень близки к возбудителю спорадического энцефаломиелита, однако в некоторых случаях они вызывали болезнь крупного рогатого скота с другими клиническими признаками. Так, в Италии болезнь протекала с симптомами бронхопневмонии, в ФРГ и ГДР — энтерита и перикардита, в Японии — атипичной пневмонии, диареи и т. д.
До настоящего времени в нашей стране спорадический энцефаломиелит крупного рогатого скота не регистрировался. Однако Т. А. Кондаков (1958) наблюдал в Якутии признаки атипичной пневмонии у телят, X. 3. Гаффаров в Татарской АССР установил подобную болезнь у телят 1—2-месячного возраста.
Возбудитель относится к группе пситтакоза — лимфогранулемы — трахомы (ПЛТ).
Элементарные тельца возбудителя спорадического энцефаломиелита представляют сферические частицы размером 300-400 нм, с однослойной, а иногда двухслойной оболочкой. Встречаются и более крупные частицы размером 400—500 нм, которые состоят из рассеянных неплотных зерен. Элементарные тельца проходят через фильтры Беркефельда, Шамберлана Ль Л2, Л3, пластины Зейтца и окрашиваются по методу Романовского — Гимза в фиолетовый цвет, по Унна — в синий, по Кастанеда — в голубой.
Элементарные тельца осаждаются при 20 тыс. g в течение 30 мин и содержат групповой комплементсвязывающий антиген и только отдельные штаммы — гемагглютинирующий.
Устойчивость возбудителя невелика: прогревание при 56 °С убивает его в течение 10 мин, обработка 2%-ным раствором щелочи, 1;%-ным фенолом, 5%-ным креазолом и т. д.— за 10— 20 мин. Ультрафиолетовое облучение в течение 10—30 мин убивает возбудителя.
Антибиотики — тетрациклин, стрептомицин — губительно действуют на агентов ПЛТ-группы.
Культивирование. Возбудителя выращивают в 5—7-дневных куриных эмбрионах при заражении в желточный мешок, в культурах клеток почки теленка и перевиваемых линиях клеток. Зараженные куриные эмбрионы инкубируют при 36 °С в течение 3—7 дней, где он накапливается в титре 106—109 ЕЛД50- В качестве материала берут желточный мешок. Возбудителя определяют по обнаружению элементарных телец. В инфицированных культурах клеток он не вызывает характерных цитопатических изменений и накапливается в титре 104—105 ЭЛД50. В окрашенных препаратах обнаруживаются элементарные тельца.
Эпизоотологические данные. К возбудителю болезни восприимчив крупный рогатый скот всех возрастов и пород, но более чувствителен молодняк в возрасте до года. В экспериментальных условиях восприимчивы овцы, свиньи, из лабораторных животных — морские свинки. Болезнь протекает энзоотически, наблюдается чаще весной, но может встречаться в любое время года. Первые случаи болезни протекают тяжело и оканчиваются гибелью 50—80% молодняка и 10—20% взрослых животных. Энзоотия охватывает 10—20% всего поголовья и продолжается от 1,5 до-3 месяцев. Наиболее вероятный способ передачи возбудителя — алиментарный, реже — респираторный (Харшфилд, 1970).
Продолжительность носительства и пути выделения возбудителя точно не определены, но отмечены случаи изолирования его из фекалий через 6 месяцев после переболевания животных.
Патогенез не изучен. Избирательным тропизмом возбудитель не обладает и способен размножаться в клетках многих органов и тканей, в том числе и центральной нервной системе, где накапливается: в селезенке, лимфатических узлах, кишечнике, печени, в крови обнаруживается только в период температурной реакции. Повреждающее действие обусловлено разрушением пораженных клеток и продуктами их распада, а также эндотоксинами возбудителя. Степень повреждения той или иной системы организма определяет клинический синдром.
Клинические признаки. Инкубационный период при естественном заражении от 4 до 27 дней, при экспериментальном — от 2 до 7 дней (Харшфилд, 1970). У больных животных повышается температура тела до 39,5—41,5°С. Лихорадка интермитирующего типа и удерживается до гибели животного или в течение 4—10 дней в случае выздоровления.
При остром течении болезни первыми появляются симптомы поражения органов дыхания (серозно-слизистые истечения из носа, кашель, признаки воспаления верхних дыхательных путей и катаральной пневмонии). На 2—3-й день болезни появляются признаки поражения центральной нервной системы, которые характеризуются резким угнетением, нарушениями координации движений, развитием состояния опистотонуса. В тяжелых случаях животные больше лежат в состоянии глубокой депрессии, иногда у них наступает паралич жевательных мышц и языка. Животные обычно погибают через 2—7 дней после появления симптомов поражения нервной системы.
В случае подострого течения болезни нервные симптомы слабо выражены. Часто развиваются признаки фибринозного плеврита и перитонита, наблюдается поражение суставов и нарушение функции органов пищеварения. При летальном исходе болезни эти признаки прогрессируют и животные погибают на 7—15-й день. В легких случаях течения болезни у животных отмечают кратковременный подъем температуры и нарушение функций органов дыхания и пищеварения. Животные выздоравливают на 10—15-е сутки.
Патологоанатомические изменения нехарактерны даже при типичном течении болезни. Наиболее выраженными признаками являются фибринозный перитонит и плеврит. На висцеральных листках брюшины, плевры, селезенки, печени и других органов обнаруживают наложения фибрина в форме сеточки. Иногда отмечают атипичную пневмонию, артриты, увеличение селезенки, кровоизлияния на плевре и брюшине, наличие экссудата в грудной и брюшной полостях и т. д.
Поражения центральной нервной системы неспецифичны и проявляются в форме сильного кровенаполнения сосудов и отечности мозговых оболочек.
Диагноз. Ввиду разнообразия клинических признаков, характера течения болезни поставить диагноз трудно. Предположительно его ставят на основании серозно-фибринозного перитонита и плеврита, нарушения координации движений, опухания суставов.
Окончательное заключение дают по выделению возбудителя болезни на морских свинках при заражении их 10%-ной суспензией органов животных. У свинок отмечают фибринозный перитонит и обнаруживают в экссудате элементарные тельца возбудителя. Ретроспективный диагноз ставят по обнаружению у переболевших животных комплементсвязывающих антител.
Лечение. Больным животным вводят антибиотики тетрациклинового ряда или стрептомицин (200—-300 тыс. ЕД) 4 раза в день в течение 3—4 дней. Животных ставят в теплые помещения и вводят в рацион легкоусвояемые питательные корма.
Иммунитет. Точных сведений о продолжительности иммунитета у переболевших животных нет. Однако установлено, что переболевшие в течение года повторно не заболевают и у них в течение 6 месяцев после выздоровления обнаруживают комплементсвязывающие антитела. Телята от переболевших матерей не приобретают устойчивости к данному агенту.
Профилактика и меры борьбы. Специфических средств профилактики (вакцины и сыворотки) против спорадического энцефаломиелита нет. Использование в качестве вакцины инактивированных препаратов (суспензия ткани желточных мешков инфицированных куриных эмбрионов, инактивированная формалином при 24 °С в течение 48 ч) и слабовирулентных штаммов не дало положительных результатов. Только отдельные животные становились устойчивыми к вирулентному возбудителю через 21 день после вакцинации. Комплементсвязывающие антитела в титре 1 : 8 обнаруживали не более чем у 50% привитых животных.
Основными мерами борьбы являются изоляция больных животных и тщательная дезинфекция помещений. Карантин накладывают только на хозяйство (ферму), где были выделены больные. Снимают карантин через 21 день после последнего случая заболевания. Из дезинфицирующих средств хороший результат оказывают 2;%-ный раствор щелочи, 1%-ный раствор фенола, 5%-ный раствор лизола и хлорная известь (Харшфилд, 1970).
Рассмотрена проблема возникновения демодекоза, обсуждена роль клеща Demodex в формировании папул и пустул на коже лица, приведены методы диагностики и подходы к лечению пациентов, меры профилактики.
The problem of demodecosis occurrence was considered, the role of Demodex tick in formation of papula and pustula on the skin of the face was discussed, methods of the diagnostics and approaches to the treatment of the patients were given, as well as the preventive measures.
Демодекоз (Demodecosis) — распространенное хроническое заболевание, преимущественно кожи лица. По разным данным, заболеваемость демодекозом составляет от 2% до 5% и стоит на седьмом месте по частоте среди кожных болезней [3, 4]. В структуре акнеформных дерматозов демодекоз составляет 10,5% [5]. Частота осложнений демодекозом у больных розацеа встречается в 88,7%, а периоральным дерматитом в 58,8% случаев [6].
Клещи рода Demodex одинаково распространены среди всех рас и всех возрастных групп [7]. Описаны редкие случаи обнаружения клеща у новорожденных [8], и в целом у детей регистрируется невысокий уровень обсемененности. По всей вероятности, это связано с более низкой выработкой кожного сала у детей по сравнению с взрослыми людьми [9]. Так, у пациентов моложе 20 лет распространенность клещей Demodex составляет 13–20%, а к 70 годам увеличивается до 95–100% [6]. У больных после 45 лет активность клещей поддерживается возрастными изменениями кожи и желез, климактерическими гормональными перестройками, а также различной соматической патологией. Наибольшее количество случаев поражения демодекозом отмечается у людей в возрастной группе 20–40 лет [10]. В лабораторных исследованиях Demodex folliculorum longus выявляется чаще, чем Demodex folliculorum brevis [1], в соотношении у мужчин — 4:1, у женщин — 10:1 [11].
Этиология и патогенез демодекоза
Как демонстрируют многие исследования, даже при наличии на кожном покрове клещей, клиническая картина заболевания развивается не всегда. Исходя из этого, можно утверждать, что клещи рода Demodex являются условно-патогенными паразитами [7]. До настоящего времени не установлены точные причины, приводящие к патогенности клещей рода Demodex, существующие теории разнообразны и противоречивы [12].
Самое распространенное мнение, что одним из пусковых факторов развития заболевания является нарушение микрофлоры кожного покрова. Следуя данной теории, развитию патогенности клеща благоприятствуют изменения функций сальных желез с последующим изменением состава кожного сала и микробиоценоза, что приводит к дисбактериозу кожи. Пусковым фактором для развития заболевания является нарушение симбиоза коринобактерий и условно-патогенной микрофлоры [5], а также усиление микробной колонизации вследствие изменения количества поверхностных липидов [13].
Согласно мнению многих авторов, успех терапии метронидазолом, не обладающим прямым антипаразитарным действием, связан с тем, что Demodex проявляет свои патогенные свойства в качестве переносчика микробов и вирусов в более глубокие отделы волосяных фолликулов и сальных желез [14]. Дополнительным фактором для развития воспалительного гнойно-некротического процесса является возможность занесения патогенных пиококков и Pityrosporum spp. в глубокие слои фолликул и сальных желез при перемещении клещей [14, 15].
Заслуживают внимания и другие теории развития воспаления в коже при демодекозе. Бацилла (Bacilluss oleronius), найденная на поверхности клеща, в результате своей жизнедеятельности способна повышать активность самих клещей, а также стимулировать другие микроорганизмы (стрептококки, стафилококки, Propionibacterium acnes, грибы рода Malassezia) [16], вырабатывать провоспалительные белки 62-Da и 83-Da, запуская каскад иммунных реакций [17].
Благоприятным фактором для возникновения демодекоза является наличие очагов хронической инфекции, нарушения функций желудочно-кишечного тракта, печени, нервной системы, эндокринных желез, длительного применения топических кортикостероидов [18–20]. Многими авторами отмечена связь подъема заболеваемости в весенне-летний период с повышенной инсоляцией, изменением температуры внешней среды [18]. Скорее всего, это можно объяснить тем, что выработка витамина D под действием ультрафиолетового излучения вызывает повышенный синтез кателицидинов (LL-37), поддерживающих активность воспалительного процесса [21, 22].
Большую роль в развитии инвазии клещами рода Demodex играет реактивность иммунной системы. Ряд авторов показали, что Demodex folliculorum встречается чаще у пациентов декретированных групп, например, при гемодиализе и Т-клеточных лимфомах [23], первичном или вторичном иммунодефиците [24], вирусе иммунодефицита человека, острой лимфобластной лейкемии и других злокачественных новообразованиях [25], после кортикостероидной [26] или цитостатической терапии [27].
Фактором для развития клещевой инвазии, поддержания активности патологического процесса, а также неэффективности проводимой терапии, по мнению большинства авторов, является дисбаланс в цитокиновом каскаде [3, 13, 28–30]. Обнаружено наличие инфильтратов вокруг клещей Demodex из эозинофилов и типичных гранулем, состоящих из CD4+ Т-хелперов [31], повышение готовности лимфоцитов к апоптозу и увеличенное количество NK клеток с Fc-рецепторами [32], снижение абсолютного числа лимфоцитов и увеличение уровня IgM [33].
Клиническая картина заболевания
Источником заражения демодекозом является человек (больной или носитель) и домашние животные. Клещи паразитируют у собак, лошадей, крупного рогатого скота. Демодекоз может быть первичным и протекать как самостоятельное заболевание и вторичным, как следствие уже имеющихся болезней кожи (розацеа, периоральный дерматит, себорейный дерматит и др.) [34].
Основная локализация клещей — сальные железы кожи лица, ушных раковин, спины, груди, мейбомиевые железы, фолликулы кожи в области сосков, редко — в области спины [2]. Атипичные локализации, где может быть найден Demodex, — половой член, ягодицы, эктопические сальные железы, слизистая оболочка рта. N. Stcherbatchoff (1903), обнаружив клещей в ресничных фолликулах век человека, доказала роль клеща в развитии блефаритов и блефароконъюнктивитов. Этиопатогенетическое влияние клещей при заболеваниях глаз достаточно велико и в настоящее время описывается многими авторами [35].
Заболевание возникает внезапно. Субъективно у больных появляются ощущения зуда, жжения, ползания, распирания и жара. Патологический кожный процесс локализуется преимущественно в области Т-зоны лица. Классические клинические проявления демодекозной инфекции — Pityriasis folliculorum, сопровождаются ощущениями зуда и жара, кожа становится истонченной, приобретая вид папирусной бумаги [1]. Акнеформный тип характеризуется преобладанием папул на коже лица, а наличие папулопустулезных элементов и диффузной эритемы говорят о розацеоподобном типе [1]. Клиническая картина demodicosis gravis имеет схожесть с гранулематозной формой розацеа, также характеризующейся наличием гранулем в дерме [1].
Интересно, что разные виды клеща вызывают различную клиническую картину, что связано, предположительно, с размерами самих клещей. При обнаружении Demodex folliculorum чаще наблюдается эритема и десквамация эпителия, при выявлении Demodex brevis — симметричные папулопустулезные элементы [36].
В научной литературе существует предположение о роли Demodex в формировании андрогенной алопеции [40]. Возможно, механизм развития облысения связан с формированием инфильтрата в волосяном фолликуле, вызванным присутствием клещей Demodex. Активированные воспалением Т-лимфоциты индуцируют синтез коллагена, что, в конечном счете, приводит к фиброзному перерождению волосяного фолликула [35].
Длительное хроническое течение демодекоза характеризуется утолщением кожи, чувством стягивания, уменьшением эластичности и мягкости, наличием серозных или кровянисто-гнойных корочек. Присоединение вторичной пиококковой инфекции сопровождается возникновением крупных пустул, нодулярных элементов, макроабсцессов, что может приводить к обезображиванию лица [34].
Диагностика демодекоза
Диагностика демодекоза может проводиться несколькими методами. Лабораторная диагностика является наиболее простым методом. В ходе нее составляется акарограмма, которая основывается на подсчете личинок, нимф, яиц и имаго. Клеща возможно обнаружить на поврежденном участке кожи, при экстракции содержимого фолликула или извлечении ресниц или бровей без повреждения волосяных фолликулов [41]. Исследуемый материал помещают на предметное стекло с 10% раствором щелочи (с целью определения активности клещей применяют глицерин), накрывают предметным стеклом и просматривают под малым увеличением микроскопа. Для более точного микроскопического подсчета обнаруженных клещей рекомендуется добавлять в исследуемый материал раствор красителя флюоресцеина [42]. Микроскопический метод является единственным для определения наличия клещей в волосяных фолликулах. Критерием клещевой активности служит количество более 5 взрослых особей, личинок или яиц на 1 см2 [34]. При диагностике демодекоза ресниц нормой считается обнаружение одного клеща на 2–4 ресницах [43].
Преимущество методики заключается в возможности анализа сразу нескольких участков поражения, а также извлечении клещей не только с поверхности кожного покрова, но и непосредственно из сальных желез. Здесь возникает другая проблема — не всегда удается добраться до клещей в глубине сальных желез. В связи с этим соскоб не является высокоинформативным методом и не доказывает отсутствие клещей [44]. К недостаткам метода также относятся травматизация эпителия, обследование небольших по величине участков поражения, относительная болезненность процедуры и дискомфорт пациентов после эпиляции [45].
Для оценки проводимой терапии делают повторные акарограммы, с целью подсчета количества и определения активности клещей [45]. Если в соскобе обнаружены исключительно продукты жизнедеятельности и пустые яйцевые оболочки, проводят повторное исследование, т. к. в процессе лечения Demodex перемещается в зоны, необработанные акарицидными средствами. В таких случаях чаще всего клещи локализуются у кромки волосистой части головы [5].
М. В. Камакина (2002) выявила достоверную статистическую вероятность отрицательного результата лабораторного анализа на наличие клещей на коже при выраженной клинической картине заболевания, которая составила 1,5% [47]. Следовательно, лабораторные методы не являются абсолютно достоверными.
Более информативным методом диагностики демодекоза является проведение кожной биопсии с последующей гистологией полученных препаратов. С этой целью пункционным (панч) или эксцизионным (скальпель) методом берут небольшой участок кожи, фиксируют его в течение суток 10% нейтральным раствором формалина, уплотняют парафином и окрашивают гематоксилин-эозином. Гистологическое исследование дает массу преимуществ. В частности, можно полностью посмотреть сальную железу и окружающие ее участки. При ретроспективном патоморфологическом исследовании биоптатов кожи головы в 15% случаев наблюдалось сочетание демодекоза с грибковыми, воспалительными поражениями, невусами, фиброзом [48]. Главным недостатком метода является травматизация кожи с образованием рубца, а также невозможность обследования большой поверхности кожного покрова [45].
В качестве диагностического инструмента для выявления Demodex R. Segal и соавт. (2010) предложили использовать дерматоскоп. Метод дерматоскопии позволяет визуализировать клещей на поверхности кожного покрова, а также расширенные сосуды кожи [49]. Другим неинвазивным методом оценки наличия клещей Demodex является применение оптической когерентной томографии, позволяющей в режиме реального времени оценить состояние кожи больных в двух проекциях [50].
С появлением конфокального лазерного микроскопа стал доступен новый метод обследования больных на наличие клещей Demodex. Конфокальная лазерная сканирующая микроскопия позволяет визуализировать поверхностные слои кожного покрова in vivo, а также получить объемное четырехмерное изображение [51]. Преимуществами метода является высокая информативность, неинвазивность и, как следствие, отсутствие дискомфорта у пациентов.
Лечение демодекоза
При выборе терапии демодекоза необходимо учитывать клиническую картину заболевания, тяжесть процесса, а также сопутствующую патологию пациента [52, 67–69].
До сих пор на протяжении многих лет самым эффективным препаратом в терапии демодекоза остается метронидазол, являющийся производным нитроимидазольной группы [53]. Метронидазол обладает выраженным противовоспалительным [22], противоотечным [54], иммуномодулирующим действием [55]. Стандартная схема лечения метронидазолом — 250 мг 3 раза в день в течение 2–4 недель [52].
Другим препаратом выбора является орнидазол, назначаемый по схеме 500 мг два раза в день курсами по 10 дней [52]. Препарат имеет как противопаразитарное, так и бактериостатическое действие, повышает активность нейтрофилов, стимулирует адренергические структуры, усиливает репаративные процессы [52, 56].
Наружная терапия также должна включать антипаразитарные средства. Наиболее часто используется метронидазол (Клион, Метрогил) в виде мази или геля 2%, применяемый в течение 14 дней. В качестве альтернативной терапии возможно применение мази бензилбензоат [1, 10, 43, 57].
С целью достижения элиминации клещей назначают акарицидные препараты. Из фармакологической группы пиретроидов, обладающих антипаразитарными свойствами, доказал свою эффективность перметрин [4, 58]. Небольшое количество мази тонким слоем наносят на пораженные участки кожи. Мазь смывают водой через 24 часа. В большинстве случаев достаточно однократного применения, но при недостаточной эффективности (появление новых элементов сыпи, сохранение зуда) процедуру рекомендуется повторить через 14 дней.
Хорошо переносится и не вызывает серьезных нежелательных лекарственных реакций препарат Спрегаль, содержащий раствор эсдепалетрина и пиперонила бутоксида [18, 59].
При наличии папулопустулезных высыпаний показано назначение классических редуцирующих мазей и паст (цинк-ихтиоловая [60], 1–2% дегтярная и 1–2% ихтиоловая мази, 1% ихтиол-резорциновая паста) [61].
Некоторые авторы высоко оценивают терапевтическую эффективность геля Демотен (сера, гиалуроновая кислота, сок алоэ вера, поливинилпирролидон) [62].
Однако, несмотря на успешную терапию с применением классических средств, в практике дерматовенеролога все чаще встречаются резистентные к терапии и рецидивирующие формы демодекоза. В связи с этим разрабатываются новые методы и методики лечения. Например, Л. Р. Беридзе (2009) рекомендует использовать сочетанную методику криотерапии с кремом Розамет (метронидазол 1%) [57].
В случае акнеформного типа демодекоза или резистентности к антипаразитарным препаратам целесообразно использовать системные ретиноиды (изотретиноин) в дозировке 0,1–0,5 мг/кг массы тела в сутки в течение 2–4 месяцев [63].
При лечении демодекоза глаз используются антихолинэстеразные средства (холиномиметики): физостигмин, 0,02% фосфакол, 0,01% армин, 0,5% тосмилен [38]. Хорошие результаты лечения наблюдаются при применении Блефарогеля 1 и 2, Блефаролосьона [64].
Из физиотерапевтических методик рекомендуется использовать свойства узкополосного синего света (405–420 нм). Длины волн голубого света несколько больше длин волн ультрафиолетового излучения, поэтому узкополосный синий свет достигает сетчатого слоя дермы, проникая на глубину до 2,5 мм, соответствующей расположению сальных желез. Единичные наблюдения свидетельствуют о высокой эффективности данного метода при лечении акне, осложненных демодекозом [65].
Меры профилактики сводятся к соблюдению общегигиенических правил, адекватного и рационального ухода за кожей лица, полноценного питания и отдыха. Важно применение защитных средств против ультрафиолетового излучения, а также ограничение пребывания на солнце [66].
Таким образом, несмотря на то, что демодекоз часто встречающееся заболевание, до сих пор не раскрыты этиологические факторы, приводящие к патогенности клеща, и не установлен точный механизм развития воспаления кожи, не оценена роль Demodex в возникновении воспалительных дерматозов на коже лица. Противоречивость мнений различных авторов вызывает много споров и вопросов, требующих дальнейшего исследования. Лечение антипаразитарными средствами не всегда эффективно и часто провоцирует развитие хронически резистентных к терапии форм.
Литература
А. А. Кубанов, доктор медицинских наук, профессор
Ю. А. Галлямова, доктор медицинских наук, профессор
А. С. Гревцева 1
Что такое болезнь Лайма? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Болезнь Лайма (иксодовый клещевой боррелиоз) — опасное инфекционное трансмиссивное заболевание острого или хронического течения, вызываемое бактериями рода Borrelia, которые поражают кожу, суставы, сердце и нервную систему. Клинически характеризуется полиморфизмом проявлений и без лечения приводит к стойкому нарушению жизнедеятельности и инвалидизации человека.
Возбудитель боррелиоза
род — Borrelia (тип Спирохет)
виды — более 10, из них наиболее этиологически значимые Borrelia burgdorferi (наиболее распространён), Borrelia azelii, Borrelia garinii.
Грамм-отрицательны. Культивируются в видоизменённой среде Kelly (селективная среда BSK-KS). Любит жидкие многокомпонентные среды. Жгутиконосцы. Небольшого диаметра, что позволяет им обходить большинство бытовых бактериальных фильтров. Borrelia burgdorferi состоит из плазмоцилиндра, покрытого клеточной мембраной, имеющей в составе термостабильный ЛПС. Температурный оптимум — 33-37°С. Сходствует со штопорообразной извитой спиралью. Вид завитков неравномерный, вращательные движения медленные.
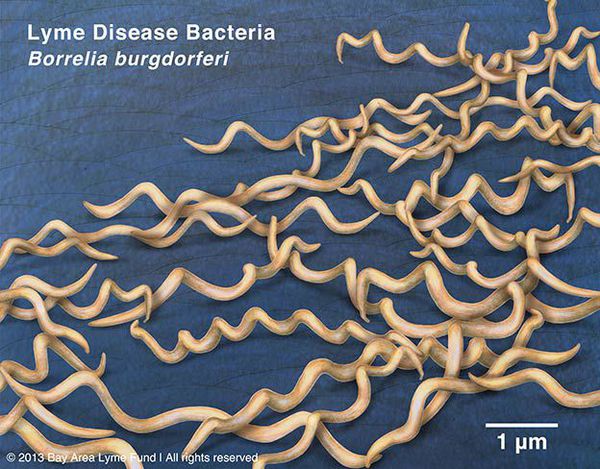
Группы антигенов: поверхностные Osp A, Osp B, Osp С (обуславливают различия штаммов). Этиологические агенты генетически гетерогенны (то есть комплекс Borrelia burgdorferi sensu lato — вызывает группу этиологически самостоятельных иксодовых боррелиозов).
Хорошо красятся анилиновыми красителями. Неплохо выдерживают низкие температуры. Фенол, формалин, спирт и другие обеззараживающие вещества, а также ультрафиолетовое излучение вызывают быструю гибель. Является внутриклеточным паразитом. [2] [3] [5]
Эпидемиология
Природно-очаговое заболевание. Источник инфекции — различные животные (олени, грызуны, волки, домашние и дикие собаки, еноты, овцы, птицы, крупный и мелкий рогатый скот и другие). Переносчики — иксодовые клещи (таёжный и лесной): Ixodes demine (США), Ixodes ricinus и Ixodes persulcatus (Россия и Европа).

Род Ixodes — это темно-коричневый клещ с твёрдым, чуть больше булавочной головки телом, похож на корочку на ссадине или кусочек грязи. В тканях животных возбудитель присутствует в очень небольшом количестве (сложно обнаружить). Исходя из географии заболевания боррелии расселяются с мигрирующими птицами, прикрепившись к ним. Возможен симбиоз нескольких видов боррелий в одном клеще. Возбудитель передаётся среди клещей трансовариальным способом, то есть от самки к потомству. Живут дклещи о 2 лет, часто находятся на кустарниках не выше одного метра от земли. Перезимовать способны только самки, самцы погибают после спаривания. В эндемичных районах заражённость клещей достигает 70%, в остальных регионах — от 10%. Высокая частота инфицированности клеща не является постулатом высокой заболеваемости людей после укуса, так как лишь у немногих клещей боррелии находятся в слюнных железах. Сосание крови осуществляется длительное время и боррелии поступают в ткани не сразу, поэтому ранее удаление клеща существенно снижает риск передачи.
Заразен ли боррелиоз
Механизмы передачи инфекции:
- трансмиссивный (инокуляция — при укусе; очень редка контаминация — при втирании остатков клеща в рану);
- вертикальный (трансплацентарно — от матери к плоду);
- алиментарный путь (через молоко больного животного).
Между людьми боррелиоз не распространяется (исключая вертикальный механизм). Через грудное молоко, слюну и половые жидкости боррелиоз не передаётся.
Распространённость
География распространения достаточно широкая: США, Прибалтика, лесная Европа, Северо-Запад и Центр России, Предуралье, Урал, Западная Сибирь, Дальний Восток.
Сезонность весенне-летняя и осенняя (то есть во время тепла, когда клещи активны). Иммунитет нестерильный. Повторные заболевания возможны через 5-7 лет. [1] [4]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы болезни Лайма
Инкубационный период в различных источниках колеблется от 1 до 50 дней (в практической деятельности следует придерживаться срока 1-30 дней).
Синдромы заболевания:
- общей инфекционной интоксикации;
- эритемы (покраснение кожи);
- артрита;
- регионарной лимфаденопатии (увеличение лимфоузлов);
- поражения нервной системы;
- поражения сердечно-сосудистой системы;
- гепатолиенальный (увеличение печени и селезёнки).
Периоды развития заболевания имеют достаточно условный характер, в основном ограничены лишь временными рамками:
- ранний (локализованная и диссеминированная стадии);
- поздний;
- резидуальный.
Локализованная стадия раннего периода
Начинается остро или подостро с невысокой лихорадки (субфебрильная температура тела — 37,1-38°C), головной боли, слабости, дискомфорта в мышцах и суставах. Редко бывает тошнота и рвота. Катар (воспаление) верхних дыхательных путей возникает очень редко, иногда бывает регионарная лимфаденопатия, гепатолиенальный синдром.
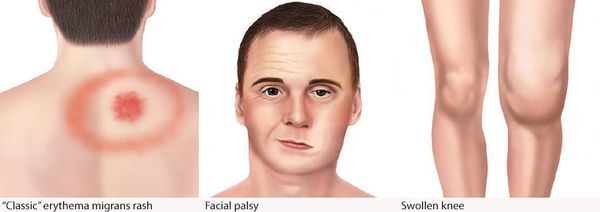
Самым ярким признаком данной фазы болезни (однако не всегда!) является выход на поверхности кожи мигрирующей кольцевидной эритемы (патогномоничный признак заболевания). Вначале в месте локализации укуса клеща возникает первичный аффект (покраснение 2-4 мм красноватого цвета), затем появляется пятно или папула интенсивного розово-красного цвета, в продолжении нескольких суток распространяющаяся во все стороны на много сантиметров в диаметре. Края пятна становятся чётко очерченными, ярко-красными, чуть возвышающимися над уровнем неизменённой кожи. Чаще в центре пятно медленно бледнеет, становится цианотичным (синеет), и образование приобретает характерный вид кольцевидной эритемы овальной или округлой формы.

В месте локализации эритемы не исключается зуд, слабая болезненность. При отсутствии антибиотикотерапии эритема визуализируется в течение нескольких дней, при их отсутствии может держаться до двух месяцев и более. В исходе — слабая непродолжительная пигментация, шелушение. У части больных появляется несколько эритем меньшего диаметра (обычно в более поздний период).
Диссеминированная стадия раннего периода
Эта стадия начинается на 4-6 неделе болезни (при отсутствии профилактической и лечебной терапии предшествующего периода). В этот период происходит угасание предшествующей симптоматики (синдрома общей инфекционной интоксикации, лихорадки и эритемы). Выявляются неврологические нарушения:
- мягкотекущий энцефалит,
- мононевропатии,
- серозные менингиты,
- энцефаломиелит с радикулоневритическими реакциями,
- лимфоцитарный менингорадикулоневрит, характеризующийся болями в месте укуса, сильными корешковыми болями с нарушением чувствительности и двигательной функции шейного и грудного отделов спинного мозга — так называемый синдром Бэннуорта, включающий триаду: корешковые боли, периферический парез (чаще лицевого и отводящего нервов) и лимфоцитарную клеточную реакцию с содержанием клеток от 10 до 1200 в мм3) при выполнении люмбальной пункции.
Возможно поражение сердечно-сосудистой системы — кардиалгии, сердцебиения, повышение артериального давления, миокардиты, AV-блокады (нарушения передачи нервного импульса в проводящей системе сердца).
Иногда бывают поражения кожи (уртикарные и другие высыпания). Может наблюдаться боррелиозная лимфоцитома (доброкачественный лимфаденоз кожи) — синюшно-красный кожный инфильтрат с лимфоретикулярной пролиферацией, преимущественно располагающийся на мочке уха или соске груди. Редко возникают поражения глаз в виде конъюнктивита, хориоидита, ирита.

Не исключаются лёгкие гепатиты, нарушение работы почек.
Поражения суставов в виде реактивного артрита (в основном крупные суставы) в виде болей и ограничения подвижности, без внешних изменений, длительностью от недели до трёх месяцев. При отсутствии лечения болезнь Лайма переходит в хроническую форму.
Поздний период лаймборрелиоза

Боррелиоз у беременных
Заражение женщины во время беременности (и до неё при отсутствии лечения) повышает риск гибели плода и выкидыша. Возможно внутриутробное поражение плода с развитием энцефалита и кардита, однако величина риска этого остаётся неясна.
Отличия боррелиоза у детей
Болезнь Лайма у детей чаще всего развивается в возрасте от 3 до 10 лет. При этом часто появляется мигрирующая эритема (покраснение кожи), расположенная в верхней половине тела. Интоксикация, как правило, сильнее, чем у взрослых. Могут увеличиваться лимфатические узлы возле места укуса клеща. Без лечения до 20 % случаев болезни Лайма переходит в хроническую форму.
Дифференциальный диагноз:
- в первую фазу — лихорадочные состояния с экзантемой, клещевой энцефалит, рожистое воспаление, эризипелоид, целлюлит;
- во вторую стадию — серозные менингиты другой этиологии, клещевой энцефалит, ревмокардит;
- в третью стадию — ревматизм и сходные заболевания, ревматоидный артрит, болезнь Рейтера. [3][6]
Отличия от клещевого энцефалита
При клещевом энцефалите присутствует выраженная лихорадка, общемозговая и неврологическая симптоматика, при боррелиозе — поражения кожи, суставов и сердца.
Патогенез болезни Лайма
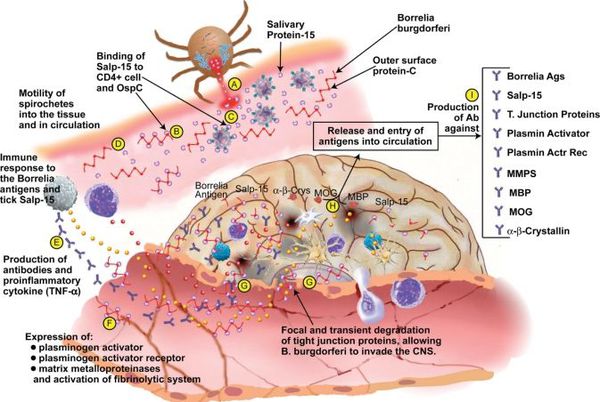
В случае прогрессирования боррелиоза (отсутствия лечения) происходит дальнейшее размножение боррелий, расширение спектра антител к антигенам спирохет и их длительная выработка (хронизация инфекции). Появляются циркулирующие иммунные комплексы, усиление продукции T-хелперов, лимфоплазматические инфильтраты (уплотнения ткани) в органах.
Ведущую роль в патогенезе артритов несут липополисахариды, стимулирующие синтез ИЛ-1 клетками моноцитарно-макрофагального ряда, Т- и В-лимфоцитов, простагландинов и коллагеназы синовиальной тканью (то есть происходит активация воспаления в полости суставов). Циркулирующие иммунные комплексы накапливаются в органах, привлекают нейтрофилы, которые вырабатывают медиаторы воспаления, вызывая воспалительные и дистрофические изменения в тканях. Возбудитель может сохраняться в организме десятилетия, поддерживая иммунопатологический процесс. [2] [3] [6]
Классификация и стадии развития болезни Лайма
1. По форме:
- манифестная;
- латентная (симптомы отсутствуют, только лабораторные изменения);
2. По течению:
- острое (до трёх месяцев)
- подострое (от трёх до шести месяцев);
- хроническое (более шести месяцев) — непрерывное и рецидивирующее.
3. По периодам:
- ранний (острая и диссеминированная стадии);
- поздний;
- резидуальные явления.
4. По клиническим признакам (при остром и подостром течении):
5. По преимущественному поражению какой-либо системы:
- нервной системы;
- опорно-двигательного аппарата;
- кожных покровов;
- сердечно-сосудистой системы;
- комбинированные.
6. По степени тяжести:
Осложнения болезни Лайма
Осложнения не характерны, но существуют резидуальные (остаточные) явления заболевания — стойкие, необратимые изменения органического характера (кожи, суставов, сердца, нервной системы при отсутствии явного воспалительного процесса и зачастую самого возбудителя). Они возникают не во время разгара болезни, а спустя длительное время (годы) и снижают работоспособность человека, вплоть до инвалидности. К ним относятся деформирующие артриты с органическими изменениями суставов, истончение кожи, нарушение мнестических функций, памяти, снижение работоспособности.
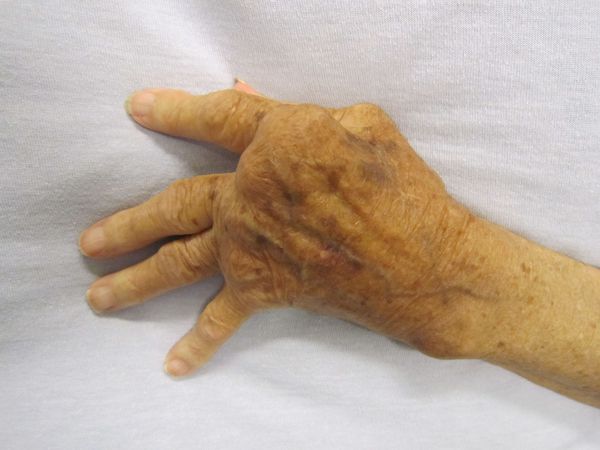
Диагностика болезни Лайма
К какому врачу обращаться при подозрении на боррелиоз
При укусе клеща и подозрении на клещевой боррелиоз необходимо обратиться к инфекционисту.
Какие исследования может назначить врач
- общеклинический анализ крови с лейкоцитарной формулой (нейтрофильный лейкоцитоз, повышение СОЭ);
- биохимический анализ крови (повышение островоспалительных белков, РФ, сиаловых кислот);
- серологические тесты (ИФА классов IgM и IgG, при сомнительных данных выполнение иммуноблоттинга. ПЦР крови, синовиальной жидкости, ликвора).
- МРТ ГМ (признаки атрофии коры головного мозга, дилатации желудочковой системы, воспалительные изменения, арахноидит).
В практической деятельности следует подходить к диагностике комплексно, учитывая совокупность данных, а не только результаты одного вида исследований. Например, в случаях, когда у пациентов при регулярных исследованиях неоднократно выявляются изолированные повышенные титры IgM (даже при подтверждении иммуноблоттингом) при отсутствии IgG, то это следует расценивать как ложноположительный результат. Причинами этого явления могут быть системные аутоиммунные заболевания, онкология, иные инфекционные заболевания, туберкулёз и другие, зачастую причины остаются невыясненными. [1] [4]
Через какое время после укуса клеща сдавать анализ на боррелиоз
Анализы следует сдавать сразу после укуса клеща и повторно три недели спустя.
Лечение болезни Лайма
Может проводиться как в инфекционном отделении больницы (при тяжёлом процессе), так и в амбулаторных условиях.
Показана диета № 15 по Певзнеру (общий стол). Режим отделения.
Медикаментозное лечение. Антибактериальная терапия
Наиболее важным и эффективным является применение этиотропной терапии (устраняющей причину) в как можно более ранние сроки от момента укуса клеща. Является достаточно дискутабельным вопрос о применении антибактериальной терапии в ранние сроки (до пяти дней от момента укуса) у необследованных лиц (или до момента получения результатов обследования клеща). Однако с практической точки зрения, учитывая возможность полиэтиологического характера возможного заражения человека (клещевой боррелиоз, моноцитарный эрлихиоз, гранулоцитарный анаплазмоз и другое) и серьёзные прогнозы при развитии системного клещевого боррелиоза, данное превентивное (профилактическое) лечение вполне обосновано. Применяются препараты широкого спектра действия, например, тетрациклинового, цефалоспоринового и пенициллинового рядов.
При развитии поздних стадий системного клещевого боррелиоза эффективность антибиотикотерапии существенно снижается (однако показания сохраняются), так как основное значение приобретают процессы аутоиммунных поражений при малоинтенсивном инфекционном процессе. Курсы лечения длительные (до одного месяца и более), в совокупности с препаратами улучшения доставки антибиотиков в ткани, десенсибилизирующей, противовоспалительной, антиоксидантной терапией.
В случае развития гипериммунного аутопроцесса (патологически усиленного иммунитета) назначаются средства, снижающие реактивность иммунной системы.
После перенесённого заболевания устанавливается диспансерное наблюдение за человеком до двух лет с периодическими осмотрами и серологическим обследованием. [1] [5]
Пробиотики
При лечение антибактериальными препаратами следует принимать пробиотические средства.
Дезинтоксикационная терапия
Выраженная интоксикация при болезни Лайма встречается редко, поэтому дезинтоксикационная терапия обычно не требуется.
Симптоматическое лечение
Для уменьшения симптомов боррелиоза могут применяться нестероидные противовоспалительные средства и противоаллергические препараты.
Общеукрепляющая терапия и физиотерапия
При лечении хронических форм боррелиоза можно применять средства общеукрепляющей терапии: витамины и иммуностимуляторы. Также могут назначаться физиотерапевтические процедуры: электрофорез, УФ-облучение, магнитотерапия, УВЧ, парафиновые аппликации, массаж, ЛФК. Эти методы популярны в России, однако исследований, подтверждающих их эффективность при восстановлении после болезни Лайма, недостаточно.
Прогноз. Профилактика
Неспецифическая профилактика — использование защитной плотной одежды при посещении лесопарковой зоны, отпугивающих клещей репеллентов, периодические осмотры кожных покровов (раз в два часа). Централизованная обработка лесных и парковых угодий акарицидными средствами. При обнаружении присосавшегося клеща незамедлительно обратиться в травматологическое отделение для удаления клеща и отправки его на обследование и параллельно обратиться к врачу-инфекционисту для наблюдения, обследования и получения рекомендаций по профилактической терапии.
Специфическая — профилактическое использование антибиотиков в ранние сроки после укуса клеща по назначению врача. [4] [5]
Создаётся ли иммунитет после перенесённого боррелиоза
Повторно заболеть можно через 5-7 лет, в некоторых случаях раньше.
Существует ли прививка от боррелиоза
Вакцины от болезни Лайма сейчас нет. Компании Valneva, Pfizer и MassBiologics разработали вакцины-кандидаты, которые проходят клинические испытания [7] .
Читайте также:

