Энтеробактер как внутрибольничная инфекция
Обновлено: 19.04.2024
Инфекции вызванные энтеробактериями. Механизмы развития
Энтеробактерии (кишечные бактерии) — представители большого семейства (более двадцати родов и свыше ста видов) факультативных грамотрицательных палочковидных анаэробов, хорошо растущих на питательных средах, восстанавливающих нитраты и ферментирующих глюкозу. Способны вызывать множество различных заболеваний.
Энтеробактерии распространены повсеместно. Они составляют основу нормальной микрофлоры организма человека и животных; в большом количестве их обнаруживают в почве и воде. Заражение происходит при контакте с животными, другими людьми и контаминированными предметами. Очень часто заболевания вызывают условно-патогенные представители нормальной микрофлоры человека.
Численность энтеробактерии зависит от их локализации в организме, его состояния (здоровый или больной) и проводимой антимикробной терапии.
Патогенез инфекции вызванной энтеробактериями
Капсулы энтеробактреий. Многие микроорганизмы обладают полисахаридной капсулой (например, бактерии рода Klebsiella, Escherichia coli и Salmonella typhi). Основной фактор вирулентности Salmonella typhi — капсульный Vi-антиген, поэтому для профилактики тифа применяют вакцину, содержащую его. Чаше всего менингит и септицемию у новорождённых вызывает Escherichia coli K1.
Существуют определённые биохимические и структурные сходства между Escherichia coli К1, N. meningitidis группы В и антигенами центральной нервной системы человека, что даёт некоторое преимущество вышеперечисленным микроорганизмам.
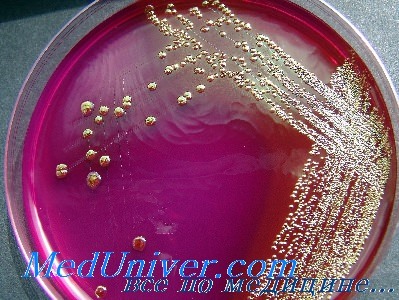
Энтеробактерии - Escherichia coli
Токсины энтеробактерий. Энтеротоксигенные штаммы Escherichia coli (ЕТЕС). Продуцируют термолабильный (LT) и термостабильный (ST) токсины, которые воздействуют на энтероциты, усиливая секрецию жидкости, вызывая диарею. Термолабильный токсин на 70% гомологичен по структуре с холерным экзотоксином. Так же как и последний, он разрушается при высокой температуре и способствует увеличению содержания циклической формы аденозинмонофосфата (цАМФ) в клетках кишечника.
Стабильный при высокой температуре, ST-токсин усиливает синтез циклической формы гуанилмонофосфата. Штаммы Escherichia coli, продуцирующие эти токсины, вызывают диарею путешественников (заболевание, при котором в течение непродолжительного времени возникает диарея).
Энтероагрегативные штаммы Escherichia coli (EAggEC). Некоторые штаммы Escherichia coli при прикреплении к энтероцитам вызывают их агрегацию. Они не поражают сами клетки, но вызывают хроническую диарею. Возбудители покрыты волокнистыми (фибриллярными) компонентами, которые предположительно обеспечивают их способность к адгезии. Некоторые штаммы продуцируют ST-подобный или гемолизинподобный токсины.
Энтерогеморрагические штаммы Escherichia coli (EHEC). Название штаммов связано с воздействием токсина возбудителей на клетки почек обезьян в тестах in vitro. Вызываемая ими геморрагическая диарея обычно сопровождается гемолизом и острой почечной недостаточностью (гемолитико-уремический синдром). Эти штаммы продуцируют вероток-син. Энтерогеморрагические штаммы Escherichia coli — представители нормальной микрофлоры кишечника крупного рогатого скота. Заражение человека происходит при несоблюдении санитарно-гигиенических норм во время работы на скотобойнях и предприятиях пищевой промышленности.
Токсин, подобный веротоксину Шига (Shiga toxin), — основной фактор вирулентности Shigella dysenteriae.
Обмен генетической информацией. Энтеробактерии могут получать генетическую информацию от других микроорганизмов посредством транспозонов, интегронов или плазмид. При этом гены, кодирующие устойчивость к антибиотикам, распространяются от одной бактерии к другой. Кроме того, с помощью обмена генетической информацией энтеробактерии могут приобретать различные факторы патогенности. При получении возбудителем ряда связанных между собой генов возникает так называемый островок патогенности.
Именно благодаря этой способности некоторые штаммы рода Salmonella могут поражать клетки кишечника. В условиях лечебных учреждений обычно выживают антибиотико-резистентные штаммы. В отделениях интенсивной терапии некоторых больниц периодически регистрируют вспышки инфекций, вызванных мультирезистентными штаммами Klebsiella pneumoniae.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Темой нынешнего разговора будет, с точки зрения автора, королева внутрибольничных инфекций любого стационара – Klebsiella pneumonia (или палочка Фридлендера).
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Темой нынешнего разговора будет, с точки зрения автора, королева внутрибольничных инфекций любого стационара – Klebsiella pneumoniae (или палочка Фридлендера). Да-да, автор не ошибся, именно она, а не синегнойки или ацинетки, а именно ее величество – клебсиелла, практически абсолютная убийца тяжелых и крайне тяжелых пациентов. Почему это именно так, мы сегодня и поговорим.
Микробиологические аспекты
Первое и главное, о чем надо знать, – Klebsiella pneumonia – это представитель нормальной микрофлоры кишечника. Еще раз и большими буквами – НОРМАЛЬНОЙ! Не надо ее там лечить (как и стафилококк в носоглотке) – она там живет, и это ее естественный ареал обитания.
А все остальные локации, где она может быть обнаружена: нижние дыхательные пути, мочевыводящий тракт, секрет простаты или содержимое полости матки (анальный сексуальный акт без презерватива – зло, имейте это в виду при сборе анамнеза, особенно у женщин с послеродовым эндометритом, автор такого навидался в достатке… мужчин это тоже касается, и обнаружение подобной зверюшки в секрете простаты должно навести на определенные мысли и вопросы, и пока пациент не закончит данную практику, простатит вы ему при всем желании не вылечите), кровь и в раны при раневых инфекциях после хирургического вмешательства на брюшной полости – могут указывать на возбудителя текущего состояния.
Что вызывает:
- Пневмонию
- Абсцессы легких
- Перитониты
- Инфекции мочевыводящих путей
- Менингиты
- Эндокардиты
- Раневые инфекции
- Инфекции матки и влагалища
- Сальпингиты
- Остеомиелиты
- Инфекции кожи
- Сепсис
Общим у всех этих патологий является одно – они все тем или иным образом связаны с вмешательством, и чаще всего (опуская уже упомянутые анальные сексуальные акты) это вмешательство носит ятрогенный характер. Клебсиелла не умеет ни летать, ни ходить, ни даже ползать, в очаг ее приносят либо неправильно вымытые руки, либо плохо обработанное медицинское оборудование.
Эпидемиологические аспекты
С клебсиеллой все намного сложнее. Эта, не побоюсь громкого слова, зверища, живет в кишечниках всего персонала медицинских учреждений. И в первую очередь, как понятно из ее названия, поражает нижние дыхательные пути. А если персонал работает с антибиотиками, то клебсиелла еще и устойчивая ко всему арсеналу применяемых препаратов (это к вопросу о разумном ограничении доступа к препаратам резерва). Так как сама клебсиелла не имеет ножек и крылышек, то попадает в оные пути она двумя способами: или в случае аспирации, или на руках персонала и с оборудования. Иного не дано. При аспирации это будет личная дикая зверюшка пациента, в случае грязных шаловливых ручек или оборудования (например, эндоскопов) – клебсиелла, высеваемая в отделении в процессе микробиологического мониторинга. А если этот мониторинг углубленный, то напрямую покажет, какая именно хрюшка, выйдя из туалетной комнаты, не соизволила помыть руки, понадеявшись на перчатки. И нет, перчатки, даже стерильные в данном случае, не спасают, они не презерватив. Руки надо мыть и обрабатывать правильно, обязательно соблюдая технологию и экспозицию.
Как вы понимаете, истребить медицинский персонал мы не можем, поэтому и полностью очистить стационар от данной проблемы не получится. И она обязательно выскочит, стоит на секунду расслабиться, и выскочит на самом тяжелом больном, где еще умудрится смутировать в такого урода, которого не достанешь никаким антибиотиком.
На общемировом клебсиеллу тоже очень сильно боятся, и когда в 2010 году вдруг в Великобритании обнаружили штамм NDM (он устойчив вообще ко всему набору существующих антибиотиков и обозван абсолютным убийцей), паника была знатной. В результате проведенного эпидемиологического расследования, по итогам которого большая группа видных ученых стала персонами non-grata в Индии, было установлено, что данный штамм привезен оттуда и из Пакистана. Присутствие в сточных водах возбудителей, имеющих карбапенемазы (то есть это уже не внутрибольничная флора, это то, что там живет на улице) на момент проведения расследования составляла 90% по CTX-M15 и 36% по NDM. С чем связан сей факт? С безрецептурным масштабным использованием карбапенемов и… проблемами с проточной канализацией. Ее либо нет, либо ей не пользуются, а делают все по старинке. А так как земной шар оказался очень маленьким, теперь NDM-штаммы обнаруживаются по всей планете. У нас, например, очень быстро данным штаммом заселились клиники Санкт-Петербурга. И медицина перед ними бессильна. До тех пор, пока не налажен эпиднадзор, а персонал не моет руки после каждого посещения туалета.
Так как любого врага надо знать в лицо, то наиболее часто встречаемые портреты у автора тоже есть.
Итак, дикая и ничем ни разу не пуганная клебсиелла выглядит вот так:
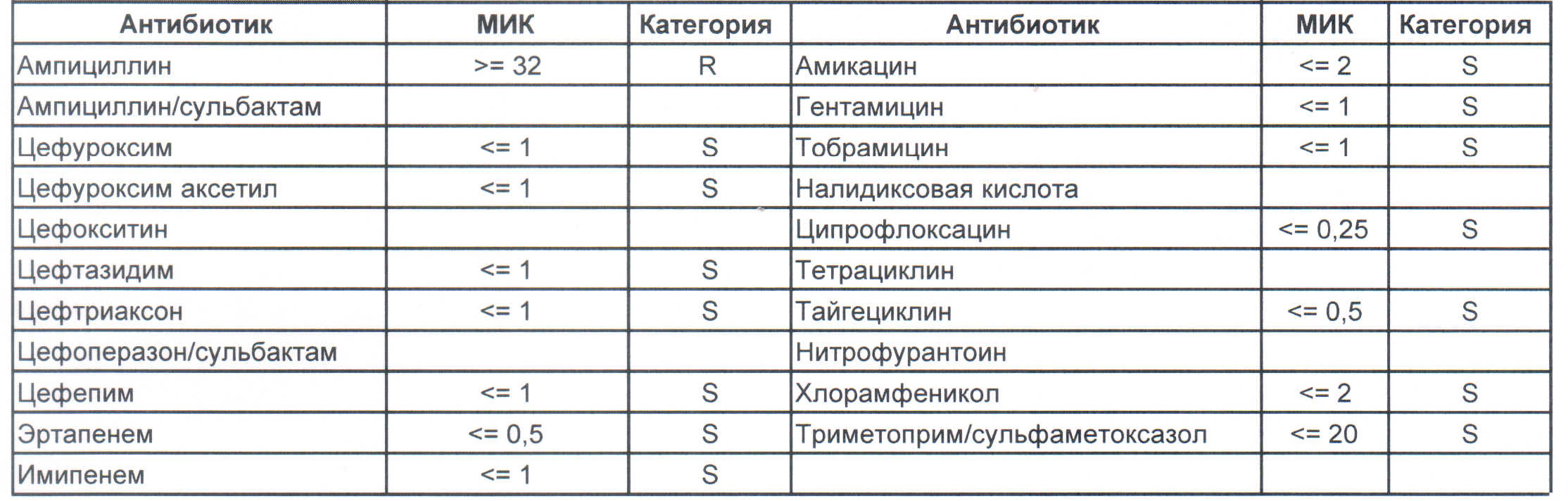
Где встречается? Те самые послеродовые эндометриты, как результат плотских утех, простатиты, а также раневые инфекции после оперативных вмешательств на брюшной полости у ранее не леченных пациентов.
На этом рисунке:
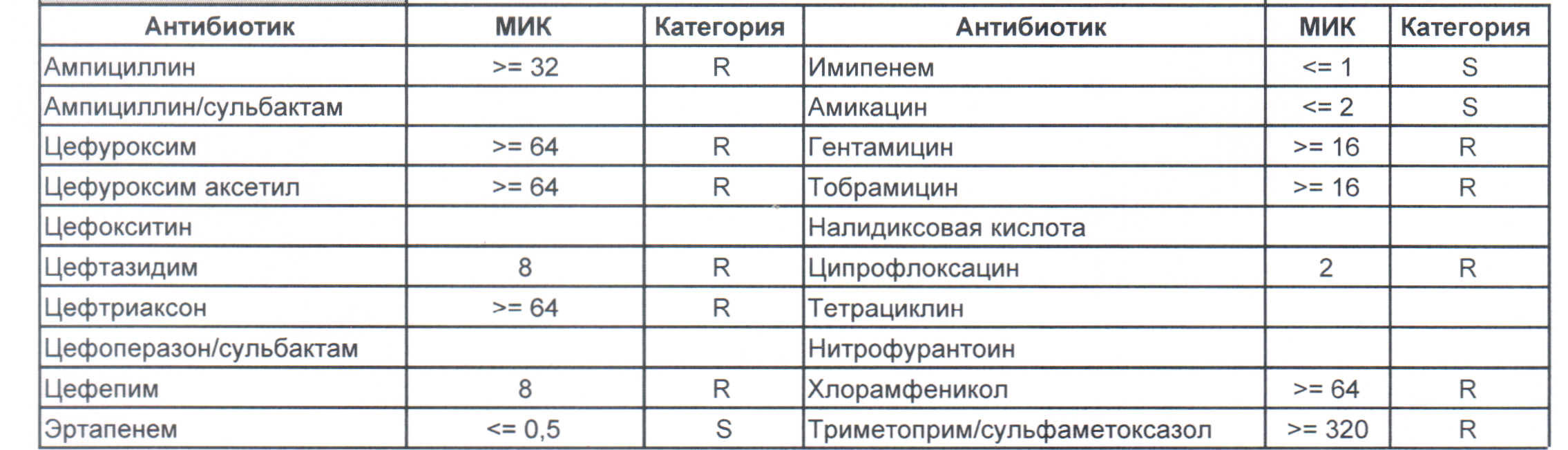
– вы можете увидеть устойчивый внутрибольничный штамм, который еще можно чем-то полечить, но это будет тяжело и дорого, проще персонал научить руки мыть и бороды брить (фекальной микрофлоры в мужских бородах в таком достатке, что единственный вариант для тех, кто хоть как-то соприкасается с ранами, данное украшение не носить или не оперировать).
На следующей картинке:
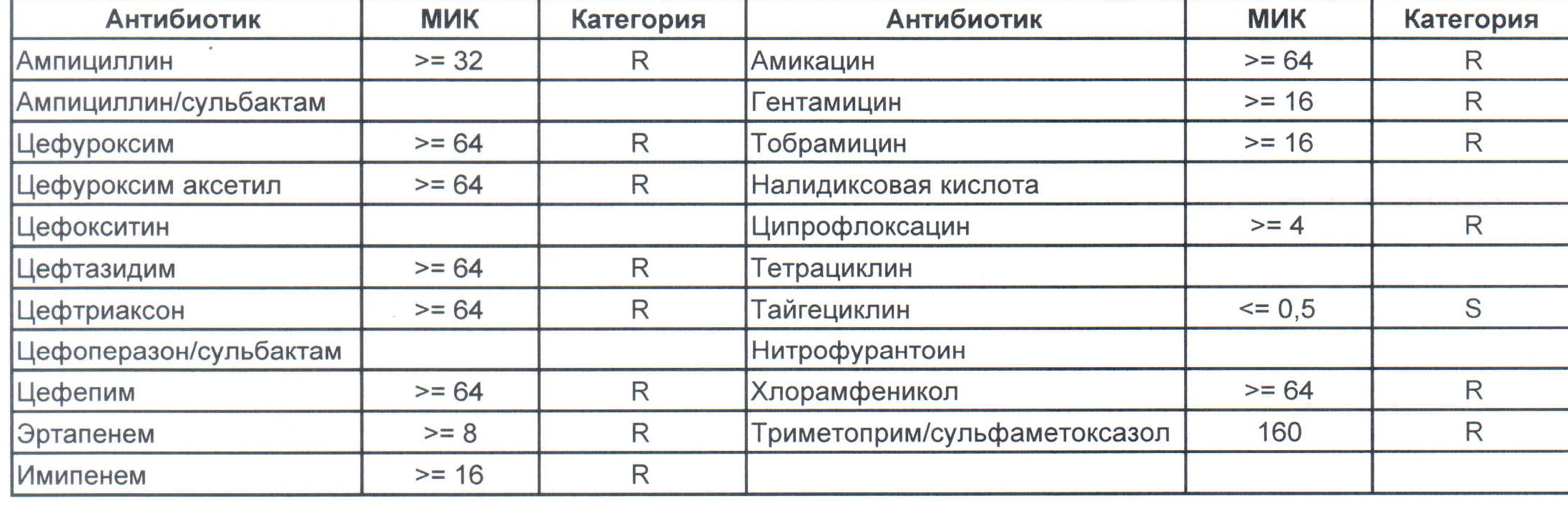
– мы видим практически неубиваемого зверя, который сам по себе вбивает тот самый последний гвоздь в гроб пациента. Но как же Тигециклин, спросите вы. Отвечу – тигацил является бактериостатиком, и пока он наберет необходимую силу, пациента уже отнесут и закопают. Но даже это еще не предел. Предел на следующем рисунке, и нет, Имипенем при указанной MIC уже бессилен:
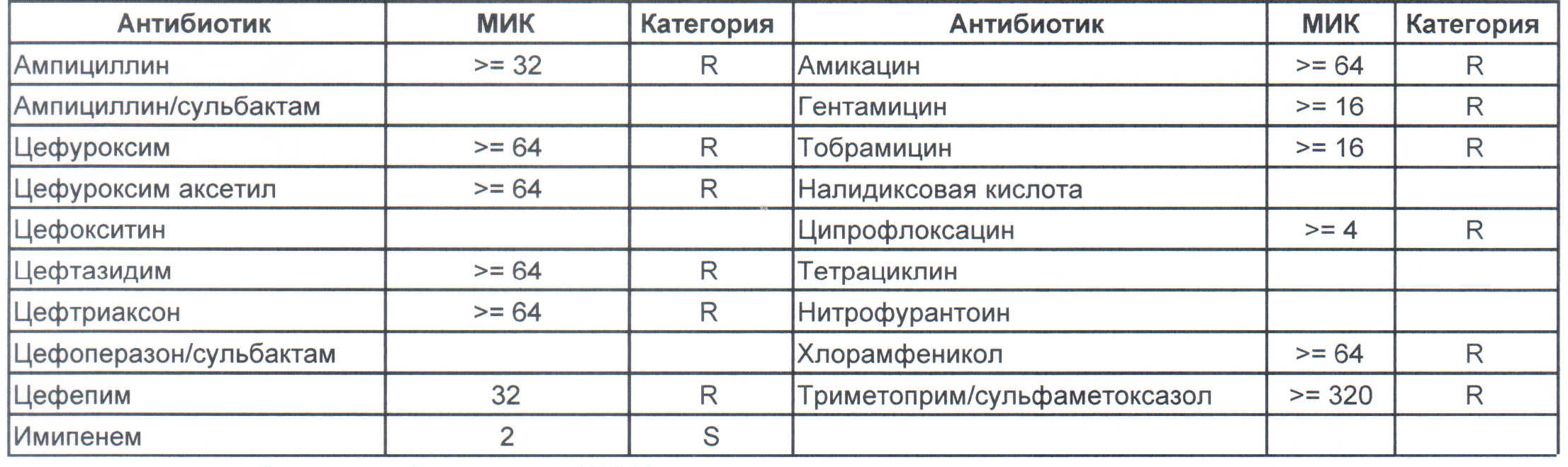
Чем лечить?
Дикая клебсиелла отлично лечится препаратами группы цефалоспоринов третьего ряда.
.jpg)
В ближайших статьях мы постараемся осветить все оставшееся семейство, как, во-первых, одно из самых проблемных в плане развития резистентности к антимикробным препаратам, а во-вторых – как возбудителей, наиболее часто являющихся причиной внутрибольничных инфекций.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: врач – клинический фармаколог Трубачева Е.С.
Morganella spp. и Proteus spp.
Особо выдающихся представителей семейства Enterobacteriaceae мы уже разбирали в отдельных статьях, а именно представительницу рода Esherichia – кишечную палочку E.coli, а также одну из представительниц клебсиелл – Klebsiella pneumonia. В ближайших статьях мы постараемся осветить все оставшееся семейство, как, во-первых, одно из самых проблемных в плане развития резистентности к антимикробным препаратам, а во-вторых – как возбудителей, наиболее часто являющихся причиной внутрибольничных инфекций.
Микробиологические аспекты
Основными клинически значимыми представителями родов семейства Enterobacteriaceae, вызывающими заболевания у человека, являются:
Естественно совсем уж экзотику мы рассматривать не станем, но по наиболее часто встречающимся представителям обязательно пробежимся.
Клинические аспекты
Почему данное семейство так актуально? Наверное, потому, что почти ни одна нозология не обходится без его представителей. В самом широком смысле семейство Enterobacteriaceae является причиной следующих заболеваний:
- со стороны нервной системы: менингит, энцефалит, множественный неврит;
- со стороны мочевыводящих путей –пиелит, пиелонефрит, цистит;
- со стороны желудочно-кишечного тракта – аппендицит, холецистит, панкреатит, которые со своей стороны могут осложниться перитонитом;
- пневмонии, в основном связанные с медицинскими вмешательствами;
- со стороны ЛОР-органов: отиты, назофарингиты;
- со стороны глаз – конъюнктивиты;
- сепсис, как исход всех вышеуказанных состояний, чаще всего уже носящий полимикробный характер.
Как мы видим, наши знакомые отметились практически везде. Но надо обязательно помнить, что выявление вышеуказанных представителей у здоровых людей из респираторного тракта, урогенитального и уж тем более желудочно-кишечного ни в коем случае не говорит о том, что человек чем-то болен, так как в большинстве своем эти микробы являются представителями нормальной микрофлоры, а не все люди умеют мыть руки, особенно летом.
Когда можно думать о наличии бактериальной патологии? Во-первых, когда имеется четкая клиника, во-вторых, когда микробы выделены из стерильных в норме сред, таких как кровь и ликвор, брюшная или плевральная полость, точнее, экссудат оттуда и, в-третьих, когда микроорганизмы выделены в клинически значимых концентрациях (тут в помощь будет ваша бак. лаборатория).
Стоит отметить еще один немаловажный момент – не все представители семейства Enterobacteriaceae умеют жить вне организма человека, и поэтому не размножаются во внешней среде, а потому обнаружение оных на пищевых продуктах и всевозможных поверхностях в лечебных учреждениях говорит о фекальном загрязнении, проще говоря, о неумении обрабатывать руки после посещения туалетной комнаты. Одним из таких микробов-детекторов является кишечная палочка, и стоит ее поймать даже не на руках персонала, а, например, на компьютерной мышке, как дальше можно уже ничего не искать, а начинать очередной этап избиения младенцев, пардон, обучения правилам асептики и антисептики, в частности, обработки рук.
Но давайте перейдем к частностям – и первым микроорганизмом, который будем сегодня рассматривать, станет:
Morganella spp.
Зверюшка названа так в честь своего первооткрывателя Гарри Р. Моргана.
Начнем традиционно с микробиологических аспектов
Семейство морганелл включает единственный вид M. morganii, включающий два подвида M. morganii и M. sibonii, которые различаются только ферментацией трегалозы.
Морганеллы являются представителями нормальной микрофлоры как человека, так и животных, а потому могут присутствовать в качестве сапрофитов в окружающей (внебольничной!) среде.
Морганеллы имеют довольно сложные отношения с антибактериальными препаратами и обладают природной резистентностью к:
- пенициллинам,
- цефалоспоринам 1 и 2 поколения,
- макролидам, .
Проявляют высокую чувствительность к:
- аминогликозидам, ,
- цефалоспоринам 3 и 4-го поколения,
- карбопенемам,
- фторхинолонам
Клинические аспекты
Как говорилось выше, морганеллы являются частью нормальной микрофлоры человека, крайне редко вызывая инфекционные заболевания. Чаще всего они являются возбудителями осложненных инфекций мочевыводящих путей.
Факторами риска развития инфекции являются:
- пожилой возраст,
- иммунодефициты любой этиологии,
- длительное лечение в стационаре,
- установленные мочевые катетеры.
В качестве механизмов резистентности морганеллы способны продуцировать бета-лактамазы, чем и объясняется их природная устойчивость к пенициллинам и цефалоспоринам 1-2 поколений. При нерациональном использовании антибиотиков они начинают вырабатывать бета-лактамазы расширенного спектра и факторы устойчивости к фторхинолонам, которыми довольно бодро делятся с соседями по семейству Enterobacteriaceae. Отдельно стоит отметить способность отдельных штаммов морганелл к резистентности к имипенему.
Какие заболевания вызывают чаще всего:
- инфекции мочевыводящих путей,
- сепсис, чаще всего уросепсис полимикробной этиологии,
- хирургические инфекции, связанные с оказанием медицинской помощи (они же нозокомиальные),
- редко, но вызывают септические артриты,
- крайне редко вызывают менингиты, эндофтальмиты, перикардиты,
- неонатальный сепсис и хориоамнионит.
Терапевтические аспекты
Антибактериальная терапия будет полностью зависеть от результата из микробиологической лаборатории. Повторимся еще раз, микроб изначально умеет вырабатывать бета-лактамазы, а потому в случае развития осложненных инфекции мочевыводящих путей, которые чаще всего уже не связанны с кишечной палочкой, препаратами выбора становятся карбопенемы (имипенем, если штамм к нему чувствителен, или меропенем), дозирование которых проводится с учетом клиренса креатинина. Длительность лечения должна быть не менее 7 дней. В качестве альтернативы можно использовать цефалоспорин 4-го поколения Цефипим каждые 8 часов или фторхинолоны.
Аминогликозиды, несмотря на чувствительность к оным, при лечении заболеваний мочевыводящих путей лучше не применять в виду их нефро- и отоксичности, и по этой же причине их невозможно будет использовать около трех месяцев после проведенной терапии, например, в лечении синегнойной инфекции. Цефалоспорины третьего поколения тоже применять не стоит, так как морганеллы довольно быстро обзаводятся бета-лактамазами расширенного спектра, которые, как мы помним, эту генерацию препаратов быстро инактивируют.
Proteus spp.
Микробиологические аспекты
Протей долгое время был практически родным отцом морганеллы, так как последняя рассматривалась как один из видов рода протей. Этот род примечателен тем, что занимает почетное второе место по выявляемости после кишечной палочки в семействе Enterobacteriaceae.
В данный момент представителями рода протей являются P. mirabilis, вызывающий порядка 90% инфекционных заболеваний, а также P. vulgaris и P. penneri.
Клинические аспекты
Протеи выступают возбудителями порядка 10% неосложненных инфекций мочевыводящих путей, с чем могут быть связаны неудачи в лечении последних с использованием аминопенициллинов.
Как и все клинически значимые возбудители семейства Enterobacteriaceae, протей является возбудителем нозокомиальных инфекций, таких как пневмония, вплоть до сепсиса. Кроме того выступает возбудителем интраабдоминальных, а также хирургических инфекций кожи и мягких тканей, сепсиса, связанного с медицинскими вмешательствами как последствий нозокомиальной пневмонии в результате недостаточной дезинфекции, например, бронхоскопов.
Таким образом, мы видим, что, как и в предыдущем случае, проще правильно помыть руки и обработать инструменты, чем лечить это все с учетом природной и приобретенной резистентности.
Терапевтические аспекты
Как и в случае с морганеллой, нам просто необходим результат микробиологического исследования с определением чувствительности по МПК возбудителя либо результаты микробиологического мониторинга, которые помогут предположить зверей в случае неудачи ранее проводимого лечения.
В случае ампициллин-чувствительного P.mirabilis именно ампициллин может выступать препаратом первой линии. Кроме того, возможно использование цефуроксима и фторхинолонов. Обязательным аспектом лечения является его длительность. В случае неосложненных инфекций мочевыводящих путей (цистита) – не менее 3 дней, пиелонефрита – 10-14 дней, осложненных инфекций – 10-21 день. Сепсис является состоянием, требующим индивидуального подхода, но лечим не менее 14 дней.
На этом на сегодня мы закончим, но повторим одну базовую и, чего уж, наиважнейшую истину: в лечении инфекций, связанных с любым представителем семейства Enterobacteriaceae, самым главным будет являться профилактика. А именно правильное и тщательное мытье рук. Обеспечим мытье рук, не будет большинства проблем с инфекциями, вызванными указанным семейством.
Клиника инфекций вызванной энтеробактериями. Диагностика, лечение
Выделяют два вида сальмонелл: Salmonella enterica и Salmonella bongori. Вид Salmonella enterica включает подвиды: enterica, salamae, arizonae, diarizonae, houtenae. Наиболее патогенны для человека и других теплокровных животных серовары подвида enterica.
Сальмонеллёз. Сальмонеллы хорошо приспособлены к обитанию в организме различных животных. У человека инфекция обычно не выходит за пределы кишечника. Заболевание характеризуется саморазрешающейся диареей. В некоторых случаях микроорганизмы могут вызывать инвазивные, угрожающие жизни человека заболевания, сопровождающиеся бактериемией, септицемией и остеомиелитом.
Сальмонелл обнаруживают в организме большинства домашних животных. Важными источниками инфекции считают больных людей и реконвалесцентных носителей. Механизм передачи заболевания — фекально-оральный (при употреблении контаминированных продуктов питания). Самые тяжёлые случаи сальмонеллёза наблюдают у пациентов со сниженным иммунитетом и сниженной секрецией желудочного сока, а также у лиц, перенёсших спленэктомию. В некоторых случаях заболевание осложняется реактивным артритом или развивается хроническое носительство.
Брюшной тиф. Возбудители брюшного тифа — серовары typhi и paratyphi подвида Salmonella enterica. Заболевание характеризуется поражением стенки кишечника, затем регионарных лимфатических узлов, сопровождается первичной бактериемией и инфекцией ретикулоэндотелиальной системы. В последующем бактерии попадают в кишечник из жёлчного пузыря, размножаются в пейеровых бляшках (развивается вторичная бактериемия), вызывают изъязвление стенки кишечника, которое может привести к кровотечению или перфорации. Пациенты предъявляют жалобы на высокую температуру, нарушение функций кишечника (диарею или запор) и сыпь (розеолёзные элементы на передней брюшной стенке). Наблюдают гепатоспленомегалию. Иногда брюшной тиф осложняется остеомиелитом и реже менингитом.
Инфекции мочевыводящих путей и пиелонефрит. Большинство инфекций мочевыводящих путей вызвают определённые серотипы Escherichia coli. Они способны к повышенному образованию К-антигена и гемолизина и прикреплению к эпителию мочевыводящих путей посредством пилей (последнее свойство характерно и для некоторых видов протея). При наличии у возбудителя маннозоустойчивых пилей развивается пиелонефрит. Важный фактор вирулентности бактерий рода Proteus — уреаза, снижающая рН и стимулирующая процесс образования камней.
Менингит и абсцессы мозга. Важной причиной менингита у новорождённых (характеризуется высокой смертностью) является Escherichia coli, штаммы которой в большом количестве продуцируют капсульный Kl-антиген. Кроме того, заболевание может быть следствием нейрохирургических вмешательств, операций по протезированию. Следует отметить, что энтеробактерии очень часто присутствуют в патогенной микрофлоре, сопровождающей абсцессы головного мозга.
Возбудитель сальмонеллеза - Salmonella enterica
Остеомиелит и септический артрит. Тяжелейшее осложнение у пациентов с серповидно-клеточной анемией и ВИЧ-инфекцией — остеомиелит или септический артрит, вызванные сальмонеллами. Кроме того, сальмонеллы и другие энтеробактерии часто вызывают инфекции костей и суставов у пожилых пациентов. Иногда эти заболевания возникают вследствие проникающего ранения. Для лечения обычно применяют фторхинолоны, так как они обладают способностью проникать в костную ткань (например, ципрофлоксацин).
Инфекции, вызванные представителями рода Klebsiella. Микроорганизмы рода Klebsiella обычно вызывают внутрибольничные инфекции. Кроме того, они могут быть причиной развития пневмонии (особенно у пациентов, находящихся на искусственной вентиляции лёгких), инфекций мочевыводящих путей, раневых инфекций и бактериемии. У высоковосприимчивых пациентов известны случаи заболеваний, сопровождающихся септицемией и заканчивающихся летальным исходом. Первичная пневмония, вызванная подвидом Pneumoniae вида К. pneumoniae, — редкое и крайне тяжёлое внебольничное заболевание, характеризующееся неблагоприятным исходом. Возбудитель прогрессирующей гранулематозной инфекции слизистой оболочки полости носа — Klebsiella rhinoscleromatis. Большинство случаев заболевания регистрируют в тропических регионах мира. Другой вид — Klebsiella ozanae — возбудитель хронической бронхо-эктатической болезни.
Инфекции, вызванные бактериями родов Enterobacter, Serratia и Citrobacter. Представители этих родов обитают в окружающей среде и могут поражать пациентов лечебных учреждений, вызывая раневые инфекции, бактериемию и внутрибольничную пневмонию. Выбор антибактериального препарата осложняется тем, что большинство возбудителей устойчиво к действию антибиотиков.
Диагностика энтеробактерий:
• Бактериологическое исследование крови или костного мозга (особенно в диагностике брюшного тифа).
• Изучение биохимических свойств возбудителя (например, способности расщеплять углеводы).
• Серотипирование (серотипы различают по липополисахаридному (О) и жгутиковому (Н) антигену) и фаготипирование применяют при эпидемиологических исследованиях.
• Колицинотипирование.
• Современные молекулярно-генетические исследования.
Лечение и профилактика инфекции вызванной энтеробактериями
Большинство грамотрицательных энтеробактерии чувствительны к действию аминогликозидов, цефалоспоринов широкого спектра действия, фторхинолонов, бета-лактамов и карбапенемов (например, меропенем). Лечение назначают только после определения чувствительности возбудителя к антимикробным средствам, так как некоторые микроорганизмы способны вырабатывать бета-лактамазу и ферменты, разрушающие аминогликозидные препараты. Возросшая в последнее время устойчивость энтеробактерии к антибиотикам широкого спектра действия обусловлена появлением штаммов, обладающих бета-лактамазами широкого спектра действия.
Препараты выбора при инфекциях мочевыводящих путей — цефалексин, ампициллин, нитрофурантоин или триметоприм.
Для профилактики заболеваний, сопровождающихся диареей, необходимо соблюдать правила личной гигиены, приготовления пищи, а также использовать безопасные источники водоснабжения. Основной метод лечения — пероральная регидратация организма.
Препарат выбора при брюшном тифе — ципрофлоксацин, альтернативные средства — триметоприм или цефалоспорины третьего поколения. В некоторых странах инфекционисты сталкиваются с заболеваниями, вызванными мультирезистентными штаммами возбудителя. Для профилактики заболевания людям, посещающим эти регионы, рекомендуют использовать живую аттенуированную (Ту21А) или бесклеточную (содержит Vi-антиген) вакцины, но вакцинация лишь частично защищает от инфекции.
Видео строение, микробиология возбудителя брюшного тифа (S. typhi)
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

