Эпидемиология сепсиса и летальность обзоры за 2012-2016 годы
Обновлено: 23.04.2024
Септический шок - эпидемиология, смертность
Тяжелый сепсис и септический шок являются актуальной проблемой современной медицины вследствие увеличения количества больных, высокой летальности и возрастания социально-экономических проблем, связанных с лечением и реабилитацией таких пациентов.
Септический шок является жизнеугрожающим состоянием, наиболее тяжелой стадией или формой развития генерализованной инфекции (сепсиса), характеризующейся наличием неконтролируемого инфекционного процесса, реактивного генерализованного воспаления, полиорганной дисфункции/недостаточности и артериальной гипотензии.
Многообразие сходных названий исторически связано с субъективными факторами: разработкой проблемы сепсиса и септического шока в различных областях медицинской науки, отсутствием до недавнего времени единой классификации сепсиса и объективными факторами — наличием существенных патогенетических различий механизмов развития сепсиса при ряде нозологических форм, недостаточной научной разработкой проблемы септического шока в целом.
На этой же конференции были даны определения других стадий инфекции: бактериемии, сепсиса, тяжелого сепсиса, септического шока и синдрома полиорганной дисфункции (СПД). Разработка этих определений открыла новые перспективы как для развития фундаментальных и прикладных научных исследований в области тяжелых инфекций, так и для клинической практики, заложив основу систематической разработки рекомендаций по диагностике и лечению.
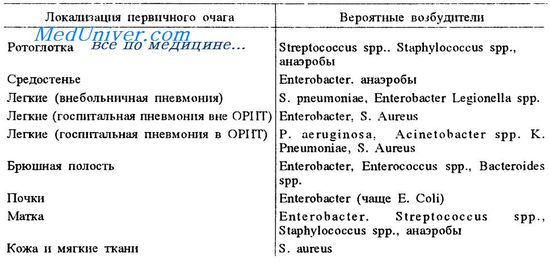
Возбудители сепсиса
Эпидемиология септического шока
Септический шок как синдром, стадия или форма заболевания пока не включен в Международную классификацию болезней, поэтому ориентировочные эпидемиологические данные были получены при проведении нескольких многоцентровых проспективных рандомизированных контролируемых исследований с целью оценки эффективности лекарственных препаратов у больных сепсисом. Обнаружено, что пациенты с септическим шоком составляют 58 % от всех больных с тяжелым сепсисом. Математическое моделирование позволило примерно определить количество пациентов с септическим шоком в США — 435 580 человек в год.
Другим источником информации могут быть данные, полученные в ходе международного многоцентрового эпидемиологического исследования 14 364 пациентов в 28 отделениях реанимации и интенсивной терапии (ОРИТ): пациенты с септическим шоком составили 6,3 % от всех больных ОРИТ, причем в 63,2 % случаев септического шока был осложнением нозокомиальных инфекций (НИ). Согласно отечественным данным, доля больных с септическим шоком составила только 26,1 % среди всех пациентов с тяжелым сепсисом.
При включении критериев сепсиса, тяжелого сепсиса и септического шока в программу регистрации пациентов ОРИТ хирургического профиля было обнаружено, что среди 25,9 % пациентов с сепсисом доля больных септическим шоком составила 4,1 %.
Близкие данные по количеству больных септическим шоком приведены в исследованиях многих авторов — 2—4 %, однако имеются данные и о более высоких показателях —7—18 %, что может свидетельствовать о значительной разнородности исследованных групп пациентов.
Летальность в группе больных с септическим шоком. Причиной летальных исходов больных сепсисом и септическим шоком является органная недостаточность, причем комбинация недостаточности нескольких органов увеличивает вероятность летального исхода. В нескольких исследованиях произведена оценка летальности в группе пациентов с септическим шоком по сравнению с больными сепсисом и тяжелым сепсисом. Летальность в группе больных с септическим шоком составила от 46 до 82 %, что в 1,5—2,5 раза превосходило летальность больных тяжелым сепсисом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
В течение последних десятилетий значительно возрос интерес мирового сообщества к проблеме сепсиса. Несмотря на достижения современной фундаментальной и клинической медицины, сепсис по-прежнему отличает значительная распространенность и высокая летальность. В статье обсуждены вопросы распространенности сепсиса в различных странах; показано, что ежегодно диагностируются миллионы случаев генерализованных гнойно-септических инфекций, отмечается устойчивый рост регистрируемого сепсиса в индустриально развитых странах, доля тяжелого сепсиса в структуре патологии на различных территориях варьирует от 2 до 43%. Сепсис по-прежнему остается в числе ведущих причин смерти больных, характеризуясь существенным размахом госпитальной летальности (от 30,6 до 80,4%). Перечислены категории больных, относящиеся к группам высокого риска развития сепсиса. Обращено внимание на эпидемиологические проявления этого патологического синдрома в педиатрии. Показаны особенности этиологического спектра возбудителей сепсиса, возрастающая этиологическая значимость микроорганизмов с множественной антибиотикоустойчивостью (Pseudomonas aeruginosa, Klebsiella pneumoniae, Acinetobacter spp., MRSA, VRE и др.). Учитывая клиникоэпидемиологическую, социальную и экономическую значимость сепсиса, изучение его эпидемиологических аспектов является важнейшим направлением работы здравоохранения.
Ключевые слова
Об авторах
Иркутская государственная областная детская клиническая больница, Иркутская государственная медицинская академия последипломного образования - филиал Российской медицинской академии непрерывного профессионального образования
Россия
Научный центр проблем здоровья семьи и репродукции человека, Иркутская государственная медицинская академия последипломного образования - филиал Российской медицинской академии непрерывного профессионального образования
Россия
Список литературы
1. Авилова Н.Д., Миронов А.Ю., Митрохин С.Д. Микробиологический мониторинг патогенов гнойно-септических заболеваний у онкологических больных. Человек и его здоровье. 2007, 2: 13-16.
2. Блохина Е.В. Кандидемии при гемобластозах. Дисс. канд. мед. наук. М., 2015.
3. Гельфанд Е.Б. Абдоминальный сепсис при перитоните: клиническая характеристика и эффективность антибактериальной терапии. Автореф. дисс. канд. мед. наук. М., 1999.
4. Гончаров А.Д. Эпидемиологические особенности гнойно-септических инфекций, вызванных Acinetobacter baumannii и Pseudomonas aeruginosa в ожоговом и реанимационном отделении. Автореф. дисс. канд. мед. наук. СПб, 2005.
5. Грувер К.П., Белобородов В.Б. Клиническое значение бактериемий у больных сепсисом. Клин. микробиол. антимикроб. химиотер. 2011, 13 (1): 90-97.
6. Егорова С.А., Кафтырева Л.А., Липская Л.В., Коноваленко И.Б., Пясецкая М.Ф. Штаммы энтеробактерий, продуцирующих бета-лактамазы расширенного спектра и металло-бета-лактамазу NDM-1, выделенные в стационарах Балтийского региона. Инфекция и иммунитет. 2013, 1: 29-36.
7. Ерюхин И.А., Гельфанд Б.Р., Шляпников С.А. Руководство по хирургическим инфекциям. И.А. Ерюхин (ред.). СПб, 2006.
9. Кевра М.К. Сепсис: новый взгляд на старую проблему. Медицинский журнал. (Беларусь). 2003, 4: 25-32.
11. Мартинович А.А. Динамика антибиотикорезистентности и эпидемиология инфекций, вызванных Acinetobacter spp., в России. Клиническая микробиология и антимикробная химиотерапия. 2010, 12 (2): 96-105.
12. Плоткин Л.В. Абдоминальный сепсис: обоснование выбора мониторинга и интенсивной терапии. Дисс. д-ра мед. наук. Екатеринбург, 2009.
13. Решедько Г.К., Рябкова Е.Л., Фаращук А.Н., Страчунский Л.С. (исследовательская группа РОСНЕТ). Неферментирующие грамотрицательные возбудители нозокомиальных инфекций в ОРИТ России: проблемы антибиотикорезистентности. Клиническая микробиология, антимикробная химиотерапия. 2006, 8: 232-248.
14. Руднов В.А., Бельский Д.В., Дехнич А.В. Инфекции в ОРИТ России: результаты национального многоцентрового исследования. Клиническая микробиология, антимикробная химиотерапия. 2011, 13 (4): 294-303.
15. Руднов В.А. Сепсис. Современный взгляд на проблему. Клин. антимикробная терапия. 2000, 1: 4-10.
16. Савельев В.С., Гельфанд Б.Р. Сепсис: классификация, клинико-диагностическая концепция и лечение. В.С. Савельев (ред.). М., МИА, 2010.
17. Савина В.А., Колосовская Е.Н., Лебедев В.Ф. Актуальные вопросы эпидемиологии сепсиса. Медицинский альманах. 2014, 4 (34): 20-22.
18. Светличная Ю.С., Колосовская Е.Н., Кафтырева Л.А., Дарьина М.Г. Микробиологический мониторинг в системе эпидемиологического надзора за госпитальными инфекциями. Эпидемиология и вакцинопрофилактика. 2014, 1(74): 9-14.
19. Сепсисология с основами инфекционной патологии. Бочоришвили В.Г. (ред.). Тбилиси, 1988.
20. Шевченко Ю.Л., Гороховатский Ю.И., Азизова О.А., Замятин М.Н. Системный воспалительный ответ при экстремальной хирургической агрессии. М., РАЕН, 2009.
21. Шпрыкова О.Н. Микробиологические и эпидемиологические особенности микробных ассоциаций при гнойно-септических исследованиях. Автореф. дисс. канд. мед. наук. Н.-Новгород, 2004.
22. Angus D.C., Linde-Zwirble W.T., Lidicker J. et al. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care. Crit. Care Med. 2001, 29 (7): 13031310.
23. Arendrup M., Sulim S., Holm A. et al. Diagnostic issues, clinical characteristic, and outcomes for patients with candidemia. J. Clin. Microbiol. 2011, 49: 3300-3308.
24. Chalupka A.N., Talmor D. The economics of sepsis. Crit. Care Clin. 2012, 28 (1): 57-76.
25. Chen C.J., Huang Y.C., Chiu C.H. et al. Clinical features and genotyping analisis of community-acquired methicillin-resistant Staphylococcus aureus infections in Taiwanese children. Pediatr. Infect. Dis. J. 2005, 24(1): 40-45.
26. Cybele L. Abad, Nasia Safdar. Antimicrobial Therapy of sepsis and septic shock- When are two drugs better than one? Crit. Care Clin. 2011, 27: 215-227.
27. Danai P., Martin G.S. Epidemiology of sepsis: Recent advances. Current Infectious Disease Reports. 2005, 7 (5): 329-334.
28. Fujishima S., Gando S., Saitoh D. et al. A multicenter, prospective evaluation of quality of care and mortality in Japan based on the Surviving Sepsis Campaign guidelines. J. Infect. Chemother. 2014, 20 (2): 115-120.
29. Harrison D.A., Welch C.A., Eddleston J.M. The epidemiology of severe sepsis in England, Wales and Northern Ireland, 1996 to 2004: secondary analysis of a high quality clinical database, the ICNARC Case Mix Programme Database. Critical Care. 2006, 10: 42.
30. Hartman M.E., Linde-Zwirble W.T., Angus D.C. et al. Trends in the epidemiology of pediatric severe sepsis Pediatr. Crit. Care Med. 2013, 14 (7): 686-693.
31. Jaramillo-Bustamante C., Mann-Agudelo A., Fernandez-Laverde M. et al. Epidemiology of sepsis in pediatric intensive care units: First colombian multicenter study. Pediatr. Crit. Care Med. 2012, 13 (5): 501-508.
32. Marx G., Litmathe J., Schulz J. et al. Incidence of severe sepsis and septic shock in German intensive care units: the prospective, multicentre INSEP study. Intensive Care Med. 2016, 42(12): 1980-1989.
33. Martin G.S., Mannino D.M., Eaton S. The epidemiology of sepsis in the United States from 1979 through 2000. Engl. J. Med. 2003, 348 (16): 1546-1554.
35. Patel G.P., Gurka D.P., Balk R.A. New treatment strategies for severe sepsis and septic shock. Curr. Opinin. Crit. Care. 2003, 9 (5): 390-396.
36. Pittoni G.M., Scatto A. Economics and outcome in the intensive care unit. Curr. Opin. Anaesthesiol. 2009, 22 (2): 232-236.
38. Sakai A.F., Rocha L.L, Pessoa M.S. et al. Patterns of organe dysfunction in severe sepsis and septic shock patients admitted to the ICU from the emergency department: a 4-year retrospective cohort. Crit. Care. 2015, 19: 78.
39. Shime N., Kawasaki T., Saito O. et al. Incidence and risk factors for mortality in pediatric severe sepsis: results from the national pediatric intensive care registry in Japan. Int. Care Med. 2012, 38: 1191-1197.
40. Silva E., Biasi Cavalcanti A., Bugano D.D. et al. Do established prognostic factors explain the different mortality rate in ICU septic patients around the world? Minerva Anesth. 2012, 78: 1215-1225.
41. Singer M., Deutschman C.S., Seymour C.W. et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 2016, 315 (8): 801-810.
42. Tang R., Huang Y., Chen Q. et al. Relationship between regional lung compliance and ventilation homogeneity in the supine and prone position. Acta Anaesthesiol. Scand. 2012, 56 (9): 1191-1199.
43. Vincent J.L., Rello J., Marshal J. et al. International study of prevalence and outcomes of infection in ICU. JAMA. 2009, 302: 2323-2329.
44. Watson R.S., Carcillo J.A., Linde-Zwirble W.T. et al. The Epidemiology of Severe Sepsis in children in the United States. Am. J. Respir. Crit. Care Med. 2003, 167: 695-701.
45. Weiss S.L., Fitzgerald J.C., Pappachan J. et al. Global epidemiology of pediatric severe sepsis: The sepsis prevalence, outcomes, and therapies study. Am. J. Respir. Crit. Care Med. 2015, 191(10): 1147-1157.
46. White L.E., Chaudhary R., Moore L.J. et al. Surgical sepsis and organ crosstalk: the role of the kidney. J. Surg. Res. 2011, 167 (2): 306-315.
47. Zahore R., Firmment J., Strakova J. et al. Epidemiology of severy sepsis ICU of Slovak Republic. Infection. 2005, 33: 125-126.
48. Zaoutis T.E., Toltzis P., Chu J. et al. Clinical and molecular epidemiology of community-acquired methicillin-resistant Staphylococcus aureus infections among children with risk factors for health care-associated infection: 2001-2003. Pediatr. Infect. Dis. J. 2006, 25(4): 343-348.
Септический шок - эпидемиология, смертность
Тяжелый сепсис и септический шок являются актуальной проблемой современной медицины вследствие увеличения количества больных, высокой летальности и возрастания социально-экономических проблем, связанных с лечением и реабилитацией таких пациентов.
Септический шок является жизнеугрожающим состоянием, наиболее тяжелой стадией или формой развития генерализованной инфекции (сепсиса), характеризующейся наличием неконтролируемого инфекционного процесса, реактивного генерализованного воспаления, полиорганной дисфункции/недостаточности и артериальной гипотензии.
Многообразие сходных названий исторически связано с субъективными факторами: разработкой проблемы сепсиса и септического шока в различных областях медицинской науки, отсутствием до недавнего времени единой классификации сепсиса и объективными факторами — наличием существенных патогенетических различий механизмов развития сепсиса при ряде нозологических форм, недостаточной научной разработкой проблемы септического шока в целом.
На этой же конференции были даны определения других стадий инфекции: бактериемии, сепсиса, тяжелого сепсиса, септического шока и синдрома полиорганной дисфункции (СПД). Разработка этих определений открыла новые перспективы как для развития фундаментальных и прикладных научных исследований в области тяжелых инфекций, так и для клинической практики, заложив основу систематической разработки рекомендаций по диагностике и лечению.
Возбудители сепсиса

Эпидемиология септического шока
Септический шок как синдром, стадия или форма заболевания пока не включен в Международную классификацию болезней, поэтому ориентировочные эпидемиологические данные были получены при проведении нескольких многоцентровых проспективных рандомизированных контролируемых исследований с целью оценки эффективности лекарственных препаратов у больных сепсисом. Обнаружено, что пациенты с септическим шоком составляют 58 % от всех больных с тяжелым сепсисом. Математическое моделирование позволило примерно определить количество пациентов с септическим шоком в США — 435 580 человек в год.
Другим источником информации могут быть данные, полученные в ходе международного многоцентрового эпидемиологического исследования 14 364 пациентов в 28 отделениях реанимации и интенсивной терапии (ОРИТ): пациенты с септическим шоком составили 6,3 % от всех больных ОРИТ, причем в 63,2 % случаев септического шока был осложнением нозокомиальных инфекций (НИ). Согласно отечественным данным, доля больных с септическим шоком составила только 26,1 % среди всех пациентов с тяжелым сепсисом.
При включении критериев сепсиса, тяжелого сепсиса и септического шока в программу регистрации пациентов ОРИТ хирургического профиля было обнаружено, что среди 25,9 % пациентов с сепсисом доля больных септическим шоком составила 4,1 %.
Близкие данные по количеству больных септическим шоком приведены в исследованиях многих авторов — 2—4 %, однако имеются данные и о более высоких показателях —7—18 %, что может свидетельствовать о значительной разнородности исследованных групп пациентов.
Летальность в группе больных с септическим шоком. Причиной летальных исходов больных сепсисом и септическим шоком является органная недостаточность, причем комбинация недостаточности нескольких органов увеличивает вероятность летального исхода. В нескольких исследованиях произведена оценка летальности в группе пациентов с септическим шоком по сравнению с больными сепсисом и тяжелым сепсисом. Летальность в группе больных с септическим шоком составила от 46 до 82 %, что в 1,5—2,5 раза превосходило летальность больных тяжелым сепсисом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Кафедра хирургии и ОВП с курсом эндохирургии факультета последипломного образования Российского государственного медицинского университета им. акад. И.П. Павлова, Новомосковская городская клиническая больница
ФГУ Эндокринологический научный центр Минздравсоцразвития РФ
Что такое сепсис: 25-летний опыт развития концепции
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2017;(1): 82‑87
Кафедра хирургии и ОВП с курсом эндохирургии факультета последипломного образования Российского государственного медицинского университета им. акад. И.П. Павлова, Новомосковская городская клиническая больница
Кафедра хирургии и ОВП с курсом эндохирургии факультета последипломного образования Российского государственного медицинского университета им. акад. И.П. Павлова, Новомосковская городская клиническая больница
ФГУ Эндокринологический научный центр Минздравсоцразвития РФ
Несмотря на то что в последние годы были получены данные, свидетельствующие о снижении летальности вследствие сепсиса в клиниках с высоким технологическим уровнем организации лечебного процесса и корректной отчетностью [31], он был и остается нерешенной проблемой глобального здравоохранения [5, 12, 23, 26]. Проблема лечения пациентов с сепсисом не ограничивается высоким уровнем острой смертности непосредственно при первичном обращении, а заключается еще и в том, что частота повторной 30-дневной госпитализации пациентов этой категории достигает 19,9—23,4%, из которых 66,9—78% обусловлены инфекцией [13, 16, 24, 25], причем в течение года больные имеют многократно повышенный риск рецидива угрожающей их жизни инфекции [25, 34].
Cиндром системной воспалительной реакции — ССВР (Systemic Inflammatory Response Syndrome — SIRS)—это патологическое состояние, обусловленное одной из форм хирургической инфекции или альтерацией тканей неинфекционной природы (травмой, операцией, панкреатитом, ожогом, ишемией или аутоиммунным повреждением тканей и др.). Для выявления клинических признаков ССВР при сепсисе было рекомендовано использовать два или более признаков из четырех: температура тела 38 °C и выше или 36 °C и ниже; частота сердечных сокращений 90 в минуту и выше; частота дыхания более 20 в минуту или гипервентиляция (paCO2 32 мм рт.ст. и ниже); уровень лейкоцитов крови более 12·10 9 /мл или менее 4·10 9 /мл, или незрелых форм более 10%. Сепсису и тяжелому сепсису были даны определения.
Сепсис—это патологический процесс, в основе которого лежит реакция организма в виде генерализованного (системного) воспаления на инфекцию различной природы (бактериальную, вирусную, грибковую). Иначе говоря, под сепсисом предлагалось понимать наличие четко установленного инфекционного начала, послужившего причиной возникновения и прогрессирования двух или более признаков ССВР. Тяжелый сепсис —этосепсис, сочетающийся с органной дисфункцией (как минимум двух систем органов), гипотензией, нарушением тканевой перфузии. Проявлением последней, в частности, служат повышение концентрации лактата, олигурия, острое нарушение сознания.
Септический шок (СШ) —сепсис с признаками тканевой и органной гипоперфузии и артериальной гипотонией, не устраняющейся с помощью инфузионной терапии и требующей назначения катехоламинов.
Одним из прогнозируемых, высокозначимых итогов консенсуса ACCP/SCCM (1991 г.) должна была стать возможность проведения согласованных эпидемиологических исследований, посвященных распространенности сепсиса в отдельных регионах мира, что способствовало бы динамичному развитию концепции в части выявления явных и скрытых дефектов в системе избранных координат [23]. Однако за столь длительный период это удалось реализовать лишь в ряде стран с высоким уровнем медицинских, информационных и коммуникационных технологий, а в большинстве стран мира, в том числе в Российской Федерации, этот принцип проведения эпидемиологических исследований оказался несостоятельным. В немалой степени этому способствовало получение при попытках анализа клинико-эпидемиологических корреляций в рамках определений сепсиса ACCP/SCCM (1991 г.) в разных странах абсолютно разноречивых результатов, касающихся как распространенности сепсиса в мире, так и частоты и значимости его отдельных клинических форм. В итоге это сказалось на полярно различающихся результатах лечения сепсиса [1, 26].
Среди РКС следует особо выделить признания значимости гипергликемии (более 7,7 ммоль/л) при отсутствии сахарного диабета, признаков нарушения сознания, гиперлактатемии более 1 ммоль/л, острой олигурии менее 0,5 мл/кг/ч, креатининемии более 44 мкмоль/л, нарушения коагуляции (АЧТВ более 60 с или МНО более 1,5, тромбоцитопения менее 100·10 9 /л), гипербилирубинемии более 70 ммоль/л и пареза кишечника.
Обоснованность логики внедрения РКС иллюстрируют результаты исследования А. Whippy и соавт. [35], согласно которым после введения в дополнение к критериям ACCP/SCCM (1991 г.) обязательного скрининга на уровень лактата в крови ранняя диагностика сепсиса в медицинском центре троекратно возросла (с 35,7 до 119,4 на 1000 госпитализаций). Примечательно, что у группы пациентов высокого риска по сепсису эффективность диагностики достигла 97% против 27%, если были использованы только критерии ACCP/SCCM (1991 г.).
Одно из национальных исследований, проведенных в США, продемонстрировало, что из 24,2 млн ежегодных госпитализаций пациентов с клиническими проявлениями ССВР (17,8% всех госпитализаций взрослых) на долю инфекционной природы синдрома приходится только 26% [17]. По итогам исследования М. Churpek и соавт. [11], основанного на анализе почти 270 тыс. ургентных госпитализаций в отделение интенсивной терапии, констатировано присутствие минимум двух критериев ССВР у 47% пациентов. Хотя летальность при наличии явлений ССВР была достоверно выше, чем без таковых (4,3% против 1,2%; р<0,001), итоговый вывод авторов заключался в том, что использование критериев ССВР для скрининга больных с сепсисом было лишено практической целесообразности.
В 2014 г. были опубликованы результаты объемного (анализировалось около 7 млн клинических наблюдений) исследования V. Liu и соавт. [22]. Дизайн этого исследования предусматривал изучение частоты летальных исходов в двух отдельных проектах с учетом дифференциации пациентов на когорты с выраженным сепсисом (при наличии бесспорных симптомов согласно рекомендациям ACCP/SCCM) и со скрытым (или латентным) сепсисом (с изолированными признаками острой инфекции либо острой органной недостаточности). В первом проекте частота явного сепсиса составила 11,4%, скрытого — 16,7%, во втором проекте явный сепсис был выявлен в 4,3%, а скрытый — в 10,9% всех госпитализаций в региональные клиники. Суммарная летальность при явном сепсисе оказалась почти в 2 раза ниже, чем при латентном. В первом проекте летальность составила 36,9% при явном сепсисе и 55,9% при латентном, во втором проекте — 34,7 и 52,0% соответственно. Большинство летальных исходов регистрируется при скрытом сепсисе, что свидетельствует в первую очередь о несовершенстве и низкой практической значимости исходных критериев ССВР и сепсиса (ACCP/SCCM, 1991 г.), поскольку стандарты для начала терапии пациентов при латентном течении инфекции определены менее четко, чем при явном.
В современных условиях, т. е. спустя 25 лет с момента принятия критериев ACCP/SCCM (1991 г.) [10] и получивших общемировое признание дополнений, внесенных в 2001 г. [21] и подтвержденных для использования в 2012 г. [12], их интерпретация представляет сложность для врачей во всем мире. В американском исследовании С. Rhee и соавт. [27] 94 врачам, занимающимся интенсивной терапией (88%), пульмональной реанимацией (39%), анестезиологам (19%), хирургам (9%) и врачам скорой помощи (9%) были предложены ситуационные задачи, в которых моделировалось по одному клиническому случаю с признаками ССВР без сепсиса, с сепсисом, с ТС, с СШ и без признаков инфекции. Средний стаж практической деятельности респондентов составил 8 лет, 90% из них практиковали в академических больницах. Большинство врачей (83%) были уверены в своей способности применять традиционные определения сепсиса, согласно критериям ACCP/SCCM (1991 г.), а при ознакомлении с текстом заданий 74% посчитали их формулировки реалистичными и понятными. Инициаторов исследования в первую очередь интересовала способность респондентов диагностировать ТС и СШ. В результате 17% респондентов классифицировали один из пяти случаев как ТС/СШ, 27,7% оценили два случая, 33,0% — три случая, 19,2% — четыре случая, 3,2% оценили все пять случаев как ТС/СШ.
Применительно к пониманию сущности определения СШ, а главное, к признанию общепринятых критериев его подтверждения, казалось бы, не должно быть противоречий. Однако даже при этой предельно конкретной форме течения септического синдрома в современной литературе встречается множество разночтений как в определении критериев цифрового выражения глубины гипотонии, так и в выборе оптимальных маркеров тканевой гипоперфузии, будь то, к примеру, уровень лактатемии, гипоксемии или дефицита оснований [28]. Та же гиперлактатемия, как правило, встречается при всех типах шока и является результатом не только перфузионных, но и гликолитических и органносистемных нарушений [32].
Рассматривать гипотонию в качестве единственного критерия СШ у пациентов с инфекцией не вполне логично с позиции современного понимания патобиологии сепсиса. Это связано с тем, что низкие показатели артериального давления могут быть обусловлены приемом гипотензивных препаратов или потенцированным эффектом комбинации нескольких фармакологических препаратов [28]. Неоднородности практического определения СШ и прогноза его терапии в значительной степени способствуют такие зависимые от клинициста управляемые составляющие вмешательств, как состав, объем, темпы осуществления инфузионной, вазопрессорной и инотропной терапии [18, 20]. D. Gaieski и соавт. [15], используя 4 разных метода статистического анализа динамики заболеваемости и летальности от септического шока в США, получили показатели, различающиеся в зависимости от выбранного метода максимально в 3,5 раза.
Судьбоносной, сыгравшей важную роль в том, что была сформирована рабочая группа с целью выработки международного консенсуса по дефиниции сепсиса [16], стала статья коллектива авторов под руководством J.-L. Vincent [33]. В статье лаконично сформирован постулат, согласно которому сепсис следует определять как системную реакцию на инфекцию только при обязательном формировании какой-либо органной дисфункции.
Российская хирургическая мысль не осталась в стороне от процесса поиска оптимальных определений и диагностических критериев различных категорий сепсиса. А.Б. Ларичев считает, что восприятие ССВР как классификационной категории сепсиса противоречит логике современного понимания генерализованного воспаления [2]. По мнению И.В. Нехаева [4], для констатации сепсиса обязательно наличие синдрома полиорганной недостаточности — СПОН (для формулировки диагноза ТС) или шока (для формулировки диагноза СШ).
С.С. Маскиным и соавт. [3] на модели распространенного гнойного перитонита (РГП) были предложены в качестве критериев абдоминального сепсиса (АС) следующие классификационные параметры: наличие трех или четырех критериев ССВР + синдром кишечной недостаточности II—III стадий + наличие критериев недостаточности одного органа (системы), соответствующее оценке по шкале SOFA до 3 баллов. Критериям абдоминального ТС, по мнению исследователей, соответствует ситуация, при которой констатировано наличие СПОН, оцененное по шкале SOFA в 4 балла и более. Модель апробировалась на когорте из 335 пациентов, при этом РГП без сепсиса был констатирован у 26,0±1,4%, АС — у 45,1±2,4% и ТС — у 28,9±1,6% из них. Результаты лечения оценивались в рамках дифференцированного подхода к контролю источника внутрибрюшной инфекции, продемонстрировавшего, что летальность при РГП и отсутствии сепсиса составила 11,4±1,2%, при АС — 34,4±2,8%, при ТС и СШ — 46,3±4,7% (p
В течение последних десятилетий значительно возрос интерес мирового сообщества к проблеме сепсиса. Несмотря на достижения современной фундаментальной и клинической медицины, сепсис по-прежнему отличает значительная распространенность и высокая летальность. В статье обсуждены вопросы распространенности сепсиса в различных странах; показано, что ежегодно диагностируются миллионы случаев генерализованных гнойно-септических инфекций, отмечается устойчивый рост регистрируемого сепсиса в индустриально развитых странах, доля тяжелого сепсиса в структуре патологии на различных территориях варьирует от 2 до 43%. Сепсис по-прежнему остается в числе ведущих причин смерти больных, характеризуясь существенным размахом госпитальной летальности (от 30,6 до 80,4%). Перечислены категории больных, относящиеся к группам высокого риска развития сепсиса. Обращено внимание на эпидемиологические проявления этого патологического синдрома в педиатрии. Показаны особенности этиологического спектра возбудителей сепсиса, возрастающая этиологическая значимость микроорганизмов с множественной антибиотикоустойчивостью (Pseudomonas aeruginosa, Klebsiella pneumoniae, Acinetobacter spp., MRSA, VRE и др.). Учитывая клиникоэпидемиологическую, социальную и экономическую значимость сепсиса, изучение его эпидемиологических аспектов является важнейшим направлением работы здравоохранения.
Ключевые слова
Об авторах
Иркутская государственная областная детская клиническая больница, Иркутская государственная медицинская академия последипломного образования - филиал Российской медицинской академии непрерывного профессионального образования
Россия
Научный центр проблем здоровья семьи и репродукции человека, Иркутская государственная медицинская академия последипломного образования - филиал Российской медицинской академии непрерывного профессионального образования
Россия
Список литературы
1. Авилова Н.Д., Миронов А.Ю., Митрохин С.Д. Микробиологический мониторинг патогенов гнойно-септических заболеваний у онкологических больных. Человек и его здоровье. 2007, 2: 13-16.
2. Блохина Е.В. Кандидемии при гемобластозах. Дисс. канд. мед. наук. М., 2015.
3. Гельфанд Е.Б. Абдоминальный сепсис при перитоните: клиническая характеристика и эффективность антибактериальной терапии. Автореф. дисс. канд. мед. наук. М., 1999.
4. Гончаров А.Д. Эпидемиологические особенности гнойно-септических инфекций, вызванных Acinetobacter baumannii и Pseudomonas aeruginosa в ожоговом и реанимационном отделении. Автореф. дисс. канд. мед. наук. СПб, 2005.
5. Грувер К.П., Белобородов В.Б. Клиническое значение бактериемий у больных сепсисом. Клин. микробиол. антимикроб. химиотер. 2011, 13 (1): 90-97.
6. Егорова С.А., Кафтырева Л.А., Липская Л.В., Коноваленко И.Б., Пясецкая М.Ф. Штаммы энтеробактерий, продуцирующих бета-лактамазы расширенного спектра и металло-бета-лактамазу NDM-1, выделенные в стационарах Балтийского региона. Инфекция и иммунитет. 2013, 1: 29-36.
7. Ерюхин И.А., Гельфанд Б.Р., Шляпников С.А. Руководство по хирургическим инфекциям. И.А. Ерюхин (ред.). СПб, 2006.
9. Кевра М.К. Сепсис: новый взгляд на старую проблему. Медицинский журнал. (Беларусь). 2003, 4: 25-32.
11. Мартинович А.А. Динамика антибиотикорезистентности и эпидемиология инфекций, вызванных Acinetobacter spp., в России. Клиническая микробиология и антимикробная химиотерапия. 2010, 12 (2): 96-105.
12. Плоткин Л.В. Абдоминальный сепсис: обоснование выбора мониторинга и интенсивной терапии. Дисс. д-ра мед. наук. Екатеринбург, 2009.
13. Решедько Г.К., Рябкова Е.Л., Фаращук А.Н., Страчунский Л.С. (исследовательская группа РОСНЕТ). Неферментирующие грамотрицательные возбудители нозокомиальных инфекций в ОРИТ России: проблемы антибиотикорезистентности. Клиническая микробиология, антимикробная химиотерапия. 2006, 8: 232-248.
14. Руднов В.А., Бельский Д.В., Дехнич А.В. Инфекции в ОРИТ России: результаты национального многоцентрового исследования. Клиническая микробиология, антимикробная химиотерапия. 2011, 13 (4): 294-303.
15. Руднов В.А. Сепсис. Современный взгляд на проблему. Клин. антимикробная терапия. 2000, 1: 4-10.
16. Савельев В.С., Гельфанд Б.Р. Сепсис: классификация, клинико-диагностическая концепция и лечение. В.С. Савельев (ред.). М., МИА, 2010.
17. Савина В.А., Колосовская Е.Н., Лебедев В.Ф. Актуальные вопросы эпидемиологии сепсиса. Медицинский альманах. 2014, 4 (34): 20-22.
18. Светличная Ю.С., Колосовская Е.Н., Кафтырева Л.А., Дарьина М.Г. Микробиологический мониторинг в системе эпидемиологического надзора за госпитальными инфекциями. Эпидемиология и вакцинопрофилактика. 2014, 1(74): 9-14.
19. Сепсисология с основами инфекционной патологии. Бочоришвили В.Г. (ред.). Тбилиси, 1988.
20. Шевченко Ю.Л., Гороховатский Ю.И., Азизова О.А., Замятин М.Н. Системный воспалительный ответ при экстремальной хирургической агрессии. М., РАЕН, 2009.
21. Шпрыкова О.Н. Микробиологические и эпидемиологические особенности микробных ассоциаций при гнойно-септических исследованиях. Автореф. дисс. канд. мед. наук. Н.-Новгород, 2004.
22. Angus D.C., Linde-Zwirble W.T., Lidicker J. et al. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care. Crit. Care Med. 2001, 29 (7): 13031310.
23. Arendrup M., Sulim S., Holm A. et al. Diagnostic issues, clinical characteristic, and outcomes for patients with candidemia. J. Clin. Microbiol. 2011, 49: 3300-3308.
24. Chalupka A.N., Talmor D. The economics of sepsis. Crit. Care Clin. 2012, 28 (1): 57-76.
25. Chen C.J., Huang Y.C., Chiu C.H. et al. Clinical features and genotyping analisis of community-acquired methicillin-resistant Staphylococcus aureus infections in Taiwanese children. Pediatr. Infect. Dis. J. 2005, 24(1): 40-45.
26. Cybele L. Abad, Nasia Safdar. Antimicrobial Therapy of sepsis and septic shock- When are two drugs better than one? Crit. Care Clin. 2011, 27: 215-227.
27. Danai P., Martin G.S. Epidemiology of sepsis: Recent advances. Current Infectious Disease Reports. 2005, 7 (5): 329-334.
28. Fujishima S., Gando S., Saitoh D. et al. A multicenter, prospective evaluation of quality of care and mortality in Japan based on the Surviving Sepsis Campaign guidelines. J. Infect. Chemother. 2014, 20 (2): 115-120.
29. Harrison D.A., Welch C.A., Eddleston J.M. The epidemiology of severe sepsis in England, Wales and Northern Ireland, 1996 to 2004: secondary analysis of a high quality clinical database, the ICNARC Case Mix Programme Database. Critical Care. 2006, 10: 42.
30. Hartman M.E., Linde-Zwirble W.T., Angus D.C. et al. Trends in the epidemiology of pediatric severe sepsis Pediatr. Crit. Care Med. 2013, 14 (7): 686-693.
31. Jaramillo-Bustamante C., Mann-Agudelo A., Fernandez-Laverde M. et al. Epidemiology of sepsis in pediatric intensive care units: First colombian multicenter study. Pediatr. Crit. Care Med. 2012, 13 (5): 501-508.
32. Marx G., Litmathe J., Schulz J. et al. Incidence of severe sepsis and septic shock in German intensive care units: the prospective, multicentre INSEP study. Intensive Care Med. 2016, 42(12): 1980-1989.
33. Martin G.S., Mannino D.M., Eaton S. The epidemiology of sepsis in the United States from 1979 through 2000. Engl. J. Med. 2003, 348 (16): 1546-1554.
35. Patel G.P., Gurka D.P., Balk R.A. New treatment strategies for severe sepsis and septic shock. Curr. Opinin. Crit. Care. 2003, 9 (5): 390-396.
36. Pittoni G.M., Scatto A. Economics and outcome in the intensive care unit. Curr. Opin. Anaesthesiol. 2009, 22 (2): 232-236.
38. Sakai A.F., Rocha L.L, Pessoa M.S. et al. Patterns of organe dysfunction in severe sepsis and septic shock patients admitted to the ICU from the emergency department: a 4-year retrospective cohort. Crit. Care. 2015, 19: 78.
39. Shime N., Kawasaki T., Saito O. et al. Incidence and risk factors for mortality in pediatric severe sepsis: results from the national pediatric intensive care registry in Japan. Int. Care Med. 2012, 38: 1191-1197.
40. Silva E., Biasi Cavalcanti A., Bugano D.D. et al. Do established prognostic factors explain the different mortality rate in ICU septic patients around the world? Minerva Anesth. 2012, 78: 1215-1225.
41. Singer M., Deutschman C.S., Seymour C.W. et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 2016, 315 (8): 801-810.
42. Tang R., Huang Y., Chen Q. et al. Relationship between regional lung compliance and ventilation homogeneity in the supine and prone position. Acta Anaesthesiol. Scand. 2012, 56 (9): 1191-1199.
43. Vincent J.L., Rello J., Marshal J. et al. International study of prevalence and outcomes of infection in ICU. JAMA. 2009, 302: 2323-2329.
44. Watson R.S., Carcillo J.A., Linde-Zwirble W.T. et al. The Epidemiology of Severe Sepsis in children in the United States. Am. J. Respir. Crit. Care Med. 2003, 167: 695-701.
45. Weiss S.L., Fitzgerald J.C., Pappachan J. et al. Global epidemiology of pediatric severe sepsis: The sepsis prevalence, outcomes, and therapies study. Am. J. Respir. Crit. Care Med. 2015, 191(10): 1147-1157.
46. White L.E., Chaudhary R., Moore L.J. et al. Surgical sepsis and organ crosstalk: the role of the kidney. J. Surg. Res. 2011, 167 (2): 306-315.
47. Zahore R., Firmment J., Strakova J. et al. Epidemiology of severy sepsis ICU of Slovak Republic. Infection. 2005, 33: 125-126.
48. Zaoutis T.E., Toltzis P., Chu J. et al. Clinical and molecular epidemiology of community-acquired methicillin-resistant Staphylococcus aureus infections among children with risk factors for health care-associated infection: 2001-2003. Pediatr. Infect. Dis. J. 2006, 25(4): 343-348.
Читайте также:

