Эшерихия коли сепсис симптомы лечение
Обновлено: 24.04.2024
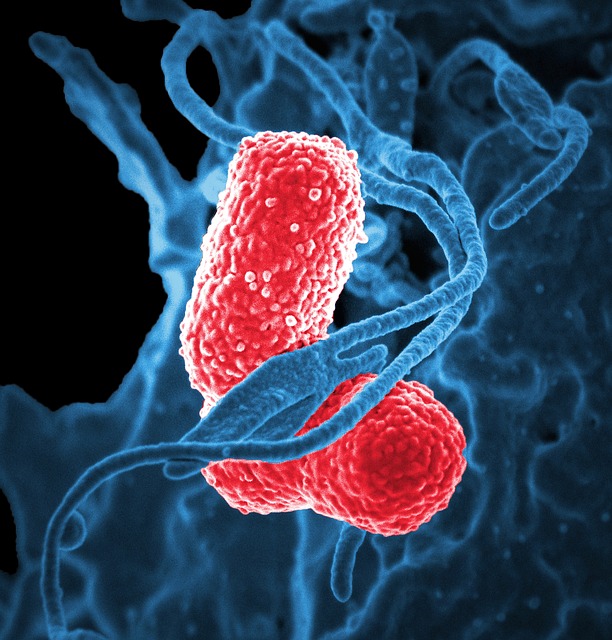
Темой нынешнего разговора будет, с точки зрения автора, королева внутрибольничных инфекций любого стационара – Klebsiella pneumonia (или палочка Фридлендера).
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Темой нынешнего разговора будет, с точки зрения автора, королева внутрибольничных инфекций любого стационара – Klebsiella pneumoniae (или палочка Фридлендера). Да-да, автор не ошибся, именно она, а не синегнойки или ацинетки, а именно ее величество – клебсиелла, практически абсолютная убийца тяжелых и крайне тяжелых пациентов. Почему это именно так, мы сегодня и поговорим.
Микробиологические аспекты
Первое и главное, о чем надо знать, – Klebsiella pneumonia – это представитель нормальной микрофлоры кишечника. Еще раз и большими буквами – НОРМАЛЬНОЙ! Не надо ее там лечить (как и стафилококк в носоглотке) – она там живет, и это ее естественный ареал обитания.
А все остальные локации, где она может быть обнаружена: нижние дыхательные пути, мочевыводящий тракт, секрет простаты или содержимое полости матки (анальный сексуальный акт без презерватива – зло, имейте это в виду при сборе анамнеза, особенно у женщин с послеродовым эндометритом, автор такого навидался в достатке… мужчин это тоже касается, и обнаружение подобной зверюшки в секрете простаты должно навести на определенные мысли и вопросы, и пока пациент не закончит данную практику, простатит вы ему при всем желании не вылечите), кровь и в раны при раневых инфекциях после хирургического вмешательства на брюшной полости – могут указывать на возбудителя текущего состояния.
Что вызывает:
- Пневмонию
- Абсцессы легких
- Перитониты
- Инфекции мочевыводящих путей
- Менингиты
- Эндокардиты
- Раневые инфекции
- Инфекции матки и влагалища
- Сальпингиты
- Остеомиелиты
- Инфекции кожи
- Сепсис
Общим у всех этих патологий является одно – они все тем или иным образом связаны с вмешательством, и чаще всего (опуская уже упомянутые анальные сексуальные акты) это вмешательство носит ятрогенный характер. Клебсиелла не умеет ни летать, ни ходить, ни даже ползать, в очаг ее приносят либо неправильно вымытые руки, либо плохо обработанное медицинское оборудование.
Эпидемиологические аспекты
С клебсиеллой все намного сложнее. Эта, не побоюсь громкого слова, зверища, живет в кишечниках всего персонала медицинских учреждений. И в первую очередь, как понятно из ее названия, поражает нижние дыхательные пути. А если персонал работает с антибиотиками, то клебсиелла еще и устойчивая ко всему арсеналу применяемых препаратов (это к вопросу о разумном ограничении доступа к препаратам резерва). Так как сама клебсиелла не имеет ножек и крылышек, то попадает в оные пути она двумя способами: или в случае аспирации, или на руках персонала и с оборудования. Иного не дано. При аспирации это будет личная дикая зверюшка пациента, в случае грязных шаловливых ручек или оборудования (например, эндоскопов) – клебсиелла, высеваемая в отделении в процессе микробиологического мониторинга. А если этот мониторинг углубленный, то напрямую покажет, какая именно хрюшка, выйдя из туалетной комнаты, не соизволила помыть руки, понадеявшись на перчатки. И нет, перчатки, даже стерильные в данном случае, не спасают, они не презерватив. Руки надо мыть и обрабатывать правильно, обязательно соблюдая технологию и экспозицию.
Как вы понимаете, истребить медицинский персонал мы не можем, поэтому и полностью очистить стационар от данной проблемы не получится. И она обязательно выскочит, стоит на секунду расслабиться, и выскочит на самом тяжелом больном, где еще умудрится смутировать в такого урода, которого не достанешь никаким антибиотиком.
На общемировом клебсиеллу тоже очень сильно боятся, и когда в 2010 году вдруг в Великобритании обнаружили штамм NDM (он устойчив вообще ко всему набору существующих антибиотиков и обозван абсолютным убийцей), паника была знатной. В результате проведенного эпидемиологического расследования, по итогам которого большая группа видных ученых стала персонами non-grata в Индии, было установлено, что данный штамм привезен оттуда и из Пакистана. Присутствие в сточных водах возбудителей, имеющих карбапенемазы (то есть это уже не внутрибольничная флора, это то, что там живет на улице) на момент проведения расследования составляла 90% по CTX-M15 и 36% по NDM. С чем связан сей факт? С безрецептурным масштабным использованием карбапенемов и… проблемами с проточной канализацией. Ее либо нет, либо ей не пользуются, а делают все по старинке. А так как земной шар оказался очень маленьким, теперь NDM-штаммы обнаруживаются по всей планете. У нас, например, очень быстро данным штаммом заселились клиники Санкт-Петербурга. И медицина перед ними бессильна. До тех пор, пока не налажен эпиднадзор, а персонал не моет руки после каждого посещения туалета.
Так как любого врага надо знать в лицо, то наиболее часто встречаемые портреты у автора тоже есть.
Итак, дикая и ничем ни разу не пуганная клебсиелла выглядит вот так:
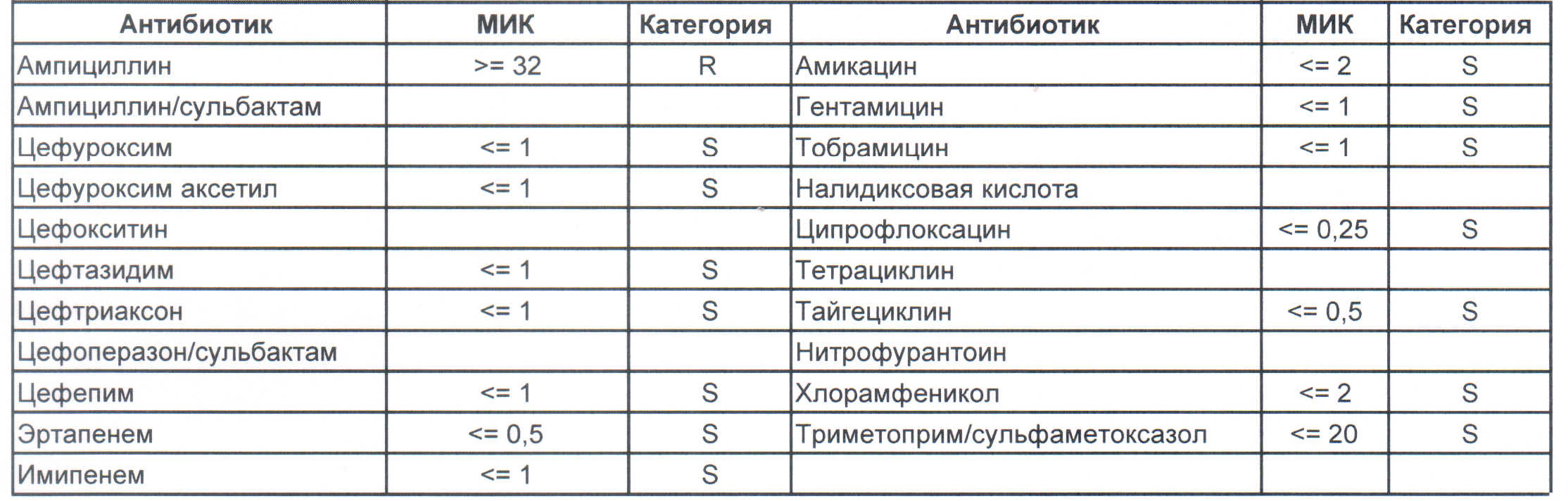
Где встречается? Те самые послеродовые эндометриты, как результат плотских утех, простатиты, а также раневые инфекции после оперативных вмешательств на брюшной полости у ранее не леченных пациентов.
На этом рисунке:
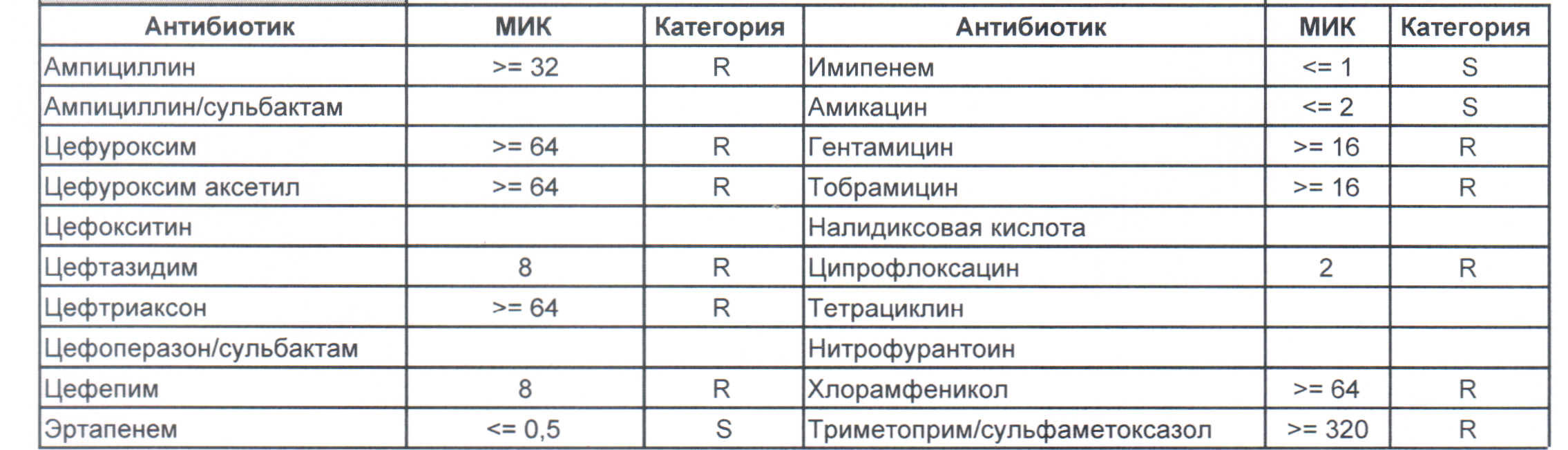
– вы можете увидеть устойчивый внутрибольничный штамм, который еще можно чем-то полечить, но это будет тяжело и дорого, проще персонал научить руки мыть и бороды брить (фекальной микрофлоры в мужских бородах в таком достатке, что единственный вариант для тех, кто хоть как-то соприкасается с ранами, данное украшение не носить или не оперировать).
На следующей картинке:
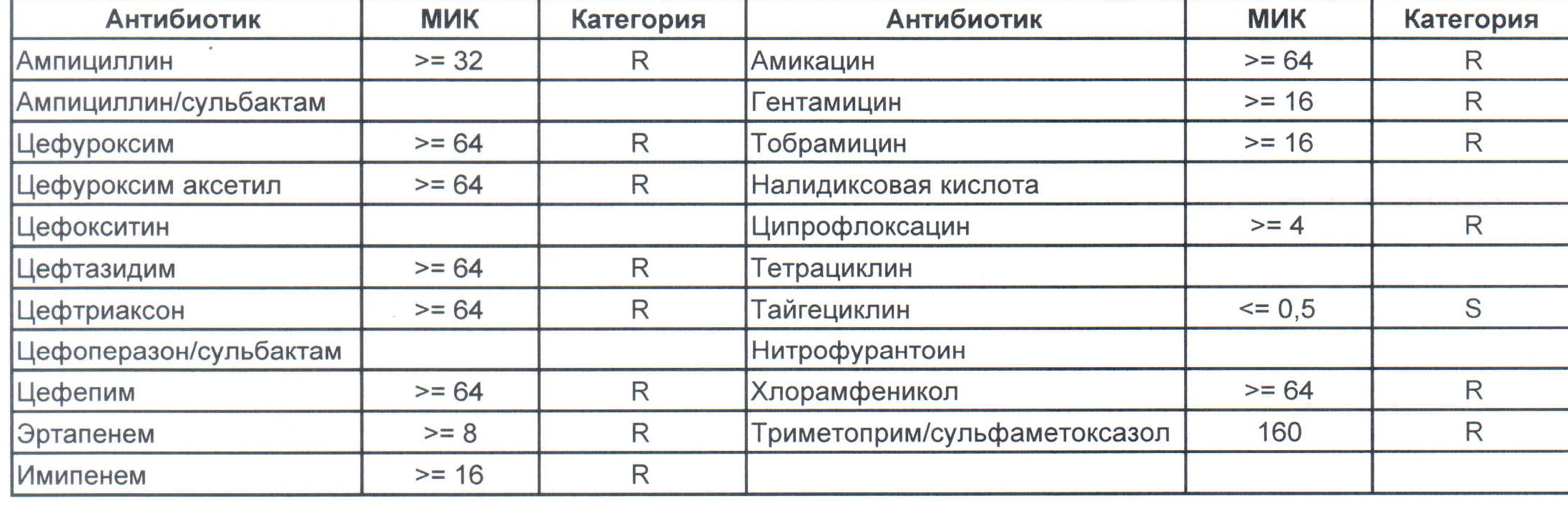
– мы видим практически неубиваемого зверя, который сам по себе вбивает тот самый последний гвоздь в гроб пациента. Но как же Тигециклин, спросите вы. Отвечу – тигацил является бактериостатиком, и пока он наберет необходимую силу, пациента уже отнесут и закопают. Но даже это еще не предел. Предел на следующем рисунке, и нет, Имипенем при указанной MIC уже бессилен:
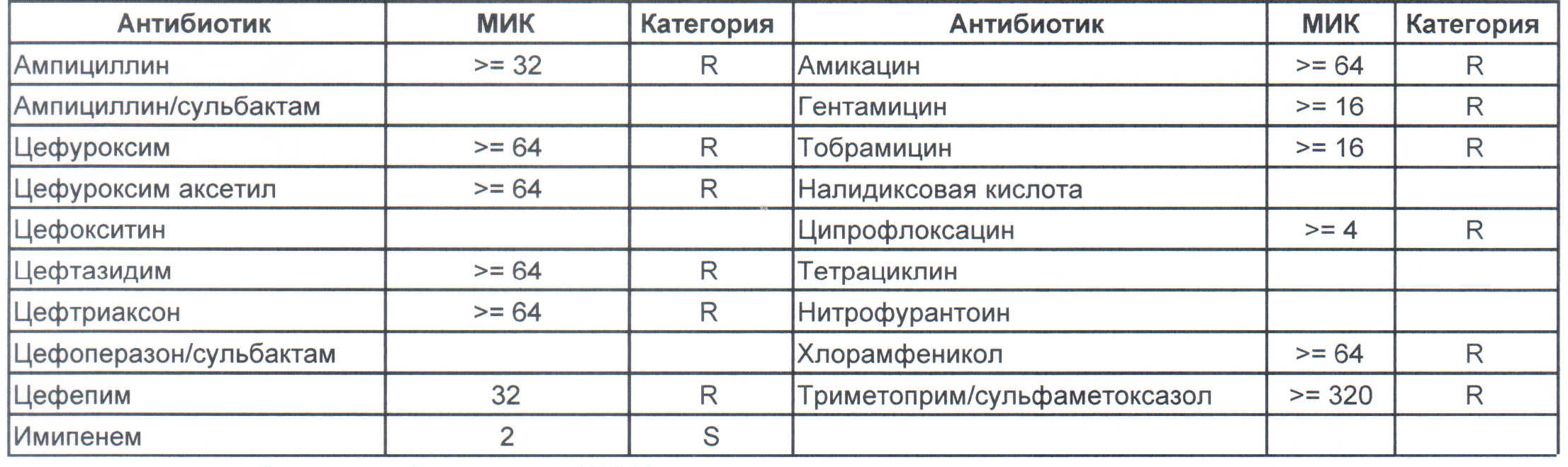
Чем лечить?
Дикая клебсиелла отлично лечится препаратами группы цефалоспоринов третьего ряда.
Эшерихиозы — группа бактериальных антропонозных инфекционных болезней, вызываемых патогенными (диареегенными) штаммами кишечной палочки, протекающих с симптомами общей интоксикации и поражением ЖКТ.
Классификация
Этиология и патогенез
Эшерихии — подвижные грамотрицательные палочки, аэробы, относящиеся к виду Escherichia coli, роду Escherichia, семейству Enterobacteriaceae. Растут на обычных питательных средах, выделяют бактерицидные вещества-колицины. Морфологически серотипы не отличаются друг от друга. Эшерихии содержат соматические (О-Аг — 173 серотипа), капсульные (К-Аг — 80 серотипов) и жгутиковые (Н-Аг — 56 серотипов) антигены. Диареегенные кишечные палочки подразделяются на пять типов:
Факторы патогенности ЭТКП (пили, или фимбриальные факторы) определяют склонность к адгезии и колонизации нижних отделов тонкой кишки, а также к токсинообразованию. Термолабильный и термостабильный энтеротоксины ответственны за повышенную экскрецию жидкости в просвет кишки. Патогенность ЭПКП обусловлена способностью к адгезии. ЭИКП способны, имея плазмиды, проникать в клетки кишечного эпителия и размножаться в них. ЭГКП выделяют цитотоксин, шигоподобные токсины 1-го и 2-го типов, содержат плазмиды, которые облегчают адгезию к энтероцитам. Факторы патогенности энтероадгезивных кишечных палочек изучены недостаточно.
Эшерихии устойчивы в окружающей среде, могут месяцами сохраняться в воде, почве, испражнениях. Сохраняют жизнеспособность в молоке до 34 дней, в детских питательных смесях — до 92 дней, на игрушках — до 3-5 мес. Хорошо переносят высушивание. Обладают способностью размножаться в пищевых продуктах, особенно в молоке. Быстро погибают при воздействии дезинфицирующих средств и при кипячении. У многих штаммов Е. coli отмечают полирезистентность к антибиотикам.
Эшерихии проникают через рот, минуя желудочный барьер, и в зависимости от типовой принадлежности оказывают патогенное действие.
Энтеротоксигенные штаммы способны вырабатывать энтеротоксины и фактор колонизации, посредством которого осуществляются прикрепление к энтероцитам и колонизация тонкой кишки.
Энтеротоксины — термолабильные или термостабильные белки, которые воздействуют на биохимические функции эпителия крипт, не вызывая видимых морфологических изменений. Энтеротоксины усиливают активность аденилатциклазы и гуанилатциклазы. При их участии и в результате стимулирующего действия простагландинов увеличивается образование цАМФ, вследствие чего в просвет кишки секретируется большое количество воды и электролитов, которые не успевают реабсорбироваться в толстой кишке, — развивается водянистая диарея с последующими нарушениями водно-электролитного баланса. Инфицирующая доза ЭТКП — 10х10 10 микробных клеток.
ЭИКП обладают свойством внедряться в клетки эпителия толстой кишки. Проникая в слизистую оболочку, они вызывают развитие воспалительной реакции и образование эрозий кишечной стенки. Из-за повреждения эпителия усиливается всасывание в кровь эндотоксинов. У больных в испражнениях появляются слизь, кровь и полиморфно-ядерные лейкоциты. Инфицирующая доза ЭИКП — 5х10 5 микробных клеток.
Механизм патогенности ЭПКП изучен недостаточно. У штаммов (055,086,0111 и др.) выявлен фактор адгезии к клеткам Нер-2, за счёт которого происходит колонизация тонкого кишечника. У других штаммов (018, 044, 0112 и др.) этот фактор не обнаружен. Инфицирующая доза ЭПКП — 10х10 10 микробных клеток.
ЭГКП выделяют цитотоксин (SLT — shiga-like toxin), который разрушает клетки эндотелия, выстилающего мелкие кровеносные сосуды кишечной стенки проксимальных отделов толстой кишки. Сгустки крови и фибрин препятствуют кровоснабжению кишки — в кале появляется кровь. Развивается ишемия кишечной стенки, вплоть до некроза. У некоторых больных наблюдают осложнения с развитием синдрома диссеминированного внутрисосудистого свёртывания (ДВС), ИТШ и ОПН.
ЭАКП способны к колонизации эпителия тонкой кишки. Вызванные ими заболевания взрослых и детей протекают длительно, но легко. Это связано с тем, что бактерии прочно закрепляются на поверхности эпителиальных клеток.
Эпидемиология
Основной источник эшерихиозов — больные со стёртыми формами заболевания, меньшую роль играют реконвалесценты и носители. Значимость последних возрастает, если они работают на предприятиях по приготовлению и реализации пищевых продуктов. По некоторым данным, источник возбудителя при энтерогеморрагических эшерихиозах (0157) — крупный рогатый скот. Инфицирование людей происходит при употреблении продуктов, которые были недостаточно термически обработаны. Механизм передачи — фекально-оральный, который осуществляется пищевым, реже — водным и бытовым путём. По данным ВОЗ, для энтеротоксигенных и энтероинвазивных эшерихии характерен пищевой, а для энтеропатогенных — бытовой путь.
Из пищевых продуктов чаще фактором передачи служат молочные изделия, готовые мясные продукты, напитки (квас, компот и др.).
В детских коллективах инфекция может распространяться через игрушки, загрязнённые предметы обихода, руки больных матерей и персонала. Реже регистрируют водный путь передачи эшерихиозов. Наиболее опасно загрязнение открытых водоёмов, которое происходит в результате сброса необезвреженных хозяйственно-бытовых сточных вод, особенно из детских учреждений и инфекционных больниц.
Основу профилактики эшерихиозов составляют меры по пресечению путей передачи возбудителя. Особенно важно соблюдать санитарно-гигиенические требования на объектах общественного питания, водоснабжения; предупреждать контактно-бытовой путь заражения в детских учреждениях, родильных домах, стационарах (использование индивидуальных стерильных пелёнок, обработка рук дезинфицирующими растворами после работы с каждым ребёнком, дезинфекция посуды, пастеризация, кипячение молока, молочных смесей). Продукты, готовые к употреблению, и сырые, нужно разделывать на разных досках отдельными ножами. Посуду, в которой транспортируют пищу, необходимо обрабатывать кипятком.
При подозрении на эшерихиоз необходимо обследовать беременных до родов, рожениц, родильниц и новорождённых.
Контактных в очаге заболевания наблюдают 7 дней. Детей, контактных с больным эшерихиозом по месту жительства, допускают в детские учреждения после разобщения с больным и трёхкратных отрицательных результатов бактериологического исследования кала.
При выявлении больных эшерихиозом в детских учреждениях и родильных домах прекращают приём поступающих детей и рожениц. Персонал, матери, дети, бывшие в контакте с больным, а также дети, выписанные домой незадолго до заболевания, обследуются трёхкратно (проводят бактериологическое исследование кала). При выявлении лиц с положительными результатами обследования их изолируют. Больных, перенёсших эшерихиоз, наблюдают в течение 3 мес с ежемесячным клиническим и бактериологическим обследованием в КИЗ. Перед снятием с учёта — двукратное бактериологическое исследование кала с интервалом в 1 день.
Клиническая картина
Cимптомы, течение
Клинические проявления эшерихиозов зависят от типа возбудителя, возраста больного, иммунного статуса.
Заболевание начинается остро, больных беспокоят слабость, головокружение. Температура тела нормальная или субфебрильная. Появляются тошнота, повторная рвота, разлитые схваткообразные боли в животе. Стул частый (до 10-15 раз в сутки), жидкий, обильный, водянистый, нередко напоминающий рисовый отвар. Живот вздут, при пальпации определяют урчание, небольшую разлитую болезненность. Тяжесть течения определяется степенью дегидратации. Возможна молниеносная форма заболевания с быстрым развитием эксикоза. Длительность болезни 5-10 дней.
Особенности эшерихиоза, вызванного энтероадгезивными штаммами, изучены мало. Заболевание регистрируют у пациентов с ослабленной иммунной системой. Чаще выявляют внекишечные формы — поражение мочевыводящих (пиелонефрит, цистит) и желчевыводящих (холецистит, холангит) путей. Возможны септические формы (коли-сепсис, менингит).
Диагностика
Клиническая картина эшерихиозов сходна с клинической картиной других диарейных инфекций. Поэтому диагноз подтверждают на основании бактериологического метода исследования. Материал (испражнения, рвотные массы, промывные воды желудка, кровь, моча, ликвор, жёлчь) следует брать в первые дни болезни до назначения больным этиотропной терапии. Посевы производят на среды Эндо, Левина, Плоскирева, а также на среду обогащения Мюллера.
Используют иммунологические методы исследования РА, РИГА в парных сыворотках, но они не убедительны, так как возможны ложноположительные результаты из-за антигенного сходства с другими энтеробактериями. Эти методы используют для ретроспективной диагностики, особенно во время вспышки.
Перспективным методом диагностики служит ПЦР. Инструментальные методы исследования (ректороманоскопия, колоноскопия) при эшерихиозах малоинформативны.
Дифференциальный диагноз
Дифференциальную диагностику эшерихиозов проводят с другими острыми диарейными инфекциями: холерой, шигеллёзом, сальмонеллёзом, кампилобактериозом, ПТИ стафилококковой этиологии и вирусными диареями: ротавирусной, энтеровирусной, Норволк-вирусной инфекцией и др.
В отличие от эшерихиозов, холера характеризуется отсутствием интоксикации, лихорадки, болевого синдрома, наличием многократной рвоты, быстрым развитием дегидратации III-IV степени. Помогает в постановке диагноза эпидемиологический анамнез — пребывание в эндемичных для холеры регионах.
Сальмонеллёз, в отличие от эшерихиозов, характеризуется более выраженной интоксикацией, разлитыми болями в животе, болезненностью при пальпации в эпигастральной и околопупочной областях, урчанием. Характерен зловонный стул зеленоватого цвета.
Для ПТИ стафилококковой этиологии, в отличие от эшерихиозов, характерны острое, бурное начало заболевания, короткий инкубационный период (30-60 мин), более выражены симптомы интоксикации, рвота неукротимая. Боли в животе режущего характера, с локализацией в эпигастральной и околопупочной областях. Характерны групповой характер заболевания, связь заболевания с пищевым фактором, быстрый регресс болезни.
Осложнения
Чаще эшерихиозы протекают доброкачественно, но возможны осложнения: ИТШ, гиповолемический шок с дегидратацией III-IV степени, ОПН, сепсис, пневмония, пиелоцистит, пиелонефрит, холецистит, холангит, менингит, менингоэнцефалит. Летальный исход в результате ОПН (синдром Гассера) регистрируют у детей до 5 лет в 3-7% случаев. В Москве за последние 10 лет летальных исходов не было.
Лечение
В остром периоде болезни больным рекомендуют щадящую терапию (стол № 4, при нормализации стула — № 2, в период реконвалесценции — № 13).
В лёгких случаях заболевания достаточно назначения оральной регидратационной терапии (регидрон и другие растворы, количество которых должно в 1,5 раза превышать потери воды с испражнениями).
Показаны ферменты (панзинорм-форте, мезим-форте), энтеросорбенты (полисорб, энтеросгель, энтеродез в течение 1-3 дней). При лёгком течении болезни целесообразно использование кишечных антисептиков (интетрикс по две капсулы три раза в день, неоинтестопан после каждого акта дефекации по две таблетки, до 14 в сутки, энтерол по две капсулы два раза в день) в течение 5-7 дней. Лёгкие и стёртые формы эшерихиозов не требуют назначения этиотропных препаратов.
При лечении больных в условиях стационара показан постельный режим в первые 2-3 дня. Назначают этиотропную терапию. С этой целью при среднетяжёлых формах используют один из следующих препаратов: ко-тримоксазол по две таблетки два раза в день или препараты фторхинолонового ряда (ципрофлоксацин по 500 мг два раза в сутки перорально, пефлоксацин по 400 мг два раза в сутки, офлоксацин по 200 мг два раза в сутки), длительность терапии 5-7 дней.
В тяжёлых случаях фторхинолоны применяют вместе с цефалоспоринами 2-го (цефуроксим по 750 мг четыре раза в сутки внутривенно или внутримышечно; цефаклор по 750 мг три раза в сутки внутримышечно; цефтриаксон 1,0 г один раз в сутки внутривенно) и 3-го поколения (цефоперазон по 1,0 г два раза в сутки внутривенно или внутримышечно; цефтазидим по 2,0 г два раза в сутки внутривенно или внутримышечно).
При дегидратации II-III степени назначают регидратационную терапию внутривенно кристаллоидными растворами (хлосоль, ацесоль и пр.), которую проводят по общим правилам.
При выраженных симптомах интоксикации используют коллоидные растворы (декстран и др.) в объёме 400-800 мл/сут.
После приёма антибактериальных препаратов при продолжающейся диарее используют эубиотики для коррекции дисбактериозов (бифидумбактерин-форте, хилак-форте и др.) в течение 7-10 дней. Больных выписывают после полного клинического выздоровления, нормализации стула и температуры тела, а также однократного бактериологического исследования кала, которое проводят не ранее чем через 2 дня после окончания лечения.
При лёгкой форме заболевания 5-7 дней, при среднетяжёлой 12-14 дней, при тяжёлой — 3-4 нед. Диспансеризация не регламентирована.
Госпитализация
Госпитализацию больных с эшерихиозами проводят по клиническим и эпидемиологическим показаниям. Больных при среднетяжёлом и тяжёлом течении заболевания госпитализируют в инфекционные больницы. В лёгких случаях больные могут лечиться амбулаторно при наличии благоприятных бытовых, санитарно-гигиенических условий.
По эпидемиологическим показаниям госпитализации подлежат лица из декретированных групп, больные из организованных коллективов, а также пациенты, проживающие в коммунальных квартирах, общежитиях.
Эшерихиозы – это острые, преимущественно кишечные инфекции, вызываемые некоторыми сероварами бактерии Escherichia coli. Эшерихиозы проявляются в виде энтерита и энтероколита, могут генерализоваться и протекать с внекишечной симптоматикой. Путь передачи кишечной палочки фекально-оральный. Чаще заражение происходит при употреблении зараженных молочных и мясных продуктов. Возможен и контактно-бытовой путь передачи кишечной инфекции. Диагноз эшерихиоза устанавливается при выявлении эшерихий в рвотных и каловых массах, а при генерализации инфекции - в крови. Лечение эшерихиозов состоит из диеты, регидратационной терапии, применения противомикробных средств и эубиотиков.
МКБ-10
Общие сведения
Эшерихиозы (коли-инфекции) - группа инфекций, вызываемой кишечной палочкой и протекающих с поражением ЖКТ, мочевых путей, респираторного тракта, мозговых оболочек, бактериемией. Чаще встречаются у детей раннего возраста. Наиболее распространены кишечные инфекции, вызванные эшерихией: они являются самой частой причиной диареи у младенцев и взрослых. Некоторые штаммы и их токсины вызывают жизнеугрожающие поражения внутренних органов.
Причины эшерихиозов
Escherichia coli (кишечная палочка) представляет собой короткие полиморфные грамотрицательные палочковидные бактерии, непатогенные штаммы которых присутствуют в составе нормальной кишечной флоры. Эшерихиоз вызывают диареегенные серовары следующих групп:
- энтеропатогенные (ЭПКП);
- энтеротоксигенные (ЭТКП);
- энтероинвазивные (ЭИКП);
- энтерогеморрагические (ЭГКП);
- энтероадгезивные (ЭАКП).
Эшерихии устойчивы во внешней среде, могут сохранять жизнеспособность в почве, воде и фекалиях до нескольких месяцев. В пищевых продуктах (в особенности в молоке) размножаются, образуя многочисленные колонии, легко переносят высушивание. Кишечные палочки погибают при кипячении и действии дезинфицирующих средств.
Эпидемиология
Резервуаром и источником инфекции являются больные люди или здоровые носители. Наибольшее эпидемическое значение в распространении возбудителя имеют лица, больные эшерихиозами, вызванными видами ЭПКП и ЭИКП, остальные группы бактерий менее опасны. Больные эшерихиозами, обусловленными заражением ЭТКП и ЭГКП контагиозны только в первые дни заболевания, в то время как ЭИКП и ЭПКП группы кишечных палочек выделяются больными 1-2 (иногда 3) недели. Выделение возбудителя может продолжаться довольно долго, в особенности у детей.
Механизм передачи кишечной палочки – фекально-оральный, чаще всего реализуется пищевой путь заражения для ЭТКП и ЭИКП и бытовой для ЭПКП. Кроме того, заражение может осуществляться водным путем. Пищевое заражение в основном происходит при употреблении молочных продуктов, мясных блюд, напитков (квас, компоты) и салатов с вареными овощами.
В детских коллективах и среди лиц, пренебрегающих правилами гигиены, возможно распространение кишечной палочки контактно-бытовым путем через загрязненные руки, предметы, игрушки. Заражение возбудителями группы ЭГПК часто происходит в результате употребления недостаточно кулинарно обработанного мяса, сырого непастеризованного молока. Отмечены вспышки эшерихиозов, вызванных употреблением гамбургеров.
Реализация водного пути заражения в настоящее время мало распространена, заражение водоемов кишечной палочкой обычно происходит при сбросе сточных вод без предварительного обезвреживания. Естественная восприимчивость к эшерихиозам высокая, после перенесения инфекции формируется нестойкий группоспецифический иммунитет.
Классификация
Эшерихиозы классифицируются по этиологическому принципу в зависимости от группы возбудителя (энтеропатогенные, энтеротоксические, энтероинвазивные, и энтерогеморрагические).
- Эшерихии группы ЭПКП – преимущественно вызывают эшерихиозы у детей, в особенности на первом году жизни. Вспышки, обусловленные этой группой кишечных палочек, как правило, возникают в яслях, детских садах, роддомах и детских отделения больниц. Заражение обычно происходит контактно-бытовым путем.
- Палочки группы ЭИКП вызывают энтероколиты, протекающие по типу дизентерии у детей старше года и взрослых. Заражение происходит водным и пищевым путем, отмечается летне-осенняя сезонность. Преимущественно распространены в развивающихся странах.
- ЭТКП вызывают инфекции холероподобного течения, заражаются дети от двух лет и взрослые, заболеваемость высока в странах с жарким климатом и низкой гигиенической культурой. Заражение происходит пищевым и водным путем.
- Эпидемиологических данных в отношении инфекций, возникающих в результате поражения возбудителем группы ЭГКП, в настоящее время недостаточно для детальной характеристики. В эпидемиологии эшерихиозов основное значение играют гигиенические мероприятия, как общего, так и индивидуального характера.
Существует клиническая классификация, выделяющая гастроэнтерическую, энтероколитическую, гастроэнтероколитическую и генерализованную формы заболевания. Генерализованная форма может быть представлена коли-сепсисом или поражением кишечной палочкой различных органов и систем (менингит, менингоэнцефалит, пиелонефрит и др.). Эшерихиоз может протекать в легкой, среднетяжелой и тяжелой форме.
Симптомы эшерихиоза
Энтеропатогенный эшерихиоз
ЭПКП I класса развивается обычно у детей младшего возраста, инкубационный период составляет несколько дней, проявляется преимущественно рвотой, жидким стулом, выраженной интоксикацией и дегидратацией. Есть вероятность развития генерализованной септической формы. Взрослые заболевают ЭПКП II класса, болезнь протекает по типу сальмонеллеза.
Энтероинвазивный эшерихиоз
Для поражения ЭИКП характерно течение наподобие дизентерии или шигеллеза. Инкубационный период длится от одного до трех дней, начало острое, отмечается умеренная интоксикация (головная боль, слабость), лихорадка в пределах от субфебрильных до высоких значений, озноб. Затем появляются боли в животе (преимущественно вокруг пупка), диарея (иногда с прожилками крови, слизью). Пальпация живота отмечает болезненность по ходу толстой кишки. Нередко эшерихиоз этого вида протекает в легкой и стертой форме, может отмечаться среднетяжелое течение. Обычно длительность заболевания не превышает нескольких дней.
Энтеротоксигенный эшерихиоз
Поражение ЭТКП может проявляться клиническими симптомами, сходными с таковыми при сальмонеллезе, пищевой токсикоинфекции или напоминать легкую форму холеры. Инкубационный период составляет 1-2 дня, интоксикация слабо выражена, температура обычно не повышается, отмечается многократная рвота, обильная энтеритная диарея, постепенно нарастает дегидратация, отмечается олигурия. Имеют место боли в эпигастральной области, носящие схваткообразный характер.
Энтерогеморрагический эшерихиоз
ЭГКП развивается чаще всего у детей. Интоксикация при этом умеренная, температура тела субфебрильная. Имеет место тошнота и рвота, жидкий водянистый стул. При тяжелом течении к 3-4 дню, заболевания появляются сильные боли в животе схваткообразного характера, диарея усиливается, в испражнениях, утрачивающих каловый характер, могут отмечать примесь крови и гноя.
Чаще всего заболевание через неделю проходит самостоятельно, но при тяжелом течении (в особенности у детей младшего возраста) на 7-10 день, после исчезновения диареи, есть вероятность развития гемолитико-уремического синдрома (сочетание гемолитической анемии, тромбоцитопении и острой почечной недостаточности). Нередки нарушения мозговой регуляции: судороги конечностей, ригидность мускулатуры, нарушения сознания вплоть до сопора и комы. Летальность больных с развитием этой симптоматики достигает 5%.
Осложнения
Обычно эшерихиозы не склонны к осложнениям. В случае инфекции, спровоцированной возбудителем группы ЭГКП, есть вероятность возникновения осложнений со стороны мочевыделительной системы, гемолитическая анемия, церебральные расстройства.
Диагностика
Для диагностики эшерихиоза производится выделение возбудителя из кала и рвотных масс, в случаях генерализации – из крови, мочи, желчи или ликвора. После чего производится бактериологическое исследование, посев на питательных средах. В связи с антигенным сходством возбудителей эшерихиоза с бактериями, входящими в состав нормоциноза кишечника, серологическая диагностика малоинформативна.
Для лабораторной диагностики инфекций, вызванных ЭГКП, может применяться выявление бактериальных токсинов в испражнениях пациентов. При этом виде эшерихиозов в анализе крови могут быть отмечены признаки гемолитической анемии, повышение концентрации мочевины и креатинина. Анализ мочи обычно показывает протеинурию, лейкоцитурию и гематурию.
Лечение эшерихиоза
Лечение преимущественно амбулаторное, госпитализации подлежат больные с тяжелыми формами и высоким риском развития осложнений. Больным рекомендована диета. На период острых клинический проявлений (диареи) – стол №4, после прекращения – стол №13. Умеренная дегидратация корректируется приемом жидкости и регидратационных смесей перорально, при нарастании и выраженной степени обезвоживания производят внутривенное вливание растворов. Патогенетическое лечение выбирают в зависимости от вида возбудителя.
В качестве противомикробной терапии обычно назначаются препараты нитрофуранового ряда (фуразолидон), либо (при тяжелом течении инфекции, вызванной ЭИКП) фторхинолоны (ципрофлоксацин). Препараты назначают на 5-7 дней. Лечение эшерихиозов ЭПКП у детей целесообразно осуществлять с помощью комбинации сульфаметоксазола и триметоприма, антибиотикотерапии. Генерализованные формы лечат цефалоспоринами второго и третьего поколений.
В комплексную терапию при продолжительном течении заболевания для нормализации пищеварения и восстановления биоценоза кишечника включают ферментные препараты и эубиотики. Современные принципы лечения эшерихиозов, спровоцированных бактериями группы ЭГКП, включают применение антитоксических терапевтических мер (сыворотки, экстракорпоральная адсорбция антител).
Прогноз
Прогноз для взрослых и детей старшего возраста – благоприятный, при легком течении отмечаются случаи самостоятельного выздоровления. Дети раннего возраста могут страдать эшерихиозом в тяжелой форме, что ухудшает прогноз. Также заметно труднее идет выздоровление в случае генерализации и развития осложнений. Некоторые особо тяжелые формы эшерихиозов могут без должной медицинской помощи закончиться смертью.
Профилактика
Эшерихиозы – заболевания, связанные с низкой гигиенической культурой. Личная профилактика этих инфекций заключается в следовании гигиеническим нормам, в особенности при общении с детьми, мытье рук, пищевых продуктов, игрушек и предметов быта. Общая профилактика направлена на контроль соблюдения санитарно-гигиенического режима в детских учреждениях, предприятиях пищевой промышленности, лечебно-профилактических учреждениях, а также контроль над стоком канализационных отходов и состоянием источников воды.
Больные после перенесения эшерихиоза выписываются из стационара после клинического выздоровления, а также по результатам трехкратной бактериологической пробы. Допуск в коллектив детей, контактировавших с больным, также осуществляется после проведения бактериологической диагностики и подтверждения отсутствия выделения возбудителя. Лица, выделяющие патогенные эшерихии, подлежат изоляции на весь период контагиозности. Работники пищевой промышленности подвергаются регулярным обследованиям на предмет выделения возбудителя, в случае положительного теста – отстраняются от работы.
- Не страдавший какой-либо патологией мужчина 32 лет заболевает острым респираторным заболеванием, на этом фоне получает физическую травму. Через несколько часов у него появляется потрясающий озноб, гипертермия, затем резкое падение артериального давления, и больной госпитализируется в стационар в состоянии некупируемого шока. На аутопсии макроскопически какой-либо патологии не выявлено. При гистологическом исследовании в сосудах микроциркуляторного русла печени, селезенки, почек, легких обнаружены скопления стафилококка.
- Девушка 15 лет, после кратковременной гипертермии поступила в стационар в состоянии некупируемого шока. На аутопсии обнаружена перфорация матки после внебольничного аборта, с незначительной местной воспалительной реакцией. При гистологическом исследовании, также как и в первом примере, обнаружены скопления стафилококка в сосудах микроциркуляторного русла.
Таким образом, сепсис протекает по-разному у лиц с отягощенным и неотягощенным преморбидным фоном, поэтому патогенез и танатогенез у этих двух групп больных принципиально различается и предложенная консенсусом концепция развития сепсиса (ССВР → сепсис → тяжелый сепсис → септический шок → рефрактерный септический шок → полиорганная недостаточность) не состоятельна, поэтому мы предлагаем свою концепцию генеза сепсиса (рис.) в зависимости от преморбидного фона.
В настоящее время в лабораторном подтверждении диагноза наибольшее значение предается уровню прокальцитонина. Действительно, прокальцитониновый тест у больных сепсисом, подтвержденным выделением гемокультуры и/или ПЦР, был положительным у 86,7% больных (10 и более нг/л). У больных с тяжелым течением инфекции, при отрицательных результатах бактериологического исследования и ПЦР прокальцитониновый тест был положительным у 43,7% больных. Полученные данные позволяют рассматривать этот тест как критерий тяжести инфекционного процесса. При эффективной антибактериальной терапии уровень прокальцитонина в течение 2–3 суток резко снижается, что позволяет его использовать как надежный критерий эффективности антибактериальной терапии. Для лабораторного подтверждения диагноза сепсиса мы по-прежнему, прежде всего, придаем значение выделению гемокультуры возбудителя, что позволяет определить чувствительность возбудителя к антимикробным препаратам, а также проводить мониторирование динамики чувствительности возбудителя. Недостатками метода являются: отрицательный результат при начатой антибактериальной терапии, возможность экзогенного загрязнения, возможность транзиторной бактериемии. Для повышения эффективности бактериологического метода следует исследовать содержимое гнойных очагов (содержание пустул, пунктата гнойных очагов, спинномозговой жидкости, мочи, мокроты и т. д.). Важнейшую роль в подтверждении диагноза сепсиса имеет ПЦР, которая обладает 100% специфичностью, позволяет определить интенсивность бактериемии (микробную нагрузку), получить положительный результат в первые 1–2 суток лечения антибиотиками. Отрицательный результат ПЦР при выделении гемокультуры свидетельствует об экзогенном загрязнении. При обследовании 40 ВИЧ-инфицированных больных со стафилококковым сепсисом мы во всех случаях получили положительный результат ПЦР, причем микробная нагрузка варьировала от 8 × 10 2 до 1,38 × 10 5 .
Лечение сепсиса должно быть комплексным и включать антибактериальную, детоксикационную терапию, иммунотерапию, интенсивную терапию и реанимацию, нутритивную поддержку, по показаниям — хирургическое вмешательство, профилактику и лечение дисбиоза.
Подробные рекомендации по антибактериальной терапии даны в практических руководствах по сепсису [20, 21]. Следует остановиться только на отдельных аспектах проблемы. Во-первых, антибактериальная терапия должна проводиться поэтапно. Целью первого этапа является купирование бактериемии, что достигается постоянным поддерживанием высоких концентраций препарата в крови (минимальные промежутки между введением разовых доз препарата или непрерывное капельное введение). После купирования бактериемии стоит задача эрадикации возбудителя из септических очагов, где его биодоступность значительно ниже (воспалительный инфильтрат, биопленка на поверхности колонии возбудителя), поэтому интервалы между введением препарата и разовые дозы следует максимально увеличить [6]. При этом в крови достигаются пиковые концентрации препарата и происходит его пассаж в септический очаг. В качестве этиотропного средства не следует забывать о бактериофагах (стафилококковый, пиофаг и другие). Особенно эффективно применение индивидуальных фагов, полученных против культуры возбудителя, выделенной у больного. Важно то, что бактериофаги не обладают побочным действием и не имеют противопоказаний для применения. Иммунотерапия включает специфические (антистафилококковый иммуноглобулин) и неспецифические иммуноглобулины. При этом следует иметь в виду, что большинство препаратов иммуноглобулинов содержат IgG, которые обладают преимущественно протективным действием. Кроме того, они при избыточном введении блокируют рецепторы иммунокомпетентных клеток и подавляют продукцию собственных антител, обладающих большей овидностью к возбудителю. Эффективен только пентаглобин и его аналоги, в меньшей степени нормальный человеческий иммуноглобулин, которые содержит IgM. Важное значение имеет детоксикация, особенно экстракорпоральная. Наиболее эффективна ультрафильтрация плазмы. Хирургическая санация доступных септических очагов является важным звеном в комплексном лечении сепсиса, хотя не гарантирует полного эффекта. Методы интенсивной терапии, искусственная вентиляция легких снижают летальность при наиболее тяжелой молниеносной форме сепсиса. Интенсивность катаболических процессов, невозможность или малая эффективность, из-за ферментативной недостаточности энтерального питания, требуют полноценного парентерального питания с использованием расчетных доз белковых, аминокислотных, липидных, углеводных растворов, витаминов. Массивная антибактериальная терапия вместе с нарушениями питания приводит к развитию тяжелого дисбиоза кишечника и требует применения с первых дней лечения пробиотиков, не подверженных действию антибактериальных препаратов.
Рациональная комплексная терапия сепсиса приводит к резкому снижению летальности, хотя она остается достаточно высокой (10–20% и выше) [24–26].
Приведенные сведения свидетельствуют о необходимости дальнейшего изучения всех аспектов проблемы сепсиса, особенно патогенеза, диагностики и лечения.
Литература
Ю. Я. Венгеров*, доктор медицинских наук, профессор
М. В. Нагибина* , 1 , кандидат медицинских наук
А. П. Угринова*
А. П. Сафонова**
С. В. Матосова**
Т. С. Свистунова***, кандидат медицинских наук
О. Ю. Шипулина**
Т. М. Коваленко***
Т. Н. Молотилова***
Д. В. Чернышов***
* ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
** ФБУН ЦНИИЭ Роспотребнадзора, Москва
*** ГБУЗ ИКБ № 2 ДЗМ, Москва
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С.,
врач – клинический фармаколог
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Микробиологические аспекты
E.coli относится к типичным представителям семейства Enterobacteriaceae, являясь грамотрицательной бактерией, факультативным анаэробом в составе нормальной кишечной микрофлоры человека. Но тут же становится патогеном, выбравшись из среды нормального обитания, хотя отдельные штаммы являются патогенными и для желудочно-кишечного тракта. То есть кишечная палочка относится к кишечным комменсалам, кишечным патогенам и внекишечным патогенам, каждый из которых мы кратко разберем.
К штаммам E.coli, действующим как кишечные патогены и встречающимся чаще других, относятся:
- Штамм серотипа O157:H7 (STEC O157) или так называемый энтерогеморрагический штамм E.coli, который является причиной 90% случаев геморрагических колитов и 10% случаев гемолитико-уремического синдрома. Встречается достаточно часто, а если вы работаете в стационарах плановой помощи, то это один из обязательных анализов для принятия решения о госпитализации, так что так или иначе он на слуху. Проблема инфицирования этим возбудителем связана с употреблением плохо термически обработанной пищи и передачи штамма контактным путем от человека к человеку, проще говоря, через руки.
- Второй крайне опасный высоко-патогенный штамм кишечной палочки – O104:H4, вызвавший в Германии 2011 году эпидемию с высоким уровнем смертности среди пациентов с пищевыми токсико-инфекциями вследствие развития гемолитико-уремического синдрома. Если помните, это была очень громкая история с перекрытиями границ для испанских огурцов, потом вообще для всей плодоовощной продукции из Европы в Россию, пока искали хотя бы источник, не говоря уж о виновнике тех событий. Окончательно виновными тогда были обозначены листья салата, в поливе которых использовалась вода с признаками фекального заражения, а затем речь пошла уже о пророщенных семенах, которые так же полили фекально-зараженной водичкой. Так вышли на конкретный штамм E.coli – O104:H4, который, подвергшись санации антибиотиком, выплескивает эндотоксин, вызывающий гемолиз и острую почечную недостаточность. В итоге – массовая летальность пациентов, получавших антибиотики.
Затем тот же штамм обнаружился при вспышке ПТИ в Финляндии, но к тому времени пациентов с диареями до появления микробиологических результатов перестали лечить бактерицидными антибиотиками и ситуация была купирована в зародыше.
И третий громкий (для нашей страны) случай – это массовое заболевание питерских школьников в Грузии, где так же был выявлен этот штамм (пресс-релиз Роспотребнадзора по данному случаю лежит здесь).
Когда кишечная палочка выступает внекишечным патогенном? Почти всегда, когда обнаруживается вне места своего нормального обитания.
- Заболевания мочевыводящий путей. Здесь E.coli является абсолютным лидером и играет ведущую роль в развитии:
- Острых циститов
- Пиелонефритов
- Абсцессов почек и
- Простатитов
Этот факт объясняется близким анатомическим расположением двух систем и огрехами в личной гигиене, что позволяет на этапе эмпирической терапии вышеперечисленных заболеваний сразу же назначать препараты, активные в отношении кишечной палочки.
- Заболевания желудочно-кишечного тракта:
- Диарея путешественников
- Интраабдоминальные абсцессы и перитониты, чаще всего носящие вторичный характер (прободение кишки в результате первичного заболевания, либо при дефектах оперативного вмешательства)
- Инфекции центральной нервной системы у очень ослабленных пациентов, результатом чего будет развитие менингитов. Встречается в основном у лиц старческого возраста и новорожденных. Кроме того, в случае внутрибольничного заражения менингит может развиться в результате плохой обработки рук медицинского персонала перед оперативным вмешательством или перевязками.
- Инфекции кровотока, а именно сепсис, как продолжение развития заболеваний мочевыводящих путей, ЖКТ и билиарного тракта вследствие метастазирования очага инфекции. Лечению поддается крайне тяжело, особенно если задействованы внутрибольничные штаммы, летальность чрезвычайно высокая.
- Инфекции кожи и мягких тканейкак следствие раневых инфекций после вмешательств на органах брюшной полости.
- Внутрибольничные пневмонии, вызванные устойчивыми штаммами кишечной палочки, целиком связаны с дефектами ухода за пациентом и фактором чистоты, точнее ее отсутствия, рук медицинского персонала или ухаживающих родственников. Факт внутрибольничного заражения доказывается элементарно, что будет наглядно продемонстрировано в следующем разделе.
- Послеродовые (и не только) эндометриты. Вынуждены упомянуть и эту патологию, так как инфицирование кишечной палочкой встречается все чаще и чаще, а большой настороженности нет. Как результат, можно очень сильно промахнуться с антибактериальной терапией и, как следствие, прийти к экстирпации органа в виду неэффективности антибиотикотерапии. Натолкнуть на мысль может более позднее, чем обычно, поступление и более агрессивное, чем обычно течение. Дополнительный осмотр прианальной области так же может натолкнуть на вероятность развития именно такого инфицирования.
(часть вторая) Практические вопросы диагностики и лечения.
Когда мы можем заподозрить, что перед нами пациент с инфекцией, вызванной кишечной палочкой?
- Пациенты с диареей, приехавшие из отпуска и все-таки смогшие прийти на прием (диарея путешественников или энтеротоксигенные штаммы E.coli).
- Пациенты со всеми заболеваниями мочевыделительной системы, в том числе беременные, но строго с наличием симптоматики (не надо лечить бессимптомную бактериурию, иначе вырастите резистентные штаммы и создадите проблему и себе, и женщине, и роддому в последующем).
- В стационарах – нозокомиальные пневмонии, послеоперационные менингиты, перитониты, сепсисы и т. д., носящие вторичный характер.
Подтвердить или полностью исключить кишечную палочку из возбудителей может только микробиологическое исследование. Конечно, в современных условиях микробиология уже становится практически эксклюзивом, но мы пришли учиться, а учится надо на правильных примерах, поэтому далее будет рассмотрен ряд антибиотикограмм, выполненных автоматизированными системами тестирования. Вдруг вам повезет, и в вашем лечебном учреждении все уже есть или в ближайшее время будет, а вы уже умеете с этим всем работать?
Если вы читаете данный цикл по порядку, то в базовом разделе по микробиологии был выложен ряд антибиотикограмм некоего микроорганизма в контексте нарастания антибиотикорезистентности, и это была наша сегодняшняя героиня – кишечная палочка.
- Начнем с дикого и крайне симпатичного штамма E.coli, который живет в кишечнике и обеспечивает синтез витамина К. С ним сталкиваются доктора амбулаторной службы у пациентов с инфекциями мочевыводящих путей или в случае госпитализации у пациентов, которые не получали антибиотики около года. И именно такую чувствительность мы имеем в виду, когда назначаем эмпирическую антибиотикотерапию
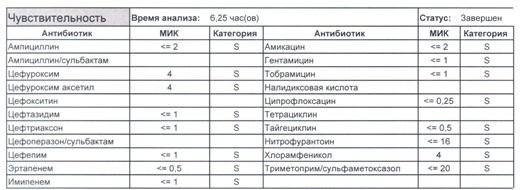
- Как видите, зверь чувствителен абсолютно ко всему, и это как раз тот случай, когда можно свободно пользоваться табличными материалами справочников или клинических рекомендаций, так как механизмы резистентности полностью отсутствуют.
- Если в ваши руки попал пациент, которого в течение последнего полугодия лечили антибиотиками пенициллинового ряда, то антибиотикограмма может выглядеть следующим образом.
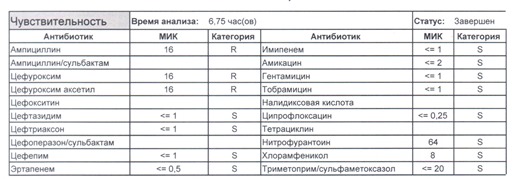
Если такая кишечная палочка окажется внекишечным патогенном, и перед вами будет беременная и ИМП (самый частый случай), то нам необходимо преодолеть резистентность к пенициллинам, то есть подавить деятельность пенициллиназ. Соответственно высокую эффективность продемонстрируют препараты с ингибиторами бета-лактамаз, чаще всего амоксициллина/клавуланат, как наиболее безопасный и эффективный. Единственное, пациентку необходимо предупредить, что в результате стимуляции рецепторов кишечника может развиться антибиотик-ассоциированная диарея.
- Отдельно хотелось бы обратить внимание на следующий штамм E.coli, как типичного обладателя бета-лактамаз расширенного спектра. И эти БЛРС чаще всего вырабатываются в результате неуемного использования цефалоспоринов третьего поколения и совершенно конкретного его представителя – цефтриаксона.
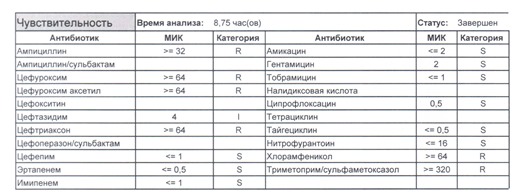
В каких ситуациях мы можем увидеть (или подумать) о таком звере:
- Пациент сам рассказывает, что получал цефтриаксон в промежутке полугодия
- Пациент был переведен из другого стационара (хотя там можно будет и следующую картинку обнаружить)
- Пациент ничего не получал, и вообще в больнице не лежал, но возбудитель попал с рук медицинского персонала, вызвав внутрибольничную инфекцию
- И самый простой случай – посев был взят в момент проведения терапии цефтриаксоном
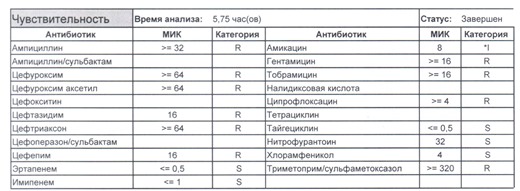
Подобный пациент не придет к вам своими ногами, его не увидит амбулаторная служба, это абсолютно стационарные больные, и если их привезут, то только из другого лечебного учреждения. Чаще всего это пациенты палат интенсивной терапии или реанимации, и такой возбудитель носит на 100% нозокомиальный характер.
Когда можем его обнаружить:
- вторичные перитониты,
- нозокомиальные пневмонии,
- пиелонефриты,
- послеоперационные менингиты,
- сепсис и т. п.
- Для эрадикации такого возбудителя нужен не просто отдельный обученный специалист и имеющая весь набор препаратов резерва аптека, но и напряженная работа эпидемиологической службы, так как подобный пациент должен быть изолирован в отдельную палату, а лучше изолятор (не подумайте, что бред – при правильной организации такие вещи вполне реальны) с проведением карантинных мероприятий, так как основная проблема появления подобного рода возбудителей в том, что они очень быстро разбегаются по всему корпусу (или стационару, если корпуса не изолированы) и обсеменяют все и вся, нанося вред другим ослабленным тяжелой болезнью пациентам и заселяя кишечники всего медицинского персонала.
- И еще одно крайне мерзкое свойство таких возбудителей – они умеют осуществлять горизонтальный перенос механизмов резистентности с другой флорой семейства Enterobacteriaceae, и даже если вы избавились от E.coli, неприятным сюрпризом может стать ее подруга клебсиелла, наносящая еще больший вред и по сути добивающая больного. Избавится полностью от этих возбудителей невозможно, для этого надо избавится от медицинского персонала как основных носителей, но контролировать можно – мероприятия подробно расписаны в действующих СанПиН 2.1.3.2630-10. Так что в случае выявления подобного возбудителя речь пойдет не только о лечении того пациента, у которого он обнаружен, но и проведения мероприятий по недопущению инфицирования всех остальных пациентов (а это, напомню, почти всегда ПИТ или ОРИТ), находящихся рядом.
- И в заключение необходимо упомянуть о панрезистентной E.coli, вооруженной полным спектром механизмов резистентности. В антибиотикограмме будут тотальные R, а МПК возбудителей пробьют все возможные потолки. К счастью для автора, она с таким зверем пока не сталкивалась, что связано с наличием работающей системы эпиднадзора, поэтому картинки не будет, хотя ее несложно представить. Такие пациенты, если кишечная палочка окажется патогеном, а не колонизатором (мало ли с чьих рук, например, в рану упала), к сожалению, почти не выживают, так как изначально являются крайне тяжелыми соматически, а кишечная палочка обычно подводит черту к их существования на бренной земле.
- Не допускать развития такой, не побоюсь этого слова, зверюги в ваших стационарах, а если появилась – гонять эпидемиологическую службу, чтобы избавляла руки и поверхности от такого рода заражения, что возможно только при условии наличия достаточного количества расходных материалов, перчаток и дезинфицирующих средств.
А теперь подведем небольшой итог нашего непростого разговора:
- Кишечная палочка – возбудитель очень серьезный и не следует его недооценивать. В ее типах также необходимо четко ориентироваться.
- В первую очередь о ней мы думаем при лечении инфекций мочевыводящих путей, особенно у беременных.
- Если перед нами пациент с признаками кишечной инфекции, то подход к терапии антибиотиками должен быть сугубо индивидуальным, и если состояние позволяет, то до получения микробиологии – вообще без антибиотиков. Если не позволяет – это должны быть бактериостатики.
- Мы никогда не лечим только анализ, и даже микробиологическое заключение, мы всегда лечим пациента со всем комплексом его симптомов и синдромов. Но микробиология помогает решить как дифференциально-диагностические задачи, что и позволяет отделить безусловный патоген от мирно живущего комменсала.
- Микробиологическая диагностика носит ключевое значение как для подтверждения самого возбудителя, так и для выбора необходимого антибиотика
- В случае выявления резистентных и панрезистентных возбудителей, помимо лечения самого пациента должна в полной мере задействоваться эпидемиологическая служба лечебного учреждения
Читайте также:

