Если занесли инфекцию в вену
Обновлено: 07.05.2024
Сепсис — это самая тяжелая, генерализованная форма инфекционного процесса, которая развивается либо при высокой патогенности возбудителя, либо при недостаточном ответе защитных систем организма. Международным консенсусом рекомендовано использовать следующее определение: сепсис — это опасная для жизни дисфункция внутренних органов, вызванная нарушением регуляции ответа организма на инфекцию. При сепсисе наблюдается общий интоксикационный синдром, тромбогеморрагический синдром (кровоизлияния) и поражение внутренних органов.
Причины возникновения сепсиса
Сепсис может быть вызван большинством известных в эпидемиологии микроорганизмов, среди которых бактерии, вирусы (в том числе сезонные вирусы гриппа), грибы, паразиты. Обычно возбудитель инфекции попадает в организм из внешней среды. При определенных условиях, например, при иммунодефицитах, заболевание может развиться от естественной, условно-патогенной флоры организма, которая в норме присутствует у каждого человека. [1]
Само по себе наличие инфекции еще не является гарантией развития сепсиса. Необходимы дополнительные условия, которые приведут к генерализации процесса и патологическому ответу организма. Вероятность таких событий увеличивается в следующих случаях:
- Возраст больного старше 75 лет.
- Выполнение операций или инвазивных процедур.
- Наличие травм и ожогов.
- Нарушения иммунной системы — СПИД, онкологические заболевания, проведение химиотерапии, необходимость применения иммуносупрессивной терапии (например, после трансплантации органов), необходимость приема высоких доз глюкокортикостероидов.
- Долгое лечение в условиях стационара.
- Наличие катетеров, канюль, зондов и других инвазивных устройств.
- Беременность и роды.
- Наличие химической зависимости — алкоголизм, наркомания.
- Наличие хронических заболеваний — хроническая почечная недостаточность, дыхательная недостаточность, сахарный диабет и многое другое.
Виды сепсиса
В зависимости от расположения первичного очага инфекции, выделяют первичный (криптогенный) и вторичный сепсис. При первичном, очаг инфекции установить не удается. При вторичном сепсисе таковой очаг имеется. В зависимости от его локализации, выделяют:
- Чрескожный сепсис. Первичный очаг находится на коже, это могут быть раны, ожоги, гнойные заболевания кожи (гнойные абсцессы, фурункулы и др).
- Одонтогенный сепсис. Причиной его развития может стать кариес, пульпит, периодонтит, челюстной остеомиелит и другие заболевания зубочелюстной системы.
- Отогенный сепсис. Первичным очагом является воспалительный процесс в ухе. Как правило, это гнойные отиты среднего уха.
- Гинекологический сепсис — первичный очаг располагается в половых органах женщины.
- Хирургический сепсис — развивается в результате инфицирования хирургической раны или при инфицировании во время проведения инвазивных процедур. 2
Первые признаки и симптомы сепсиса
Определить первые признаки сепсиса бывает непросто, даже для специалистов. Это связано с тем, что, во-первых, этот синдром развивается уже на фоне существующей патологии, которая может иметь самую разнообразную симптоматику, а во-вторых, при наличии иммунодефицита, клиническая картина может быть стертой. Тем не менее, есть некоторые симптомы, которые позволяют заподозрить начало сепсиса:
- Повышение или понижение температуры тела — выше 38 и ниже 36 градусов.
- Снижение давления ниже рабочего значения.
- Увеличение частоты пульса.
- Увеличение частоты дыхательных движений (одышка).
- Снижение количества выделенной мочи.
- Общая слабость, изможденность.
- Нарушение сознания или поведения.
Особое внимание возникновению этих признаков уделяют у хронических больных, при наличии лейкопении, онкологических заболеваний и у пациентов, перенесших травмы или хирургические вмешательства. При возникновении хотя бы 2-3 таких симптомов, следует немедленно связаться с врачом.
Диагностика сепсиса
Своевременная диагностика сепсиса имеет решающее значение для выздоровления больного. Чем раньше начато лечение, тем больше шансов на успех. Диагноз выставляется на основании данных клинического осмотра и лабораторно-инструментального обследования.

Клинические критерии:
- Температура тела более 38 градусов или менее 36 градусов.
- Частота сердечных сокращений более 90 или превышает возрастную норму.
- Частота дыхания более 20 раз в минуту.
- Наличие отеков.
- Спутанность сознания.
- Повышение уровня глюкозы в крови более 7,7 мкмоль/л при отсутствии диабета.
- Нарушение гемодинамических процессов — снижение систолического артериального давления менее 90 мм.рт.ст, либо его снижение более чем на 40 мм.рт.ст. от привычного значения. [5,6]
Лабораторные критерии
Проводят общий анализ крови с подсчетом лейкоцитарной формулы и определением количества тромбоцитов. При сепсисе определяется лейкоцитоз более 12*109/л или лейкопения, когда количество лейкоцитов ниже 4*109/л. Также отмечается выход в кровяное русло незрелых форм гранулоцитов и уменьшение количества тромбоцитов.
В биохимическом анализе крови отмечается увеличение С-реактивного белка, креатинина, билирубина. Но это неспецифичные признаки, которые могут наблюдаться и при других заболеваниях. Поэтому продолжается поиск более информативных методов диагностики.
На сегодняшний день главными таким маркерами являются прокальцитонин, пресепсин, СРБ. По данным этого лабораторного показателя устанавливают диагноз и отслеживают динамику заболевания.
Бактериологический посев
Обнаружение в крови микроорганизмов является важным, но не обязательным проявлением сепсиса. Даже при использовании самых современных диагностических систем и при тщательном соблюдении техники забора материала, выделить возбудитель из крови удается менее, чем в половине случаев. Поэтому отрицательный результат бакпосева при наличии клинической симптоматики не должен расцениваться как отсутствие сепсиса, и, наоборот, выделение микроорганизмов из крови при отсутствии симптоматики, должно расцениваться как транзиторная бактериемия или вирусемия, но не как сепсис.
Тем не менее, биологические исследования в любом случае должны присутствовать, как один из этапов диагностики сепсиса по следующим причинам:
- Возможность определения этиологии возбудителя.
- Подбор или смена режимов антибиотикотерапии.
- Контроль эффективности лечения.
- В некоторых случаях позволяет определить источник инфекции, например, катетер-связанная инфекция, эндокардиты и др.
Стадии развития сепсиса
Развитие и течение септического процесса индивидуально и зависит как от свойств возбудителя, так и от особенностей организма больного. Тем не менее, можно выделить несколько фаз течения данного заболевания:
Что касается продолжительности заболевания, то здесь все опять же индивидуально. У одних, более сильных пациентов, сепсис купируется в течение 3-4 недель, у других он может протекать годами, периодически стихая и вспыхивая.
Кроме того, при диагностике сепсиса выделяют следующие состояния.
Токсико-резорбтивная лихорадка
Токсико-резорбтивная лихорадка — состояние, которое развивается при всасывании бактериальных токсинов или продуктов тканевого распада из первичного патологического очага. Как правило, это характерно для бактериальных инфекций ран, катетеров и др. Характерны общие типовые синдромы, которые сопровождают инфекционные процессы — лихорадка, изменения в общем анализе крови и мочи (лейкоцитоз, протеинурия). При ликвидации первичного очага, состояние пациента стабилизируется.
Септицемия
Септицемия — форма сепсиса, при которой наблюдается выраженный интоксикационный синдром, гиперэргия (повышенная реакционность организма) и быстрое течение. Септические очаги либо выражены минимально, либо отсутствуют. Такая форма сепсиса больше характерна для детей первых лет жизни. Для клинической картины больше характерны общие проявления:
- Гемолитическая желтуха, сопровождающаяся пожелтением кожных покровов и склер.
- Сыпь. Сначала она проявляется в виде мелких розовых точек, которые разрастаются и сливаются между собой, образуя бледно-розовые или пурпурные пятна.
- У некоторых пациентов элементы сыпи могут покрываться пузырями или язвами. При глубоких поражениях может затрагиваться подкожная жировая клетчатка с развитием флегмонозного воспаления.
- Геморрагический синдром — кровоизлияния во внутренние органы.
Септикопиемия
Септикопиемия — это форма сепсиса, при которой в организме, помимо общей интоксикации, начинают возникать метастатические абсцессы в органах и тканях, которые являются результатом бактериальной эмболии. Чаще всего первые абсцессы обнаруживаются в легких, а затем процесс распространяется на другие органы: печень, печень, сердце, менингиальные оболочки, синовиальные оболочки. Абсцессы могут прорваться и вызвать развитие эмпиемы плевры, флегмоны, перитонита и др.
Клиническая классификация сепсиса по стадиям
Клиническое стадирование сепсиса играет важную роль, так как оно помогает врачам выбирать оптимальную тактику и добиваться наилучших из возможных в каждом конкретном случае результатов лечения. Выделяют следующие стадии:
- Сепсис диагностируют, когда внутренняя температура (измеряется на слизистых оболочках) тела поднимается больше 38 градусов или опускается ниже 36 градусов, частота сердечных сокращений 90 в минуту и более, частота дыхания 20 в минуту и более, либо парциальное давление углекислого газа в артериальной крови (PaCO2) опускается ниже 32 мм. рт. ст. При этом уровень лейкоцитов в крови поднимается более 12000/мкл или опускается ниже ≤4000/мкл, либо среди них появляется более 10% незрелых форм.
- Тяжелый сепсис – сепсис, который сочетается с острой органной дисфункцией.
- Септический шок диагностируют, когда у пациента имеется стойкая гипотензия (снижение артериального давления) или гипоперфузия (недостаточное кровоснабжение) тканей, несмотря на адекватную инфузионную терапию.
- Синдром полиорганной дисфункции – состояние, при котором у больного имеется органная дисфункция (нарушение работы внутренних органов), и его гомеостаз не удается поддерживать без медикаментозного вмешательства.
Лечение сепсиса
Лечение сепсиса базируется на трех принципах:
Санация первичного очага. Это может быть достигнуто с помощью хирургического вмешательства и/или адекватной антибактериальной терапии. При обнаружении первичного очага, который можно санировать хирургически, необходимо провести это как можно скорее. Это может быть вскрытие и дренирование абсцессов, удаление инфицированных инвазивных устройств (катетеры, имплантаты и др.), дренирование и лаваж брюшной полости, и др.
Антимикробная терапия является еще одним краеугольным камнем лечения сепсиса, при этом важна ее своевременность и адекватность. Например, при развитии септического шока, препараты должны быть введены в течение часа от начала симптомов. При этом препарат должен охватывать весь спектр предполагаемых возбудителей и, что немаловажно, проникать в первичный инфекционный очаг. При необходимости назначения комбинированной терапии из нескольких препаратов, их применяют не более 5 дней, после чего должны быть получены данные биологических методов исследования и произведена коррекция схемы лечения. [7]
Обеспечение транспорта кислорода — все клинические проявления сепсиса усугубляются в условиях недостатка кислорода, поэтому очень важно контролировать этот процесс. Для этого проводят:
- Гемодинамическую поддержку — вливание растворов, которые обеспечивают восполнение водно-электролитного баланса, назначаются препараты, поддерживающие артериальное давление и др.
- Респираторную поддержку — искусственную вентиляцию легких, кислородные маски и др.
Коррекция метаболических нарушений
Одним из эффективных способов лечения сепсиса является селективная сорбция на колонках TORAYMYXIN. Данная методика успешно применяется во многих странах мира. В настоящее время такое лечение прошли более 200 тысяч пациентов с септическим шоком и тяжелыми формами сепсиса. Эффективность и безопасность технологии подтверждена в ходе клинических исследований. [11,12]

Осложнения при сепсисе
- Осложнения со стороны дыхательной системы. Нарушение вентиляции легких приводит к повышению аэрогематического барьера и, как следствие, пропотеванию жидкости в альвеолы. Это еще больше нарушает газообмен и приводит к развитию шокового легкого и респираторного дистресс-синдрома, который усугубляется усталостью дыхательных мышц.
- Осложнения со стороны почек. Наблюдается снижение фильтрационной функции почек из-за повреждения канальцев, развившееся в результате снижения давления. Сопровождается резким уменьшением выделяемой мочи, протеинурией, азотемией.
- Нарушение свертывания крови из-за падения уровня тромбоцитов и развития ДВС-синдрома — грозного состояния, при котором сначала происходит массовое образование тромбов в кровеносном русле, а затем массивные кровотечения из-за недостаточности кровесвертывающих факторов.
- Неврологические осложнения. Длительно протекающий сепсис может привести к развитию полинейропатии, которая, в частности, приводит к ослаблению дыхательной мускулатуры и невозможности самостоятельного дыхания.
- Септический шок — самое тяжелое проявление сепсиса, сопровождающееся стойким снижением кровяного давления, которое сложно восстановить даже с применением инфузионной терапии и вазопрессоров. Он развивается из-за выхода жидкости из кровеносных сосудов и из-за общего обезвоживания. При этом, нарушения настолько тяжелые, что могут привести к гибели пациента от полиорганной недостаточности.[13]
Прогноз при сепсисе
Прогноз при сепсисе очень осторожный. На возможность выздоровления оказывают влияние особенности этиологической микрофлоры, общее состояние пациента в начале заболевания, а также своевременность и адекватность проводимого лечения. Наиболее неблагоприятно сепсис протекает у людей старческого возраста и у ослабленных пациентов, имеющих сопутствующие заболевания.
В целом в крупных клиниках летальность при данном состоянии составляет 30-40%. При развитии септического шока, ситуация усугубляется и согласно некоторым данным, в таком случае от него погибает до 90% больных.
Катетер-ассоциированные инфекции кровотока (КАИК) – это нозокомиальные инфекционные осложнения, связанные с использованием внутрисосудистых катетеров. Клинически проявляются местными воспалительными изменениями (отек, болезненность, гиперемия в области катетера) или генерализованной инфекцией (фебрильная лихорадка, озноб, бактериемия). Для лабораторного подтверждения КАИК осуществляется посев крови на гемокультуру и микробиологическое исследование сосудистого катетера. При первых признаках КАИК производится удаление катетера, назначается антибактериальная, инфузионная терапия.
МКБ-10
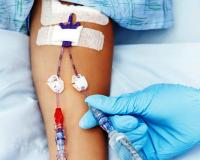
Общие сведения

Причины
Установка внутрисосудистого устройства (ВСУ) – инвазивная манипуляция, сопряженная с нарушением целостности кожных покровов и сосудистой стенки, внедрением и оставлением в просвете сосуда инородного предмета. Катетерные инфекции кровотока в большинстве случаев ассоциированы с установкой центрального венозного катетера (ЦВК), инфузионной порт-системы, периферической венозной канюли. Чаще КАИК развиваются при катетеризации бедренной вены, реже – подключичной и внутренней яремной.
Развитию ангиогенных инфекций предшествует контаминация сосудистого устройства патогенными или условно-патогенными микроорганизмами. Источниками и причинами обсеменения могут стать:
- инфекции кожи в области сосудистого протеза (пиодермии);
- несоблюдение требований асептики при манипуляциях с ЦВК (ненадлежащая обработка операционного поля, рук врача);
- неадекватный выбор доступа, размера, типа и материала катетера;
- частые пункции сосудистого русла;
- плохой уход за сосудистым протезом.
Среди этиологических агентов, вызывающих КАИК, преобладают возбудители, которые являются самой частой причиной ВБИ: стафилококки (47%, из них золотистый стафилококк ‒ 25%), энтеробактерии (27%), ацинетобактеры (13%), синегнойная палочка (9%), кандиды (5%), энтерококки (3%) и др. Большую роль в возникновении внутрисосудистых инфекций, играет срок катетеризации: по опубликованным данным, через 7 дней нахождения катетера в вене КАИК развивается у 5%пациентов, через 1 месяц и более – у 36%.
Факторы риска
Инфицированию внутривенных катетеров способствуют сопутствующие состояния: сахарный диабет, иммунодефициты и иммуносупрессия, гипоальбуминемия. В группу повышенного риска по развитию катетер-ассоциированных инфекций кровотока входят пациенты, имеющие значительную катетеризационную нагрузку (длительную и неоднократную пункцию центральных вен):
- находящиеся на гемодиализе;
- получающие массивную инфузионно-трансфузионную терапию;
- проходящие химиотерапию;
- требующие проведения эфферентных методов детоксикации;
- нуждающиеся в парентеральном питании.
Патогенез
Механизм развития КАИК реализуется тремя основными путями. Чаще всего инфекция проникает в кровоток с обсемененных кожных покровов по наружной поверхности катетера (экстралюминально). Такой путь наиболее актуален в ранние сроки после постановки катетера (первые 10-15 суток). В последующем увеличивается доля интралюминального инфицирования, когда инфекция распространяется по внутренней стороне протеза через контаминированные инфузионные среды, канюли шприцев и систем для переливания. Также возможно гематогенное инфицирование, при котором возбудители оседают на катетере, разносясь с током крови из других источников (при пневмонии, панкреатите и пр.).
Внутрисосудистое устройство является инородным телом, поэтому в ответ на его введение организм вырабатывает различные белковые вещества, отграничивающие его от собственных тканей. В их числе ‒ фибрин и фибронектин, к которым легко прикрепляется коагулаза – фермент, продуцируемый многими патогенами, в частности, золотистым стафилококком и кандидой.
В результате такой адгезии внутри сосудистого протеза образуется биопленка, защищающая микробные колонии от воздействия антибиотиков и клеток иммунной системы. Это способствует переходу инфекции в персистирующую хроническую форму. Микробные биопленки образуются на внутренней поверхности имплантируемых устройств в 40% случаев.
Наличие биопленки снижает чувствительность патогенов к антибиотикам в сотни раз, способствует увеличению в структуре ВБИ доли антибиотикорезистентных штаммов, устойчивых практически ко всем известным противомикробным препаратам. Рост колоний микроорганизмов сопровождается фрагментацией биопленки и попаданием патогенов в кровоток, что приводит развитию бактериемии и сепсиса.
Классификация
В настоящее время в медицинских кругах используется классификация катетер-ассоциированных инфекций кровотока, рекомендованная Комитетом по контролю за госпитальными инфекциями (США). Согласно ей, различают следующие формы КАИК:
- Колонизация катетера, подтвержденная микробиологическим исследованием, при отсутствии любых клинических проявлений.
- Флебит: эритема, уплотнение, болезненность катетеризированной вены при пальпации.
- Ограниченная инфекция в месте установки катетера: инфильтрат, болезненность тканей, гиперемия, наличие гнойного отделяемого, очаг не более 2 см.
- Инфекция подкожного кармана, содержащего установленную порт-систему: гиперемия и некроз кожи над имплантируемым устройством, гнойное отделяемое в подкожном кармане.
- Туннельная инфекция: признаки воспаления, распространяющегося по ходу катетера более 2-х см от места его установки.
- Инфекции кровотока: бактериемия, фунгемия, сепсис, при которых один и тот же возбудитель высевается из кровотока и из удаленного ВСУ.
- КАИК, ассоциированные с инфузионной средой: контаминированными растворами, гемокомпонентами.
Симптомы КАИК
Катетер-асоциированные инфекции кровотока могут быть локальными (37%) и генерализованными (63%). Первые из них ограничены местом установки сосудистого протеза, вторые характеризуются бактериемией и системным поражением. Местные инфекции представлены инфильтратами, абсцессами, флебитами, непосредственно связанными с установленным внутрисосудистым устройством. Генерализованные КАИК проявляются сепсисом.
На высокую вероятность КАИК указывает появление признаков воспаления вокруг сосудистого катетера: уплотнение и покраснение кожи, боли, отделение гнойного экссудата, нарушение проходимости протеза. Общие симптомы инфекционного процесса ‒ лихорадка с ознобом ‒ обычно возникают через 20 минут–1,5 часа после использования катера (забора крови, вливания растворов). В тяжелых случаях лихорадка становится фебрильной и практически постоянной, снижается АД, нарастают признаки интоксикации. Развивается катетер-ассоциированный ангиогенный сепсис.
Осложнения
Длительное нахождение катетера в сосудистом просвете повышает риск развития тромбофлебита, тромбоза глубоких вен. КАИК могут осложниться септикопиемией ‒ формированием метастатических гнойных отсевов различной локализации. Среди них – бактериальный эндокардит, абсцедирующая пневмония, септический артрит, гематогенный остеомиелит и др. Причиной гибели пациентов становится септический шок, полиорганные нарушения, фатальные тромбоэмболии.
Диагностика
Клиническим критерием КАИК считается появление у пациента симптомов инфекции кровотока спустя 48 часов и более после установки ЦВК при отсутствии других источников инфекции. Однако из-за низкой специфичности клинических данных диагноз катетер-ассоциированной инфекции требует обязательного лабораторного подтверждения. Для этого производится парный посев:
- крови из периферической вены и дистального конца внутрисосудистого катетера (либо смыва из него). КАИК считается достоверной при одновременном выделении одной и той же гемокультуры из периферической крови и сосудистого зонда (>15 КОЕ полуколичественно и >102 КОЕ количественно);
- крови из сосудистого протеза и вены. На КАИК указывает более чем 3-кратное превышение количества колоний в образце крови из катетера по сравнению с венозным образцом.
Забор крови необходимо производить двукратно, до начала антибиотикотерапии, на высоте лихорадки. Для уточнения осложнений осуществляются инструментальные исследования. При подозрении на гнойный тромбофлебит выполняется УЗДС сосудов, флебография. Исключить или подтвердить септический эндокардит помогает трансторакальная ЭхоКС. Методами диагностики гнойных процессов костно-суставной системы является рентген, УЗИ суставов.
Ангиогенные инфекции дифференцируют с бактериемией, ассоциированной с другими первичными источниками: пневмонией, гнойными ранами, интраабдоминальными абсцессами и др.
Лечение катетер-ассоциированных инфекций кровотока
Системную антибиотикотерапию начинают, не дожидаясь результатов бакпосева, при необходимости в дальнейшем ее корректируют с учетом выделенной флоры и чувствительности. Обычно используются пенициллины, цефалоспорины, гликопептиды, аминогликозиды длительностью не менее 14 дней. Для терапии грибковой инфекции назначают амфотерицин В, флуконазол. При явлениях тромбофлебита показано введение антикоагулянтов, фибринолитиков. В отношении флегмон, гнойного артрита, остеомиелита, абсцессов различной локализации применяется соответствующая хирургическая тактика.
Прогноз
Катетер-ассоциированные инфекции кровотока являются серьезным вызовом современной медицине ввиду их распространенности и антибиотикорезистентности. Они удлиняют сроки госпитализации, утяжеляют исход основного заболевания, требуют значительных финансовых затрат для лечения. Неосложненные ангиогенные инфекции обычно разрешаются в течение нескольких суток. КАИК, осложненные местным нагноительным процессом или бактериемией, имеют серьезный прогноз и высокую летальность.
Профилактика
Современные протоколы четко регламентируют правила установки и ухода за ВСУ. Наибольшее внимание при этом уделяется соблюдению норм асептики и антисептики (дезинфекция операционного поля и рук персонала, хранение крышек катетеров в растворе хлоргексидина, обработка кожи и смена повязок вокруг ВСУ). Необходимо правильно осуществлять выбор внутрисосудистого устройства и места для катетеризации, максимально ограничивать срок эксплуатации внутривенных зондов, использовать гепариновые и антибактериальные замки.
1. Профилактика катетер-ассоциированных инфекций кровотока и уход за центральным венозным катетером (ЦВК). Клинические рекомендации. – 2017.
2. Комплексная клинико-этиологическая и эпидемиологическая характеристика катетер-ассоциированных инфекций кровотока/ Квашнина Д. В., Ковалишена О.В., Белянина Н.А.// Медицинский альманах. – 2017.
3. Распространенность и критерии диагностики катетер-ассоциированных инфекций кровотока/ Везирова З.Ш.// Вестник хирургии Казахстана. – 2014.
4. Инфекции, связанные с внутрисосудистыми устройствами: терминология, диагностика, профилактика и терапия/ Багирова Н.С.// Злокачественные опухоли. – 2014.
Постинъекционный абсцесс – это ограниченный гнойно-воспалительный очаг в месте инъекционного введения лекарственного препарата. Для абсцесса характерно появление локального отека и покраснения кожи, постепенно увеличивающегося в объеме уплотнения, нарастание болей распирающего характера, флюктуация. Диагноз ставится на основании анамнеза и клинической картины (появление гнойно-воспалительного очага в месте проведения внутримышечных и внутривенных инъекций), данных УЗИ, МРТ мягких тканей. На стадии инфильтрации эффективно консервативное лечение. Сформировавшийся абсцесс вскрывают хирургическим путем и дренируют.
МКБ-10
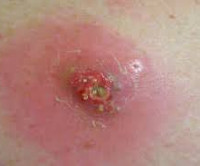
Общие сведения
Случаи постинъекционного абсцедирования мягких тканей встречаются у лиц всех возрастов, чаще у тучных, полных пациентов. Большая часть постинъекционных гнойников развивается в области ягодиц, так как для парентерального введения лекарственных средств ягодичную мышцу используют чаще всего. У детей велика доля абсцессов плеча как следствие проведения прививок. Внутривенное введение наркотиков – наиболее частая причина формирования очага нагноения в области локтевой ямки. Постинъекционные абсцессы этой локализации составляют 69% всех случаев гнойно-воспалительных процессов мягких тканей у наркозависимых.

Причины
- Высокая патогенность микроорганизмов. Разные виды бактерий имеют различную скорость деления клеток и способность противостоять иммунной системе. Золотистый стафилококк или синегнойная палочка чаще вызывают формирование постинъекционного абсцесса, чем условно-патогенные виды, составляющие микрофлору кожи.
- Ослабление иммунитета. Может быть следствием банального сезонного ОРВИ или серьезного сопутствующего заболевания. Вероятность развития абсцессов выше у больных сахарным диабетом, тяжелыми сердечно-сосудистыми, эндокринными, инфекционными заболеваниями.
- Локальное нарушение кровообращения. Этому способствует одномоментное введение значительных объемов раствора в мышцу (более 5 мл), одновременное введение нескольких препаратов в одну ягодицу. Первым признаком абсцедирования является значительное уплотнение в месте уколов. Риск постинъекционного нагноения повышается у лежачих больных, пациентов с пролежнями.
- Местнораздражающее действие лекарств. Спровоцировать гнойное расплавление тканей способны не только бактерии, но и химические вещества. Ошибочное внутримышечное введение препаратов, предназначенных для внутривенных или подкожных вливаний, может вызвать некроз и воспаление. Индивидуальную реакцию может дать препарат, который разрешен для внутримышечного применения, но не подходит конкретному пациенту.
- Нарушение техники инъекций. Факторами развития постинъекционных осложнений служат несоблюдение правил асептики и антисептики, использование неправильного растворителя, слишком быстрое введение растворов, несовместимость разных лекарственных средств. Одним из последствий неправильной техники может стать повреждение сосудов различного диаметра иглой. Сгустки крови являются субстратом для размножения микроорганизмов и формирования постинъекционного абсцесса.
Патогенез
В основе развития воспалительной реакции лежит выход из поврежденных и погибших клеток во внеклеточную среду большого количества лизосомальных ферментов, которые изменяют обмен веществ в патологическом очаге. В зоне некроза обмен веществ замедляется, а в прилегающих к нему областях резко усиливается, что приводит к повышению потребления кислорода и питательных веществ, развитию ацидоза вследствие накопления недоокисленных продуктов: молочной, пировиноградной и других кислот.
Кровоснабжение патологического очага изменяется: усиливается приток крови и замедляется отток. Этим объясняется покраснение пораженной области. Кровеносные сосуды расширяются, повышается проницаемость капилляров для плазмы крови и клеток. В ткани выходят лейкоциты, макрофаги. Локальный приток жидкости приводит к формированию отека. Сдавливание нервных окончаний провоцирует болевые ощущения. Это этап инфильтрата, когда в очаге воспаления гноя еще нет. При благоприятных условиях на этапе инфильтрации изменения обратимы.
На этапе абсцедирования отмершие ткани и погибшие клетки иммунной системы образуют гной. Постинъекционный абсцесс располагается в центре очага воспаления. Сгустки гноя отграничены от здоровых тканей грануляционным валом. Гной не рассасывается. Устранить воспаление можно лишь в том случае, если создать условия для оттока содержимого абсцесса.
Симптомы постинъекционного абсцесса
Патологический очаг формируется в течение нескольких дней. Начало заболевания может пройти незамеченным для пациента в связи с незначительной степенью выраженности симптомов. Замаскировать первые проявления развивающегося гнойного воспаления могут боли и припухлость мест инъекции, обусловленные физиологической реакцией на введение лекарств. Разграничить формирование воспалительного инфильтрата и нормальную для внутримышечных инъекций реакцию можно при внимательном отношении к своим ощущениям.
Боль после укола сразу резкая распирающая, затем ноющая. Интенсивность ее достаточно быстро уменьшается. Боль при зреющем абсцессе постоянно усиливается. В норме уплотнение после уколов достаточно равномерное, температура его не отличается от температуры окружающих областей, кожа над уплотнением обычного цвета. Присоединение воспалительной реакции знаменуется заметным локальным повышением температуры. Нарастание отека и болей в ягодице приводит к тому, что на пораженной стороне невозможно сидеть. Неприятные ощущения усиливаются при ходьбе и выполнении других движений. Надавливание на область абсцесса резко болезненно, тогда как обычное уплотнение можно ощупать, не провоцируя у пациента выраженных неприятных ощущений.
Для постинъекционного абсцесса характерна лихорадка с повышением температуры тела до 39-40 о С. Однако ориентироваться только на этот симптом не стоит. Если воспалительный очаг развивается на фоне продолжающихся инъекций нестероидных противовоспалительных средств, обладающих обезболивающим и жаропонижающим действием, то гипертермия отсутствует.
Осложнения
Бурное развитие инфекции в очаге может спровоцировать образование затеков гноя в межмышечные пространства. Распространение бактерий в тканях вызывает развитие обширных флегмон ягодицы, бедра, плеча. Существует опасность формированием длительно незаживающих свищей мягких тканей и прямокишечных фистул. Прорыв гноя в кровеносное русло становится причиной сепсиса, перикардита, остеомиелита, ДВС-синдрома - в этих случаях даже при назначении адекватного лечения исход для пациента может быть неблагоприятным.
Диагностика
Постановка диагноза не вызывает у консультирующего хирурга сложностей. Характерная пентада признаков воспаления (покраснение, отек, боли, повышение температуры, нарушение функции) в месте выполнения инъекций позволяет быстро определиться с характером патологического процесса. Положительный симптом флюктуации свидетельствует о наличии жидкости в очаге, что является показанием к проведению хирургической операции. Для подтверждения диагноза постинъекционного абсцесса в сомнительных случаях проводят:
Лечение постинъекционного абсцесса
Подходы к лечению абсцессов на этапах инфильтрации и нагноения кардинально различаются. В первом случае показана консервативная терапия, во втором - хирургическая операция. Основные принципы консервативного местного лечения инфильтратов могут быть с успехом применены для быстрого рассасывания постинъекционных уплотнений, не имеющих признаков воспаления.
- Общее лечение. Его объем определяется врачом исходя из клинической картины. Противовоспалительные препараты и антибиотики нацелены на разрешение воспалительного процесса. Дополнительно может быть назначена инфузионная терапия для борьбы с интоксикацией.
- Местная терапия. Предполагает нанесение на пораженную область мази Вишневского или использование компрессов с димексидом. На начальных этапах допускается выполнение йодной сетки. Если улучшения состояния не наступает в течение суток, целесообразно использовать более эффективные препараты.
- Физиотерапия. Все тепловые воздействия под запретом. Эффективны электрофорез противовоспалительных средств, диадинамические токи. Физиотерапевтические процедуры назначаются одновременно с местным и общим противовоспалительным лечением.
- Хирургическая операция.Вскрытие и дренирование гнойной полости проводится под местным обезболиванием. Под общим наркозом операция выполняется при расположении постинъекционного абсцесса глубоко в тканях. В послеоперационном периоде проводится общее и местное консервативное лечение, назначаются физиотерапевтические процедуры.
Прогноз и профилактика
Прогноз постинъекционного нагноения благоприятный при условии своевременного обращения за медицинской помощью. В противном случае возможно развитие осложнений заболевания. Самопроизвольное вскрытие и опорожнение глубокого абсцесса невозможно, а без эвакуации гноя из полости выздоровление не наступает. Хирургическое вскрытие гнойника позволяет решить проблему за один день.
Профилактика постинъекционных осложнений предполагает введение лекарств парентерально в условиях лечебных учреждений медицинским персоналом, отказ от самолечения. Места введения растворов при курсовом назначении целесообразно менять: если на ягодицах уже сформировались уплотнения, можно вводить лекарства в мышцы передней поверхности бедра. Нельзя вводить средства для в/в инфузий в мышцы, даже если вены тонкие и ломкие. Инъекционный курс желательно сделать максимально коротким, продолжив лечение приемом таблеток.
1. Хирургическое лечение постинъекционных абсцессов мягких тканей и фармакологические возможности в повышении эффективности и безопасности инъекций: Автореферат диссертации/ Елхов И.В. - 2007.
2. Постинъекционные кровоподтеки, инфильтраты, некрозы и абсцессы/ Ураков А.Л., Уракова Н.А.// Современные проблемы науки и образования. - 2012 - №5.
3. Локальные постинъекционные осложнения или медикаментозноеятрогенное заболевание - инъекционная болезнь/ Уракова Н.А., Ураков А.Л.// Проблемы экспертизы в медицине. - 2014.
4. Лечение постинъекционных инфильтратов, абсцессов и флегмон/ Колб Л.И.// Военная медицина. - 2009 - №1.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Сепсис: причины появления, симптомы, диагностика и способы лечения.
Определение
Сепсис – это патологический процесс, в основе которого лежит реакция организма в виде генерализованного воспаления на инфекцию различной природы. При сепсисе бактерии преодолевают иммунную защиту человека и распространяются из очага воспаления по всему организму. Местное воспаление, сепсис, тяжелый сепсис и септический шок – это различные формы выраженности воспалительной реакции организма на инфекционный процесс.
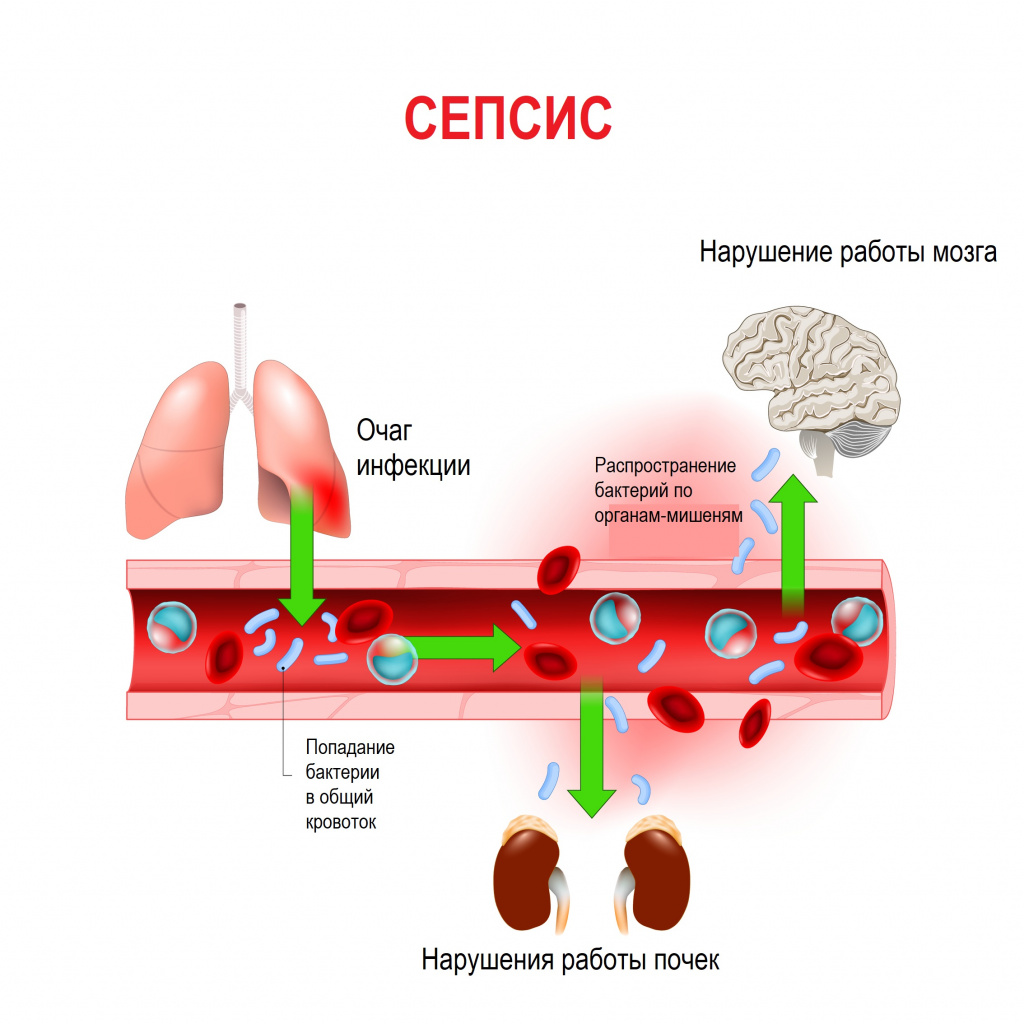
Истинная частота возникновения случаев сепсиса остается неизвестной, однако по оценкам исследователей, во всем мире сепсис является лидирующей причиной летальности у пациентов в критическом состоянии. Согласно результатам большого европейского исследования SOAP, включившего 3147 пациентов из 198 европейских медицинских центров, сепсис развился в 37,4% случаев, а госпитальная летальность от него колебалась от 14% случаев в Швейцарии до 41% в Португалии, в среднем составив 24,1%. Данные другого крупного исследования PROGRES (12 881 больной тяжелым сепсисом в 37 странах) показали, что госпитальная летальность в среднем составила 49,6%.
Причины возникновения сепсиса
Возбудителями сепсиса могут быть бактерии, вирусы или грибы. Но чаще сепсис имеет бактериальную природу - его причиной становятся стафилококки, стрептококки, пневмококки, менингококки, сальмонеллы, синегнойная палочка и др.
В большинстве случаев патологический процесс вызывают условно-патогенные микроорганизмы, которые присутствуют на коже, слизистых оболочках дыхательного и пищеварительного трактов, мочевыводящих путей и половых органов. Иногда при сепсисе выделяют сразу 2-3 микроорганизма.
Причиной сепсиса могут стать гнойно-воспалительные заболевания кожи (абсцессы, фурункулы, флегмоны), обширные травмы, ожоги, инфекционно-воспалительные заболевания мочевыводящей системы (пиелонефрит), живота (например, гнойно-некротический деструктивный панкреатит), тяжелая ангина, гнойный отит, пневмония, инфицирование во время родов или абортов и др.
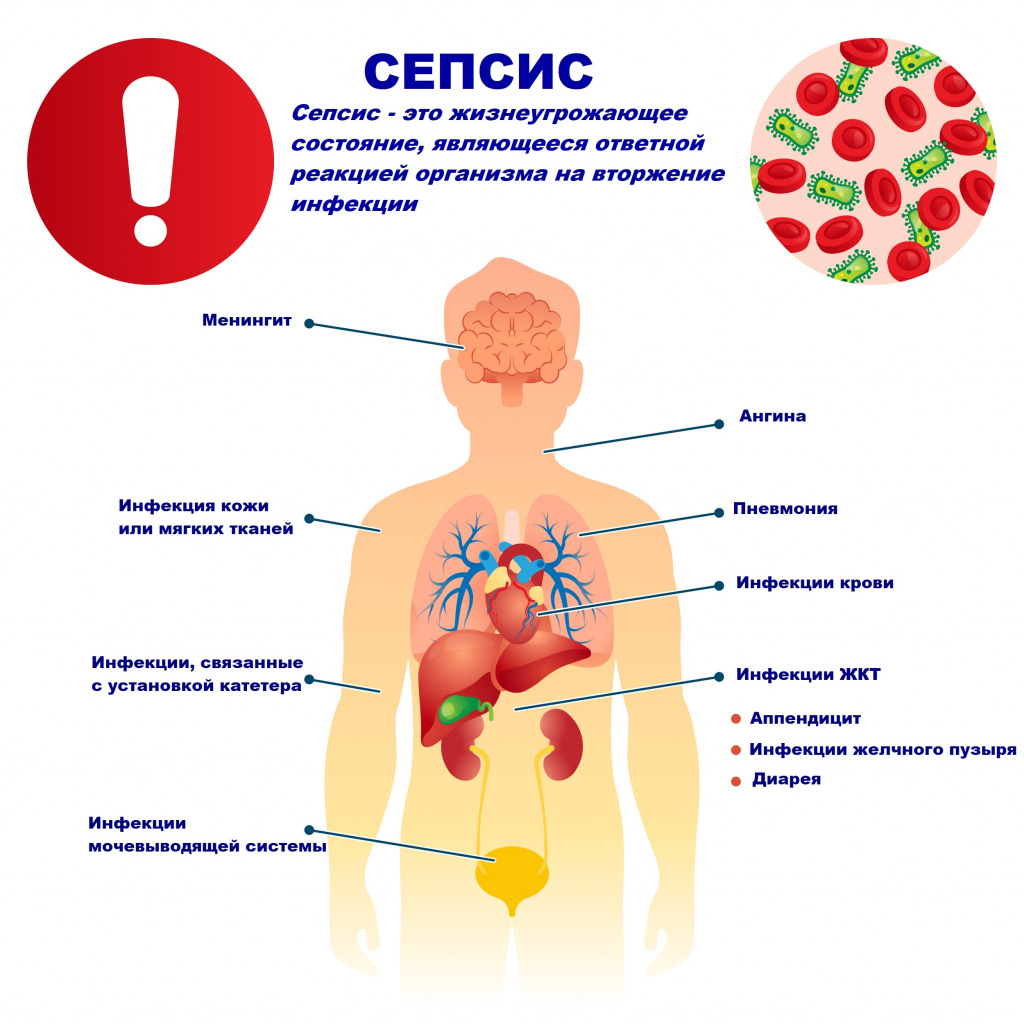
Возможность возникновения сепсиса зависит не только от свойств возбудителя, но и от состояния иммунной системы человека - нарушения в ее работе предрасполагают к распространению инфекции. Причинами таких нарушений могут быть врожденные дефекты иммунитета, хронические инфекционные болезни (ВИЧ, гнойные процессы), эндокринные заболевания (сахарный диабет), онкологические болезни, хронические интоксикации (алкоголизм, наркомания), проникающая радиация, прием иммуносупрессоров (кортикостероидов, цитостатиков) и др.
В ответ на внедрение возбудителя вырабатываются цитокины – особые белковые молекулы, которые выполняют защитные функции сначала на местном уровне, а затем, попадая в системный кровоток, продолжают работать уже на уровне всего организма. Цитокины бывают провоспалительными и противовоспалительными. В самом начале инфекционного процесса их количество находится в равновесии. Если регулирующие системы организма не способны поддерживать это равновесие, то цитокины накапливаются в кровотоке в сверхвысоких объемах, начинают доминировать их деструктивные, разрушающие эффекты, в результате повреждается сосудистая стенка, запускается синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) и полиорганная дисфункция. Вследствие полиорганной дисфункции печени, почек, кишечника появляются новые повреждающие факторы (лактат, мочевина, билирубин и др.), которые усиливают деструктивные процессы. При ДВС-синдроме в сосудах микроциркуляторного русла образуются множественные тромбы в сочетании с несвёртываемостью крови, приводящей к множественным кровоизлияниям.
Классификация заболевания
В зависимости от локализации входных ворот и первичного очага сепсис подразделяют на:
- перкутанный (чрескожный) – развивается при попадании возбудителя в организм через поврежденный кожный покров (ранки, царапины, фурункулы и др.);
- акушерско-гинекологический – развивается после родов и абортов;
- оральный (одонтогенный и тонзиллогенный) – развивается в результате первичной инфекции в полости рта;
- оториногенный – развивается в результате распространения инфекции из полости уха и/или носа;
- пневмогенный – при наличии инфекционного очага в нижних дыхательных путях;
- хирургический;
- урологический;
- пупочный – развивается у новорожденных вследствие проникновения инфекционных агентов в кровь через пупочную ранку;
- криптогенный (идиопатический, эссенциальный, генуинный) – сепсис неизвестного происхождения: первичный очаг гнойного воспаления неизвестен.
- молниеносный сепсис,
- острый сепсис,
- подострый сепсис,
- хронический сепсис (хрониосепсис).
По клиническим признакам:
1. Синдром системного воспалительного ответа (ССВО) – системная реакция организма на воздействие различных сильных раздражителей (инфекции, травмы, операции и др.) характеризуется двумя или более признаками:
- температура тела ≥ 38°С или ≤ 36°С;
- частота сердечных сокращений (ЧСС) ≥ 90 ударов в минуту;
- частота дыхания (ЧД) > 20 в минуту или гипервентиляция (РаСО2 ≤ 32 мм рт. ст.);
- лейкоциты крови > 12х109 /л или < 4х109 /л, или незрелых форм >10%.
По виду и характеру возбудителя:
- аэробный сепсис,
- анаэробный сепсис,
- смешанный сепсис,
- грибковый сепсис,
- вирусный сепсис.
Клинические проявления сепсиса могут варьировать от незначительных до критических. При молниеносном течении патологическое состояние развивается бурно - за несколько часов или суток. При остром сепсисе симптомы развиваются за несколько дней. Для хрониосепсиса характерно вялое течение и наличие малозаметных изменений, формирующихся месяцами. Рецидивирующий сепсис протекает с эпизодами обострений и затуханий.
Инкубационный период после выявления ворот инфекции или первичного очага составляет от 1 до 3-5 суток. Начало сепсиса, как правило, острое, хотя иногда может быть подострым или постепенным. Интоксикация проявляется резкой слабостью, адинамией, анорексией, нарушением сна, головной болью, расстройством сознания, менингеальным синдромом (поражением оболочек головного и спинного мозга), тахикардией, артериальной гипотензией. Температура тела держится высокой, со скачками утром и вечером. Признаки интоксикации особенно выражены на высоте лихорадки. На коже у трети больных появляется геморрагическая сыпь.
Со стороны дыхательной системы наблюдаются одышка и хрипы в легких. При нарушении функции почек снижается количество выделяемой мочи (олигурия) вплоть до полного прекращения мочеиспускания (анурия), в моче появляются следы крови, гноя. Наблюдается ухудшение функции печени с развитием желтухи и явлениями гепатита, увеличивается селезенка. Повреждение органов ЖКТ проявляется нарушением пищеварения, отсутствием аппетита, язык сухой, обложенный, нередко наблюдаются упорные септические поносы, тошнота и рвота. Метастазирование возбудителя из первичного очага с образованием вторичных очагов инфекции может приводить к инфаркту легкого, гангрене легкого, гнойному плевриту, эндокардиту (поражению внутренней оболочки сердца), воспалению сердечной мышцы (миокардиту), воспалению околосердечной сумки (перикардиту), гнойному циститу, абсцессам мозга и воспалению оболочек мозга (гнойному менингиту), гнойным артритам, флегмонам и абсцессам в мышцах.
Недостаточность функции одного органа длительностью более суток сопровождается летальностью до 35%, при недостаточности двух органов – 55%, при недостаточности функции трех и более органов летальность к четвертому дню возрастает до 85%.
Производят посевы крови, мочи, ликвора, мокроты, гнойного экссудата из элементов сыпи, абсцессов, пунктатов плевры, суставов и других септических очагов. Посевы делают многократно, чтобы определить чувствительность к максимальному количеству антибиотиков. Используется также обнаружение антигенов в крови методом ИФА и определение генома возбудителя методом ПЦР.
Одним из наиболее специфичных и чувствительных маркеров бактериальной инфекции служит прокальцитониновый тест. Прокальцитонин – один из основных маркёров системного воспаления, вызванного бактериями.
Синонимы: Анализ крови на прокальцитонин; ПКТ. Procalcitonin; PCT. Краткая характеристика определяемого вещества Прокальцитонин Прокальцитонин является прогормоном кальцитонина, состоящим из 116 аминокислот с молекулярной массой 14,5 кDa. Биосинтез прокальцитонина в физиологических условиях прои.

Заражение крови (сепсис) – это острое или хроническое заболевание, которое возникает вследствие проникновения в организм бактериальной, вирусной или грибковой флоры.
Что это такое?
Сепсис – это тяжелый инфекционный процесс, который формируется в результате постоянного нахождения или периодического попадания различного рода возбудителей в систему кровообращения человека.
В клинической картине преобладают симптомы нарушения работы всего организма, а не местные реакции.
Классификация
В зависимости от скорости развития инфекционного процесса выделяют следующие виды септических состояний:
- Молниеносный сепсис , который развивается в течение трех суток после инфицирования патогенными возбудителями;
- Острый , при котором клиническая симптоматика развивается не ранее, чем через неделю после выявления первичного очага инфекции;
- Подострое септическое состояние формируется от недели и до четырех месяцев;
- Хроническим сепсис у взрослых будет считаться при появлении первой симптоматики не ранее чем через полгода; он, как правило, развивается у больных с иммунодефицитами различной этиологии.
В эпидемиологическом плане при характеристике данной патологии выделяют следующие виды:
- Внутрибольничное инфицирование . Оно развивается в результате хирургических, гинекологических, диагностических или других медицинских манипуляций, возникающих после оказания медицинской помощи.
- Внебольничное инфицирование . Причиной становится какое-либо инфекционное заболевание, например, кишечная инфекция, менингит, лор-патология и т. д.
По особенностям проявления клинических симптомов сепсиса выделяют:
- Токсимию , при которой развивается системный воспалительный процесс, обусловленный распространением инфекции из первичного очага;
- Септицемию , которая характеризуется отсутствием формирования вторичных гнойных очагов;
- Септикопиемию , при ней такие очаги присутствуют.
Причины заражения крови
В качестве возбудителей сепсиса выступают самые разные микроорганизмы: стафилококки, менингококки, пневмококки, кишечная палочка, микобактерия туберкулеза, клебсиелла, грибы типа Candida, вирусы герпетиморфной группы.
Стоит отметить, что развитие сепсиса связано не столько с свойствами самих возбудителей, сколько с состоянием организма человека и его иммунитета. Снижение эффективности защитных барьеров приводит к тому, что наши охранные системы уже не могут вовремя локализовать вредных возбудителей и тем более предотвратить их проникновение внутрь различных органов.
Если же говорить о наиболее распространенных способах заражения сепсисом, то стоит отметить, что они зависят от типа конкретного возбудителя. Для каждого из них характерны свои особенности и эпидемиологические предпосылки. Особняком стоят лишь случаи, когда у больных развивается внутрибольничный сепсис, симптомы которого иногда дают о себе знать даже после вдыхания плохо очищенного воздуха в палатах (в 60% проб выявляются потенциально опасные микроорганизмы).
Также можно выделить и другие пути инфицирования, определяющие основные симптомы сепсиса:
- акушерско-гинекологический;
- отогенный;
- криптогенный;
- черезкожный сепсис;
- оральный;
- заражение крови, происходящее вследствие хирургических и диагностических манипуляций.
Как мы уже сказали выше, для развития сепсиса необходимо соблюдение некоторых условий, в частности:
- формирование вторичных очагов, которые в дальнейшем также поставляют возбудителей;
- наличие первичного очага (он должен быть связан с кровеносной системой или лимфатическими сосудами);
- многократное проникновение возбудителей в кровь;
- неспособность организма организовать необходимую иммунную защиту и спровоцировать реакции против вредных микробов.
Только если все эти условия соблюдены и у больного имеются соответствующие клинические признаки инфекции, врачи диагностируют сепсис крови. Развитие сепсиса провоцируется тяжелыми заболеваниями (диабет, раковые опухоли, рахит, ВИЧ, врожденные дефекты иммунной системы), терапевтическими мероприятиями, травмами, длительным приемом иммунодепрессивных препаратов, рентгенотерапией и некоторыми другими факторами.
Первые симптомы сепсиса
Сепсис (см. фото) может протекать с образованием местных гнойников в различных органах и тканях (занос инфекции из первичного очага) — т. н. септикопиемия, при которой течение сепсиса зависит от расположения гнойников (например, гнойник в мозге с соответствующими неврологическими расстройствами), и без метастатических гнойников — т. н. септицемия, нередко с более бурным течением, резко выраженными общими симптомами. При развитии сепсиса у новорождённых (источник — гнойный процесс в тканях и сосудах пуповины— пупочный сепсис) характерны рвота, понос, полный отказ ребёнка от груди, быстрое похудение, обезвоживание; кожные покровы теряют эластичность, становятся сухими, иногда землистого цвета; нередко определяются местное нагноение в области пупка, глубокие флегмоны и абсцессы различной локализации.
При диагностике заражения крови различают:
- Синдром системной воспалительной реакции . Характеризуется изменением температуры тела (как в сторону повышения, более 38 °C, так и в сторону понижения — ниже 36 °C), учащенным сердцебиением (более 90 ударов в минуту) и дыханием (более 20 вдохов в минуту), изменением количества лейкоцитов в крови (менее 4×109 или более 12×109 клеток на литр крови).
- Сепсис . При тех же симптомах, что и в случае системного воспалительного синдрома, в одной из стерильных в норме тканей (в крови, цереброспинальной жидкости, в моче…) обнаруживают один из известных патогенов, выявляют признаки перитонита, пневмонии, пурпуры и других местных воспалительных процессов.
- Тяжелый сепсис . Характеризуется так же, как обычный сепсис, но с гипотензией, гипоперфузией или дисфункцией отдельных органов.
- Септический шок . Наиболее тяжелое состояние, после которого у каждого второго больного из-за нарушения кровоснабжения органов и тканей наступает смерть. Определяется теми же симптомами, что и сепсис, когда интенсивные реанимационные мероприятия не приводят к нормализации кровотока и уровня артериального давления. Другими признаками септического шока являются замедление образования мочи и спутанность сознания.
В феврале 2016 года понятия и диагностические критерии сепсиса были пересмотрены. Понятие синдрома системной воспалительной реакции и тяжелого сепсиса признаны неактуальными, понятиям сепсиса и септического шока даны новые определения.
Для выявления и диагностики сепсиса рекомендовано использовать шкалы SOFA и qSOFA.
Сепсис новорожденных
У детей вследствие сепсиса происходит нарушение многих процессов в организме (движение крови, перфузия). Статистика показывает, что частота случаев заболевания у новорожденных остается высокой, но эта проблема активно изучается.
Сепсис у детей способен развиться в качестве сопутствующего другим заболеваниям симптома и может не иметь собственных признаков. Это заболевание является реакцией организма на попадание в него патогенной микрофлоры. При воспалительном процессе происходит неконтролируемое образование гноя. У новорожденных сепсис может возникнуть при воздействии клебсиеллы и синегнойной палочки, а также стрептококков, энтеробактерий или кандиды. Иногда болезнь возникает при воздействии нескольких микроорганизмов. Чаще всего сепсис поражает детей до одного года с низкой массой тела.
При развитии молниеносной формы сепсиса возникает септический шок, который в большинстве случаев заканчивается летально. Болезнь приводит к резкому снижению температуры тела, сопровождается сильной слабостью, вялостью, повышенной кровоточивостью, отеком легких, сердечно-сосудистыми нарушениями, острой почечной недостаточностью.
Диагностика
Заражение крови диагностируют, основываясь на симптомах и данных исследований крови на наличие бактерий, учитывая, что на этапе токсико-резорбтивной лихорадки и при хроническом течении на этапе ремиссии бактериемия (наличие в крови микробов), не выявляется.
При диагностировании обязательно учитывают изменения показателей крови, для которых характерно:
- высокие показатели уровня билирубина и остаточного азота;
- сниженное содержание кальция и хлоридов;
- прогрессирующая анемия;
- высокий лейкоцитоз (ненормально высокое содержание лейкоцитов) или, в случае ослабленных пациентов – лейкопения (снижение количества белых клеток крови);
- тромбоцитопения — уменьшенное содержание тромбоцитов.
В моче выявляется белок, лейкоциты, эритроциты, повышенное количество мочевины и мочевой кислоты.
К лабораторным методам относят:
- Определение в крови количества прокальцитонина: его повышенное содержание рассматривается как характерный признак заражения крови
- Выделение генетического материала патогена, вызвавшего сепсис, с помощью полимеразно-цепной реакции (ПЦР) путем экспресс-методов. В течение 2 часов возможна идентификация до 25 видов микроорганизмов и болезнетворных грибков.
- Бактериологический анализ крови для выявления активного микроба и его реакции на действие разных антибактериальных лекарств (антибиотикограмма) для разработки оптимальной схемы лечения. Забор проводят из двух разных подкожных вен в объеме 5 – 10 мл, проводя посев в питательную среду.

Какие последствия?
Осложнения сепсиса крайне опасны, тяжело поддаются лечению даже в условиях интенсивной терапии. Рассмотрим подробнее самые распространенные из них.
- Сильное кровотечение – может резвиться в результате дефицита специальных веществ (факторов свертывания крови и тромбоцитов), вырабатываемых печенью.
- Острая почечная и печеночная недостаточность – развивается под прямым воздействием токсинов на почку, или в результате закупорки фильтрующего аппарата почек микробными фрагментами и гноем. Нарушается и полностью прекращается выведение из организма продуктов обмена, что еще больше усугубляет состояние.
- Инфекционно-токсический шок (ИТШ) — резкое падение артериального давления, под воздействием большого количества микробных токсинов. Без оказания экстренной медицинской помощи можно умереть в течение часа или даже нескольких минут. Лечат ИТШ в условиях реанимационного отделения.
- Бактериальный эндокардит – развивается при попадании микробов в полость сердца. Вызвав воспаление, они способствуют образованию тромбов в его полости. Впоследствии эти тромбы, отрываясь и попадая с током крови в сосуды головного мозга, могут привести к инсульту.
В целом сепсис приводит к нарушению функций и повреждению всех внутренних органов.
Что нужно для лечения сепсиса?
Общеизвестно, что сепсис крайне тяжело поддается лечению. Смертность при нем крайне высока и в некоторых ситуациях достигает 50%. Впрочем, своевременно оказанная помощь снижает этот показатель в разы.
Согласно клиническим рекомендациям в 2019 году больных сепсисом лечат в отделениях интенсивной терапии или реанимации. Это вызвано необходимостью постоянного контроля жизненных показателей. В течение первых 6 часов усилия врачей направлены на доведение этих цифр до определенного значения и стабилизации их:
Лечение заключается в ликвидации возникших осложнений, которые в большинстве своём являются реанимационными.
Так например при возникновении острой почечной недостаточности применяют гемофильтрацию, гепатопротекторы и гемодиализ, при нарушениях гемодинамики – восстановление сосудистой проницаемости и объёма циркулирующей крови, при кардионедостаточности – кардиостимулирующие и вазотропные средства, при легочной недостаточности применяют ИВЛ, при стрессовом кровотечении применяют Н2 гистаминовые блокаторы/ блокаторы протонной помпы/ сукральфат. Что касается антибиотико-терапии, то антибиотики должны назначаться по результатам бактериальных исследований или против наиболее вероятных возбудителей.
Для последнего случая также создана таблица:
| Локализация первичного очага | Наиболее вероятные возбудители |
| Лёгкие (нозокомиальная пневмония развившаяся вне ОРИТ) | Streptococcus pneumonia, Enterobacteriaceae (E.colli), Staphylococcus aureus |
| Лёгкие (нозокомиальная пневмония развившаяся в ОРИТ) | Pseudomonias aeruginosa, Acinetobacter spp, а также вышеперчисленные возбудители |
| Брюшная полость | Bacteroides spp, Enterococcus spp, Streptococcus spp, Pseudomonias aeruginosa, Staphylococcus aureus |
| Кожа и мягкие ткани | Streptococcus spp, Staphylococcus aureus, Enterobacteriaceae |
| Почки | Enterobacteriaceae, Enterococcus spp |
| Ротоглотка | Staphylococcus spp, Streptococcus spp, анаэробы |
| После спленэктомии | Streptococcus pneumonia, Haemophilis influenzae |
| Внутривенный катетер | Staphylococcus epidermididis, Staphylococcus aureus, энтерококки и кандиды |
При формировании вторичных гнойных очагов необходимо их хирургическое лечение – вскрытие абсцессов, удаление гноя и промывание ран, иссечение пораженных участков.

Профилактика
Предотвратить заражение крови помогут следующие меры:
- грамотное применение антибиотиков;
- соблюдение основных правил гигиены;
- своевременное лечение процессов гнойного характера;
- соблюдение асептических условий при проведении медицинских манипуляций;
- иммунизация людей, относящихся к группам риска.
Гнойно-септические заболевания значительно легче предотвратить, чем вылечить, поэтому больным нужно не только выполнять индивидуальные меры профилактики, но и следить за тем, как проходит процедура в медицинском кабинете. Соблюдение этих простых мер поможет предотвратить развитие заболевания.
Прогноз при сепсисе
Исход сепсиса определяется вирулентностью микрофлоры, общим состоянием организма, своевременностью и адекватностью проводимой терапии. К развитию осложнений и неблагоприятному прогнозу предрасположены больные пожилого возраста, с сопутствующими общими заболеваниями, иммунодефицитами. При различных видах сепсиса летальность составляет 15-50%.
При развитии септического шока вероятность летального исхода крайне высока.
Читайте также:

