Этиология и патогенез кишечных инфекций
Обновлено: 18.04.2024
Для цитирования: Падейская Е.Н. НЕКОТОРЫЕ ВОПРОСЫ АНТИМИКРОБНОЙ ТЕРАПИИ КИШЕЧНЫХ ИНФЕКЦИЙ. РМЖ. 1997;24:5.
В статье представлены возбудители различных кишечных инфекций и рассмотрены вопросы этиотропной терапии этих заболеваний. Используемые для этой цели препараты делятся на две группы: средства, плохо всасывающиеся и оказывающие лишь местное действие,и системные препараты, способные, тем не менее, достигать высоких концентраций в содержимом кишечника.
В статье представлены возбудители различных кишечных инфекций и рассмотрены вопросы этиотропной терапии этих заболеваний. Используемые для этой цели препараты делятся на две группы: средства, плохо всасывающиеся и оказывающие лишь местное действие,и системные препараты, способные, тем не менее, достигать высоких концентраций в содержимом кишечника.
Особое внимание уделено препаратам группы фторхинолонов. Даны рекомендации по использованию антибактериальных средств с учетом этиологии заболеваний.
The paper presens pathogens of various intestinal infections and considers their etiotropic therapy. The agents used for this purpose are divided into two groups: those which are poorly absorbed and produce only local effects and those which have systemic effects and, nevertheless. can achieve high concentrations in the intestinal contents.
Particular attention is given to a group of fluoroquinolones. Recommendations are given on the use of antibiotics according to the etiology of the diseases.
Е.Н. Падейская, профессор, д.м.н., Москва
Prof Ye.N. Padeiskaya, Doctor of Medical Sciences, Moscow
Ш ироко распространенный термин “кишечные инфекции” относится к большой группе инфекционных заболеваний с преимущественным поражением желудочно-кишечного тракта (ЖКТ) и соответствующей симптоматикой (диарея, боли в области живота, в подложечной области, тошнота, иногда рвота, в тяжелых случаях – выраженная интоксикация, обезвоживание). Эти инфекции вызываются главным образом различными патогенными или условно-патогенными бактериями, вирулентные и токсигенные свойства которых определяют особенности патогенеза. Кроме того, поражение ЖКТ может быть вызвано некоторыми протозоа и вирусами (табл. 1) . Общим для этой группы инфекций является орально-фекальный путь заражения (через пищу, воду, контактно-бытовым путем – “болезни грязных рук”), входные ворота инфекции – ЖКТ, основные формы заболевания – гастроэнтерит, энтероколит, колит, гастроэнтероколит или гастрит. При тяжелых формах инфекции (в том числе на фоне иммунодефицитных состояний) могут иметь место токсинемия или бактериемия, реже – септицемия или септикопиемия. Учитывая особенности возбудителей инфекций, патогенез, характер течения и тяжесть процесса, определяющие тактику терапии, каждое заболевание в зависимости от этиологии следует рассматривать отдельно. К кишечным инфекциям, учитывая путь инфицирования и поражение тонкой кишки, обычно относят брюшной тиф и паратифы. При этих заболеваниях на фоне поражения кишечника и инвазии в кровь возбудителя развивается тяжелый генерализованный инфекционный процесс с бактериемией и интоксикацией. Высвобождающийся после гибели сальмонелл эндотоксин оказывает нейротропное действие, вызывает дистрофические изменения в миокарде, повреждает костный мозг. Генерализация процесса с поражением внутренних органов происходит при осложненных формах амебной дизентерии (амебный гепатит, абсцесс печени, поражение центральной нервной системы). Таким образом, понятие “кишечные инфекции” является в значительной степени условным.
Инфекционные диареи различного генеза широко распространены в разных регионах мира, могут протекать в тяжелой форме с выраженной токсинемией, в развивающихся странах остаются одной из основных причин заболеваемости и смертности [1 – 6].
Таблица 1. Возбудители и клинические формы кишечных инфекций
К кишечным инфекциям бактериальной этиологии относятся холера, эшерихиоз, шигеллез, кампилобактериоз, геликобактериоз, иерсиниоз, сальмонеллы, брюшной тиф и паратифы, а также острые диареи, часто недиагностированные по этиологическому фактору. Причиной последних могут быть как возбудители перечисленных выше инфекций, так и некоторые другие условно-патогенные аэробные бактерии. Характер течения заболевания зависит от свойств штаммов, в первую очередь от их токсигенных и инвазивных свойств. Одна из тяжелых свойств эшерихиоза – геморрагический колит с синдромом гемолитической уремии – вызывается токсигенным штаммом кишечной палочки 0156:Н7 [5].
Серьезную проблему для ВИЧ-инфицированных представляют диареи, вызванные Campylobacter spp.: описано до 10 различных представителей Campylobacter, которые могут быть причиной этих диарей [6].
Возбудителем инфекции у человека может быть Cyclospora cayetanensis – энтеропатогенный микроорганизм, вызывающий иногда очень длительную (до 70 дней) диарею [7].
Особое место занимают пищевые токсикоинфекции, патогенез которых определяют бактериальные экзотоксины с энтеротропными свойствами (энтеротоксины, цитотоксины). Они продуцируются различными аэробными и некоторыми анаэробными бактериями, причем и вне организма человека, в частности при размножении бактерий в пищевых продуктах, что и является причиной пищевой интоксикации. Клиника заболевания связана в первую очередь с поражением верхних отделов ЖКТ. Энтеротоксины мoгут продуцировать токсигенные штаммы P. vulgaris, P. mirabilis, Klebsiella spp., Enterobacter spp., Serratia spp., Citrobacter spp., Pseudomonas spp., Aeromonas spp., S. aureus, C. perfringens. Наиболее серьезную опасность представляют термостабильные энтеротоксины, в частности энтеротоксин стафилококка. Чаще энтеротоксины относятся к термолабильным токсинам [2].
К пищевым токсикоинфекциям, с учетом источника заражения и пути инфицирования, можно было бы отнести и заболевание, вызванное токсином Clostridium botulinum. Однако этот токсин характеризуется не энтеротропными, а нейроплегическими свойствами, и заболевание (ботулизм) по патогенезу и клинике принципиально отличается от инфекций с преимущественным поражением ЖКТ.
Таблица 2. Группы антимикробных препаратов, применяющихся для этиотропной терапии бактериальных кишечных инфекций
Лечение кишечных инфекций является комплексным и включает патогенетическую терапию (прежде всего – дезинтоксикацию, при обезвоживании – регидратацию), этиотропное лечение, направленное на инактивацию возбудителя инфекции, диетотерапию (сбалансированную и тщательно подобранную в зависимости от характера ферментативных нарушений при той или иной инфекции), коррекцию нарушений нормальной микрофлоры кишечника с помощью биопрепаратов для предупреждения развития дисбактериоза.
Задачей настоящей работы является рассмотрение разных аспектов этиотропной терапии. Вместе с тем следует подчеркнуть, что патогенетическая и диетотерапия в сочетании с коррекцией микрофлоры должны рассматриваться как важнейшие компоненты лечения кишечных инфекций, а при легких формах заболевания могут быть эффективны и без применения антимикробных препаратов. С другой стороны, этиотропные средства являются важнейшим копонентом терапии при среднетяжелых и тяжелых (особенно генерализованных) формах инфекции, кроме того, они используются для лечения и профилактики бактерионосительства.
Учитывая широкий профиль возбудителей (см. табл. 1) , трудности быстрой микробиологической диагностики острых диарей в большистве случаев на первом этапе проводят эмпирическую терапию. В связи с этим, важно, чтобы антимикробный препарат характеризовался широким антимикробным спектром, включающим, по возможности, всех потенциальных возбудителей этих инфекций. Необходимо также, чтобы препарат:
– достигал высокой концентрации в содержимом кишечного тракта после перорального применения;
– хорошо проникал в клетки фагоцитарной системы (микроорганизмы с внутриклеточной локализацией – одни из важнейших в этиологии рассматриваемых заболеваний);
– оказывал минимальное отрицательное влияние на нормальную микрофлору кишечника;
– не вызывал побочных реакций со стороны ЖКТ.
Кроме того, важно, чтобы у энтеропатогенных бактерий как можно реже развивалась выраженная резистентность к данному препарату.
При пищевых токсикоинфекциях основное значение имеет дезинтоксикационная патогенетическая терапия, и в большинстве случаев нет необходимости прибегать к применению этиотропных средств.
Проблема лекарственной резистентности существенно осложнила этиотропную терапию кишечных инфекций. Особенно демонстративным в этом отношении является пример дизентерии и брюшного тифа. Изучение чувствительности шигелл к антимикробным препаратам в 14 штатах США за период с 1985 – 1986 по 1995 г. показало повышение частоты выделения устойчивых к ампициллину штаммов с 32 до 67%, к ко-тримоксазолу – с 7 до 35% [8]. Значительно возросло число штаммов сальмонелл, в том числе S. typhi, устойчивых к хлорамфениколу, ко-тримоксазолу и ампициллину, причем уровень резистентности может быть очень высоким: минимальная ингибирующая концентрация (МИК) достигает 400 мг/л. Одновременно в ряде регионов отмечается и более тяжелое клиническое течение кишечных инфекций, в частности шигеллеза, что проявляется увеличением продолжительности и тяжести интоксикации и диареи в сочетании с более глубокими деструктивными изменениями в стенке толстой кишки [9].
Для этиотропной терапии кишечных инфекций с учетом лекарственной резистентности в настоящее время успешно используются препараты группы фторхинолонов, эффективность которых при этих заболеваниях очень высокая.
Уже внедренные в практику с 1962 г. нефторированные хинолоны (налидиксовая кислота и аналоги) оказались эффективными при пероральном приеме при дизентерии, вызванной штаммами, устойчивыми к сульфаниламидам и хлорамфениколу. Однако широкое использование этих препаратов способствовало формированию резистентности к ним энтеропатогенов и снижению эффективности. В связи с особенностями фармакокинетики нефторированные хинолоны оказались неэффективными при генерализации процесса, не могли применяться для лечения брюшного тифа и паратифов, несмотря на высокую активность in vitro.
Таблица 4. Эффективность перорального приема офлоксацина при брюшном тифе и сальмонеллезах 1)
За последние 15 лет накоплен большой клинический опыт, свидетельствующий о высокой эффективности фторхинолонов при кишечных инфекциях бактериальной этиологии [1, 4, 10 – 18].
Фторхинолоны высокоэффективны в отношении практически всех возбудителей бактериальных кишечных инфекций, включая штаммы с множественной устойчивостью к бета-лактамам (в частности к ампициллину), хлорамфениколу, препаратам группы ко-тримоксазола. Несмотря на высокую биодоступность, препараты при применении перорально обеспечивают достаточно высокие концентрации в содержимом кишечника, колеблющиеся в пределах 100 – 2500 мг/кг и выше, что на несколько порядков превышает МИК и минимальную бактериостатическую концетрацию фторхинолонов для энтеропатогенов. Препараты создают высокие концентрации в слизистой кишечника и в макрофагах; это особенно существенно, учитывая внутриклеточную локализацию сальмонелл, шигелл, иерсиний, стафилококков. Высокая бактерицидная активность фторхинолонов в сочетании с активностью в отношении полирезистентных штаммов энтеробактерий, высокими концентрациями препаратов в содержимом кишечника и клетках фагоцитарной системы обеспечивают клинический и бактериологический эффект и, как правило, предотвращают формирование бактерионосительства. При генерализованных инфекциях важное значение имеет длительная циркуляция фторхинолонов в организме, хорошее проникновение в органы и ткани и высокие тканевые и внутриклеточные концентрации. Последнее особенно важно при лечении брюшного тифа и паратифов, а также других форм генерализованных сальмонеллезов.
Таблица 5. Эффективность фторхинолонов при лечении больных холерой; курс лечения – 3 дня [12, 17,21, 22, в модификации]
Кишечная инфекция является собирательным понятием и включает в себя кишечные инфекции, вызванные вирусами (энтеровирусная, ротавирусная инфекция), бактериями (сальмонеллез, дизентерия, холера, E. coli–инфекция), а также токсинами бактерий (стафилококковая кишечная токсикоинфекция). Наиболее распространена кишечная инфекция человека, вызываемая Campylobacter [3] (рис. 1). Основными клиническими проявлениями являются диарея и системные эффекты. Инфекция Campylobacter вызывает воспалительную диарею, иногда с примесями крови, или дизентерийный синдром.
Campylobacter jejuni является наиболее частой причиной приобретенного воспалительного энтерита, сопровождаемого чаще водной диареей. Наличие инфекции Campylobacter может повышать риск возникновения инфекций, вызванных Helicobacter cinaedi и Helicobacter fennelliae, а также синдромов энтероколита и/или проктоколита, особенно у мужчин–гомосексуалов. Инфекции, вызванные C. jejuni, могут также вызывать бактериемию, иногда и тяжелую, особенно у пациентов с ВИЧ. Campylobacter fetus также может быть причиной возникновения бактериемии. Также была доказана роль Campylobacter lari в возникновении периодической диареи у детей. Campylobacter upsaliensis может также являться причиной диареи или бактериемии, в то время как Campylobacter hyointestinalis, имеющая биохимические характеристики, близкие к C. fetus, может вызывать бактриемию у иммунокомпрометированных лиц. Бактерии Campylobacter также могут быть причиной диареи путешественников, особенно в Таиланде и окружающих регионах Юго–Восточной Азии. Инфекция Campylobacter также была выявлена у более чем половины сотрудников американской армии, служащих в Таиланде, которые имели диарею. Интересен тот факт, что микроорганизмы, относящиеся к Helicobacter pylori, были прежде известны как Campylobacter pylori, для которых только лишь слизистая желудка была определена как резервуар для H. pylori.
Инкубационный период после заражения Сampylobacter длится около 1 нед. Бактерия повреждает тощую кишку, подвздошную кишку, толстую кишку. C. jejuni вторгается в эпителиальные клетки и разрушает их. Специальные жгутики помогают C. jejuni при помощи хемотаксиса прилипать ко слизистой кишки перед внедрением. Наличие липолисахаридов и других компонентов покрывающей мембраны помогает адгезии бактерий и колонизации в слизистой оболочке. Имеющися у бактерии поверхностный антиген PEB1 помогает проявлять высокие адгезивные и защитные свойства.
Некторые штамы C. jejuni продуцируют теплоустойчивый, холероподобный энтеротоксин, который играет важную роль в формировании симптомов водной диареи у инфицированных пациентов. При поражении слизистой оболочки кишки формируются диффузные морфологические изменения, характерные для отечного экссудативного энтероколита. Воспалительный инфильтрат состоит из нейтрофилов, мононуклеарных клеток и эозинофилов. В эпителиальных железах формируются абсцесы крипт и изъязвления эпителия слизистой оболочки кишки.
Имеются данные о продукции специального цитотоксина штаммами Campylobacter, полученные при анализе случаев диареи с примесью крови. Некоторые случаи инфекции могут быть ассоциированы с гемолитико–уремическим синдромом и тромботической тромбоцитопенической пурпорой, механизм возникновения которых полностью до сих пор не ясен. Повреждение эндотелиальных клеток опосредуется эндотоксинами или иммунными комплексами и ведет к интраваскулярной коагуляции и тромботической микроангиопатии в клубочках и гастроинтестинальной слизистой.
У пациентов с ВИЧ инфекция Campylobacter может быть широко распространена, является наиболее частой причиной длительной или периодической диареи и может быть наиболее часто ассоциированна с бактериемией и антибиотикорезистентностью.
При инвазии в слизистую желудка C. fetus покрывается поверхностным слоем S–протеина, который функционирует как капсула, что приводит к сывороточной и фагоцитарной резистентности. Инфекция C. jejuni наиболее распространена у детей и взрослых с недостаточностью иммуноглобулинов. После острой инфекции C. jejuni возможно формирование короткосрочного иммунитета. Пациенты вырабатывают специфические иммуноглобулины G (IgG), M (IgM) и A (IgA) в сыворотке, а IgA–антитела также формируются в кишечной стенке. Роль клеточно–опосредованного и гуморального иммунитета была показана при изучении инфекции C. jejuni у пациентов с ВИЧ и гипогаммаглобулинемией. Данные исследования показали роль данных видов иммунитета в предупреждении и прекращении инфекции. В США ежегодно регистрируется около 2 млн случаев энтерита, вызванного Campylobacter. Бактерия имеет огромный резервуар в животном мире, в 100% случаев инфекция обнаруживается у домашней птицы, включая курицу, индюшку, водоплавающих, имеющих асимптомную кишечную инфекцию. Наибольшим резервуаром для C. fetus является домашний скот и овцы. Однако частота инфекции Campylobacter в последние годы уменьшается, по данным Foodborne Diseases Active Surveillance Network (FoodNet).
Инфекция Campylobacter может проявляться как асимптомным, так и тяжелым жизнеугрожающим колитом с развитием токсического мегаколона. Все случаи инфекции ассоциированы с кишечными синдромами и являются клинической манифестацией заболевания. В анамнезе заболевания превалируют случаи употребления неправильно приготовленной пищи, непастеризованного молока или некипяченой воды. Инкубационный период составляет около 1–7 дней и обычно связан с дозой поглощенных микроорганизмов. Продромальный период характеризуется лихорадкой, головной болью, миалгиями в первые 24 ч, после чего могут наблюдаться выраженная абдоминальная боль, лихорадка выше 40 °C и частая, более 10 раз/сут., водная диарея, иногда с примесью крови. Лихорадка, развивающаяся у более чем 90% пациентов, может длиться около недели. Пациенты с инфекцией C. jejuni, которые жалуются на рвоту, диарею с примесью крови, или те, кто имеет длительное течение заболевания, подлежат госпитализации. Боль в животе и тенезмы могут быть локализованными. Боль в правом нижнем квадранте может симулировать симптомы аппендицита (псевдоаппендицит). Тенезмы наблюдаются у более чем 25% пациентов. Среди прочих симптомов абдоминальная боль наблюдается чаще при инфекции Campylobacter, чем при инфекции, вызванной Salmonella или Shigella. По сранению с инфекцией C. jejuni C. fetus является причиной диареи реже. Однако C. fetus, которая вызывает диарею, приводит к клинической манифестации, очень схожей с клиническими проявлениями инфекций С. Jejuni. C. fetus является условно–патогенной инфекцией у ослабленных организмов, однако риск заражения здоровых организмов также имеется. При данной инфекции также может наблюдаться бактериемия, обычно у пациентов более старшего возраста и с воспалением подкожной жировой клетчатки (целлюлит), эндоваскулярными инфекциями или инфекциями, связанными с имплантируемыми устройствами. Также для этого вида инфекции характерны сосудистые осложнения – менингит, абсцессы. C. fetus может явиться причиной волнообразной диареи или неспецифической боли в животе. При объективном обследовании обращает внимание напряженность живота при пальпации, наличие зон более выраженной напряженности, как правило в правом или левом нижнем квадранте. Среди всех симптомов только абдоминальная боль является наиболее частым проявлением инфекции Campylobacter по сравнению с инфекциями, вызванными Salmonella и Shigella.
Campylobacter имеет форму завитка или спирали, является подвижным, неспорообразующим, грамотрицательным микроорганизмом. Подвижность обеспечивается одним или двумя жгутиками. Данный вид бактерий является оксидаза– и каталаза–позитивным и микроаэрофильным, требующим уменьшенного количества кислорода (5–10%) и повышенного уровня углекислого газа (3–10%) (рис. 2) [4].
Клиническая лабораторная диагностика кишечной инфекции Campylobacter основана на обнаружении микроорганизмов в фекалиях или на выделении организмов. Для выделения данного рода бактерий из фекалий применяются специальные техники. Они включают рост при 42 °C, использование специальных сред, фильтрацию через микроспоры с целью выделить бактерии больших диаметром из культуры. Образцы специальных сред должны содержать кровь, антибиотики. Для культивации C. jejuni могут быть использованы такие среды, как Mueller–Hinton и агар, которые создают прекрасные условия для роста C. jejuni. Оптимальная атмосфера для роста C. jejuni: 85% N2, 10% CO2, 5% O2. Исследование фекалий должно быть проведено в минимальные сроки.
При сигмоидоскопии в 80% случаев инфекции Campylobacter обнаруживаются признаки проктоколита. Однако признаки иногда могут быть такими же, как при псевдомембранозном колите или воспалительном заболении кишечника. Патология, выявляемая при сигмоидоскопии – от фокального отека слизитой и петехиальной гиперемией до диффузного или афтоидного изъязвления.
Некоторыми авторами была изучена возможность использования этого препарата с целью детоксикации. Энтеродез применяли у 104 больных с различной инфекционной патологией. Во всех этих наблюдениях имел место резкий эндотоксикоз, подтвержденный показателями формулы крови и токсичности крови, мочи и лимфы (по данным парамецийного теста). В 83 наблюдениях Энтеродез применяли в комплексе с другими методами детоксикации (гемосорбция, гемодиализ, дренирование грудного лимфатического протока).
У 21 больного при состоянии средней тяжести Энтеродез применяли изолированно, без использования других методов детоксикации. Препарат назначали по 5 г (растворяли в 100 мл воды с добавлением сахара) 3–4 раза/сут. Во всех наблюдениях при приеме препарата в течение 5–8 дней в дозе от 75 до 120 г на курс лечения у больных клинически отмечалась положительная динамика. Постепенно улучшались аппетит и сон, быстрее, чем при обычной терапии, нормализовалась функция кишечника (усиливалась перистальтика, отходили газы, нормализовалась дефекация), уменьшалась головная боль. При исследовании крови на токсичность в процессе лечения отмечали снижение токсичности исследуемой среды. Больные охотно принимали Энтеродез, осложнений не было выявлено. Изучено также влияние энтеродеза на состояние центральной гемодинамики с использованием тетраполярного реоплетизмографа, электрокардиограммы и фонокардиограммы. Через 30–60 мин после приема Энтеродеза у всех больных отмечено улучшение состояния кровообращения. Частота сердечных сокращений и артериальное давление практически не изменялись. Ударный объем увеличился на 10–35% по сравнению с исходным. Улучшение показателей центральной гемодинамики после применения Энтеродеза сопровождалось улучшением состояния больных и ускоренным их выздоровлением, что свидетельствовало о четко выраженном лечебном эффекте препарата.
Следует отметить, что Энтеродез более 20 лет широко использовался для лечения желудочно–кишечных интоксикаций – дизентерии, сальмонеллеза и др. Выявлено, что препарат снимает рвоту, тошноту, нормализует стул, температуру, пульс, позволяет исключить или уменьшить применение другой дезинтоксикационной терапии. Препарат оказался эффективным и при других видах интоксикации – ожоговой болезни, травматических поражениях, почечно–печеночной недостаточности и др. При таком частом осложнении тяжелой инфекционной интоксикации, как почечно–печеночная недостаточность, Энтеродез способствует снижению в 2–3 раза лейкоцитарного индекса интоксикации, нормализации числа лейкоцитов, снижению в 2–3 раза содержания билирубина, уменьшению в 2–4 раза токсичности крови по парамецийному тесту, повышению ударного и минутного объема сердца, нормализации функции печени. При данном патологическом состоянии применение Энтеродеза позволяет уменьшить объем вводимой в организм жидкости, что очень важно для ряда больных, особенно пожилого возраста.
Исследования, проведенные в Институте имени Н.В. Склифосовского, показали, что комплексное применение гемо– и лимфосорбции, гемодиализа и дезинтоксикационных препаратов для внутривенного (неогемодез) и перорального (Энтеродез) введения в терапии тяжелого интоксикационного синдрома дает хороший лечебный эффект. Также была исследована клиническая эффективность Энтеродеза у 85 больных в возрасте от 19 до 69 лет с острыми кишечными инфекционными болезнями (65 пациентов с пищевыми токсикоинфекциями и 20 – с острой дизентерией). Все больные поступали в остром периоде болезни, и препарат назначался при наличии интоксикации различной интенсивности. В частности выраженная интоксикация была у 42 больных с картиной быстро развивающейся слабости, заторможенности, потери аппетита, тошноты и рвоты от 1 до 4 раз/сут. У больных пищевой токсикоинфекцией стул был обычно жидкий, водянистый, от 5 до 10 раз/сут., в единичных случаях – до 20 раз, а при острой дизентерии – в среднем 5–6 раз/сут. с примесью слизи и крови. У всех этих больных были выражены боли в области, живота, часто интенсивные, но непродолжительные, отмечалась высокая лихорадка.
Препарат в дозе 5 г растворяли в 100 мл горячей воды и назначали перорально больным 1–4 раза/сут. в течение 1–3 дней в зависимости от степени интоксикации. Больные хорошо переносили препарат, хотя после растворения в воде он имел горьковатый вкус. При повышенном рвотном рефлексе к раствору добавляли одну столовую ложку сладкого сиропа.
Все больные с пищевыми токсикоинфекциями (85) были разделены на 2 группы. Первую составили 43 пациента, которые получали Энтеродез на фоне комплексного лечения: гидратационной терапии (внутривенного введения квартасоли, физиологического раствора) и симптоматических средств (спазмолитиков, витаминов, антигистаминных препаратов). Вторую группу (контрольную) составили 22 больных с пищевыми токсикоинфекциямй, которые получали гидратационную терапию и другие симптоматические средства без применения Энтеродеза; еще 20 больных острой дизентерией получали Энтеродез на фоне этиотропной терапии без приема симптоматических средств.
Основным критерием эффективности Энтеродеза было улучшение общего самочувствия больных, что связано прежде всего с уменьшением интоксикации. Положительный эффект имел место у всех леченных Энтеродезом больных. Достоверно раньше, чем в контрольной группе, при использовании Энтеродеза исчезали тошнота и рвота, уменьшались головная боль и слабость, снижалась повышенная температура, особенно у больных с пищевыми токсикоинфекциями; в 80% случаев нормализовался стул уже к концу 1–х и началу 2–х сут. после начала лечения. Измененные у некоторых больных функциональные пробы печени также быстро возвращались к норме (обычно на 2–е сут.). Средний срок пребывания больных в стационаре с пищевой токсикоинфекцией, леченных Энтеродезом, был достоверно ниже, чем в контрольной группе. Авторы отметили, что лечение Энтеродезом больных острой дизентерией почти полностью позволило исключить применение гидратационной терапии. Уже после 1–2 приемов этого препарата значительно уменьшались признаки интоксикации, исчезали болевой синдром и вздутие кишечника, появлялась тенденция к нормализации стула. У всех больных до и после лечения Энтеродезом существенных изменений в микрофлоре кишечника выявлено не было. Побочные явления также не отмечались. В ходе данного исследования было выявлено, что эффективность Энтеродеза зависит от срока начала его применения. Чем быстрее от начала болезни начато лечение, тем лучше эффект. Лечение Энтеродезом эффективно как на фоне другой комплексной (в том числе гидратационной) терапии, так и без нее. Применение Энтеродеза в ряде случаев позволяет исключить внутривенные капельные вливания жидкости даже при среднетяжелом и тяжелом течении болезни, особенно у больных острой дизентерией [2].
Использование антибиотиков для лечения инфекции Campylobacter является противоречивым. Исследования показали, что эритромицин быстро элиминирует Campylobacter из стула без воздействия на продолжительность заболевания. Исследования на детях с дизентерией, вызванной C. jejuni, показали пользу от раннего начала лечения эритромицином. Антибиотики могут быть назначены при следующих показаниях: лихорадка, диарея с примесью крови, диарея более 8 раз/сут., ухудшение симптомов, неэффективность проводимой терапии, длительность симптомов более 1 нед., беременность, ВИЧ–инфекция и другие состояния, связанные с иммунодефицитом.
Во время лечения необходимо воздерживаться от потребления препаратов, вызывающих антиперистальтику, в связи с тем, что их прием увеличивает продолжительность симптомов и увеличивают риск наступления неблагоприятных исходов. Пациенты с гипогаммаглобулинемией, имеющие волноообразную бактериемию, вызванную C. jejuni, могут потребовать назначения свежезамороженной плазмы и антибиотиков. Пациенты с тяжелой дизентерией или рецидивирующими сиптомами нуждаются в госпитализации. Пациенты с эндоваскулярной инфекцией C. fetus требуют не менее 4 нед. лечения, гентамицин может быть препаратом выбора, а терапия с ампициллином или 3–м поколением цефалоспоронов – альтернативой. Лечение инфекции центральной нервной системы C. fetus может продолжаться 2–3 нед. и проводиться 3–м поколением цефалоспоринов, ампициллина или хлорамфеникола. При подозрении на токсический мегаколон или аневризмы может быть проведено хирургическое вмешательство. При подозрении на токсический мегаколон или инфицированную аневризму консультация с хирургом обязательна. При подозрении на эндоваскулярную инфекцию C. fetus требуется консультация с инфекционистом. Во многих случаях системная инфекция Campylobacter диагносцируется ретроспективно, после успешного применения эмпирической антибиотикотерапии. В таких случаях рекомендуется повторный контроль роста культур в крови пациента. Оральное применение эритромицина может быть неэффективным при системной эндоваскулярной инфекции C. jejuni или C. fetus.
При приготовлении пищи должна быть использована разная посуда для продуктов животного происхождения и других видов блюд. После приготовления пищи посуда должна быть тщательно вымыта при помощи специального средства и горячей воды. Курица должна быть тщательно приготовлена: сырая курица является превалирующим источником инфекции Campylobacter, замена данного вида курицы замороженной может снизить уроверь Campylobacter.
Наиболее частыми осложнениями инфекции Campylobacter являются токсический мегаколон, псевдомембранозный колит, геморрагический колит, гемолитико–уремический синдром, тромботическая тромбоцитопеническая пурпура, иммунопролиферативные заболевания тонкой кишки (известны случаи ассоцииации MALT лимфомы с инфекцией C. jejuni), реактивный артрит, бактериемия, эндокардит, холецистит, инфекция мочевых путей, выкидыши, септические аборты (C. fetus), синдром Guillain–Barr, инфицированная аорто–подвздошная аневризма.
Прогноз обычно благоприятный. В большинстве случаев пациенты выздоравливают самостоятельно или при помощи специфической терапии.
Многие виды инфекции Сampylobacter можно потенциально предупредить путем знания об основных механизмах передачи данного вида инфекции. Следует помнить, что перед употреблением мясо и домашняя птица должны быть хорошо приготовлены, руки надо хорошо вымыть до и после приготовления пищи. Родители должны быть информированы, что больные животные (щенки, котята) могут быть носителями тех же патогенов, что и человек, и что такие животные должны быть изолированы от детей. Необработанная вода и непастеризованное молоко не надо употреблять в пищу.
Таким образом, доказанная длительным использованием в клинической практике (более 20 лет) высокая детоксикационная эффективность Энтеродеза и возможность комбинирования его с другими лекарственными средствами позволяет рекомендовать данный препарат для лечения интоксикационного синдрома инфекционной этиологии как легкой и средней, так и тяжелой степени, особенно в ранние сроки от начала заболевания. Удобство использования, а также практически полное отсутствие побочных явлений позволяют рекомендовать применение Энтеродеза уже на догоспитальном этапе лечения, т. е. в поликлинических условиях [1].
Пищевые токсикоинфекции - острые инфекционные заболевания, вызываемые условно-патогенными бактериями, продуцирующими экзотоксины. При попадании микроорганизмов в пищевые продукты в них накапливаются токсины, которые могут вызывать отравления человека.
Краткие исторические сведения
На протяжении многих веков человечеству было известно, что употребление в пищу недоброкачественных продуктов, прежде всего мясных, может приводить к развитию рвоты и поноса. После описания П.Н. Лащенковым (1901) клинической картины стафилококковой пищевой интоксикации было установлено, что заболевания с синдромами диареи и интоксикации могут вызывать условно-патогенные бактерии. В результате работ отечественных исследователей эти заболевания отнесены к группе пищевых токсикоинфекций.
Что провоцирует / Причины Пищевых токсикоинфекций :
Пишевая токсикоинфекция вызывает большая группа бактерий; основные возбудители - Staphylococcus aureus, Proteus vulgaris, Bacillus cereus, Clostridium perfringens, Clostridium difficile, представители родов Klebsiella, Enterobacter, Citrobacter, Serratia, Enterococcus и др. Возбудители широко распространены в природе, обладают выраженной устойчивостью и способны размножаться в объектах внешней среды. Все они являются постоянными представителями нормальной микрофлоры кишечника человека и животных. Нередко у заболевших не удаётся выделить возбудитель, так как клиническую картину пищевых токсикоинфекций в основном определяет действие микробных токсических субстанций. Под действием различных факторов внешней среды условно-патогенные микроорганизмы изменяют такие биологические свойства, как вирулентность и устойчивость к антибактериальным препаратам.
Эпидемиология
Источник инфекции - различные животные и люди. Наиболее часто это лица, страдающие гнойными заболеваниями (панарициями, ангинами, фурункулёзом и др.); среди животных - коровы и овцы, болеющие маститами. Все они выделяют возбудитель (обычно стафилококки), попадающие в пищевые продукты в процессе их обработки, где и происходит размножение и накопление бактерий. Эпидемиологическую опасность представляют как больные, так и носители возбудителей. Период заразности больных небольшой; относительно сроков бактерионосительства данные противоречивы.
Возбудители других токсикоинфекций (С. perfringens, В. cereus и др.) люди и животные выделяют во внешнюю среду с испражнениями. Резервуаром ряда возбудителей могут являться почва, вода и другие объекты внешней среды, загрязнённые испражнениями животных и человека.
Механизм передачи - фекально-оральный, основной путь передачи - пищевой. Для возникновения пищевых токсикоинфекций, вызываемых условно-патогенными бактериями, необходима массивная доза возбудителей либо определённое время для его размножения в пищевых продуктах. Чаще всего пищевые токсикоинфекции связаны с контаминацией молока, молочных продуктов, рыбных консервов в масле, мясных, рыбных и овощных блюд, а также кондитерских изделий, содержащих крем (торты, пирожные). Основным продуктом, участвующим в передаче клостридий, является мясо (говядина, свинина, куры и др.). Приготовление некоторых мясных блюд и изделий (медленное охлаждение, многократное подогревание и др.), условия их реализации способствуют прорастанию спор и размножению вегетативных форм. В эстафетной передаче возбудителя участвуют различные объекты внешней среды: вода, почва, растения, предметы быта и ухода за больными. Продукты, содержащие стафилококковый и другие энтеротоксины, по внешнему виду, запаху и вкусу не отличаются от доброкачественных. Заболевания протекают в виде спорадических случаев и вспышек. Их чаще регистрируют в тёплое время года, когда создаются благоприятные условия для размножения возбудителей и накопления их токсинов.
Естественная восприимчивость людей высокая. Обычно заболевает большая часть лиц, употреблявших контаминированную пищу. Помимо свойств возбудителя (достаточная доза, высокая вирулентность) для развития заболевания требуется ряд способствующих факторов как со стороны микроорганизма, так и макроорганизма (сниженная сопротивляемость, наличие сопутствующих заболеваний и др.). Более восприимчивы индивидуумы из группы риска: новорождённые, ослабленные лица, пациенты после хирургических вмешательств либо длительно получавшие антибиотики и др.
Основные эпидемиологические признаки. Заболевания, вызываемые условно-патогенными микроорганизмами, распространены повсеместно. Вспышки носят семейный характер или при контаминации пищи на предприятиях общественного питания, заболевания могут быть рассеяны среди населения. Число заболевших определяет количество лиц, употреблявших контаминированный пищевой продукт, и может существенно варьировать. В частности, весьма характерны групповые заболевания среди пассажиров морских судов, туристов и членов детских и взрослых организованных коллективов. Вспышки обычно носят взрывной характер. Каких-либо особенностей по социально-возрастному и половому составу не выявлено. Заболевания чаще регистрируют в летнее время. В зависимости от вида пищевого продукта среди заболевших преобладают дети или взрослые. Кроме пищевых возможны и бытовые вспышки, в большинстве случаев возникающие в больничных условиях. Вспышки внутрибольничных инфекций, вызываемых С. difficile, связаны с длительным применением антибиотиков. При водных вспышках как следствие фекального загрязнения одновременно с условно-патогенными микроорганизмами выделяют и другие возбудители острых кишечных инфекций.
Патогенез (что происходит?) во время Пищевых токсикоинфекций :
Общее свойство для всех возбудителей пищевых токсикоинфекций - способность вырабатывать различные типы экзотоксинов (энтеротоксинов) и эндотоксинов (липополисахаридных комплексов). Именно благодаря особенностям действия этих токсинов отмечают определённое своеобразие в клинических проявлениях пищевых токсикоинфекций, обусловленных различными возбудителями. На исключительно важную роль бактериальных токсинов в развитии пищевых токсикоинфекций указывает и относительно короткий инкубационный период заболевания.
В зависимости от типов токсинов они могут вызывать гиперсекрецию жидкости в просвет кишечника, клинические проявления гастроэнтерита и системные проявления заболевания в виде синдрома интоксикации.
Токсины бактерий реализуют своё действие через выработку эндогенных медиаторов (цАМФ, ПГ, интерлейкинов, гистамина и др.), непосредственно регулирующих структурно-функциональные изменения органов и систем, выявляемые у больных с пищевой токсикоинфекцией.
Сходство патогенетических механизмов пищевых токсикоинфекций различной этиологии обусловливает общность основных принципов в подходах к лечебным мероприятиям при этих заболеваниях, а также при сальмонеллёзе и кампилобактериозе.
Симптомы Пищевых токсикоинфекций :
Инкубационный период. Составляет, как правило, несколько часов, однако в отдельных случаях он может укорачиваться до 30 мин или, наоборот, удлиняться до 24 ч и более.
Вместе с тем, клинические проявления пищевых токсикоинфекций имеют некоторые различия в зависимости от вида возбудителя. Стафилококковой инфекции свойственны короткий инкубационный период и бурное развитие симптомов заболевания. В клинической картине доминируют признаки гастрита: многократная рвота, резкие боли в эпигастральной области, напоминающие желудочные колики. Характер стула может не меняться. Температура тела в большинстве случаев остаётся нормальной или кратковременно повышается. Выраженное снижение артериального давления, цианоз и судороги можно наблюдать уже в первые часы заболевания, но в целом течение болезни кратковременное и благоприятное, поскольку изменения кардиогемодинамики не соответствуют степени водно-электролитных расстройств. В случаях пищевых токсикоинфекций, вызванных Clostridium perfringens, клиническая картина, сходная с таковой при стафилококковой инфекции, дополняется развитием диареи с характерным жидким кровянистым стулом, температура тела остаётся нормальной. При пищевых токсикоинфекциях, вызванных вульгарным протеем, стул приобретает зловонный характер.
Осложнения
Наблюдают крайне редко; наиболее часто - гиповолемический шок, острая сердечно-сосудистая недостаточность, сепсис и др.
Диагностика Пищевых токсикоинфекций :
Дифференциальная диагностика
Пищевые токсикоинфекции следует отличать от сальмонеллёза и других острых кишечных инфекций - вирусных гастроэнтеритов, шигеллёзов, кампилобактериоза, холеры и др., а также от хронических заболеваний ЖКТ, хирургической и гинекологической патологий, инфаркта миокарда. Поскольку основные патогенетические механизмы и клинические проявления пищевых токсикоинфекций мало отличимы от таковых при сальмонеллёзе, в клинической практике часто ставят обобщённый предварительный диагноз пищевых токсикоинфекций, а выделение сальмонеллёза из этой общей группы проводят в случае его бактериологического или серологического подтверждения.
Лабораторная диагностика
Основу составляет выделение возбудителя из рвотных масс, промывных вод желудка и испражнений. При высеве возбудителя необходимо изучение его токсигенных свойств. Однако в большинстве случаев выделяемость незначительна, а обнаружение конкретного микроорганизма у больного ещё не позволяет считать его виновником заболевания. При этом необходимо доказать его этиологическую роль либо с помощью серологических реакций с аутоштаммом, либо установлением идентичности возбудителей, выделенных из заражённого продукта и от лиц, употреблявших его.
Лечение Пищевых токсикоинфекций :
Лечение пищевых токикоинфекций аналогично таковому при сальмонеллёзе; показаны промывание желудка, сифонные клизмы, раннее назначение энтеросорбентов (активированный уголь и др.), витаминов. При необходимости проводят регидратационную терапию. Этиотропное лечение при неосложнённом течении пищевых токсикоинфекций не показано.
Профилактика Пищевых токсикоинфекций :
Эпидемиологический надзор следует проводить в рамках надзора за кишечными инфекциями и внутрибольничными инфекциями.
В основе профилактики заболеваний лежит соблюдение санитарно-гигиенического и технологического режима, норм и правил заготовки, приготовления, хранения и реализации пищевых продуктов. Необходимо обеспечить ветеринарно-санитарный контроль над животными, способными контаминировать почву, воду и окружающие предметы возбудителями. Для предупреждения стафилококковых отравлений проводят мероприятия, направленные на уменьшение носительства стафилококков у работников пищевых предприятий (санация носителей стафилококка в носоглотке и на кожных покровах, лечение хронических воспалительных заболеваний миндалин и верхних дыхательных путей). Необходимо отстранение от работы, непосредственно связанной с обработкой пищевых продуктов и их изготовлением, лиц с гнойничковыми заболеваниями кожи, фарингитами, ангинами и другими проявлениями стафилококковой инфекции. Большое значение имеют контроль за соблюдением санитарно-гигиенического режима на пищевых предприятиях и лечебно-профилактических учреждениях, соблюдение правил личной гигиены, постоянное проведение санитарно-просветительной работы. Важно правильно хранить пищевые продукты, исключить размножение в них возбудителей пищевых токсикоинфекций. Чрезвычайно важны термическая обработка пищевых продуктов, кипячение молока и соблюдение сроков их реализации.
Мероприятия в эпидемическом очаге
Аналогичны таковым при других острых кишечных инфекциях. Диспансерное наблюдение за переболевшими не регламентировано.
К каким докторам следует обращаться если у Вас Пищевые токсикоинфекции :
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Пищевых токсикоинфекций , ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .








Современные методы лечения




Острая кишечная инфекция
Кишечные инфекции – одно из самых распространенных заболеваний в мире.
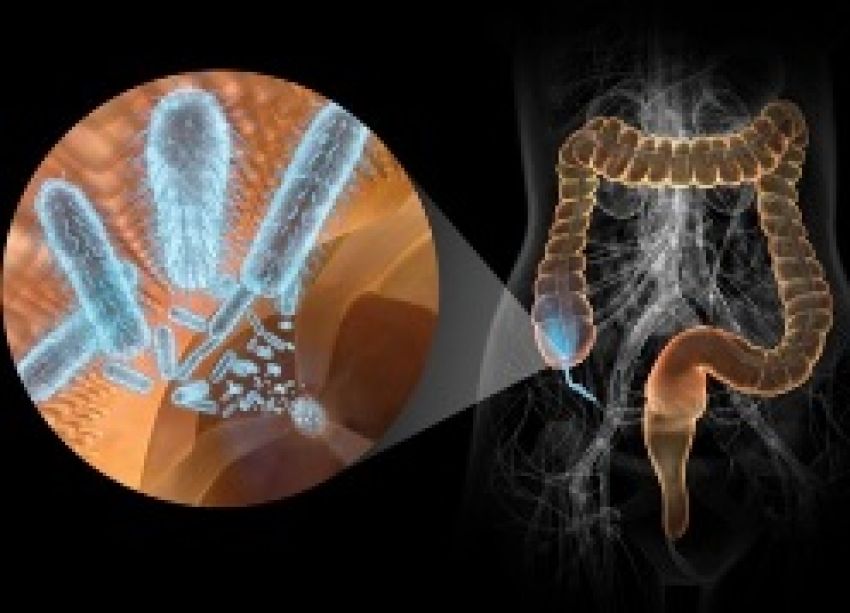
Острые кишечные инфекции (ОКИ) – группа острых инфекционных заболеваний человека, вызываемых различными инфекционными агентами (преимущественно бактериями), с алиментарным механизмом заражения, проявляющиеся лихорадкой и кишечным синдромом с возможным развитием обезвоживания и тяжелым течением в детской возрастной группе и у пожилых людей.
Заболеваемость кишечными инфекциями в мире, и в частности в России, достаточно высока. Ежегодно на планете заболевают более 500 млн. человек. Показатель заболеваемости в России доходит до 400 и более случаев на 100 тыс. населения.
Причины кишечных инфекций
Пищеварительный тракт состоит из ротовой полости, глотки, пищевода, желудка, тонкого кишечника (включающего 12-типерстную кишку, тощую кишку, подвздошную кишку), толстого кишечника. В слюне ротовой полости присутствует вещество – лизоцим, обладающее бактериостатическим действием. Это первый защитный барьер. Слизистая оболочка желудка имеет железы, вырабатывающиежелудочный сок (состоящий из соляной кислоты и пепсина). Соляная кислота является вторым барьером для патогенных микроорганизмов, который могут в нем погибнуть (однако это происходит не всегда). Слизистая тонкого кишечника покрыта многочисленными ворсинками, участвующими в пристеночном пищеварении, выполняющими защитную и транспортную функции. Кроме того, слизистая кишечника содержит секреторный иммуноглобулин – IgA, играющий роль в иммунитете организма человека.
Микрофлора, населяющая кишечник, делится на облигатную (обязательную для присутствия в кишечнике), к которой относятся бифидобактерии, лактобактерии, кишечные палочки, бактероиды, фузобактерии, пептококки. Облигатная флора составляет 95-98% от всех представителей. Функция облигатной флоры – защитная за счет конкурентного присутствия и участие в процессах пищеварения. Другая группа микроорганизмов, населяющих кишечник, называется факультативной (добавочной) флорой, к которой относятся стафилококки, грибы, условно-патогенные микроорганизмы (клебсиеллы, стрептококки, протей, синегнойная палочка, клостридии и другие). Добавочная флора также может участвовать в процессе пищеварения за счет выработки определенных ферментов, однако условно-патогенная при определенном росте может вызвать развитие кишечного синдрома. Вся остальная флора, попадающая извне, называется патогенной и вызывает острую кишечную инфекцию.
Какие возбудители могут явиться причиной острой кишечной инфекции?
Выделяют несколько видов кишечных инфекций в зависимости от этиологии:
- Кишечная инфекция бактериальная: cальмонеллез (Salmonellae enteritidis et spp.), дизентерия (Shigellae sonnae et spp.), иерсиниоз (Iersiniae spp.), эшерихиоз (Esherihiae coli энтероинвазивные штаммы), кампилобактериоз (энтерит, вызванный Campylobacter), острая кишечная инфекция, вызванная синегнойной палочкой (Pseudomonas aeruginosa), клостридиями (Clostridium), клебсиеллами (Klebsiellae), протеем (Proteus spp.), стафилококковое пищевое отравление (Staphilococcus spp.), брюшной тиф (Salmonellae typhi), холера (Vibrio cholerae), ботулизм (отравление ботулотоксином) и прочие.
- ОКИ вирусной этиологии (ротавирусы, вирусы группы Норфолк, энтеровирусы, коронавирусы, аденовирусы, реовирусы).
- Грибковые кишечные инфекции (чаще грибы рода Candida).
- Протозойные кишечные инфекции (лямблиоз, амебиаз).
Причины возникновения кишечных инфекций

Источник инфекции – больной клинически выраженной или стертой формой кишечной инфекции, а также носитель. Заразный период с момента возникновения первых симптомов болезни и весь период симптомов, а при вирусной инфекции – до 2х недель после выздоровления. Больные выделяют возбудителей в окружающую среду с испражнениями, рвотными массами, реже с мочой.
Механизм заражения – алиментарный (то есть через рот). Пути инфицирования – фекально-оральный (пищевой или водный), бытовой, а при некоторых вирусных инфекциях – воздушно-капельный. Большинство возбудителей острой кишечной инфекции высокоустойчивы во внешней среде, хорошо сохраняют свои патогенные свойства на холоде (в холодильнике, например). Факторы передачи – пищевые продукты (вода, молоко, яйца, торты, мясо в зависимости от вида кишечной инфекции), предметы обихода (посуда, полотенца, грязные руки, игрушки, дверные ручки), купание в открытых водоемах. Основное место в распространении инфекции отводится соблюдению или не соблюдению норм личной гигиены (мытье рук после туалета, ухода за больным, перед едой, дезинфекция предметов обихода, выделение личной посуды и полотенца заболевшему, сокращение контактов до минимума).
Восприимчивость к кишечным инфекциям всеобщая независимо от возраста и пола. Наиболее восприимчивы к кишечным патогенам – дети и лица преклонного возраста, лица с заболеваниями желудка и кишечника, люди, страдающие алкоголизмом.
Иммунитет после перенесенной инфекции нестойкий, строго типоспецифический.
Общие симптомы острых кишечных инфекций
Инкубационный период (с момента попадания возбудителя до появления первых признаков болезни) длится от 6 часов до 2х суток, реже дольше.
Для практически любой кишечной инфекции характерно развитие 2х основных синдромов, но в различной степени выраженности:
- Инфекционно-токсического синдрома (ИТС), который проявляется температурой от субфебрильных цифр (37? и выше) до фебрильной лихорадки (38° и выше). При некоторых инфекциях температуры нет совсем (например, холера), также отсутствие температуры или небольшой кратковременный подъем характерен для пищевого отравления (стафилококкового, например). Температура может сопровождаться симптомами интоксикации (слабость, головокружение, ломота в теле, подташнивание, иногда на фоне высокой температуры рвота). Часто инфекционно-токсический синдом является началом острой кишечной инфекции, длится от нескольких часов до суток, реже дольше.
- Кишечного синдрома. Проявления кишечного синдрома могут быть разными, но есть схожесть симптоматики. Этот синдром может проявляться в виде синдрома гастрита, гастроэнтерита, энтерита, гастроэнтероколита, энтероколита, колита.
Синдром гастрита характеризуется появлением болей в области желудка (эпигастрии), постоянной тошноты, рвоты после приема пищи и питья воды, причем ее может вызвать даже глоток жидкости. Рвота может быть многократной, приносящей недолговременное облегчение. Возможно разжижение стула и в течение короткого промежутка времени, иногда однократно.
Синдром гастроэнтерита сопровождается болями в животе в области желудка и околопупочной области, рвотой, появлением частого стула сначала кашицеобразного характера, а затем с водянистым компонентом. В зависимости от причины возникновения в стуле может меняться цвет (зеленоватый при сальмонеллезе, светло-коричневый при эшерихиозе, к примеру), а также появляться слизь, непереваренные остатки пищи.
Синдром энтерита характеризуется появлением только нарушений стула в виде частого водянистого стула. Частота зависит от вида возбудителя и степени инфицирующей дозы его, попавшей к конкретному больному.
Синдром гастроэнтероколита проявляется и рвотой, и частым жидким стулом, боли в животе становятся разлитого характера и практически постоянными, акты дефекации становятся болезненными, не приносящими облегчения, нередко примеси крови и слизи в стуле. Некоторые акты дефекации со скудным слизистым отделяемым.
Синдром энтероколита характеризуется только выраженным болевым синдромом по всему периметру живота, частым стулом вперемешку со скудным отделяемым.
Синдром колита проявляется боями в нижних отделах живота, преимущественно слева, акты дефекации болезненные, содержимое скудное с примесью слизи и крови, ложные позывы на стул, отсутствие облегчения в конце дефекации.
Такие синдромы как гастроэнтерит, гастроэнтероколит и энтероколит характерны для сальмонеллеза, энтероколит и колит – для дизентерии, эшерихиозы сопровождаются развитием гастроэнтерита, энтерит – ведущий синдром холеры, синдром гастрита может сопровождать пищевое отравление, однако это может быть и гастроэнтерит, вирусные кишечные инфекции протекают чаще в виде гастроэнтеритов.
Осложнения острых кишечных инфекций
- Дегидратация (обезвоживание) – патологическая потеря воды и солей неестественным путем (рвота, жидкий стул). Выделяют 4 степени обезвоженности у взрослых: - 1 степень (компенсированная) – потеря массы тела до 3% от исходной; 2 степень (переходная) – потеря массы тела 4-6% от исходной; 3 степень (субкомпенсированная) – 7-9% от исходной; 4 степень (декмпенчированная) – более 10% потери массы тела от исходной. Помимо снижения веса беспокоит сухость кожи и слизистых, жажда, снижение эластичности кожи, нарушения гемодинамики (учащение пульса, снижение АД).
- Одно из проявлений молниеносной дегидратации: дегидратационный шок с возможным летальным исходом. Имеет место глубокое обезвоживание и расстройства гемодинамики (критическое падение артериального давления).
- Инфекционно-токсический шок: возникает на фоне высокой температуры, чаще в начале болезни и сопровождается высокой токсинемией (высокой концентрацией токсинов бактерий в крови), серьезными нарушениями гемодинамики и возможным летальным исходом.
- Пневмония (воспаление легких).
- Острая почечная недостаточность.
Не секрет, что появление частого жидкого стула для большинства людей – не повод для обращения к врачу. Большинство стараются различными препаратами и методами остановить диарею и восстановить нарушенное состояние здоровья. Вместе с тем, простая (как кажется на первый взгляд) кишечная инфекция может обернуться серьезной проблемой с длительной потерей трудоспособности.
Симптомы, с которыми нужно обратиться к врачу незамедлительно:
- ранний детский возраст (до 3х лет) и дошкольный возраст ребенка;
- лица преклонного возраста (старше 65 лет);
- частый жидкий стул более 5 раз в сутки у взрослого;
- многократная рвота;
- высокая лихорадка с диареей и рвотой;
- кровь в стуле;
- схваткообразные боли в животе любой локализации;
- выраженная слабость и жажда;
- наличие хронических сопутствующих болезней.
Что нельзя категорически делать при подозрении на острую кишечную инфекцию:
Если появился частый жидкий стул, сопровождаемой болями в животе и температурой, то:
- Нельзя применять болеутоляющие лекарственные средства. В случае скрытых симптомов какой-либо хирургической патологии (холецистит, аппендицит, кишечная непроходимость и другие) снятие болевого синдрома может затруднить постановку диагноза и отложить оказание своевременной специализированной помощи.
- Нельзя самостоятельно применять закрепляющие средства (вяжущие) – такие как иммодиум или лоперамид, лопедиум и другие. При острой кишечной инфекции основная масса токсинов возбудителей концентрируется в кишечнике, и применение таких препаратов способствует их накоплению, что усугубит состояние пациента. Течение кишечной инфекции будет благоприятным при своевременном опорожнении содержимого кишечника вместе с токсинами патогенов.
- Нельзя делать самостоятельно клизмы, особенно с горячей водой.
- Нельзя применять греющие процедуры на живот (грелка с горячей водой, например), что безусловно способствует усилению воспалительного процесса, что усугубит состояние пациента.
- При наличии симптомов острой кишечной инфекции и подозрении на хирургическую патологию нельзя медлить и пытаться лечить подручными средствами (народные, гомеопатические и другие). Последствия промедления с обращением за медицинской помощью могут быть очень печальными.
Профилактика острой кишечной инфекции сводится к следующим мероприятиям:
Читайте также:

