Европейские рекомендации по лечению аутоиммунного энцефалита
Обновлено: 07.05.2024
06.01.2020 Никита Соловей, доцент кафедры инфекционных болезней БГМУ, кандидат мед. наук; Марина Андреева, ассистент кафедры нервных и нейрохирургических болезней БГМУ; Игорь Карпов, заведующий кафедрой инфекционных болезней БГМУ, доктор мед. наук, профессор. 20.10.2020 !-->
Пациенты с энцефалитами и менингоэнцефалитами часто встречаются в клинической практике врачей- неврологов, анестезиологов-реаниматологов, инфекционистов и, как показали последние годы, психиатров. Даже опытному врачу зачастую сложно заподозрить энцефалит и тем более быстро установить его этиологию, учитывая множество инфекционных и неинфекционных причин данного состояния и широкий спектр заболеваний, способных имитировать энцефалит.
Общие диагностические критерии для энцефалита или энцефалопатии инфекционного или аутоиммунного генеза (2013)
Большой критерий (обязательный для всех пациентов):
- качественное и/или количественное нарушение сознания, длящееся 24 ч и более и не объяснимое какими-либо иными причинами.
Малые критерии (необходимо выявление минимум двух для возможного и минимум трех для вероятного или подтвержденного (в случае наличия лабораторного подтверждения) диагноза энцефалита):
- лихорадка ≥ 38 °С в течение 72 ч до или после госпитализации;
- впервые возникшие генерализованные или фокальные судороги;
- впервые появившаяся очаговая неврологическая симптоматика;
- плеоцитоз цереброспинальной жидкости ≥ 5/мкл;
- патологические изменения паренхимы мозга при нейровизуализации;
- патологические отклонения на электроэнцефалограмме, сопоставимые с энцефалитом и не связанные с другими причинами.
Дифференциальная диагностика
Диагностические критерии общие как для энцефалита (любого генеза — и инфекционного, и аутоиммунного), так и для энцефалопатии. При первом контакте с пациентом в реальных условиях сложно сразу отличить энцефалит от энцефалопатии, а при выявлении энцефалита практически невозможно уверенно говорить о его инфекционном или аутоиммунном происхождении без дополнительных лабораторно-инструментальных методов диагностики.
Энцефалит представляет собой диффузное воспаление вещества головного мозга и является, по сути, патоморфологическим диагнозом, но на практике устанавливается клинически с опорой на лабораторно-инструментальные методы исследования (прежде всего результаты люмбальной пункции и нейровизуализации). Он может быть инфекционным (первичным, обусловленным непосредственно инвазией инфекционного агента, и вторичным, связанным с развитием индуцированных инфекционным агентом иммунных реакций), а также аутоиммунным (идиопатическим или паранеопластическим — ассоциированным с различными новообразованиями).
Энцефалопатия в отличие от энцефалита представляет собой клинический синдром качественного и/или количественного нарушения сознания пациента, в основе которого находятся разнообразные функциональные нарушения в центральной нервной системе (ЦНС). При первом осмотре иногда сложно дифференцировать энцефалопатию и энцефалит, однако при выявлении провоцирующего фактора и его быстром устранении энцефалопатия разрешается в короткие сроки (это нехарактерно для энцефалита — органического поражения головного мозга). Этиология энцефалопатии крайне разнообразна: системные инфекции (септическая энцефалопатия), метаболические расстройства (гипонатриемия, гипотиреоз, печеночная энцефалопатия, уремическая энцефалопатия), гипоксия, васкулиты, употребление психоактивных веществ и т. д.
Этиология 40–50 % всех энцефалитов до сих пор остается неуточненной. Различное происхождение энцефалитов зачастую диктует необходимость выбора диаметрально противоположных подходов к лечению пациента. Неверно выбранная тактика может существенно усугубить быстро ухудшающееся состояние пациента с энцефалитом и даже привести к развитию летального исхода в первые несколько суток заболевания, поэтому крайне важно дифференцировать хотя бы категории инфекционных и неинфекционных энцефалитов.
Распространенность и стадии течения
Результаты крупного по-пуляционного исследования распространенности различных видов энцефалита в США, опубликованные в 2018 году, показали, что частота аутоиммунных энцефалитов сопоставима с частотой энцефалитов инфекционного генеза.
В 2007–2011 годах Калифорнийский энцефалитический проект обратил внимание врачей на то, что аутоиммунный энцефалит с антителами к глутаматным рецепторам (анти-NMDAR-энцефалит) в возрасте до 30 лет диагностируется в 4,5 раза чаще, казалось бы, самого распространенного в популяции энцефалита, вызываемого вирусом герпеса 1-го типа.
Выделяют несколько различных вариантов аутоиммунного энцефалита, но наиболее часто в клинической практике встречается энцефалит с антителами к внеклеточным (клеточно-поверхностным и синаптическим) антигенам нейронов.
В настоящий момент описано по меньшей мере 18 видов аутоиммунного энцефалита с антителами к внеклеточным антигенам нейронов, и их спектр продолжает расширяться. Наиболее часто встречается анти-NMDAR-энцефалит. Для данного вида характерно острое или подострое начало, частый дебют с психотической симптоматикой (пациенты могут ошибочно госпитализироваться в психиатрические отделения), впоследствии появление неврологической симптоматики и ряда стремительно прогрессирующих угрожающих жизни осложнений. Очень часто у женщин анти-NMDAR-энцефалит ассоциирован с тератомой яичников (в большинстве случаев доброкачественной инкапсулированной опухолью, содержащей компоненты разных органов и тканей человека, в т. ч. нервную ткань).
Условно выделяют три стадии течения анти-NMDAR-энцефалита. В первой (продромальной) стадии заболевания у пациента могут быть лихорадка, легкий катаральный синдром, головная боль, миалгии, иногда рвота и диарея. Данная стадия длится от нескольких дней до 2–3 недель и характерна также для многих инфекционных поражений ЦНС. На второй стадии анти-NMDAR-энцефалита доминирует психотическая симптоматика (изменения личности и поведения, раздражительность, тревога, агрессия, галлюцинации, бред, нарушения памяти, концентрации внимания, кататония и т. д.), иногда могут развиваться судороги. На третьей стадии превалируют неврологические нарушения (дискинезии, дыхательные нарушения, прогрессирующее снижение уровня сознания вплоть до комы, вегетативная дизавтономия).
Многочисленные описания пациентов с анти-NMDAR-энцефалитом свидетельствуют, что психиатрические симптомы и двигательные расстройства встречаются наиболее часто, при этом доминируют орофациальные дискинезии, дистоническая поза конечностей, хореоатетоидные движения, окулогирный криз, миоклонус, опистотонус. У части пациентов неврологические проявления анти-NMDAR-энцефалита могут быть крайне скудны, если вообще наличествуют, а в клинике даже в разгар заболевания доминирует психотическая симптоматика, что существенно затрудняет раннюю диагностику, особенно при недостаточной настороженности врачей. Назначение при этом пациенту нейролептиков, даже атипичных, может приводить к непредсказуемым реакциям, имитирующим клинику злокачественного нейролептического синдрома, и должно наводить на мысль об органическом поражении нервной системы. Рефрактерные к противоэпилептической терапии судороги, вегетативная дизавтономия и длительные нарушения кратковременной памяти также могут регистрироваться у пациентов с анти-NMDAR-энцефалитом, однако встречаются значительно реже по сравнению с лимбическим энцефалитом.
Признаки энцефалита с антителами к внеклеточным антигенам нейронов:
- иногда может быть ассоциирован с некоторыми новообразованиями (часто доброкачественными);
- клинически проявляется симптоматикой, имитирующей нейроинфекции, психиатрические заболевания или внезапно возникшую эпилепсию;
- в основе развития — временное и чаще всего обратимое нарушение функции специфических рецепторов нейронов;
- хороший ответ на иммуномодулирующую терапию даже при длительном течении заболевания с полным выздоровлением или минимальными неврологическими и психиатрическими последствиями.
Лабораторно- инструментальные методы
В качестве методов лабораторно-инструментальной диагностики анти-NMDAR-энцефалита используют общеклиническое исследование цереброспинальной жидкости (ЦСЖ), методы нейровизуализации (МРТ головного мозга) и электроэнцефалографию (ЭЭГ). В ЦСЖ у 50–90 % пациентов выявляется плеоцитоз с преобладанием лимфоцитов, увеличение концентрации белка и нормальный уровень глюкозы. В то же время отсутствие отклонений в ЦСЖ не позволяет исключить аутоиммунный энцефалит. МРТ головного мозга в 30–50 % случаев выявляет изменения в виде зон гиперинтенсивного сигнала на T2/FLAIR в гиппокампе, коре полушарий или мозжечка, лобно-базальной и островковой областях, базальных ганглиях, стволе мозга, однако данные изменения не специфичны для анти-NMDAR-энцефалита и не коррелируют с его тяжестью, часто сохраняясь даже после выздоровления пациента. Изменения на ЭЭГ могут проявляться в виде очаговой или диффузной медленно-волновой активности во время эпизодов дискинезий, иногда регистрируется эпиактивность. Но наиболее специфичным для анти-NMDAR-энцефалита является паттерн extreme delta brush — ритмическая продолжительная дельта-активность с наложенной бета-активностью на каждой дельта-волне (выявляется у 30 % пациентов). Определенную роль для диагностики анти-NMDAR-энцефалита может играть ПЭТ с [18F]-флудезоксиглюкозой. В исследовании Kerik-Rotenberg N. et al (2019) анализировалось [18F]-ФДГ-ПЭТ пациентов с анти-NMDAR-энцефалитом. По сравнению со здоровыми добровольцами у них детектировался фокальный/билатеральный гиперметаболизм в височной доле, островке, мозжечке и выраженный билатеральный гипометаболизм в затылочных и теменных долях.
К сожалению, перечисленные методы лабораторно-инструментальной диагностики не всегда указывают на какие-либо патологические отклонения при анти-NMDAR-энцефалите, для подтверждения диагноза крайне важно определение специфических аутоантител класса IgG к NR1 субъединице глутаматного рецептора, в том числе у пациентов с нормальными данными ЦСЖ, нейровизуализации и ЭЭГ. Оптимально определять антитела к глутаматным рецепторам не только в крови, но и в ЦСЖ, поскольку у 12–15 % пациентов имеются анти-NMDAR-антитела в ЦСЖ при их отсутствии в сыворотке крови.
Дебют психиатрического заболевания или анти-NMDAR-энцефалит?
У каждого пациента с впервые возникшим эпизодом психоза важно вначале исключить органическое поражение нервной системы. В ноябре 2019 года в журнале Lancet Psychiatry опубликован международный консенсус по подходам к диагностике и лечению психозов аутоиммунного генеза. Для раннего выявления пациентов с аутоиммунным энцефалитом в психиатрической практике предложены две группы критериев:
В исследовании Shou M. et al. (2018) анализировались 340 пациентов, последовательно направленных в психиатрический стационар с впервые возникшей острой психотической симптоматикой. У 41 из 340 пациентов (12,1 %) обнаружены антинейрональные антитела (у 21 — анти-NMDAR, у 14 — CASPR2, у 9 — GAD65). При этом клинические проявления в двух группах пациентов — с аутоиммунным энцефалитом и психиатрическими заболеваниями — не позволяли убедительно провести дифференциальный диагноз без использования дополнительных методов. Другое исследование Baumgartner A. et al. (2018), ретроспективно анализируя 50 пациентов с лабораторно верифицированным аутоиммунным энцефалитом, обнаружило, что 40 пациентов на момент госпитализации имели характерные клинические признаки энцефалита, однако у 60 % из них первоначально был выставлен альтернативный диагноз (эпилепсия, психиатрическое заболевание, транзиторная ишемическая атака, деменция, менингит, церебеллит и пр.).
Таким образом, учитывая, что до 80 % пациентов с аутоиммунным энцефалитом могут ошибочно госпитализироваться в психиатрические отделения, все пациенты с впервые возникшим эпизодом острого психоза (длительностью до 3 месяцев) должны быть обследованы на наличие анти-NMDAR-антител. Оптимальный выбор: люмбальная пункция и нейровизуализационное исследование всем пациентам с впервые возникшей психотической симптоматикой.
Лечебные тактики
В основе лечения аутоиммунного энцефалита, в т. ч. энцефалита с антителами к глутаматным рецепторам, — применение иммуномодулирующей терапии (см. табл.). В качестве средств первой линии чаще всего используют пульс-терапию метилпреднизолоном внутривенно и/или нормальный внутривенный иммуноглобулин человека, а также плазмаферез. Части пациентов может быть необходима терапия второй линии (при этом диагноз аутоиммунного энцефалита, как правило, уже верифицирован лабораторно, и пациент не отвечает или имеет субоптимальный клинический ответ на терапию первой линии после 10-го дня), включающая ритуксимаб, циклофосфамид или их сочетание, а также альтернативные средства (тоцилизумаб, альдеслейкин). Добавление плазмафереза/иммуноадсорбции к иммуносупрессивной терапии метилпреднизолоном, ритуксимабом или циклофосфамидом может существенно ускорять выздоровление пациентов с аутоиммунным энцефалитом, особенно в случае его рефрактерности к лексредствам первой линии.

Если состояние пациента с энцефалитом стремительно ухудшается, при исключении/низкой вероятности инфекционного генеза должна быть назначена иммуномодулирующая терапия ex juvantibus по жизненным показаниям. Так, в описании серии случаев Sahoo B. et al. (2018) среди 9 детей с предполагаемым аутоиммунным энцефалитом только у 2 диагноз лабораторно верифицирован. При этом все дети ответили на иммуномодулирующую терапию первой или второй линии.
В случае рефрактерного к лечению аутоиммунного энцефалита показан онкопоиск. При выявлении опухоли ее необходимо удалить, так как сохранение новообразования не позволяет добиться выраженного клинического ответа на консервативную терапию даже при использовании современных иммуномодулирующих лексредств. В случае детекции аутоантител, потенциально ассоциированных с опухолями, необходимо повторять онкопоиск каждые три месяца, поскольку паранеопластические поражения нервной системы могут дебютировать задолго до выявления ассоциированных с ними новообразований.
Категории МКБ: Системные атрофии, поражающие преимущественно центральную нервную систему при болезнях, классифицированных в других рубриках (G13*), Энцефалит, миелит и энцефаломиелит (G04), Энцефалит, миелит и энцефаломиелит при болезнях, классифицированных в других рубриках (G05*)
Общая информация
Краткое описание
Аутоиммунные энцефалиты — неврологические заболевания, характеризующиеся поражением преимущественно серого вещества, в патогенезе которых основную роль играют аутоантитела к внутри-и/или внеклеточным структурам нервной системы, выступающие в качестве антигенов [1,2]. Представляет собой разнородную группу нервно-психических расстройств в виде острого или подострого течения с изменением сознания, когнитивных функций и нарушения движений.
Соотношение кодов МКБ-10 и МКБ-9
| МКБ-10 | МКБ-9 | ||
| Код | Название | Код | Название |
| G04 | |||
Дата разработки/пересмотра протокола: 2016 года.
Пользователи протокола: ВОП, врачи-неврологи, психиатры, инфекционисты, иммунологи, онкологи, радиологи.
Категория пациентов: дети.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
Классификация
Выделяют:
· паранеопластические неврологические синдромы, при которых поражение нервной системы связано с текущим онкологическим процессом [1,3];
· идиопатические АЭ, при которых поражение нервной системы может происходить в отсутствие онкологии [2];
В настоящее время антитела могут быть классифицированы в соответствии с местоположением распознаваемого антигена, на три основные группы [4]:
Внутриклеточные антигены:
Нейрональные нуклеарные/нуклеолярные:
· Hu (ANNA1), Ri (ANNA2), ANNA3, Ta (Ma2), Ma1, ZIC4.
Нейрональные или мышечно-цитоплазматические:
· Yo (PCA1), Tr, PCA2, GAD67, Gephyrin, CARP8, TG6 (TGM6), ENO1, striational muscle (Titin, RyR1, и т д.).
Пресинаптические структуры:
· GAD65, Amphiphysin.
Глиальные:
· CV2 (CRMP-5, POP66, олигодендроциты), Bergman (AGNA, SOX-1), ENO1.
Антигены, расположенные на поверхности клеточной мембраны или внутри клеточной мембраны:
· потенциал-или лиганд-зависимые ЦСЖ/плазменные мембранные структуры
Ионотропные каналы и рецепторы:
· AChR (взрослый, плод, alpha3, M1-types), NMDAR (NR1, NR2), AMPAR (GluR1, GluR2), Ca-каналы (P/Q-type), GlyR-alpha1, DPPX (DPP6, Kv4.2).
Метаботропные каналы и рецепторы:
· D1,D2,D3,D4,D5,GABABR1,GABABR3,mGluR1,mGluR5,5HT2A,5НТ2С.
Другие мембранные структуры:
· AQP4 (астроциты), MuSK, CASPR2, миелин олигодендроцит гликопротеин (МОГ), ганглиозиды включая лизолецитин-GM1, ENO1.
Внеклеточная локализация антигенов.
Синаптические белки:
· LGI1.
Клиническая классификация аутоиммунных энцефалитов [5]:
Паранеопластические аутоиммунные энцефалиты (с аутоантителами против новообразовании).
1. Паранеопластические аутоиммунные энцефалиты, ассоциированные с поверхностными антигенами клеточной мембраны:
· с анти-NMDAR антителами (тератома яичников);
· с анти-AMPAR антителами (рак молочной железы, мелкоклеточный рак легких);
· с анти-GABAвR антителами (мелкоклеточный рак легких).
2. Паранеопластические аутоиммунные энцефалиты, ассоциированные с внутриклеточными антигенами:
· с анти-Hu(ANNA-1) антителами (мелкоклеточный рак легких);
· с анти-Yo антителами (рак яичников, рак молочной железы);
· с анти-CV2(CRMP-5) антителами (мелкоклеточный рак легких, тимома);
· с анти-Ma2 антителами (опухоль тестикулярных зародышевых клеток).
Аутоиммунные энцефалиты, не связанные с паранеопластическим процессом
· аутоиммунный энцефалит с анти-VGKC антителами (нейромиотония (Isaacs syndrome), синдром Morvan);
· аутоиммунный энцефалит с анти-GAD антителами (сахарный диабет 1 типа, аутоиммунный тиреоидит);
· аутоиммунный энцефалит Хошимото (связаны с антителами щитовидной железы, включая анти-ТПО и/или анти-ТГ);
· аутоиммунный энцефалит при глютен чувствительной энтеропатии (целиакия).
У детей клинические формы АЭ, при которых аутоиммунная этиология была доказана/предполагается [8]:
- энцефалит, вызванный антителами к NMDA-рецепторам нейронов (аутоиммунная этиология доказана);
- лимбический энцефалит;
- энцефалит Хошимото;
- энцефалит Расмуссена;
- другие энцефалиты, связанные с эпилепсией или эпилептическим статусом;
- опсоклонус-Миоклонус.
Диагностика (стационар)
ДИАГНОСТИКА НА СТАЦИОНАРНОМ УРОВНЕ
Диагностические критерии на стационарном уровне:
Жалобы [6]:
Психоневрологические симптомы:
· поведенческие проблемы, изменение личности;
· депрессия, тревога, страх, галлюцинации, психоз;
· синдром дефицита внимания/гиперактивности (СДВГ);
· обсессии, компульсии;
· анорексия.
Неврологические симптомы:
· потеря памяти или амнезия;
· двигательные расстройства и дистония: моторные или вокальные тики, хорея, миокимия, парезы взора, катотония, паркинсонизм, ригидность, острая дистония;
· эпилепсия: генерализованные, парциальные, миоклонус, икота (миоклонические судороги диафрагмы);
· афазия, мутизм;
· нистагм, атаксия;
· расстройства сна (сонливость, вялость, апатия, инверсия сн;
· снижение уровня сознания, ступор, потеря сознания;
· вегетативные нарушения (нестабильность АД, гиповентиляция, дыхательная недостаточность).
Гастроинтестинальные симптомы:
· диарея (anti-DPPX, DPP6).
Почечные симптомы:
· гипонатриемия (anti-LGI1) [4].
Анамнез заболевания
Заболевание развивается стадийно:
В продромальной фазе:
· лихорадка;
· головная боль;
· рвота, диарея (симптомы, напоминающие вирусную инфекцию).
В стадии развернутых проявлений в течение 2 недель развиваются психиатрические и поведенческие нарушения:
· беспокойство;
· вычурное поведение;
· страх, параноидальные мысли, бред величия/бред религиозного содержания;
· бессонница;
· потеря кратковременной памяти, незаметная из-за выраженной психиатрической симптоматики, на фоне быстрого распада языковых функций, вплоть до развития мутизма.
NB! Симптомы быстро прогрессируют, появляются нарушения сознания и эпилептические приступы [9]. В этой стадии характерны кататония и дискинезии.
Двигательные нарушения носят разнообразный характер – наряду с дистоническими позами могут отмечаться ригидность и опистотонус, в виде оро-лингво-фациальных дискинезий, окулогирных кризов и хореоатетоза. Перечисленные двигательные нарушения могут интерпретироваться как судороги и служить поводом для наращивания противосудорожной терапии. Отмечаются выраженные вегетативные расстройства – гипертермия, нарушение частоты сердцебиений (описывается как тахикардия, так и брадикардия), гиперсаливация, колебание показателей артериального давления, недержание мочи, гиповентиляция (у детей в 16% случаев)[9].
Физикальное обследование:
· двигательные нарушения с учетом преобладания нарушения экстрапирамидной и пирамидной систем, а также с учетом нарушения вегетативной
нервной системы.
Лабораторные исследования:
· исследование ЦСЖ [6] – лимфоцитарный плеоцитоз, повышенное содержание белка и иммуноглобулинов G, специфические олигоклональные иммуноглобулины, обнаружение антител к нейрональным рецепторам;
· исследование крови на нейрональные антитела к NMDAR (NR1, NR2), AMPAR (GluR1, GluR2), Hu (ANNA1), Ri (ANNA2), Ta (Ma2), Yo (PCA1), GABAвR1, GABAвR3, mGluR1, mGluR5, 5HT2A – обнаружение антител к нейрональным рецепторам.
Инструментальные исследования:
· МРТ головного и спинного мозга – гиперинтенсивные очаги на Т2-взвешенных изображениях и в режиме FLAIR;
· ЭЭГ: определяется диффузное замедление (дельта- и тета-диапозона), иногда фокальное замедление;
· иммуногистохимическое исследование – признаки воспалительных изменений в головном мозге.
Диагностический алгоритм:
· схема алгоритм 1– диагностика аутоиммунных энцефалитов;
· схема алгоритм 2 – интерпретация тестов на антитела
· схема алгоритм 3 – диагностика аутоиммунного лимбического энцефалита
Алгоритм 1 – Диагностические шаги при постановке диагноза АЭ [6].

Алгоритм 2 – Алгоритм интерпретации тестов на антитела [15]

Алгоритм 3 – Диагностика ЛЭ.

Перечень основных диагностических мероприятий:
· общий анализ крови с гематокритом и тромбоцитами;
· биохимический анализ крови (глюкоза, печеночные трансаминазы, общий, прямой билирубин, мочевина, креатинин, общий белок и его фракции);
· электролиты крови (калий, натрий, кальций, хлориды);
· коагулограмма;
· общий анализ мочи;
· люмбальная пункция;
· МРТ головного мозга в режимах Т1, Т2, FLAIR, DWI, PWI;
· ЭЭГ (ЭЭГ-мониторинг сна).
Перечень дополнительных диагностических мероприятий:
· исследование крови и цереброспинальной жидкости на нейрональные антитела к NMDAR (NR1, NR2), AMPAR (GluR1, GluR2), Hu (ANNA1), Ri (ANNA2), Ta (Ma2), Yo (PCA1), GABAвR1, GABAвR3, mGluR1, mGluR5, 5HT2A;
· КТ/МРТ грудной клетки, брюшной полости, малого таза при подозрение на онкологическую патологию;
· иммуноферментный анализ на онкомаркеры.
· ПЭТ/ОФЭТ – головного мозга;
· биопсия головного мозга – при прогрессировании очаговой и/или общемозговой симптоматики и неясности окончательного диагноза (вопрос решается совместно с нейрохирургами);
· анализ на генетику.
Диагностика энцефалита Расмуссена по КТ, МРТ
а) Терминология:
1. Сокращения:
• Энцефалит Расмуссена (ЭР)
2. Синонимы:
• Хронический фокальный (локализованный) энцефалит
3. Определение:
• Хроническое прогрессирующее одностороннее воспаление мозговой ткани неясной этиологии
• Характеризуется рефрактерной фокальной эпилепсией, прогрессирующей гемиплегией, когнитивными нарушениями
б) Визуализация:
2. КТ признаки энцефалита Расмуссена:
• Бесконтрастная КТ:
о Изначально изменения отсутствуют → атрофия
• КТ с контрастированием:
о Контрастирование обычно не наблюдается
о Редко преходящее контрастирование мягкой мозговой оболочки и/или коры
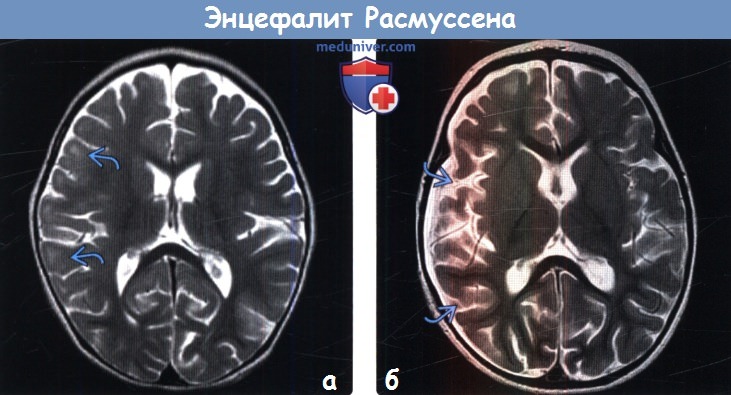
(а) МРТ, Т2-ВИ, аксиальный срез: у годовалого ребенка с фокальными судорожными приступами, устойчивыми к лекарственной терапии, и прогрессирующим левосторонним гемипарезом в субкортикальном белом веществе правого полушария головного мозга определяется легкое повышение интенсивности сигнала.
(б) МРТ, Т2-ВИ, аксиальный срез: у этого же пациента через месяц наблюдается выраженная потеря объема мозговой ткани правого большого полушария и углубление борозд. На серии МР-томограмм при энцефалите Расмуссена прослеживается прогрессирующая атрофия головного мозга в сочетании с изменениями сигнальных характеристик коры/субкортикального белого вещества.
4. Радионуклидная диагностика:
• Сцинтиграфия с Тс-99m ГМПАО: ↓ перфузии даже при нормальной МР-картине
• ПЭТ/ОФЭКТ:
о Диффузное ↓ метаболизма/перфузии в полушарии
о Перекрестный мозжечковый диашиз
о Преходящий гиперметаболизм может быть связан с недавно перенесенным судорожным приступом (редко):
- Мультифокальный гиперметаболизм поданным исследования с С-11-метионином
5. Рекомендации по визуализации:
• Лучший инструмент визуализации:
о МРТ + оценка клинических симптомов + соответствующие признаки на ЭЭГ
• Советы по протоколу исследования:
о МРТ с контрастным усилением ± ПЭТ (ФДГ)
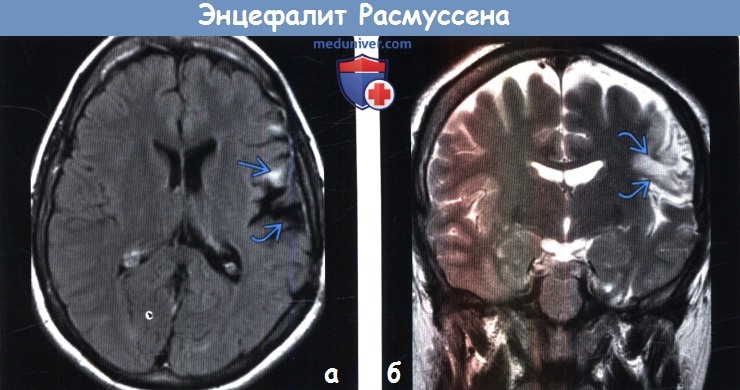
(а) МРТ, FLAIR, аксиальный срез: у пациента с энцефалитом Расмуссена (подтвержден по данным биопсии) определяется расширение левой сильвиевой борозды, обусловленное потерей объема мозговой ткани и сочетающееся с субкортикальным глиозом лобной покрышки.
(б) МРТ, Т2-ВИ, корональный срез: у того же пациента определяется потеря объема мозговой ткани и глиоз лобной покрышки слева.
в) Дифференциальная диагностика энцефалита Расмуссена:
1. Синдром Стерджа-Вебера:
• Пламенеющий невус лица и контрастируемая ангиома мягкой мозговой оболочки
• Прогрессирующая полушарная атрофия
• Кальцификация коры
2. Синдром MELAS (митохондриальная энцефаломиопатия, лактоацидоз и инсультоподобные эпизоды):
• Острый: может вызывать повышение интенсивности сигнала от коры (наиболее часто в теменно-затылочной области) + ДВИ
• Хронический: атрофия коры, формирование лакун (базальные ганглии, таламус)
3. Синдром Дайка-Давыдова-Массона (полушарный инфаркт в пренатальном/неонатальном периоде):
• Односторонняя церебральная атрофия
• Компенсаторное утолщение костей черепа
• Приподнятость каменистого гребня височной кости и гипераэрация околоносовых пазух
• Развивается после инфаркта во внутриутробном или перинатальном периоде
4. Фокальная кортикальная дисплазия:
• Может вызывать полушарный эпилептический статус, что приводит к односторонней потере объема мозговой ткани
5. Другие аутоиммунные воспалительные заболевания:
• Односторонний васкулит головного мозга, паранеопластические синдромы, онконейрональные антитела
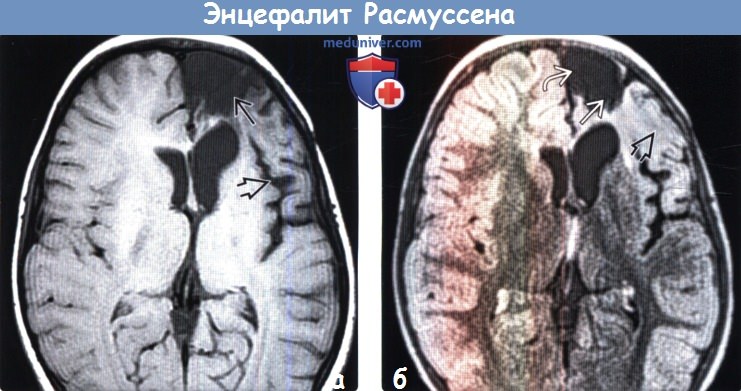
(а) МРТ, Т1-ВИ, аксиальный срез: у четырехлетней девочки с хроническим локализованным энцефалитом Расмуссена определяется выраженная атрофия лобной доли. Обратите внимание на расширение лобного рога левого бокового желудочка заместительного генеза и расширение круговой борозды островка что является признаком потери объема островковой доли.
(б) МРТ, FLAIR, аксиальный срез: у того же пациента определяется атрофия верхней и средней лобных извилин Атрофия и субкортикальный глиоз распространяются на нижнюю лобную извилину слева.
г) Патология:
1. Общие характеристики энцефалита Расмуссена:
• Этиология:
о Этиология и патогенез энцефалита Расмуссена (ЭР) остаются неизвестными
о Накапливаются данные о том, что заболевание носит аутоиммунный характер:
- Антитело-опосредованная, Т-клеточная цитотоксичность и индуцированная микроглией денерация
• Генетика:
о Возможно существование вирусного триггера генетически обусловленной иммунодисфункции
• Ассоциированные аномалии:
о Сочетание трех потенциальных факторов может инициировать/закреплять процессы, ведущие к поражению мозговой ткани:
- Вирусная инфекция
- Аутоиммунные антитела
- Аутоиммунные цитотоксические Т-лимфоциты
2. Стадирование и классификация:
• Три стадии течения энцефалита Расмуссена (ЭР):
о Продромальная стадия: неспецифическая симптоматика, низкая частота судорожных приступов и легкая гемиплегия
о Острая стадия: частые судорожные приступы, часто парциальная непрерывная эпилепсия, прогрессирующий гемипарез, когнитивные нарушения
о Стадия резидуальных изменений: перманентная и стабильная неврологическая симптоматика и сохраняющиеся судорожные приступы
• Классификация и стадирование: МРТ (Т2-ВИ):
о Стадия 1: отек/гиперинтенсивный сигнал
о Стадия 2: нормальный объем мозговой ткани/гиперинтенсив-ный сигнал
о Стадия 3: атрофия/гиперинтенсивный сигнал
о Стадия 4: прогрессирующая атрофия и нормальные сигнальные характеристики
3. Макроскопические и хирургические особенности:
• Полушарная атрофия коры
• Зона поражения часто окружена неизменной корой или зоной легкого воспаления:
о Данные при биопсии могут вводить в заблуждение
д) Клиническая картина:
1. Проявления энцефалита Расмуссена:
• Наиболее частые признаки/симптомы:
о Рефрактерная эпилепсия, клонические судороги
о Прогрессирует до парциальной непрерывной эпилепсии
о Другие: гемипарез, зрительные и сенсорные нарушения, дизартрия, дисфазия, изменения личности
• Клинический профиль:
о Дети младшего возраста с прогрессирующей парциальной эпилепсией, некупируемой лекарственными средствами
• Клиническое течение:
о Парциальные комплексные судорожные приступы с увеличивающейся частотой возникновения
о У 20% пациентов проявляется эпилептическим статусом
о Вслед за этим наступает рост тяжести судорожных приступов, прогрессирующий гемипарез, нарушение когнитивной функции, смерть
• ЭЭГ: изначально картина от нормальной до персистирующего одностороннего замедления ± эпилептогенная активность
• СМЖ: ± олигоклональные полосы
2. Демография:
• Возраст:
о Обычно начинается в детстве (6-8 лет)
о В 10% случаев развивается у подростков или взрослых
• Пол:
о М = Ж
• Этническая принадлежность:
о Отсутствует
• Эпидемиология:
о Наличие предшествующего эпизода воспаления (50% случаев):
- Тонзиллит, инфекция верхних дыхательных путей, средний отит
3. Течение и прогноз:
• В большинстве случаев гемиплегия и нарушение когнитивной функции
• Для пациентов старшего возраста характерен более длительный продромальный период и затяжное течение
• Неблагоприятный прогноз
• Развитие гемиплегии неизбежно ± лечение
4. Лечение:
• Заболевание рефрактерно к противосудорожным препаратам
• ± преходящее улучшение состояния при плазмоферезе, внутривенной терапии иммуноглобулинами, лечении стероидными препаратами, агентами, направленными на В-клетки и Т-клетки
• При ЭР полное излечение судорожных приступов достигается только за счет хирургического вмешательства:
о функциональная гемисферэктомия/центральное разобщение
о Гемисферэктомия
Инфекции с осложнением в виде энцефалита у ребенка
а) Микоплазменный энцефалит. Микоплазма, хотя и не является вирусом, также нуждается в механизме репликации клетки-хозяина. Энцефалит микоплазменной этиологии иногда может иметь острое начало одновременно с респираторными симптомами или чаще в виде вторичного явления с атипичным иммунным ответом на инфекцию в ЦНС (Abramovitz с соавт., 1987). В одном из исследований были представлены плохие продолжительные неврологические последствия у пациентов с микоплазменным энцефалитом (Koskiniemi et al., 1991). Диагноз ставится при выделении ДНК из ликвора и/или серологическим методом определения продукции IgM, IgG и IgA к микоплазме в крови и/или СМЖ (Bencina et al., 2000).
Несмотря на то, что макролидные антибиотики эффективны против микоплазменного агента и должны использоваться при острой системной инфекции, в отдельных случаях трудно установить, является ли энцефалит первичным или иммунной реакцией. Однако проникновение макролидов в ЦНС недостаточно, и эффективность в преодолении гематоэнцефалического барьера не определена.
б) Респираторные вирусные инфекции:
1. Гриппозный энцефалит (грипп А и В). Несмотря на то, что у большинства новорожденных и детей, зараженных вирусом гриппа, развивается легкая респираторная инфекция, могут встречаться более тяжелые проявления болезни, включая неврологические симптомы (Wang et al., 2003; Maricich et al., 2004). Неврологическое поражение часто стойкое с серьезными последствиями или смертельным исходом, и включает острый энцефалит, синдром Рейе, острую некротическую энцефалопатию и миелит, а также аутоиммунные состояния типа синдрома Гийена-Барре. Вирусологическая диагностика основана на выделении вируса или определении антигенов в носоглоточном секрете, а так же на выявлении РНК в ликворе с помощью ПЦР или сероконверсией (Studahl, 2003).
Первоначально о повышенном уровне заболеваемости грипп-ассоциированным энцефалитом/энцефалопатией было заявлено у японских детей. В одном исследовании у 89 детей со средним возрастом 3,8 лет, ни один из которых не получал аспирин, заболевание отмечалось в течение восьми сезонов гриппа (1994-2002 гг.) (Togashi et al., 2004). После короткого респираторного продромального периода у большинства пациентов быстро развилось коматозное состояние с (или без) судорогами; 37% умерли, 19% имели неврологические последствия. В образцах плазмы и ликвора у двоих пациентов, которые умерли от молниеносного течения болезни, отмечалось значительное повышение уровня интерлейкина-6 (ИЛ-6) и фактора некроза опухоли-α (ФНО-α).
При посмертном исследовании одного летального случая выявлен вазогенный отек мозга с генерализованной васкулопатией, подтверждая повреждение эндотелия сосудов, вероятно, за счет высокой активности цитокинов. Другие исследования показали повышенный уровень системных и ликворных цитокинов при гриппозном энцефалите (ИЛ-6 и ФНО-а), так же как увеличение цитохрома С, свидетельствующего о вторичной смерти клеток путем апоптоза в результате гиперцитокинемии (Hosoya et al., 2005, Nunoi et al., 2005). Наиболее высокий уровень отмечен у пациентов с летальным исходом.
2. Энцефалит птичьего гриппа. На сегодняшний день птичий грипп A (H5N1) возникает у небольшой группы лиц, обычно там, где имеется контакт с больными птицами (de Jong et al., 2006). Как и при тяжелой респираторной инфекции, возможно сочетанное поражение многих органов с комой, в большинстве случаев с летальным исходом.
3. Аденовирусный энцефалит. Чаще встречается у детей, обычно проявляясь в виде легкой простудной или гастроинтестинальной болезни. К более тяжелым осложнениям относятся дыхательная недостаточность, энцефалопатия и хронические последствия, включая облитерирующий бронхиолит и продолжительное повреждение ЦНС (Chuang et al., 2003). Аденовирус может быть причиной асептического менингита, однако некоторые штаммы, такие как аденовирус 7 типа, часто вызывают менингоэнцефалит с более тяжелым течением. Другие неврологические синдромы, связанные с аденовирусом — миелит, подострый очаговый аденовирусный энцефалит и Рейе-подобный синдром (Straussberg et al., 2001).
У детей с ослабленным иммунитетом аденовирус может быть причиной полиорганной недостаточности с энцефалитом, печеночной коагулопатией и смертью. Диагноз выставляется на основе изоляции вируса или определения антигенов в носоглоточном секрете или стуле, так же как определение ДНК методом ПЦР в спинномозговой жидкости.
Редкие проявления энцефалопатии возникали при ротавирусных гастроэнтеритах, но, вероятно, это не связано с проникновением вирусов в ткани ЦНС (Nakagomi и Nakagomi, 2005). Энцефалитные проявления с припадками и расстройствами сознания могут быть осложнением других невирусных диарейных заболеваний, включая энтеритные инфекции Shigella (Mulligan et al., 1992) и C. jejuni (Nasralla et al., 1993).
г) Постинфекционные энцефалиты. Постинфекционные энцефалиты, вероятно, самый распространенный тип острых энцефалитов в европейских странах. Поскольку ни в одном из этих случаев не обнаруживают вирус, они скорей всего не являются результатом прямого вирусного вторжения в ЦНС, а вероятно возникают благодаря ответу иммунной системы на инфекционный агент в тканях хозяина посредством механизмов, обсуждаемых в отдельной статье на сайте при остром диссеминированном энцефаломиелите (ADEM).
Большинство случаев постинфекционного энцефалита являются осложнением заболеваний, сопровождающихся экзантематозной сыпью. Однако многие случаи возникают вследствие недиагностированных инфекционных заболеваний. Частота постинфекционных энцефалитов оценивается приблизительно, так как во многих случаях не доступны данные патогенеза и механизма острой энцефалитной картины. Так, при свинке менингит возникает очень часто, но доказательства перивенозного энцефалита представлены лишь в некоторых случаях (Johnson, 1982а). В ряде случаев болезнь, предшествующая началу энцефалита, не диагностируется и не идентифицируется ни один вирус, даже ретроспективно. Диагноз вирусной инфекции основывается на клинических проявлениях и течении продромального периода.
Корь — наиболее частая причина экзантематозной сыпи; таким образом, заболеваемость энцефалитом будет зависеть от заболеваемости корью и уровня иммунизации против кори среди населения. Острый коревой энцефалит начинается через 6-8 дней после первых высыпаний и встречается в 1 из 1000 случаев (Johnson et al, 1984). Несмотря на вариабельность интенсивности, заболевание часто протекает тяжело, со смертельными исходами в 10% случаев и частыми осложнениями, включая припадки, двигательные нарушения и умственную отсталость. Трудности в обучении и поведенческие расстройства характерны для детей с очевидным полным выздоровлением. Описаны редкие случаи постинфекционного энцефалита вследствие вакцинации против кори, но их частота значительно меньше, чем энцефалиты, связанные с диким вирусом кори (Landrigan и Witte, 1973). Постинфекционный энцефалит, ассоциированный с пятой болезнью (парвовирус В19) и внезапной сыпью (HHV-6 и 7) встречается очень редко.
В странах с вакцинацией против кори, свинки и краснухи, rubella (коревая краснуха) в настоящее время является редким заболеванием и случаи острого краснушного энцефаломиелита, следовательно, крайне редки. Постинфекционный краснушный энцефалит — тяжелое заболевание со смертностью примерно в 20% случаев, возникающее в 1 из 5000 острых случаев краснухи. Может развиваться одновременно с сыпью или даже через неделю или позже.
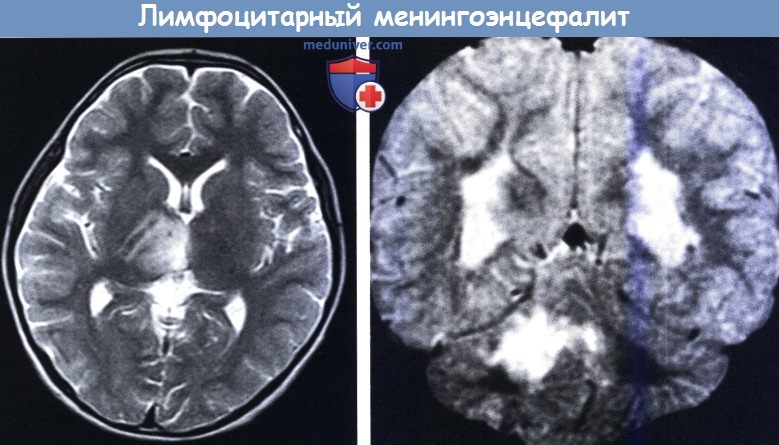
MPT (слева): патологический сигнал от правого таламуса и среднего мозга, вызванный параинфекционным лимфоцитарным менингоэнцефалитом.
12-последовательность (справа): более обширная зона интенсивного сигнала от правого полушария мозжечка и двусторонний интенсивный сигнал от супратенториального белого вещества полушарий (четырехлетняя девочка с мозжечковой атаксией с внезапным началом,
продолжающейся несколько недель, с легким ступором, который исчез через несколько дней).
1. Патология. Патогенез постинфекционного энцефалита имеет отличительные черты. Представлен множественными очагами перивенозной демиелинизации. Осевые цилиндры обычно лучше сохраняются, чем миелин. Определяются лейкоцитарные муфты вокруг вен и венул из мононуклеарных клеток, в демиелинизированных участках видны клетки микроглии и макрофаги.
2. Клинические проявления. Клинические проявления те же, что и при уже описанных типах энцефаломиелита. В большинстве случаев имеется внезапное начало с расстройствами сознания и припадками. Эти симптомы появляются в среднем через шесть дней (до 21 дня) после появления инфекции верхних дыхательных путей или экзантемы, в большинстве случаев у детей в возрасте старше двух лет. Могут быть представлены различные неврологические проявления, включая гемипарез, экстрапирамидные симптомы, атаксию, лицевые параличи, нистагм и поражение черепных нервов (Kennard и Swash, 1981; Marks et al, 1988). Результаты нейровизуализации могут быть отрицательными, а при МРТ обычно выявляются участки повышения сигнала преимущественно в белом веществе полушарий и иногда с вовлечением мозжечка. Характерны вовлечение зрительного бугра и базальных ганглиев. Течение заболевания варьирует от случая к случаю и зависит от причинных факторов. Уровень смертности низкий. Три четверти случаев протекают быстро, с выздоровлением в течение двух недель.
Другим вариантом постинфекционного энцефалита является острый геморрагический лейкоэнцефалит. Это фульминантное заболевание, которое характеризуется быстрой прогрессией очаговых неврологических симптомов и признаков, особенно гемиплегии, сопровождающейся беспокойством, комой и лихорадкой. Ликвор при этом ксантохромный в 20% случаев и показывает полиморфноядерный плеоцитоз. В периферической крови часто представлен выраженный лейкоцитоз. Возможно бифазное течение. Демиелинизирующие повреждения имеют геморрагический характер из-за некротизирующего ангиита венул и капилляров. В постановке диагноза может помочь КТ и МРТ, указывая на наличие больших гиподенсных участках иногда с геморрагическим компонентом (Watson et al., 1984, Huang et al., 1988). При некоторых случаях острого геморрагического лейкоэнцефалита удавалось выделить ДНК и РНК герпесвирусов, но до сих пор неясно, вовлекаются ли эти вирусы в патологический процесс (An et al., 2002).
Лечение постинфекционного энцефалита в основном такое же, как при всех острых энцефалитных заболеваниях. Значение стероидной терапии остается неясным, несмотря на весьма впечатляющее немедленное действие в отдельных случаях (Pasternak et al, 1980). В некоторых случаях применяли внутривенное введение иммуноглобулинов (Kleiman и Brunquell, 1995).
д) Энцефалит ствола мозга и мозжечка. При рентгенографии в случаях острого диссеминированного энцефалита может выявляться вовлечение ствола мозга. Ограниченное вовлечение ствола мозга не характерно и может встречаться при первичных энцефалитах (Kaplan и Koveleski, 1978; North et al., 1993; Duarte et al., 1994) и реже, при постинфекционных типах.
Среди клинических проявлений выделяют лихорадку, системные симптомы и асептический менингит вместе с симптомами и признаками дисфункции ствола головного мозга. Заметно поражение глазодвигательных нервов и нижней лицевой пары, что может сопровождаться заторможенностью и признаками вовлечения длинных нервных путей, что приводит к пирамидальным и мозжечковым проявлениям. Участие черепных нервов и атаксия могут имитировать синдром Миллера-Фишера, который некоторыми авторами рассматривается в качестве формы энцефалита ствола мозга. МРТ может продемонстрировать повышенный сигнал в ножках мозга, в мосте, мозжечке и продолговатом мозге (Ormerod et al., 1986, Hosoda et al., 1987) и энцефалит следует отличать от опухоли ствола мозга, абсцесса или других нейрохирургических проблем. Всегда следует помнить о возможности ромбэнцефалита, вызванного L. monocytogenes, при эффективности антибиотикотерапии (Frith et al., 1987).
е) Острый очаговый энцефалит. Острый очаговый энцефалит, поражающий ограниченный участок при инфекции коксаки-вирусом А9 (Roden et al., 1975) и ЕСНО-вирусом 25 (Peters et al., 1979), может привести к острой гемиплегии или гемихорее. Лакунарные повреждения в центральном сером веществе или внутренней капсуле могут быть результатом сосудистых инфарктов или очаговых церебритов.
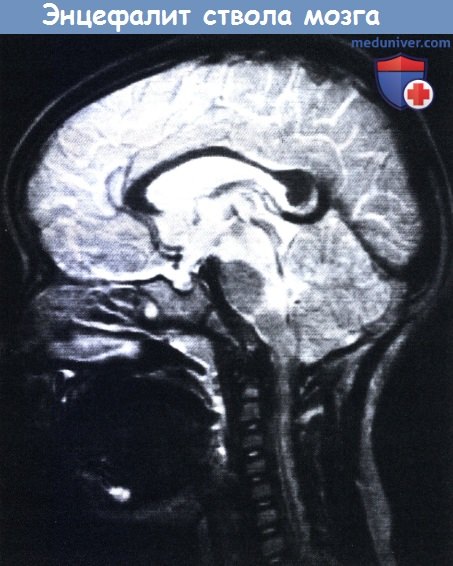
Энцефалит ствола мозга у четырехлетней девочки с клиникой ступора и множественными параличами черепных нервов.
При МРТ выявлено усиление сигнала от ножек мозга и дорсальной части моста.
При повторной МРТ через два месяца патологических изменений не обнаружено.
Читайте также:

