Эзофагит симптомы при вич
Обновлено: 26.04.2024
Для начала разберемся в терминах: гастроэзофагеальная рефлюксная болезнь – неэрозивная рефлюксная болезнь – функциональная изжога. Все эти состояния роднит общий симптом – изжога.
Одним из кардинальных симптомов гастроэзофагеальной рефлюксной болезни (ГЭРБ) является изжога, а основным механизмом развития заболевания – расслабление нижнего пищеводного сфинктера, приводящее к поступлению содержимого желудка и/или двенадцатиперстной кишки в пищевод. На первый взгляд все понятно: расслабляется нижний пищеводный сфинктер, что приводит к забросу кислого содержимого желудка в пищевод, и возникает изжога. Однако, как показали последние исследования, все оказывается сложнее: реально расслабление нижнего пищеводного сфинктера редко связано с появлением симптомов, в частности изжоги, как у больных ГЭРБ, так и у здоровых людей.
Спектр ГЭРБ достаточно обширен – от неэрозивной рефлюксной болезни (НЭРБ) (когда по данным эндоскопического исследования отсутствуют изменения слизистой оболочки пищевода) до рефлюкс-эзофагита (воспаления, вплоть до изъязвления, слизистой оболочки пищевода). Казалось бы, чем больше активность воспаления в пищеводе, тем более выраженными должны быть симптомы (в том числе изжога). Однако и здесь нет прямой связи: распространенность умеренной или сильной изжоги при рефлюкс-эзофагите и НЭРБ одинакова.
Таким образом, НЭРБ – заболевание, обусловленное расслаблением нижнего сфинктера пищевода и вследствие этого забросом содержимого желудка и/или двенадцатиперстной кишки в пищевод. Характерными симптомами НЭРБ, значительно ухудшающими качество жизни больного, являются изжога, отрыжка, болезненные ощущения при прохождении пищи по пищеводу, соленый или кислый привкус во рту, боли в эпигастральной области. При этом эндоскопические проявления воспаления в пищеводе отсутствуют, повреждений не обнаруживается.
В последние годы большое внимание сфокусировано именно на проблеме НЭРБ, что обусловлено двумя основными причинами. Во-первых, у большинства больных с изжогой не диагностируется повреждений пищевода, т.е. это больные НЭРБ. Во-вторых, у этих больных стандартная терапия, принятая при рефлюкс-эзофагите (так называемая антирефлюксная терапия), оказывает менее выраженное положительное влияние, чем у пациентов с эрозивным эзофагитом.
Одна из групп НЭРБ включает пациентов с функциональными расстройствами пищевода – функциональной изжогой. Под функциональной изжогой понимают эпизодически возникающее чувство жжения за грудиной при отсутствии патологического гастроэзофагеального рефлюкса, расстройств моторики или структурных нарушений пищевода.
Распространенность функциональной изжоги остается предметом эпидемиологических исследований. Большинство пациентов не обращаются за медицинской помощью в случае редкой, эпизодически возникающей изжоги.
В нескольких популяционных исследованиях установлено, что более чем у 70% пациентов с изжогой не выявлялись признаки повреждения слизистой оболочки при проведении эндоскопии.
От 30 до 50% больных НЭРБ при проведении рН-мониторирования в пищеводе имеют нормальную картину показателей кислотности, что предопределяет выделение этих пациентов как подгруппу с функциональной изжогой. Как правило, это молодые люди с нормальной массой тела.
Одну подгруппу с такими определениями, как "гиперчувствительный или чувствительный к кислоте пищевод", формируют пациенты, у которых обнаруживается связь между временем появления изжоги и кислотными рефлюксами, несмотря на то что показатели кислотности в пищеводе не выходят за рамки физиологических. Эти больные чувствительны к физиологической концентрации кислоты, которую большинство людей не ощущают.
У другой части пациентов "пусковым механизмом" типичной изжоги являются не кислотные стимулы, а заброс щелочного содержимого двенадцатиперстной кишки или нарушение моторики пищевода.
Как указывалось выше, у больных функциональной изжогой даже физиологическая концентрация соляной кислоты в пищеводе вызывает ощущение изжоги. Какие же факторы могут способствовать этому?
Наиболее распространенной причиной изжоги может быть пища, богатая жирами. В качестве механизма рассматривается влияние холецистокинина и других биологически активных веществ, выделяющихся клетками двенадцатиперстной кишки при поступлении жира и других пищевых субстанций в ее просвет, на процессы восприятия стимулов в просвете пищевода. Эти пептиды могут вызывать появление симптомов, действуя местно на слизистую оболочку пищевода или вовлекая в процесс центральные механизмы регуляции. Возможно, какую-то роль играют пепсин, желчь, а также увеличение объема пищевода.
У определенной части больных с избыточным вниманием к симптомам своего заболевания, с повышенной "бдительностью" и тревожностью отмечается нарушение восприятия стимулов в пищеводе. Это проявляется снижением порога чувствительности, при этом изжога и боль появляются при, казалось бы, низкой интенсивности стимулов. Стресс увеличивает восприятие изжоги пациентами, а под влиянием гипноза и мышечной релаксации происходит субъективное снижение интенсивности изжоги.
В норме давление в области нижнего пищеводного сфинктера (циркулярная мышца, работающая наподобии жома) высокое, что препятствует забрасыванию кислого желудочного содержимого из полости желудка в пищевод. Кроме нижнего пищеводного сфинктера забросу содержимого желудка в пищевод препятствует еще ряд механизмов, которые показаны на рисунке.
Курение, алкоголь, кофе и шоколад расслабляют сфинктер, что предрасполагает к рефлюксу. Также способствует забросу желудочного сока в пищевод повышение внутрибрюшного давления из-за ожирения или беременности.
Факторы, усиливающие изжогу: тяжелая пища, слишком горячие или слишком холодные напитки, сутулость, привычка лежать после еды, прием пищи на ночь, подъем тяжестей, кофе и кофеинсодержащие напитки.
- желудочно-пищеводный (гастро-эзофагеальный) рефлюкс
- эзофагит
- грыжа пищеводного отверстия диафрагмы
- прием нестероидных противовоспалительных препаратов
- язвенная болезнь желудка и двенадцатиперстной кишки
- ожирение
- беременность
- курение и употребление алкоголя
Основные антирефлюксные механизмы

Форма выпуска, состав и упаковка: таблетки для рассасывания. 1 таблетка содержит магалдрат безводный 800 мг. В одной упаковке содержится 20, 50 и 100 шт.
Фармакологическое действие: антацидный препарат.
1. Нейтрализует избыточный уровень соляной кислоты и устанавливает физиологический баланс рН.
2. Обладает выраженными цитопротективными свойствами, активно защищает слизистую оболочку желудка.
3. Связывает основные агрессивные факторы: пепсин, желчные кислоты, лизолецитин.
1. Язвенная болезнь желудка и двенадцатиперстной кишки, в том числе для профилактики повторных обострений.
2. Гиперацидные состояния, гастриты, эзофагиты, включая рефлюкс-эзофагит.
3. Изжога, отрыжка кислым содержимым желудка, дискомфорт и боли в области желудка после погрешностей в диете.
4. Появление диспепсии и гастралгии у больных ревматическими заболеваниями, длительно принимающих нестероидные противовоспалительные препараты (НПВП).
Противопоказания: повышенная чувствительность к магалдрату, выраженная почечная недостаточность.
Побочное действие: при применении препарата в высоких дозах возможна диарея.
Применение при беременности и лактации: до настоящего времени не сообщалось об отрицательном влиянии магалфила 800 при беременности.
Режим дозирования: внутрь. При гастрите и дискомфорте в эпигастрии назначают по 1 таблетке, при язвенной болезни и эзофагите – по 2 таблетки спустя 1–2 ч после каждого приема пищи и перед сном. С целью профилактики повторных обострений язвенной болезни можно длительно принимать в дозе 1 таблетка утром и 1 таблетка на ночь. Больным ревматическими заболеваниями, длительно принимающим НПВП, рекомендуется прием по противоязвенной схеме. Таблетки следует держать во рту до полного рассасывания или тщательно разжевывать перед проглатыванием.
Условия отпуска из аптек: препарат разрешен к применению в качестве средства безрецептурного отпуска.
Условия и сроки хранения: препарат следует хранить при комнатной температуре. Срок годности – 4 года.
Многочисленные исследования прошлых лет привели к появлению аксиомы: "нет кислоты – нет изжоги". В последние годы, в связи с появлением новых технических средств, стало очевидным, что развитие изжоги и боли пищеводного происхождения может быть обусловлено не кислотными стимулами. Так, растяжение стенок пищевода воздухом, поступающим в просвет баллона, вызывает чувство изжоги у значительного количества здоровых добровольцев и воспроизводит этот симптом у половины больных с ГЭРБ.
При проведении внутрипищеводного ультразвукового исследования обнаруживается тесная связь между развитием изжоги и ненормально продолжительным сокращением продольных мышц пищевода. Заметим, что эпизоды изжоги в этом случае произошли в отсутствие заброса кислоты и вызваны исключительно сокращением мышц.
Итак, оба исследования показали, что развитие изжоги может быть следствием действия механического стимула (растяжение стенок вследствие увеличения объема) и изменения моторики (спастического сокращения мышц) даже в отсутствие кислотного рефлюкса.
В качестве еще одного фактора, ответственного за появление изжоги у здоровых людей и больных НЭРБ, рассматривается воздействие компонентов желчи при развитии билиарного рефлюкса (заброса содержимого двенадцатиперстной кишки в пищевод).
Для установления диагноза НЭРБ и функциональной изжоги проводятся эндоскопическое исследование пищевода и 24-часовая рН-метрия.
Терапия функциональной изжоги
Ингибиторы протонной помпы
У больных с НЭРБ исчезновение симптомов в ответ на четырехнедельную терапию стандартными дозами ингибиторов протонной помпы (омепразол, ланзопразол, рабепразол, эзомепразол и др.) наблюдается примерно в половине случаев. Этот удивительно низкий уровень ответа на терапию ингибиторами протонной помпы почти на 10–30% меньше, чем у пациентов с эрозивным эзофагитом. Большую часть больных с отрицательным ответом на стандартную терапию ингибиторами протонной помпы представляют пациенты с функциональной изжогой. У этой категории пациентов применяются высокие дозы ингибиторов протонной помпы, хотя и они только в ограниченных случаях позволяют купировать изжогу.
Антациды (магалфил 800, алмагель нео, фосфалюгель, рутацид, тальцид) являются популярными безрецептурными средствами, используемыми для купирования изжоги. Ранее считалось, что купирование симптомов при использовании антацидов возможно только в случае нейтрализации кислоты в желудке, т.е. при введении больших доз. Однако последними исследованиями установлено, что обычные дозы антацидов эффективны в нижних отделах пищевода не за счет нейтрализации внутрижелудочной секреции, а скорее посредством их взаимодействия с содержимым пищевода, вызывающим появление изжоги.
Известно, что значительная часть больных испытывает изжогу после еды и применяет для ее купирования антациды. Эта группа составляет значительный сегмент среди лиц, страдающих изжогой. В подавляющем количестве это больные с нормальными эндоскопическими данными в пищеводе. И, безусловно, значительную часть среди них составляют больные с функциональной изжогой.
Действительно, необходимость нейтрализации кислоты в желудке при развитии функциональной изжоги более чем сомнительна. Возможно, что нейтрализация небольшого объема кислого рефлюксата (части содержимого желудка, заброшенного в пищевод) в пищеводе возможна при использовании антацидов, в особенности выпускаемых в жидкой или быстрорастворимой форме, а также в виде таблеток для рассасывания (магалфил 800) или жевательных таблеток (рутацид, тальцид). Эта гипотеза была блестяще проверена в недавних исследованиях, показавших высокую способность антацидов нейтрализовать внутрипищеводную кислотность и купировать проявления изжоги у здоровых людей с рефлюксами, возникающими после еды.
Дополнительным методом, обеспечивающим эффективность антацидов, выпускаемых в форме жевательных таблеток, возможно, является стимуляция очищения пищевода. Известно, что акт глотания вызывает волну перистальтики пищевода, которая изгоняет рефлюксат из пищевода. Многократное проглатывание слюны, образующейся во рту при жевании или рассасывании антацида, помимо нейтрализации кислотного содержимого компонентами антацида, индуцирует перистальтические волны в пищеводе и способствует его скорейшему очищению.
Кандидоз пищевода — это микотическая инфекция, которая вызвана грибками рода Кандида (Candida). Заболевание проявляется затруднениями при глотании, загрудинными болями и дискомфортом. При длительном существовании кандидоза возникает потеря веса, тяжелые авитаминозы. Основу диагностики грибковой инфекции составляет осмотр пищевода при ЭФГДС с последующим морфологическим анализом биоптатов для выявления частиц возбудителя. Дополнительно проводится микробиологический посев биоматериала. Для лечения пищеводного кандидоза применяют различные по химической структуре противогрибковые препараты системного действия.
МКБ-10
Общие сведения
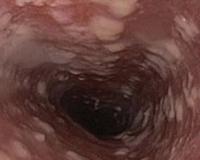
Кандидоз пищевода (кандидозный эзофагит) считается оппортунистической инфекцией. Среди пациентов общего профиля частота заболевания составляет 1-2%, при наличии сахарного диабета микоз встречается намного чаще — в 5-10% случаев. У больных с ВИЧ-инфекцией и СПИДом распространенность грибкового поражения пищевода достигает 30%. Уровень заболеваемости кандидозом среди людей пожилого возраста в 2 раза выше, чем в среднем в популяции, в старческом возрасте (после 75 лет) — в 6 раз выше. Инфекция иногда возникает у детей на фоне первичных иммунодефицитов.

Причины
Возбудителями инфекционного заболевания пищевода являются грибки рода Candida. Всего насчитывается более 150 видов грибов Кандида, но в 60-90% случаев патология вызвана C. albicans. При иммуносупрессии возрастает роль других видов — C. glablata, C. kefir, C. lucitanies и C. krusei. Микроорганизмы в естественных условиях находятся в форме бластомицетов или псевдомицелия. Развитию кандидоза способствует ряд предрасполагающих факторов:
- Иммунодефициты. Поражение слизистых пищеварительного тракта грибами Кандида является одним из маркеров прогрессирующей ВИЧ-инфекции. Высокая заболеваемость наблюдается при первичных генетически обусловленных иммунодефицитах: синдроме Ди Джорджи, синдроме Брутона, болезни Вискотта-Олдрича и др.
- Лекарственная иммуносупрессия. Частота кандидоза возрастает при продолжительном лечении кортикостероидами, которые угнетают активность иммунной системы. Негативное влияние оказывает лучевая и химиотерапия онкологических больных, которая нарушает местные и общие факторы иммунной защиты.
- Эндокринные заболевания. Вероятность появления микоза повышается у страдающих сахарным диабетом, аутоиммунным полиэндокринным синдромом, гипотиреозом. Антифунгальная резистентность снижается при ожирении и других проявлениях метаболического синдрома.
- Местные факторы. К локальным причинам микотического процесса относят хронические воспалительные и атрофические изменения в эзофагеальной стенке, ксеростомию, дегенеративно-деструктивные нарушения в полости рта. Патология вдвое чаще встречается у тех, кто пользуется съемными зубными протезами.
Факторы риска
Факторы риска развития кандидоза пищевода: истощение, авитаминозы, хронические соматические болезни, сопровождающиеся астенией. Вероятность микоза возрастает после операций по трансплантации органов.
Широкая распространенность кандидоза у пожилых людей связана с инволютивным угасанием функций иммунитета, нарушениями микроциркуляции вследствие атеросклероза, атрофией слизистого слоя пищевода. В формировании кандидоза большую роль имеет полипрагмазия, а именно неконтролируемое применение антибиотиков, гормонов и антисекреторных препаратов.
Патогенез
Первым этапом механизма развития заболевания является адгезия (прикрепление) клеток грибка к поверхности эзофагеальной слизистой. В дальнейшем микроорганизмы способны трансформироваться в нитевидную форму и внедряться в более глубокие слои стенки пищевода. Поражение тканей происходит вследствие продукции возбудителем специфических ферментов. Большое значение в манифестации кандидоза играют дефекты Т-клеточного звена иммунитета.
Характер инфекции определяется состоянием факторов антифунгальной защиты организма. При правильной работе иммунной системы возникает транзиторное носительство. При дефектах иммунитета обычно встречается персистирующее носительство без клинических симптомов. При наличии у человека одной или нескольких предпосылок развивается типичный кандидоз.
Классификация
Согласно анатомической классификации, поражение пищевода грибками-кандидами относится к поверхностным формам кандидоза. В практической гастроэнтерологии широко применяется эндоскопическая классификация, которая необходима для систематизации различных вариантов поражения эзофагеальной слизистой. Клиницисты выделяют 3 варианта изменений в пищеводе при кандидозе:
- Катаральный эзофагит. Характеризуется гиперемией слизистой пищевода и умеренной отечностью. На кандидозную инфекцию указывает тонкий паутинообразный налет на эпителии, контактная кровоточивость.
- Фибринозный эзофагит. В пищеводе образуются беловато-серые налеты в виде бляшек размером до 0,5 см. Гиперемия, отечность и кровоточивость слизистой оболочки выражены интенсивнее, чем при катаральной форме.
- Фибринозно-эрозивный эзофагит. Кандидоз проявляется множественными налетами грязно-серого цвета, после удаления которых на слизистой оболочке визуализируются эрозии. Характерна спонтанная кровоточивость.
Симптомы кандидоза пищевода
Типичные признаки кандидоза пищевода — затруднения и боли в момент глотания. Человек испытывает дискомфорт при употреблении твердой и сухой пищи, тогда как при питье неприятные ощущения не беспокоят. Болезненность ощущается при прохождении пищевого комка по пищеводу. Некоторые пациенты для облегчения боли и жжения запивают каждый кусочек пищи водой.
Характерен дискомфорт за грудиной, который возникает независимо от употребления продуктов питания. Реже появляется отрыжка с неприятным запахом, изжога. При тяжелом поражении пищевода во время еды бывают очень сильные боли, поэтому больные сокращают объем порций и кратность приема пищи. Вследствие длительного недоедания отмечается потеря массы тела, присоединяются симптомы авитаминоза.
Осложнения
Вследствие контактной ранимости слизистой типичны постоянные малоинтенсивные кровотечения при травмировании пищевода кусочками плохо пережеванной пищи. Хроническая кровоточивость приводит к железодефицитной анемии. У пациентов, страдающий тромбоцитопенией, возможно профузное кровотечение с геморрагическим шоком. Очень опасна перфорация пищевода, которая проявляется болевым шоком, пневмомедиастинумом и подкожной эмфиземой шеи.
Диагностика
При кандидозе пищевода отсутствуют патогномоничные симптомы, поэтому диагностический поиск включает ряд лабораторных и инструментальных методов. Иногда при осмотре врач-гастроэнтеролог замечает очаги грибкового поражения ротовой полости, что косвенно указывает на микотическую этиологию дисфагии. Для подтверждения диагноза используются следующие методы исследования:
Лечение кандидоза пищевода
Основу терапии кандидозной инфекции составляют специфические антифунгальные средства. Они угнетают синтез химических веществ, входящих в клеточную стенку грибов. Существует 3 группы антимикотиков, которые различаются по степени усвояемости при пероральном приеме. Чаще всего в клинической практике используются азольные противогрибковые средства, которые необходимо принимать в течение 2-3 недель.
При неэффективности стандартной схемы антимикотик меняют либо переходят на парентеральное введение лекарства. Прием препарата длится до полного исчезновения клинико-лабораторных симптомов. Для больных со СПИДом обязательным условием излечения является снижение вирусной нагрузки и повышение уровня CD4-клеток. Для этого рекомендуют современные схемы антиретровирусной терапии.
Прогноз и профилактика
Вероятность полного выздоровления зависит от условий и причин, вызвавших кандидоз. У людей с нормальным иммунным статусом прогноз благоприятный — для излечения требуется 1 курс противогрибковой терапии. Если больной принадлежит к категории носителей ВИЧ-инфекции либо по состоянию здоровья принимает иммуносупрессоры, существует риск рецидива грибковой инфекции.
Меры первичной профилактики включают контролируемое назначение иммуносупрессоров и антибиотиков, раннее выявление и лечение орофарингеального кандидоза. Для предотвращения рецидивов иммунокомпрометированным пациентам показан ежедневный прием противогрибкового препарата в невысокой дозе. Реже прибегают к профилактическому еженедельному приему удвоенных дозировок антимикотика.
1. Особенности кандидоза пищевода у больных пожилого и старческого возраста/ Д.М. Албегова// Проблемы медицинской микологии. — 2012.
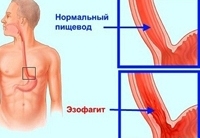
Эзофагит - это поражение слизистой оболочки пищевода воспалительного характера. Проявлениями эзофагита могут служить жгучая боль за грудиной, нарушения глотания, изжога, повышенная саливация. Осложнением эзофагита могут явиться пептическая язва, стеноз, перфорация пищевода, болезнь Барретта. Диагностический минимум состоит из проведения эзофагоскопии, эндоскопической биопсии и рентгенографии пищевода. Лечение назначается с учетом этиологии эзофагита; включает диету, медикаментозную терапию, физиотерапию; при необходимости – хирургическое лечение сужения пищевода (бужирование, рассечение рубцовых стриктур и др.).
МКБ-10



Общие сведения
Эзофагит – воспалительное заболевание стенки пищевода острого или хронического течения. При эзофагите воспалительный процесс развивается во внутренней, слизистой оболочке пищевода и при прогрессировании может поражать более глубокие слои. Среди заболеваний пищевода эзофагит является наиболее частым, в 30-40% случаев заболевание может протекать без выраженной симптоматики.
Эзофагиты могут быть следствием различного рода повреждений слизистой пищевода или развиться вследствие инфекционного поражения, гастрита, заброса желудочного сока (иногда с желчью) из желудка. Эзофагит вследствие рефлюкса (заброса) желудочного содержимого выделяется как отдельное заболевание – гастроэзофагеальная рефлюксная болезнь.

Причины эзофагита

Острый эзофагит развивается вследствие повреждающего фактора кратковременного действия:
- острые инфекционные процессы (грипп, грибковое поражение, дифтерия и др.);
- физическое повреждение (ожог, травмирование при введении зонда, повреждение инородными телами);
- химический ожог (повреждение едкими химическими веществами);
- аллергическая реакция на пищевые продукты (как правило, сочетается с другими признаками аллергии).
Наиболее тяжелыми бывают повреждения пищевода после ожогов. В патогенезе инфекционного эзофагита основным фактором развития воспаления считается снижение иммунных свойств организма.
Причины развития хронических эзофагитов также разнообразны:
- алиментарный эзофагит (употребление очень горячей, острой пищи, крепкого алкоголя);
- профессиональный эзофагит (работа, связанная с вдыханием паров едких химических веществ);
- застойный эзофагит (раздражение слизистой остатками скопившейся пищи при разного рода затруднениях эвакуационной функции пищевода);
- аллергический эзофагит (развивается в связи с пищевой аллергией);
- дисметаболический эзофагит (связан с нарушениями обмена – гиповитаминозами, недостаточностью микроэлементов и тканевой гипоксией, продолжительной интоксикацией организма и т. п.);
- идиопатический ульцерозный эзофагит (особая форма хронического воспаления пищевода неясной этиологии, морфологически подобная язвенным колитам и гранулематозу пищевода (неспецифический регионарный стенозирующий эзофагит).
В качестве отдельного заболевания выделяют пептический, или рефлюкс-эзофагит. Он развивается вследствие гастроэзофагеального рефлюкса (заброса желудочного содержимого в пищевод). Иногда сочетается с дуодено-гастральным рефлюксом. Рефлюкс из желудка в пищевод может возникать по следующим причинам: недостаточность кардии (нижнего пищеводного сфинктера); хиатальная грыжа (грыжа пищеводного отверстия диафрагмы); недостаточная длина пищевода.
Классификация
Эзофагит по течению может быть острым, подострым и хроническим. По характеру воспалительного процесса и его выраженности в гастроэнтерологии различают катаральный, отечный, эрозивный, псевдомембранозный, геморрагический, эксфолиативный, некротический и флегмонозный эзофагиты.
Катаральный и отечный эзофагит (наиболее часто встречающиеся формы) ограничиваются гиперемией слизистой и ее отеком. При остром инфекционном процессе, а также химических и тепловых ожогах пищевода возможно развитие эрозий слизистой оболочки (эрозивный эзофагит). При тяжелом течении инфекции нередко происходит развитие некротической формы. Геморрагический эзофагит сопровождается кровоизлияниями в стенку пищевода. При псевдомембранозной форме фиброзный экссудат не сращен с подслизистой тканью в отличие от эксфолиативного эзофагита. Флегмона пищевода, как правило, развивается при повреждении стенки пищевода инородным телом.
По локализации и распространенности воспалительного процесса различают дистальный, проксимальный и тотальный эзофагит. Классификация эзофагита по степени поражения имеет различия для острого и хронического течения заболевания. Острые эзофагиты и ожоги пищевода делят на три степени:
- поверхностное поражение без эрозивных и язвенных дефектов;
- поражение всей толщи слизистой с язвенными дефектами и некрозом;
- поражение распространяется на подслизистые слои, образуются глубокие дефекты с возможностью перфорации стенки пищевода, кровотечения. После залечивания возможно образование рубцовых стриктур.
Хронический эзофагит по выраженности поражения стенки делят на 4 степени согласно классификации Савари и Миллера (классификация эндоскопических признаков хронического эзофагита):
- гиперемия без эрозивных дефектов в дистальных отделах;
- разрозненные мелкие эрозивные дефекты слизистой;
- эрозии слизистой сливаются друг с другом;
- язвенное поражение слизистой, стеноз.
Симптомы острого эзофагита
Выраженность симптоматики при остром эзофагите имеет прямую зависимость от выраженности воспалительного процесса в слизистой пищевода. При катаральной форме эзофагит может протекать без клинических симптомов, только иногда проявляясь повышенной чувствительностью пищевода к горячей или холодной пище. Тяжелые формы эзофагита проявляются выраженным болевым симптомом (острая, сильная, жгучая боль за грудиной, отдающая в шею и спину), расстройством глотания (дисфагия) из за сильной боли, изжогой, повышенным слюноотделением.
В крайне тяжелых случаях – кровавая рвота вплоть до шокового состояния. Тяжело протекающий эзофагит спустя неделю может смениться периодом мнимого благополучия (резкое стухание симптомов, возможно даже употребление твердой пищи), но без адекватного лечения спустя несколько недель (до 3-х месяцев) заживления тяжелых дефектов пищеводной стенки может привести к образованию грубых рубцов и стеноза, что приведет к прогрессированию дисфагии и регургитации пищи.
Симптомы хронического эзофагита
При рефлюкс-эзофагите основным клиническим проявлением является изжога (жжение в области эпигастрия и за грудиной). Как правило, изжога усиливается после приема жирной, острой пищи, кофе, газированных напитков. Переедание также способствует развитию симптоматики. Другими вероятными симптомами могут быть: отрыжка (воздухом, кислым, горьким с примесью желчи); ночью может проявляться регургитация. Нередки присоединения расстройств дыхания, ларингоспазм, бронхиальная астма, частые пневмонии. Симптомы нарушения дыхания проявляются, как правило, ночью, в горизонтальном положении тела.
Хронический эзофагит может протекать с болями за грудиной в районе мечевидного отростка, иррадиирующими в спину и шею. Для хронического эзофагита характерна умеренная выраженность болевого симптома.
У детей первого года жизни недостаточность сфинктера пищевода можно диагностировать по многократным умеренным срыгиваниям сразу после кормления в горизонтальном положении. При упорных срыгиваниях могут развиться симптомы гипотрофии.
Осложнения

Осложнениями эзофагитов могут стать следующие заболевания и состояния:
- пептическая язва пищевода (часто развивается при болезни Баррета), характеризуется образованием глубокого дефекта стенки пищевода, может вести к грубому рубцеванию и укорочению пищевода;
- сужение (стеноз) просвета пищевода (ведет к нарушению прохождения пищи в желудок, снижению массы тела);
- прободение стенки пищевода (перфорация) – осложнение, опасное для жизни, требует срочного хирургического вмешательства;
- гнойные осложнения эзофагита – абсцесс, флегмона (как правило, являются следствием повреждения пищевода инородным телом);
- болезнь Барретта (при продолжительном рефлюкс-эзофагите без адекватного лечения развивается перерождение эпителия пищевода – метаплазия). Пищевод Баррета – предраковое состояние.
Диагностика

Если острый эзофагит проявляется клинической симптоматикой, то диагностика этого заболевания, как правило, не составляет проблем – локализация болевого симптома весьма специфична и характерна. Опрос позволяет выявить вероятную причину развития эзофагита. Для подтверждения диагноза используется:
- Эзофагоскопия. Показывает изменения в слизистой, их выраженность. Проведение эндоскопического обследования пищевода проводят не ранее чем на шестой день после проявления выраженной клинической картины. Показания для эндоскопического обследования выявляются индивидуально. При необходимости берут эндоскопическую биопсию слизистой и исследуют гистологически.
- Манометрия. Нарушения моторной функции пищевода выявляются с помощью эзофагоманометрии.
- Рентген.Рентгенография пищевода позволяет выявить изменения контуров пищевода, изъязвления, отек стенки и скопление слизи.
Лечение эзофагита
Острый эзофагит
Эзофагит вследствие химического ожога требует срочного промывания желудка для удаления химического агента. Для лечения легких форм острых эзофагитов больным рекомендовано воздерживаться от приемов пищи 1-2 дня, медикаментозное лечение заключается в приеме антацидов и препаратов группы фамотидина. После начала питания исключают продукты, способные повредить слизистую (алкоголь, кофе, горячая, острая, грубая пища) и пища, активизирующая выработку желудочного сока (шоколад, жирные продукты). Всем больным эзофагитом рекомендован отказ от курения.
При тяжелом протекании болезни - бережное питание вплоть до отказа от энтерального питания, обволакивающие и гелевые антацидные препараты. При выраженной интоксикации проводится инфузионная терапия с помощью дезинтоксикационных растворов. Для подавления инфекционного процесса показана антибиотикотерапия.
При язвенном эзофагите с выраженным болевым симптомом прописано обезболивание и противопоказано промывание желудка. При безуспешности массированного лечения антибиотиками очагов гнойного воспаления (флегмона, абсцесс) – хирургическая санация. Также показанием к хирургическому лечению эзофагита является развитие тяжелой стриктуры пищевода, не поддающейся дилатации.
Хронический эзофагит
В терапии хронического эзофагита основное значение играет устранение фактора его возникновения. Важнейшей составляющей лечения является строгое соблюдение диеты и режима питания и образа жизни. Рекомендации по диете в период острых клинический проявлений: употребление умеренного количества мягкой протертой пищи комнатной температуры. Исключение из рациона продуктов, оказывающих раздражающее действие на слизистую – острые, жирные, жареные, газированные, алкоголесодержащие продукты. Также исключают пищу, содержащую большое количество клетчатки.
Больным эзофагитом необходимо отказаться от курения и приема лекарственных препаратов, влияющих на тонус сфинктера пищевода (седативные препараты, транквилизаторы, теофиллин, простагландины и т. п.). Также следует отказаться от приемов пищи не менее чем за полтора-два часа до сна, не принимать горизонтальное положение после еды, не проводить много времени наклонясь. Спать рекомендуется на приподнятом изголовье. Терапия хронического эзофагита:
- препараты, снижающие кислотность желудочного сока (антациды – оптимальным выбором являются гелевые антациды с анестетиками, ингибиторы протоновой помпы, блокаторы Н2-гистаминовых рецепторов);
- препараты, усиливающие тонус кардии (нижнего сфинктера пищевода и ускоряющие продвижение пищевого комка из желудка в двенадцатиперстную кишку (блокаторы дофа-рецепторов и холиномиметики).
- при рефлюкс-эзофагите хороший результат дает амплипульстерапия;
- снижение болевого синдрома достигается сеансами электрофореза ганглиоблокаторов;
- грязелечение и бальнеотерапия.
При тяжелом течении рефлюкс-эзофагита со стриктурами, язвами и стенозом физиотерапия противопоказана. Операции при стенозе пищевода заключаются в эндоскопическом рассечении стриктур, расширении или бужировании пищевода. По показаниям проводится резекция и пластика пищевода.
Прогноз и профилактика
При отсутствии осложнений (стеноз, перфорации, кровотечение, воспаление средостения и т. п.) прогноз благоприятен. Важным фактором в перспективе излечения эзофагита является строгое соблюдение режима питания, образа жизни и рекомендаций по диете.
Профилактика эзофагитов подразумевает избегание причин его развития – ожогов горячей пищей, химическими веществами, повреждений инородными телами и т. п. Профилактика хронического эзофагита – регулярное диспансерное обследование у гастроэнтеролога и при необходимости – лечение. Больным хроническим эзофагитом в качестве профилактики обострений показано санаторно-курортное лечение.
Вирусный эзофагит - диагностика

Поражение пищевода вирусом простого герпеса наблюдают редко, за исключением случаев заболевания у ВИЧ-инфицированных. Данное состояние можно распознать с помощью рентгеновского метода, однако его легче выявить эндоскопически, особенно при наличии неповрежденных везикул, в противном случае можно наблюдать картину неспецифического эрозивного эзофагита. При отсутствии везикул необходимо подтверждение диагноза с помощью биопсии.
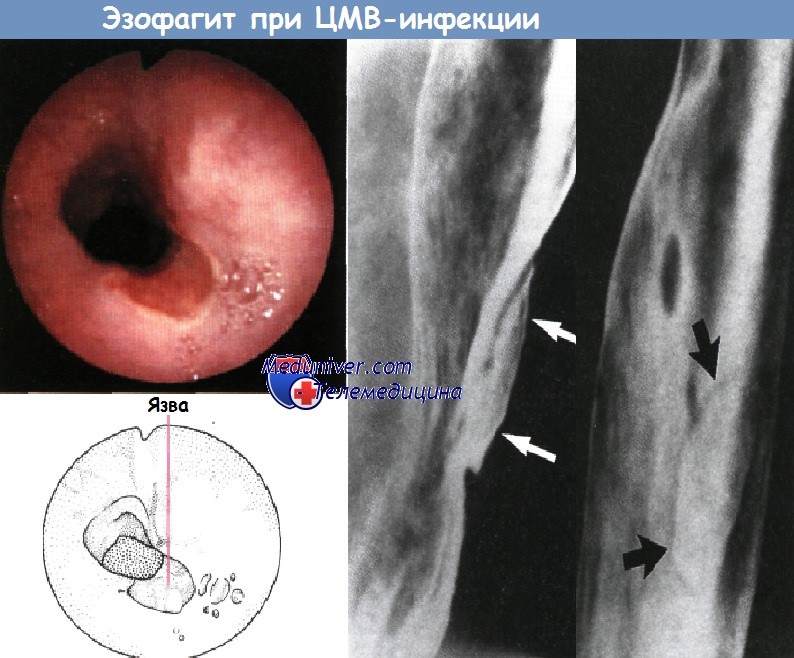
При эзофагите цитомегаловирусной природы можно наблюдать обширное глубокое язвенное поражение слизистой оболочки, которое иногда принимают за злокачественное. Рентгеновская картина может быть неоднозначна, однако подтвердить диагноз можно с помощью гистологического исследования (с применением иммуногистохимии или без нее) при обнаружении вирусных включений и соответственной воспалительной реакции.
Волосатоклеточная лейкоплакия ротовой полости (встречают в основном у ВИЧ-инфицированных) может распространяться на пищевод, провоцируя развитие одинофагии или дисфагии. Данное состояние можно наблюдать при инфекции вирусом Эпштейна—Барр. Эзофагит при ВИЧ также может существовать при отсутствии вторичной инфекции.
Хотя способность папиллом к злокачественному перерождению в других органах считают низкой, папилломавирусные повреждения пищевода — предмет пристального внимания. Они неотличимы от прочих доброкачественных полипов эндоскопически, но имеют гистологические различия.
Клиническая картина и эндоскопические признаки инфекционного эзофагита схожи с таковыми при болезни Крона; при постановке диагноза следует обратить внимание на поражение болезнью Крона других органов и/или выявление гранулем при гистологическом исследовании.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Наиболее часто у больных СПИДом обнаруживаются признаки поверхностного кандидозного стоматита, проявляющегося образованием на слизистой оболочке щек, губ, неба, языка белых налетов (псевдомембранозная форма), после отторжения которых остается эритематозная, нередко кровоточащая поверхность. Лечение таких поражений сводится к назначению местнодействующих противогрибковых препаратов (например, суспензии нистатина) или системных противогрибковых средств (кетоконазола и флуконазола).
Поражения пищевода
Наиболее частой формой поражения пищевода является кандидоз слизистой оболочки (рис. 2). Он выявляется при эндоскопии у 50−80% пациентов, предъявляющих жалобы, характерные для заболеваний данной локализации. Реже встречаются поражения, обусловленные оппортунистическими инфекциями (цитомегаловирус, вирус простого герпеса), так называемые идиопатические язвы пищевода, лимфома, саркома Капоши, медикаментозные поражения (вследствие применения цитовудина и зальцитабина). При этом оппортунистические инфекции и идиопатические язвы пищевода возникают обычно в тех случаях, когда содержание СD4−лимфоцитов падает ниже 100−200 в 1 мкл. Гастроэзофагеальная рефлюксная болезнь, частота |
| рис.2 |
Клинически поражения пищевода при СПИДе проявляются обычно ощущением затрудненного и болезненного прохождения пищи (дисфагия и одинофагия). Диагноз объективизируется при эндоскопическом исследовании, дополняемом множественной биопсией. Кандидоз слизистой оболочки пищевода характеризуется образованием налетов, изолированных или сливающихся между собой и покрывающих иногда всю поверхность слизистой оболочки. Язвы пищевода (одна или несколько), чаще всего вызываемые цитомегаловирусной инфекцией, могут быть поверхностными или глубокими. Наличие цитомегаловируса верифицируется гистологически (обнаруживается вирусный цитопатический эффект в виде появления внутриядерных включений), иммуногистохимически, а также с помощью серологических тестов. Вирус простого герпеса обусловливает развитие эрозивного эзофагита или небольших поверхностных язв. Этиология указанных поражений подтверждается данными гистологического и цитологического исследований, а также иммуногистохимически.
Для лечения кандидоза слизистой оболочки пищевода применяется флуконазол и итраконазол в жидком виде внутрь. При эзофагите, вызванном вирусом простого герпеса, назначают ацикловир, при цитомегаловирусной этиологии поражения ганцикловир и цидофовир. В случае развернутой клинической картины эрозивного эзофагита и язв пищевода могут дополнительно использоваться блокаторы протонного насоса и Н2−блокаторы.
Поражения желудка
При СПИДе возможны патологические изменения слизистой оболочки желудка, связанные с оппортунистическими инфекциями (чаще всего цитомегаловирусом), появление новообразований желудка неходжкинская лимфома и саркома Капоши. При этом лимфома обычно протекает с болями в подложечной области и может сопровождаться тошнотой и кровотечениями, тогда как саркома Капоши нередко протекает бессимптомно. Диагноз устанавливается эндоскопически и подтверждается с помощью гистологического исследования. Синдром диспепсии у больных СПИДом может быть обусловлен, кроме того, приемом противовирусных лекарственных препаратов. Значение инфекции Helicobacter pylori в возникновении диспептических жалоб у больных СПИДом пока однозначно не определено. Язвенная болезнь желудка и двенадцатиперстной кишки у таких пациентов с учетом возможности развития у них гипохлоргидрии диагностируется сравнительно редко.
Поражения кишечника
Диарея является одним из ведущих симптомов в клинической картине СПИДа и, по разным данным, встречается у 50−90% инфицированных (особенно часто при падении содержания CD4−лимфоцитов ниже 100 в 1 мкл). Факторы, способствующие ее развитию, могут быть достаточно многообразными. В ряду инфекционных причин диареи первое место занимают простейшие микроорганизмы: криптоспоридии (рис.3) и изоспоры. В Уганде, например, криптоспоридии выявляются у 48% больных СПИДом, страдающих диареей, в США и Германии
 |
| рис.3 |
Диагноз основывается на обнаружении возбудителя в фекалиях (с помощью специальной окраски или Гимзе), лучше всего в условиях предварительного накопления (флотации). Возможно выявление микроорганизмов и при исследовании биоптата слизистой оболочки с помощью электронного микроскопа. Кроме того, используются серологические тесты с моноклональными антителами. Сходные методы исследования применяются и для выявления изоспор (Isospora belli ).
Лечение криптоспоридийной диареи у больных СПИДом не дает обнадеживающих результатов. Иногда удается достичь ремиссии при применении спиромицина (в дозе 1 г 3 раза в день). Для лечения диареи, вызванной изоспорами, назначают котримоксазол (960 мг 4 раза в день) в течение 10−14 дней. При диарее, обусловленной микроспоридийной инфекцией, хорошее действие оказывает албендазол (по 800 мг 2 раза в день).
Диарея у больных СПИДом может быть вызвана <оппортунистическими>вирусами, в частности цитомегаловирусом и вирусом простого герпеса.
Цитомегаловирусная диарея встречается у 5−10% больных СПИДом. Заболевание протекает с лихорадкой, болями в животе, анорексией, потерей массы тела. При эндоскопическом и |
Вирус простого герпеса способен вызвать страдающих СПИДом, явления язвенного проктита и анита. Эти поражения сопровождаются сильными болями в аноректальной области, тенезмами, выделениями из прямой кишки секрета с примесью крови. Диагноз ставится на основании типичной ректоскопической картины и подтверждается с помощью электронной микроскопии и постановкой полимеразной цепной реакции. Лечение проводится ацикловиром (в суточной дозе 10−30 мг/кг массы тела, распределенной на 3 внутривенных введения) в течение 10−14 дней.
Причиной развития диареи может быть и бактериальная инфекция. При этом диарея, вызванная сальмонеллами, шигеллами, кампилобактером, у пациентов со СПИДом протекает более тяжело и хуже поддается лечению. Однако наиболее частой причиной бактериальной диареи у таких пациентов выступают микобактерии (Mycobacterium avium intracellulare). Заболевание характеризуется развернутой клинической картиной, в которой наряду с лихорадкой, диареей и адинамией присутствуют признаки поражения печени, селезенки, лимфоузлов и костного мозга. Точный диагноз ставится после микроскопического исследования биоптатов тонкой кишки с окраской В лечении применяются различные комбинации антибиотиков, в том числе классические схемы туберкулостатической терапии (рифампицин, изониазид и этамбутол).
Диарея у больных СПИДом может быть вызвана и микроорганизмами Clostridium difficile. В таких случаях она выступает основным клиническим симптомом псевдомембранозного колита, нередко обусловливается частым приемом этими пациентами различных антибиотиков, протекает с выраженной интоксикацией и может сопровождаться высокой летальностью (до 15−30%). Диагноз подтверждается обнаружением при эндоскопическом исследовании характерных псевдомембран на слизистой оболочке кишечника и выявлением токсинов А и В микроорганизмов микробиологическим и иммуноферментным методами. Для лечения используют ванкомицин (125−500 мг 4 раза в сутки в течение 10−14 дней) и метронидазол (по 250 мг 3 раза в сутки в течение 7−14 дней).
В некоторых случаях диарея у больных СПИДом обусловливается синдромом избыточного роста бактерий. Возникновению его способствуют характерная для этих пациентов наклонность к гипохлоргидрии и ослабление моторики тонкой кишки вследствие автономной нейропатии. Наличие синдрома избыточного роста бактерий подтверждается дыхательным тестом с |
Нередко у больных СПИДом не удается установить инфекционную природу диареи. В таких случаях ее возникновение связывается с непосредственным действием самого вируса СПИДа на кишечник и развитием энтеропатии. Вирус иммунодефицита человека способен проникать в мононуклеарные клетки слизистой оболочки кишечника, вызывать изменения в местной иммунной системе и атрофию эпителиальных клеток, вследствие чего могут развиться синдром мальабсорбции и прогрессирующая потеря массы тела. Лечение пациентов в указанных ситуациях предусматривает помимо соответствующей диеты и ферментных препаратов назначение парентерального питания.
У части больных СПИДом может наблюдаться секреторная диарея, что обусловлено способностью вируса иммунодефицита человека усиливать процессы секреции в кишечнике. Объем водянистых каловых масс у таких пациентов составляет, как правило, не менее 1 л в день и достигает в некоторых случаях 12−14 л/сут. Единственным эффективным препаратом при этом оказывается октреотид (500 мкг подкожно каждые 8 ч в течение 2 нед) с последующим постепенным снижением дозы.
Наконец, возникновение диареи у больных СПИДом может быть вызвано неопластическим поражением тракта (саркома Капоши, злокачественная лимфома). Клиническая картина заболевания в этих случаях бывает, как правило, очень выраженной и характеризуется лихорадкой, профузными ночными потами, прогрессирующей потерей массы тела, болями в животе, возможным возникновением асцита, кишечных кровотечений, перфорации стенки кишки. Прогноз у таких пациентов, даже несмотря на активную химиотерапию, оказывается очень плохим, и средняя продолжительность их жизни не превышает обычно 6 мес.
Поражения печени
Изменения печени, чаще всего проявляющиеся гепатомегалией и нарушением ее функций, отмечаются более чем у 60% больных СПИДом. Спектр их может быть достаточно многообразным [4].
У части пациентов поражения печени могут возникать после приема лекарственных препаратов (в первую очередь, сульфаниламидов и цитовудина). При этом отмечаются гепатомегалия, стеатоз, отклонения в функциональных печеночных пробах. У некоторых больных изменения функций печени могут развиться в результате перегрузки организма железом на фоне повторных гемотрансфузий.
Наиболее частым специфическим поражением печени у больных СПИДом является гранулематозный гепатит, обусловленный микроорганизмами Mycobacterium avium (встречается более чем у 40% пациентов с поздними стадиями заболевания). Поражения печени могут быть вызваны и Mycobacterium tuberculosis: в таких случаях они служат проявлением милиарного туберкулеза, туберкулезного абсцесса или туберкуломы печени. Диагноз подтверждается при обнаружении микобактерий в биоптатах печени, полученных при чрескожной пункционной или лапароскопической биопсии. В 5−25% случаев в биоптатах печени (чаще в купферовских клетках, реже в гепатоцитах и эндотелиальных клетках синусоидов ) выявляется цитомегаловирус.
Почти у 90% больных СПИДом одновременно обнаруживаются маркеры вируса гепатита В (HBV). При этом наличие предшествующей способствует хронизации инфекции HBV, ослабляет эффективность вакцинации против гепатита В, потенцирует репликацию HBV, уменьшает |
Частота сочетания и гепатита С (HCV) оказывается наиболее высокой у наркоманов, использующих внутривенное введение наркотиков, и у больных гемофилией (50−90%). Особенностью таких случаев являются возможность ложноотрицательных результатов исследования антител к HCV, нарастание титра HCV РНК и уровня трансаминаз по мере прогрессирования меньшая эффективность интерферонотерапии.
Саркома Капоши, локализующаяся в перипортальной зоне, встречается в биоптатах печени у 10−15% больных СПИДом. Клинически она может проявляться желтухой и повышением уровня трансаминаз, но чаще всего обнаруживается при аутопсии. Кроме саркомы Капоши, у больных СПИДом (особенно в печени может развиться неходжкинская лимфома.
Лечение поражений печени у больных СПИДом сводится к специфической антимикробной терапии или (при наличии опухоли) химиотерапии. При стенозе фатерова сосочка проводится эндоскопическая папиллосфинктеротомия.
Таким образом, и в эру применения активных противовирусных препаратов симптомы поражения органов пищеварения остаются ведущей составляющей клинической картины у больных СПИДом, определяющей нередко течение и прогноз заболевания. Клинический спектр этих поражений и механизмы их возникновения (в частности, синдрома диареи) могут быть многообразными. Лечение сводится к воздействию на основное заболевание с помощью активных противовирусных препаратов, борьбе с оппортунистическими инфекциями, паллиативной химиотерапии.
Читайте также:

