Фаготипирование стафилококков определение источника инфекции
Обновлено: 18.04.2024
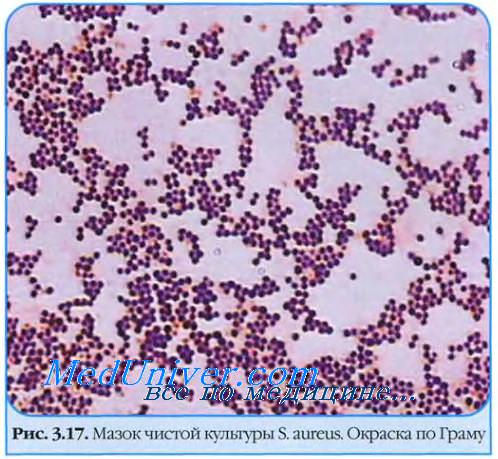
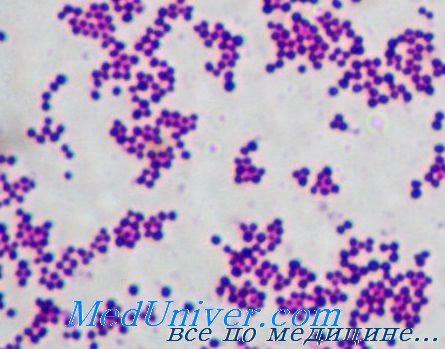
Микроскопия золотистого стафилококка. Выявление скоплений грамположительных кокков и полиморфно-нуклеар-ных лейкоцитов при исследовании окрашенных мазков клинического материала может служить основанием для предварительного диагноза. Следует помнить, что результаты микроскопии нельзя считать достаточными для выдачи окончательного заключения.
Выделение золотистого стафилококка
Посев золотистого стафилококка проводят на простые питательные среды, обычно на тио-гликолевую среду и КА. Если существует риск контаминации образца, применяют дифференциально-диагностические среды. Наиболее часто используют молочно-солевой (или молочно-жел-точно-солевой) агар и солевой агар с маннитом, на них рост контаминирующей микрофлоры угнетает высокая концентрация NaCl. Кроме того, на молочно-солевом агаре (МСА) хорошо проявляется способность к пигментообразованию и разложению лецитина (лецитовителазная активность). В последнее время широкое распространение в качестве дифференциально-диагностической среды нашёл агар с колистином и налидиксовой кислотой.
Стафилококки хорошо растут на бульоне, сначала вызывая его равномерное помутнение, а затем образуя рыхлый хлопьевидный осадок. Они дают весьма характерный рост в желатине; через 24-28 ч (наряду с обильным ростом по ходу укола микробиологической иглы) наблюдают начальное разжижение среды, а на 4-5-е сутки образуется открытая вниз воронка, заполненная разжиженной средой.
Для внутривидовой дифференцировки золотистого стафилококка ( S. aureus ) применяют коагулазный тест (на наличие свёртывающего фактора), положительный у 95% изолятов (рис. 12-3). Существует ещё несколько дифференцирующих признаков.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Суточную агаровую культуру стафилококка засевают в 2,5 мл бульона Хоттингера, Мартена или МПБ (рН 7,2-7,4) и выращивают 3-4 часа при 37°C (до появления заметной мути).
Одновременно готовят чашки с 1,2% агаром, приготовленным на бульоне Хоттингера с добавлением свежей мясной вода (рН 7,6; глюкозы 0,4%). CaCl2 добавляют в расплавленный агар непосредственно перед разливом (0,2 мл стерильного 10%-ного раствора CaCl2 на 100 мл агара). По 25-30 мл расплавленного агара разливают в чашки Петри и после застывания подсушивают чашку 30-40 минут при 37°C. Затем 3-4-часовую испытуемую культуру стафилококка пастеровской пипеткой засевают газоном, избыток культуры удаляют пипеткой, а чашку подсушивают 30-40 минут.
Дно засеянной чашки расчерчивают карандашом на 23 квадрата и в каждый квадрат засеянной среды стандартной петлей (диаметр 2 мм) или тонко оттянутой пипеткой наносят каплю соответствующего фага всегда в одном и том же порядке.
Фаготипирование начинают рабочим разведением фагов, соответствующим I ТР. Штаммы, с которыми получен отрицательный результат, на следующий день типируют повторно, используя разведения фагов, соответствующие 100 ТР (разведение 1:10) в нашем опыте.
Учет и регистрация результатов
Штамм считается типируемым, если хотя бы один фаг вызвал сильную реакцию при типировании I ТР или 100 ТР. Стафилококковые штаммы чаще лизируются не одним, а несколькими фагами, что дает для каждого штамма характерную для него фагомозаику. В зависимости от фагов, входящих в эту мозаику, штамм стафилококка относят к тем или иным фагогруппам.
Б. Методы определения чувствительности бактерий к антибиотикам
а) Метод дисков. Бумажные диски, пропитанные определенными антибиотиками, помещают на газон исследуемой бактериальной культуры в чашке Петри, Посевы инкубируют в течение 16-24 часов, после чего учитывают результаты опыта по образованию зон задержки роста бактерий.
По диаметру зон задержки роста ориентировочно судят о степени чувствительности бактерий к антибиотикам (рис. 2). Зона задержки роста до 15 мм указывает на слабую, до 25 мм - на среднюю и свыше 25 мм - на высокую чувствительность. Более точные результаты получают при использовании метода серийных разведений.
б) Метод серийных разведений. Этот метод позволяет определить минимальную задерживающую концентрацию антибиотика для данного микроорганизма (МЗК) как на жидких, так и на плотных питательных средах.
МПБ разливают по 2 мл в серию пробирок. Готовят основной раствор антибиотика, для чего берут навеску антибиотика и растворяют в дистиллированной воде из расчета 1 мг антибиотика на мл растворителя.
Левомицетин предварительно растворяют в 96° этиловом спирте из расчета 0,25 мл спирта на 1 мг антибиотика; после полного растворения добавляют такое количество дистиллированной воды, чтобы раствор содержал в 1 мл 1 мг антибиотика.
Тетрациклин и окситетрациклин растворяют в сантинормальном растворе соляной кислоты из расчета 1 мл на 1 мг антибиотика.
Эритромицин сначала растворяют в чистом метиловом спирте из расчета 1 мл на 10 мг эритромицина. После растворения добавляют такое количество дистиллированной воды, чтобы получить раствор, содержащий в 1 мл 1 мг антибиотика.
Исходный раствор антибиотика в количестве 2 мл вносят в первую пробирку с МПБ, перемешивают и получают определенную его концентрацию.
Из первой пробирки 2 мл разведенного антибиотика переносят во вторую пробирку и после перемешивания переносят 2 мл в третью пробирку и т.д. до предпоследней, откуда 2 мл выливают. Последняя пробирка является контролем, в ней нет антибиотика и она свидетельствует о пригодности среды для роста культуры.
Пробирки помещают в термостат на 12-18 часов, но предварительные результаты можно учитывать через 6-8 часов.
По истечении необходимого срока инкубации определяют максимальное разведение антибиотика, которое еще подавляет рост культуры. Концентрация антибиотика в последней пробирке с видимой задержкой роста и представляет собой минимальную задерживающую концентрацию антибиотика (МЗК) или минимальной подавляющей концентрацией (МПК).
Штамм считается чувствительным к антибиотикам, если МЗК препарата для данного штамма соответствует концентрации этого препарата, создаваемой в организме. Измеряется МПК в мг/л или мкг/мл (рис. 1).
Минимальная подавляющая концентрация (МПК) - наименьшая концентрация антибиотика (мг/л или мкг/мл), которая in vitro полностью подавляет видимый рост бактерий.

Рис. 1. Определение значения МПК методом разведения в жидкой питательной среде.
в) Определение чувствительности микроорганизма с помощью Е-теста проводится аналогично тестированию диско-диффузионным методом. Отличие состоит в том, что вместо диска с антибиотиком используют полоску Е-теста, содержащую градиент концентраций антибиотика от максимальной к минимальной (рис. 3). В месте пересечения эллипсовидной зоны подавления роста с полоской Е-теста получают значение минимальной подавляющей концентрации (МПК).


Рис. 2. Зоны задержки роста при дисковом методе определения чувствительности к антибиотикам
Рис. 3. Определение чувствительности микроорганизмов с помощью Е-тестов
Несомненным достоинством диффузионных методов является простота тестирования и доступность выполнения в любой бактериологической лаборатории. Однако с учетом высокой стоимости Е-тестов для рутинной работы обычно используют диско-диффузионный метод.
З А Н Я Т И Е 5
Тема: Микробиологическая диагностика дифтерии и коклюша
План занятия:
1. Изучение морфологии и культуральных свойств дифтерийной палочки. Макро- и микроскопия культур бактерий.
2. Типы дифтерийных бактерий. Разбор особенностей роста культур соответствующих типов на теллуритовых средах.
3. Биохимические свойства коринебактерий. Дифференциация истинных дифтерийных бактерий от псевдодифтерийных и дифтероидов по биохимическим свойствам. Демонстрация и разбор.
4. Правила взятия и пересылки материала от больного дифтерией для бактериологического исследования. Разбор.
5. Бактериологическая диагностика дифтерии. Разбор схемы исследования дифтеритической пленки (или материала от бактерионосителя).
6. Определение токсигенности дифтерийных бактерий реакцией преципитации в агаре и биопробой на морской свинке. Разбор и демонстрация.
7. Изучение морфологии и культуральных свойств коклюшной палочки.
8. Микробиологическая диагностика коклюша. Разбор схемы.
9. Знакомство с иммунопрепаратами, применяемыми для профилактики и лечения дифтерии и коклюша.
Методические указания
1. Готовые фиксированные мазки из чистой культуры дифтерийной палочки окрасить синькой Леффлера и по Нейссеру. Дифтерийные бактерии окрашиваются неравномерно, более интенсивно окрашиваются зерна волютина. При окраске метиленовым синим наблюдается явление метахромазии. По способу Нейссера зерна окрашиваются в темно-коричневый цвет. Дифтерийные палочки располагаются под углом друг к другу в виде римской цифры V. Препараты промикроскопировать и зарисовать.
Знакомство с характером роста возбудителя дифтерии на свернутой сыворотке, на теллуритовых средах.
2. Разбор особенностей колоний различных типов дифтерийной палочки на теллуритовой среде – форма, размеры, цвет, блеск. Характер их роста на жидких средах - помутнение, осадок, пленка.
3. Знакомство с биохимическими свойствами дифтерийной палочки по биохимическим наборам. Демонстрация и разбор. Заполнить таблицу.
Лабораторная диагностика. Основной метод — бактериологический; разработаны и внедрены серологические реакции.
В случае необходимости (при интоксикациях) прибегают к биологической пробе. Материалом для бактериологического исследования служат кровь, гной, слизь из зева, носа, отделяемое ран, мокрота (при стафилококковой пневмонии), испражнения (при стафилококковом колите), в случае пищевых интоксикаций — рвотные массы, испражнения, промывные воды желудка, подозрительные продукты.
Материал засевают на кровяной агар (гемолиз), на молочно-солевой (молочно-желточно-солевой) агар (угнетается рост посторонних бактерий за счет NаСl, лучше выявляются пигмент и лецитиназа). Выделенную культуру идентифицируют по видовым признакам, определяют у нее наличие основных признаков и факторов патогенности (золотистый пигмент, сбраживание маннита, гемолиз, плазмокоагулаза), обязательно проверяют чувствительность к антибиотикам, в случае необходимости проводят фаготипирование. Из числа серологических реакций для диагностики гнойно-септических заболеваний применяют РПГА и ИФМ, в частности для определения антител к тейхоевой кислоте или к видоспецифическим антигенам.
Для определения энтеротоксигенности стафилококков используют три метода:
серологический — с помощью специфических антитоксических сывороток в реакции преципитации в геле обнаруживают энтеротоксин и устанавливают его тип;
биологический — внутривенное введение фильтрата бульонной культуры стафилококка кошкам в дозе 2—3 мл на 1 кг веса. Токсины вызывают у кошек рвоту и понос;
непрямой бактериологический метод — выделение из подозрительного продукта чистой культуры стафилококка и определение у него факторов патогенности (образование энтеротоксина коррелирует с наличием других факторов патогенности, в частности РНК-азы).
Наиболее простым и чувствительным является серологический метод обнаружения энтеротоксина.
3. Стрептококки. Характеристика морфологических, культуральных свойств, антигенное строение. Серологическая классификация. Факторы патогенности стрептококков. Особенности патогенеза стрептококковых болезней. Характеристика свойств пневмококков.
Стрептококки — грамположительные, цитохромнегативные, каталазонегативные клетки шаровидной или овоидной формы диаметром 0,6—1,0 мкм, растут в виде цепочек различной длины или в виде тетракокков; неподвижны. Спор не образуют. Патогенные стрептококки образуют капсулу. Стрептококки — факультативные анаэробы, но имеются и строгие анаэробы. Температурный оптимум 37 °С, оптимальная рН 7,2—7,6. На обычных питательных средах патогенные стрептококки или не растут, или растут очень скудно. Для их культивирования обычно используют сахарный бульон и кровяной агар, содержащий 5 % дефибринированной крови. Среда не должна содержать восстанавливающих cахаров, так как они угнетают гемолиз. На бульоне рост придонно-пристеночный в виде крошковатого осадка, бульон прозрачен. Стрептококки, образующие короткие цепочки, вызывают помутнение бульона. На плотных средах стрептококки серогруппы А образуют колонии трех типов:
в) гладкие - невирулентные культуры.
Классификация стрептококков. Род стрептококков включает около 50 видов. Среди них выделяют 4 патогенных (S. pyogenes, S. pneumoniae, S. agalactiae и S. equi)
Cерологическая классификация. Стрептококки имеют сложное антигенное строение: у них имеется общий для всего рода антиген и различные другие антигены. Среди них особое значение для классификации имеют группоспецифические полисахаридные антигены, локализованные в клеточной стенке. По этим антигенам стрептококки разделены на серологические группы, обозначаемые буквами А, В, С, D, F, С и т. д. Сейчас известны 20 серологических групп стрептококков (от А до V). Патогенные для человека стрептококки относятся к группе А, к группам В и D, реже — к С, F и G. В связи с этим определение групповой принадлежности стрептококков является решающим моментом в диагностике вызываемых ими болезней.
У гемолитических стрептококков обнаружены типоспецифические антигены. У стрептококков группы А ими являются белки М, Т и R.
R-антиген обнаружен также у стрептококков серогрупп В, С и D. Он чувствителен к пепсину, но не к трипсину, разрушается при нагревании в присутствии кислоты, но устойчив при умеренном нагревании в слабом щелочном растворе.
По М-антигену гемолитические стрептококки серогруппы А подразделяют на большое количество серовариантов (около 100), их определение имеет эпидемиологическое значение.
По Т-белку стрептококки серогруппы А также подразделяют на несколько десятков серовариантов. В группе В различают 8 серовариантов.
Стрептококки имеют перекрестно реагирующие антигены.
Основные факторы патогенности стрептококков.
1)Белок М — главный фактор патогенности. М-белки стрептококка - фибриллярные молекулы, образуют фимбрии на поверхности клеточной стенки стрептококков группы А. М-белок определяет адгезивные свойства, угнетает фагоцитоз, определяет антигенную типоспецифичность и обладает свойствами суперантигена.
2)Капсула. Она состоит из гиалуроновой кислоты, аналогичной той, которая входит в состав ткани, поэтому фагоциты не распознают стрептококки, имеющие капсулу, как чужеродные антигены.
3)Эритрогенин — скарлатинозный токсин, суперантиген, вызывает СТШ. Различают три серотипа (А, В, С). Обладает пирогенным, аллергенным, иммуносупрессивным и митогенным действием, разрушает тромбоциты.
4)Гемолизин (стрептолизин) О разрушает эритроциты, обладает цитотоксическим, в том числе лейкотоксическим и кардиотоксическим, действием.
5)Гемолизин (стрептолизин) 5 обладает гемолитическим и цитотоксическим действием.
6)Стрептокиназа — фермент, который превращает преактиватор в активатор, а он — плазминоген в плазмин, последний и гидролизует фибрин. Таким образом, стрептокиназа, активируя фибринолизин крови, повышает инвазивные свойства стрептококка.
7)Фактор, угнетающий хемотаксис (аминопептидаза), подавляет подвижность нейтрофильных фагоцитов.
8)Гиалуронидаза — фактор инвазии.
9)Фактор помутнения — гидролиз липопротеидов сыворотки крови.
10)Протеазы — разрушение различных белков; возможно, с ними связана тканевая токсичность.
11)ДНКазы (А, В, С, D) - гидролиз ДНК.
11)Способность взаимодействовать с Fс-фрагментом IgG с помощью рецептора II - угнетение системы комплемента и активности фагоцитов.
13)Выраженные аллергенные свойства стрептококков, обусловливают сенсибилизацию организма.
Особенности патогенеза и клиники. Стрептококки являются обитателями слизистых оболочек верхних дыхательных путей, пищеварительного и мочеполового трактов, поэтому вызываемые ими заболевания могут быть эндогенного или экзогенного характера, т. е. вызываются либо собственными кокками, либо в результате заражения извне. Проникнув через поврежденную кожу, стрептококки распространяются из местного очага через лимфатическую и кровеносную системы. Заражение воздушно-капельным или воздушно-пылевым путем приводит к поражению лимфоидной ткани (тонзиллиты), в процесс вовлекаются регионарные лимфатические узлы, откуда возбудитель распространяется полимфатическим сосудам и гематогенно.
ПНЕВМОКОККИ
Кокки имеют форму, напоминающую пламя свечи: один конец клетки заострен, другой — уплощен; располагаются обычно парами (плоские концы обращены друг к другу), иногда в виде коротких цепочек. Жгутиков не имеют, спор не образуют. В организме человека и животных, а также на средах, содержащих кровь или сыворотку, образуют капсулу. Грамположительны, но в молодых и старых культурах нередко грамотрицательны. Факультативные анаэробы. Температурный оптимум для роста 37 °С, при температуре ниже 28 °С и выше 42 °С не растут. Оптимальная рН для роста 7,2—7,6. Пневмококки образуют перекись водорода, но у них нет каталазы, поэтому для роста они требуют добавления субстратов, содержащих этот фермент (кровь, сыворотка). На кровяном агаре мелкие круглые колонии окружены зеленой зоной, образующейся в результате действия экзотоксина гемолизина (пневмолизина). Рост на сахарном бульоне сопровождается помутнением и выпадением небольшого осадка.
Инфекции золотистого стафилококка (Staphylococcus aureus): диагностика, лечение, профилактика
Представители этого рода — неспорообразующие неподвижные грамположительные кокки, формирующие при росте колонии в виде виноградной грозди (кластера) и входящие в состав нормальной микрофлоры кожного покрова животных и человека.
Стафилококки — представители семейства Micrococcaceae. Существует свыше 26 видов стафилококков, но лишь некоторые из них представляют угрозу для здоровья человека. Самым опасным считают золотистый стафилококк (Staphylococcus aureus), отличающийся от остальных наличием фермента коагулазы.
Staphylococcus aureus
Этот вид долгое время считали единственным патогенным микроорганизмом в своём роде. Носительство S. aureus у человека обычно протекает бессимптомно; его обнаруживают у 40% здорового населения.
Обычно он локализуется на слизистой оболочке носа, коже подмышечной области и промежности.
Патогенез инфекции золотистого стафилококка (Staphylococcus aureus)
Коагулаза, продуцируемая Staphylococcus aureus, катализирует реакцию превращения фибриногена в фибрин и помогает микроорганизму образовывать защитный барьер. Кроме того, наличие рецепторов к поверхностным структурам клеток хозяина и матричным белкам (например, фибронектину, коллагену) обусловливает возможность адгезии возбудителя.
Он вырабатывает экстрацеллюлярные лизирующие ферменты (липазу), разрушающие ткани и способствующие инвазии. Некоторые штаммы продуцируют сильнейший экзотоксин, вызывающий синдром токсического шока. Выделяемые бактерией энтеротоксины могут быть причиной диареи.
Клиническая значимость золотистого стафилококка (Staphylococcus aureus)
Staphylococcus aureus вызывает различные заболевания. Кожные инфекции возникают в условиях повышенной температуры и влажности, а также в связи с нарушением целостности кожного покрова при некоторых заболеваниях (экзема и др.), хирургических операциях, инъекциях или внутривенной катетеризации. Даже на здоровой коже может развиться поверхностная пиодермия (импетиго), которая затем передаётся от человека к человеку.
Пневмонию, вызванную S. aureus, наблюдают достаточно редко (в большинстве случаев в качестве осложнения гриппа). Инфекция быстро профессирует (часто наблюдают образование полостей или каверн); характерен высокий уровень смертности. Быстрое течение свойственно и стафилококковому эндокардиту, возникающему при неправильном подборе антибиотиков или вследствие микробной колонизации внутривенных устройств. Заболевание часто приводит к смерти пациента. Кроме того, S. aureus — наиболее распространённая причина остеомиелита и септического артрита.
Лабораторная диагностика золотистого стафилококка (Staphylococcus aureus)
• Бактериологическое исследование: S. aureus — грамположительные кокки, располагающиеся в микропрепарате в виде виноградной грозди. Быстро растут на большинстве питательных сред. Выдерживают высокие концентрации солей, поэтому диагностическая среда может быть приготовлена с учётом этой особенности микроорганизма.
• Изучение биохимических свойств: большинство штаммов S. aureus разлагают маннитол, поэтому добавление его и характерного красителя помогает идентифицировать субкультуру бактерий. Продуцируют коагулазу, ДНКазу, каталазу.
• Типирование S. aureus с помощью набора типовых стафилококковых бактериофагов или методом рестрицирования ДНК.
Чувствительность золотистого стафилококка (Staphylococcus aureus) к антибиотикам
Изменение чувствительности S. aureus к антибиотикам можно считать настоящим пособием по антимикробной химиотерапии. Сначала против золотистого стафилококка был в полной мере эффективен бензилпенициллин, но затем возникли штаммы, способные вырабатывать бета-лактамазы. Со временем они стали преобладать над всеми остальными. С внедрением в клиническую практику метициллина и родственных ему лекарственных средств (флуклоксациллина) именно они стали препаратами выбора и в настоящее время остаются таковыми при наличии чувствительных штаммов.
Позже возникли штаммы золотистого стафилококка, устойчивые к действию метициллина. Их резистентность обусловлена геном тесА+, кодирующим белки со сниженным сродством к пенициллинам. Некоторые из устойчивых штаммов способны вызвать эпидемические вспышки заболевания, для борьбы с которыми применяют ванкомицин и тейкопланин.
В настоящее время обнаруживают всё больше микроорганизмов со средней устойчивостью (или гетерорезистентностью) к гликопептидам. Описаны случаи полной гликопептидной резистентности у некоторых штаммов, обусловленной наличием генов vanA+ и vanB+ заимствованных у энтерококков.
Другими эффективными препаратами считают линезолид, аминогликозиды, эритромицин, клиндамицин, производные фузидовая кислота, хлорамфеникол и тетрациклин.
В отношении метициллинчувствительных штаммов активны цефалоспорины первого и второго поколения. Производные фузидовой кислоты применяют при комбинированной терапии инфекционных заболеваний костей и суставов. Лечение должно сопровождаться обязательным проведением теста на чувствительность к антимикробным препаратам.
Профилактика заболеваний вызванного золотистым стафилококком (Staphylococcus aureus)
Передача инфекций, вызываемых Staphylococcus aureus, происходит посредством аэрозольного и контактного механизма. Носителей или лиц, заражённых штаммами, устойчивыми к метициллину и гликопептидам, необходимо изолировать в отдельные боксы и соблюдать меры предосторожности во избежание раневого или энтерального проникновения бактерий.
Следует помнить, что медперсонал может стать носителем инфекции и способствовать её распространению в лечебном учреждении. Именно поэтому всем работникам больницы рекомендовано применение местных растворов мупироцина и хлоргексидина.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

