Физиолечение при системной красной волчанке
Обновлено: 26.04.2024
Системная красная волчанка (СКВ) – аутоиммунное заболевание, этиология которого остается неизвестной. Кожный синдром при СКВ зачастую имеет первостепенное диагностическое значение – поражение кожи в 20-30% случаев является самым ранним симптомом, а у 60-
Systemic lupus erythematosus: alertness in the practice of a dermatologist / M. M. Tlish, Zh. Yu. Naatyzh1, T. G. Kuznetsova, E. A. Chernenko /State Budgetary educational institution of higher professional education Kuban State Medical University of the Ministry of Healthcare of the Russian Federation, Krasnodar, Russia
Abstract. Systemic lupus erythematosus (SLE) is an autoimmune disease, the etiology of which remains unknown. Skin syndrome in SLE is often of paramount diagnostic value – skin lesion is the earliest symptom in 20-30% of cases, and in 60-70% it manifests itself at various stages of the course of the disease, which leads to the patient's primary referral to a dermatologist. Frequent diagnostic errors are due to the absence of clinical symptoms of systemic lesions in the presence of cutaneous manifestations of lupus erythematosus (LE). In this case, laboratory tests are an integral part of the algorithm for managing patients with LE at the stage of contacting a dermatologist. The most specific laboratory test is the determination of antinuclear antibodies by an indirect immunofluorescence reaction, referred to as antinuclear factor (ANF). An elevated ANF titer is included in the list of diagnostic criteria for SLE, its detection allows one to suggest a diagnosis of SLE and determine a further algorithm for the provision of medical care. The article presents two clinical cases illustrating that against the background of an isolated skin lesion and the absence of visible somatic pathology, abnormalities in immunological tests were identified. This made it possible to suspect the systemic course of the process at an early stage and refer patients to a rheumatologist's consultation, where the diagnosis of SLE was confirmed. For citation: Tlish M. M., Naatyzh Zh. Yu., Kuznetsova T. G., Chernenko E. A. Systemic lupus erythematosus: alertness in the practice of a dermatologist // Lechaschy Vrach. 2020; vol. 23 (11): 23-26. DOI: 110.26295/OS.2020.35.78.005
Согласно современным представлениям, системная красная волчанка (СКВ) – аутоиммунное заболевание неустановленной этиологии, характеризующееся гиперпродукцией органонеспецифических аутоантител с развитием иммуновоспалительного повреждения тканей внутренних органов [1]. Широкий ряд вырабатываемых аутоантител и их прямое или опосредованное воздействие на клеточные мишени обуславливают многообразие клинических проявлений при красной волчанке (КВ) [2]. СКВ может проявляться изолированным или сочетанным поражением систем и органов, включающим поражение кожи и слизистых оболочек (волчаночная бабочка, дискоидная эритема, фотосенсибилизация, алопеция, телеангиэктазии, сетчатое ливедо, язвы в полости рта), сердечно-сосудистой системы (перикардит, миокардит, эндокардит, коронарит), почек (волчаночный нефрит), центральной нервной системы (судороги, психоз), опорно-двигательного аппарата (артралгии, артриты), легких (плеврит, волчаночный пневмонит), гематологическими нарушениями (гемолитическая анемия, лейкопения, тромбоцитопения) и т. д. [3].
Ключевую роль в диагностике СКВ играет обнаружение клинических проявлений заболевания и данные лабораторной диагностики [3]. Кожный синдром при СКВ зачастую имеет первостепенное диагностическое значение – поражение кожи в 20-30% случаев является самым ранним симптомом, а у 60-70% проявляется на различных этапах течения болезни, что приводит к первичному обращению больного именно к дерматологу [4]. Поражения кожи при СКВ полиморфны и представлены различными изменениями – от незначительных телеангиэктазий до буллезных поражений [2]. Выделяют волчаночно-специфичные и волчаночно-неспецифичные поражения кожи, последние встречаются в несколько раз чаще. К волчаночно-специ-фичным относят различные проявления хронической, подострой и острой КВ [5]. Группа неспецифических поражений включает: фотосенсибилизацию, лейкоцитокластический и уртикарный васкулит, телеангиэктазии, сетчатое ливедо, злокачественный атрофический папулез и синдром Рейно [5]. Широкая вариабельность клинических проявлений кожного синдрома обуславливает необходимость проведения тщательного дифференциального диагноза [1].
Важным инструментом ранней диагностики системных заболеваний является обнаружение аутоантител с помощью лабораторных тестов [3]. Наиболее специ-фичными для СКВ являются антинуклеарные антитела (АНА) – это гетерогенная группа аутоантител к компонентам клеточного ядра, среди которых выделяют антитела к двуспиральной дезоксирибонуклеиновой кислоте (ДНК), гистонам, нуклеосомам, экстрагируемым ядерным антигенам, ядрышковым антигенам и другим клеточным структурам [6]. Стандартным методом обнаружения группы АНА является непрямая реакция иммунофлюоресценции (НРИФ) с использованием линии эпителиальных клеток аденокарциномы гортани человека (HЕp-2) [7]. Определение АНА методом НРИФ принято обозначать как антинуклеарный фактор (АНФ), содержание которого оценивается по максимальному выявленному титру в сыворотке крови, с указанием интенсивности и типа флюоресценции [8]. Количественное увеличение титра свыше 1:160 входит в перечень диагностических критериев СКВ согласно рекомендациям Американской коллегии ревматологов (American College of Rheumatology, ACR) и Европейской лиги борьбы с ревматизмом (European League Against Rheumatism, ULAR) и используется для оценки активности процесса, прогноза, так как является предиктором развития СКВ на доклинической стадии [8].
Длительное формирование патогномоничного клинического симптомокомплекса СКВ, отсутствие проведения необходимых лабораторных исследований и междисциплинарного взаимодействия являются причиной частых диагностических ошибок, приводящих к отсутствию своевременной противовоспалительной и иммуносупрессивной терапии у врача-ревматолога. Учитывая вышесказанное, считаем целесообразным привести собственные клинические наблюдения.
Клиническое наблюдение № 1
Данные со стороны других органов и систем: предъявляет жалобы на ноющие боли в мелких суставах кистей и коленных суставах, чувство утренней скованности. Соматически не обследована.
Объективно: кожный патологический процесс носит ограниченный симметричный характер, локализуется на коже крыльев носа, щек, подбородка. Представлен: эритематозные пятна, чешуйки, телеангиэктазии.
На коже лица (в области крыльев носа, щек, подбородка) расположены ярко-розовые эритематозные очаги, с четкими границами, слегка инфильтрированные, правильной округлой формы, диаметром 3-4 см, покрытые небольшим шелушением в центре очагов; в периферической зоне очагов визуализируются телеангиэктазии (рис. 1). Удаление чешуек сопровождается болезненностью (симптом Бенье–Мещерского).
.jpg)
Определена биодоза 20 секунд.
Результаты гистоморфологического исследования кожи из патологического очага на правой щеке: фолликулярный гиперкератоз; эпидермис с тенденцией к атрофии; вакуольная дистрофия клеток базального слоя. Под эпидермисом сосуды расширены. Во всех отделах дермы – густые диффузные и периваскулярные лимфогистиоцитарные инфильтраты с примесью нейтрофилов и плазмоцитов. Вокруг сально-волосяных фолликулов – густой лимфогистиоцитарный инфильтрат с примесью нейтрофилов, тучных клеток и фибробластов, проникающий в наружное эпителиальное влагалище. В дерме – участки мукоидного набухания коллагеновых волокон. Заключение: морфологическая картина может соответствовать красной волчанке.
Данные общеклинических исследований: общий и биохимический анализ крови – показатели в пределах нормы; общий анализ мочи – показатели в пределах нормы.
Настораживающими факторами в плане трансформации кожной формы в системный процесс у пациентки М. явились: дебют заболевания в молодом возрасте, длительная инсоляция в анамнезе, II фототип кожи, биодоза 20 секунд, наличие выраженного суставного синдрома.
Для исключения диагноза СКВ было проведено иммунологическое исследование:
- Антинуклеарный фактор на НЕр-2 клетках: 1:320 титр (норма менее 160); мелкогранулярный тип свечения.
- Антитела к двуспиральной ДНК (a-dsDNA) – 53 МЕ/мл (норма – менее 25 МЕ/мл).
- Анализ крови на антитела к фосфолипидам класса IgG (скрининг) – 10,13 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
- Анализ крови на антитела к фосфолипидам класса IgM (скрининг) – 12,68 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
С полученными данными больная направлена к ревматологу в Краевую клиническую больницу № 2, где был подтвержден диагноз СКВ. Больная взята на диспансерный учет ревматологом для определения дальнейшей тактики ведения и лечения.
Клиническое наблюдение № 2
Объективно: кожный патологический процесс носит распространенный характер, локализован на коже лица, шеи. Представлен: пятна, телеангиэктазии, чешуйки.
На коже лица в области щек, левой околоушной области и шеи расположены отечные эритематозные очаги розовато-красного цвета, диаметром 2–3 см, преимущественно правильно-округлой формы с небольшим шелушением, визуализируются единичные телеангиэктазии. Удаление чешуек сопровождается болезненностью (симптом Бенье–Мещерского) (рис. 2).
.jpg)
Результаты гистоморфологического исследования кожи из патологического очага: на коже левой щеки – фолликулярный гиперкератоз; участки паракератоза; эпидермис местами атрофичен; вакуольная дистрофия клеток базального слоя эпидермиса; подэпидермальные пузыри. В сосочковом слое – отек, стенки сосудов утолщены. В дерме – густые очаговые и периваскулярные лимфогистиоцитарные инфильтраты с примесью нейтрофилов. Вокруг сально-волосяных фолликулов – густой лимфогистиоцитарный инфильтрат с примесью нейтрофилов, тучных клеток и фибробластов, проникающий в наружное эпителиальное влагалище. В дерме – участки мукоидного набухания коллагеновых волокон. Заключение: морфологическая картина больше соответствует красной волчанке.
Данные общеклинических исследований: в общем и биохимическом анализах крови выявлены следующие отклонения – лейкоциты 3,7 × 10 9 /л; холестерин 8,7 ммоль/л.
Учитывая длительность течения кожного патологического процесса, отсутствие результатов обследования смежных специалистов, для исключения диагноза СКВ было проведено иммунологическое исследование:
- Антинуклеарный фактор на НЕр-2 клетках: 12 560 титр (норма менее 160); крупногранулярный тип свечения.
- Антитела к двуспиральной ДНК (a-dsDNA) – 0,5 МЕ/мл (норма – менее 25 МЕ/мл).
- Анализ крови на антитела к фосфолипидам класса IgG (скрининг) 16,65 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
- Анализ крови на антитела к фосфолипидам класса IgM (скрининг) – 14,68 МЕ/мл (референсные значения до 10 МЕ/мл – не обнаружено).
Таким образом, иммунологические исследования и их комплексный анализ являются неотъемлемой составляющей алгоритма ведения больных с КВ уже на этапе обращения к врачу-дерматологу и способствуют высокому качеству оказания медицинской помощи данному контингенту больных.
Литература/References
М. М. Тлиш, доктор медицинских наук, профессор
Ж. Ю. Наатыж 1 , кандидат медицинских наук
Т. Г. Кузнецова, кандидат медицинских наук
Е. А. Черненко
ФГБОУ ВО КубГМУ Минздрава России, Краснодар, Россия
Системная красная волчанка: настороженность в практике дерматолога/ М. М. Тлиш, Ж. Ю. Наатыж, Т. Г. Кузнецова, Е. А. Черненко
Для цитирования: Тлиш М. М., Наатыж Ж. Ю., Кузнецова Т. Г., Черненко Е. А. Системная красная волчанка: настороженность в практике дерматолога // Лечащий Врач. 2020; т. 23 (11), 23-26. DOI: 110.26295/OS.2020.35.78.005
Теги: аутоиммунное заболевание, кожный синдром, алгоритм лечения
Статья - Системная красная волчанка (СКВ) - расскажет Вам о причинах возникновения болезни, ее лечении, симптомах. Узнайте, как правильно диагностировать Системная красная волчанка (СКВ) | Центр Дикуля

Волчанка — аутоиммунное заболевание , означающее, что естественная система защиты организма (иммунная система) объектом атаки начинать выбирать не чужеродные агенты ( вирусы и бактерии ), а собственные ткани. Это вызывает воспалительную реакцию, что проявляется отечностью, болью и повреждением тканей по всему организму. При тяжелой форме СКВ могут быть повреждены почки, сердце, легкие, нервная система, кроветворная система. И хотя у части пациентов с системной красной волчанкой симптоматика может быть очень умеренной, надо понимать, что заболевание имеет хронический характер ( на протяжении всей жизни ) и, со временем симптоматика может стать очень серьезной.Но в большинстве случаев, удается контролировать течение заболевания и предотвратить осложнения и повреждения органов и систем.Это стало возможно благодаря медикаментозному лечению, ЛФК и контролю со стороны лечащего врача.Кроме системной красной волчанки( самая часто встречающаяся ) существуют и другие виды волчанки : дисковидная волчанка, лекарственная волчанка, волчанка новорожденных и подострая кожная волчанка.
Прогноз для людей с таким заболеванием как системная красная волчанка значительно улучшился с тех пор, как появилось адекватное лечение. В настоящее время почти 70% пациентов имеют шанс прожить 20 и более лет после первичной диагностики заболевания. Течение заболевания индивидуально и трудно предсказать периоды обострений.СКВ обычно развивается медленно и подчас человек в течение длительного времени не замечает симптомов .
Периоды обострения иногда называют вспышками или рецидивами.Периоды, следующими за обострениями, называют периодами ремиссии.В некоторых случаях имеет место стремительное развитие СКВ.Рецидивы и ремиссии возникаю подчас спонтанно, внезапно. И поэтому предсказать рецидив, степень тяжести , длительность обострения не представляется возможном. Кроме того, при рецидиве возможно появление новых симптомов.
Дети тоже могут болеть волчанкой ,хотя как правило заболевание развивается в подростковом возрасте или в более старшей группе.СКВ в детском возрасте протекает более тяжело, чем у взрослых и часто происходит повреждение органов и систем ( почки и сердце).Возможно это происходит из-за разницы в скорости метаболизма и степени завершенности дифференцировки тканей.Часть пациентов вынуждена вести менее активный образ жизни, чем здоровые люди из-за наличия быстрой утомляемости, боли в суставах .Кроме того, снижается способность к аэробной физической активности ( ходьба или плавание), которая необходима для лучшего насыщения крови кислородом.У некоторых пациентов бываю следующие осложнения СКВ:
- Проблемы с беременностью
- Проблемы с почками
- Проблемы с сердцем
- Проблемы с органами дыхания
- Системы кроветворения
- Нервной системы
- Психические нарушения.
Большинство людей с системной красной волчанкой сохраняют свою обычную повседневную физическую активность. Но нередко приходится корректировать уровень физической активности из-за усталости, болей в суставах или других симптомов, вплоть до полного прекращения активной деятельности.
У большинство пациентов с СКВ можно прогнозировать нормальную или почти нормальную продолжительность жизни.Это зависит от наличия поражения жизненно важных органов ( таких например как почки) и степени нарушения их функций.СКВ, как правило, не вызывает повреждения или деформации суставов, как бывает при ревматоидном артрите или другом аутоиммунном заболевании. У медикаментов, применяемых для лечения СКВ средней и тяжелой формы, есть масса побочных эффектов и нередко при длительном приеме этих препаратов бывает трудно понять чем вызвана симптоматика — самим заболеванием или побочным действием лекарств.В недалеком прошлом патогенез СКВ был не понятен и пациенты нередко умирали в более молодом возрасте, особенно когда появлялись осложнения во внутренних органах.В настоящее время, когда появилось патогенетическое лечение, прогностическая продолжительность жизни значительно выросла.Около 90% пациентов проживают 5 и более лет после постановки диагноза и почти 70% 20 лет и более.
Причины
Системная красная волчанка (СКВ) является аутоиммунным заболеванием, то есть иммунная система агрессивно реагирует на собственные ткани воспринимая их как чужеродные . СКВ не инфекционное заболевание и не контагиозно.Пока не удается выяснить, почему иммунная система воздействует на собственные ткани.Отчасти предполагается генетическая детерминированность сбоя иммунной системы. Но большинство ученых сходятся во влияние комбинации факторов, провоцирующих аутоиммунную реакцию.
Избыточное воздействие ультрафиолетового излучения ( обычно солнечного света) является триггером процесса или обострения.
Считается что эстрогены тоже влияют на возможность появления волчанки .Связывают это с тем ,что женщины больше болееют СКВ. И хотя уровень гормонов больше всего во время беременности, немалая часть женщин заболевают в возрасте после 45 лет, когда уровень эстрогена минимальный.
Курение увеличивает риск появления СКВ и ухудшают прогноз при имеющемся заболевании.
Некоторые медикаменты считаются триггерами СКВ.
Некоторые инфекции считаются триггерами СКВ.У части пациентов с цитомегаловирусом, гепатитом С, парвовирусом через некоторое время развивалась системная красная волчанка.У детей такой инфекцией считается вирус Эпштейн- Барра.
Интоксикация различными химическим веществами ( например трихлорэтиленом).
- женский пол
- раса ( больше подвержены представители негроидной расы)
- возраст от 15 до 45 лет
- наличие родственников с СКВ
- прием препаратов провоцирующих появление СКВ.
Симптомы
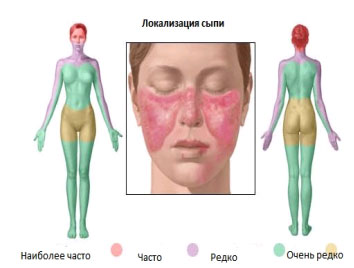
При наличии СКВ у пациента могут быть такие симптомы, как быстрая утомляемость, наличие кожных высыпаний или боль в суставах. Если же заболевание протекает тяжело, то появляются проблемы с почками, легкими, сердцем, кровью или в нервной системы.
Степень выраженности симптоматики зависит от пораженного органа и степенью его повреждения.
Усталость: Быстрая утомляемость характерна для всех пациентов с системной красной волчанкой. Даже при умеренном течении СКВ у пациентов значительно снижается возможность выполнять обычную физическую деятельность.Быстрая утомляемость является классическим симптомом СКВ, также как и высыпания на лице ( в виде бабочки).
Боли в суставах и мышцах: У большинства пациентов отмечаются периоды с наличием боли в суставах ( артриты). Приблизительно у 70% пациентов боль в суставах и мышцах были первыми симптомами заболевания. Проявляться это может отечностью, гиперемией суставов и скованностью в утренние часы. Как правило, при СКВ артриты бывают с обеих сторон и в основном в мелких суставах ( кисти рук, запястье, лодыжки), иногда в коленях.
Кожные проявления: В большинстве случаев у пациентов встречаются кожные высыпания. Характер высыпаний нередко является ключом в диагностике СКВ. В дополнение к высыпаниям на лице, на щеках и переносице ( в виде бабочки) могут быть красные пятна в области шеи, на голове на губах, руках, груди. Высыпания имеют тенденцию к шелушению.
Чувствительность к свету: Воздействие ультрафиолетового излучения при пребывание на солнце или в солярии ухудшает кожные проявления и может вызвать покраснение лица. Чувствительность к свету больше у пациентов со светлой кожей ..
Нарушения со стороны нервной системы: У части пациентов бывают нарушения со стороны нервной системы -обычно это проявляется головными болями. Не совсем понятно являются ли головные боли непосредственным симптомом СКВ или связаны с хроническим стрессом и усталостью . Но однако нарушения памяти или концентрации внимания не характерны для СКВ.
Нарушения со стороны сердца: У пациентов с СКВ может быть воспаление сердечной сумки ( перикардит), который может быть причиной острых болей в левой половине грудной клетки, с иррадиацией в шею плечо руку.
Нарушения со стороны легких: У пациентов с СКВ может быть воспаление легочного мешка вокруг легких ( плеврит), что может вызвать кашель и боль в грудной клетке при дыхании.
Психические нарушения : У пациентов с СКВ могут быть такие нарушения, как тревожность и депрессия. Эти нарушения могут быть вызваны волчанкой, медикаментами, применяемыми для ее лечения или связаны с хроническим стрессом, сопровождающим это заболевание.
Повышение температуры ( фебрилитет ): У большинства пациентов в течение длительного времени отмечается субфебрилитет и это нередко первый симптом заболевания.
Изменения веса тела: Большинство пациентов в активной стадии заболевания худеют.
Выпадение волос: При СКВ возможно значительное выпадение волос по мере развития кожных высыпаний на волосистой части головы.
Увеличение лимфоузлов: Нередко при развитии высыпаний на лице происходит увеличение лимфоузлов.
Синдром Рейно: Синдром Рейно иногда встречается у пациентов с СКВ.Происходит этот синдром в результате сужения капилляров пальцев кистей рук и пальцев стопы. Это проявляется побледнением или посинением пальцев ( это связано с нарушением кровообращения) и на ощупь они холодные.
Отеки на руках и ногах: В связи с возможным поражением почек у пациентов могут быть отеки на руках и ногах в связи с нарушением выделения жидкости из организма поврежденными почками.
Анемия: Анемия это снижение содержания гемоглобина в эритроцитах . Кроме того, у пациентов с СКВ происходит угнетение кроветворного ростка и снижение количества эритроцитов.
Диагностика
Подчас диагностика системной красной волчанки затруднительна и может занять от нескольких недель до года. СКВ проявляется у людей по разному и иногда проходит определенное время, пока не появятся симптомы характерные для этого заболевания.Врачу для диагностики заболевания необходима история болезни, физикальное обследование и выявление определенных критериев этого заболевания. Критерии необходимы для дифференциальной диагностики с другими заболеваниями. При наличии 4 из 11 критериев можно говорить о наличии СКВ. Эти признаки могут появиться одновременно или один за другим в течение времени.
Критерии характерные для системной красной волчанки:
Если есть клинические признаки СКВ и положительный анализ на антиядерные антитела, то как правило, не требуется дальнейшее обследование. Но в некоторых случаях, при необходимости может быть назначено дополнительное обследование.:
- анализы крови на наличие других антител
- анализ днк
- тщательный анализ мочи
- анализ крови на тромбопластин.
Выявление возможного повреждения органов:
Анализ мочи на наличие белка клеток может помочь выявить повреждение почек.
Биопсия почек. Этот анализ может помочь выявить воспаление почечной ткани и подобрать адекватное лечение. Но как правило этот метод назначается достаточно редко при СКВ.
КТ ( компьютерная томография) и МРТ ( магнитно-резонансная томография) назначаются для визуализации органов, которые вторично поражаются при СКВ..
Лечение
Основная задача лечения предотвратить обострения, во время которых происходит усиление таких симптомов, как утомляемость, боль суставах, кожные высыпания. Для этого необходимо систематически посещать врача, а не только когда происходит обострение. Во время рецидива задача лечения максимально быстро купировать симптоматику и минимизировать возможное повреждение внутренних органов.
Лечение при умеренном течении волчанки включает:
Избегать воздействия солнечных лучей. Если же приходится пребывать на солнце, то необходимо защищать открытые участки тела одеждой, а лицо смазывать специальным солнцезащитным кремом.
Применение крема с кортикостероидами для высыпаний.
Применение НПВС для снятия болей в суставах и мышцах и фебрилитета.
Применение противомалярийных препаратов при кожной сыпи, а также для снижения усталости и болей с суставах.
Применение кортикостероидов в небольших дозах ( при не эффективности НПВС)
При более тяжелом течении СКВ лечение может включать:
Кортикостероиды в более высоких дозах( в таблетках или инъекциях).
Лекарства, которые подавляют иммунную систему (иммунодепрессанты).
Но необходимо учитывать, что длительный прием стероидов может увеличить риск инфаркта или инсульта и, поэтому необходим контролировать такие факторы риска, как высокое АД и высокий холестерин.Кроме того, большое значение имеет здоровый образ жизни : нормальное сбалансированное питание, избегание употребления табака, регулярные физические нагрузки .Главная задача длительного лечения СКВ -это профилактика повреждений жизненно важных органов (сосуды, почки, костная ткань, головной мозг).
Использование материалов допускается при указании активной гиперссылки на постоянную страницу статьи.
Системная красная волчанка (СКВ) — это аутоиммунное мультисистемное заболевание, которое может поражать такие жизненно важные органы, как почки и головной мозг. Хотя в последние десятилетия выживаемость больных СКВ значительно улучшилась в результате использования кортикостероидов и иммуносупрессантов, современное лечение сопровождается значительными побочными эффектами. И сама болезнь, и побочные эффекты лечения приводят к кумуляции органных повреждений, что снижает и качество, и продолжительность жизни пациентов. Международная экспертная группа сформулировала рекомендации для достижения хороших результатов лечения СКВ с учетом клинического течения, накопления необратимых органных изменений и функционального статуса. Рабочая группа установила четыре всеобъемлющих принципа ведения больных СКВ, подчеркивая важность вклада пациента в процесс принятия решений, мультидисциплинарного подхода, регулярного мониторинга и корректировки терапии с целью повышения продолжительности жизни, предотвращения повреждения внутренних органов, оптимизации качества жизни путем снижения активности СКВ, минимизации проявлений сопутствующей патологии и токсичности лекарственных препаратов.
Ключевые слова: системная красная волчанка, лечение, ремиссия, активность, качество жизни.
Challenges in treating-to-target in systemic lupus erythematosus
Mok T.M.
City University of Hong Kong
North District Hospital, New Territories, Hong Kong
Systemic lupus erythematosus (SLE) is an autoimmune multi-systemic disease that can affect such vital organs as the kidneys and the brain. Although the survival rate of SLE patients has dramatically improved over the past few decades as a result of the use of corticosteroids and immunosuppressants, the current treatment is associated with significant adverse effects. Both the disease itself and the side effects from treatment are associated with cumulative organ damage, which reduces both the quality and expectancy of patients’ life. The international expert group on treat-to-target in SLE has formulated recommendations with the goals to yield superior outcomes in terms of clinical course, long-term damage and functional status. The working group established four overarching principles for managing SLE patients, emphasizing the importance of contribution of the patient in the decision making, the multidisciplinary approach, the regular monitoring and adjustment of therapy with the goals towards ensuring long-term survival, preventing organ damage, optimising health-related quality of life by controlling disease activity, minimising comorbidities and drug toxicity.
Key words: systemic lupus erythematosus, treatment, remission, activity, quality of life.
For citation: Mok T.M. Challenges in treating-to-target in systemic lupus erythematosus // RMJ. 2018. № 4(I). P. 6–9.
Введение
Системная красная волчанка (СКВ) — это системное аутоиммунное заболевание, распространенное среди азиатов несколько больше, чем в европейской популяции. СКВ затрагивает преимущественно женщин в репродуктивном возрасте и связана со значительной заболеваемостью и смертностью [1]. Это мультисистемное воспалительное заболевание, которое может поражать такие жизненно важные органы, как почки и головной мозг. Хотя в последние десятилетия выживаемость больных СКВ значительно улучшилась в результате использования кортикостероидов и иммуносупрессантов, современное лечение сопровождается значительными побочными эффектами. И сама болезнь, и побочные эффекты лечения приводят к кумуляции органных повреждений, что снижает качество и продолжительность жизни пациентов. Пациенты с СКВ также имеют повышенный стандартизированный коэффициент смертности, прежде всего за счет сердечно-сосудистой патологии и инфекционных осложнений [2].
Проблема ведения больных СКВ далека от разрешения
Несмотря на то, что СКВ по большей части имеет волнообразное течение клинической картины, у значительной доли пациентов (46–52%) имеет место постоянно высокая активность болезни [3]. Около четверти пациентов (24,5%) демонстрируют рефрактерное к проводимой терапии течение СКВ [4]. Рефрактерное течение СКВ, несмотря на современный арсенал терапии, часто проявляется симптомами изъязвления кожи (дискоидной волчанки), волчаночного нефрита и нейропсихиатрической симптоматикой. Пациенты с активным волчаночным нефритом, которые не отвечают на индукционную терапию, имеют худший долговременный прогноз по сравнению с теми, у кого имеется полностью или частично ранний положительный эффект лечения. В целом поражение внутренних органов при СКВ обусловливает неблагоприятный прогноз болезни и более высокую летальность [5].
В настоящее время единственным утвержденным биологическим препаратом для лечения активной СКВ является белимумаб. Он показан при легкой и умеренной степени активности заболевания. В связи с этим возникает насущная потребность в разработке стратегий для лучшего ведения больных СКВ и создания терапевтических подходов с более высокой клинической эффективностью и меньшим количеством побочных эффектов.
Трудности, стоящие на пути внедрения стратегии Т2Т при СКВ
Критерии Европейской антиревматической лиги (EULAR) для стратегии Т2Т при СКВ
Международная целевая группа сформулировала рекомендации с целями достижения превосходных результатов лечения СКВ с учетом клинического течения, накопления необратимых изменений и функционального статуса. Рабочая группа установила 4 всеобъемлющих принципа ведения больных СКВ, подчеркивая важность:
вклада пациента в процесс принятия решений;
мультидисциплинарного подхода;
регулярного мониторинга и корректировки терапии;
повышения продолжительности жизни, предотвращения повреждения внутренних органов, оптимизации качества жизни путем снижения активности СКВ, минимизации проявлений сопутствующей патологии и токсичности лекарственных препаратов.
Ниже представлен упрощенный вариант этих рекомендаций:
Ремиссия или как можно более низкая активность болезни, если ремиссия не может быть достигнута, являются терапевтическими мишенями, измеряемыми с помощью надежного индекса активности СКВ.
Предотвращение обострений.
Лечение больных СКВ с признаками серологической активности без явной клинической активности не рекомендуется.
Предотвращение накопления необратимых изменений в органах.
Решение проблемы факторов, влияющих на здоровье и связанных с качеством жизни больного: усталость, боль, депрессия.
Раннее распознавание и лечение волчаночного нефрита.
Как минимум 3-летняя поддерживающая иммуносупрессивная терапия волчаночного нефрита после успешного ответа на начальный курс терапии.
Использование, насколько возможно, низких доз кортикостероидов и, при возможности, их полная отмена.
Профилактика и лечение проявлений антифосфолипидного синдрома.
Применение противомалярийных препаратов у всех больных СКВ, если нет противопоказаний.
Контроль сопутствующей патологии.
Заключение
При СКВ необходимо мобилизовать усилия врачей для разработки стратегии Т2Т в целях оптимизации лечения этого заболевания. С разработкой удобных в клинической практике методик для измерения степени органоспецифических поражений, при конкретизации реалистичных и достижимых терапевтических целей, с выработкой критериев эффективности лечения поражения органов, с созданием системы строгого мониторинга пациентов с серологической активностью и созданием новых, высокоэффективных биологических агентов можно предположить, что цели профилактики обострений и органных повреждений при СКВ, а в конечном итоге — улучшение качества жизни и снижение смертности могут быть достигнуты.
Оригинал статьи: Mok T.M. Challenges in treating-to-target in systemic lupus erythematosus // Hong Kong Medical Diary. 2017. Vol. 22(10). P. 15–19. Перевод и публикация согласованы с редакцией издания. This reprint was authorized by The Federation of Medical Societies of Hong Kong. The Hong Kong Medical Diary May Issue 2017.
Статью перевел к.м.н. М.В. Головизнин
1. Mok M.Y., Li W.L. Do Asian patients have worse lupus? // Lupus. 2010. Vol. 19(12). P. 1384–1390.
2. Bernatsky S., Boivin J.F., Joseph L. et al. Mortality in systemic lupus erythematosus // Arthritis Rheum. 2006. Vol. 54(8). P. 2550–2257.
3. Conti F., Ceccarelli F., Perricone C. et al. Flare, persistently active disease, and serologically active clinically quiescent disease in systemic lupus erythematosus: a 2-year follow-up study // PLoS One. 2012. Vol. 7. P. e45934.
4. Pego-Reigosa J.M., Rua-Figueroa I., Lopez-Longo F.J. et al. Analysis of disease activity and response to treatment in a large Spanish cohort of patients with systemic lupus erythematosus // Lupus. 2015. Vol. 24. P. 720–729.
5. Bruce I.N., O’Keeffe A.G., Farewell V. et al. Factors associated with damage accrual in patients with systemic lupus erythematosus: results from the Systemic Lupus International Collaborating Clinics (SLICC) Inception Cohort // Ann Rheum Dis. 2015. Vol. 74. P. 1706–1713.
6. Atar D., Birkeland K.I., Uhlig T. ‘Treat to target’: moving targets from hypertension, hyperlipidaemia and diabetes to rheumatoid arthritis // Ann Rheum Dis. 2010. Vol. 69. P. 629–630.
7. Smolen J.S., Breedveld F.C., Burmester G.R. et al.Treating rheumatoid arthritis to target: 2014 update of the recommendations of an international task force // Ann Rheum Dis. 2016. Vol. 75. P. 3–15.
8. Gibson K.L., Gipson D.S., Massengill S.A. et al. Predictors of relapse and end stage kidney disease in proliferative lupus nephritis: focus on children, adolescents, and young adults // Clin J Am Soc Nephrol. 2009. Vol. 4. P. 1962–1967.
9. Urowitz M.B., Feletar M., Bruce I.N. et al. Prolonged remission in systemic lupus erythematosus // J Rheumatol. 2005. Vol. 32. P. 1467–1472.
10. Medina-Quinones C.V., Ramos-Merino L., Ruiz-Sada P., Isenberg D. Analysis of Complete Remission in Systemic Lupus Erythematosus Patients Over a 32-Year Period // Arthritis Care Res. 2016. Vol. 68. P. 981–987.
11. Carlavilla A., Gutierrez E., Ortuño T. et al. Relapse of lupus nephritis more than 10 years after complete remission // Nephrol Dial Transplant. 2005. Vol. 20. P. 1994–1998.
12. Golder V., Kandane-Rathnayake R., Hoi A.Y. et al. Association of the lupus low disease activity state (LLDAS) with health-related quality of life in a multinational prospective study // Arthritis Res Ther. 2017. Vol. 19. P. 62.
13. Mikdashi J., Nived O. Measuring disease activity in adults with systemic lupus erythematosus: the challenges of administrative burden and responsiveness to patient concerns in clinical research // Arthritis Res Ther. 2015. Vol. 17. P. 183.
14. Romero-Diaz J., Isenberg D., Ramsey-Goldman R. Measures of adult systemic lupus erythematosus: updated version of British Isles Lupus Assessment Group (BILAG 2004), European Consensus Lupus Activity Measurements (ECLAM), Systemic Lupus Activity Measure, Revised (SLAM-R), Systemic Lupus Activity Questionnaire for Population Studies (SLAQ), Systemic Lupus Erythematosus Disease Activity Index 2000 (SLEDAI-2K), and Systemic Lupus International Collaborating Clinics/American College of Rheumatology Damage Index (SDI) // Arthritis Care Res. 2011. Vol. 63 Suppl. 11. P. S37–S46.
15. Isenberg D.A., Gordon C., Group BGBILA. From BILAG to BLIPS — disease activity assessment in lupus past, present and future // Lupus. 2000. Vol. 9. P. 651–654.
16. Steiman A.J., Gladman D.D., Ibanez D., Urowitz M.B. Prolonged serologically active clinically quiescent systemic lupus erythematosus: frequency and outcome // J Rheumatol. 2010. Vol. 37. P. 1822–1827.
17. Steiman A.J., Gladman D.D., Ibañez D., Urowitz M.B. Outcomes in patients with systemic lupus erythematosus with and without a prolonged serologically active clinically quiescent period // Arthritis Care Res. 2012. Vol. 64. P. 511–518.
18. Tseng C.E., Buyon J.P., Kim M. et al. The effect of moderate-dose corticosteroids in preventing severe flares in patients with serologically active, but clinically stable, systemic lupus erythematosus: findings of a prospective, randomized, double-blind, placebo-controlled trial // Arthritis Rheum. 2006. Vol. 54. P. 3623–3632.
19. Mok M.Y., Chan E.Y., Fong D.Y. et al. Antiphospholipid antibody profiles and their clinical associations in Chinese patients with systemic lupus erythematosus // J Rheumatol. 2005. Vol. 32. P. 622–628.
20. Mikdashi J., Handwerger B. Predictors of neuropsychiatric damage in systemic lupus erythematosus: data from the Maryland lupus cohort // Rheumatology. 2004. Vol. 43. P. 1555–1560.
Для цитирования: Соловьев С.К., Асеева Е.А., Цанян М.Э. Нейролюпус: клинические проявления и возможности интенсифицированной терапии. РМЖ. 2012;7:373.
Нейропсихиатрические проявления системной красной волчанки (НПСКВ), возможно, являются наименее изученными и, в то же время, одними из самых распространенных при этом заболевании. Поражение нервной системы имеет очень сложный патогенез, включающий взаимодействие провоспалительных цитокинов, аутоантител и иммунных комплексов, приводящее к повреждению нейронов непосредственно или опосредованно (vasculopatia vasa nervorum). Разнообразные НПСКВ, по данным некоторых исследователей, наблюдаются у 14–80% взрослых пациентов и у 22–95% детей, они могут встречаться в дебюте СКВ и являться единственным проявлением заболевания, особенно часто это бывает у детей и подростков [1–3]. Коварство НПСКВ проявляется в том, что их развитие может быть внезапным и не связанным с клинической или лабораторной активностью СКВ [4,5]. В то же время поражение центральной и периферической нервной системы при СКВ нередко ассоциировано с васкулитом кожи и слизистых оболочек [6]. Наличие у больных НПСКВ приводит к значительному снижению качества жизни и ассоциируется с неблагоприятным жизненным прогнозом [7].
Литература
1. Popescu A., Kao A.H. Neuropsychiatric Systemic Lupus Erythematosus // Curr Neuropharmacol. 2011 September. Vol. 9 (3). Р. 449–457.
2. Hanly J.G., Urowitz M.B. et al. Systemic Lupus International Collaborating Clinics. Neuropsychiatric events at the time of diagnosis of systemic lupus erythematosus: An international inception cohort study // Arthritis Rheum. 2007. Vol. 56 (1). Р. 265–273.
3. Benseler S., Silverman E. Neuropsychiatric involvement in pediatric systemic lupus erythematosus // Lupus. 2007. Vol. 16. Р. 564–571.
4. Rowshani A.T., Remans P. et al. Cerebral vasculitis as a primary manifestation of systemic lupus erythematosus // Ann Rheum Dis. 2005. Vol. 64. Р. 784–786.
5. Everett C.M., Graves T.D. et al. Aggressive CNS lupus vasculitis in the absence of systemic disease activity // Rheumatology (Oxford). 2008. Р. 107–109.
6. Callen J.P., Kingman J. Cutaneous vasculitis in systemic lupus erythematosus. A poor prognostic indicator. Cutis. 1983. Р. 433–436.
7. Bray R.L. Neuropsychiatric lupus: clinical and imaging aspects // Bull NYU Hosp Jt Dis. 2007. Vol. 65 (3). Р. 194–199.
8. The American College of Rheumatology nomenclature and case definitions for neuropsychiatric lupus syndromes // Arthritis Rheum. 1999. Vol. 42. Р. 599–608.
9. Hanly J.G., Urowitz M.B. et al. Short–term outcome of neuropsychiatric events in systemic lupus erythematosus upon enrollment into an international inception cohort study // Arthritis Rheum. 2008. Vol. 59. Р. 721–729.
10. Pego–Reigosa J.M., Isenberg D.A. Psychosis due to systemic lupus erythematosus: characteristics and long–term outcome of this rare manifestation of the disease // Rheumatology. 2008. Vol. 47. Р. 1498–1502.
11. Ainiala H., Hietaharju A. et al. Validity of the new American College of Rheumatology criteria for neuropsychiatric lupus syndromes: a population–based evaluation // Arthritis Rheum. 2001. Vol. 45. Р. 419–423.
12. Hanly J.G., McCurdy G. et al. Neuropsychiatric events in systemic lupus erythematosus: Attribution and clinical significance // J Rheumatol 2004; Vol. 31. Р. 2156–2162.
13. Sanna G., Bertolaccini M.L. et al. Neuropsychiatric manifestations in systemic lupus erythematosus: Prevalence and association with antiphospholipid antibodies // J Rheumatol. 2003. Vol. 30. Р. 985–992.
14. Sibbitt W.L.Jr., Brandt J.R. et al. The incidence and prevalence of neuropsychiatric syndromes in pediatric onset systemic lupus erythematosus // J Rheumatol. 2002. Vol. 29. Р. 1536–1542.
15. Johnson R.T., Richardson E.P. The neurological manifestations of systemic lupus erythematosus // Medicine (Baltimore). 1968. Vol. 47. Р. 337–369.
16. Ellis S.G., Verity M.A. Central nervous system involvement in systemic lupus erythematosus: A review of neuropathologic findings in 57 cases, 1955–1977 // Sem Arthritis Rheum. 1979. Vol. 8. Р. 212–221.
17. Everett C.M., Graves T.D. et al. Aggressive CNS lupus vasculitis in the absence of systemic disease activity // Rheumatology (Oxford). 2008. Vol. 47. Р. 107–109.
18. Kleinig T.J., Koszyca B. Fulminant leucocytoclastic brainstem vasculitis in a patient with otherwise indolent systemic lupus erythematosus // Lupus. 2009. Vol. 18. Р. 486–490.
19. Rizos T., Siegelin M. et al. Fulminant onset of cerebral immunocomplex vasculitis as first manifestation of neuropsychiatric systemic lupus erythematosus (NPSLE) // Lupus. 2009. Vol. 18. Р. 361–363.
20. Lukjanowcz M., Brzosko M. Myelitis in the course of systemic lupus erythematosus // Polskie Arch Med Wew. 2009. Vol. 119. (1–2). Р. 67–72.
21. Krishnan C., Kaplin A.I., Deshpande D.M. et al. Transverse Myelitis: pathogenesis, diagnosis and treatment // Front Biosci. 2004. Vol. 9. Р. 1483–1499.
22. Frohman E.M., Wingerchuk D.M. Transverse Myelitis // N Engl J Med. 2010. Vol. 363. Р. 564–572.
23. Lu X., Gu Y., Wang Y. et al. Prognostic factors of lupus myelopathy // Lupus. 2008. Vol. 17. Р. 323–328.
24. Sanna G., Bertolaccini M.L., Mathieu A. Central nervous system lupus: a clinical approach to therapy // Lupus. 2003. Vol. 12. Р 935–942.
25. Jennekens F.G.I., Kater L. The central nervous system in systemic lupus erythematosus. Part I: Clinical syndromes: a literature investigation // Rheumatology (Oxford) 2002. Vol. 41. Р. 605–618.
26. Ramos P.C., Mendez M.J., Ames P.R., Khamashta M.A., Hughes G.R. Pulse cyclophosphamide in the treatment of neuropsychiatric systemic lupus erythematosus // Clin Exp Rheumatol. 1996. Vol. 14. Р. 295–299.
27. Boumpas D.T., Yamada H., Patronas N.J., Scott D., Klippel J.H., Balow J.E. Pulse cyclophosphamide for severe neuropsychiatric lupus // Q J Med. 1991. Vol. 81. Р. 975–984.
28. Barile L., Lavalle C. Transverse myelitis in systemic lupus erythematosus—the effect of IV pulse methylprednisolone and cyclophosphamide // J Rheumatol. 1992. Vol. 19. Р. 370–372.
29. Barile–Fabris L. et al. Controlled clinical trial of IV cyclophosphamide versus IV methylprednisolone in severe neurological manifestations in systemic lupus erythematosus // Ann Rheum Dis. 2005. Vol. 64. Р. 620–625.
30. Pine D. et al. The therapeutic uses of intravenous immunoglobulins in autoimmune rheumatic diseases // Rheumatol. 2002. Vol. 41. Р. 367–374.
31. Murrae E., Perry M. Off–label use of rituximab in systemic lupus erythematosus: a systemic review // Clin Rheumatol. 2010 [Epub ahead].
32. Tokunaga M., Saito K. et al. Efficacy of rituximab (anti–CD20) for refractory systemic lupus erythematosus involving the central nervous system // Ann. Rheum. Dis. 2007. Vol. 66. Р. 470–475.
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапи
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапии метилпреднизолоном (МП) и циклофосфаном (ЦФ) у больных с волчаночным нефритом, поражением центральной нервной системы (ЦНС) и цитопеническим кризом способствует ускорению сроков достижения клинического улучшения. Патофизиологическим обоснованием для применения ударных доз метилпреднизолона является его способность активно влиять на систему иммунитета и подавлять воспалительные реакции. Один из важнейших эффектов ударных доз КГ — подавление активности нейтрофилов и моноцитов и способность вызывать транзиторную перераспределительную лимфопению. Угнетающее воздействие мегадоз кортикостероидов на функцию В-лимфоцитов приводит к стойкому снижению продукции иммуноглобулинов, а следовательно, и аутоантител, а также к уменьшению образования патологических иммунных комплексов. Из других важных компонентов механизма действия ударных доз КГ заслуживают внимания воздействие на систему цитокинов-интерлейкинов-1,6, фактора некроза опухоли, металлопротеиназ и липокортина, ингибиция экспрессии и функциональной активности Fc и СЗ рецепторов мононуклеарных фагоцитов.
Консервативная терапия с использованием подавляющих доз преднизолона и цитостатиков, назначаемых внутрь, у некоторых больных улучшает клиническую картину, но почти не влияет на жизненный прогноз, особенно в случаях прогрессирующего волчаночного нефрита, церебрального криза и геморрагического пневмонита. Однократное трехдневное применение ПТ МП может за сравнительно короткое время уменьшить клиническую и лабораторную активность при нефротическом синдроме. Однако 5-летняя выживаемость пациентов, как правило, не превышает 60%. Другими словами, ударные дозы МП прекрасно зарекомендовали себя в качестве фактически ургентной терапии, с успехом применяющейся в ситуациях, непосредственно угрожающих жизни пациента, при нарастании симптоматики и в случаях неэффективности или невозможности использования консервативной схемы лечения.
Практически при всех прогрессирующих хронических заболеваниях, в том числе и аутоиммунных, жизненный и социальный прогноз в огромной степени зависит от системного, программного подхода к терапии.
Различные схемы и программы интенсивной терапии у больных СКВ стали появляться уже с середины 80-х годов и сводились к назначению ПТ в ежемесячном режиме в течение полугода. Несколько позже появилась схема программного назначения ПТ в комбинации с циклофосфаном: 1 г циклофосфана может быть добавлен к стандартной пульс-терапии обычно на 2-3-й день лечения или дополнительно к метипреду при ежемесячном режиме. Показанием для комбинированного использования циклофосфана и метипреда является манифестная высокоактивная СКВ с выраженными иммунологическими нарушениями. Программное применение пульс-терапии ЦФ у больных быстро прогрессирующим люпус-нефритом впервые в стране предложила группа исследователей во главе с профессором И. Е. Тареевой. Согласно этой методике, ЦФ вводится внутривенно из расчета 1 г на 1 м 2 поверхности тела 1-2 раза в месяц в течение года. По сравнению с пероральным назначением ЦФ эта программа позволяет добиться хороших и стабильных результатов более чем у 70% больных с прогрессирующим нефритом. Особенно важным представляется то, что внутривенное введение мегадоз ЦФ оказывает значительно меньшее токсическое воздействие на эпителий мочевого пузыря и костный мозг, практически не вызывая геморрагических циститов и агранулоцитоза.
Другое направление интенсивной терапии ревматических заболеваний — экстракорпоральные методы лечения: плазмаферез (ПФ) и практически все сорбционные технологии, гемо- и плазмосорбция. В современном исполнении ПФ осуществляется с помощью центрифужной или мебранной технологии с удалением 40-60 мл плазмы на 1 кг веса больного. Для замещения потери белка используется альбумин или свежезамороженная плазма. Стандартные курсы ПФ состоят из 3-6 процедур, проводимых последовательно или с короткими интервалами, с суммарной эксфузией плазмы до 15 л.
Интерес к ПФ у ревматологов возник на рубеже 60-80-х годов после фундаментальных исследований, посвященных иммунокомплексной природе СКВ, изучению механизмов иммунокомплексного поражения органов и тканей и патогенетической роли антител к нативной ДНК. Представлялось вполне рациональным уменьшить степень тканевых повреждений за счет удаления из циркуляции иммунных комплексов (ЦИК), антител к ДНК (а-ДНК), криоглобулинов и цитокинов.
Первые попытки применения терапевтического ПФ у больных СКВ продемонстрировали возможности этого метода в первую очередь в ситуациях, когда кортикостероидная и иммуносупрессивная терапия оказывается неэффективной, при наличии высокого уровня ЦИК, а-ДНК, криоглобулинемии, цитопениях. Выявлена прямая зависимость между адекватным удалением из циркуляции патологических белковых структур и клиническим эффектом, изучены механизмы деблокирования РЭС и повышения естественного клиренса.
Эффективность плазмафереза (от нескольких процедур до многократно повторяемых серий при неблагоприятном течении СКВ) хорошо известна и доказана в ходе многочисленных, в основном зарубежных, исследований 80-90-х годов. Пока не получено убедительных данных об эффективности ПФ у больных люпус-нефритом. Результаты проведенных в США и Канаде открытых и контролируемых испытаний весьма противоречивы.
Идея синхронной ИТ материализовалась уже в 80-х годах и является практически неотъемлемой частью лечения некоторых системных васкулитов, синдрома Гудпасчера, Вегенера, Хаммана-Ричи, криоглобулинемической пурпуры и поражения центральной и периферической нервной системы при болезни Шегрена. Первые успешные попытки применения синхронной ИТ у больных СКВ были предприняты в 1984 году в Японии, России и Германии: за рубежом — плазмаферез в комбинации с ЦФ, в России — ПФ в комбинации с пульс-терапией МП и ЦФ.
В Институте ревматологии начиная с середины 80-х изучалась эффективность синхронного применения ПФ и пульс-терапии МП и ЦФ у 56 больных СКВ с неблагоприятным жизненным прогнозом. Методика проведения синхронной интенсивной терапии (СИТ) заключалась в следующем: в течение первого месяца больным проводились три процедуры ПФ с удалением не менее 1500 мл плазмы за сеанс, интервалы между процедурами составляли 5-6 дней. После каждой процедуры назначался внутривенно 1 г метипреда, а после второй процедуры к МП добавлялся 1 г ЦФ. Далее в течение года через каждые 3 месяца проводилась одна процедура ПФ с последующим введением 1 г МП и 1 г ЦФ. Основу группы составляли молодые женщины, в подавляющем большинстве с небольшим сроком заболевания, с развернутой клиникой СКВ. Почти у каждого пациента наблюдался прогрессирующий волчаночный нефрит, более чем у половины — нефротический синдром, церебропатия, у трети больных на фоне криоглобулинемии наблюдался распространенный генерализованный васкулит кожи и слизистых оболочек. Высокая клиническая активность сопровождалась значительным повышением уровня антител к ДНК, ЦИК и гипокомплементемией.
Особо следует подчеркнуть, что у половины больных этой группы стандартная терапия, включавшая в себя массивные дозы кортикостероидов и иммунодепрессантов, была неэффективной, а почти трети пациентов адекватная терапия вообще не проводилась.
Многолетнее наблюдение за этой группой больных по окончании 12-месячной СИТ позволило сделать заключение о ее высокой эффективности. Среди этих пациентов 5-летняя выживаемость составила 81%. Наиболее показательными оказались результаты применения СИТ в группе из 12 подростков, у которых течение волчанки, как правило, приобретает фатальный характер. За весь период наблюдения состояние, близкое к клинико-лабораторной ремиссии, было отмечено у 8 из 12 больных, у 2 пациентов эпизодически наблюдались кратковременные обострения СКВ. Ежедневная доза преднизолона составляла от 2,5 до 15 мг, у одной пациентки кортикостероиды были полностью отменены. Большинству больных удалось вернуться к нормальной жизни, учебе, посильной работе, некоторые пациентки вышли замуж и имеют здоровых детей.
Таким образом, программа синхронной интенсивной многомесячной терапии оказывает значительное влияние на клинико-лабораторные проявления и существенно улучшает жизненный и социальный прогноз у больных СКВ с прогностически неблагоприятным вариантом течения. Синхронное назначение ПФ и внутривенное введение ударных доз МП и ЦФ могут использоваться по жизненным показаниям в случаях так называемого волчаночного криза — при тромбоцитопенической пурпуре, церебральной коме, развитии тромбозов, инфарктов и инсультов у больных с антифосфолипидным синдромом и геморрагическим пневмонитом. В этих ситуациях проведение СИТ обычно ограничивается 3-4 последовательными процедурами — вплоть до купирования ургентной ситуации. В случаях с заведомо неблагоприятным долгосрочным жизненным прогнозом — прогрессирующий гломерулонефрит или поражение ЦНС, язвенно-некротический васкулит, острое начало болезни у подростка — требуется проведение длительных программ СИТ.
Нам представляется, что возможности программной СИТ далеко не исчерпаны. Перспективным может оказаться добавление в схему внутривенного иммуноглобулина, моноклональных антител и интерферонов, применение которых способно блокировать образование аутоантител и патологических ЦИК. Весьма актуальным остается индивидуальный подбор программы с более частым (ежемесячным, еженедельным) назначением плазмафереза и ПТ. Особенно важным аспектом, обеспечивающим возможность проведения более длительных и полноценных курсов экстракорпоральных процедур, является внедрение новых технологий обработки плазмы, таких, как каскадная фильтрация и иммуносорбция, применение которых позволяет сводить к минимуму потерю альбумина и селективно удалять из циркуляции патологические аутоантитела и иммунные комплексы.
Читайте также:

