Фокальная очагов инфекции что это такое
Обновлено: 23.04.2024
Очаговая инфекция в практике оториноларинголога
Журнал: Вестник оториноларингологии. 2014;(4): 4‑6
Пальчун В.Т. Очаговая инфекция в практике оториноларинголога. Вестник оториноларингологии. 2014;(4):4‑6.
Pal'chun VT. The focal infection encountered in the practical work of an otorhinolaryngologist. Vestnik Oto-Rino-Laringologii. 2014;(4):4‑6. (In Russ.).
Таким образом формируется острая стадия очага инфекции. Она продолжает прогрессировать, микробы становятся все более защищенными, и в течение 3-4 нед завершается хронизация острого воспаления. Главной характеристикой хронической стадии является то, что иммунные возможности и антибактериальное лечение оказываются недостаточными для полной элиминации инфекции. Консервативное лечение уже не может полностью подавить хронический очаг инфекции в ЛОР-органах, оно может лишь снять обострение процесса.
Элиминация очаговой инфекции (выздоровление) в полостях околоносовых пазух и среднего уха, в небных миндалинах, в гортани может произойти самостоятельно или в результате лечения лишь в острой стадии очаговой инфекции, когда механизмы устойчивости микробов в очаге инфекции еще не полностью сформировались. Эффективность консервативного лечения по этой причине тем выше, чем раньше оно начато, и проводится соответствующими препаратами в адекватной дозировке до завершения воспаления. В противном случае имеется большая вероятность хронизации и возникновения осложнений. Достоверным признаком хронизации наряду с местными симптомами являются последующие обострения воспалительного процесса.
Закономерности развития очаговой инфекции верхних дыхательных путей и уха во многом раскрывает и объясняет взаимосвязь и единство ЛОР-органов с другими органами и системами.
В структуре общей патологии большой удельный вес имеют заболевания ЛОР-органов, представленные в значительной мере острой и хронической очаговой инфекцией. В одних случаях эта инфекция осложняется распространением инфекции и формированием новых заболеваний, сопровождающихся нарушением функционального состояния организма и отрицательным влиянием на течение уже имеющихся болезней, в других - частым переходом инфекции по контакту на соседние или отдаленные органы с формированием тяжелых осложнений.
Кроме этого, осложнения очаговой инфекции верхних дыхательных путей и уха часто сопровождаются отеком (гипертрофией) слизистой оболочки в области очага инфекции, что соответственно суживает (и даже закрывает) выводные протоки полостей (околоносовых пазух, среднего уха) и нарушает их дренаж. Последнее ведет, как правило, к активизации воспалительной реакции окружающих тканей в виде нарастания отека, инфильтрации, образования гнойного экссудата, нарастанию интоксикации организма. При этом возрастает вероятность генерализации инфекции.
Клиническая значимость очаговой инфекции в оториноларингологии, как и во всей медицине, оценивается по характеру развития местного процесса, участию инфекции (или возможности участия) в патогенезе многочисленных местных и общих заболеваний (осложнений).
Практически все острые и хронические воспалительные процессы в оториноларингологии являются очагами инфекции и представляют опасность распространения инфекции по продолжению и контактным путем.
Отмеченные характеристики очаговой инфекции ЛОР-органов хорошо известны, так же как и особенности выбора эффективной (адекватной) лечебной тактики. Тем не менее многие врачи с завидной настойчивостью (и не только оториноларингологи) игнорируют научно обоснованную тактику лечения в этих случаях. При этом в острой стадии очаговой инфекции без учета закономерностей патогенеза нарушается адекватность консервативного лечения, а после хронизации процесса вместо хирургической элиминации инфекции продолжают в течение длительного времени применять консервативное лечение. Результатом является высокий уровень распространенности очаговой инфекции и ее осложнений.
Среди многочисленных очагов инфекции к числу наиболее клинически значимых и распространенных относится хроническая инфекция небных миндалин. Высокая агрессивность этой инфекции обусловлена рядом следующих факторов. В лимфатической ткани (в том числе и в миндалинах) при воспалении не формируется воспалительный защитный вал (выполняющий так называемую барьер-фиксирующую функцию). Эпителиальный покров стенок крипт миндалин в норме имеет множество разрывов, где эпителий отсутствует, а микробы свободно проникают из крипт в лимфаденоидную ткань миндалины и, не размножаясь, погибают, являясь в норме антигеном для выработки иммунитета.
В отличие от нормы при токсико-аллергической форме хронического тонзиллита живые и размножающиеся микробы обнаруживаются не только в лимфаденоидной ткани, но и внутри лимфоцитов, кровеносных и лимфатических сосудов небных миндалин.
Таким образом, иммунопатологическими антигенами в тонзиллярном очаге хронической инфекции являются живые размножающиеся и погибшие микроорганизмы, их токсины и альтерированные клетки миндалин. Эти особенности патогенеза токсико-аллергической формы хронического тонзиллита объясняют активное формирование в миндалинах большого количества иммунопатологических антител и, тем самым, высокую и постоянную интоксикацию и тенденцию к распространению инфекции из небных миндалин, возникновение различных осложнений.
Основным доводом против тонзиллэктомии при хроническом тонзиллите является наличие защитной (иммунной) роли у хронически воспаленных небных миндалин, которую нужно сохранить. Так ли это на самом деле? Следует отметить, что главное в данном случае заключается в том, что в иммунном процессе при хроническом тонзиллите появляется новый фактор - формирование в очаге инфекции, охватывающей всю паренхиму миндалин, иммунопатологических (агрессивных) антител, которые обусловливают токсико-аллергическую реакцию с соответствующей симптоматикой. Ведущим патогеном при хроническом тонзиллите является β-гемолитический стрептококк группы А (БГСА). Клинически диагностируемая без особых затруднений интоксикация при токсико-аллергической форме хронического тонзиллита достоверно свидетельствует о наличии в организме этиологических и иммунопатологических факторов, участвующих в возникновении грозных осложнений. Среди них - острая ревматическая лихорадка (ОРЛ) с необратимыми поражениями сердца, нефрит, поражение суставов и др. Удаление очага инфекции (тонзиллэктомия) в этот период уже не излечит наступившую патологию, оно лишь поможет уменьшить дальнейшее развитие перечисленных осложнений.
Соотношение защитных иммунных процессов в организме и агрессивных иммунопатологических антител в небных миндалинах лежит в основе тяжести патогенеза хронического тонзиллита. Классификация хронического тонзиллита, разделяющая его на простую и токсико-аллергическую формы, предусматривает диагностическую оценку иммуннопатологических (токсико-аллергических) реакций у больных. Наличие и значимость таких реакций является прямым показанием к хирургической элиминации очага инфекции (тонзиллэктомии).
Следует отметить, что небные миндалины в течение первых десятилетий жизни человека выполняют уникальную и, с точки зрения физиологии, парадоксальную функцию формирования в организме ограниченного очага инфекции, который дает антигены для становления иммунитета. Происходит это следующим образом. В лимфаденоидной ткани небных миндалин имеется по 16-18 глубоких древовидно разветвленных щелей (крипт) с общей поверхностью стенок более 250 см 2 . Микрофлора из полостей рта и глотки свободно проникает в крипты и вегетирует в них в оптимальных условиях. Стенки крипт легко проницаемы для микробов, поскольку покрыты слоем эпителия с часто встречающимися изъязвлениями. Таким образом, анатомическое устройство небных миндалин приспособлено для инкубации микрофлоры и поступления ее в паренхиму миндалин, где она является антигеном для выработки иммунитета. В ткани миндалин в норме (при отсутствии клинических признаков воспаления) обнаруживаются лишь тела погибших микробов и только в паренхиме. В то же время при токсико-аллергической форме хронического тонзиллита обнаруживаются и микробный детрит, и живые размножающиеся микробы в паренхиме, внутри сосудов и внутри лимфоцитов. В первом случае интоксикации нет, во втором - подтверждается токсико-аллергическая форма заболевания.
Таким образом, в небных миндалинах действует биологический механизм становления иммунитета посредством очаговой инфекции, уровень активности которой поддерживается общим иммунитетом и должен быть ниже интоксикационного для организма. Достоверным показателем перехода этого механизма в патологическое состояние являются клинические признаки интоксикации.
Наиболее частые местные и общие осложнения очаговой инфекции и связанное с ней ухудшение состояния организма могут быть представлены следующим образом.
В ревматическую группу осложнений, обусловленных в основном острым и хроническим тонзиллитом и фарингитом, входят такие заболевания, как уже упоминавшиеся выше ревматические поражения сердца, суставов, почек, острая ревматическая лихорадка. Часто при хроническом тонзиллите встречается хроническая субклиническая интоксикация организма с разной выраженности нарушениями (или угнетением) функционального состояния организма, практически всегда наступает ухудшение течения имеющихся заболеваний, качества жизни пациента.
К ринологическим осложнениям очаговой инфекции (гайморит, этмоидит, сфеноидит, фронтит) относятся воспалительный инфильтрат и абсцедирование в области щеки, лба, орбиты (флегмона орбиты с поражением зрения). Со стороны глотки и гортани - паратонзиллярный и заглоточный абсцессы, парафарингеальная флегмона, медиастинит, стеноз гортани, евстахиит.
Внутричерепные абсцессы и менингит могут быть рино- и отогенными, так же как и сепсис. Тромбоз сигмовидного синуса и сопутствующий ему сепсис, паралич лицевого нерва, вестибуло-кохлеарные осложнения обычно обусловлены очагом инфекции в среднем ухе.
Теоретические и практические вопросы очаговой инфекции ЛОР-органов, в частности этиология, патогенез, диагностика, лечебная тактика, во многом решены. Во всяком случае настолько, что при правильном их использовании в практической оториноларингологии была бы существенно снижена относительно высокая в настоящее время распространенность очаговой инфекции. Однако на практике крайне неудовлетворительно проводится лечение этой патологии: с большими отступлениями от научно обоснованной и хорошо известной адекватной и эффективной лечебной тактики. Обычно это выражается в том, что назначение лечения часто не соотносится с этапами развития патогенеза очага инфекции и его осложнений: не корректно подобрана, несвоевременно и не ритмично применяется (преждевременно или наоборот - излишне долго проводится стартовая и последующая терапия).
Нарушается режим лекарственной терапии и в острой стадии, а после хронизации - необоснованно длительно продолжается консервативное лечение, в то время как в этот период необходима (без всякого промедления) хирургическая элиминация хронического очага инфекции.
Таким образом, высокая заболеваемость, разнообразие и тяжесть очаговой инфекции и ее осложнений в оториноларингологии широко представлены и связаны со всеми областями медицины. Инфекционная природа локального воспаления в полостях верхних дыхательных путей и среднего уха, ее агрессивный характер, вызывающий патологию иммунной системы с образованием иммунопатологических антител, многообразие форм развития осложнений обусловливают общемедицинскую значимость этой патологии.
Взаимосвязь фокальных одонтогенных очагов инфекции и воспалительных заболеваний глаза
C. Jones описал клинический случай пациента 16 лет, у которого развилось паренхиматозное воспаление роговиц обоих глаз. Несмотря на активное антисифилитическое и другое противовоспалительное лечение в течение 6 мес, кератит прогрессировал до состояния, когда обе роговицы стали полностью непрозрачными. При этом васкуляризации роговиц не было отмечено. Лишь спустя 9 мес от начала болезни у пациента были выявлены и удалены 9 зубов с апикальными абсцессами, а также была произведена тонзиллэктомия инфицированных миндалин. Посевы гнойного содержимого из миндалин и апикальных абсцессов выявили рост одного и того же микроорганизма — гемолитического стрептококка. Впервые за все время болезни уже спустя 48 ч после санации очагов фокальной инфекции было зафиксировано улучшение состояния обоих глаз — значительное уменьшение мучительной фотофобии, гиперемии и резорбция инфильтрации обеих роговиц. Острота зрения стала уверенно расти и в итоге повысилась с правильной светопроекции до 1,0 в течение последующих 8 мес. При этом прозрачность роговиц OU полностью восстановилась, за исключением помутнения верхненаружного квадранта роговицы правого глаза [3].
Согласно теории F. Billings [6], фокус инфекции может оставаться неактивным в течение продолжительного времени, так как защитные функции организма препятствуют развитию инфекции. Однако при негативных воздействиях на организм, таких как травма, переохлаждение, стресс, острая вирусная инфекция, высокая температура и др., фокус латентной инфекции способен активироваться и привести к развитию септических осложнений.
R. Haden [7] в своих исследованиях выделил бактериальные культуры из околоверхушечных тканей 1500 удаленных зубов. Из 400 недепульпированных удаленных зубов лишь в 15% были выявлены стрептококки. Но из 500 раннее депульпированных удаленных зубов с выявленными рентгенологически гранулемами и кистами стрептококки выявлялись в 72,4% случаев, а из 600 раннее депульпированных удаленных зубов, где рентгенологически очаги инфекции выявлены не были, — в 55,7%. Самой распространенной культурой были негемолитические стрептококки.
Депульпирование зубов потенциально создает риск развития хронического инфекционно-воспалительного процесса в полости рта из-за неправильной или неполной очистки зубных каналов, неполного удаления пораженных нервов или недостаточного пломбирования открытых каналов. Эти факторы способствуют распространению микробов и образованию фокальных очагов одонтогенной инфекции [8].
P. Chojnocki [10] внутривенно вводил подопытным кроликам инфекционный материал, выделенный из депульпированных зубов 10 пациентов с иридоциклитом и 4 пациентов с ретробульбарным невритом. В большинстве случаев у кроликов проявлялась та же глазная патология, что и у пациентов. Ученый отметил также, что экстракция больного зуба пациента благоприятно влияла на состояние его глаза.
C. Henry [11] описал 50 случаев циклитов, иридоциклитов и конъюнктивитов, развившихся как следствие инфицирования непрорезавшегося 3-го моляра (зуба мудрости) и быстро купированных после его удаления. Автор считал, что поиск зубного сепсиса никогда не должен рассматриваться как полноценный, если он не включает прицельную рентгенограмму зубов мудрости. Зуб мудрости, как и любой другой зуб, может быть местом развития инфекции, однако автор приводит ряд примеров, где совершенно здоровый, но непрорезавшийся, дистопированный или ретинированный зуб мудрости вызывал воспаление глаза вследствие давления на верхние или нижние зубные нервные сплетения и рефлекторного раздражения тройничного нерва.
Дентальные источники инфекции расценивались J. Doggart [12] как пусковые факторы таких заболеваний глаза, как конъюнктивиты, склериты, эписклериты, различные формы кератитов с изъязвлениями или без, катаракты, хориоретиниты, тромбозы вен сетчатки, ретробульбарные невриты, орбитальные целлюлиты, блефариты, дакриоциститы.
P. Klieve и J. Reh описали более 50 случаев иридоциклитов и кератитов, успешно вылеченных лишь после удаления пораженных зубов. F. Krusin доложил о нескольких случаях язв роговицы, полностью излеченных после устранения дентальных очагов инфекции (цит. по [14]).
S. Mujevic [15] после тщательного обследования 127 пациентов с иридоциклитами выявил, что одонтогенная инфекция послужила непосредственной причиной развития заболевания у 49 (38,5%) из них. Причем автор заметил, что санация очагов инфекции приводила к короткому обострению симптомов с последующим немедленным выздоровлением, естественно, на фоне адекватной консервативной терапии. W. Lang [16] в ходе работы отмечал, что очаги одонтогенной инфекции были обнаружены примерно у 1/3 его пациентов, страдающих иридоциклитом. У ряда пациентов им же была выявлена ЛОР-патология, в частности тонзиллит. При этом одонтогенная инфекция была причиной иридоциклитов в 40 раз чаще, чем очаги инфекции в миндалинах.
K. Langmann [19] указывает на возможность рецидива герпетического кератита вследствие одонтогенной инфекции. У наблюдаемого им больного с тяжелым рецидивирующим герпетическим кератитом и вторичной глаукомой при рентгенологическом исследовании была обнаружена зубная гранулема в верхней челюсти на стороне пораженного глаза. После удаления зуба с гранулемой быстро достигнуто выздоровление, внутриглазное давление нормализовалось и рецидивы кератита не повторялись.
L. King и соавт. [22] описан случай септического тромбоза центральной вены сетчатки, развившегося вследствие транзиторной бактериемии на фоне глубокого кариеса верхних моляров. После проведения системной антибиотикотерапии зрение пациента полностью восстановилось.
S. Blum и cоавт. (цит. по [14]) полагали, что кератиты возникали под влиянием раздражения тригеминального ганглия, которое производил воспаленный зуб на тройничный нерв. S. Blum описал 7 случаев кератита, при которых устранение очага одонтогенной инфекции способствовало уменьшению выраженности симптомов кератита или излечению.
S. Theobald (цит. по [23]) также предположил наличие рефлекторного ответа ветвей тройничного нерва на раздражители со стороны зубных очагов инфекции и, как следствие, развитие воспаления роговицы. Автор отметил, что значительно чаще подвергается воспалению тот глаз, на стороне которого находится пораженный зуб. Преимущественно такая связь наблюдалась при очагах, расположенных в верхней челюсти. В своих работах автор призывал незамедлительно удалять пораженные зубы во избежание глазных осложнений.
И.Г. Лукомский (цит. по [25]) выдвинул нейротоксическую концепцию механизма действия инфекционных очагов полости рта на организм, суть которой заключается в следующем: при воспалительном процессе в тканях периодонта образуются промежуточные продукты распада белка типа биогенных или протеиногенных аминов, а также клеточные и тканевые яды. Эти вещества, всасываясь в кровь, раздражают нервно-трофический аппарат и воздействуют на процессы обмена и функцию вегетативной нервной системы в отдельных органах. В то же время указанные вещества, являясь антигенами, изменяют чувствительность организма, что приводит к сенсибилизации и развитию явлений общей интоксикации. И.Г. Лукомский считал, что наиболее частой причиной ротового сепсиса является хронический гранулирующий апикальный периодонтит, который из всех других форм периодонтитов является наиболее активной формой нейротоксической связи между хроническими очагами в периодонте и другими системами организма.
Поскольку стоматологические манипуляции всегда сопровождаются кровотечением, риск развития транзиторной бактериемии очень высок. В 88% случаев микрофлора одонтогенных очагов инфекции попадает в кровяное русло и временно циркулирует там до 15 мин [26].
A. Heimdahl и соавт. [27] выявили бактериемию после экстракции зуба у 100% пациентов, у 70% — после глубокой чистки зубов, у 55% — после хирургического вмешательства на 3-м моляре, у 20% — после эндодонтического лечения (механической и лекарственной обработки зубных каналов с последующей герметизацией) и у 55% — после тонзиллэктомии. D. Kaye (1985) (цит. по [28]) также установил, что в 90% случаев после удаления зубов возникала бактериемия. При этом в 74% удаленных зубов из корневых каналов были выделены Streptococcus viridans, а в 61% — Bacteroides melanogenicus. Кроме того, в корневых каналах были выявлены стафилококки, энтерококки и другие микроорганизмы.
Чаще всего бактериемия протекает бессимптомно, однако пациенты со сниженным иммунитетом имеют высокий риск развития тяжелых последствий подобной бактериемии — от случаев кератитов и эндофтальмитов, абсцессов глазницы, синдрома верхушки глазницы до абсцесса мозга, что требует срочного привлечения врачей других специальностей — офтальмологов, отоларингологов, нейрохирургов [3, 29—32]. D. May и соавт. [33] описали случай гематогенного распространения инфекции через 1 нед после стоматологического лечения, когда у пациента появились симптомы прогрессирующего увеита, перешедшего в эндофтальмит (гнойное воспаление внутренних оболочек глазного яблока), что потребовало эвисцерации — хирургического удаления содержимого глазного яблока с сохранением фиброзной оболочки. В литературе имеется множество работ, описывающих развитие эндофтальмита после удаления больного зуба [34, 35].
В исследовании G. Debelian и соавт. [36] использовали фенотипические и генетические методы, чтобы проследить распространение микроорганизмов из полости рта на фоне эндодонтического лечения. Микробиологические образцы были взяты из корневых каналов 26 пациентов с бессимптомным апикальным периодонтитом однокорневых зубов. В материале были выявлены штаммы анаэробных бактерий: Propionibacterium acnes, Peptostreptococcus prevotii, Fusobacterium nucleatum, Prevotella intermedia, Saccharomyces cerevisiae, Actinomyces israelii, Streptococcus intermedius, Streptococcus sanguis. Те же штаммы были обнаружены в кровотоке у пациентов через 10 мин по окончании пломбировки канала зуба.
В подтверждение изложенного M. Kilian и соавт. [37] приводят данные о том, что распространение микроорганизмов из полости рта в кровоток происходит в большинстве случаев менее чем за 1 мин после стоматологических процедур, и микроорганизмы из очагов инфекции способны проникать в мозг, сердце и легкие.
Анализ статистических данных за последние 40 лет показывает, что число больных с острой одонтогенной инфекцией неуклонно растет. По данным стоматологических клиник, в 1978 г. этот показатель составил 51,1—56%, в 1992 г. — 56—59%, в 2000 г. уже 63—70%, а в 2017 г. 85,5—95,6%. Болезни периодонта занимают одно из важнейших мест среди проблем в современной стоматологии [38, 39].
Результаты опроса среди стоматологов, проведенного Department of Oral Pathology (Индия) в 2017 г., показали, что 45,7% опрошенных не знали о существующей связи между фокальными очагами инфекции полости рта и заболеваниями глаз. Только 26,8% были согласны с данной теорией, в то время как 16,2% отрицали наличие взаимосвязи [40].
Хронический гранулирующий и гранулематозный периодонтиты сопровождаются воспалительными и деструктивными изменениями кости альвеолярного отростка, а продукты распада тканевых белков (биогенные амины) представляют большую опасность для организма, вызывая хроническую интоксикацию и сенсибилизацию. В 85—98% случаев периодонтит зубов служит этиологическим фактором острых воспалительных процессов в челюстно-лицевой области (периостит, абсцесс, флегмона, лимфаденит, остеомиелит челюсти) [41].
Как правило, хронический апикальный периодонтит протекает в бессимптомной форме. Гранулемы и корневые кисты часто обнаруживают в области разрушенного зуба, а также зубов после травмы и на фоне недостаточного или неправильного эндодонтического лечения кариеса и пульпита. Местом образования кисты может быть любой поврежденный зуб, однако в 2,5—3 раза чаще гнойные кисты локализуются на верхней челюсти. Киста образуется из околоверхушечной гранулемы, в которую пролиферируют активированные воспалением эпителиальные остатки периодонтальной связки, приводящие к образованию кистогранулемы, затем трансформирующейся в кисту. В неактивном состоянии гранулемы и кисты содержат незначительное количество гноя и не вызывают жалоб у пациентов, что затрудняет клиническую диагностику. В период обострения количество гноя увеличивается за счет гибели макрофагов. Гнойное воспаление повреждает костные структуры, нервные окончания и сосуды альвеолы и кости. Корневая киста всегда инфицирована — содержимое может варьировать от прозрачного серозного до гнойного; в нем обнаруживаются микроорганизмы, которые находятся в полости рта и кариозных зубах. Прорыв гноя из полости кисты в околочелюстные мягкие ткани приводит к таким осложнениям, как развитие абсцесса или флегмоны, а также образованию свищевого хода, который располагается в преддверии полости рта, небе или коже лица [42, 43].
Пути распространения инфекции. Сложные пути, по которым инфекция распространяется в организме, изучены недостаточно. Однако экспериментальные данные позволяют считать возможным существование трех путей распространения инфекции в организме — неврального, гематогенного и лимфогенного.
Невральный путь. Экспериментальные исследования, проведенные И.Ф. Баринским и соавт. [44], И.Ф. Баринским и Ф.Р. Махмудовым [45] с помощью светового микроскопа в 1964 и 1986 гг., подтвердили предположения S. Blum, S. Theobald, A. Nesburn и P. Absell о том, что герпесвирусная инфекция распространяется в различные органы двумя путями — невральным (по чувствительным, двигательным и симпатическим нервным волокнам) и гематогенным (в результате выраженного эритротропизма вируса простого герпеса — ВПГ), вследствие чего происходит заражение новых клеток.
В ходе экспериментов на кроликах A. Nesburn и соавт. [46] и P. Absell и соавт. [47] доказали, что ганглий тройничного нерва является основным резервуаром для латентного существования вируса простого герпеса (ВПГ) в течение многих лет.
При изучении механизма распространения герпетической инфекции K. Hayashi и Y. Uchida [48] пришли к выводу, что раздражение ганглия тройничного нерва приводит к реактивации ВПГ и обратному поступлению вируса из ганглия по первой ветви тройничного нерва к органу-мишени — глазу. Развиваются острый герпетический кератит или его рецидивы. Миграция вируса по нервным путям осуществляется с помощью аксоплазматического транспорта в анте- и ретроградном направлениях, распространяется интрааксонально, периневрально, эндоневрально, по леммоцитам. J. Szanto и J. Rajcani [49] доказали, что вирионы вируса герпеса после прикрепления к нервным окончаниям поглощаются аксонами и транспортируются внутри них со скоростью 1,5 мм/ч. Авторы считают невральный путь распространения ВПГ преобладающим.
Гематогенный путь. По мнению J. Bullock и J. Fleishman [50], предположительным путем гематогенного распространения инфекции является ретроградный занос через глазные вены. Верхняя и нижняя глазные вены анастомозируют с угловой и лицевой венами у медиального угла глаза. Нижняя глазная вена проходит через нижнюю глазную щель и соединяется с крыловидным венозным сплетением. Эти вены не имеют клапанов, и в них нет сопротивления распространению инфекции. Отсутствие клапанов при наличии анастомозов между венами глазницы и лица, пазух носа и крылонебной ямки формирует условия для оттока крови в трех направлениях: в пещеристую пазуху, крылонебную ямку и к венам лица. Это создает возможность распространения инфекции с кожи лица, из пазух носа в глазницу и пещеристую пазуху. C кровотоком по указанным венам инфекция распространяется из полости рта и придаточных пазух носа в орбиту, далее — по глазным, вортикозным и эписклеральным венам, осуществляющим венозный отток от переднего отрезка глаза [29, 50, 51]. R. Brooks [52] и D. Parke и соавт. [53] описано 38 и 32 соответственно случаев гематогенного распространения Candida albicans, приводивших к возникновению эндофтальмитов.
Лимфогенный путь. Лимфатическая система находится в тесной связи с кровеносной, принимая активное участие в обменных процессах, а также обеспечивая защитную функцию организма от инфекционного и интоксикационного воздействий. От фокальных очагов инфекции бактерии, вирусы и грибы способны по афферентным лимфатическим сосудам достигать лимфатических узлов (ЛУ). Далее инфекция распространяется от пораженного ЛУ к следующему ЛУ по эфферентным лимфатическим сосудам, достигая глубоких ЛУ и попадая в кровеносное русло [54].
По данным Y. Shinomura и S. Higaki [55], ВПГ обладает не только тропизмом к нервной ткани и эритроцитам, но и способностью к сохранению и размножению в лейкоцитах и лимфоцитах, что приводит к дальнейшей реактивации вируса при определенных условиях. Инфицированные ВПГ лейкоциты и лимфоциты обеспечивают последующее его распространение по ходу лимфатических сосудов, поражая близлежащие структуры.
От перикорнеального лимфатического кольца лимфа оттекает в сторону экватора, в густую сеть широко анастомозирующих между собой извитых лимфатических сосудов. Первыми Л.У. для конъюнктивальных лимфатических сосудов являются околоушные; кроме того, установлены дренажные связи конъюнктивального лимфооттока с подчелюстными и шейными ЛУ. В подчелюстные ЛУ осуществляется отток от всех зубов, кроме нижних резцов и верхних третьих моляров (для них отток лимфы идет в глубокие ЛУ шеи). Таким образом, подчелюстные и шейные ЛУ могут быть связующим звеном лимфооттока от зубов и глаз [56].
Заключение
Многочисленные наблюдения врачей разных специальностей (офтальмологов, стоматологов), изложенные в настоящем обзоре, подтверждают существование несомненной взаимосвязи очагов одонтогенной инфекции и воспалительных заболеваний глаз.
По данным литературы, фокальные очаги инфекции оказывают раздражающее или токсическое воздействие на вторую и третью ветви тройничного нерва, вызывая рефлекторное раздражение ганглия тройничного нерва, являющегося резервуаром для вируса герпеса. Вирус простого герпеса, имеющий тропность к нервной ткани и эритроцитам, распространяется из ганглия тройничного нерва по глазничной ветви тройничного нерва нейрогенным, а также гематогенным путем. Таким образом, инфекция через сосуды и нервы в супрахориоидальном пространстве достигает переднего отрезка глаза. Гематогенный путь распространения микробной инфекции возможен благодаря анастомозу верхней и нижней глазных вен с угловой и лицевой венами. Лимфатический путь распространения предположительно осуществляется через подчелюстные и шейные лимфатические узлы, которые служат общим звеном в системе оттока лимфы от зубов и глаз.
Знание того, что одонтогенные очаги инфекции являются потенциальными триггерами возникновения и развития тяжелых воспалительных заболеваний глаз, обеспечит стоматологам и офтальмологам повышение качества своевременной дифференциальной диагностики с установлением этиологии заболевания, эффективность лечения и предупреждение рецидивов данных тяжелых заболеваний.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
КАК ЦИТИРОВАТЬ:
МКБ-10
Общие сведения

Причины хориоретинита
Воспалению хориоидеи и сетчатой оболочки способствует множество факторов. Описана вирусная, бактериальная и паразитарная природа патологии. Доказано, что риску развития заболевания более подвержены лица, страдающие миопией высокой степени. Роль других аномалий клинической рефракции в этиологии поражений увеального тракта не изучена. Основные причины хориоретинита:
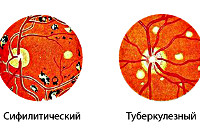
- Инфекционные заболевания. Болезнь часто возникает на фоне туберкулёза, сифилиса. При туберкулёзной природе патологии офтальмоскопически выявляются очаги поражения разной давности, которые отличаются по окраске. При сифилисе изменения со стороны заднего отдела глаз менее выражены.
- Травматические повреждения. При посттравматическом генезе воспалительному процессу предшествуют разрывы сосудистой оболочки и кровоизлияния в супрахориоидальное пространство. В большинстве случаев удается выявить входные ворота инфекции. Хориоретинит сочетается с поражением переднего сегмента глаз.
- Фокальные инфекции. Патологические агенты могут распространяться гематогенным путём при наличии очага острой или хронической инфекции в ротовой полости, глазнице или поражении ЛОР-органов. Возбудителем, как правило, выступают пиогенные штаммы бактерий.
- Токсоплазмоз. Возбудитель способен проникать в задний сегмент глазного яблока гематогенным путем. Наиболее распространены случаи внутриутробного инфицирования. Патология часто сочетается с другими пороками развития глаз (анофтальм, микрофтальм).
Патогенез
В механизме развития болезни ведущее значение отводится воздействию бактериальных токсинов, которые запускают аллергические реакции, реже – аутоиммунный процесс. Бактерии или вирусы могут проникать в структуры увеального тракта эндогенным или экзогенным путём. Предрасполагающие факторы к развитию патологии – анатомические (широкое сосудистое ложе) и гемодинамические (замедление кровотока) особенности строения. Первой поражается сетчатка. Распространение патологических агентов в сосудистую оболочку происходит вторично. Атрофия анатомических образований увеального тракта возникает из-за нарушения кровоснабжения, которое в норме происходит благодаря хориокапилярным сосудам. Выделяют негранулематозный и гранулематозный типы воспалительного процесса.
Классификация
По характеру течения в офтальмологии различают острую и хроническую формы воспаления. В зависимости от локализации зоны поражения выделяют панувеит, периферический и задний увеит, который подразделяют на очаговый, мультифокальный, диссеминированный, нейрохориоретинит и эндофтальмит. По активности хориоретинит классифицируют на следующие стадии:
- Активную. Характеризуется прогрессирующим снижением остроты зрения. Пациенты отмечают повышенную утомляемость при выполнении зрительной работы, которая сочетается с ухудшением самочувствия.
- Субактивную. Занимает промежуточное положение между активной и неактивной стадиями. Выявляется при инфекционном процессе другой локализации. Клиническая симптоматика мало выражена. При отсутствии своевременного лечения переходит в хроническую форму.
- Неактивную. Признаки воспаления отсутствуют. При офтальмоскопии обнаруживаются хронические очаги инфекции плотной консистенции. Пациенты отмечают стойкую зрительную дисфункцию, которая не прогрессирует. Неактивная стадия является случайной находкой.
В классификации по локализации воспалительного процесса выделяют центральную и периферическую формы. Возможно диффузное и очаговое поражение увеального тракта. Патологические очаги могут быть единичными и множественными.
Симптомы хориоретинита
В случае тяжелого течения отмечается выпадение отдельных участков зрительного поля, фотопсии. Развитие микро- и макропсий ведёт к искажению предметов перед глазами. Многие больные указывают на то, что появлению клинической симптоматики предшествуют инфекционные, системные и аутоиммунные заболевания. Реже хориоретинит возникает после перенесённых оперативных вмешательств на глазном яблоке или глазнице. Визуально патологических изменений не выявляется. Ввиду того, что острота зрения длительное время может оставаться нормальной, постановка диагноза часто затруднена.
Осложнения
Повышенная экссудация приводит к развитию офтальмогипертензии, реже возникает вторичная глаукома. Гнойный хориоретинит осложняется невритом зрительного нерва. Скопление экссудата и организация гнойных масс ведут к развитию пан- и эндофтальмита. Атрофии сетчатки зачастую предшествует ее разрыв или отслойка. Массивные кровоизлияния становятся причиной возникновения гифемы и гемофтальма. При поражении фоторецепторов внутренней оболочки глаза нарушается цветовое зрение. У большинства пациентов выявляется гемералопия. В прогностическом плане наиболее неблагоприятным осложнением является полная слепота.
Диагностика
Постановка диагноза базируется на анамнестических данных, результатах инструментальных и лабораторных методов исследования. При объективном осмотре патологические изменения не выявляются. Это важный критерий, который позволяет дифференцировать хориоретинит с патологией переднего полюса глазного яблока. Лабораторная диагностика сводится к проведению:
- Бактериологического посева. Материалом для исследования служит биоптат орбитальной конъюнктивы или конъюнктивальная жидкость. Цель метода – выявление возбудителя и определение чувствительности к антибактериальной терапии.
- Иммуноферментного анализа (ИФА). Изучение титра антител (Ig M, Ig G) применяется для обнаружения возбудителей хламидиоза, простого герпеса, токсоплазмоза, цитомегаловируса. ИФА позволяет оценить стадию активности воспалительного процесса.
- Теста на определение С-реактивного белка. Выявление протеина в крови даёт возможность исключить или подтвердить аутоиммунную природу заболевания. При положительном тесте на С-протеин проводятся ревмопробы.
С целью постановки диагноза и оценки объема поражения офтальмолог применяет инструментальные методы. При помощи визометрии определяется снижение остроты зрения разной степени выраженности со склонностью к миопическому типу рефракции. Повышение внутриглазного давления (ВГД) наблюдается только при средней тяжести и тяжелом течении. Специфическая диагностика включает:
- Гониоскопию. В передней камере глазного яблока выявляется скопление гноя, что свидетельствует о гипопионе или экссудате. Кровоизлияние в переднюю камеру глаза ведёт к гифеме.
- Офтальмоскопию. При офтальмоскопическом осмотре визуализируются очаги поражения серовато-желтого оттенка с нечеткими контурами, точечные кровоизлияния. Обнаружение ограниченного участка белого цвета свидетельствует об атрофии. Область желтого пятна пигментирована.
- Флуоресцентную ангиографию сетчатки (ФАГ). Удаётся визуализировать признаки васкулита сетчатки. При проведении ФАГ с контрастом выявляются тёмные пятна в месте скопления индоцианина зеленого.
- Периметрию. При периферической форме болезни отмечается концентрическое сужение зрительного поля. Очаговое поражение ведёт к выпадению небольших участков с поля зрения.
Дифференциальная диагностика
Дифференциальная диагностика проводится с дистрофией желтого пятна и злокачественными новообразованиями сосудистой оболочки. В отличие от опухоли при хориоретините обнаруживается перифокальный очаг воспаления с размытыми конурами. При дистрофических изменениях желтого пятна признаки воспаления и помутнения стекловидного тела отсутствуют. При травматическом происхождении болезни проводится рентгенография глазницы, которая дает возможность выявить патологические изменения позадибульбарной клетчатки и костных стенок орбиты (перелом, смещение обломков).
Лечение хориоретинита
Этиотропная терапия базируется на лечении основного заболевания. При травматической этиологии требуется проведение оперативного вмешательства, которое направлено на пластику костной стенки глазницы, сопоставление смещенных обломков. Перед операцией и в раннем послеоперационном периоде показан короткий курс антибиотиков. Консервативная терапия сводится к назначению:
- Нестероидных противовоспалительных средств. Применяются с целью купирования воспалительного процесса. Пациентам проводятся ежедневные инстилляции по 5-6 раз в день. При осложненном течении показано ретробульбарное введение.
- Мидриатиков. М-холиноблокаторы и симпатомиметики используются с целью профилактики образования синехий и для улучшения оттока водянистой влаги. Своевременное назначение мидриатиков снижает риск развития глаукомы.
- Гормональных препаратов. Показание к назначению – острый хориоретинит. Больным проводятся инсталляции или субконъюнктивальные инъекции гидрокортизона. Дополнительно можно закладывать 3-4 раза в сутки под веко гидрокортизоновую мазь.
- Антибиотиков. Антибактериальная терапия осуществляется при токсоплазмозной природе хориоретинита, а также в случае присоединения бактериальных осложнений. При недостаточном эффекте дополнительно показаны сульфаниламиды.
- Репарантов и биогенных стимуляторов. Препараты данной группы способствуют регенерации сетчатки. Доказана целесообразность применения таурина, сульфатированных гликозаминогликанов.
Для повышения эффекта от консервативного лечения в подостром периоде или при хроническом течении болезни назначаются физиотерапевтические процедуры. При помощи электрофореза вводится хлорид кальция, антибактериальные средства, протеолитические ферменты растительного происхождения. На стадии разрешения патологии используется ультразвуковая терапия на стороне поражения. Вне зависимости от формы воспаления показано применение витаминов группы В, С и РР. При повышении ВГД целесообразно назначение гипотензивных средств.
Прогноз и профилактика
Прогноз зависит от этиологии, иммунного статуса пациента, локализации и распространенности патологического процесса. При отсутствии своевременной диагностики и лечения исходом болезни становится атрофия сосудистой оболочки, а также сетчатки, что приводит к полной слепоте. Специфическая профилактика отсутствует. Неспецифические превентивные меры направлены на санацию очагов фокальной инфекции, предупреждение развития инфекционных и паразитарных заболеваний. При высоком риске травмирования глаз следует применять средства индивидуальной защиты (очки, маску).
Фокальная эпилепсия — такой вид эпилепсии, при котором эпилептические приступы обусловлены ограниченной и чётко локализованной зоной повышенной пароксизмальной активности головного мозга. Зачастую носит вторичный характер. Проявляется парциальными сложными и простыми эпи-пароксизмами, клиника которых зависит от расположения эпилептогенного очага. Диагностируется фокальная эпилепсия по клиническим данным, результатам ЭЭГ и МРТ головного мозга. Проводится противоэпилептическая терапия и лечение причинной патологии. По показаниям возможно хирургическое удаление зоны эпилептической активности.
Общие сведения
Понятие фокальной эпилепсии (ФЭ) объединяет все формы эпилептических пароксизмов, возникновение которых связано с наличием в церебральных структурах локального очага повышенной эпи-активности. Начинаясь фокально, эпилептическая активность может распространяться от очага возбуждения на окружающие мозговые ткани, обуславливая вторичную генерализацию эпиприступа. Такие пароксизмы ФЭ следует отличать от приступов генерализованной эпилепсии с первично-диффузным характером возбуждения. Кроме того, существует мультифокальная форма эпилепсии, при которой в головном мозге имеются несколько локальных эпилептогенных зон.
Фокальная эпилепсия составляет около 82% от всех эпилептических синдромов. В 75% случаев она дебютирует в детском возрасте. Наиболее часто она возникает на фоне нарушений развития мозга, травматического, ишемического или инфекционного поражения. Подобная вторичная фокальная эпилепсия выявляется у 71% всех страдающих эпилепсией пациентов.

Причины и патогенез фокальной эпилепсии
Этиологическими факторами ФЭ являются: пороки развития головного мозга, затрагивающие его ограниченный участок (фокальная корковая дисплазия, артериовенозные мальформации головного мозга, врождённые церебральные кисты и т. п.), черепно-мозговые травмы, инфекции (энцефалит, абсцесс головного мозга, цистицеркоз, нейросифилис), сосудистые нарушения (перенесенный геморрагический инсульт), метаболическая энцефалопатия, опухоли головного мозга. Причиной фокальной эпилепсии могут выступать приобретённые или генетически детерминированные нарушения в метаболизме нейронов определённого участка церебральной коры, не сопровождающиеся никакими морфологическими изменениями.
Среди этиофакторов возникновения фокальной эпилепсии у детей высока доля перинатальных поражений ЦНС: гипоксия плода, внутричерепная родовая травма, асфиксия новорожденного, перенесённые внутриутробно инфекции. Возникновение фокального эпилептогенного очага в детском возрасте бывает связано с нарушением созревания коры. В таких случаях эпилепсия носит временный возраст-зависимый характер.
Патофизиологическим субстратом ФЭ выступает эпилептогенный фокус, в котором выделяют несколько зон. Зона эпилептогенного повреждения соответствует участку морфологических изменений церебральной ткани, в большинстве случаев визуализируемых при помощи МРТ. Первичная зона — это участок мозговой коры, который генерирует эпи-разряды. Область коры, при возбуждении которой возникает эпиприступ, носит название симптоматогенная зона. Выделяют также ирритативную зону — область, являющуюся источником эпи-активности, регистрируемой на ЭЭГ в межприступный промежуток, и зону функционального дефицита — участок, ответственный за сопутствующие эпиприступам неврологические расстройства.
Классификация фокальной эпилепсии
Специалистами в области неврологии принято различать симптоматические, идиопатические и криптогенные формы фокальной эпилепсии. При симптоматической форме всегда можно установить причину её возникновения и выявить морфологические изменения, которые в большинстве случаев визуализируются при томографических исследованиях. Криптогенная фокальная эпилепсия носит также название вероятно симптоматическая, что подразумевает её вторичный характер. Однако при этой форме никакие морфологические изменения современными способами нейровизуализации не выявляются.
Идиопатическая фокальная эпилепсия возникает на фоне отсутствия каких-либо изменений ЦНС, которые могли бы привести к развитию эпилепсии. В её основе могут лежать генетически обусловленные канало- и мембранопатии, расстройства созревания мозговой коры. Идиопатическая ФЭ носит доброкачественный характер. К ней относят доброкачественную роландическую эпилепсию, синдром Панайотопулоса, детскую затылочную эпилепсию Гасто, доброкачественные младенческие эписиндромы.
Симптомы фокальной эпилепсии
Ведущий симптомокомплекс ФЭ — повторяющиеся парциальные (фокальные) эпилептические пароксизмы. Они могут быть простые (без потери сознания) и сложные (сопровождающиеся утратой сознания). Простые парциальные эпиприступы по своему характеру бывают: двигательные (моторные), чувствительные (сенсорные), вегетативные, соматосенсорные, с галлюцинаторным (слуховым, зрительным, обонятельным или вкусовым) компонентом, с психическими расстройствами. Сложные парциальные эпиприступы иногда начинаются как простые, а затем происходит нарушение сознания. Могут сопровождаться автоматизмами. В период после приступа отмечается некоторая спутанность сознания.
Возможна вторичная генерализация парциальных приступов. В таких случаях эпиприступ начинается как простой или сложный фокальный, по мере его развития возбуждение диффузно распространяется на другие отделы мозговой коры и пароксизм принимает генерализованный (клонико-тонический) характер. У одного пациента с ФЭ могут наблюдаться различные по типу парциальные пароксизмы.
Симптоматическая фокальная эпилепсия наряду с эпиприступами сопровождается другой симптоматикой, соответствующей основному поражению головного мозга. Симптоматическая эпилепсия ведёт к когнитивным нарушениям и снижению интеллекта, к задержке психического развития у детей. Идиапатическая фокальная эпилепсия отличается своей доброкачественностью, не сопровождается неврологическим дефицитом и нарушениями психической и интеллектуальной сфер.
Особенности клиники в зависимости от локализации эпилептогенного очага
Височная фокальная эпилепсия. Наиболее частая форма с локализацией эпилептогенного очага в височной доле. Для височной эпилепсии наиболее характерны сенсомоторные приступы с утратой сознания, наличием ауры и автоматизмов. Средняя длительность приступа 30-60 с. У детей преобладают оральные автоматизмы, у взрослых — автоматизмы по типу жестов. В половине случаев пароксизмы височной ФЭ имеют вторичную генерализацию. При поражении в височной доле доминантного полушария отмечается постприступная афазия.
Лобная фокальная эпилепсия. Эпи-очаг расположенный в лобной доле обычно вызывает стереотипные кратковременные пароксизмы со склонностью к серийности. Аура не характерна. Зачастую отмечаются поворот глаз и головы, необычные моторные феномены (сложные автоматические жесты, педалирование ногами и т. п.), эмоциональная симптоматика (агрессия, вскрикивания, возбуждение). При очаге в прецентральной извилине возникают двигательные пароксизмы джексоновской эпилепсии. У многих пациентов эпиприступы возникают в период сна.
Затылочная фокальная эпилепсия. При локализации очага в затылочной доле эпиприступы часто протекают с нарушениями зрения: транзиторным амаврозом, сужением зрительных полей, зрительными иллюзиями, иктальным морганием и пр. Самый частый вид пароксизмов — зрительные галлюцинации длительностью до 13 мин.
Теменная фокальная эпилепсия. Теменная доля - наиболее редкая локализация эпи-очага. Поражается в основном при опухолях и корковых дисплазиях. Как правило, отмечаются простые соматосенсорные пароксизмы. После приступа возможна кратковременная афазия или паралич Тодда. При расположении зоны эпиактивности в постцентральной извилине наблюдаются сенсорные джексоновские приступы.
Диагностика фокальной эпилепсии
Впервые возникший парциальный пароксизм является поводом для тщательного обследования, поскольку может быть первым клиническим проявлением серьёзной церебральной патологии (опухоли, сосудистой мальформации, корковой дисплазии и пр.). В ходе опроса невролог выясняет характер, частоту, длительность, последовательность развития эпиприступа. Выявленные при неврологическом осмотре отклонения указывают на симптоматический характер ФЭ и помогают установить примерную локализацию очага поражения.
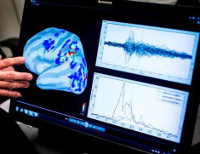
Диагностика эпилептической активности мозга осуществляется при помощи электроэнцефалографии (ЭЭГ). Зачастую фокальная эпилепсия сопровождается эпи-активностью, регистрируемой на ЭЭГ даже в межприступный период. Если обычная ЭЭГ оказывается неинформативна, то проводится ЭЭГ с провокационными пробами и ЭЭГ в момент приступа. Точное расположение эпи-очага устанавливается при проведении субдуральной кортикографии — ЭЭГ с установкой электродов под твёрдой мозговой оболочкой.
Выявление морфологического субстрата, лежащего в основе фокальной эпилепсии, производится путём МРТ. Для выявления малейших структурных изменений исследование должно проводится с малой толщиной срезов (1-2 мм). При симптоматической эпилепсии МРТ головного мозга позволяет диагностировать основное заболевание: очаговое поражение, атрофические и диспластические изменения. Если отклонения на МРТ не были выявлены, то устанавливается диагноз идиопатическая или криптогенная фокальная эпилепсия. Дополнительно может проводиться ПЭТ головного мозга, которая выявляет участок гипометаболизма церебральной ткани, соответствующий эпилептогенному очагу. ОФЭКТ на этом же участке определяет зону гиперперфузии во время приступа и гипоперфузии — в период между пароксизмами.
Лечение фокальной эпилепсии
Терапия фокальной эпилепсии проводится эпилептологом или неврологом. Она включает подбор и постоянный приём антиконвульсантов. Препаратами выбора являются карбамазепин, производные вальпроевой к-ты, топирамат, леветирацетам, фенобарбитал и др. При симптоматической фокальной эпилепсии главным моментом является лечение основного заболевания. Обычно фармакотерапия достаточно эффективна при затылочной и теменной эпилепсии. При височной эпилепсии зачастую спустя 1-2 года лечения отмечается возникновение резистентности к проводимой противосудорожной терапии. Отсутствие эффекта от консервативной терапии выступает показанием для хирургического лечения.
Операции осуществляются нейрохирургами и могут быть направлены как на удаление очагового образования (кисты, опухоли, мальформации), так и на резекцию эпилептогенного участка. Оперативное лечение эпилепсии целесообразно при хорошо локализуемом очаге эпи-активности. В таких случаях проводится фокальная резекция. Если отдельные прилегающие к эпилептогенной зоне клетки также являются источником эпиактивности, показана расширенная резекция. Хирургическое лечение проводится с учётом индивидуального строения функциональных зон коры, установленном при помощи кортикографии.
Прогноз фокальной эпилепсии
Во многом прогноз ФЭ зависит от её типа. Идиопатическая фокальная эпилепсия отличается доброкачественностью течения без развития когнитивных нарушений. Её исходом зачастую становится самопроизвольное прекращение пароксизмов при достижении ребёнком подросткового возраста. Прогноз симптоматической эпилепсии обуславливает основная церебральная патология. Он наиболее неблагоприятен при опухолях и тяжёлых пороках развития головного мозга. Такая эпилепсия у детей сопровождается задержкой психического развития, которая особенно выражена при раннем дебюте эпилепсии.
Среди пациентов, которым было проведено хирургическое лечение, у 60-70% отмечалось отсутствие или значительное урежение эпи-пароксизмов после операции. Окончательное исчезновение эпилепсии в отдалённом периоде наблюдалось у 30%.
Читайте также:

