Фолликулитам и пиодермии
Обновлено: 24.04.2024
Одним из частых заболеваний кожных покровов с особенной устойчивостью к терапии является фолликулит. Хроническое течение характерно для фолликулитов, вызванных, в частности, стафилококками. В данной статье представлено исследование препарата, который с ус
One of the most common skin diseases, remarkably resistant to the therapy is folliculitis. The chronic process is typical for folliculitis caused, in particular, by Staphylococcus aureus. This article presents a study of the drug which can be successfully used against antibiotic resistance.
С 1928 года, когда А. Флемингом был открыт первый антибиотик пенициллин, до настоящего времени группа антибактериальных препаратов значительно увеличилась. Антибиотики стали чрезвычайно популярны. Порой их назначение не оправдано, зачастую пациенты самовольно назначают себе антибактериальную терапию, что в конечном итоге привело к тому, что медицинское сообщество столкнулось с такой сложной проблемой, как резистентность к антибиотикотерапии. Основой терапевтического действия антибактериальных препаратов является подавление жизнедеятельности возбудителя инфекционной болезни в результате угнетения более или менее специфичного для микроорганизмов метаболического процесса. Угнетение происходит в результате связывания антибиотика с мишенью, в качестве которой может выступать либо фермент, либо структурная молекула микроорганизма.
Резистентность микроорганизмов к антибиотикам может быть природной и приобретенной.
Истинная природная устойчивость характеризуется отсутствием у микроорганизмов мишени действия антибиотика или недоступностью мишени вследствие первично низкой проницаемости или ферментативной инактивации. При наличии у бактерий природной устойчивости антибиотики клинически неэффективны. Природная резистентность является постоянным видовым признаком микроорганизмов и легко прогнозируется.
Под приобретенной устойчивостью понимают свойство отдельных штаммов бактерий сохранять жизнеспособность при воздействии таких концентраций антибиотиков, которые подавляют основную часть микробной популяции. Возможны ситуации, когда большая часть микробной популяции проявляет приобретенную устойчивость. Появление у бактерий приобретенной резистентности не обязательно сопровождается снижением клинической эффективности антибиотика. Формирование резистентности во всех случаях обусловлено генетически: приобретением новой генетической информации или изменением уровня экспрессии собственных генов.
Известны следующие биохимические механизмы приобретенной устойчивости бактерий к антибиотикам:
Механизмы резистентности могут быть различны, например, микроорганизм непроницаем для антибиотика (большинство грамотрицательных бактерий невосприимчивы к пенициллину G, поскольку клеточная стенка защищена дополнительной мембраной). Одной из возможных причин приобретенной резистентности может являться то, что микроорганизм в состоянии переводить антибиотик в неактивную форму (многие виды Staphylococcus spp. содержат фермент β-лактамазу, который разрушает β-лактамное кольцо большинства пенициллинов), или вследствие генных мутаций обмен веществ микроорганизма может измениться таким образом, что блокируемые антибиотиком реакции больше не являются критичными для жизнедеятельности организма [1].
Одним из основных механизмов жизненного цикла микроорганизмов, организации формы их существования в окружающей среде и резистентности к ее агрессивным условиям является способность к образованию биопленок. Согласно современным представлениям, биопленка — это совокупность микроорганизмов, в составе которой бактерии взаимодействуют друг с другом, что способствует повышению их устойчивости к факторам внешней среды. Биопленка состоит из непрерывного мультислоя бактериальных клеток, прикрепленных к поверхности раздела фаз и друг к другу и заключенных в биополимерный матрикс [2, 3]. Способностью к образованию биопленок обладает большое количество микроорганизмов, являющихся этиологическими агентами инфекционных, дерматологических, урогенитальных и других заболеваний. Наиболее изученными видами бактерий, образующих биопленки, являются стафилококки, представители семейства Enterobacteriaceae, Pseudomonas aeruginosa, генитальные микоплазмы [4].
Известно, что матрикс биопленки способен препятствовать скорости диффузии некоторых антибиотиков и других биоцидных препаратов, что зависит от его биохимического состава и метаболической активности популяции. Например, аминогликозиды, как отмечается в ряде работ, достаточно длительно диффундируют через матрикс, фторхинолоны, напротив, легко проникают через этот барьер [5–7]. По данным R. Shafreen, левофлоксацин способен проникать в биопленку, сформированную не только бактериями, но и дрожжеподобными грибами Candida albicans, нарушать их биосинтетическую активность, тем самым разрушая структурную организацию грибкового сообщества [8].
Долгие годы оставался малоизученным вопрос о причинах восстановления популяции микроорганизмов после полноценно проведенного курса антибиотикотерапии. Исследования показали, что в культуре бактерий сохраняется небольшая часть клеток, которые проявляют устойчивость к антибиотику, несмотря на то, что остальная популяция чувствительна к его действию [6, 9, 10]. В процессе изучения данной проблемы биологами и генетиками была выявлена субпопуляция клеток, которые впоследствии были названы персистерами. Персистеры — клетки, составляющие 1–5% всей бактериальной массы биотопа, которые образуются в стационарной фазе роста, не проявляют метаболической активности и обеспечивают выживание материнской популяции в присутствии летальных для других клеток факторов. Они замедляют все физиологические процессы и становятся толерантными к действию разных факторов, в том числе антимикробных препаратов. В данном ракурсе понятие антибиотикотолерантности отличается от антибиотикорезистентности. Антибиотики способны оказывать свое действие, влияя на мишени в делящейся и метаболически активной клетке. Стадия физиологического покоя позволяет сохранить часть популяции микроорганизмов и при благоприятных для нее условиях полностью регенерировать [11–14].
Одним из частых заболеваний кожных покровов с особенной устойчивостью к терапии является фолликулит. Фолликулит (folliculitis) — одна из форм пиодермии, которая возникает в волосяном фолликуле. Причиной воспалительного процесса может быть бактериальный, грибковый или вирусный агент. Если не устранены провоцирующие факторы, фолликулит рецидивирует и может стать хроническим. Хроническое течение характерно для фолликулитов, вызванных стафилококками и грибами-дерматофитами. Факторы, провоцирующие развитие фолликулитов:
В лечении стафилококкового фолликулита традиционно используют антибактериальные мази (например, мупироцин), которые наносят на пораженные участки кожи. Прием антибиотиков показан при хроническом течении фолликулита, распространенном процессе, воспалении регионарных лимфатических узлов, недостаточной эффективности местного лечения. Но и в этом случае зачастую невозможно избежать рецидивирования.
В связи с этим было принято решение о поиске средства, способного снизить резистентность бактерий к антибактериальному лечению. Был проведен анализ современной научной литературы, в которой отражалось действие различных антисептиков на рост и размножение бактерий in vitro. По результатам литературного поиска для проведения исследования эффективности антибиотикотерапии рецидивирующего стафилококкового фолликулита был выбран препарат Мирамистин® (группировочное название — бензилдиметил-миристоиламино-пропиламмоний, химическое название — бензилдиметил[3(миристоиламино)пропил]аммоний хлорид моногидрат).
В основе биологического действия препарата Мирамистин® лежит воздействие на клеточные мембраны бактериальных клеток. В результате воздействия препарата происходит нарушение структуры и функции мембран бактериальных клеток, нарушение их осмотического баланса и быстрый лизис. Мирамистин® не воздействует на оболочки клеток человека, поскольку составляющие их липиды имеют значительно большую длину радикалов, и гидрофобных взаимодействий с молекулами препарата Мирамистин® не происходит. Мирамистин® обладает выраженным антимикробным действием в отношении грамположительных и грамотрицательных, аэробных и анаэробных, спорообразующих и аспорогенных бактерий в виде монокультур и микробных ассоциаций, включая госпитальные штаммы с полирезистентностью к антибиотикам. Под действием препарата Мирамистин® снижается устойчивость бактерий и грибов к антибиотикам [15, 16].
Группой ученых были проведены серии экспериментов in vitro, где изучалось влияние бензилдиметил-миристоиламино-пропиламмония на бактерии S. аureus, находящиеся в состоянии как биопленки, так и в обособленных формах. В ходе исследования были получены данные, что, находясь в биопленке, микроорганизмы проявляли большую устойчивость к действию распространенных в практике растворов антисептиков. Вне зависимости от формы существования микроорганизма бензилдиметил-миристоиламино-пропиламмоний оказывал бактерицидный эффект на S. аureus, в том числе MRSA (метицилинорезистентный Staphylococcus aureus) [17]. Бензилдиметил-миристоиламино-пропиламмоний в концентрации 5 мкг/мл и выше обладал 100% бактерицидной активностью в отношении S. аureus [16, 18].
Целью настоящего исследования было оценить эффективность, переносимость, безопасность и удобство применения раствора для местного применения препарата Мирамистин® (бензилдиметил [3-(миристоиламино)пропил]аммоний хлорид моногидрат) при фолликулитах, устойчивых к базовой терапии топическими антибиотиками.
Материалы и методы исследования
В качестве методов оценки эффективности терапии использовались индекс DIDS (Dermatology Index of Disease Severity, дерматологический индекс тяжести заболевания) и индекс DLQI (Dermatology Life Quality Index, дерматологический индекс качества жизни).
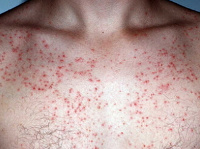
До начала лечения все пациенты проходили инструктаж по применению исследуемого препарата, подписывали форму информированного согласия, по каждому пациенту подробно велась амбулаторная карта. Типовая картина заболевания у пациента с фолликулитом, вызванным S. aureus, представлена на рис. 1. В течение 7 дней пациенты лечились самостоятельно. Терапия была комбинированной: крем, в составе которого метилурацил и хлорамфеникол, и спрей Мирамистин® (0,01%). Схема лечения: аппликация крема 1 раз/сут тонким слоем на весь пораженный участок кожных покровов, а также двукратное орошение в день спреем Мирамистин®. Данные назначения были даны в строгом соответствии с инструкцией препарата. Препарат назначался до полного разрешения симптомов, но не более двух недель (ни у одного из участников исследования симптомы не сохранялись более 9 дней). Первое нанесение препарата осуществлялось пациентами под надзором медицинского персонала. В последующем пациенты лечились самостоятельно, нанося исследуемый препарат 2 раза в день согласно представленным им письменным инструкциям.
.jpg)
В качестве метода оценки эффективности терапии использовался индекс DIDS (Dermatology Index of Disease Severity, дерматологический индекс тяжести заболевания), который был предложен исследователями медицинского центра университета Индианы (США) для оценки степени тяжести воспалительных кожных заболеваний с учетом площади поражения кожи и степени функциональных ограничений. Первый компонент индекса — оценка степени поражения поверхности тела (рис. 2).
Для каждого пациента индивидуально высчитывались проценты по каждому параметру до лечения и по истечении одной недели от начала терапии. После чего высчитывалось среднеарифметическое значение по каждому параметру, которое приобрело не целое, а дробное значение.
Общие принципы подхода к оценке:
- Текущее заболевание, распространенное в определенной области, необходимо мысленно представить в виде одного сливающегося участка поражения. Диссеминированное заболевание может фактически вовлечь только небольшой процент поверхности тела.
- Оценивается только воспалительное заболевание, прогрессирующее в момент обращения пациента.
- Участки поствоспалительной гиперпигментации и рубцы не включаются в оценку.
К моменту начала лечения среднеарифметическое значение степени поражения поверхности тела составило 14,74%, при этом с 5% площадью поражения поверхности тела было 12 человек, с 10% — 6, с 20% — 18, с 40% — 2. К концу первой недели от начала терапии динамика была следующей: с 5% площадью поражения поверхности тела — 1 человек, с 10% — 3, с 20% — 2, с 40% — 0, а среднеарифметическое значение — 1,97%. Пациент с типовой картиной фолликулита спустя 5 дней комбинированной терапии представлен на рис. 3.
.jpg)
Функциональная ограниченность при выполнении повседневных действий в быту и на работе являлась вторым компонентом оценки тяжести заболевания при использовании индекса DIDS (таблица):
- Данное функциональное ограничение должно относиться к прогрессирующему в настоящий момент. Ограничения, имевшие место в прошлом, не учитываются.
- Ограничения, связанные с сопутствующими заболеваниями, такими как артрит, не учитываются.
Исходя из данных табл., к моменту начала лечения среднеарифметическое значение степени тяжести заболевания по индексу DIDS составило 1,74, а к концу первой недели — 0,29.
Важным параметром для каждого человека, считающего себя больным, является так называемый уровень качества жизни, для оценки которого авторы исследования использовали индекс DLQI (Dermatology Life Quality Index, дерматологический индекс качества жизни). Данный индекс рассчитан для применения у пациентов старше 16 лет. Анкета заполнялась больным самостоятельно, на заполнение требовалось не более 1–2 минут. Цель анкеты — измерить, насколько проблемы с кожей повлияли на качество жизни за последнюю неделю до лечения и спустя две недели от начала лечения, за исключением последнего пункта. Оценка влияния лечебных процедур на порядок жизни давалась за последнюю неделю до лечения и за неделю самого лечения. Детальный анализ индекса DLQI проводился по шести разделам: 1) симптомы и ощущения (максимум 6 баллов); 2) повседневная деятельность (максимум 6 баллов); 3) отдых и досуг (максимум 6 баллов); 4) работа и учеба (максимум 3 балла); 5) межличностные отношения (максимум 6 баллов); 6) лечение (максимум 3 балла). По каждому показателю высчитывалось среднеарифметическое значение. Результаты измерения качества жизни представлены на рис. 4.
Результаты и их обсуждение
Заключение
В проведенном исследовании установлено, что раствор для местного применения Мирамистин®, основное действующее вещество которого — бензилдиметил [3-(миристоиламино)пропил]аммоний хлорид моногидрат, является эффективным и легко переносимым, а также косметически приемлемым средством борьбы с устойчивыми к антибиотикотерапии фолликулитами. По результатам исследования можно сделать вывод, что оптимальным режимом применения препарата является орошение спреем Мирамистин® два раза в сутки, при этом в подавляющем большинстве случаев достаточно одной недели терапии. Подобная схема лечения способствует хорошей комплаентности. Исходя из этих данных спрей Мирамистин® может быть рекомендован к широкому использованию для комбинированного лечения устойчивых форм фолликулитов различных локализаций.
Литература
- Практическое руководство по антиинфекционной химиотерапии. Под ред. Страчунского Л. С., Белоусова Ю. Б., Козлова С. Н. 2007.
- Donlan R. M., Costerton J. W. Biofilms: survival mechanisms of clinically relevant microorganisms // Clin Microbiol Rev. 2002; Apr; 15 (2): 167–193.
- Donlan R. M. Biofilms: microbial life on surfaces // Emerg. Infect Dis. 2002, Sep; 8 (9): 881–890.
- Рахматулина М. Р., Нечаева И. А. Биопленки микроорганизмов и их роль в формировании резистентности к антибактериальным препаратам.
- Garcia-Castillo M., Morosini M. I., Galvez M., Baquero F., del Campo R., Maseguer M. A. Differences in biofilm development and antibiotic susceptibility among clinical Ureaplasma urealyticum and Ureaplasma purvum isolates // J. Antimicrob. Chemother. 2008; Nov. 62 (5): 1027–1030.
- Gostev V. V., Sidorenko S. V. Bacterial biofilms and infections // Journ Infectol. 2010; 3: 4–15.
- Xavier J. B. Biofilm-control strategies based on enzymic disruption of the extracellular polymeric substance matrix — a modelling study // Microbiology. 2005; 151: 3817–3832.
- Shafreen R. M., Muthamil S., Pandian S. K. Inhibition of Candida albicans virulence factors by novel levofloxacin derivatives // Appl. Microbial. Biotechnol. 2014; Aug; 98 (15): 6775–6785.
- Pace J. L., Rupp M. E., Finch R. G. Biofilms, Infection, and Antimicrobial Therapy. CRC Press, 2005.
- Feng C., Hung Y., Yu Y., Duan G., Dai Y. Effects on quinolone resistance due to the biofilm formation activity in Ureaplasma urealyticum // Turk. J. Med. Sci. 2015; 45 (1): 55–59.
- Moons P. Bacterial interactions in biofilms // Crit. Rev. Microbiol. 2009; 35 (3): 157–168.
- Karatan E. Signals, regulatory networks, and materials that build and break bacterial biofilms // Microbiol. Mol. Biol. Rev. 2009; 73 (2): 310–347.
- Silva-Dias A. Adhesion, biofilm formation, cell surface hydrophobicy, and antifungal planktonic susceptibility: relationship among Candida spp. // Front Microbal. 2015; 12 (6): 205.
- Stepanyan K., Wenseleers T. Fitness trade-offs explain low levels of persister cells in the opportunistic pathogen Pseudomonas aeruginosa // Mol. Ecol. 2015; Apr.; 24 (7): 1572–1583.
- Павлова Н. В., Кривошеин Ю. С. Исследование возможности снижения формирования лекарственной устойчивости у стафилококков под влиянием мирамистина // Труды Крымского медуниверситета. 2000. Т. 136. С. 134–136.
- Павлова Н. В. Микробиологическое обоснование сочетанного действия мирамистина и антибиотиков при стафилококковой раневой инфекции. Автореф. канд. дисс. Харьков, 2000. С. 16.
- Винник Ю. С., Теплякова О. В., Перьянова О. В., Тяпкин С. И., Соседова Е. В. Адгезивная активность микроорганизмов в выборе дренажного полимера и местных антисептиков при инфицированном панкреонекрозе // Анналы хирургической гепатологии. 2013, т. 18, № 4.
- Кривошеин Ю. С., Рудько А. П., Тышкевич Л. В., Сарачан Т. А. Зависимость между антимикробной активностью и строением в ряду некоторых четвертичных аммониевых соединений. В кн.: Физиологически активные вещества в медицине. Киев, 1984, В. 16, с. 50–52.
Ю. К. Кузнецова* , 1
Ю. Ю. Файрузова**
К. Ю. Кузнецова*, кандидат медицинских наук
Н. С. Сирмайс***, кандидат медицинских наук
Фолликулит — инфекционное поражение средних и глубоких отделов волосяного фолликула, приводящее к его гнойному воспалению. Фолликулит может иметь бактериальную, грибковую, вирусную, паразитарную этиологию. Проявляется он появлением в местах роста волос единичных или множественных пустул, по центру которых проходит волос. Вскрывшиеся пустулы образуют язвочки, их заживление при глубоком поражении волосяного фолликула сопровождается рубцеванием. Диагностика фолликулита проводится путем дерматоскопии, микроскопии мазков и исследования отделяемого пустул. Лечение осуществляется растворами анилиновых красителей, антисептическими средствами, местным и системным применением этиотропных препаратов: антибиотиков, антимикотиков, ацикловира.
Общие сведения
Наряду с гидраденитом, сикозом, стрептодермией и стрептококковым импетиго фолликулит относится к гнойным заболеваниям кожи (пиодермиям), распространенность которых среди населения достигает 40%. В жарких странах заболеваемость фолликулитом выше, поскольку сам климат способствует развитию инфекции. Высокий уровень заболеваемости отмечается также среди социально неблагополучных слоев населения, проживающих в антисанитарных условиях.
В ряде случаев фолликулит начинается с остиофолликулита — поверхностного воспаления волосяного фолликула, захватывающее только его устье. Дальнейшее распространение инфекции в глубину фолликула приводит к трансформации остиофолликулита в фолликулит.

Причины возникновения фолликулита
Инфекционными агентами, вызывающими фолликулит, в большинстве случаев являются бактерии, преимущественно стафилококки. Встречается фолликулиты, обусловленные псевдомонадами, возбудителем сифилиса, гонореи и др. бактериями. Причиной заболевания могут быть грибковые поражения кожи (грибы рода Candida и Pityrosporum, дерматофиты), вирусы (контагиозный моллюск, простой и опоясывающий герпес) и паразиты (например, клещ, вызывающий демодекоз). В соответствии с этиологией инфекционного процесса клиническая дерматология выделяет бактериальные, грибковые, вирусные, сифилитические и паразитарные фолликулиты.
Проникновение инфекции внутрь волосяного фолликула происходит через мелкие повреждения кожи: царапины, экскориации, ссадины, мокнутия. Вероятность инфицирования повышена у людей, страдающих зудящими дерматозами (экзема, почесуха, атопический дерматит, аллергический контактный дерматит, дерматит Дюринга) и в связи с этим постоянно расчесывающими свою кожу, а также у лиц, страдающих повышенной потливостью.
Ослабление защитных сил организма и барьерной функции кожи облегчает проникновение инфекции внутрь волосяного фолликула и развитие фолликулита. Поэтому к факторам, способствующим инфицированию, относят сахарный диабет и различные иммунодефициты: ВИЧ-инфекция, состояния, связанные с длительным заболеванием или иммуносупрессорной терапией. Длительное накожное применение глюкокортикостероидов приводит к снижению местного иммунитета и также может благоприятствовать развитию фолликулита. Снижение защитных свойств кожи происходит и при длительном воздействии на нее различных химических веществ: керосина, смазок, технических масел. С эти связано возникновение профессионального фолликулита у слесарей, трактористов, нефтяников.
Симптомы фолликулита
Фолликулит начинается с покраснения и инфильтрации в области волосяного фолликула. Затем формируется пронизанная пушковым волосом коническая пустула с гнойным содержимым в центре. После ее вскрытия и освобождения от гноя образуется небольшая язвочка, покрытая кровянисто-гнойной коркой. При поражении всего фолликула после отхождения корки на коже остается гиперпигментация или рубец. Более поверхностные фолликулиты могут разрешаться, не оставляя после себя никаких следов. Процесс развития и разрешения воспаления одного фолликула занимает до 1 недели.
Чаще всего фолликулит носит множественных характер. Его элементы обычно располагаются на волосистых участках кожи: на лице, голове, в подмышечных впадинах, в паху, на ногах (в основном у женщин, депилирующих голени и бедра). Высыпания сопровождаются болезненностью и зудом различной степени выраженности. При отсутствии корректного лечения и гигиенических мероприятий фолликулит осложняется развитием фурункула, карбункула, гидраденита, абсцесса, флегмоны.
Стафилококковый фолликулит обычно локализуется в областях роста щетинистых волос, чаще всего это подбородок и кожа вокруг рта. Встречается в основном у мужчин, которые бреют бороду и усы. Может осложниться развитием сикоза.
Сифилитический фолликулит (угревидный сифилид) развивается при вторичном сифилисе, сопровождается нерубцовой алопецией в зоне роста бороды и усов, а также волосистой части головы.
Гонорейный фолликулит является осложнением при нелеченной и длительно протекающей гонореи. Излюбленная локализация — кожа промежности у женщин и крайняя плоть у мужчин.
Кандидозный фолликулит наблюдается в основном при наложении окклюзионных повязок, у лежачих больных и при длительной лихорадке.
Дерматофитный фолликулит характеризуется началом воспалительных изменений с поверхностного рогового слоя эпидермиса. Затем процесс постепенно захватывает фолликул и волосяной стержень. Может возникать на фоне трихофитии и фавуса, оставляя после себя рубцовые изменения.
Герпетический фолликулит отличается образованием везикул в устьях волосяных фолликулов. Наблюдается на коже подбородка и носогубного треугольника, чаще у мужчин.
Фолликулит, вызванный демодекозом, проявляется покраснением кожи с образованием в устьях волосяных фолликулов характерных пустул, вокруг которых отмечается отрубевидное шелушение.
Импетиго Бокхарта — еще один вариант фолликулита. Он развивается при мацерации кожи. Наиболее часто встречается при гипергидрозе или вследствие терапии согревающими компрессами.
Диагностика фолликулита
Диагностические мероприятия при подозрении на фолликулит направлены на исследование состояния волосяного фолликула; определение возбудителя, вызвавшего воспаление; исключение специфической этиологии заболевания (сифилис, гонорея); выявление сопутствующих заболеваний, благоприятствующих развитию инфекционного процесса.
На консультации дерматолога проводится осмотр высыпаний и дерматоскопия, которая помогает врачу определить глубину поражения фолликула. Производится забор отделяемого пустул для микроскопии и бактериологического посева, исследования на грибы и бледную трепонему. Для исключения гонореи и сифилиса проводится ПЦР-диагностика и RPR-тест. При необходимости пациенту назначается иммунограмма, анализ крови на сахар и другие обследования.
Лечение фолликулита
Терапия фолликулита должна соответствовать его этиологии. При бактериальном генезе фолликулита назначают мази с антибиотиками, при грибковом — противогрибковые препараты, лечение герпетического фолликулита проводят ацикловиром.
В начале заболевания достаточно местной терапии и обработки очагов поражения растворами анилиновых красителей (фукарцин, зеленка, метиленовый синий). Для предупреждения распространения инфекции на здоровые участки кожи производят их обработку салициловым или борным спиртом. Дополнительно применяется УФО.
Случаи тяжелого рецидивирующего течения фолликулита требуют системной терапии. При стафилококковом фолликулите внутрь назначают цефалексин, диклоксациллин, эритромицин. Лечение тяжелых форм псевдомонадного фолликулита проводят ципрофлоксацином. При кандидозном фолликулите применяют флуконазол и итраконазол, при дерматофитном — тербинафин. Одновременно проводят терапию сопутствующего сахарного диабета или иммунодефицитных состояний.
Пиодермии объединяют в себе гнойно-воспалительные кожные болезни, причиной которых является гноеродная микрофлора – пиококки, стафилококки и стрептококки. Примерно треть всех кожных заболеваний составляют различные пиодермии; первичные пиодермии возникают при поражении здоровой кожи, а вторичные являются осложнением заболеваний, при которых возможны повреждения кожи из-за зуда. Пиодермиями осложняется чесотка, экзема, а так же сахарный диабет и хроническая почечная недостаточность. Если пиодермия протекает с вовлечением глубоких слоев кожи, то после нее остаются стойкие рубцовые и пигментные изменения.
МКБ-10



Общие сведения
Пиодермии объединяют в себе гнойно-воспалительные кожные болезни, причиной которых является гноеродная микрофлора – пиококки, стафилококки и стрептококки. Примерно треть всех кожных заболеваний составляют различные пиодермии; первичные пиодермии возникают при поражении здоровой кожи, а вторичные являются осложнением заболеваний, при которых возможны повреждения кожи из-за зуда. Пиодермиями осложняется чесотка, экзема, а так же сахарный диабет и хроническая почечная недостаточность.
При неосложненных пиодермиях поражения кожи неглубокие и после выздоровления кожный покров полностью восстанавливается; если пиодермии принимают хроническое или затяжное течение, в процесс вовлекаются глубокие слои кожи, то остаются рубцы и пигментные пятна.
Причины пиодермий
На коже человека постоянно присутствует большое количество микроорганизмов, какие-то из них являются нормальной микрофлорой кожи, какие-то сапрофитной и транзиторной микрофлорой, которая при снижении защитных функций кожи способна вызывать пиодермии. В результате жизнедеятельности микроорганизмы выделяют ферменты, эндо- и экзотоксины, что и вызывает местную реакцию в виде пиодермий.
В патогенезе пиодермий важное место занимают условия труда и особенности кожи человека, возраст и состояние иммунной системы; снижение иммунологической реактивности человека и несоблюдение личной гигиены увеличивает вероятность возникновения пиодермий. В большинстве случаев пиодермии вызывает сапрофитная микрофлора, а потому пациенты не представляют опасности для окружающих.
Микротравмы, стрессовые ситуации, перегревание или переохлаждения являются факторами, которые снижают защитные функции кожи и повышают вероятность пиодермий; в группу риска попадают люди, страдающие сахарным диабетом, патологиями пищеварительной системы, нарушениями функции кроветворения и витаминного баланса, ожирение и истощение также угнетают местный иммунитет.
Кожа, склонная к выработке излишнего количества кожного сала, что случается при нарушениях ЦНС, наиболее уязвима для пиококков, так как изменение химического состава кожного сала снижает стерилизационные свойства кожи. Изменение гормонального фона или прием корткостероидов приводят к общим заболеваниям, которые являются предрасполагающими к пиодермиям.
Классификация пиодермий

Пиодермии классифицируют в зависимости от глубины и тяжести поражения, а так же в зависимости от возбудителя. Поверхностные пиодермии проявляющиеся остиофолликулитами, сикозами кожи – это чаще всего стафилодермии. Поверхностные стрептодермии и смешанные пиодермии клинически проявляются в виде импетиго вульгарного.
Глубокие стафилодермии проявляются в виде глубоких фолликулитов, гидраденитов, фурункулеза и карбункулеза. Глубокие воспаления кожи стрептококковой инфекцией заканчиваются язвенными поражениями кожи, протекающими по типу эктимы вульгарной. Язвенно-вегетатирующие хронические формы глубоких пиодермий чаще всего вызываются смешанной микрофлорой.
Лечение пиодермии

Лечением пиодермии занимается дерматолог. При пиодермиях волосы в очаге инфекции и вокруг него состригают, но не бреют, чтобы не допустить обсеменения патогенной микрофлорой участки здоровой кожи; если пиодермия носит генерализованный характер, то запрещаются водные процедуры, в том числе и мытье. Контакт с водой крайне не желателен, особенно в острой фазе заболевания.
Кожу вокруг пораженного участка обрабатывают спиртовыми растворами анилиновых красителей и дезинфектантами, хороший эффект оказывает салициловая кислота и раствор перманганата калия. Несмотря на то, что контакт с водой запрещен, ежедневно нужно тщательно мыть руки и обрабатывать ногти 2% раствором йода, чтобы предотвратить распространение инфекции, а также протирать здоровую кожу влажной губкой.
Питание в период лечения должно быть сбалансированным, лучше перейти на молочно-растительную диету, полностью исключить из меню экстрактивные вещества и алкоголь, ограничить употребление соли и простых углеводов. Если пациент ослаблен, имеет сопутствующие заболевания или пиодермия принимает затяжной или хронический характер течения, при присоединении симптомов интоксикации, медикаментозное лечение пиодермии целесообразно проводить антибактериальными препаратами. Перед назначением антибиотика проводят бакпосев отделяемого или соскоба, определяют возбудителя и его чувствительность к препаратам. Антибиотики пенициллинового ряда практически не назначают из-за их низкой эффективности, макролиды и тетрациклины дают хороший терапевтический эффект, но эритромицин и тетрациклин нежелательно применять для лечения детей и беременных.
Лечение комбинированными антибактериальными препаратами и цефалоспоринами (цефотаксим и др) назначают при инфицировании смешанной микрофлорой, так как эти препараты обладают широким спектром действия и устойчивы к изменчивости бактерий. Курс и дозировка препаратов назначаются индивидуально, исходя из тяжести течения пиодермий, обычно прием антибиотиков не должен быть меньше недели. Сульфаниламидные препараты менее эффективны при пиодермиях, но если у пациента непереносимость антибиотиков, то назначают сульфаметоксазол+триметоприм, сульфомонометоксин в нужных дозировках.
Активная специфическая иммунотерапия в сочетании с антибиотикотерапией и местным лечением дает хорошие результаты, особенно при хронических и вялотекущих процессах. Подкожное введение анатоксинов, специфических антигенов, стафилопротектинов два раза в неделю проводят в условиях поликлиники или в стационаре, если пациент находится на госпитальном лечении.
Для стимуляции неспецифического иммунитета прибегают к аутогемотрансфузии, переливанию компонентов крови, ультрафиолетовому облучению крови (УФОК); такие препараты как метилурацил, настойка лимонника и экстракт элеутерококка тоже стимулируют иммунную систему. Если имеются иммунные нарушения, то лечение пиодермий целесообразно проводить с назначением иммуностимуляторов группы препаратов тимуса; препаратов гамма-глобулинов и стимуляторов выработки интерферона. Витаминотерапия показана при всех видах пиодермий.
Профилактика пиодермий
Профилактика как для лиц, у которых нет в анамнезе гнойничковых заболеваний, так и для лиц с рецидивами пиодермий в анамнезе, заключается в соблюдении правил личной гигиены, в организации предупреждающих мер в быту и на производстве. Соблюдение санитарно-технических и санитарно-гигиенических норм на производстве существенно снижают заболеваемость пиодермиями в отдельно взятом учреждении. Кроме того своевременная обработка травм и микротравм позволяет исключить дальнейшее инфицирование ран и развитие пиодермий.
Регулярные профилактические медицинские осмотры с целью выявления хронических заболеваний пищеварительной системы, ЛОР-органов позволяют назначить лечение и не допустить развитие вторичных пиодермий. Для больных сахарным диабетом профилактика пиодермий заключается в более тщательном уходе за кожей, в своевременном ее увлажнении, чтобы не допускать мацерации и образования микротравм, так как при сахарном диабете даже небольшая царапина зачастую становится причиной обширных и глубоких пиодермий.
Пиодермии (гнойничковые болезни кожи) являются наиболее распространенными кожными заболеваниями во всех возрастных группах. По-видимому, это обусловлено тем, что возбудители пиодермий – стафилококки и стрептококки – часто обнаруживаются в окружающей человека среде (в воздухе, пыли помещений, а также на одежде, коже человека).
Бактериальные инфекции кожи являются междисциплинарной проблемой, они встречаются в практике хирургов, терапевтов, педиатров, гинекологов.
Пиодермии (от греч. pyon – гной, derma – кожа) составляют обширную группу различных по клиническим формам, течению и прогнозу дерматозов, в основе которых лежит гнойное воспаление кожи, ее придатков и подкожной жировой клетчатки (рис. 1).
Заболевания кожи, связанные с деятельностью бактерий, как патогенных, так и условно-патогенных, характеризуются нозологическим многообразием. Инфекционный процесс при пиодермиях порой не ограничивается лишь локальным эффектом – развитием воспаления, но может нанести серьезный урон общему состоянию организма (например, синдромы стафилококкового и стрептококкового токсического шока), приводит к возникновению заболеваний, протекающих без воспалительных явлений (точечный кератолизис) [1, 2].
Возбудителями пиодермии являются в основном стафилококки и стрептококки, относящиеся к грамположительной микробной флоре. Возникновение нагноения кожи под влиянием стафилококков и стрептококков объясняется воздействием на нее различных продуктов метаболизма, выделяемых пиогенными кокками в процессе их жизнедеятельности (экзотоксины, энтеротоксины, ферменты и др.).
В российской дерматологии общепризнанной является классификация пиодермий, предложенная Jadasson (1949) в модификации А.А. Каламкаряна (1954) и С.Т. Павлова (1957), согласно которой пиодермии в зависимости от возбудителя традиционно разделяют по этиологическому принципу – стафилодермии и стрептодермии, а также смешанные – стрептостафилодермии. По протеканию заболевания выделяют острые и хронические формы; по глубине поражения – поверхностные и глубокие, а по механизму возникновения – первичные и вторичные.
Клинические проявления гнойничковых болезней кожи разнообразны. Наиболее распространенными являются фолликулиты, вульгарный сикоз, фурункул, карбункул, гидраденит, импетиго, хроническая язвенная пиодермия. У грудных детей может развиться эпидемическая пузырчатка новорожденных и др.
Пиодермия часто осложняет зудящие кожные заболевания (так называемая вторичная пиодермия), особенно чесотку, экзему, нейродермит, атопический дерматит. Нередко вторичная пиодермия наблюдается при пузырчатке, опоясывающем герпесе, микозах, язвенно-некротическом ангиите.
Лечение гнойничковых заболеваний кожи остается одним из актуальных вопросов терапии дерматозов [3].
Лечение пиодермий всегда должно быть комплексным и включать особый режим поведения и ухода за кожей, диету, местные и системные препараты, а также физиотерапевтические процедуры.
В лечении гнойничковых заболеваний кожи необходимо соблюдать основной принцип, а именно – проводить этиотропное лечение, т. е. воздействующее на возбудителя, и патогенетическое – для устранения способствующих пиодермии факторов и коррекции сопутствующей патологии.
Режим больного пиодермией в первую очередь предполагает рациональный уход за кожей, как в очаге поражения, так и вне его.
При локализованных формах заболевания не рекомендуется мыть кожу лишь в очаге поражения и вблизи него, а при диссеминированном процессе мытье запрещается вообще.
Волосы в области расположения пиодермических элементов необходимо состричь (не брить!).
Непораженную кожу обрабатывают, особенно тщательно в окружности очага поражения, дезинфицирующими растворами (1–2% спиртовой раствор салициловой кислоты, 0,1% водный раствор перманганата калия и др.).
С целью предотвращения распространения инфекции ногти должны быть коротко острижены, дважды в день их обрабатывают 2% спиртовым раствором йода.
При длительно текущих процессах, а также при множественных высыпаниях особое внимание следует уделить диете: питание должно быть регулярным, полноценным, богатым витаминами; резко ограничивают количество соли и углеводов; полностью исключается алкоголь.
Для местного лечения поверхностных форм пиодермий используют спиртовые растворы (салициловой кислоты, камфоры), анилиновые красители (фукорцин, 1% бриллиантовый зеленый, 0,1% калия перманганат), топические антисептические и антимикробные препараты. При необходимости, принимая асептические меры, вскрывают покрышку фликтен и пустул с последующим промыванием 3% раствором перекиси водорода (водорода пероксид) и смазыванием дезинфицирующими растворами: нитрофуралом 0,1%, йода раствором спиртовым 5%. В качестве антисептических средств широко применяют хлоргексидин (0,5% спиртовой или 1% водный раствор хлоргексидина биглюконата), диоксидин, эвкалипта листьев экстракт, микроцид, повидон-йод и др.; для наружного лечения также эффективны аэрозоли, т. к. они равномерно наносятся на поверхность, быстро проникают в кожу: триамцинолон, гидрокортизон + окситетрациклин, лифузоль, декспантенол. На распространенные множественные очаги наносят мази, содержащие антибиотики и сульфаниламиды: 2% мазь, крем фуцидина, 2% мазь мупироцина, сульфадиазин, бацитрацин + неомицин, сульфатиазол серебра, левомеколь, гелиомициновая мазь 4%, линкомициновая мазь 2%, гентамициновая мазь 0,1%. Курс лечения составляет 7–14 дней.
Топические комбинированные глюкокортикостероидные препараты с противовоспалительным и антибактериальным действием назначают при вторичной пиодермии основных дерматозов (атопического дерматита, чесотки, экземы и др.): фуцикорт, фузидовая кислота, гидрокортизон + окситетрациклин, лоринден С, целестодерм с гарамицином, травокорт и др. Курс лечения 7–14 дней.
При лечении поверхностных форм пиодермий (остиофолликулиты, фолликулиты, импетиго, эктима) хороший терапевтический эффект был получен при использовании сульфатиазола серебра – 2% крема аргосульфан [4].
После первичной обработки глубоких ограниченных очагов стафилококковой инфекции показаны также рассасывающие средства, ферменты, мази, ускоряющие репаративные процессы в коже, обеспечивающие глубокое проникновение лекарственного препарата и ограничивающие распространение гноя: ихтаммол, 0,25% раствор трипсина, химотрипсин, левосин, пиолизин, актовегин, солкосерил, цинка гиалуронат.
Для лечения язвенных поражений при пиодермии применяют эпителизирующие мази и повязки, для очищения от некротических масс – ируксол, трипсин, химотрипсин. В последнее время впечатляющий эффект при лечении язвенных дефектов при пиодермии получен от применения 2% крема аргосульфан. В качестве действующего начала содержит серебряную соль сульфатиазола, которая обладает мощным антибактериальным эффектом на грамотрицательные и грамположительные микроорганизмы (стафилококки, стрептококки, вульгарный протей, кишечная палочка, клостридии и др). и более чем на порядок превосходит аналогичное действие одних сульфаниламидов. Ионы серебра, содержащиеся в креме, ослабляют сенсибилизирующие свойства сульфаниламидов, а благодаря связыванию с РНК микробных клеток они обладают и бактериостатическим действием. Серебряная соль сульфатиазола обладает слабой растворимостью и всасываемостью с раневой поверхности, что позволяет длительно поддерживать более-менее постоянную концентрацию препарата в очаге воспаления. Сульфатиазол, как составная часть крема, подавляет размножение микроорганизмов. Гидрофильная основа крема, имеющая оптимальное значение рН и содержащая большое количество воды, обеспечивает местное анальгезирующее действие и увлажнение раны, способствуя репарации тканей. Препарат наносится на очаги поражения 2–3 р./сут.
Мы применяли аргосульфан при лечении гангренозной пиодермии. Его применение в составе комплексной терапии позволило добиться у всех больных полного или почти полного клинического излечения. Это выражалось в уменьшении или исчезновении болевых ощущений при перевязках и вне их, в очищении язвенного дефекта от некротических тканей и появлении зрелых грануляций и краевой эпителизации в области язв, а также в отсутствии или резком снижении роста микрофлоры. Использование аргосульфана у всех пациентов приводило к быстрому рубцеванию язв (в среднем в течение 20–22 дней в зависимости от глубины и обширности дефекта), при этом в процессе лечения больные не отмечали никаких побочных эффектов от проводимой местной терапии.
В целях санации всей кожи рекомендуют общее ультрафиолетовое облучение или обтирание визуально здоровой кожи дезинфицирующими средствами. При отсутствии эффекта от наружного лечения глубоких поражений на лице, шее (фурункул, карбункул), при пиодермиях, осложненных лимфангитом, лимфаденитом, показано этиотропное лечение антибиотиками широкого спектра действия (парентерально или внутрь).
Системные антибиотики при пиодермиях применяют при длительном хроническом течении процесса, большой его распространенности, наличии общих явлений (лихорадка, головная боль, недомогание) и регионарных осложнений (лимфаденит, лимфангиит), локализации глубоких пиодермий на лице, особенно в области носогубного треугольника.
Лечение больных хронической пиодермией системными антибактериальными препаратами должно быть основано на результатах бактериологического анализа с определением чувствительности к ним микрофлоры.
В последние годы препараты пенициллина практически не применяются в терапии пиодермии. В настоящее время наиболее эффективными и в то же время вызывающими наименьшее число побочных реакций являются антибиотики – макролиды (эритромицин, джозамицин, кларитромицин и др.), линкомицин, тетрациклины (тетрациклин, метациклин, доксициклин). Можно назначать также рифампицин, цепорин, цефазолин, цефалотин, цефотаксим, цефтриаксон и другие антибиотики, устойчивые к β-лактамазам и имеющие широкий спектр действия. Разовые и курсовые дозы антибиотиков, способ их введения подбирают индивидуально в зависимости от клинической картины и течения процесса.
Реже антибиотиков, обычно при их непереносимости, применяются сульфаниламидные препараты, которые менее эффективны и нередко вызывают токсидермии. Обычно используют препараты пролонгированного действия (сульфамонометоксин, ко-тримоксазол и др.).
В амбулаторной практике целесообразно применять только антибиотики для приема внутрь с высокой биодоступностью и длительным периодом полувыведения (что позволяет снизить количество приемов в течение суток), при этом воздействие на микрофлору кишечника должно быть минимальным.
При лечении в условиях стационара предпочтение отдают парентеральному введению антибактериальных препаратов. При ступенчатом лечении вначале антибиотик назначают парентерально, а при положительной динамике состояния больного (через 3–7 сут) переходят на его применение внутрь. При первичных инфекциях кожи выбирают антибиотики пенициллинового ряда, альтернативные препараты – цефалоспорины II и III поколения, линкозамиды и фторхинолоны. При легкой или средней форме протекания болезни назначают лекарственные формы для приема внутрь.
При остром течении болезни антибиотик назначается курсом не менее чем на 5–7 сут, при хроническом – на 7–10 сут.
Помимо антибактериальной терапии при хронических формах пиодермии широко применяется иммунотерапия. К средствам активной специфической иммунотерапии относятся стафилококковый анатоксин (нативный и адсорбированный) и стафилококковый антифагин, стафилопротектин, представляющий собой смесь цитоплазматического стафилококкового антигена и анатоксина (препарат вводят подкожно в область нижнего угла лопатки 2 р./нед.). Первая инъекция в дозе 0,3 г, последующие четыре – по 0,5 г. Больным с тяжелыми заболеваниями внутренних органов, что является противопоказанием для проведения активной иммунотерапии, назначают антистафилококковый γ-глобулин или антистафилококковую гипериммунную плазму.
С целью стимуляции неспецифических факторов иммунитета используют аутогемотерапию, пирогенал, продигиозан, диоксометилтетрагидропиримидин, спленин, настойку китайского лимонника, экстракт элеутерококка, гемотрансфузии.
В терапии рецидивирующих, упорно протекающих пиодермий широко применяются иммуностимуляторы, особенно в тех случаях, когда есть возможность подтвердить факт иммунных нарушений: препараты тимуса (тималин, тактивин и др.), препараты γ-глобулинов (γ–глобулин внутримышечный и др.), синтетические химические вещества (левамизол, диуцифон, изопринозин), стерильный фильтрат культуральной жидкости некоторых видов самопроизвольно лизирующихся актиномицет (актинолизат), азоксимера бромид (полиоксидоний). Перспективны стимуляторы выработки интерферонов (оксодигидроакридинилацетат натрия, меглюмина акридонацетат и др.). При всех хронических, вялотекущих формах пиодермии показаны аскорбиновая кислота и витамины группы В и препараты, улучшающие микроциркуляцию (пентоксифиллин, ксантинола никотинат и др.).
При различных формах хронических глубоких пиодермий (язвенно-вегетирующая, гангренозная пиодермии) к антибиотикотерапии присоединяют системные глюкокортикоиды (преднизолон 30–60 мг/cут, метилпреднизолон, бетаметазон), цитостатики (азатиоприн 150 мг/сут, проспидия хлорид).
При лечении абсцедирующего и подрывающего фолликулита Гоффманна применяют изотретиноин из расчета 0,5–1 мг/кг массы тела в течение нескольких месяцев или комбинацию системных антибиотиков и глюкокортикоидов.
В комплексную терапию пиодермий входят физиотерапевтические процедуры: ультрафиолетовое облучение, сухое тепло, УВЧ, низкоэнергетическое лазерное излучение, wiRA-терапия – коротковолновое инфракрасное излучение, прошедшее фильтрацию через воду (780–1400 нм).
Профилактика пиодермий, как первичная (у лиц без гнойничковых заболеваний в анамнезе), так и вторичная, предусматривающая предупреждение рецидивов пиодермии, заключается в проведении определенных мероприятий на производстве и в быту.
На производстве необходимо устранение факторов, приводящих к нарушению санитарно-технических и санитарно-гигиенических норм, производственному травматизму и микротравмам.
Одним из средств борьбы с пиодермиями является своевременная обработка микротравм, для чего применяют растворы анилиновых красителей, спиртовой раствор йода, а также пленкообразующий аэрозоль нитрофурал.
Следует проводить лечение выявленных общих заболеваний, на фоне которых могут развиться гнойничковые поражения кожи (сахарный диабет, болезни пищеварительного тракта, ЛОР-органов и др.).
Вторичная профилактика пиодермии включает периодические медицинские осмотры, учет и анализ заболеваемости, диспансеризацию больных, проведение противорецидивной терапии (стафилококковый анатоксин, витамины, общие УФО, уход за кожей, санация фокальной инфекции).
Для цитирования: Таха Т.В., Нажмутдинова Д.К. Рациональный выбор антибиотикотерапиипри пиодермиях. РМЖ. 2008;8:552.
Гнойничковые заболевания кожи или пиодермиты (греч. руоn – гной) являются актуальной проблемой для здравоохранения всех стран. Пиодермиты в структуре дерматозов занимают первое место и 3–4 место в общей структуре заболеваемости человека после гриппа, респираторных и сердечно–сосудистых заболеваний [Stevens DL et al., 1989, Zeng X et al., 2006]. Это обусловлено тем, что пиодермиты нередко принимают хроническое, рецидивирующее течение, требуют упорной, продолжительной терапии. Фурункул, карбункул, гидраденит, сикоз – далеко не весь список форм данной нозологии.
Литература
1. Скрипкин Ю.К. Кожные и венерические болезни, Триада–фарм, 2005,с.127–165
2. Новоселов В.С., Плиева Л.Р. Пиодермии, РМЖ, 2004– т.12, №5, с.327–335
3. Халдин А.А. рациональная антибактериальная терапия в практике дерматовенеролога, РМЖ, 2005, т.13, №5, с.273–277.
4. Шляпников С.А., Федорова В.В. Использование макролидов при хирургических инфекциях кожи и мягких тканей. РМЖ, 2004.–т.12. №4, с.204–207.
5. Гучев И.А., Сидоренко С.В, Французов В.Н. Рациональная антимикробная химиотерапия инфекций кожи и мягких тканей. Антибиотики и химиотерапия. 2003, т.48, 10, с.25–31
6. Яковлев С.В., Ухтин С.А. Азитромицин: основные свойства, оптимизация режимов применения на основе фармакокинетических и фармакодинамических параметров. Антибиотики и химиотерапия. 2003, т. 48, №2.–с.22–27
7. Белоусова Т.А., Горячкина М.В. Бактериальные инфекции кожи: проблема выбора оптимального антибиотика РМЖ
8. Масюкова С.А., Гладько В.В. и соавт. Бактериальные инфекции кожи и их значение в клинической практике дерматолога Том 06/N 3/2004
9. Tredway G, Goyo R, Suares J et al. Comparative study of azithromycin and amoxicillin/clavulanic acid (co–amoxiclav) in the treatment of community–asquired in peadiatric patients. Zithromax ICMAS Poster Book. 1996; p. 82–3.
10. Foulds G, Johnson RB. Selection of dose regimens of azithromycin. J Antimicrob Chemother 1993; 31 (Suppl. E): 39–50.
Читайте также:

