Функциональная диспепсия ассоциированная с хеликобактер
Обновлено: 05.05.2024
Функциональная диспепсия (неязвенная, идиопатическая, эссенциальная) - это заболевание, для которого характерны неприятные ощущения (боль, жжение, вздутие, чувство переполнения после приема пищи, чувство быстрого насыщения), локализуемые в эпигастральной области, при которых не удается выявить каких-либо органических или метаболических изменений, способных вызвать указанные симптомы.
Классификация
Классификация синдрома функциональной диспепсии (СФД) в соответствии с "Римскими критериями III" (выработаны Комитетом по изучению функциональных расстройств ЖКТ в 2006 году ):
Этиология и патогенез
Этиология и патогенез СФД в настоящее время недостаточно изучены и являются спорными.
Среди возможных причин, способствующих развитию ФД, рассматривают следующие факторы:
Хронический гастрит в настоящее время рассматривают как самостоятельное заболевание, которое может возникать в сочетании или без синдрома диспепсии.
Эпидемиология
Признак распространенности: Распространено
Соотношение полов(м/ж): 0.5
По данным разных авторов, от диспепсии страдают 30-40% населения Европы и Северной Америки.
Ежегодная заболеваемость синдромом диспепсии составляет около 1%. При этом на долю функциональной диспепсии выпадает от 50 до 70% случаев.
У женщин функциональная диспепсия встречается вдвое чаще, чем у мужчин.
Клиническая картина
Клинические критерии диагностики
Cимптомы, течение
Клинические особенности различных вариантов функциональной диспепсии (в соответствии с "Римскими критериями II").
Примечание. В соответствии с новой классификацией тошноту не относят к симптомам ФД. Пациентов, у которых тошнота выступает доминирующим симптомом, рассматривают как страдающих синдромом функциональной тошноты и рвоты.
У пациентов с ФД зачастую присутствуют симптомы функциональных расстройств других органов и систем. Особенно распространенным является сочетание ФД с синдромом раздраженного кишечника. В связи с полиморфизмом симптомов часто пациенты наблюдаются у врачей различных специальностей одновременно.
У значительной части больных выражены такие жалобы астенического характера, как повышенная утомляемость, общая слабость, разбитость.
Клиническая картина ФД характеризуется нестабильностью и быстрой динамикой жалоб: у больных присутствуют колебания интенсивности симптомов в течение суток. У некоторых пациентов заболевание имеет четко выраженный сезонный или фазный характер.
При изучении анамнеза заболевания, возможно проследить, что симптоматическое лечение обычно не приводит к стабильному улучшению в состоянии пациента, а прием препаратов имеет нестойкий эффект. Иногда наблюдается эффект ускользания симптома: после успешного завершения лечения диспепсии, больные начинают высказывать жалобы на боль внизу живота, сердцебиение, проблемы со стулом и т.д.
В начале лечения нередко наблюдается быстрое улучшение самочувствия, но накануне завершения курса терапии или выписки из стационара симптомы
Диагностика
1.Продолжительность симптомов не менее трех последних месяцев, притом, что дебют заболевания произошел не менее полугода назад.
2. Симптомы не могут исчезать после акта дефекации или возникать в сочетании с изменением частоты или консистенции стула (признак синдрома раздраженного кишечника).
3. Изжога не должна быть доминирующим симптомом (признак гастроэзофагеальной рефлюксной болезни).
4. Тошноту нельзя рассматривать как симптом диспепсии, поскольку это ощущение имеет центральный генез и не возникает в эпигастрии.
Постпрандиальный дистресс-синдром
Диагностические критерии (может включать один или оба перечисленных симптома):
- чувство переполнения в эпигастрии после приема обычного количества пищи, возникающее не реже нескольких раз в неделю;
- чувство быстрого насыщения, которое не дает возможности завершить прием пищи, возникающее не реже нескольких раз в неделю.
- боль или жжение в эпигастрии средней или высокой интенсивности, возникающие не реже одного раза в неделю;
В случае, когда не удается четко выделить преобладающие симптомы, возможна постановка диагноза без уточнения варианта течения заболевания.
Для исключения органических заболеваний, способных вызвать диспепсию, применяют эзофагогастродуоденоскопию и УЗИ органов брюшной полости. По показаниям можно назначать и другие инструментальные исследования.
Лабораторная диагностика
Лабораторная диагностика выполняется с целью дифференциальной диагностики и включает в себя клинический и биохимический анализ крови (в частности содержание эритроцитов, лейкоцитов, показатели СОЭ, уровень ACT, АЛТ, ГГТ, ЩФ, глюкозы, креатинина), общий анализ кала и анализ кала на скрытую кровь.
Патогномоничные лабораторные признаки диспепсии отсутствуют.
Дифференциальный диагноз
При проведении дифференциальной диагностики важное значение имеет своевременное выявление так называемых "симптомов тревоги". Обнаружение хотя бы одного из перечисленных симптомов требует тщательного исключения тяжелых органических заболеваний.
- появление симптомов впервые в возрасте старше 40 лет.
Наиболее часто возникает необходимость дифференцировать ФД с другими функциональными расстройствами, в частности с синдромом раздраженного кишечника. Симптомы диспепсии при СФД не должны быть связаны с актом дефекации, нарушением частоты и характера стула. Тем не менее, следует иметь в виду, что эти два расстройства нередко сочетаются.
В целом дифдиагностика cиндрома функциональной диспепсии предусматривает прежде всего исключение органических заболеваний, протекающих с аналогичными симптомами, и включает в себя следующие методы исследования:
- Ультразвуковое исследование - дает возможность обнаружить хронический панкреатит, желчнокаменную болезнь.
- Рентгенологическое исследование.
- Электрогастроэнтерография - выявляет нарушения гастродуоденальной моторики.
- Сцинтиграфия желудка - применяется для обнаружения гастропареза.
- Суточное мониторирование рН - позволяет исключить гастроэзофагеальную рефлюксную болезнь.
- Определение инфицированности слизистой оболочки желудка Helicobacter pylori.
- Эзофагоманометрия - применяется для оценки сократительной активности пищевода, скоординированности его перистальтики с работой нижнего и верхнего пищеводных сфинктеров (НПС и ВПС).
- Антродуоденальная манометрия - позволяет исследовать моторику желудка и двенадцатиперстной кишки.
Лечение
Медикаментозная терапия
Назначают с учетом клинического варианта ФД и ориентируют на ведущие клинические симптомы.
Высока эффективность плацебо (13-73% пациентов с СФД).
При синдроме эпигастральной боли широко применяют антацидные и антисекреторные препараты.
Антациды традиционно используют для лечения диспепсии, однако четких данных, подтверждающих их эффективность при СФД, не получено.
Блокаторы Н2-рецепторов незначительно превосходят плацебо по своей эффективности (примерно на 20%), и уступают ИПП .
Применение ИПП, позволяет добиться результата у 30-55% пациентов при синдроме эпигастральной боли. Однако они эффективны только у лиц с ГЭРБ.
В терапии постпрандиального дистресс-синдрома используют прокинетики.
Спорным остается вопрос о необходимости проведения антихеликобактерной терапии. Это связано с тем, что роль этой инфекции в развитии заболевания пока не доказана. Тем не менее многие ведущие гастроэнтерологи считают необходимым проведение антихеликобактерной терапии у лиц, не отвечающих на другие препараты. У больных с СФД оказалось эффективным применение стандартных эрадикационных схем, которые используются при лечении пациентов с хроническими поражениями желудка и ДПК.
Врачебная тактика в соответсвии с "Римскими критериями III" выглядит следующим образом:
Первый этап лечения
Назначение симптоматической медикаментозной терапии, а также установление доверительных отношений между врачом и пациентом, разъяснение больному в доступной форме особенностей его заболевания.
Второй этап лечения
Проводится при недостаточной эффективности первого этапа лечения и в случае, когда не удается купировать имеющиеся симптомы или на их месте появились новые.
Существует два основных варианта лечения на втором этапе:
1. Назначение психотропных средств: трициклических антидепрессантов или ингибиторов обратного захвата серотонина в стандартной дозе, с оценкой эффекта через 4-6 недель. Такое лечение гастроэнтеролог, при наличии определенных навыков, может проводить самостоятельно.
2. Направление пациента на консультацию к психотерапевту с последующим применением психотерапевтических методик.
- сведения об обращении в большое количество лечебных учреждений, упорное стремление больного к проведению диагностических процедур при отсутствии
показаний;
Третий этап лечения
Рекомендуется применение более высоких доз психотропных препаратов или их комбинации под наблюдением психиатра.
Прогноз
Прогноз для жизни пациента при данном заболевании благоприятный. Риск развития органических заболеваний ЖКТ, в том числе рака желудка у пациентов СФД не выше, чем в популяции.
Прогноз в отношении выздоровления при СФД неблагоприятный, поскольку, как и все функциональные расстройства, заболевание носит хронический рецидивирующий характер. Пациентам показано длительное наблюдение гастроэнтеролога, во многих случаях совместно с психиатром.
В обзоре представлены современные данные о тактике ведения пациента с синдромом диспепсии на амбулаторно-поликлиническом этапе.
The current data about patient management strategy of dyspepsia syndrome at outpatient stage are reported in the review.
Классификационные подходы
Алгоритм диагностического поиска
Диспепсия и другие тревожные признаки могут быть связаны с раком верхних отделов пищеварительного тракта, в частности пищевода и желудка [11].
Персистенция симптомов диспепсии относится к тревожным признакам, поэтому важна их динамическая оценка с учетом ответа на проводимую терапию. Как правило, наличие тревожных признаков при злокачественных новообразованиях встречается при более выраженных (клинически и гистологически) стадиях заболевания.
- язва желудка и двенадцатиперстной кишки;
- заболевания желчевыводящих путей;
- хронический панкреатит;
- злокачественные опухоли желудка, поджелудочной железы, толстой кишки;
- лекарственные препараты (нестероидные противовоспалительные препараты, антибиотики, теофиллин, препараты наперстянки, железа и др.);
- алкоголь;
- эндокринные заболевания (сахарный диабет, гипер- или гипотиреоз, гиперпаратиреоз);
- заболевания соединительной ткани;
- электролитные нарушения;
- другая органическая патология.
Следует также помнить, что симптомы заболеваний верхних отделов желудочно-кишечного тракта (ЖКТ) наблюдаются в 2 раза чаще среди пациентов с сердечно-сосудистыми заболеваниями. Наличие атеросклероза, лабораторные признаки дислипидемии повышают риск возникновения симптомов болезней верхних отделов ЖКТ. При курации пациентов старших возрастных групп следует учитывать, что диспепсия может быть продромальными проявлениями острого коронарного синдрома или начальными проявлениями мезентериальной недостаточности [13].
С одной стороны, хронический гастрит может не иметь клинического эквивалента и протекать бессимптомно. Но у части пациентов инфекция Н. pylori может быть причиной развития симптомов с явлениями диспепсии. Во-первых, острая ятрогенная или самостоятельная инфекция Н. pylori может индуцировать острые симптомы диспепсии. Несмотря на то, что персистирующая колонизация практически всегда приводит к развитию хронического гастрита, у большинства лиц тяжелые диспепсические явления возникают периодически.
Н. pylori-индуцированный гастрит приводит к хроническому активному гастриту разной степени тяжести практически у всех инфицированных лиц. Однако выраженность структурных повреждений слизистой оболочки существенно варьирует в зависимости от индивидуума, соответственно, ассоциированные физиологические изменения также различаются.
Диагноз диспепсии, связанной с Н. pylori, выставляется пациентам, у которых симптомы эффективно купируются эрадикацией инфекции [6].
В настоящее время критерии, позволяющие с высокой степенью надежности прогнозировать, ответит ли пациент с симптомами диспепсии на эрадикационную терапию, отсутствуют.
Расчетное количество пролеченных больных на одного излеченного составляет, по данным литературы, — восемь человек [14].
Гастрит — это морфологический диагноз, который обязательно должен отражать выраженность и распространенность воспаления и атрофии. Тяжесть и распространенность атрофического гастрита и кишечной метаплазии используют в качестве индикаторов повышенного риска развития рака желудка. Тяжелый Н. pylori-ассоциированный гастрит тела желудка связан с повышенным риском рака желудка. Это обосновывает необходимость использования методов стратификации риска. Взятие биоптатов из разных отделов желудка может быть использовано для получения наиболее важной информации с целью классификации рисков [18–20]. Оценка биоптатов слизистой оболочки по системе OLGA и OLGIM необходима для стратификации риска развития рака желудка. Риск возникновения рака желудка коррелирует с тяжестью и распространенностью атрофического гастрита. Более высокий риск развития рака желудка у пациентов на стадии III или IV по системе OLGA или OLGIM [18–20].
Точная оценка характера гастрита требует взятия биоптатов как из антрального отдела, так и из тела желудка, при этом, помимо стандартных 5 точек (антральный и фундальный отдел по малой и большой кривизне, угол желудка), необходимо взятие биопсии из всех эндоскопически измененных участков слизистой оболочки [18–20].
К сожалению, повседневная практика гастробиопсии, а также морфологического исследования гастробиоптатов в 95,97% диагностических случаев не соответствует требованиям Российского пересмотра Международной классификации хронического гастрита OLGA-system [21].
Подходы к терапии
Антисекреторная терапия
У пациентов с стойкими симптомами после эрадикации H. pylori предлагается антисекреторная терапия ИПП в течение четырех-восьми недель [23].
ИПП малоэффективны для борьбы с симптомами постпрандиального дистресс-синдрома (тяжесть, переполнение в эпигастрии после еды) [23]. На этом фоне прокинетики оказывают значимое положительное влияние на перистальтику по сравнению с плацебо, с относительным снижением риска на 33% и числом пролеченных больных на одного излеченного, равным шести [1, 5].
Лечение вторичной диспепсии при каждой нозологической форме определяется соответствующими стандартами.
Оценка стойких симптомов
Несмотря на терапию, некоторые пациенты продолжают испытывать симптомы диспепсии. Пациенты с продолжающимися симптомами диспепсии относятся к следующим категориям: пациенты с альтернативным диагнозом, пациенты с персистирующей инфекцией Н. pylori и пациенты с функциональной диспепсией [25].
Пациенты с сохраняющимися симптомами диспепсии требуют особого внимания с анализом текущих симптомов, степени их улучшения или ухудшения на фоне медикаментозного лечения. В случае отсутствия эффекта от терапии в стандартные сроки или при прогрессировании диспепсии выставленный ранее диагноз должен быть пересмотрен, пациенту необходимо провести уточняющие диагностические исследования (компьютерная томография, магнитно-резонансная томография, колоноскопия и др.), следует привлечь для консультации других специалистов.
Заключение
Синдром диспепсии — один из наиболее распространенных гастроэнтерологических синдромов, который встречается при широком спектре заболеваний.
Диспепсия может быть органической (вторичной) или функциональной. Вторичная диспепсия диагностируется у пациентов с органическими, системными или метаболическими заболеваниями.
Диагноз диспепсии, связанной с Н. pylori, выставляется подгруппе пациентов, у которых симптомы эффективно купируются эрадикацией инфекции.
Хронический гастрит, вызванный инфекцией Н. pylori, следует рассматривать как показание к проведению эрадикационной терапии, так как это является эффективной мерой профилактики ассоциированных с Н. pylori заболеваний.
Диагноз хронического гастрита является морфологическим. Оба заболевания (гастрит и диспепсия) не противоречат друг другу и могут сочетаться у одного и того же больного.
Диагноз хронического гастрита требует взятия биоптатов из 5 стандартных точек, биопсию необходимо брать также из всех визуально измененных участков слизистой оболочки. Гистологическая оценка биоптатов слизистой оболочки по системе OLGA и OLGIM необходима для стратификации риска развития рака желудка, который коррелирует с тяжестью и распространенностью атрофического гастрита.
Реализация современных международных и российских рекомендаций в клинической практике позволит избежать ошибок при постановке диагноза, улучшить прогноз и качество жизни пациентов.
Литература
Е. А. Лялюкова* , 1 , доктор медицинских наук, профессор
В. Н. Дроздов**, доктор медицинских наук, профессор
Е. Н. Карева***, доктор медицинских наук, профессор
С. Ю. Сереброва**, доктор медицинских наук, профессор
А. К. Стародубцев**, доктор медицинских наук, профессор
Д. О. Кургузова**
* ФГБОУ ВПО ОмГМУ МЗ РФ, Омск
** ФГАОУ ВО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
*** ФГБОУ ВО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
Для функциональной диспепсии считается характерным отсутствие каких-либо заметных желудочно-кишечных (включая и пищевод) поражений [1, 21, 24, 25]. Это подразумевает лишь наличие или отсутствие гастрита и исключает не только относительно небольшие по протяженности очаговые поражения (язвы, эрозии), но и такие, в ряде случаев относительно большие по протяженности, диффузные поражения, как рефлюкс-эзофагит, саркома, лимфоматоз желудка и др.
Патогенез синдрома функциональной диспепсии как в целом, так и большинства его симптомов пока еще неясен. Однако замечено, что диспепсические нарушения при функциональной диспепсии [15, 22], в том числе и сочетающейся с хроническим гaстритом, возможны у больных с ослабленной моторикой антрального отдела желудка, приводящей к замедлению эвакуации содержимого желудка в двенадцатиперстную кишку, в основе появления которой, вероятно, лежит нарушение антрумдуоденальной координации, с перемежающимся характером желудочных дисритмий (нарушений ритма). Лишь патогенез симптома быстрого насыщения желудка, связанного с замедлением опорожнения желудка, кажется, достаточно ясен.
Однако у части больных с нормальной двигательной функцией желудка также возможны симптомы функциональной диспепсии (в том числе и у пациентов с гастроэзофагеальной рефлюксной болезнью), что, скорее всего, связано с висцеральной повышенной чувствительностью желудка, в основном к растяжению. Повышенная чувствительность желудка к растяжению может быть связана с нарушением рецепторного восприятия нормальных раздражителей, включая мышечные перистальтические сокращения, а также растяжение стенок желудка пищей. У части больных диспепсические нарушения возможны и при повышенной секреции соляной кислоты (в связи с увеличением продолжительности контакта кислого содержимого желудка с его слизистой оболочкой).
Большая часть больных с функциональной диспепсией, в том числе и сочетающейся с хроническим гастритом, относительно редко обследуются и лечатся не только в стационарах, но и в амбулаторно-поликлинических условиях. Только немногие пациенты при ухудшении состояния обращаются к врачу, настаивая на госпитализации в стационар для уточнения диагноза и лечения.
По-видимому, различия в контингенте обследованных больных с функциональной диспепсией влияют на частоту развития тех или иных симптомов этого синдрома, представляемых в литературе различными исследователями. Так, по другим данным [26], у больных с функциональной диспепсией боль в верхних отделах живота установлена лишь в 36% случаев: только 60% из этих больных предъявляли жалобы на боль, возникающую после приема пищи, 80% пациентов беспокоили ночные боли (в то же время боль в животе, которая мешала больным спать, — в 89,3% случаев). Чувство раннего насыщения больные отмечали в 85,7% случаев, жжение (изжогу), в основном в эпигастральной области, — в 88,4% случаев, тошноту — в 92,9% случаев.
Достаточно известно, что периодически возникающая изжога (жжение) возможна у больных и при нормальном по времени контакте соляной кислоты со слизистой оболочкой пищевода и/или желудка (43%); у таких больных нормальное давление нижнего сфинктера пищевода составляет 10 мм рт. ст. и более. Приблизительно у 30% лиц, постоянно принимающих антацидные препараты для устранения изжоги (жжения), отмечается повышенная висцеральная чувствительность пищевода к механическим или химическим стимулам (при нормальных данных эзофагоскопии и суточной рН-метрии) [29]. В отличие от органической диспепсии такой характерный для диспепсии симптом, как чувство быстрого насыщения после приема пищи, отмечается лишь у больных с функциональной диспепсией. Кроме того, чрезмерная отрыжка, рвота по утрам чаще беспокоят больных с функциональной диспепсией.
Диагностика функциональной диспепсии. Известно, что диагноз функциональной диспепсии устанавливается на основании изучения и анализа симптомов, анамнеза заболевания, результатов физикального обследования больных, а также данных лабораторно-инструментального обследования, по существу, — посредством исключения органических заболеваний, при которых возникли симптомы диспепсии, т. е. исключения органической диспепсии.
Неоднократно предлагалось при постановке диагноза функциональной диспепсии учитывать те или иные сроки появления симптомов, которые рассматриваются в качестве характерных для этого синдрома, частоту их возникновения, продолжительность (в течение определенного времени, в том числе и в течение одного года), однако вряд ли такой подход к обследованию больных найдет широкое применение. Интенсивность, частота и время появления симптомов диспепсии могут быть различными. При этом значительная часть больных настолько привыкают к симптомам диспепсии, что зачастую и не обращают на них внимания (да и в течение продолжительного времени не воспринимают их как проявление какой-либо болезни). Иногда те или иные препараты принимают (без консультации с врачами) с целью устранения неприятных ощущений различного типа. И наконец, чаще всего больной не может точно вспомнить время появления многих диспепсических расстройств, частоту их возникновения (даже интенсивных по выраженности симптомов). Поэтому, как правило, начало развития функциональной диспепсии, а нередко и ее течение врач может проследить со слов больных лишь приблизительно.
Дифференциальная диагностика. При дифференциальной диагностике симптомов диспепсии следует учитывать следующее: в 40% случаев симптомы диспепсии встречаются у больных с доброкачественными язвами желудка и двенадцатиперстной кишки различной этиологии, с гастроэзофагеальной рефлюксной болезнью и раком желудка. У 50% больных причина появления клинических симптомов диспепсии остается неясной, поэтому нередко они ошибочно рассматриваются как проявления функциональной диспепсии. Именно поэтому при дифференциальной диагностике органической и функциональной диспепсии, наряду с выяснением симптомов и анамнеза заболевания и анализом полученных данных, существенное значение (в сомнительных случаях) имеют результаты таких объективных методов, как эндоскопическое и рентгенологическое обследование, ультрасонография; в некоторых случаях при обследовании больных показано и проведение компьютерной томографии. Применение этих методов позволяет выявить или исключить наличие других заболеваний (в том числе и установить причину органической диспепсии).
Авторы некоторых публикаций [7, 9, 19, 24], сообщая о функциональной диспепсии, не сходятся в выделении того или иного их симптомокомплекса. Отметим две наиболее распространенные классификации функциональной диспепсии. Согласно одной из них [6], выделяются язвенноподобный, дискинетический, связанный с нарушением моторики, и неспецифический варианты; при этом рефлюксподобная диспепсия рассматривается как часть симптоматического комплекса гастроэзофагеальной рефлюксной болезни. Однако, согласно другой классификации [27], выделяются следующие варианты функциональной диспепсии: вариант, связанный с нарушением моторики, язвенноподобная диспепсия, рефлюксоподобная диспепсия и неспецифическая диспепсия.
Наши собственные наблюдения свидетельствуют о том, что подразделение функциональной диспепсии на разные типы может рассматриваться лишь как весьма условное. Только у части больных есть возможность выявить тот или иной комплекс симптомов, который можно более или менее точно связать с одним из вариантов функциональной диспепсии, особенно если придерживаться определения функциональной диспепсии, предложенного составителями Римских критериев по функциональным заболеваниям желудочно-кишечного тракта. При постановке диагноза функциональной диспепсии предлагается учитывать следующие критерии:
- наличие постоянной или перемежающейся диспепсии, возникающей в течение 12 нед в году, не обязательно последовательно на протяжении 12 последних месяцев;
- отсутствие органических заболеваний желудочно-кишечного тракта со сходной симптоматикой;
- сохранение симптомов диспепсии, не связанных с синдромом раздраженного кишечника, при котором после дефекации улучшается состояние больных.
Как показывает практика, у большинства больных с функциональной диспепсией в период обращения больных к врачу нередко достаточно сложно определить вариант диспепсии для выбора наиболее оптимального варианта лечения. В определенной степени это связано с тем, что в период обращения к врачу пациента могут беспокоить не все симптомы, которые, по данным анамнеза заболевания, сохранялись у него 12 недель и более в течение последнего года. Лишь при наличии множества симптомов удается более или менее точно определить вариант функциональной диспепсии. Поэтому, по нашим наблюдениям, при подборе медикаментозного лечения целесообразно учитывать прежде всего основные симптомы диспепсии, причиняющие больному наибольшее беспокойство.
Терапия функциональной диспепсии. Основная цель лечения больных с функциональной диспепсией — улучшение объективного и субъективного состояния, включая устранение болей и диспепсических расстройств.
Успех лечения больных с функциональной диспепсией в значительной степени определяется следующими факторами:
- настойчивость и доброжелательность врача по отношению к больным;
- отношение пациента к своему здоровью;
- дисциплинированность больных по отношению к приему пищи, лекарств, соблюдению общих профилактических рекомендаций;
- коррекция образа жизни, улучшение ее качества.
Известно, что при лечении больных с функциональной диспепсией, в том числе и сочетающейся с хроническим гастритом, в нашей стране наиболее часто применяются (в зависимости от состояния больных) следующие медикаментозные препараты (или их комбинации): прокинетики (домперидон, метоклопрамид), антисекреторные препараты (ингибиторы протонного насоса, антагонисты Н2-рецепторов), невсасывающиеся антацидные препараты (висмута трикалия дицитрат (денол)), ферментные препараты (фестал, микразим, панзинорм, пензитал и др.). Иногда у больных с хроническим гастритом, ассоциируемым с Helicobacter pylori (НР), и сочетающимся с функциональной диспепсией, проводится антихеликобактерная терапия, в ходе которой в качестве базисных препаратов чаще используются висмута трикалия дицитрат (де-нол) или ингибиторы протонного насоса.
Наличие большого количества вариантов медикаментозной терапии, предлагаемых для лечения больных с функциональной диспепсией, в определенной степени свидетельствует о неудовлетворенности врачей результатами лечения пациентов с функциональной диспепсией. Вероятно, это связано не только с недостаточной изученностью патогенеза большинства симптомов диспепсии, но и патогенеза синдрома функциональной диспепсии в целом, а также с нередко возникающими при дифференциации вариантов функциональной диспепсии по комплексу тех или иных симптомов трудностями. Это объясняется тем, что интерпретация многих симптомов диспепсии больными в разных популяциях населения, включая и этнические группы, существенно различается.
В качестве прокинетиков при лечении больных с функциональной диспепсией обычно используются домперидон (мотилиум, мотониум) или метоклопрамид (церукал). Эти препараты усиливают перистальтику пищевода и желудка, а также обеспечивают нормализацию гастродуоденальной координации и опорожнения желудка, увеличение тонуса нижнего сфинктера пищевода. Применение данных средств показано при наличии у больных с функциональной диспепсией таких симптомов, как замедление опорожнения желудка (чувство раннего насыщения, возникающее во время еды или сразу после приема небольшого количества пищи), а также симптомов, ассоциируемых с повышенной чувствительностью желудка к растяжению (чувство тяжести, распирания и/или переполнения желудка, возникающие во время или непосредственно после приема пищи); при наличии изжоги (жжения). Обычная доза прокинетиков — 10 мг 3 раза в сутки за 20–30 мин до еды. В тяжелых случаях дозировку прокинетиков можно увеличить до 10 мг 4 раза в сутки (последний раз на ночь), до снижения интенсивности выраженных проявлений диспепсии, затем продолжить лечение больных препаратами в обычной дозировке.
При использовании домперидона (мотилиум, мотониум) возникает меньшая, по сравнению с метоклопрамидом, вероятность появления побочных эффектов [3]. Поэтому в случае необходимости домперидон можно использовать в лечении больных более продолжительное время, однако не менее 3 нед.
Лечение больных домперидоном позволяет устранить чувство преждевременного насыщения в 84% случаев, распирания в подложечной области — в 78%, дискомфорта после приема пищи — в 82% и тошноты — в 85% случаев. К сожалению, сроки лечения больных (это относится ко всем прокинетикам) довольно часто превышают 2–5 нед.
Для устранения выраженных боли и/или изжоги (жжения) в эпигастральной области у больных с функциональной диспепсией вполне достаточно в течение первых 7–10 дней использовать ингибиторы протонного насоса в стандартной дозировке 1 раз в день (лансопразол, пантопразол, рабепразол, эзомепразол соответственно по 30, 40, 20 и 40 мг), после этого пациентов можно переводить на лечение антагонистами Н2-рецепторов (ранитидин или фамотидин соответственно по 150 мг и 20 мг 2 раза в день). Известно, что омепразол (лосек) в дозе 20 мг позволяет в среднем снизить суточный уровень выделения соляной кислоты в желудке на 80%, ранитидин в дозе 300 мг в сутки в среднем до 60%, что в определенной степени определяет эффективность этих препаратов. Вышеуказанный курс лечения целесообразно проводить у лиц с функциональной диспепсией при язвенноподобном варианте или при наличии у больных рефлюксоподобной диспепсии.
Длительность лечения больных определяется их общим состоянием, которое во многом зависит от отношения к своему здоровью и выполнения рекомендаций врачей.
Не менее важно научить пациентов соблюдать режим труда и отдыха, избегать приема тех или иных продуктов, плохо переносящихся ими; посоветовать им своевременно обращаться к врачам за медицинской помощью, если в этом появится необходимость.
Функциональная диспепсия и НР. При рассмотрении вопроса о существовании связи между функциональной диспепсией и НР, необходимо принимать во внимание три аспекта.
- Синдром функциональной диспепсии возможен у больных и при отсутствии хронического гастрита.
- Синдром функциональной диспепсии может сочетаться с хроническим гастритом, не связанным с НР.
- Синдром функциональной диспепсии, может сочетаться с хроническим гастритом, ассоциируемым с НР. Лишь в этом случае есть смысл рассматривать вопрос о целесообразности или нецелесообразности проведения эрадикационной терапии.
Взаимосвязь между НР и функциональной диспепсией остается неясной. По некоторым наблюдениям [28, 30, 31], функциональная диспепсия лишь в 28–40% случаев сочетается с хроническим гастритом, ассоциируемым с НР. Однако между клиническими симптомами, считающимися характерными для функциональной диспепсии, и наличием обсемененности НР слизистой оболочки желудка [1, 7, 19] не установлено какой-либо достоверной связи: не выявлено каких-либо специфических симптомов, характерных для НР-положительных больных с функциональной диспепсией. Да и значение НР в развитии нарушений моторики желудка является спорным.
Взгляды на целесообразность проведения эрадикации НР при функциональной диспепсии и гастроэзофагеальной рефлюксной болезни весьма противоречивы. В частности, одни исследователи [16, 17] полагают, что эрадикация НР при функциональной диспепсии, как и при гастроэзофагеальной рефлюксной болезни [20] необходима, в то время как другие [5] считают, что инфекция НР у больных с рефлюкс-эзофагитом и хроническим гастритом может иметь защитный эффект.
Литература
Ю. В. Васильев, доктор медицинских наук, профессор
ЦНИИ гастроэнтерологии, Москва
Значительная часть обращений к гастроэнтерологам и терапевтам связана с жалобами со стороны верхних отделов пищеварительного тракта, такими как боль, жжение, отрыжка, тошнота, изжога и др.
Данные жалобы могут быть обусловлены серьезными органическими заболеваниями желудочно-кишечного тракта, однако чаще причина их кроется в функциональных нарушениях (у 70-80%), речь в таком случае идет о так называемой функциональной диспепсии.
Современный взгляд на патофизиологию диспепсии, а также диагностические и терапевтические подходы были представлены в докладе Кайбышевой Валерии Олеговны, к.м.н., старшего научного сотрудника НИЛ хирургической гастроэнтерологии и эндоскопии РНИМУ им. Пирогова, гастроэнтеролога Московской ГКБ №31.
К счастью, в большинстве (в 70-80%) случаев возникновение симптомов диспепсии не связано с органическими заболеваниями желудочно- кишечного тракта, а обусловлено функциональными нарушениями, такими, как например, расстройства аккомодации фундального отдела желудка (способности расслабляться в ответ на прием пищи), ослабление моторики антрального отдела с замедлением эвакуаторной функции желудка, висцеральная гиперчувствительность к растяжению, дуоденальная гиперчувствительность к соляной кислоте и липидам. Интересно, что в Римских критериях IV пересмотра приводится ряд новых патофизиологических механизмов развития функциональной диспепсии: повышение проницаемости слизистой оболочки 12-ти перстной кишки, инфильтрация ее эозинофилами и тучными клетками, воспаление низкой степени [1,3]. Последние годы ведутся дискуссии о роли пула желчных кислот (снижение доли первичных желчных кислот) и изменении состава микробиоты (увеличение числа провоспалительных бактерий) в развитии симптомов диспепсии [4].
Подойдя к главному вопросу нашего обсуждения-как лечить функциональную диспепсию, мы должны вспомнить о наличии 2 клинических вариантов данной нозологии: синдром эпигастральной боли и постпрандиальный дистресс синдром. Их выделение обусловлено отличиями в механизмах патогенеза и в ответе на лечение препаратами различных групп. Как показали данные клинических исследований, систематических обзоров и мета-анализов, наилучший эффект от лечения больных с синдромом эпигастральной боли достигается при применении антисекреторных препаратов (ингибиторов протонной помпы (ИПП) и Н2-блокаторов)[1]. Причем в данном случае речь не идет о необходимости мощной и длительной кислотосупрессии, как это принято при лечении серьезных кислотозависимых заболеваний (ГЭРБ, язвенная болезнь, НПВП-гастропатия). Применение ИПП у больных с синдромом боли в эпигастрии предполагает улучшение самочувствия пациентов в связи со снижением висцеральной гиперчувствительности в ответ на колебания секреции соляной кислоты.
Д.Н. Андреев, А.А. Самсонов
ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России
В статье отражены современные аспекты патогенетической и клинической взаимосвязи синдрома функциональной диспепсии (ФД) и инфекции Helicobacterpylori. Сделан вывод, согласно которому накопленные на сегодняшний день данные не дают основания считать инфекцию H. pylori абсолютным этиологическим фактором ФД. Однако на основании ряда мета-анализов, демонстрирующих небольшой, но статистически значимый положительный эффект в купировании симптоматики после эрадикации инфекции, проведение эрадикационной терапии может быть обоснованным, особенно в регионах с высокой инфицированностью H. pylori, к которым относится и Россия.
Понятие о функциональной диспепсии
Функциональная диспепсия (ФД) является широко распространенным функциональным заболеванием желудочно-кишечного тракта (ЖКТ), характеризующимся гетерогенным паттерном клинических проявлений и существенным негативным влиянием на качество жизни больных [1, 2]. Согласно Римским критериям 3-го пересмотра (2006), под термином ФД понимают наличие одного и более симптомов у пациента – боль или жжение в эпигастрии, чувство переполнения в эпигастрии или раннее насыщение в отсутствие данных об органической патологии, способной объяснить эти симптомы [3].
Распространенность истинной ФД среди взрослого населения достигает 15–20% с ежегодным показателем заболеваемости в 1% [4, 5]. Эти данные в целом можно экстраполировать и на нашу страну со следующей оговоркой: лишь 5% больных получают квалифицированную медицинскую помощь [6].
В зависимости от превалирования в клинической картине тех или иных диспепсических жалоб выделяют два основных клинических варианта ФД [3]:
- синдром эпигастральной боли (СЭБ);
- постпрандиальный дистресс-синдром (ПДС).
СЭБ проявляется периодическими болями (как минимум умеренной интенсивности) в эпигастрии с частотой не менее одного раза в неделю. Боль негенерализованная, имеет четкую локализацию, не изменяется после дефекации и отхождения газов. Признаков нарушения функции желчного пузыря и сфинктера Одди не наблюдается. Дополнительными критериями служат жгучий характер боли без ретростернального компонента, связь болевого синдрома с приемом пищи или возникновение боли натощак, а также сопутствующий постпрандиальный синдром [2, 3].
К диагностическим критериям ПДС относятся возникающее несколько раз в неделю, беспокоящее больного чувство полноты (тяжести в эпигастрии) после еды при приеме обычного объема пищи и (или) чувство раннего насыщения, не дающее полноценно завершить прием пищи. Данные симптомы могут сопровождаться тошнотой, отрыжкой, ощущением вздутия в верхней части живота, эпигастральной болью или жжением [2, 3].
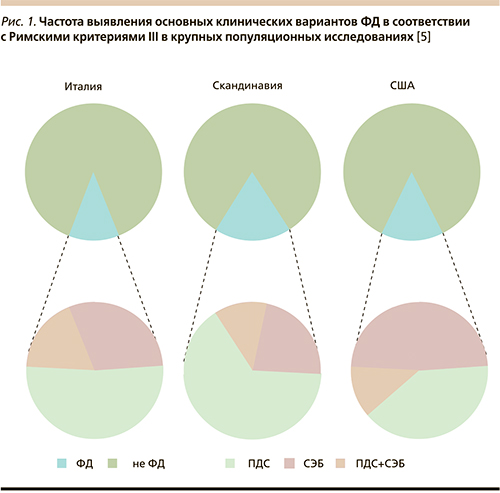
Следует сказать, что выделение данных подгрупп на основании критериев, предложенных Римскими критериями 3-го пересмотра, подтверждается популяционными исследованиями и вполне правомочно. Так, в крупных исследованиях в Италии, Скандинавии и США было обнаружено четкое разграничение между пациентами с СЭБ и ПДС. При этом перекрест (наложение) симптомов данных подтипов ФД оказался значительно ниже ожидаемого и не превысил 20% (рис. 1), что подтверждает правомочность такой стратификации [5]. В целом, согласно современным данным, превалирующей формой ФД является ПДС (45–65%), реже выявляются СЭБ (25–45%) и смешанная форма (10–15%) [2, 5].
Диагностика ФД на первичном этапе предполагает в первую очередь исключение органической причины явлений диспепсии. Многие органические, системные и метаболические заболевания, такие как язвенная болезнь, злокачественные новообразования ЖКТ и гепатобилиарной системы, паразитарные инвазии, хронические заболевания поджелудочной железы, сахарный диабет, гипо- и гипертиреоидизм, системная склеродермия, хроническая почечная недостаточность, электролитный дисбаланс, а также прием лекарственных препаратов (холинолитиков, спазмолитиков, трициклических антидепрессантов, антагонистов кальция и др.), могут вызывать симптомы диспепсии [7]. Важную роль на этом этапе играют не только рутинные лабораторные и визуализационные методы диагностики, но и клиническое выявление симптомов тревоги (дисфагия, рвота кровью, лихорадка, немотивированное похудание, возникновение симптоматики в возрасте старше 45 лет, мелена, гематохезия, анемия, лейкоцитоз, повышение СОЭ) – ориентиров органической патологии. В случае выявления последних пациенту независимо от возраста необходимо безотлагательное проведение эндоскопического исследования верхних отделов ЖКТ с прицельной биопсией и морфологическим изучением биопсийного материала [8]. Важно подчеркнуть, что, по современным рекомендациям, все пациенты старше 45 лет при наличии симптомов диспепсии должны пройти эндоскопическое обследование [9]. В случае обнаружения органической причины диспепсии устанавливается соответствующий диагноз, а в отсутствие таковых формулируется диагноз ФД (К30 Международная классификация болезней 10-го пересмотра).
Инфекция H. pylori как этиологический фактор ФД
Несмотря на существенные продвижения в области изучения механизмов, индуцирующих симптоматику ФД, к настоящему моменту единой этиопатогенетической модели формирования рассматриваемой патологии не существует. На текущий момент этиопатогенез ФД представляется как сложный многофакторный процесс, причинно-следственные связи которого продолжают активно изучаться. Наиболее вероятно, что комбинация ряда физиологических, генетических, средовых и психологических факторов у конкретного пациента ведет к развитию определенных комбинаций сенсорно-моторных нарушений ЖКТ и как следствие – к проявлению симптомов диспепсии [2, 8, 10].
Данные об участии в этиологии ФД инфекции H. pylori неоднозначны и противоречивы. Согласно различным источникам, микроорганизм выявляется у 39–87% пациентов с ФД и, как правило, в два раза чаще, чем в контроле [11, 12]. В настоящее время эпидемиологические исследования не позволяют достоверно устанавливать связь между инфекцией Н. pylori и ФД. Возможно, она и имеется, только не во всей популяции пациентов с данной патологией. В недавно завершенном крупном исследовании Y.J. Fang и соавт. (2014) было показано, что инфекция Н. pylori достоверно чаще ассоциирована с ПДС (отношение шансов [ОШ]=1,86, 99,5% доверительный интервал [ДИ] – 1,01–3,45) по сравнению с СЭБ (ОШ=1,43, 99,5% ДИ – 0,72–2,84). При этом частота выявления наиболее вирулентных штаммов (CagA+ – cytotoxin-associated gene) при ПДС была также достоверно выше, достигнув 98,4% [13].
Теоретически инфекция H. pylori может вызывать диспепсические симптомы через реализацию ряда механизмов:
- изменение секреции (гиперхлоргидрия) соляной кислоты в желудке и связанное с ней повышение сенситивности рецепторного аппарата в интерстиции;
- вторичное нарушение моторной функции желудка;
- персистирующее и активное воспаление, выходящее за пределы слизистой оболочки желудка;
- постинфекционные изменения, связанные с активацией иммунокомпетентных клеток в гастродуоденальной слизистой оболочке и интерстиции.
На сегодняшний день показано, что максимальный уровень соляной кислоты в желудке (МАО – maximal acid output), выделение которой индуцирует гастрин-рилизинг пептид, в 3 раза выше у пациентов с инфекцией H. pylori по сравнению с неинфицированными лицами [14]. При этом у половины пациентов, инфицированных H. pylori с признаками ФД, имеются эквивалентные значения МАО с больными язвенной болезнью двенадцатиперстной кишки. Инфекция H. pylori стимулирует продукцию гастрина и уменьшает синтез соматостатина, реализуя повышение секреции соляной кислоты. Помимо этого инфекция изменяет продукцию грелина, который участвует в секреции кислоты, синтезе ощущений голода и регуляции желудочно-кишечной перистальтики [15]. Обращает на себя внимание, что эти изменения секреции соляной кислоты нормализуются через 6–12 месяцев после успешной эрадикации H. pylori [16]. Таким образом, если бы диспепсические жалобы были связаны исключительно с повышенной секрецией соляной кислоты, то их нивелирование после успешной эрадикации H. pylori происходило бы не ранее чем через 6 месяцев.
Существуют следующие данные: инфекция H. pylori может замедлять эвакуаторную функцию желудка за счет инактивации III фазы мигрирующего моторного комплекса (циклическая, стереотипно повторяющаяся сократительная активность желудка в межпищеварительный период), при этом эрадикация микроорганизма приводит к нормализации сократительной активности желудка [17]. Однако крупными исследованиями такие ассоциации пока не подтверждены. Скорее всего, роль инфекции H. pylori в генезе ФД может реализовываться через ряд комплексных воспалительных механизмов, однако данных о таких взаимосвязях к сегодняшнему дню явно недостаточно.
Лечение
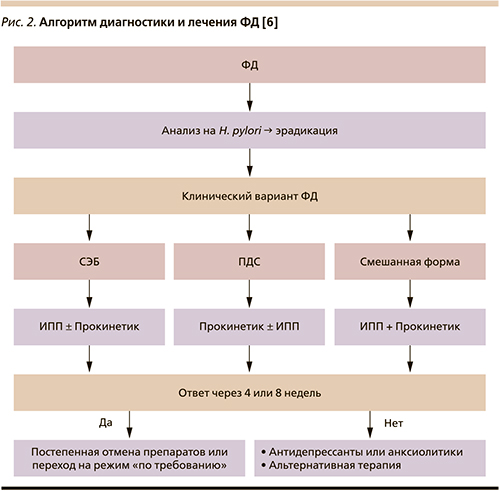
В современных российских и европейских рекомендациях по лечению ФД на основании принципов доказательной медицины отражено три фармакотерапевтических направления терапии данной патологии [7, 9, 20]:
- эрадикация инфекции H. pylori;
- антисекреторная терапия;
- прокинетическая терапия.
Из перечисленных методик лечения частота ответа на терапию при лечении ФД прокинетиками составляет 42%, что выше по сравнению с другими способами: эрадикацией инфекции H. pylori (38%), антисекреторной терапией (34%) [21]. Однако нередко пациентам с ФД требуется комплексная терапия с применением всех вышеописанных методов [6, 8, 9].
Как уже говорилось выше, определенным доказательным базисом роли инфекции H. pylori в генезе ФД являются данные клинических исследований, демонстрирующих небольшой, но статистически значимый положительный эффект в купировании симптоматики ФД после эрадикации микроорганизма. Так, в Кокрановском мета-анализе было установлено, что эффективность эрадикации H. pylori на 10% (95% ДИ – 6–14) выше по сравнению с плацебо с показателем NNT (number needed to treat – число пациентов, которых необходимо пролечить, чтобы у одного пациента исчезли жалобы) – 14% (95% ДИ 10–25). При этом нивелирование симптоматики в конечном счете происходит почти в 40% случаев успешно эрадицированных больных [22]. Недавний мета-анализ B. Zhao и соавт. (2014 г), включивший более современные исследования (14 2993 пациента), подтвердил, что купирование симптоматики ФД возникает чаще после эрадикации H. pylori по сравнению с контролем (ОШ=1,38, 95% ДИ – 1,18–1,62; р<0,0001) без различий между популяциями пациентов Европы, США и Азии [23].
В соответствии с консенсусом Маастрихт-IV, в регионах с низкой резистентностью H. pylori к кларитромицину (менее 20%) в качестве эрадикационной терапии первой линии регламентируется стандартная тройная терапия, включающая ингибитор протонной помпы (ИПП), кларитромицин и амоксициллин. В регионах с высокой резистентностью H. pylori к кларитромицину (более 20%) в качестве эрадикационной терапии первой линии рекомендуется квадротерапия с препаратами висмута (ИПП+метронидазол+тетрациклин+висмута трикалия дицитрат) или последовательная эрадикационная терапия (первые 5 дней: ИПП+амоксициллин, последующие 5 дней: ИПП+кларитромицин+тинидазол/метронидазол). В случае неудачи проведенной эрадикации по схемам терапии первой линии экспертный совет консенсуса Маастрихт-IV регламентирует переход на схемы второй линии. Так, квадротерапия на основе препаратов висмута приоритетна для регионов с низкой распространенностью резистентных штаммов H. pylori к кларитромицину, а в качестве альтернативы выдвигается тройная терапия с левофлоксацином (ИПП+амоксициллин+левофлоксацин). Что же касается регионов с высокой резистентностью штаммов H. pylori к кларитромицину, то, согласно консенсусу Маастрихт-IV, терапией второй линии при неэффективности квадротерапии первой линии является тройная терапия с левофлоксацином (ИПП+амоксициллин+левофлоксацин) [24].
Хотя в настоящее время данных федерального уровня об антибиотикорезистентности H. pylori в России не существует, Российская гастроэнтерологическая ассоциация рекомендует использовать в качестве терапии первой линии стандартную тройную или квадротерапию с препаратами висмута. Последняя может применяться в качестве схемы терапии второй линии при неэффективности стандартной тройной схемы наравне с тройной терапией с левофлоксацином [25].
Контроль эффективности эрадикации H. pylori необходимо проводить каждому пациенту не ранее чем через 4 недели после окончания лечения [24, 26]. Важно отметить, что далеко не от всех больных возможно добиться 100%-ного успеха эрадикации, что определено не только ростом количества резистентных штаммов микроорганизма в популяции, а также вариативной генетической предиспозицией пациента к успешности лечения (полиморфизмы генов CYP2C19, MDR1, IL-1β) [27, 28]. Неэффективность схем первой линии обусловливает необходимость применения схем эрадикации второй линии. В свою очередь индивидуальный подбор препаратов на основании результатов тестирования резистентности H. pylori к антибиотикам показан только в случае неудачи двух линий эрадикационной терапии [24, 26, 27].
Дальнейший выбор медикаментозной терапии должен базироваться в зависимости от клинического варианта ФД [18, 21]. Так, при СЭБ препаратами выбора являются ИПП, а при ПДС – прокинетические. Эффективность обеих групп вышеназванных препаратов при ФД подтверждена мета-анализами, где выявлено статистически значимое превосходство по сравнению с плацебо [29, 30]. В случае смешанных и недифференцированных клинических вариантов ФД целесообразно использование комбинации ИПП и прокинетиков [18].
В отсутствие ответа на лечение пациентам с ФД целесообразно дальнейшее продолжение терапии антидепрессантами или анксиолитическими средствами.
Заключение
Таким образом, несмотря на существенные продвижения в области изучения механизмов, индуцирующих симптоматику ФД, к настоящему моменту единой этиопатогенетической модели формирования рассматриваемой патологии не существует. Данные об участии в этиологии ФД инфекции H. pylori противоречивы и на сегодняшний день не дают основания считать инфекцию H. pylori абсолютным этиологическим фактором ФД. Однако на основании ряда мета-анализов, демонстрирующих небольшой, но статистически значимый положительный эффект в купировании симптоматики ФД после эрадикации инфекции H. pylori, можно сделать следующий вывод: проведение эрадикационной терапии может быть обоснованным, особенно в регионах с высокой инфицированностью H. pylori, к которым относится и Россия. Данная позиция подтверждается современными национальными и зарубежными рекомендациями по лечению пациентов с ФД.
Литература
Об авторах / Для корреспонденции
Читайте также:

