Фузобактерии в хирургической стоматологии
Обновлено: 19.04.2024
Московский государственный медико-стоматологический университет
лаборатория молекулярно-биологических исследований Научно-исследовательского медико-стоматологического института
Кафедра микробиологии, вирусологии, иммунологии стоматологического факультета Научно-исследовательского медико-стоматологического института
Первый опыт детекции молекулярных маркеров пародонтопатогенных видов 1-го и 2-го порядка при одонтогенных гнойно-воспалительных процессах челюстно-лицевой области с применением разных диагностических систем
Журнал: Российская стоматология. 2014;7(2): 43‑46
Царев В.Н., Ипполитов Е.В., Шулаков В.В., Никитин И.В. Первый опыт детекции молекулярных маркеров пародонтопатогенных видов 1-го и 2-го порядка при одонтогенных гнойно-воспалительных процессах челюстно-лицевой области с применением разных диагностических систем. Российская стоматология. 2014;7(2):43‑46.
Tsarev VN, Ippolitov EV, Shulakov VV, Nikitin IV. The first experience with the detection of the molecular markers of the 1st and 2nd order periodontal pathogenic bacteria associated with the odontogenic pyo-inflammatory processes in the maxillofacial region with the use of various diagnostic systems. Russian Stomatology. 2014;7(2):43‑46. (In Russ.).
Московский государственный медико-стоматологический университет
Представлен первый опыт детекции ДНК пародонтопатогенных видов бактерий — возбудителей одонтогенного воспаления с помощью полимеразной цепной реакции (ПЦР). Цель исследования: оценка эффективности молекулярно-генетического метода диагностики одонтогенных воспалительных процессов челюстно-лицевой области с применением разных наборов реагентов. Материал и методы. Проведено исследование гнойного экссудата 32 больных одонтогенными флегмонами от 18 до 56 лет с использованием двух вариантов диагностических систем — МультиДент-5 и Micro-Ident plus. Результаты. Установлено, что изученные наборы реагентов для ПЦР-диагностики позволяют определить видовой состав микрофлоры в течение 24 ч с момента оказания ургентной помощи. Определен спектр пародонтопатогенных видов 1-го и 2-го порядка, очевидно, играющих роль в развитии одонтогенного воспаления.
Московский государственный медико-стоматологический университет
лаборатория молекулярно-биологических исследований Научно-исследовательского медико-стоматологического института
Кафедра микробиологии, вирусологии, иммунологии стоматологического факультета Научно-исследовательского медико-стоматологического института

Мазок из чистой культуры возбудителя одонтогенной инфекции T. forsythia (а) и F. nucleatum (б). Окраска по Граму. Ув. ×90, масляная иммерсия.
Одной из наиболее актуальных проблем хирургической стоматологии по-прежнему остается совершенствование методов профилактики, диагностики и лечения инфекционных воспалительных заболеваний челюстно-лицевой области. Это связано с сохраняющейся высокой частотой этих заболеваний в общей структуре стоматологической заболеваемости, увеличением числа случаев развития атипично протекающих форм воспаления, развивающихся на фоне нарушенной реактивности организма и изменяющихся свойств микроорганизмов, постоянно приспосабливающихся к новым условиям существования [5, 7].
По данным современной литературы, базирующейся на результатах бактериологического исследования, наиболее часто встречающийся анаэробный компонент микробных ассоциаций при воспалительных процессах челюстно-лицевой области — представители группы бактероидов (преимущественно относящиеся к родам Porphyromonas, Prevotella) — на их долю приходится от 19 до 23% случаев. Реже встречаются фузобактерии и пептострептококки — 8—16%, а также вейлонеллы, пропионибактерии, эубактерии и извитые формы — 4—10% случаев [3, 4, 6, 7].
Однако известны вирулентные виды бактерий, обнаруживаемые в полости рта, как правило, пародонтопатогенной группы, которые невозможно или трудно идентифицировать традиционным бактериологическим методом исследования, даже с применением техники анаэробного культивирования [1, 2].
Так, выявление таких видов, как Treponema denticola, Eikenella corrodens, Capnocytophaga spp. затруднено в связи с ограниченной возможностью их культивирования на питательных средах. Есть определенные сложности и при выделении основных пародонтопатогенных видов — Porphyromonas gingivalis и Tannerella forsythia [1, 6]. Кроме того, при использовании анаэробного метода культивирования, диагностика нередко бывает малоэффективной, поскольку занимает продолжительное время — 5—7 сут и более. Особенности транспортировки материала, необходимость использования большого количества питательных сред, газовых смесей для культивирования, использование специальных идентификационных систем — все это является недостатками традиционного метода, так как усложняет и затрудняет процесс клинико-лабораторного исследования, увеличивает вероятность диагностических ошибок [1, 4].
Цель исследования: оценить эффективность молекулярно-генетического метода диагностики одонтогенных воспалительных процессов челюстно-лицевой области с применением разных наборов реагентов для выявления молекулярных маркеров пародонтопатогенных бактерий 1-го и 2-го порядка.
Материал и методы
Обследованы 32 пациента (18 мужчин и 14 женщин) в возрасте от 18 до 56 лет. Пациенты были госпитализированы с диагнозом одонтогенной флегмоны дна полости рта (19 пациентов) и флегмоны подчелюстной области (11 пациентов) в отделение центральной стоматологии и челюстно-лицевой хирургии Московского государственного медико-стоматологического университета (МГМСУ) им. А.И. Евдокимова и отделение хирургической стоматологии ГКБ № 36, где им оказывали ургентную медицинскую помощь.
Под внутривенным наркозом и местной анестезией Sol. Lidocaini 0,5% — 10—30 мл производили разрез кожи длиной 5—10 см, отступя от нижнего края челюсти на 2,0 см. Послойно рассекали подкожную клетчатку, платизму. Полутупым путем проходили в подчелюстное, подподбородочное, крылочелюстное пространства пораженной стороны, получали гнойное отделяемое. Раны дренировали трубочными дренажами, которые фиксировали йодоформным тампоном. Накладывали асептическую повязку.
Отбор проб для исследования (гнойный экссудат), в соответствии с протоколом фирмы производителя тест-систем, проводили бумажными чипами, которые помещали в пробирки Эппендорфф с подготовленным стерильным физиологическим раствором. Материал для исследования доставляли в лабораторию кафедры микробиологии, вирусологии, иммунологии МГМСУ им. А.И. Евдокимова в течение 2 ч.
Для осуществления полимеразной цепной реакции (ПЦР) использовали отечественный амплификатор, в который помещали пробирки с реакционной смесью, а также ультрацентрифуги, термошейкеры и другое необходимое оборудование. Учет результатов проводили в агарозном геле. Результаты исследования материала были доступны для анализа уже через 12—24 ч.
Для выделения ДНК из исследуемого материала использовали вариант пробоподготовки с помощью набора реагентов ГенЛаб (Россия), включающего: экстраген — суспензию смеси гранул ионообменников (1 флакон, 10 мл); энзимикс, протеолитический комплекс (1 пробирка с лиофилизированным содержимым), растворитель энзимикса (1 пробирка, 100 мкл). Дальнейшее выделение и детекцию ДНК пародонтопатогенных бактерий осуществляли в соответствии с медицинской технологией ФС-2006/043-У, разработанной на кафедре микробиологии, вирусологии, иммунологии МГМСУ [1].
Анализ молекулярных маркеров методом ПЦР-диагностики проводили с учетом рабочей классификации пародонтопатогенных видов, позволяющей разделить их по значимости в патологии пародонта на виды 1-го и 2-го порядка [2]. Соответственно выявление молекулярных маркеров трех основных видов пародонтопатогенов 1-го порядка: Aggregatibacter actinomycetemcomitas, Porphyromonas gingivalis, Tannerella forsythia, и двух пародонтопатогенов 2-го порядка — Prevotella intermedia, Treponema denticola — осуществляли, используя отечественную систему МультиДент-5. Выявление еще шести видов пародонтопатогенов 2-го порядка: Peptostreptococcus micros, Fusobacterium nucleatum/periodonticum, Campylobacter rectus, Eubacterium nodatum, Eikenella corrodents, Capnocytophaga spp. (S. gingivalis, C. ochraces, C. sputigena) проводили с использованием тест-системы Micro-Ident plus.
Одновременно выполняли бактериологическое исследование с применением техники анаэробного культивирования в анаэростатах с бескислородной газовой смесью. Для получения демонстраций готовили мазки из выделенных чистых культур и осуществляли микрофотографирование с использованием цифровой техники микроскопа Eclips.
Статистическую обработку результатов проводили методами непараметрической статистики с использованием критерия Манна—Уитни.
Результаты исследования
При проведении молекулярно-биологических исследовании нами были проанализированы результаты частоты обнаружения бактериальных видов пародонтопатогенной группы в гнойном экссудате, полученном у пациентов при ургентном хирургическом лечении (вскрытии и дренировании) одонтогенных флегмон челюстно-лицевой области (см. таблицу).

Результаты молекулярно-биологического исследования материала, полученного при вскрытии одонтогенных флегмон с использованием двух разных наборов реагентов для ПЦР-диагностики Примечание. * — разница статистически достоверна (p<0,002).
В результате проведенного исследования получили следующее процентное соотношение по 11 бактериальным видам. Как видно из таблицы, такой приоритетный пародонтопатоген 1-го порядка и частый возбудитель гнойно-воспалительных процессов полости рта, как Aggregatibacter actinomycetemcomitas, выделяли из полученного гнойного экссудата в 26,6% случаев. Другой пародонтопатогенный вид 1-го порядка Porphyromonas gingivalis выявлен у 46,6% пациентов. Максимальная частота установлена для пародонтопатогенного вида 1-го порядка Tannerella forsythia — у 73,3% пациентов.
Частота выявления пародонтопатогенных видов 2-го порядка была значительно ниже, за исключением двух возбудителей — Prevotella intermedia, который был идентифицирован нами в 66,6% случаев и Fusobacterium nucleatum/periodonticum, который обнаружили в гнойном экссудате в 40% случаев.
Частота выявления молекулярных маркеров вида Treponema denticola составляла 20%, в то время как молекулярные маркеры остальных пародонтопатогенных видов 2-го порядка (Campylobacter rectus, Eubacterium nodatum, Eikenella corrodents, Capnocytophaga spр.) не были выявлены ни у одного пациента.
Полученные данные были подтверждены для культивируемых возбудителей при бактериологическом методе исследования. На рисунке представлены фотографии препаратов чистых культур анаэробных бактерий F. nucleatum, T. forsythia, полученные с помощью цифровой камеры микроскопа Eclips.
Заключение
Сочетание новых подходов к диагностике и лечению одонтогенных воспалительных процессов позволяет повысить эффективность оказания ургентной медицинской помощи пациентам. Большие возможности в диагностике одонтогенных инфекций открывает молекулярно-генетический метод исследования. ПЦР, лежащая в основе данного метода, позволяет многократно умножить за несколько часов специфический фрагмент молекулы ДНК возбудителя и обнаружить его в исследуемом материале даже при незначительном количестве последнего. При этом нет необходимости соблюдать особые условия стерильности взятия материла, практически нет ограничений по времени и способу доставки материала в лабораторию.
Использование молекулярно-биологического метода диагностики позволяет в течение 12—24 ч с момента оказания ургентной помощи определить видовой состав микрофлоры. Высокая чувствительность метода, быстрота получения результатов обусловливают высокую эффективность данной методики при диагностике воспалительных процессов головы и шеи.
Как показали наши исследования, набор праймеров, содержащихся в отечественной системе МультиДент-5, имеет больше перспектив для диагностики одонтогенных процессов по сравнению с немецкой системой Micro-Ident plus, так как праймеры пародонтопатогенных видов 2-го порядка этой тест-системы не выявляли соответствующих возбудителей, за исключением Fusobacterium nucleatum/periodonticum, который обнаруживали в гнойном экссудате в 40% случаев.
В заключение необходимо подчеркнуть, что возможность оперативно получить результаты молекулярно-биологического исследования позволяет врачу быстро и точно подобрать антибактериальную терапию пациенту.
Основные места обитания фузобактерий в человеческом организме — толстая кишка и респираторный тракт. Фузобактерии продуцируют масляную (основной метаболит) и уксусную кислоты (дополнительный) (Акопян А.Н.).
- у детей раннего возраста — 10 8 –10 9 КОЕ/г
- у взрослых — 10 7 –10 10 КОЕ/г
- у пожилых — 10 8 –10 9 КОЕ/г.
Согласно современным представлениям, бактерии рода Fusobacterium относятся к основной резидентной микрофлоре желудка здорового человека, при условии отсутствия в нём Helicobacter pylori в доминирующем количестве (Engstrand L., 2012).
Фузобактерии — возбудители заболеваний
Некоторые виды фузобактерий являются условно-патогенными и при имуннодефицитах могут вызывать вторичные гангренозные и гнойно-гангренозные процессы. При ангине, герпетическом стоматите, гипотрофии у детей, при имуннодефицитных состояниях возможно развитие фузоспирохетоза — некротического воспалительного процесса на миндалинах, слизистой оболочки полости рта.
- Fusobacterium necrophorum (ранее называемой палочкой Шморля) — представитель нормальной микрофлоры ротовой полости и кишечника человека, рубца жвачных животных, известен также как возбудитель копытной гнили (некробиоза) крупного рогатого скота;
- Fusobacterium nucleatum (палочка Плаута) — превалирующий компонент нормальной микрофлоры зубного налета и возбудитель заболеваний дёсен и других органов человека.
Публикации для профессионалов здравоохранения, затрагивающие роль фузобактерий в нормальной физиологии и заболеваниях человека
Антибиотики, активные и неактивные в отношении фузобактерий
Антибактериальные средства (из имеющих описание в данном справочнике), активные в отношении фузобактерий: метронидазол, тинидазол, клиндамицин, левофлоксацин, моксифлоксацин.
Фузобактерии устойчивы к рокситромицину.
Фузобактериозы лечатся, в том числе, фосфимицином (торговые наименования: Монурал, Урофосфабол и др.).
Фузобактерии в систематике бактерий
По современной классификации род Fusobacterium входит в семейство Fusobacteriaceae, порядок Fusobacteriales, класс Fusobacteriia, тип Fusobacteria, царство Бактерии.
В состав рода фузобактерии входят виды: F. canifelinum, F. equinum, F. gastrosuis, F. gonidiaformans, F. hwasookii, F. massiliense, F. mortiferum, F. naviforme, F. necrogenes, F. necrophorum, F. nucleatum, F. perfoetens, F. periodonticum, F. russii, F. simiae, F. ulcerans, F. varium.
Вид Fusobacterium necrophorum имеет подвиды: Fusobacterium necrophorum subsp. funduliforme, Fusobacterium necrophorum subsp. necrophorum.
У вида Fusobacterium nucleatum выделяют подвиды: Fusobacterium nucleatum subsp. animalis, Fusobacterium nucleatum subsp. nucleatum, Fusobacterium nucleatum subsp. polymorphum, Fusobacterium nucleatum subsp. vincentii.
Из-за своей близости к бактероидам ранее род фузобактерий относился к семейству бактероидов (Bacteroidaceae), однако позже был отнесен к семейству Fusobacteriaceae.
Одно время включаемый в род фузобактерий вид Fusobacterium sulci был отнесен к роду эубактерий и классифицирован как Eubacterium sulci, однако позже его включили в семейство с временным наименованием Clostridiales Family XIII. Incertae Sedis и пока именуются [Eubacterium] sulci.
Кафедра факультетской хирургической стоматологии и имплантологии;
кафедра микробиологии, вирусологии, иммунологии Московского государственного медико-стоматологического университета
Московский государственный медико-стоматологический университет
Антибактериальная профилактика при костно-пластических операциях и дентальной имплантации
Журнал: Стоматология. 2013;92(3): 84‑87
Чувилкин В.И., Чувилкина Е.И., Царев В.Н., Широков Ю.Е. Антибактериальная профилактика при костно-пластических операциях и дентальной имплантации. Стоматология. 2013;92(3):84‑87.
Chuvilkin VI, Chuvilkina EI, Tsarev VN, Shirokov JuE. Preventive antibacterial treatment in oral bone augmentation procedures. Stomatologiya. 2013;92(3):84‑87. (In Russ.).
Кафедра факультетской хирургической стоматологии и имплантологии;
кафедра микробиологии, вирусологии, иммунологии Московского государственного медико-стоматологического университета
Приводится клинико-микробиологическое обоснование использования препарата цефтибутен для профилактики воспалительных осложнений при костно-пластических операциях и дентальной имплантации.
Кафедра факультетской хирургической стоматологии и имплантологии;
кафедра микробиологии, вирусологии, иммунологии Московского государственного медико-стоматологического университета
Московский государственный медико-стоматологический университет
Объем костной ткани в области проведения дентальной имплантации — один из главных факторов, определяющих возможность установки 1 или нескольких дентальных имплантатов [3, 6]. Если участок с отсутствующими зубами существует достаточно давно, нередко выявляются признаки выраженной атрофии костной ткани и установка дентальных имплантатов становится невозможной [3, 5, 7]. Использование костных аутотрансплантатов — один из эффективных методов восстановления объема костной ткани [7, 8]. Костная пластика дает возможность сформировать недостающий объем и впоследствии установить дентальные имплантаты. В клинической практике все шире применяются различные методики восстановления объема костной ткани [6, 7]. Эти операции достаточно травматичны, при их проведении неизбежно происходит контаминация микрофлорой полости рта, что в дальнейшем может обусловить развитие воспаления в ране и экспозицию костного аутотрансплантата [5, 7, 8].
Цель исследования — оценка эффективности применения антибактериального препарата пролонгированного действия цефтибутена при костно-пластических операциях и дентальной имплантации.
Материал и методы
Проведены обследование и лечение 46 пациентов с использованием аутотрансплантатов, у 24 человек применена сандвич-пластика, у 22 — межкортикальная остеотомия. Для антибактериальной профилактики у 24 пациентов использовали препарат пролонгированного действия цефтибутен в дозе 400 мг 1 раз в сутки в течение 10 дней, в контрольной группе (22 пациента) — препарат цефалексин по 500 мг 2 раза в сутки в течение 10 дней. Эффективность препаратов оценивали по данным клинического обследования и динамике бактериальной обсемененности операционной раны. У всех пациентов микробиологически исследовали материал со слизистой оболочки послеоперационной раны на 1-е, 3-и и 10-е сутки. При изучении микрофлоры использовали бактериологический метод с применением техники анаэробного культивирования. Выделенные чистые культуры бактерий идентифицировали, исходя из их биохимических свойств. Для удобства статистической обработки осуществляли пересчет показателя lg в КОЕ.
Результаты и обсуждение

При анализе микробной обсемененности операционной раны у пациентов контрольной группы обращает на себя внимание сохранение во все сроки наблюдения, хотя и на минимальном уровне, большинства представителей агрессивной микробной флоры полости рта. Так, количество Aggregatibacter actinomycetemcomitans в 1-е сутки после операции составило 3,0±0,20, на 3-и сутки — 4,4±0,19, на 10-е сутки оно уменьшилось (табл. 1). Сходная динамика отмечена и в отношении других вирулентных видов, таких как Prevotella intermedia и Porphyromonas gingivalis.
Количество фузобактерий — микроорганизмов, тоже обладающих агрессивными свойствами и способных поддерживать воспаление в тканях пародонта, составляло 3,7±0,20; на 10-е сутки оно снизилось — 3,0±0,20.
Количество такого важного компонента микробной флоры полости рта, как St. sanguis, в 1-е сутки после операции составило 7,9±0,20. Сохранялась тенденция к увеличению количества бактерий данного вида и на 3-и сутки, на 10-е сутки оно возвратилось почти к исходному уровню (6,3±0,19). Количество других стрептококков, St. intermedius, P. anaerobius имело схожую динамику.

При оценке микробной флоры в области операционной раны у пациентов основной группы (препарат цефтибутен), отмечен ряд отличий динамики количества бактерий от таковой в контроле. Так, вид A. actinomycetemcomitans в 1-е сутки после операции обнаруживали в количестве 3,4±0,20, на 3-и сутки количество A. actinomycetemcomitans незначительно снижалось, на 10-е сутки их не обнаруживали (табл. 2). Из других представителей пародонтопатогенной микрофлоры следует отметить такие виды, как P. intermedia и Porphyromonas gingivalis. Вид P. intermedia выделяли в 1-е сутки наблюдения в данной группе в количестве 4,0±0,20, на 3-и сутки их количество уменьшилось до 2,0±0,19, на 10-е сутки их не обнаруживали. Porphyromonas gingivalis не обнаруживали уже на 3-и сутки после операции. Количество Fusobacterium spp. в 1-е сутки после операции составляло 4,6±0,20, на 3-и и 10-е сутки оно снижалось (см. табл. 2). Количество S.sanguis в данной группе пациентов увеличивалось на 3-и сутки и несколько уменьшалось на 10-е. Значительно снижалось на 10-е сутки количество S. intermedius.

При оценке динамики клинической картины у пациентов контрольной группы (препарат цефалексин) на 2-е сутки отек мягких тканей и слизистой оболочки отмечали у всех пациентов, гематому — у 13 (59,1%) человек, увеличение регионарных лимфатических узлов — у 27,3%, повышение температуры тела до субфебрильных значений отмечено в 31,8% случаев; жалобы на боль предъявляли 14 (63,6%) пациентов. На 4-е сутки после операции гематома отмечена у 13 пациентов, повышение температуры тела — у 2 (9,1%), температура тела не превышала субфебрильных величин; жалобы на незначительные болевые ощущения в области операционной раны отмечены у 7 (31,8%) пациентов. На 7-е сутки после операции отек мягких тканей и слизистой оболочки регистрировали уже у 18 (81,8%) пациентов, наличие гематомы — у 13 (59,1%), жалобы на боль предъявляли 2 (9,1%) пациента. На 10-е сутки отек мягких тканей выявлялся у 2 (9,1%) пациентов, гематома определялась у 4 (18,2%), увеличение регионарных лимфатических узлов — у 7 (31,8%); на увеличение температуры тела жалоб не предъявлял ни один пациент; отек слизистой оболочки выявлен у 2 (9,1%); жалобы на боль предъявляли 2 (9,1%) пациента (рис. 1). Рисунок 1. Клиническая картина у пациентов контрольной группы при применении антибактериального препарата цефалексин (n=22). У 4 (18,2%) пациентов наблюдали в результате развития воспалительного процесса экспозицию костных трансплантатов; эти костные аутотрансплантаты были удалены.

При оценке клинической картины в основной группе (антибактериальный препарат цефтибутен) выявлены следующие особенности динамики клинических признаков. Отек мягких тканей и слизистой оболочки наблюдали на 2-е сутки в 100% случаев, наличие гематомы — у 37,5% пациентов, увеличение регионарных лимфатических узлов — у 4 (16,7%), повышение температуры тела — у 3 (12,5%), жалобы на боль — у 12 (50%). На 4-е сутки отек мягких тканей сохранялся у всех пациентов, жалобы на боль — у 5 (20,8%). На 7-е сутки отек и гематому мягких тканей выявляли у 8 (33,3%) пациентов. На 10-е сутки гематому наблюдали у 12,5% пациентов (рис. 2). Рисунок 2. Клиническая картина у пациентов основной группы при применении антибактериального препарата цефтибутен (n=24).
Значительное снижение количества вирулентных видов бактерий, таких как A. actinomycetemcomitans, P. intermedia на 3-и сутки и полное их исчезновение на 10-е сутки, а также исчезновение вида P. gingivalis на 3-и сутки после операции у пациентов при назначении препарата цефтибутен свидетельствует о выраженном эффекте санации от потенциальных возбудителей воспалительных осложнений. Следует отметить, что в контрольной группе при назначении препарата цефалексин бактерии данных видов сохранялись во все сроки наблюдения. Отсутствие признаков воспаления, приводящих к нагноению послеоперационной раны и экспозиции костного аутотрансплантата у пациентов основной группы, позволяет сделать заключение о высокой клинической эффективности препарата цефтибутен. Выгодным преимуществом препарата цефтибутен является и возможность его применения 1 раз в сутки. Результаты исследования позволяют рекомендовать данный антибактериальный препарат для профилактики воспалительных осложнений при костно-пластических операциях и дентальной имплантации.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.

Согласно принятой в микробиологии классификации, фузобактерии относятся к прокариотам и представляют собой грамотрицательные бактерии-анаэробы, которые обитают в организме человека и других млекопитающих, являясь частью постоянного нормального микробиоценоза или микрофлоры. Их семейство – Fusobacteriaceae - насчитывает более полутора десятков видов.

[1], [2], [3]
Морфология фузобактерий и особенности их метаболизма
Структура фузобактерий одноклеточная, в виде палочки, похожей на веретено (по-латыни fusus) – из-за имеющихся с обеих сторон заостренных концов. Палочки могут быть толстыми и тонкими, прямыми и искривленными, также может встречаться нитевидная форма. Длина данных бактерий колеблется от 0,0005 до 0,008 мм, органы движения отсутствуют, хотя в некоторых источниках утверждается наличие у них перитрихиальных (расположенных по всей поверхности) жгутиков.
Бактериологи отмечают, что эти микроорганизмы не образуют спор, то есть в случае ухудшения условий существования они не могут превращаться в клетки с плотной оболочкой. Размножение фузобактерий происходит путем митотического расщепления одной клетки на две с горизонтальным переносом генов, сосредоточенных в нуклеоиде.
Морфология фузобактерий отчасти обусловливает места обитания их колоний: слизистые оболочки полости рта, дыхательных путей, урогенитальной области и нижней части пищеварительного тракта – толстого кишечника. В крови их присутствие не установлено, да это фузобактериям и ни к чему, потому что питательные вещества они получают путем масляного брожения глюкозы, сахарозы, мальтозы и некоторых аминокислот.
Так что в основе метаболизма данных микроорганизмов лежит биохимический процесс анаэробной (без участия кислорода) диссимиляции углеводов под воздействием ферментов. Метаболитами являются низкомолекулярная масляная (бутановая) кислота, углекислый газ и водород. Для получения энергии бактерии нужен водород, и его ионы принимает поверхностный белок фузобактерий адгезин A (FadA), а затем перемещает их внутрь клетки.
Кстати, масляная кислота очень важна для поддержания гомеостаза кишечника (всасывания воды и электролитов) и для регенерации клеток слизистого эпителия; медики установили взаимосвязь между недостатком этой кислоты в кишечнике и развитием локальных воспалительных патологий (к примеру, язвенного колита). Кроме фузобактерий масляная кислота вырабатывается бактериями рода Clostridium.
Об условной патогенности фузобактерий
Фузобактерии, как большинство грамотрицательных анаэробов, бактериологи относят к условно патогенным, однако есть штаммы, в повышенной патогенности которых ученые уже не сомневаются. В частности, это обитающая в полости рта и кишечнике Fusobacterium necrophorum, а также Fusobacterium nucleatum, облюбовавшая для проживания зубной налет.
Как действует их патогенный механизм? Наружная поверхность цитоплазматической мембраны фузобактерий состоит из полимеризованных жиров, белков и углеводов в виде липополисахаридов, которые являются бактериальными токсичными веществами (эндотоксинами) и, одновременно, антигенами. То есть эти соединения вызывают иммунный ответ организма и воспалительную реакцию без очевидного экзогенного (внешнего) воздействия на отдельные системы и органы.
Одонтогенная инфекция – это любой вторичный инфекционный процесс, источником которого служит воспаление околозубных тканей. Включает такие нозологии как одонтогенный периостит, остеомиелит, синусит, флегмоны головы и шеи, лимфаденит и др. Проявляется общей (интоксикация, лихорадка) и местной симптоматикой (боль, припухлость пораженной области, гнойные выделения, затруднение жевания и глотания). Патология диагностируется на основании стоматологического осмотра, рентгенологических данных, УЗИ, КТ, микробиологических посевов. Лечение – санация полости рта, антибиотикотерапия, дезинтоксикация, вскрытие и дренирование гнойных очагов.
МКБ-10
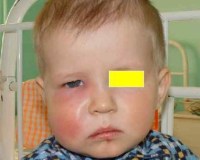


Общие сведения
Одонтогенные инфекции (ОИ) – это острые или хронические гнойно-воспалительные заболевания, причиной которых становятся патологические процессы в тканях зуба (периодонте). Из стоматогенного очага микроорганизмы могут распространяться не только на близлежащие структуры (надкостницу, челюстную кость, придаточные пазухи), но и на органы и ткани, удаленные от источника инфекции (шею, средостение, оболочки головного мозга). Частота острых одонтогенных процессов среди инфекционных поражений ЧЛО достигает 69,5%. Одонтогенные инфекции являются предметом изучения клинической стоматологии, ЧЛХ, отоларингологии.

Причины
Микробная флора, вызывающая одонтогенную инфекцию, чаще представлена кокками (β-гемолитическим стрептококком, пептострептококком, золотистым стафилококком, превотеллами, фузобактериями). Также из очагов инфекции могут высеваться бактероиды, актиномицеты, спирохеты, протей, клостридии, кандиды. Микробный пейзаж при одонтогенных инфекциях обычно носит смешанный характер.
Источниками ОИ выступают различные локальные патологические процессы в полости рта. Чаще всего ими становятся дефекты твердых зубных тканей и периодонта:
- глубокий кариес;
- абсцессы полости рта: пульпарный (гнойный пульпит), пародонтальный, периапикальный;
- хронический гангренозный пульпит;
- острый апикальный или хронический периодонтит;
- нагноившаяся киста зуба, одонтома;
- перикоронарит;
- альвеолит.
Иногда спровоцировать манифестацию одонтогенной инфекции могут стоматологические манипуляции: эндодонтическое лечение, травматичное удаление зуба, синус-лифтинг, дентальная имплантация. При неправильном проведении эти процедуры способствуют перфорации верхнечелюстной пазухи, попаданию в синусы инородных предметов (осколков зубов, пломбировочных материалов), образованию незаживающих ороантральных свищей, поддерживающих инфекционный процесс.
Факторы риска
Пусковыми факторами, приводящими к развитию одонтогенных патологических процессов, могут являться переохлаждение, переутомление, стрессы, кровопотеря, инсоляция. ОИ чаще развиваются у пациентов с отягощенным соматическим фоном. Наибольшее значение имеют следующие сопутствующие патологии:
- сахарный диабет;
- ХНЗЛ;
- инфекции (грипп, туберкулез, гепатит, ВИЧ);
- онкологические заболевания;
- химические зависимости (алкогольная, наркотическая, токсическая).

Патогенез
На развитие одонтогенной инфекции влияют вирулентность и количество микроорганизмов в первичном очаге, а также состояние макроорганизма. Распространение инфекционных патогенов из первичного стоматогенного очага в большинстве случаев происходит контактным путем. При определенных условиях (высокая степень патогенности, снижение местной и общей резистентности) возбудители проникают в лимфатическое и кровеносное русло, мигрируют по организму.
В области инфекционного очага в полости рта создаются условия для беспрепятственного размножения микроорганизмов (венозный застой, отек, ишемия тканей). Через верхушку корня зуба патогены могут выходить за пределы очага через межмышечное, поднадкостничное, клетчаточное пространство. Так возникают одонтогенные периоститы, оститы, гаймориты, остеомиелиты.
Кроме этого, микробные токсины вызывают усиление сосудистой проницаемости, что в условиях хорошей васкуляризации околочелюстных тканей облегчает проникновение бактериальных агентов в сосудистое русло. Таким путем формируются околочелюстные абсцессы и флегмоны. Оседание микроорганизмов в лимфатических узлах при нарушении барьерной функции последних сопровождается развитием регионарного лимфаденита.
Симптомы одонтогенной инфекции
Одонтогенный периостит
В зависимости от клинического течения периостит может быть острым (серозным, гнойным) либо хроническим (простым, гиперпластическим). В области пораженного зуба – вероятного источника инфекции – ощущается боль, иррадиирущая в ухо, висок. Нередко визуально заметна припухлость щеки, асимметрия лица за счет одностороннего отека мягких тканей. Затруднено открывание рта.
При одонтогенном периостите страдает общее самочувствие: беспокоит слабость, фебрильная температура, головная боль, нарушение сна и приема пищи. Регионарные лимфоузлы увеличены и болезненны.
Одонтогенный остеомиелит
Чаще диагностируется у мужчин в возрастной группе 20-40 лет, в 68% случаев поражает нижнюю челюсть. На фоне резко выраженного интоксикационного синдрома беспокоит интенсивная локальная боль в зубе или разлитая боль во всей челюсти, которая распространяется на соответствующую половину головы. Конфигурация лица изменена за счет припухлости на стороне воспаления.
Отмечаются трудности при открывании рта, боль при пережевывании и глотании пищи, нарушение речевой функции, парестезии верхней или нижней губы. Может ощущаться гнилостный запах изо рта. Температурная кривая при одонтогенном остеомиелите колеблется от 37,5 до 39-40°С.
Одонтогенный синусит
На долю одонтогенного гайморита приходится от 10 до 30% случаев всех инфекций верхнечелюстных пазух. Острый синусит манифестирует с головной боли, температурной реакции, ощущения давления в проекции соответствующей пазухи. Нарастает отечность полости носа, затрудняется дыхание, снижается обоняние. Через некоторое время из пазухи начинает отделяться слизисто-гнойный или гнойный секрет. Мягкие ткани подглазничной области и щеки выглядят припухшими.
Одонтогенные абсцессы и флегмоны
Около 57% гнойных инфекций мягких тканей головы и шеи имеют стоматогенную этиологию. Одонтогенные абсцессы обычно локализуются в подглазничной, щечной, подчелюстной, околоушной области. Сопровождаются появлением припухлости в области лица или шеи, гиперемией кожи над гнойником. При поверхностном абсцессе ощущается симптом флюктуации. Отмечается локальная боль и пульсация в проекции гнойника. Признаки интоксикации выражены умеренно.
По локализации выделяют одонтогенные флегмоны дна полости рта, подчелюстного, подподбородочного, окологлоточного пространства, области шеи. Возникает припухлость мягких тканей без четких границ с наличием плотного болезненного инфильтрата. Боль самопроизвольная, разлитая, присутствует постоянно. В зависимости от локализации флегмоны нарушается жевание, глотание, дыхание, речь. Характерно выраженное ухудшение общего самочувствия, фебрильная лихорадка, ознобы.
Одонтогенный лимфаденит
Обычно развивается в области подчелюстных или шейных лимфоузлов. Характеризуется их локальной припухлостью, болезненностью, плотной консистенцией. Возникает асимметрия лица. При абсцедировании лимфоузлов повышается температура тела, появляется озноб, недомогание. При пальпации гнойного очага ощущается флюктуация.
Осложнения
Одонтогенные инфекции могут становиться источником тяжелых септических заболеваний. При нагноении лимфоузлов развивается аденофлегмона, а при хронизации воспаления – подкожная одонтогенная гранулема. Инфекции верхней челюсти чреваты формированием флегмоны глазницы, которая может привести к панофтальмиту и слепоте. Инфекционные процессы в области нижней челюсти выступают причиной гнойного медиастинита.
Крайне опасными по своим последствиям являются одонтогенные внутричерепные осложнения: абсцесс мозга, менингит, тромбоз пещеристого синуса. Из кардиальных осложнений наиболее часто развивается бактериальный эндокардит. Любой очаг ОИ может послужить источником одонтогенного сепсиса.
Диагностика
Одонтогенные инфекции диагностируются на основании выявления их связи с заболеваниями зубов (запущенный кариес, пульпит, периодонтит) или стоматологическими манипуляциями/операциями. Пациенты нуждаются в консультации стоматолога-терапевта, стоматолога-хирурга, челюстно-лицевого хирурга, врача-отоларинголога. В зависимости от клинической картины одонтогенной инфекции выполняется:
- Стоматологический осмотр. В полости рта удается обнаружить первичный очаг, повлекший за собой прогрессирование гнойного воспаления. Это может быть сильно разрушенный зуб, воспаленная лунка, воспалительный инфильтрат с флюктуацией или без, свищ на десне с гнойным отделяемым и т.д. При этом пальпация и перкуссия области поражения болезненна, десна отечна, гиперемирована (иногда цианотична), зубы подвижны.
- Рентген. Для оценки местных изменений зубных и костных тканей выполняется ОПТГ, рентгенография челюсти, придаточных синусов, мягких тканей шейной области. При планировании оперативного вмешательства рентгеновская диагностика дополняется КТ и МРТ соответствующих областей.
- ЛОР-осмотр. Наряду с рентгеновской визуализацией выполняется эндоскопическое обследование: риноскопия, эндоскопия носа, синусоскопия. При необходимости прибегают к диагностической пункции верхнечелюстной пазухи.
- Сонография. При развитии гнойного лимфаденита, флегмон, медиастинита осуществляют УЗИ лимфоузлов, околоносовых пазух, мягких тканей, средостения. Для исключения поражения сердца выполняют ЭхоКГ.
- Лабораторные анализы. При любых одонтогенных инфекциях исследуется общий анализ крови, маркеры воспаления (прокальцитонин, СРБ, фибриноген и др.). Производится забор и бакпосев материала из инфекционного очага, посев крови на гемокультуру.
Дифференциальная диагностика
При подозрении на одонтогенное инфицирование мягких тканей необходимо исключить неодонтогенные патологические процессы: рожистое воспаление, фурункулы и карбункулы, сиаладенит, аденофлегмоны и лимфадениты иной этиологии. Остеомиелиты челюстей дифференцируют посттравматическими, гематогенными формами заболевания. Также исключают синуситы риногенного, травматического, аллергического генеза.

Лечение одонтогенных инфекций
Хирургическое лечение
Лечение любых форм ОИ необходимо начинать с устранения первичного патологического очага. При этом может выполняться лечение пульпита или периодонтита, удаление зуба или импланта, вскрытие абсцесса, резекция верхушки корня. В дальнейшем проводится активное лечение вторичной патологии. При необходимости осуществляется госпитализация пациента в отделение челюстно-лицевой хирургии.
Консервативная терапия
Параллельно с хирургическими мероприятиями назначают массивную антибиотикотерапию с учетом выделенной микрофлоры, по показаниям вводят антимикотические препараты. Не утратили своей актуальности при одонтогенных инфекциях сульфаниламиды, нитрофураны. Проводят дезинтоксикационную, десенсибилизирующую терапию, витаминотерапию. В рамках иммунокоррекции вводят нативную и гипериммунную плазму, гамма-глобулин, осуществляют аутогемотерапию.
Прогноз и профилактика
Своевременное комплексное лечение предопределяет благоприятный исход одонтогенной инфекции. Генерализация гнойно-воспалительного процесса чревата формированием тяжелейших по своим последствиям осложнений. Существенное влияние на прогноз оказывает противоинфекционная резистентность организма, общее состояние здоровья. Профилактика одонтогенных инфекций заключается в регулярном санировании полости рта, ликвидации очагов стоматогенной инфекции, выполнении стоматологических манипуляций в строгом соответствии с протоколом.
1. Одонтогенная инфекция: существующие проблемы/ Матчин А.А.// Оренбургский медицинский вестник. – 2015.
2. Одонтогенные инфекции головы и шеи/ М. Тримарки, А. Галли, П. Каппаре и др.// Journal of Osseointegration. - 2019;11(1).
3. Совершенствование диагностики тяжелых осложнений острой одонтогенной инфекции/ Харитонов Ю.М., Громов А.Л.// Актуальные проблемы медицины. – 2011.
4. Клинико-функциональная характеристика пациентов с острыми одонтогенными воспалительными заболеваниями/ Романенко И.С., Конев С.С., Гандылян К.С., Караков К.Г., Карпова Е.Н., Апагуни А.Э.// Современные проблемы науки и образования. – 2015. – №4.
Читайте также:

