Галавит при вич отзывы
Обновлено: 25.04.2024
Oдним из первых препаратов, использованных для лечения ВИЧ-инфекции, был азидотимидин (АЗТ). У нас он выпускался под названием тимозид, на Западе известен как ретровир, зидовудин (ЗДВ). Суточная доза определяется стадией инфекции и переносимостью препара
Oдним из первых препаратов, использованных для лечения ВИЧ-инфекции, был азидотимидин (АЗТ). У нас он выпускался под названием тимозид, на Западе известен как ретровир, зидовудин (ЗДВ). Суточная доза определяется стадией инфекции и переносимостью препарата. Препарат относится к ингибиторам обратной траскриптазы.
Препаратами второго поколения являются дидеоксииназин (ДДИ), дидеоксицитидин (ДДС). В настоящее время спектр препаратов этой группы значительно расширился (ставудин-ДДТ, хивид, фосфозид и другие).
Эта группа лекарственных средств (ЛС) имеет ряд существенных недостатков. Указанные ЛС не подавляют полностью репликацию вируса, который может быть выделен у большинства больных во время терапии.
Как показали исследования, к ЗДВ достаточно быстро развивается устойчивость, в особенности на поздних стадиях болезни с усиленной репликацией ВИЧ, когда, по-видимому, возникает резистентность и к другим аналогам нуклеозидов.
Обычный фактор, существенно ограничивающий применение ЛС этой группы, — их токсичность. Для ЗДВ характерно главным образом токсическое действие на костный мозг, тогда как ДДИ и ДДС обладают нейротоксическим действием. Кроме того, ДДИ может вызывать тяжелый острый геморрагический панкреатит.
Установлена тесная связь между клинической неэффективностью ЗДВ и резистентностью к нему in vitro.
Вторая группа препаратов, открытая сравнительно недавно и уже широко используемая, — это ингибиторы протеаз: индиновир (криксиван), инвираза (саквиновир), вирасепт (нельфиновир) и другие.
В настоящее время речь не идет уже о монотерапии антиретровирусными средствами, а только о ди-, три- и даже тетратерапии. Такие методики позволяют снижать концентрацию вируса до величин, не определяемых с помощью современных тест-систем (< 200 копий/1 мл).
Предпочтительность комбинированной терапии обосновывается следующими положениями (В. В. Покровский).
- Использование многих этиотропных агентов более эффективно подавляет жизнедеятельность вируса, воздействуя на различные болевые точки или синергически воздействуя на одну из них.
- Это позволяет снизить дозы препаратов, что уменьшает частоту и выраженность побочных эффектов.
- Различные лекарства имеют различную способность проникать в ткани (головной мозг и т. д.).
- Комбинация лекарств затрудняет формирование устойчивости, или она появляется позднее.
Все описанные выше подходы к терапии ВИЧ-инфекции предполагали непосредственное воздействие на репликацию вируса. Другая возможная методика лечения ВИЧ-инфекции состоит в усилении защитных сил макроорганизма. Некоторые варианты такого подхода в большинстве случаев неспецифические, изредка специфические и могут воздействовать на защитные свойства клетки-хозяина.
Интерфероны, как природные, так и рекомбинантные, имеют ряд недостатков: антигенность, необходимость многократного введения для поддержания достаточной концентрации в организме, большое количество побочных эффектов и т. д.
Этих недостатков лишены многие индукторы эндогенного интерферона, некоторые из них способны включаться в синтез ИФН в некоторых популяциях клеток, что в ряде случаев имеет определенное преимущество перед поликлональной стимуляцией иммуноцитов интерфероном.
Специфическая активность циклоферона при ВИЧ-инфекции изучена в 1997 году в Институте гриппа РАМН
- Выявлена выраженная ингибирующая активность циклоферона на репродукцию ВИЧ в культуре клеток моноцитов.
- По показателям ингибирующей активности циклоферон значительно превосходит азидотимидин.
- Представленные экспериментальные данные обосновывают клиническое использование циклоферона для лечения больных ВИЧ-инфекцией.
Пятилетний опыт применения циклоферона у ВИЧ-инфицированных позволяет оценить результаты этой работы.
В период 1992 – 1997 годы в Санкт-петербургском городском центре по профилактике и борьбе со СПИД циклоферон получили 40 пациентов с разными стадиями ВИЧ-инфекции. Следует отметить, что 11 больных прошли два курса терапии циклофероном, в связи с чем общее число лиц, получивших один курс лечения циклофероном, составило 29 человек. В основном это были молодые люди в возрасте до 40 лет (20 человек), в том числе трое детей до 14 лет.
Все больные отмечали хорошую переносимость циклоферона, отсутствие пирогенных реакций после его введения.
Пациенты также констатировали улучшение общего состояния, сна и аппетита, повышение жизненного тонуса, работоспособности. 30% из числа получавших препарат и перенесших в осенне-зимний период грипп или ОРВИ отметили, что заболевание протекало непривычно легко и выздоровление наступило быстрее обычного.
Из клинической практики
После курса циклоферона отмечалось существенное снижение вирусной нагрузки (в 3,6 раза). Число CD4+ возросло на 62%. Монотерапия циклофероном оказала положительное стабильное влияние на изученные показатели у пациентов.
Определенный интерес представляют результаты многолетнего наблюдения больных ВИЧ-инфекцией, которые получали длительно циклоферон в своеобразном профилактическом режиме с целью стабилизации процесса и профилактики прогрессирования заболеваний.
В 1998 году на базе Российского научно-методического Центра по профилактике и борьбе со СПИД (руководитель член-корр. АМН В. В. Покровский) была изучена динамика суррогатных маркеров ВИЧ-инфекций (уровень CD4+) и вирусная нагрузка у больных ВИЧ-инфекцией при лечении циклофероном.
Оценка достоверности полученных результатов проводилась с помощью непараметрических критериев (критерий знаков, максимум-критерий, критерий Вилкоксона для сопряженных совокупностей).
В испытуемую группу вошли 10 взрослых больных ВИЧ-инфекцией в стадии первичных проявлений по Российской классификации ВИЧ-инфекции (В. И. Покровский, 1989 г.). Результаты исследования уровня CD4-лимфоцитов представлены в таблице и на рисунке, из которых видно, что после первых четырех недель исследования наметилась тенденция к повышению среднего уровня CD4-лимфоцитов, которое к 12-й неделе стало статистически достоверным. Это повышение сохранилось до конца исследования, несмотря на
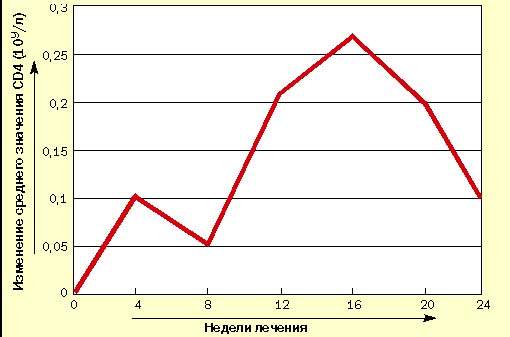 |
| Рисунок 1. Изменение уровня CD4-лимфоцитов у больных ВИЧ-инфекцией при лечении циклофероном (в сравнении с исходным уровнем) |
 |
| Рисунок 2. Средние значения изменения концентрации РНК ВИЧ (log10/мл) |
Таким образом, применение циклоферона в терапии ВИЧ-инфекций сопровождается стабилизацией клинических проявлений заболевания, улучшением состояния, а также гематологических и иммунологических показателей больных.
Циклоферон как монопрепарат оказывает иммуномодулирующее и противовирусное действие при лечении ВИЧ-инфицированных (стадии А1 3Б) в тех случаях, когда нет значительного снижения числа CD4+ клеток (<200). Хорошо зарекомендовало себя назначение циклоферона по следующей схеме.
- По 4 мл препарата в 1, 2, 4, 6, 8, 10, 13, 16, 19 и 22-й дни лечения (у детей по 2 мл). Первые две инъекции могут вводиться внутривенно, остальные внутримышечно. Повторные курсы циклоферона рекомендуется проводить через 6 месяцев под иммунологическим контролем.
- Циклоферон хорошо сочетается со всеми основными лекарственными средствами, его рекомендуется использовать в случае, когда имеются признаки активной репликации ВИЧ (высокие показатели вирусной нагрузки), у больных с обострениями различных оппортунистических заболеваний.
Исчезновение у некоторых больных иммунологических и вирусологических показаний для проведения противоретровирусной терапии может иметь важное значение для разработки новых подходов к проведению лечения больных ВИЧ-инфекцией, для снижения стоимости терапии и отсрочки развития резистентности к ней или преодолению последней.
Циклоферон может оказаться перспективным профилактическим средством при сомнительных контактах и контактах с заведомо ВИЧ-инфицированными партнерами.
Лекарственные препараты, воздействующие на различные звенья иммунной системы, давно получили широкое распространение в современной клинической практике. Но если о пользе иммуномодуляторов при лечении ОРВИ и гриппа известно многим, то о применении этих препаратов в комплексной терапии ВИЧ, дерматологических и онкологических заболеваний слышали далеко не все.
Иммуномодуляторы – это лекарственные препараты с содержанием природных или синтетических веществ, которые при применении их в терапевтических дозах восстанавливают функции иммунной системы. Поэтому их применение показано при различных иммунодефицитных состояниях.
Применение иммуномодуляторов
Одна из главных мишеней иммуномодуляторов – вторичные иммунодефициты, или болезни иммунной системы, которые характеризуются развитием повторных, затяжных инфекционно-воспалительных заболеваний всех локализаций и любой этиологии. Патологические процессы при этом могут охватить кожу, подкожную клетчатку, верхние дыхательные пути, легкие, мочеполовую систему, пищеварительный тракт и другие органы. Причиной развития вторичных иммунодефицитов могут стать хронические вирусные инфекционные заболевания, включая такое серьезное заболевание, как ВИЧ-инфекция. Чтобы выявить наличие вируса иммунодефицита в крови, проводится тестирование на антитела.

Пока что наука не может предложить метод, который победил бы ВИЧ и полностью удалил его из организма человека. Но уже сейчас успешно применяется самая современная и эффективная на сегодняшний день высокоактивная антиретровирусная терапия (ВААРТ), которая направлена на замедление прогрессирования заболевания и остановку его перехода в СПИД (AIDS) – термальную стадию развития ВИЧ-инфекции, которая формируется в среднем через 9-10 лет после инфицирования человека вирусом иммунодефицита. Однако, при соответствующей терапии жизнь инфицированного человека может продолжаться до 70-80 лет. И помочь в этом могут в том числе и иммуномодуляторы.
Применение иммуномодуляторов при ВИЧ
Как известно, вирус иммунодефицита человека достаточно быстро видоизменяется. На один ген приходится до 1000 мутаций. При отсутствии лечения ВИЧ воспроизводит себя достаточно быстро: в организме инфицированного человека образуется от 10 до 100 миллиардов новых вирусов в день. Для сравнения: вирус гриппа мутирует примерно в 30 раз реже. Это одна из главных причин, препятствующих изобретению вакцины против ВИЧ.
Основное коварство ВИЧ состоит в том, что он постепенно разрушает клетки иммунной системы и делает человека беззащитным перед другими заболеваниями, которые обычно и приводят к изменению качества жизни больных. Для проведения терапии сопутствующих ВИЧ-инфекции других инфекционных заболеваний необходимо очень тщательно подходить к выбору лекарственных средств, а также не забывать о комплексном лечении, которое было бы направлено на несколько возбудителей одновременно. В список препаратов могут попасть антибиотики, противогрибковые и противовирусные препараты, а также иммуномодуляторы.
Список типов препаратов-иммуномодуляторов при ВИЧ-инфекции
При ВИЧ иммуномодуляторы применяют с обязательным учетом особенностей и механизмов их воздействия, возможных побочных эффектов и клинико-иммунологического состояния пациентов. Среди препаратов, которые врачи могут рекомендовать при вирусе иммунодефицита человека – препараты на основе:
- интерферонов,
- интерлейкинов
- лекарства с содержанием тимопоэтина,
- альфа-глутамил-триптофан натрия
- комплекса дезоксирибонуклеата натрия с железом и других составляющих.
Иммуномодуляторы при онкологических заболеваниях (раке)
Среди основных методов борьбы с онкологическими заболеваниями, которые применяются во всем мире, – лучевое и химиотерапевтическое лечение. Эффективность подобной терапии давно подтверждена, она ежегодно помогает спасать жизни десяткам тысяч людей. Однако, нельзя не принимать во внимание тот факт, что с целью повышения процента ремиссий заболевания ученые постоянно разрабатывают и внедряют в практику все более агрессивные схемы лечения, что приводит к развитию выраженных функциональных и количественных нарушений в иммунной системе. Это может стать причиной развития различных аутоиммунных, аллергических и инфекционных осложнений, что может дополнительно усугубить течение онкологического заболевания. Подобные осложнения могут препятствовать проведению лечения основного заболевания, снижать его эффективность и тем самым способствовать росту опухоли и ухудшению качества жизни пациентов.
По этой причине врачи-онкологи в процессе комплексного лечения особое внимание уделяют иммунокорригирующей терапии. Применение препаратов, положительно влияющих на иммунитет, способствует уменьшению токсичности химиопрепаратов, сокращению сроков восстановления лейкоцитов, снижению заболеваемости от вирусных инфекций, а в ряде случаев – увеличению продолжительности ремиссии. При онкологическом заболевании можно принимать только лекарственные средства с хорошо изученным механизмом действия, которые преимущественно могут влиять на то или иное звено иммунной системы. Очень важно понимать, что самостоятельно выбирать такие препараты не рекомендуется. Перед началом приема иммуномодуляторов при раке необходима оценка параметров иммунной системы врачом с последующим подбором соответствующего лекарства.
Корригировать показатели иммунитета может быть необходимо как после лучевой и химиотерапии, так и после оперативных вмешательств. Также подобное лечение проводится для коррекции иммунологических нарушений, которые возникают вследствие иммунодепрессивного воздействия на иммунную систему самой злокачественной опухоли. Среди иммуномодуляторов, которые применяют при лечении онкологических заболеваний, – препараты микробного происхождения, пептидные препараты, цитокины и препараты на их основе (интерфероны, интерлейкины), препараты на основе природных факторов (препараты иммуноглобулинов, экстракты растений).
Иммуномодуляторы при ВПЧ (вирусе папилломы человека)
Вирус папилломы человека (ВПЧ) – это совокупность микроорганизмов вирусной природы, которые передаются от одного живого организма другому. ВПЧ населяет исключительно базальный слой эпидермиса, а его размножение происходит в верхних слоях кожи. Проникая в организм своего хозяина, вирус внедряется в ДНК клеток. Инфицированная вирусом клетка интенсивно растет и делится, а через некоторое время на пораженном участке появляются характерные разрастания – папилломы, остроконечные кондиломы и бородавки. ВПЧ может быть с низким, средним и высоким риском онкологического перерождения.

Список препаратов-иммуномодуляторов при ВПЧ
С проявлениями ВПЧ борются препараты с содержанием:
- интерферона
- комплекса инозина и соли 4-ацетамидобензойной кислоты
- глюкозаминилмурамилдипептида
- веществ растительного происхождения.
Одним из препаратов интерферона, который используется для лечения папилломавирусной инфекции, является ВИФЕРОН – иммуномодулирующий препарат с противовирусным действием. Препарат выпускается в трех лекарственных формах: Свечи (суппозитории ректальные), Мазь и Гель.
Схема лечения препаратом ВИФЕРОН Свечи при ВПЧ
Рекомендуемая доза для взрослых для лечения папилломавирусной инфекции – ВИФЕРОН 500 000 ME по 1 суппозиторию 2 раза/сут через 12 ч ежедневно в течение 5-10 суток и более при рецидивирующей инфекции. По клиническим показаниям терапия может быть продолжена.

На современном этапе иммунотерапия является неотъемлемой частью четвёртого направления в терапии опухолевых заболеваний. Большинство иммунотропных препаратов не обладает прямой противоопухолевой активностью, поэтому оптимальный клинический эффект может быть достигнут только при сочетании радикального противоопухолевого лечения с иммунотерапией. Существуют: специфическая иммунотерапия - инициирующая развитие специфических противоопухолевых иммунных реакций (так называемые противоопухолевые вакцины) и неспецифическая, восстанавливающая нарушенные количественные и функциональные показатели иммунной системы и повышающая в результате этого противоопухолевую резистентность организма в целом. Фармацевтический рынок предлагает большое количество лекарственных средств, влияющих на иммунную систему и на противоопухолевую резистентность организма. Среди них особого внимания заслуживает Галавит - отечественный иммуномодулятор с противовоспалительной активностью.
Цель работы - анализ механизмов иммуномодулирующих и противоопухолевых эффектов Галавита, который представляет собой аминодигидрофталазиндион натрия и является единственным иммуномодулятором с противовоспалительным механизмом действия, вследствие модуляции синтеза провоспалительных цитокинов гиперактивными макрофагами. Он способен, как супрессировать избыточные проявления иммунного ответа (обратимое ингибирование гиперактивированных макрофагов на 6-8 часов), так и повышать иммунную реакцию при недостаточной её активности. Основные механизмы действия Галавита осуществляются по следующим направлениям. Он регулирует активность макрофагов и синтез цитокинов (ИЛ-1, ИЛ-6, ФНО-α), повышает неспецифическую защиту организма за счёт усиления фагоцитарной активности нейтрофилов, повышает уровень иммуноглобулинов при их недостаточности, регулирует пролиферативную активность субпопуляций Т-лимфоцитов (Т-хелперы, Т-киллеры) регулирует пролиферативную активность NК-клеток, стимулирует синтез интерферонов, обладает антиоксидантным действием.
Установлено, что Галавит нормализует репрезентативную функцию макрофагов, синтез ими провоспалительных и противовоспалительных цитокинов, фагоцитарную активность нейтрофилов, цитотоксическую активность NK-клеток, усиливает продукцию ИЛ-2 Т-лимфоцитами и наработку лимфокинактивированных киллеров. Он регулирует пролиферацию Т- и В-лимфоцитов, синтез цитокинов (ИФ-α, ИФ-γ), опосредованно воздействует на гуморальное звено иммунитета, нормализуя продукцию антител и их функциональную активность. Отмечено, что на фоне применения Галавита повышается биодоступность опухоли для противоопухолевых препаратов и лучевой терапии. Характерно, что препарат не воздействует на нормально функционирующие клетки, что выгодно отличает его от большинства иммуномодулирующих препаратов. Доклинические исследования показали, что Галавит при концентрациях, не оказывающих цитотоксического действия на опухолевые клетки, ингибирует их инвазивную активность. Данный эффект проявляется как в отношении клеток экспериментальных опухолей мыши, так и опухолей человека. Клинические исследования подтвердили, что включение Галавита в традиционную схему послеоперационного лечения больных с гипернефроидным раком, инвазивным раком мочевого пузыря обеспечивает адекватную коррекцию иммунных нарушений и способствует снижению эндогенной токсемии, количества осложнений, летальности и длительности лечения больных в стационаре. Проведенный анализ наблюдения и терапии больных с диагнозом - аденома и рак простаты доказал, что у пациентов, которым к стандартной терапии добавлялся Галавит достоверно реже, по сравнению с контрольной группой, развивались не только иммунологические нарушения, опосредованные действием химиопрепаратов, но и была ниже частота таких побочных эффектов химиотерапии, как тошнота, рвота, диарея. Отмечено, что в группе "Галавит" частота возникновения отдалённых метастазов была достоверно ниже по сравнению с группой контроля. Коррекция иммунного статуса, и как результат, снижение частоты возникновения и тяжести протекания побочных эффектов привели к значительному улучшению общего состояния онкологических больных.
Таким образом, применение Галавита в комплексной терапии онкологических больных способствует нормализации иммунного статуса, повышению неспецифической резистентности, снижению частоты возникновения и тяжести инфекционных осложнений, длительности послеоперационного реабилитационного периода, улучшению переносимости химио- и радиотерапии, способствует формированию настроя на выздоровление и улучшает качество жизни онкологических больных.
Так как элиминация любого инфекционного возбудителя является результатом синергического взаимодействия между защитными силами макроорганизма и антимикробными агентами, то лечение антибиотиками, противовирусными и противогрибковыми средствами будет малоэфф
Так как элиминация любого инфекционного возбудителя является результатом синергического взаимодействия между защитными силами макроорганизма и антимикробными агентами, то лечение антибиотиками, противовирусными и противогрибковыми средствами будет малоэффективным у лиц с исходно пониженной функциональной активностью иммунной системы. Поэтому оправдан поиск препаратов, стимулирующих иммунологическую реактивность и тем самым повышающих эффективность антимикробной терапии. Речь идет об иммуномодуляторах — лекарственных препаратах с иммунотропным действием, усиливающих эффективную иммунную защиту [9, 10, 13].
При вялотекущих, рецидивирующих, плохо поддающихся химиотерапии, имеющих тенденцию к хронизации заболеваниях целесообразно включение в комплексную терапию иммуномодулятора. Отечественный препарат последнего поколения — полиоксидоний — является иммуномодулятором первого выбора.
В условиях целостного организма полиоксидоний оказывает сложное и многогранное действие на иммунную систему. Так как развитие любого иммунного ответа начинается с клеток моноцитарно-макрофагальной системы, а цитокины, продуцируемые моноцитами/макрофагами, обладают плейотропным эффектом, то усиление под влиянием полиоксидония их функциональной активности ведет к активации и клеточного, и гуморального иммунитета. Так, в частности, при введении полиоксидония совместно с низкими дозами антигена происходит усиление синтеза антител к этому антигену в 5-10 раз по сравнению с контролем. Важно отметить, что такое усиление можно наблюдать у животных с генетически детерминированной слабой отвечаемостью на данный антиген [6]. Таким образом, полиоксидоний обладает способностью приводить в движение все факторы, защищающие организм от инфекционных агентов, причем защищающие естественным путем, так, как это происходит при развитии иммунного ответа в организме. А интенсивность иммунного ответа в большей степени зависит от исходного функционального состояния иммунной системы человека [6].
Рассмотрим, какова же клиническая и иммунологическая эффективность полиоксидония при трех основных формах иммунодефицитов.
Первичные иммунодефициты — это врожденные нарушения иммунной системы, связанные с наличием дефектов на генном уровне. Применение иммуномодуляторов при этих заболеваниях на первый взгляд кажется бесперспективным. Естественно, вылечить с помощью любого, даже самого хорошего иммуномодулятора первичный иммунодефицит невозможно, но применение этих препаратов в комплексном лечении таких состояний является обоснованным. Это связано с тем, что, согласно концепции иммунологических мобилей [4], иммунная система работает по типу весов. Наличие груза, даже очень небольшого, на одной из чашечек весов приводит в движение всю систему. Концепция иммунологических мобилей обосновывает применение иммуномодуляторов при первичных иммунодефицитах. Мы полагали, что активация, например, фагоцитарной системы у больных с дефектами в биосинтезе антител может в какой-то степени компенсировать этот недостаток и привести хотя бы к временному улучшению клинического состояния больного.
В отделении иммунопатологии нашего института полиоксидоний применялся в комплексном лечении первичного иммунодефицита — общей вариабельной иммунологической недостаточности (ОВИН) у взрослых. Это заболевание характеризуется снижением всех классов иммуноглобулинов — IgG, IgA, IgM и клинически чаще всего проявляется в виде хронических рецидивирующих заболеваний бронхолегочного аппарата. Как правило, при длительном течении ОВИН и выраженных очагах инфекции у этой категории больных формируется комбинированный клеточно-гуморальный дефект иммунитета; у многих пациентов отмечается тенденция к лейкопении, нейтропении и лимфопении.
У больных с ОВИН лечение полиоксидонием проводили по индивидуальной схеме: начинали с 12 мг, в/в, № 3 через день, а потом переводили на поддерживающую терапию по 6 мг в/м до 10 инъекций. В некоторых случаях полиоксидоний применяли в течение трех месяцев. У больных ОВИН в результате терапии полиоксидонием формула крови нормализовывалась, сокращались сроки лечения обострений, удлинялась ремиссия и в целом существенно улучшалось качество жизни.
К приобретенным иммунодефицитам относится ВИЧ-инфекция. Длительное время клинические иммунологи подвергали сомнению целесообразность применения иммуномодуляторов у больных с этой инфекцией, так как опасались активации под их влиянием Т-клеточного иммунитета и усиления размножения вируса. Однако в настоящее время накапливается положительный опыт применения иммуномодуляторов при ВИЧ-инфекции, и в частности полиоксидония. В НИИ клинической иммунологии Ростова-на-Дону применяли полиоксидоний совместно с антибиотиками (без противовирусной терапии) у больных в стадии пре-СПИДа с двусторонней очаговой пневмонией. У всех пациентов получен хороший клинический эффект, подтвержденный данными иммунологического и биохимического исследований. При применении антибиотиков и полиоксидония, по данным рентгенологического исследования, удалось на пять дней раньше ликвидировать очаги пневмонии в легких и вывести больных в состояние стойкой ремиссии по сравнению с теми, кто получал только антибиотики. У пациентов повысился уровень CD4+ T-клеток и вырос до единицы иммунорегуляторный индекс. Кроме того, улучшилась функциональная активность печени: снизился уровень билирубина и трансаминаз. Удивительным представляется факт существенного снижения вирусной нагрузки: с lg10 7 до lg10 6 . Мы полагаем, что снижение уровня ВИЧ связано со способностью полиоксидония повышать функциональную активность макрофагов и NK-клеток, осуществляющих элиминацию из организма инфицированных клеток. Мы также считаем, что включение полиоксидония в комплексную терапию больных СПИД, страдающих оппортунистическими инфекциями, является оправданным и целесообразным, так как резервные возможности организма человека очень велики и их повышение с помощью иммуномодулятора в ряде случаев может дать хороший клинический результат, пусть даже и кратковременный.
Вторичные иммунодефициты (ВИД) — это нарушения иммунной системы, развивающиеся в позднем постнатальном периоде или у взрослых и не являющиеся результатом генетических дефектов. Условно мы выделяем две формы ВИД: индуцированную и спонтанную [11]. Индуцированная форма возникает в результате конкретных причин, вызвавших ее появление: рентгеновское излучение, цитостатическая терапия, применение кортикостероидов, травмы и хирургические вмешательства. В этот перечень также входят нарушения иммунитета, развивающиеся вторично по отношению к основному заболеванию (диабет, заболевание печени, почек, злокачественные новообразования). Спонтанная форма вторичного иммунодефицита характеризуется отсутствием явной причины (хотя, без сомнения, она имеется), вызвавшей нарушение иммунной реактивности. Клинически она проявляется в виде хронических, часто рецидивирующих инфекционно-воспалительных процессов бронхолегочного аппарата, придаточных пазух носа, урогенитального и желудочно-кишечного тракта, глаз, кожи, мягких тканей, вызванных оппортунистическими (условно-патогенными) микроорганизмами. Поэтому хронические, часто рецидивирующие, вялотекущие, трудно поддающиеся лечению традиционными средствами воспалительные процессы любой локализации у взрослых рассматриваются как клинические проявления ВИД.
Наиболее ярким примером индуцированных ВИД являются хирургические инфекции. Доказана высокая клиническая эффективность полиоксидония, применяющегося как для их профилактики, так и при лечении [2]. В первом случае применение препарата перед операцией может существенно снизить развитие гнойно-септических осложнений, особенно при операциях на толстом кишечнике, когда велик риск их развития. При предоперационном применении полиоксидония почти в три раза удалось снизить частоту ампутации стопы вследствие язвенно-некротических поражений у больных сахарным диабетом [1]. Включение полиоксидония в комплексную терапию развившихся хирургических инфекций способствует более быстрому очищению раны от гнойно-некротических масс, ускоряет ее эпителизацию и заживление. Все это ведет к существенному снижению количества потребляемых антибиотиков и сокращению числа койко-дней. В силу наличия детоксицирующих и антиоксидантных свойств полиоксидоний особенно эффективен при токсико-септических состояниях; в этих случаях его целесообразно назначать капельно, внутривенно ежедневно в течение первых двух-трех дней и далее через сутки.
Как отмечалось выше, хроническое, рецидивирующее течение инфекционно-воспалительного процесса любой локализации может считаться проявлением ВИД. В этих случаях при назначении антимикробных препаратов целесообразным представляется также назначение иммуномодулятора. В нашем институте имеется положительный опыт применения полиоксидония в комплексном лечении хронического рецидивирующего фурункулеза [3] и хронического рецидивирующего герпеса.
У больных в стадии обострения фурункулеза в результате приема полиоксидония наблюдалось уменьшение признаков интоксикации, уменьшение инфильтрации фурункулов, более быстрая их регрессия. Наблюдение в течение двух лет выявило стойкую ремиссию заболевания у 44,6 % больных. Исходно у больных с хроническим рецидивирующим фурункулезом наблюдалось снижение функциональной активности фагоцитарных клеток, в частности снижение бактерицидных свойств нейтрофилов. Как правило, после применения полиоксидония у таких больных происходило восстановление их функциональной активности. Также имело место восстановление иммунорегуляторного индекса при его исходном нарушении.
При применении полиоксидония совместно с противовирусными препаратами у больных с рецидивирующим герпесом в стадии обострения острая фаза местного воспаления купировалась уже на вторые сутки, тогда как в контрольной группе везикулезные элементы сохранялись до пятого дня от начала лечения. Значительно быстрее достигалась и полная реэпитализация очагов поражения. У 95% больных, получавших полиоксидоний, длительность ремиссии составила в среднем три года. У этих больных наблюдалось повышение функциональной активности естественных киллеров и усиливался синтез α-интерферона, то есть полиоксидоний стимулировал развитие противовирусной защиты.
Литература
1. Гришина Т. Ю., Станулис А. И., Жданов А. В., Хаев А. В. Лечение гнойно-септических осложнений у больных диабетом // Аллергия, астма и клиническая иммунология. 2000. № 1. С. 47-48.
2. Карсонова М. И., Пинегин Б. В., Хаитов Р. М. Иммунопрофилактика и иммунотерапия хирургических инфекций // Практикующий врач. 1998. № 12. С. 9-12.
3. Латышева Т. В., Сетдикова Н. Х. Эффективность полиоксидония при некоторых формах первичных иммунодефицитов (ОВИН) и вторичных иммунодефицитных состояниях // Аллергия, астма и клиническая иммунология. 2000. № 1. С. 41-43.
4. Лусс Л. В. Полиоксидоний в общеклинической практике // Аллергия, астма и клиническая иммунология. 2000. № 1. С. 21-41.
5. Петров Р. В. Я или не Я. Иммунологические мобили. М.: Молодая гвардия, 1987.
6. Петров Р. В., Хаитов Р. М., Некрасов А. В. и др. Полиоксидоний - иммуномодулятор последнего поколения: итоги трехлетнего клинического применения // Аллергия, астма и клиническая иммунология. 1999. № 3. С. 3-6.
7. Пинегин Б. В. Полиоксидоний — новое поколение иммуномодуляторов с известной структурой и механизмом действия // Аллергия, астма и клиническая иммунология. 2000. № 1. С. 27-28.
8. Полосин А. В. Иммуномодулятор полиоксидоний — перспектива в лечении хронических урогенитальных инфекций//Аллергия, астма и клиническая иммунология. 2000. № 1. С. 45-46.
9. Хаитов Р. М., Пинегин Б. В. Иммуномодуляторы и некоторые аспекты их клинического применения // Клиническая медицина. 1996. № 8. С. 7-12.
10. Хаитов Р. М., Пинегин Б. В., Андронова Т. М. Отечественные иммунотропные лекарственные средства последнего поколения и стратегия их применения // Лечащий Врач. 1998. № 4. С. 46-51.
11. Хаитов Р. М., Пинегин Б. В. Вторичные иммунодефициты: клиника, диагностика, лечение // Иммунология. 1999. № 1. С. 14-17.
12. Хаитов Р. М., Пинегин Б. В. Современные представления о защите организма от инфекции // Иммунология. 2000. № 1. С. 61-64.
13. Хаитов Р. М., Пинегин Б. В. Основные принципы иммуномодулирующей терапии // Аллергия, астма и клиническая иммунология. 2000. № 1. С. 9-16.
14. Хоменко А. Г. Туберкулез вчера, сегодня, завтра//Проблемы туберкулеза. 1997. № 5. 9-11.
Для цитирования: Свистушкин В.М., Леонова М.В., Никифорова Г.Н., Покозий И.Ю. Применение иммуномодулятора Галавит в лечении хронического тонзиллита. РМЖ. 2015;6:342.
Актуальность проблемы хронической воспалительной патологии структур лимфоэпителиального кольца Вальдейера – Пирогова не вызывает сомнений. Прежде всего это обусловлено широкой распространенностью данных патологических процессов в человеческой популяции и значительным вкладом лимфоидной ткани глотки в формирование местного и общего иммунитета организма. Основное рабочее звено глоточного кольца представлено скоплениями лимфоидной ткани на перекрестье респираторного и пищеварительного трактов – небными миндалинами, которые располагаются между небными дужками у входа в полость ротоглотки.
Изучению роли небных миндалин в формировании местного и гуморального иммунитета в организме посвящено много научных работ последних лет. Синтез естественных антибиотиков лейкоцитарного происхождения, обладающих бактерицидным и цитотоксическим эффектами (дефензинов, лактоферрина), выработка протеолитических ферментов (протеазы, липазы, гликозидазы, фосфотазы) и лизоцима, процессы в лимфопоэтических тканях, образование антител и секреторных иммуноглобулинов, регуляция процессов миграции фагоцитов, экзоцитоза и фагоцитоза и некоторые другие функции обусловливают важную роль небных миндалин в защитно-приспособительных реакциях человека. Именно в лакунах происходят распознавание и презентация антигенов В- и Т-клеток лимфоидной ткани и запускается механизм формирования иммунного ответа – прежде всего антигенспецифичные В- и Т-клеточные реакции. При развитии хронического тонзиллита (ХТ) воспалительные реакции в миндалинах имеют более выраженный характер и развиваются не только в области лакун, но и в более глубоких отделах миндаликовой ткани, включая лимфатическую и кровеносную сосудистую сети [5, 7, 11].
ХТ в настоящее время рассматривается как инфекционно-аллергическое заболевание с местными проявлениями в виде стойкой воспалительной реакции небных миндалин, морфологически выражающееся альтерацией, экссудацией и пролиферацией, приводящее к угнетению неспецифических факторов естественной резистентности организма, нарушению гуморального и клеточного звеньев иммунитета. Клинически ХТ проявляется периодическими обострениями в виде ангин и в ряде случаев обусловливает формирование патологических изменений со стороны сердечно-сосудистой, нервной, эндокринной систем, а также почек и суставов, и нередко является причиной развития регионарных и общих осложнений [3].
С позиции клинической иммунологии ХТ является вторичным иммунодефицитным состоянием, характеризующимся дисбалансом как гуморального, так и клеточного звеньев иммунитета. Причем именно иммунный дисбаланс является одной из причин хронического течения заболевания. Нарушения системного иммунитета проявляются преимущественно изменениями клеточного звена в виде снижения содержания в крови активных Т-клеток и уменьшения фагоцитарной активности нейтрофилов [4, 6]. Наряду с системным иммунитетом страдает и местная иммунологическая активность небных миндалин вплоть до декомпенсации их иммунологической функции, что повышает риск наступления токсико-аллергической стадии заболевания. Степень нарушения иммунологической функции миндалин рассматривается как наиболее важный клинико-прогностический критерий, определяющий необходимость применения тонзиллэктомии.
ХТ характеризуется длительным упорным течением и может проявляться в 2-х клинических вариантах: безангинной форме со стертой клинической картиной в виде местных изменений миндалин (стадия компенсации) или с частыми обострениями в форме ангин (стадия субкомпенсации). Причем частота обострений хронического тонзиллита, как правило, составляет 1–3 раза в год, однако в некоторых случаях тонзиллиты могут развиваться и до 5–6 раз в год [1, 3].
В связи с важной ролью небных миндалин в иммуногенезе и местной защите слизистой оболочки верхних отделов дыхательных путей показания к тонзиллэктомии должны быть строго определены. При отсутствии абсолютных показаний к удалению миндалин наиболее целесообразным представляется консервативное лечение ХТ, сохраняющее иммунологические функции миндаликовой лимфоидной ткани. Основной целью терапии ХТ является достижение ремиссии или компенсации заболевания. Критериями эффективности консервативного лечения ХТ являются исчезновение гноя и патологического содержимого небных миндалин, уменьшение выраженности местных признаков хронического воспаления, снижение частоты или отсутствие ангин, улучшение общего состояния.
Основным действием препарата Галавит® является способность избирательно воздействовать на функционально-метаболическую активность фагоцитарных клеток, прежде всего моноцитов/макрофагов, нейтрофилов, NK-клеток (естественных киллеров), повышая или понижая их функционально-метаболическую активность в зависимости от исходных значений. Галавит® регулирует пролиферацию Т- и В-лимфоцитов, стимулирует синтез эндогенных интерферона-α и -γ, повышает уровень иммуноглобулинов классов G, М, А и их аффинитет. Кроме того, Галавит® проявляет противовоспалительное действие в результате обратимого на 6–8 ч ингибирования синтеза гиперактивированными макрофагами провоспалительных цитокинов (фактора некроза опухоли, интерлейкинов-1 и -6), активных форм кислорода и др., определяющих степень проявления воспалительных реакций, их цикличность, а также выраженность интоксикации. Нормализация функционального состояния макрофагов/моноцитов приводит к уменьшению интоксикационного синдрома и продолжительности воспалительного процесса. В дополнение Галавит® имеет антиоксидантный механизм действия, который реализуется несколькими путями: прямое антиоксидантное действие, инактивация реакционных соединений, регуляция активности антиоксидантных ферментов, уменьшение выработки макрофагами активных форм кислорода и перекисных радикалов. Все эти механизмы действия препарата Галавит® позволяют достигать быстрого купирования воспаления, симптомов интоксикации и осуществлять коррекцию иммунной защиты организма.
В реальной практике с целью повышения эффективности лечения хронических воспалительных заболеваний, ускорения разрешения симптомов острых респираторных инфекционных заболеваний у пациентов с сопутствующей патологией ЛОР-органов применяется комплексная терапия с использованием иммуномодулятора Галавит® [2, 8–10]. Вместе с тем возможности влияния иммуномодулирующей терапии на течение хронических воспалительных заболеваний, частоту обострений и устойчивость ремиссии у пациентов с хроническими заболеваниями ЛОР-органов остаются малоизученными.
Для изучения влияния препарата Галавит® в составе комплексной терапии ХТ на течение заболевания и длительность ремиссии было инициировано проспективное наблюдательное исследование в условиях реальной клинической практики. Исследование проводится в амбулаторных условиях в течение 1 года наблюдения; сроки проведения – февраль 2014 – апрель 2015 г. Основным критерием включения было обращение в связи с развитием ангины у пациентов с анамнезом ХТ, которым после выздоровления назначался или не назначался препарат Галавит® в комплексном лечении. Таким образом, было сформировано 2 группы наблюдения: в основной группе (40 пациентов) в комплексной терапии ХТ использовался иммуномодулятор Галавит®, в контрольной группе (20 пациентов) терапия ХТ проводилась без применения иммунотропных препаратов. На фоне ангины всем пациентам было проведено стандартное лечение в амбулаторных условиях, включая курс антибактериальных препаратов. После купирования обострения у пациентов основной группы применялся Галавит® в форме сублингвальных таблеток по 25 мг в соответствии с инструкцией по схеме: 1 таблетка 4 р./сут в течение 5 дней, затем по 1 таблетке 4 раза через 48 ч курсом до 15 дней (курсовая доза 2000 мг). Сроки наблюдения за пациентами составили 30 дней, 6 и 12 мес. Первичной конечной точкой в исследовании была частота перенесенных за период наблюдения ангин; вторичными точками – частота ухудшений состояния миндалин (наличие/увеличение гнойного отделяемого в лакунах, пастозность, отек, разрыхленность миндаликовой ткани с ухудшением общего самочувствия), эпизоды острых респираторных инфекционных заболеваний.
Общая выборка больных ХТ представлена 60 пациентами в возрасте от 18 до 50 лет, из них 24 мужчины и 36 женщин. Анамнез течения ХТ у всех наблюдаемых характеризовался ангинной формой с частотой обострений более 2-х раз и более 2-х эпизодов ухудшения общего состояния на фоне усиления выраженности местных признаков воспаления в глотке в течение 1 года. Средняя частота простудных заболеваний (ОРЗ) составила 2,5 раза в год. Сравнительная характеристика групп пациентов представлена в таблице 1.
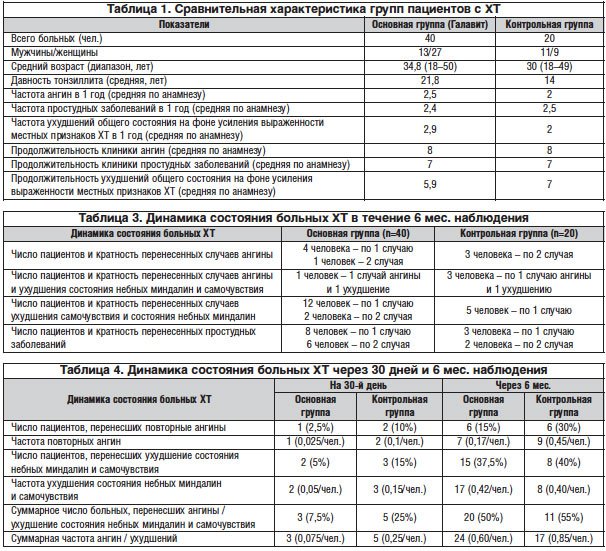
По результатам осмотра состояния миндалин при орофарингоскопии на момент включения гипертрофия с воспалительными изменениями миндаликовой ткани (гипертрофический тонзиллит) имела место у 35 и 40% пациентов основной и контрольной групп соответственно, наличие казеозного детрита в лакунах – у более чем половины больных (табл. 2).
В первый контрольный срок оценки результатов лечения ХТ (30-й день) были получены сопоставимые результаты: отсутствие ангин в основной группе пациентов отмечалось у 97,5%, в контрольной – у 90%; развитие повторной ангины имело место у 1-го и 2-х больных, а ухудшение состояния миндалин наблюдалось у 2–х (5%) и 3-х (15%) больных соответственно. Острые респираторные инфекционные заболевания перенесли однократно по 1–му пациенту в каждой группе наблюдения. Таким образом, суммарная частота обострений ХТ (ангины и ухудшения) на 30-й день составила 3 случая (7%) в основной группе и 5 случаев (25%) – в контрольной. К настоящему времени все пациенты завершили 6-месячное наблюдение, результаты которого представлены в таблице 3.
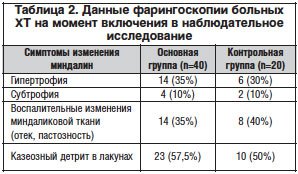
Промежуточные результаты наблюдательного исследования пациентов с ХТ за 6 мес. показали преимущество применения иммуномодулирующего препарата Галавит® в комплексном лечении ХТ и возможность сокращения частоты развития обострений в форме ангин или ухудшения состояния небных миндалин и общего состояния как в ранние сроки (на 30-й день), так и в дальнейшем. Так, для суммарной частоты исходов снижение абсолютного риска составило 25% и относительного риска – 30% в основной группе; NNT (number needed to trеat) составило 4 человека, что означает предотвращение развития 1 исхода после лечения 4 больных ХТ с применением препарата Галавит®.
Таким образом, применение иммуномодулятора Галавит® в комплексном лечении больных ХТ показало дополнительные клинические преимущества по предупреждению развития обострений и ухудшения течения патологического процесса. Дальнейшее наблюдение позволит оценить вклад данного препарата в обеспечение ремиссии и более благоприятное течение заболевания.
Читайте также:

