Гамма глобулин от коклюша у
Обновлено: 24.04.2024
Коклюш (wooping-cough - англ.; Keuchhusten - нем; Coqueluche - франц.) и паракоклюш - острые инфекционные болезни, клинически неотличимые друг от друга. Характеризуется острым катаром дыхательных путей и приступами спазматического кашля.
Этиология.
Возбудитель коклюша (Bordetella pertussis) представляет собой короткую палочку с закругленными концами (0,2-1,2 мкм), грамотрицательную, неподвижную, хорошо окрашивающуюся анилиновыми красками. В антигенном отношении неоднородна. Антиген, который обусловливает образование агглютининов (агглютиноген), состоит из нескольких компонентов. Они названы факторами и обозначаются цифрами от 1 до 14. Фактор 7 является родовым, фактор 1 содержит В. pertussis, 14 - 5. parapertussis, остальные встречаются в разных комбинациях; для возбудителя коклюша это факторы 2, 3, 4, 5, 6, для паракоклюша - 8, 9, 10. Реакция агглютинации с адсорбированными факторными сыворотками позволяет дифференцировать виды бордетелл и определять их антигенные варианты. Возбудители коклюша и паракоклюша очень неустойчивы во внешней среде, поэтому посев нужно делать сразу же после взятия материала. Бактерии быстро погибают при высушивании, ультрафиолетовом облучении, под влиянием дезинфицирующих средств. Чувствительны к эритромицину, левомицетину, антибиотикам тетрациклиновой группы, стрептомицину.
Эпидемиология.
Патогенез.
Воротами инфекции является слизистая оболочка респираторного тракта. Коклюшные микробы прикрепляются к клеткам мерцательного эпителия, где они размножаются на поверхности слизистой оболочки, не проникая в кровоток. На месте внедрения возбудителя развивается воспалительный процесс, угнетается деятельность ресничного аппарата клеток эпителия и увеличивается секреция слизи. В дальнейшем происходит изъязвление эпителия дыхательных путей и очаговый некроз. Патологический процесс наиболее выражен в бронхах и бронхиолах, менее выраженные изменения развиваются в трахее, гортани и носоглотке. Слизисто-гнойные пробочки закупоривают просвет мелких бронхов, развивается очаговый ателектаз, эмфизема. Наблюдается перибронхиальная инфильтрация. В генезе судорожных приступов имеет значение сенсибилизация организма к токсинам коклюшной палочки. Постоянное раздражение рецепторов дыхательных путей обусловливает кашель и приводит к формированию в дыхательном центре очага возбуждения типа доминанты. Вследствие этого типичные приступы спазматического кашля могут быть вызваны и неспецифическими раздражителями. Из доминантного очага возбуждение может иррадиировать и на другие отделы нервной системы, например на сосудодвигательный (повышение АД, спазм сосудов). Иррадиацией возбуждения объясняется также появление судорожных сокращений мышц лица и туловища, рвоты и других симптомов коклюша. Перенесенный коклюш (как и противококлюшные прививки) не обеспечивает напряженного пожизненного иммунитета, поэтому возможны повторные заболевания коклюшем (около 5% случаев коклюша приходится на взрослых людей).
Симптомы и течение.
Инкубационный период продолжается от 2 до 14 дней (чаще 5-7 дней). Катаральный период характеризуется общим недомоганием, небольшим кашлем, насморком, субфебрильной температурой. Постепенно кашель усиливается, дети становятся раздражительными, капризными. В конце 2-й недели болезни начинается период спазматического кашля. Приступы судорожного кашля проявляются серией кашлевых толчков, затем следует глубокий свистящий вдох (реприз), сменяющийся рядом коротких судорожных толчков. Число таких циклов во время приступа колеблется от 2 до 15. Приступ заканчивается выделением вязкой стекловидной мокроты, иногда в конце приступа отмечается рвота. Во время приступа ребенок возбужден, лицо цианотично, вены шеи расширены, язык высовывается изо рта, уздечка языка часто травмируется, может наступить остановка дыхания с последующей асфиксией. У детей раннего возраста репризы не выражены. В зависимости от тяжести заболевания число приступов может варьировать от 5 до 50 в сутки. Период судорожного кашля длится 3-4 нед, затем приступы становятся реже и наконец исчезают, хотя "обычный" кашель продолжается еще в течение 2-3 нед (период разрешения). У взрослых заболевание протекает без приступов судорожного кашля, проявляется длительным бронхитом с упорным кашлем. Температура тела остается нормальной. Общее самочувствие удовлетворительное. Стертые формы коклюша могут наблюдаться у детей, которым проведены прививки.
Осложнения.
Наиболее частым осложнением является пневмония, обусловленная коклюшной палочкой или вторичной бактериальной инфекцией. У детей до 3 лет около 90% летальных исходов обусловлено пневмонией. Может наступить обострение туберкулеза. Из других осложнений наблюдается острый ларингит со стенозом гортани (ложный круп), бронхиолиты, ателектазы, энцефалопатия, остановка дыхания, пупочная, паховая грыжа, разрыв диафрагмы, выпадение прямой кишки. У взрослых осложнения бывают редко.
Диагноз и дифференциальный диагноз.
Достоверный диагноз в катаральном периоде может быть поставлен после получения результатов бактериологических исследований. Основанием для исследования в этих случаях обычно служат эпидемиологические данные (контакт с больными коклюшем, отсутствие данных о прививках и др.). В периоде спазматического кашля диагноз коклюша поставить значительно легче, так как появляются типичные приступы. Однако нужно учитывать, что иногда приступы кашля, сходные с коклюшными, могут быть обусловлены другими причинами (аденовирусная инфекция, вирусные пневмонии, сдавление дыхательных путей при злокачественных новообразованиях, инфекционном мононуклеозе и др.), с другой стороны, коклюш может протекать атипично без характерных приступов (у привитых детей, у взрослых). Основным методом лабораторного подтверждения диагноза является выделение возбудителя коклюша. Частота выделения зависит от сроков взятия материала; на 1-й неделе заболевания положительные результаты удается получить у 95% больных, на 4-й - лишь у 50%, а начиная с 5-й недели, микроб выделить уже не удается. Материал из носоглотки берут сухим тампоном с немедленным посевом на чашки с селективной питательной средой. Используют также метод "кашлевых пластинок", при котором чашка Петри с питательной средой устанавливается перед ртом кашляющего ребенка (на расстоянии около 10 см), удерживается в таком положении несколько секунд, чтобы уловить 5-6 кашлевых толчков. Чашку с посевом быстро закрывают крышкой и помещают в термостат. При транспортировке оберегают от охлаждения (заворачивают в бумагу, вату, в контейнер помещают грелку, заполненную горячей водой). Однако по частоте выделения возбудителей коклюша метод "кашлевых пластинок" значительно уступает взятию материала тампоном. Серологические методы можно использовать для ретроспективной диагностики, а также у больных с отрицательными результатами бактериологических исследований. Из старых методов можно использовать РСК, РПГА, реакцию агглютинации. Диагностическим считается нарастание титров антител в 4 раза и более, а также высокие титры антител (1:80 и выше).
В последнее время успешно используют иммуноферментный метод для обнаружения антител в сыворотке (иммуноглобулины класса М) и в носоглоточной слизи (иммуноглобулины класса А). Эти антитела появляются со 2-3-й недели болезни и сохраняются в течение 3 мес. Дифференцируют в катаральном периоде болезни от ОРЗ, в период спазматического кашля от других заболеваний, сопровождающихся упорным кашлем при нормальной температуре тела и отсутствии признаков обшей интоксикации.
Лечение.
Больных в возрасте до 1 года, а также больных с осложнениями, тяжелыми формами коклюша госпитализируют. Остальные больные могут лечиться дома. Антибиотики могут быть эффективными в катаральном периоде. Они могут подавить возбудителя и купировать дальнейшее развитие болезни. Назначение антибиотиков в период спазматического кашля не влияет на клиническую симптоматику. При легких и стертых формах антибиотики не назначают. Их назначают при тяжелых и осложненных формах коклюша, когда отмечается наслоение вторичной инфекции. Возбудитель коклюша чувствителен ко многим антибиотикам, однако предпочтительнее назначать эритромицин или азитромицин. Эффективны также левомицетин и тетрациклин, однако левомицетин более токсичен, а тетрациклин противопоказан детям до 8 лет. При наслоении вторичной инфекции можно назначать пенициллин и стрептомицин. Специфические противококлюшные иммуноглобулины не оказывали влияния ни на длительность бактериовыделения, ни на длительность и выраженность клинической симптоматики и в настоящее время не рекомендуются. Для лечения больных коклюшем важен общий режим, чистый воздух, спокойная обстановка, устранение всех факторов, способствующих возникновению приступов, назначение витаминов, оксигенотерапия. Периодически рекомендуется отсасывание слизи из дыхательных путей, особенно важно это во время апноэ, при необходимости проводят искусственную вентиляцию легких. Рекомендуют препараты антигистаминного действия (димедрол, пипольфен), ингаляции аэрозолей с протеолитическими ферментами (химопсин, химотрипсин), которые облегчают отхождение вязкой мокроты. При тяжелых формах коклюша некоторые авторы отмечали эффективность кортикостероидных препаратов.
Профилактика и мероприятия в очаге.
Специфическая профилактика проводится всем детям от 3 мес до 3 лет, не болевшим коклюшем. Курс вакцинаций состоит из 3 внутримышечных инъекций 0,5 мл вакцины (АКДС) с интервалом 1,5 мес. Ревакцинацию делают через 1,5-2 года после законченной 3-кратной вакцинации. Детей старше 3 лет вакцинируют только против дифтерии и столбняка. Вакцинация или полностью предупреждает возникновение заболевания (у 70-80%) или же заболевание протекает в легкой форме. При вакцинации (коклюш - дифтерия - столбняк) отмечались различные побочные реакции, связанные преимущественно с коклюшным компонентом, в частности, асептический менингит, многоформная экссудативная эритема, синдром Гийена-Барре, периферические мононевриты, тромбоцитопения, гемолитическая анемия, энцефалопатия (10 на 1 млн привитых), анафилактические реакции (2 на 100 000 привитых). Однако положительный эффект вакцинации намного превышает риск развития серьезных неврологических осложнений. Так, в США до появления вакцины от коклюша погибало столько же детей, сколько от всех других инфекционных болезней вместе взятых [R. Feigin, F. Murphy, 1989, 1993]. В настоящее время для иммунизации взрослых апробируется цельноклеточная противококлюшная вакцина, она менее реактогенна, чем бесклеточная.
Из дошкольных учреждений изолируют всех больных коклюшем и детей в возрасте до 1 года, больных паракоклюшем. Эти больные при отсутствии клинических противопоказаний допускаются в детские учреждения на 25-й день болезни. Здоровых бактерионосителей при коклюше изолируют до получения двух отрицательных результатов бактериологических исследований, но не ранее 14 дней со дня выделения возбудителя. Детей в возрасте до 7 лет, контактировавших с больным коклюшем, разобщают на 14 дней со дня изоляции больного; на такой же срок устанавливают карантин для детей в дошкольном учреждении. Если здоровым бактерионосителям, контактировавшим с больным коклюшем, а также больным в начальный период болезни назначить эритромицин (в возрастных дозах в течение 5-7 дней), то это быстро прекращает бактериовыделение и купирует развитие болезни у контактировавших лиц.
Паракоклюш - острая инфекционная болезнь, сходная по клинической картине с коклюшем, но протекающая более легко. Возбудитель паракоклюша по биохимическим, антигенным и культуральным свойствам легко дифференцировать от возбудителя коклюша. На паракоклюш приходится 12-76% всех выделенных культур. После паракоклюша возможно заболевание коклюшем; паракоклюшем могут заболеть привитые против коклюша и перенесшие коклюш. Заразный период обычно не превышает 2 нед. Осложнения при паракоклюше наблюдаются редко. Случаев смерти не бывает.

Возбудитель коклюша относится к роду Bordetella, виду B.pertussis и принадлежат к группе 4 (Грамотрицательные, аэробные/микроаэрофильные палочки и кокки) по определителю Берджи.
B.pertussis - мелкие, овоидные палочки с закругленными концами, располагаются чаще поодиночно. Спор не имеют, неподвижны, могут образовывать микрокапсулы. Грамотрицательные. Строгие анаэробы. Биохимически малоактивны.
Антигенное строение возбудителя коклюша сложное: он имеет О-антиген, который может находиться в различных фазах и состоит из отдельных факторов, сочетание которых позволяет разделить вид на серовары.
Основным фактором вирулентности является продукция эндо- и экзотоксинов. Экзотоксин - цитотоксин, который вызывает местные повреждения, приводящие к гибели и десквамации мерцательного эпителия верхних дыхательных путей, и обладает тропизмом к нервной и сосудистой системам. Для эндотоксина характерно сенсибилизирующее и общетоксическое действие. Кроме токсинов, возбудитель коклюша продуцирует ферменты агрессии, которые повышают проницаемость сосудистой стенки, обладают сенсибилизирующим действием и вызывают гибель эпителиальных клеток.
Коклюш - антропонозная инфекция. Возбудитель передается воздушно-капельным путем. Для клиники коклюша характерны приступы спазматического кашля, обусловленные действием токсина на блуждающий нерв, заканчивающиеся выделением мокроты. Помимо поражения дыхательных путей (гортани, трахеи, бронхов), нарушается функция нервной и сосудистой систем. Болеют в основном дети.
После перенесенного заболевания формируется стойкий иммунитет.
Основным методом микробиологической диагностики коклюша является бактериологическое исследование, материалом для которого служит отделяемое верхних дыхательных путей. Возможно использование серодиагностики (РПГА).
В тяжелых случаях заболевания проводится этиотропная терапия антибиотиками. Для специфической профилактики коклюша применяется вакцина АКДС, в которой коклюшный компонент представлен убитой вакциной.
Возбудитель паракоклюша - Bordetella parapertussis - вызывает сходное с коклюшем, но легче протекающее заболевание. B. parapertussis отличается от B. pertussis культуральными (менее требователен к питательным средам), биохимическими (более активен) и антигенными свойствами.
Коклюшная вакцина
Препарат изготавливается из штаммов, обладающих всеми признаками микроорганизма, находящегося в первой фазе. Это относится к морфологическим, культуральным и серологическим свойствам. Производственные штаммы должны характеризоваться определенной токсичностью, вирулентностью и иммуногенностью. Данная вакцина используется для приготовления АКДС и АКДС с паракоклюшным компонентом (см. Препараты, применяемые против
дифтерии).
Коклюшный гамма-глобулин (донорский)
Пассивный иммунитет против коклюша создается с помощью гамма-глобулина, полученного из человеческой сыворотки. Для повышения эффективности препарата можно готовить его из сывороток, в которых путем предварительной титрации установлен высокий титр антител против возбудителя коклюша.
Препарат применяется для предупреждения развития заболевания у детей, бывших в контакте с больными коклюшем, а также как одно из средств раннего лечения коклюша у детей, начавших кашлять после контакта с больным.
Противококлюшный лактоглобулин (сухой)
Препарат представляет собой глобулиновую фракцию, выделенную спиртоводным осаждением из молочной сыворотки коров, иммунизированных живой коклюшной культурой. Для иммунизации применяются штаммы возбудителя коклюша в первой фазе, типичные по всем признакам.
Готовый препарат должен быть стерильным, безвредным. Специфическая активность лактоглобулина проверяется в реакции агглютинации с коклюшным антигеном, он выпускается с титром 1:51200.
Лактоглобулин закапывают по 2 капли в каждый носовой ход, с лечебной целью 4 раза в день в течение десяти дней, с профилактической - 2 раза в день в течение пяти дней.
Препарат годен в течение 1 года.
Коклюшный диагностикум для реакции агглютинации
Препарат применяется для серодиагностики коклюша и для оценки иммунологических сдвигов в инфицированном или вакцинированном организме. Он представляет собой 20 млрд. взвесь убитых мертиолятом коклюшных палочек в физиологическом растворе NaCl.
Для приготовления диагностикума применяются штаммы в первой фазе, типичные по всем признакам. По вирулентности штаммы считаются годными для производства, если LD50 их при интрацеребральном введении не выше 10 млн., а при интраназальном - не выше 100 млн. При внутрикожном введении кролику 1 млрд. культуры в объеме 0,2 мл должен развиваться некроз кожи.
По иммуногенности штаммы признаются годными, если в результате внутрибрюшинного введения мышам дозы в 1,5 млрд. развивается достаточный иммунитет, обеспечивающий выживаемость более половины мышей, которым через 20 дней после иммунизации введено в мозг 50-100 LD50 живой культуры коклюшных бактерий. Агглютинабельность производственных штаммов проверяется в реакции агглютинации со специфической агглютинирующей сывороткой. Результат учитывается с помощью лупы или агглютиноскопа.
Срок годности диагностикума - 1 год.
Коклюш – острое инфекционное заболевание бактериальной природы, проявляющееся в виде приступов спазматического кашля, сопровождающих катаральную симптоматику. Заражение коклюшем происходит аэрозольным путем при тесном контакте с больным человеком. Инкубационный период составляет 3-14 дней. Катаральный период коклюша напоминает симптомы острого фарингита, затем развиваются характерные приступы спазматического кашля. У привитых чаще наблюдается стертая клиническая картина коклюша. Диагностика основывается на выявлении коклюшевой палочки в мазках из зева и в мокроте. В отношении коклюша эффективна антибактериальная терапия (аминогликозиды, макролиды), антигистаминные средства с седативным эффектом, ингаляции.
МКБ-10
Общие сведения
Коклюш – острое инфекционное заболевание бактериальной природы, проявляющееся в виде приступов спазматического кашля, сопровождающих катаральную симптоматику.
Характеристика возбудителя
Резервуаром и источником коклюшной инфекции является больной человек. Контагиозный период включает последние дни инкубации и 5-6 дней после начала заболевания. Пик заразности приходится на момент максимально выраженной клиники. Эпидемиологическую опасность представляют лица, страдающие стертыми, клинически маловыраженными формами инфекции. Носительство коклюша не бывает длительным и эпидемиологически не значимо.
Коклюш передается с помощью аэрозольного механизма преимущественно воздушно-капельным путем. Обильное выделение возбудителя происходит при кашле и чихании. Ввиду своей специфики, аэрозоль с возбудителем распространяется на незначительное расстояние (не более 2 метров), поэтому заражение возможно только в случае тесного контактирования с больным. Поскольку во внешней среде возбудитель не сохраняется длительно, контактный путь передачи не реализуется.
Люди обладают высокой восприимчивостью к коклюшу. Чаще всего заболевают дети (коклюш отнесен к детским инфекциям). После перенесения инфекции формируется стойкий пожизненный иммунитет, однако полученные ребенком от матери трансплацентарно антитела не обеспечивают достаточной иммунной защиты. В пожилом возрасте иногда отмечаются случаи повторного заболевания коклюшем.
Патогенез коклюша
Коклюшная палочка попадает на слизистую оболочку верхних дыхательных путей и заселяет реснитчатый эпителий, покрывающий гортань и бронхи. В глубокие ткани бактерии не проникают и по организму не распространяются. Бактериальные токсины провоцируют местную воспалительную реакцию.
После гибели бактерий высвобождается эндотоксин, который и вызывает характерный для коклюша спазматический кашель. С прогрессированием кашель приобретает центральный генез – формируется очаг возбуждения в дыхательном центре продолговатого мозга. Кашель рефлекторно возникает в ответ на различные раздражители (прикосновение, боль, смех, разговор и др.). Возбуждение нервного центра может способствовать инициации аналогичных процессов в соседних областях продолговатого мозга, вызывая рефлекторную рвоту, сосудистую дистонию (повышение АД, сосудистый спазм) после кашлевого приступа. У детей могут отмечаться судороги (тонические или клонические).
Эндотоксин коклюша вместе с продуцируемым бактериями ферментом – аденилатциклазой способствует снижению защитных свойств организма, что повышает вероятность развития вторичной инфекции, а также - распространения возбудителя, и в некоторых случаях - длительного носительства.
Симптомы коклюша
Инкубационный период коклюша может длиться от 3 дней до двух недель. Заболевание протекает с последовательной сменой следующих периодов: катарального, спазматического кашля и разрешения. Катаральный период начинается постепенно, появляются умеренный сухой кашель и насморк (у детей ринорея может быть довольно выражена). Ринит сопровождается вязким отделяемым слизистого характера. Интоксикация и лихорадка обычно отсутствуют, температура тела может подниматься до субфебрильных значений, общее состояние больные признают удовлетворительным. Со временем кашель становится частым, упорным, могут отмечаться его приступы (в особенности по ночам). Этот период может продолжиться от нескольких дней и до двух недель. У детей обычно кратковременный.
Постепенно катаральный период переходит в период спазматического кашля (иначе – судорожный). Приступы кашля учащаются, становятся интенсивнее, кашель приобретает судорожный спастический характер. Больные могут отмечать предвестники приступа – першение в горле, дискомфорт в груди, беспокойство. Из-за спастического сужения голосовой щели перед вдохом отмечается свистящий звук (реприз). Приступ кашля представляет собой чередование таких свистящих вдохов и, собственно, кашлевых толчков. Тяжесть течения коклюша определяется частотой и продолжительностью приступов кашля.
Приступы учащаются в ночное время и утренние часы. Частое напряжение способствует тому, что лицо больного становится гиперемированным, отечным, могут отмечаться небольшие кровоизлияния на коже лица и слизистой ротоглотки, конъюнктиве. Температура тела сохраняется в нормальных пределах. Лихорадка при коклюше является признаком присоединения вторичной инфекции.
Период спазматического кашля длится от трех недель до месяца, после чего заболевание вступает в фазу выздоровления (разрешения): при кашле начинает отхаркиваться слизистая мокрота, приступы становятся реже, теряют спазматический характер и постепенно прекращаются. Продолжительность периода разрешения может занимать от нескольких дней до нескольких месяцев (несмотря на стихание основной симптоматики, нервная возбудимость, покашливание и общая астения могут отмечаться у больных длительное время).
Стертая форма коклюша иногда отмечается у привитых лиц. При этом спазматические приступы выражены слабее, но кашель может быть более продолжительным и с трудом поддаваться терапии. Репризы, рвота, сосудистые спазмы отсутствуют. Субклиническая форма обнаруживается иногда в очаге коклюшевой инфекции при обследовании контактных лиц. Субъективно больные не отмечают каких-либо патологических симптомов, однако нередко можно отметить периодический кашель. Абортивная форма характеризуется прекращением заболевания на стадии катаральных признаков или в первые дни судорожного периода и быстрым регрессом клиники.
Диагностика коклюша
Специфическая диагностика коклюша производятся бактериологическими методами: выделение возбудителя из мокроты и мазков слизистой верхних дыхательных путей (бакпосев на питательную среду). Коклюшевую палочку высеивают на среду Борде-Жангу. Серологическая диагностика с помощью РА, РСК, РНГА производится для подтверждения клинического диагноза, поскольку реакции становятся положительными не ранее второй недели судорожного периода заболевания (а в некоторых случаях могут давать отрицательный результат и в более поздние сроки).
Неспецифические диагностические методики отмечают признаки инфекции (лимфоцитарный лейкоцитоз в крови), характерно незначительное повышение СОЭ. При развитии осложнений со стороны органов дыхания пациентам с коклюшем рекомендована консультация пульмонолога и проведение рентгенографии легких.
Осложнения коклюша
Коклюш чаще всего вызывает осложнения, связанные с присоединением вторичной инфекции, особенно часты заболевания дыхательной системы: бронхит, пневмония, плеврит. В результате деструктивной деятельности коклюшевых бактерий возможно развитие эмфиземы. Тяжелое течение в редких случаях приводит к ателектазу легких, пневмотораксу. Кроме того, коклюш может способствовать возникновению гнойного отита. Имеется вероятность (при частых интенсивных приступах) инсульта, разрыва мышц брюшной стенки, барабанных перепонок, выпадение прямой кишки, геморрой. У детей раннего возраста коклюш может способствовать развитию бронхоэктатической болезни.
Лечение коклюша
Коклюш лечат амбулаторно, больным желательно дышать увлажненным воздухом, богатым кислородом, комнатной температуры. Питание рекомендовано полноценное, дробное (часто небольшими порциями). Рекомендовано ограничить воздействие не нервную систему (интенсивные зрительные, слуховые впечатления). В случае сохранения температуры в пределах нормы желательно больше гулять на свежем воздухе (однако при температуре воздуха не менее -10 °С).
В катаральном периоде эффективно назначение антибиотиков (макролидов, аминогликозидов, ампициллина или левомицетина) в среднетерапевтических дозировках курсам на 6-7 дней. В комплексе с антибиотиками в первые дни нередко назначают введение специфического противококлюшного гаммаглобулина. В качестве патогенетического средства больным назначают антигистаминные препараты с седативным действием ( прометазин, мебгидролин). В судорожный период для облегчения приступов можно назначать спазмолитики, в тяжелых случаях – нейролептики.
Противокашлевые, отхаркивающие средства и муколитики при коклюше малоэффективны, противокашлевые средства с центральным механизмом действия противопоказаны. Больным рекомендована оксигенотерапия, хороший эффект отмечается при оксигенобаротерапии. Успешно применяются физиотерапевтические методики, ингаляции протеолитических ферментов.
Прогноз благоприятный. Заканчивается летально в исключительных случаях у лиц старческого возраста. При развитии осложнений возможно сохранение длительных последствий, хронических заболеваний легких.
Профилактика
Специфическая профилактика
Вакцинация против коклюша при отсутствии медицинских противопоказаний проводится детям в возрасте 3-х месяцев; второй раз – в 4,5 месяцев; третий – в 6 месяцев. Первая ревакцинация осуществляется в 1,5 года; вторая и третья – в 6-7 и 14 лет; далее каждые 10 лет.
Разрешены вакцины АКДС, АДС, АДС-М (Россия), Пентаксим (Франция), Инфанрикс и Инфанрикс Гекса (Бельгия), Тетраксим (Франция). Для ревакцинации детей старшего возраста, взрослых, беременных женщин в 3 триместре беременности может применяться вакцина Адасель (Канада). Членам семьи беременной также следует привиться перед рождением ребенка.
Неспецифическая профилактика
Общие профилактические мероприятия включают раннее выявление больных и контроль над состоянием здоровья контактных лиц, профилактическое обследование детей в организованных детских коллективах, а также взрослых, работающих в лечебно-профилактических и в детских дошкольных учреждениях и в школах, при обнаружении продолжительного кашля (более 5-7 дней).
Дети (и взрослые из вышеуказанных групп), больные коклюшем, изолируются на 25 дней с начала заболевания, контактные лица отстраняются от работы и посещения детского коллектива на 14 дней с момента контакта, проходя двукратную бактериологическою пробу. В очаге инфекции производятся тщательная дезинфекция, проводятся соответствующие карантинные меры. Экстренная профилактика производится с помощью введения иммуноглобулина. Его получают дети первого года жизни, а также непривитые лица, имевшие контакт с больным коклюшем. Иммуноглобулин (3 мл) вводят однократно вне зависимости от срока, прошедшего с момента контакта.
Что является критерием эффективности иммуномодуляторов? Каковы показания к применению ИГВВ? Стремительное развитие фундаментальной и прикладной иммунологии сопровождается интенсивным внедрением в практику здравоохранения методов иммунокоррекции. В нас
Что является критерием эффективности иммуномодуляторов?
Каковы показания к применению ИГВВ?
Стремительное развитие фундаментальной и прикладной иммунологии сопровождается интенсивным внедрением в практику здравоохранения методов иммунокоррекции. В настоящее время врачи достаточно широко используют иммуномодуляторы различных фармакологических групп и механизмов действия.
Иммуномодуляция в широком понимании этого термина подразумевает воздействие на различные звенья иммунной системы, приводящее к увеличению или уменьшению параметров иммунного ответа в целях поддержания или восстановления иммунного гомеостаза. В настоящее время установлено, что иммунокорригирующим действием обладают сотни лекарственных препаратов различных классов. Причем препаратами, воздействующими на те или иные звенья иммунной системы, являются не только специальные вещества, но и лекарства, давно и широко используемые в практической медицине, такие, как витамины, аминокислоты, ферменты, адаптогены, эндокринные средства, некоторые сердечно-сосудистые и ноотропные препараты и др.
Несмотря на длительный опыт использования иммуномодуляторов, оценка их эффективности — один из наиболее сложных вопросов современной медицины. И прежде всего потому, что изменения иммунного статуса чрезвычайно лабильны во времени и индивидуальны, а многие из выявленных отклонений не столько отражают нарушение функционирования иммунной системы, сколько свидетельствуют об адаптационном ответе организма на патологическое воздействие. Кроме того, нельзя забывать, что мы еще реально не можем идентифицировать весь спектр имеющихся поломок иммунного ответа организма. Вот почему на сегодняшний день критериями эффективности действия иммуномодуляторов являются медико-статистические показатели, такие, как уровни заболеваемости и смертности, частота возникновения осложнений и перехода в хроническую патологию, сроки выздоровления и т. д.
Среди многочисленных видов иммуномодулирующей терапии следует отметить иммунозаместительную, которая включает в себя использование препаратов иммуноглобулинов, свежезамороженной плазмы, лейкоконцентрата, препаратов рекомбинантных колониестимулирующих факторов (КСФ), интерлейкинов, интерферонов, тимических факторов и т. д.
Из этих препаратов иммуноглобулины для внутривенного введения (ИГВВ) занимают заметное место, особенно в лечении детей, хотя многие вопросы, связанные с их применением, остаются еще нерешенными. Необходимо подчеркнуть: весьма распространенное среди врачей мнение, что основная сфера применения ИГВВ — это тяжелая инфекция, совершенно не соответствует терапевтическим возможностям этих средств.
Как известно, иммуноглобулины для внутривенного введения пришли на смену иммуноглобулинам для внутримышечного введения, при использовании которых доза вводимого препарата значительно варьировала в зависимости от соотношения скорости всасывания и инактивации его в месте введения. В настоящее время иммуноглобулины для внутримышечного введения практически утратили свое значение.
ИГВВ первоначально были предложены для лечения первичных иммунодефицитов, при которых их эффективность доказана. Такие заболевания, как Х-связанная агамма- и гипогаммаглобулинемия, общая вариабельная гипогаммаглобулинемия, иммунодефицит с гипергаммаглобулинемией M, синдромы Вискотта-Олдридча, Луи-Бара, Х-связанный лимфопролиферативный синдром, тяжелые комбинированные иммунодефициты всех типов, являются прямым показанием к терапии внутривенными иммуноглобулинами. Наряду с этим доказана эффективность ИГВВ при транзиторной гипогаммаглобулинемии у детей, при болезни Кавасаки, а также для профилактики цитомегаловирусной инфекции при пересадке костного мозга [2].
Со времени появления в начале 80-х годов прошлого столетия сандоглобулина, содержащего интактную молекулу с активной Fc-функцией и обладающего иммуномоделирующим эффектом, сфера применения ИГВВ значительно расширилась [2]. В настоящее время доказан терапевтический эффект ИГВВ при острой и хронической иммунной тромбоцитопении и иммунной нейтропении, а также при хронической демиелинизирующей воспалительной полинейропатии. Стоит отметить, что при иммунной патологии используются высокие дозы препаратов.
Большое число исследований свидетельствует о высокой эффективности ИГВВ в лечении тяжелых бактериальных инфекций, в том числе у детей раннего возраста и при сепсисе новорожденных [4]. Предлагается также использовать иммуноглобулины у новорожденных высокого риска для профилактики развития инфекции [4], однако убедительных данных о профилактической эффективности этого метода терапии получить пока не удается.
Использование ИГВВ в терапии тяжелой бактериальной и вирусно-бактериальной инфекции у детей имеет убедительное патогенетическое обоснование. Известно, что при тяжелой, особенно генерализованной, инфекции в организме больного образуется избыток продуктов нормального или нарушенного обмена веществ, продуктов клеточного реагирования. Эти вещества, накапливаясь, становятся для организма эндогенными токсическими субстанциями, вызывающими интоксикацию. Наличие одновременно бактериальной антигенемии и токсемии у больного усугубляет интоксикацию и приводит к нарушению нормальных межклеточных взаимодействий в иммунном ответе. Эта ситуация усиливается при развитии полиорганной недостаточности, сопровождающей тяжелую инфекцию и сепсис. А у новорожденных и детей первого полугодия жизни, кроме того, имеет место физиологическая гипогаммаглобулинемия, которая также способствует усилению этого механизма.
Межклеточные взаимодействия, реализуемые в процессе иммунного ответа, играют ключевую роль в его адекватности, а следовательно, и в возможности выздоровления. Интенсивная интоксикация при инфекционном заболевании сопровождается снижением содержания антигенсвязывающих лимфоцитов. Снижается также аффинность их рецепторов в связи с их блокировкой и угнетением экспрессии медиаторами воспаления, то есть, по сути, наблюдается депрессия клеточного звена иммунитета.
Кроме того, инфекционный токсикоз в той или иной степени сопровождается повышением уровня R-белка в плазме, продукта катаболизма клеточных рецепторов, обладающего лигандсвязывающими и иммунорегуляторными свойствами. Повышение концентрации R-белков также способствует иммуносупрессии. Причем отмечено, что их уровень коррелирует с тяжестью заболевания и степенью выраженности метаболических сдвигов в организме.
Медикаментозная терапия, в том числе и антибактериальная, при выраженных метаболических нарушениях может дать только минимальный эффект, так как эффективность лечения больного в конечном счете даже при абсолютно правильном подборе препаратов зависит от способности клеток организма реагировать на проводимую терапию. ИГВВ, связывая и элиминируя многие компоненты, вызывающие интоксикацию, способствуют деблокировке рецепторов, нормализации экспрессии антигенов. Эти препараты также способствуют восстановлению способности фагоцитов и эффекторов естественной цитотоксичности (натуральные киллеры, Т-лимфоциты и др.) осуществлять противоинфекционную защиту, увеличивают количество соответствующих рецепторов различных клеточных популяций, способных отвечать адекватной реакцией на влияние бактериальных индукторов, гормонов, интерферонов и других биологически активных веществ. Другими словами, ИГВВ способствуют повышению чувствительности иммунокомпетентных клеток макроорганизма к лекарственной терапии и повышают противоинфекционную защиту.
Таким образом, для достижения максимальной эффективности противоинфекционной терапии при тяжелой инфекции и сепсисе наиболее целесообразно сочетать антибактериальную терапию с внутривенным введением иммуноглобулина [5, 9]. Причем, если речь идет о детях, то, учитывая наличие у новорожденных, а особенно у недоношенных новорожденных, и детей раннего возраста тенденции к гипогаммаглобулинемии, целесообразно введение ИГВВ до достижения уровня Ig G в крови не менее 800 мг%. Рекомендуемая суточная доза при этом составляет от 500 до 800 мг/кг массы, а длительность курса введения — от 3 до 6 суток.
Введение иммуноглобулина должно проводиться в максимально ранние сроки после постановки диагноза инфекционного заболевания и в достаточном объеме. Исследования, проведенные на нашей кафедре [1], показали, что введение стандартных иммуноглобулинов (т. е. иммуноглобулинов с преимущественным содержанием Ig G, таких, как интраглобин F и др.) новорожденным детям в первую неделю тяжелого инфекционного заболевания (менингит, сепсис) сопровождалось улучшением в 57% случаев. Причем при суммарной дозе ИГВВ в пределах 5-6 мл/кг массы эффект отмечался лишь в 33-40% наблюдений. Если суммарная доза препарата достигала 9-10 мл/кг массы, положительный эффект регистрировался в 70% случаев. При этом последующее увеличение суммарной дозы до 15-18 мг/кг массы тела не сопровождалось достоверным повышением эффективности. Назначение ИГВВ в более поздние сроки — на 3-5-й неделе болезни — также было малоэффективным (34-32%). Возможно, это связано с тем, что повышенные дозы внутривенно вводимых препаратов человеческого Ig G обладают способностью угнетать продукцию интерлейкинов и снижать уровень экспрессии рецепторов к ИЛ-2 из-за наличия в препаратах антител против соответствующих интерлейкинов и блокады Fc-рецепторов [6]. Кроме того, ИГВВ содержат ряд биологически активных протеинов, например растворимые молекулы HLA I и II класса, что также небезразлично для реализации иммунного ответа.
Как уже отмечалось выше, иммуномодулирующий эффект ИГВВ тесно связан с наличием Fc-функции молекулы иммуноглобулина, а также с содержанием субпопуляций Ig G (в первую очередь субпопуляции Ig G2, синтез которой у детей первого года жизни снижен) и Ig M. Сохранность Fс-функции, в свою очередь, в значительной мере зависит от используемых методов инактивации вирусов в препарате и может существенно различаться в разных препаратах иммуноглобулинов.
Первые стандартные ИГВВ, или стандартные ИГВВ первого поколения, проходили обработку алкилированием, в связи с чем они утрачивали Fc-фрагмент и не обладали (или обладали слабым) иммуномодулирующим эффектом. Поэтому и использовались эти ИГВВ сугубо с заместительной целью при иммунодефицитах. В настоящее время они устарели и имеют скорее историческое значение.
В конце 70-х годов прошлого столетия был создан сандоглобулин, названный препаратом второго поколения. Принципиальным отличием его явилось наличие интактной молекулы иммуноглобулина с сохраненной активной Fc-функцией (70-75% от Европейского стандарта). Именно появление этого ИГВВ позволило значительно расширить показания к клиническому применению иммуноглобулинов.
Препараты третьего поколения (например, интраглобин) были разработаны в 80-х годах. Они характеризуются высокой степенью очистки (5 стадий очистки), высокой вирусбезопасностью, почти 100-процентной активностью Fc-фрагмента. Препараты выпускаются в жидком виде и хранятся в холодильнике. Иммуноглобулины этого класса характеризуются высоким клиническим эффектом при лечении тяжелых бактериальных инфекций, особенно обусловленных грамположительной микрофлорой, а также при терапии иммунных патологий.
Иммуноглобулины, появившиеся в 90-х годах (в частности, октагам, альфаглобин), также обладают высокой степенью чистоты (4 стадии очистки), вирусбезопасностью и активностью Fc-фрагмента. Соотношение подклассов иммуноглобулинов в них характеризуется более высоким содержанием подкласса Ig G3, то есть подкласса вируснейтрализующих антител. Отсюда высокая эффективность данных ИГВВ не только при бактериальной инфекции, но и при генерализованных вирусных (например, энтеровирусных) и вирусно-бактериальных заболеваниях (например, болезни Кавасаки). В то же время использование этого ИГВВ не дает убедительной эффективности при генерализованной цитомегаловирусной инфекции [3]. К достоинствам октагама можно отнести то, что хранение этого иммуноглобулина возможно при комнатной температуре, поэтому препарат можно использовать сразу, как только возникнет необходимость.
Стандартные иммуноглобулины различаются также по уровню осмолярности и величине pH. Эти параметры в какой-то мере определяют возможность возникновения побочных проявлений и должны учитываться при введении больших доз препарата у детей с полиорганной недостаточностью и нарушениями гомеостаза. Так, гиперосмолярные по отношению к плазме крови препараты с большей вероятностью могут вызывать нарушения функции почек, что следует учитывать при их назначении. Препараты с низким pH влияют на кислотно-основный баланс организма. Среди широко используемых ИГВВ наиболее высокой осмолярностью обладает сандоглобулин, а наиболее низким pH (5,4-6,0) — альфаглобин и октагам.
Наличие в препарате иммуноглобулина класса М, который первым образуется в ответ на антигенное раздражение и несет антитела к эндотоксину и капсулярным антигенам грамотрицательных бактерий, сделало пентаглобин чрезвычайно эффективным в лечении тяжелых инфекционных заболеваний. Кроме того, Ig M-антитела лучше, чем другие классы Ig, фиксируют комплемент и соответственно улучшают опсонизацию, то есть подготовку бактерий к фагоцитозу. Особо следует подчеркнуть, что пентаглобин значительно повышает опсонизацию E. coli, K. pneumoniae, Ps. aeruginosa, S. pneumoniae, H. influenzae. Отмечено, что увеличение уровня Ig M в организме способствует ограничению продукции, повышению ингибирования провоспалительных цитокинов и соответственно ограничению общей воспалительной реакции организма, лежащей в основе развития полиорганной недостаточности при инфекционно-токсическом шоке и сепсисе.
Внутривенное введение пентаглобина сопровождалось достоверно значимым повышением уровня Ig M на 3-5-й день после введения [5, 9]. Метаанализ 20 клинических исследований применения пентаглобина в лечении сепсиса новорожденных показал, что использование препарата достоверно (более чем в 2 раза) снижает летальность от этого заболевания, в то время как введение стандартных иммуноглобулинов приводит к снижению смертности лишь в 1,37 раза [11].
Наконец, особую группу составляют иммуноглобулины, обогащенные специфическими антителами. Примерами таких препаратов служат цитотект, особенностью которого является повышенный титр антицитомегаловирусных антител, и гепатект, содержащий антитела к вирусу гепатита В.
Использование цитотекта показано при профилактике и лечении цитомегаловирусной инфекции, например при трансплантации тканей и органов, медикаментозной иммуносупрессии, вторичном иммунодефиците. При неонатальной ЦМВИ — это единственный препарат противовирусной терапии, так как применение ганцикловира возможно только в более старшем возрасте. Обычно используется доза 50 МЕ/кг массы тела в сутки. Кратность введения составляет от 3 до 6 раз в зависимости от клинической картины и состояния больного.
Гепатект — препарат ИГВВ, обогащенный вируснейтрализующими антителами к вирусу гепатита В. Препарат используется для активно-пассивной иммунизации (одновременное применение вакцины против гепатита В и иммуноглобулина у новорожденных), а также самостоятельно, когда из-за тяжести состояния невозможна вакцинация ребенка, рожденного от матери — носительницы вируса гепатита А. Активно-пассивная иммунизация с использованием гепатекта проводится только тем детям, которые родились от матерей с текущим острым гепатитом, от матерей — ранних реконвалесцентов гепатита и Hbs Ag-носительниц. Обычная доза составляет 20 МЕ/кг массы ребенка [12].
Общим основным преимуществом использования препаратов иммуноглобулинов для внутривенного введения является возможность быстро и беспрепятственно достигать высоких сывороточных концентраций иммуноглобулинов. Получены данные о высокой степени безопасности внутривенного введения обычных терапевтических доз иммуноглобулинов при инфекционных заболеваниях у новорожденных детей; так, применение ИГВВ у недоношенных детей в дозах до 1000 мг/кг в сутки не имело каких-либо побочных эффектов [7, 8]. Но расширение сферы применения ИГВВ, особенно увеличение доз, практикующееся для достижения иммуномодулирующего эффекта, позволило обнаружить ряд новых побочных проявлений и нежелательных эффектов препаратов.
Ранее основные побочные проявления ИГВВ были связаны с несоблюдением требований к скорости введения — слишком быстрое введение. Обычно это проявлялось болевым синдромом, тошнотой, рвотой, лихорадкой, ознобом и изменением АД.
С увеличением дозы ИГВВ отмечался такой побочный эффект, как обратимая острая почечная недостаточность, обусловленная создаваемой при введении препарата гиперосмолярностью плазмы. Обычно острая почечная недостаточность наблюдается при использовании иммуноглобулина в концентрации выше, чем 3%-ный и 5%-ный раствор.
Описано также возникновение асептического менингита, механизм развития которого связывают с воздействием молекул человеческого лейкоцитарного антигена и действием цитокинов. Не исключено и воздействие специфических аутоантител. Асептический менингит не имеет ничего общего с инфекционным и требует лишь чисто симптоматического лечения.
Использование сверхвысоких доз ИГВВ (при иммунной патологии) может сопровождаться гемолизом и диссеминированным внутрисосудистым свертыванием крови, описаны и случаи гемолитической анемии. Эти осложнения связывают с конфликтом по системе АВ0 (первые два) и наличием анти-D-изоагглютининов (гемолитическая анемия). Поэтому при использовании сверхвысоких доз рекомендуется проверка ИГВВ на совместимость по группам крови и наличие анти-D-агглютининов.
Необходимо отметить, что в большинстве случаев побочные проявления при терапии ИГВВ протекают в легкой форме и вполне обратимы. Однако, несмотря на это, необходим строго обоснованный подход к их назначению.
Что такое коклюш? Причины возникновения, диагностику и методы лечения разберем в статье доктора Каминской Ольги Николаевны, инфекциониста со стажем в 21 год.
Над статьей доктора Каминской Ольги Николаевны работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Коклюш (от франц. coqueluche) — острое инфекционное заболевание, вызываемое бактерией Bordetella pertussis. Клинически характеризуется респираторным синдромом (поражением верхних дыхательных путей) с приступообразным кашлем. Имеет характерное название "стодневный кашель", так как симптомы держатся длительно — 3-4 месяца [1] [2] [3] [4] [5] .

Этиология
Вид — Bordetella pertussis
Бактерия представляет собой мелкую палочку с закруглёнными концами. Она неподвижная, хорошо окрашивается анилиновыми красителями (при микроскопии данные красители окрашивают коклюшный микроб в красный цвет ) [6] [7] .
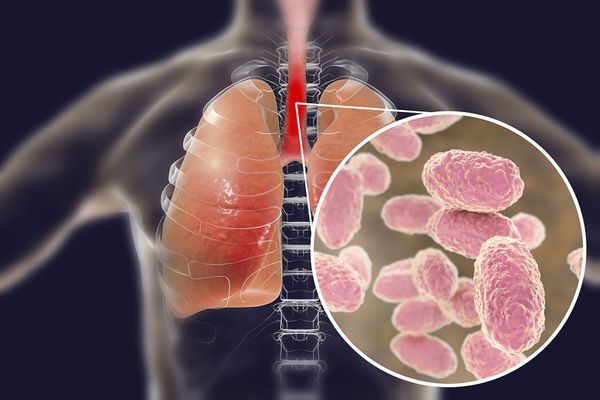
Строение Bordetella pertussis
Возбудитель коклюша (Bordetella pertussis) содержит чужеродные вещества (антигены), которые стимулируют образование в организме антител. Антигены, участвующие в реакции агглютинации (склеивания бактерий антителами) называются агглютиногенами , а антитела вызывающие этот процесс — агглютининами . А гглютиноген иначе называют фактором и обозначают цифрами от 1 до 14. Коклюшная палочка в своём строении имеет несколько таких факторов.
Именно по наличию в организме определённых факторов-агглютиногенов с помощью специальных лабораторных исследований возможно определить принадлежность микроба к данному виду. Схожее строение имеет Bordetella parapertussis, которая вызывает похожее заболевание. Отличие возможно только по лабораторным тестам.
Возбудитель неустойчив во внешней среде, поэтому посев нужно делать сразу после взятия материала. При высушивании, облучении ультрафиолетом, под действием дезинфицирующих веществ бактерия быстро погибает [4] [5] .
Эпидемиология
Заболевание коклюш является антропонозом, т. е. им болеют только люди. Источник инфекции — больные коклюшем, носители. В эпидемиологическом плане наиболее опасны бактериовыделители, которые не имеют жалоб и клинических симптомов, ведут активный образ жизни, но выделяют микроб во внешнюю среду, заражая окружающих.
Для коклюша характерен аэрозольный механизм передачи, т. е. заболевание передается воздушно-капельным путём, особенно часто заражение происходит при близком, семейном контакте. Чаще болеют дети дошкольного возраста.
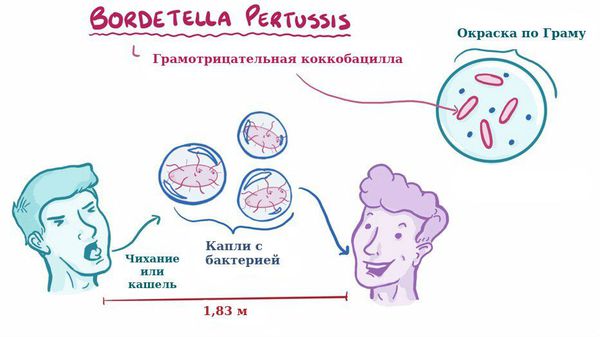
Отмечается высокая восприимчивость к инфекции, индекс контагиозности до 90 %, т. е из 100 человек, которые не болели коклюшем и не прививались, после контакта заболевает до 90 человек. В зимне-весенний период отмечается подъём заболеваемости.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы коклюша
Инкубационный период продолжается до 14 суток. В этот период пациент не предъявляет жалоб, но уже с конца данного периода становится опасен для окружающих, так как начинает выделять коклюшный микроб во внешнюю среду при кашле и чихании. Начало болезни постепенное без лихорадки с умеренно выраженной интоксикацией.
По мере развития заболевания появляются следующие синдромы:
- респираторный (кашель, скудный насморк без гнойного отделяемого);
- интоксикации — выражен умеренно, характеризуется кратковременной невысокой температурой. Высокая температура возможна при развитии осложнений (пневмонии).
Болезнь начинается с появления кашля на фоне слабой интоксикации и насморка. Интенсивность кашля постепенно нарастает, с 10-14 дня кашель становится мучительным, приступообразным с формированием характерных реприз с остановкой дыхания и затруднённым вздохом. Реприза представляет собой кашлевые толчки, сменяющиеся глубоким вдохом по типу "петушиного крика". В приступе кашля у больного синеет лицо, кончик языка при кашле направлен вверх, возможны кровоизлияния в кожу лица и склеры. В одном приступе может быть от 2 до 15 реприз. У детей приступы часто заканчиваются рвотой.
При тяжёлом течении с частотой реприз более 15 в сутки, большой частотой рвоты, связанной с кашлем, отмечается ухудшение физического состояния. Дети до года теряют в весе, начинают отставать в физическом и нервно-психическом развитии, теряют приобретённые навыки: перестают держать головку, переворачиваться, не сидят, хотя до развития заболевания данные навыки присутствовали.

При аускультации (выслушивании дыхания через фонендоскоп) выслушивается жёсткое дыхание, хрипов нет [4] [5] [6] .
Патогенез коклюша
Ворота инфекции — верхние дыхательные пути. Коклюшные палочки прикрепляются к слизистой дыхательных путей, вызывают воспаление без проникновения в кровоток. Коклюшная палочка не имеет факторов агрессии (ферментов), способных растворять клеточные мембраны, сосудистую стенку, поэтому её размножение происходит на поверхности бронха. На месте внедрения увеличивается секреция слизи, реснитчатый эпителий угнетается, формируются очаги некрозов (омертвения). Больше всего процесс затрагивает бронхи и бронхиолы.
В патогенезе судорожных приступов играет роль действие токсина коклюшной палочки. Токсин, попадая в кровоток, вызывает постоянное раздражение рецепторов бронхов, что приводит к перевозбуждению дыхательного центра. Также приступ может быть спровоцирован неинфекционными факторами, например холодным воздухом.
После перенесённого коклюша и вакцинации пожизненного иммунитета не формируется, он сохраняется до 5-6 лет, в дальнейшем возможны повторные заболевания.
Около 5 % случаев коклюша приходится на взрослых. Последние исследования показывают увеличение доли школьников среди заболевших коклюшем, что подтверждается результатами обследования длительно-кашляющих подростков на коклюш [4] [5] [6] [9] .
Классификация и стадии развития коклюша
Критерии тяжести протекания коклюша :
- лёгкая форма (до 15 реприз в сутки);
- средне-тяжёлая (15-25 реприз в сутки);
- тяжёлая (более 25 реприз в сутки) [7] .
По форме:
- Типичная форма коклюша — характерно наличие приступообразного кашля, этапность появления симптомов.
- Атипичная форма коклюша — характеризуется нетипичным покашливанием, отсутствием последовательной смены периодов болезни. Длительность кашля составляет до 50 дней, в среднем около 30 дней. Кашель носит сухой, навязчивый характер, наблюдается напряжение лица, чаще ночью с усилением на второй неделе от начала болезни. Иногда удаётся наблюдать появление единичных типичных приступов кашля при волнении ребёнка, во время еды или в связи с наслоением респираторной вирусной инфекции. Для этой формы характерно редкое повышение температуры и слабая выраженность катарального синдрома (воспаления) слизистых носа и зева [1][2][5][7] .
Клинические периоды (стадии) коклюша:
- Инкубационный период (3-14 дней) — симптомы не проявляются, пациент не предъявляет жалоб .
- Катаральный период (10-13 дней) — наблюдается клиническая картина, характерная для множества простудных заболеваний .
- Пароксизмальный, или спазматический период (1-6 недель) — проявления становятся более выраженными, пациента беспокоит мучительный приступообразный кашель.
- Период обратного развития, или реконвалесценции — приступы кашля становятся редкими , улучшается общее состояние. Этот период, в свою очередь, делят на ранний (развивается через 2-8 недель от начала клинических проявлений) и поздний (спустя 2-6 месяцев) [12] .
Осложнения коклюша
Наиболее частым осложнением является пневмония, которая может быть вызвана самой коклюшной палочкой или быть вторичной из-за активизации микрофлоры бронха.
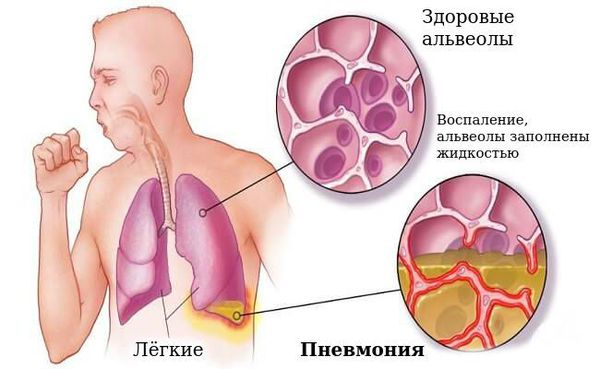
В период спазматического кашля возможны: остановка дыхания, ателектазы (спадение доли лёгкого), пупочная и паховая грыжи, энцефалопатия (нарушение поведения, расстройство внимания, у детей до года отставание в психомоторном развитии, беспокойный сон, раздражительность).
Данные осложнения чаще развиваются у грудных детей. У взрослых осложнения встречаются редко [5] [7] [9] .
Диагностика коклюша
К какому врачу обратиться при коклюше
При подозрении на коклюш следует обратиться к врачу-инфекционисту.
Лабораторная диагностика коклюша
К методам лабораторной диагностики относятся:
- Клинический анализ крови: при коклюше наблюдается лимфоцитарный лейкоцитоз, СОЭ (скорость оседания эритроцитов) повышена или в норме.
- Бактериальный посев с носоглотки (мазок) на коклюш.
- ПЦР диагностика (мазок с носоглотки).
- ИФА (иммуноферментный анализ) крови с определением маркеров проникновения инфекции — антител IgG и IgM, IgА к Bordetella pertussis. Исследование проводится двукратно с интервалом 10-14 дней, оценивается нарастание антител IgG (отвечают за устойчивый иммунитет к инфекции) в четыре раза в динамике. Наличие в крови IgM (первый ответ на инфекцию), IgА (обеспечивают местную защиту на уровне слизистых оболочек) к Bordetella pertussis является подтверждением диагноза [5][7][8][10] .
Дифференциальная диагностика
Длительный кашель может указывать не только на инфекционные заболевания, но и на патологии ЖКТ и других систем.
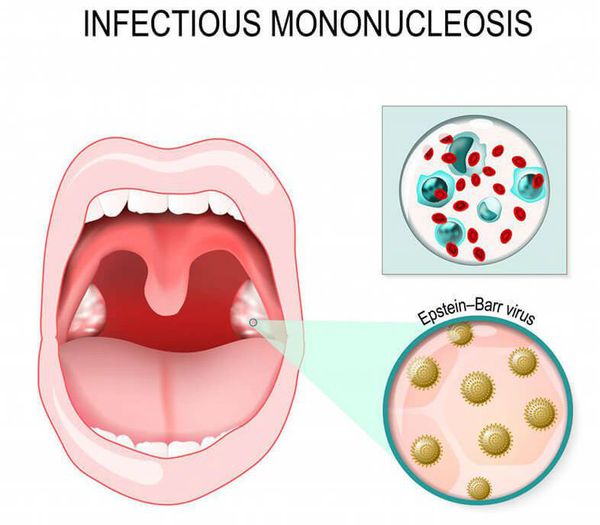
Инфекционный мононуклеоз может характеризоваться длительным кашлем из-за увеличения всех групп лимфоузлов, в том числе расположенных около бронха. Возникает синдром сдавления бронха, что вызывает длительный сухой кашель. Отличительная особенность — высокая и длительная лихорадка, кашель протекает без реприз. Диагноз подтверждается результатами обследования крови: в клиническом анализе крови на фоне повышения общего числа лейкоцитов с преобладанием лимфоцитов определяются специфичные клетки — мононуклеары, при серологическом исследовании крови определяются антитела класса IgM к вирусу Эбштейна — Барр.
Паракоклюш — заболевание, клинически не отличимое от коклюша. Вызывается схожей бактерией Bordetella parapertussis. Диагностика совпадает с таковой при коклюше. Возможно только лабораторное подтверждение: выделение Bordetella parapertussis при бактериологическом посеве со слизистой носоглотки, при ПЦР-исследовании, нарастание титров антител к Bordetella parapertussis при обследовании крови метом ИФА.
Туберкулёз — заражение туберкулёзной палочкой приводит к состоянию, для которого характерно поражение внутригрудных лимфоузлов (чаще у детей), лёгких (чаще у взрослых). В клинике преобладает длительный, навязчивый кашель, интоксикация, снижение массы тела. Репризы не характерны, необходимо дообследование у фтизиатра для исключения туберкулёза. Для уточнения диагноза применяют рентгенологические методы исследования лёгких, мультиспиральную компьютерную томографию (МСКТ) грудной клетки, учёт реакций туберкулиновых проб (реакция Манту, Диаскинтест), бактериологические методы исследования (посев мокроты на туберкулёзную палочку).
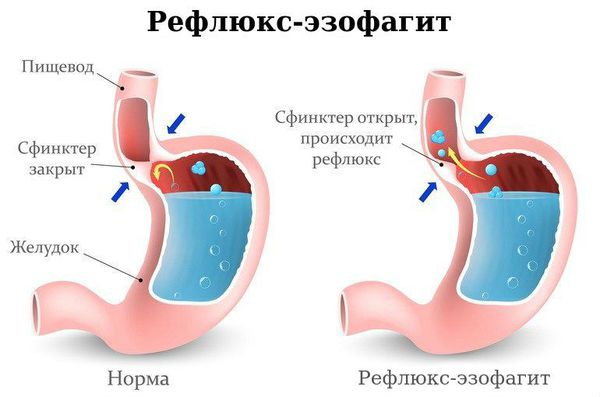
Рефлюкс-эзофагит — при данном состоянии возникает заброс кислого содержимого желудка в пищевод. Из-за близкого расположения пищевода и бронхов происходит раздражение последних и в клинике появляется кашель. Характерно появление кашля в положении лёжа, ночной кашель преобладает над дневным. Диагноз подтверждается проведением ультразвукового исследования желудка. Лечение рефлюкс-эзофагита проводит врач-гастроэнтеролог [5] [7] .
Дополнительные методы обследования: на рентгенограмме органов грудной клетки при неосложнённом коклюше отмечаются признаки усиления лёгочного рисунка: из-за отёка и воспаления на рентгеновском снимке тень лёгкого более выражена.
Лечение коклюша
В домашних условиях осуществляется лечение лёгких форм при условии отсутствия в семье непривитых детей.
Нужен ли постельный режим пациенту с коклюшем
Режим — домашний, постельный режим по самочувствию.
Когда необходимо лечение в стационаре
Тяжёлые формы подлежат госпитализации в инфекционный стационар. Показания для госпитализации: остановка дыхания, более 10 реприз в день, возраст до двух лет.
Диета при коклюше и общие рекомендации
Диета при коклюше — общий стол. Общие рекомендации: увлажнение воздуха (снижает раздражение рецепторов бронхов, уменьшает частоту реприз), витаминотерапия, исключение пассивного курения, проветривание и влажная уборка помещения.
Какие медикаменты и физиотерапевтические процедуры помогут при коклюше
В катаральный период показано применение антибактериальной терапии. Коклюшный микроб чувствителен к макропенам (азитромицин) и защищённым аминопенициллинам (амоксициллина клавуанат). В период спазматического кашля антибиотики малоэффективны, так как в этот период микроба уже нет в организме человека, клиника развивается на основании уже выделенного токсина.
Показаны ингаляции через небулайзер с гормонами (будесонид) [5] [6] [7] .

Как облегчить кашель при коклюше. Симптоматическая терапия
Облегчить кашель помогут препараты на основе кодеина или либексина, насморк — сосудосуживающие препараты в каплях или спрее.
Народные методы лечения коклюша
Народные методы не имеют доказанной эффективности, поэтому применение их может нанести вред здоровью. Отсутствие своевременного адекватного лечения коклюша, особенно у маленьких детей, опасно осложнениями — пневмонией и остановкой дыхания.
Прогноз. Профилактика
Прогноз обычно благоприятный. Симптомы коклюша нарастают в течение месяца, стихают за 2-4 месяца. Рецидивы связаны с наслоением ОРЗ, так как снова возникает раздражение слизистой бронха, усиливается кашель, учащаются репризы. На фоне лечения ОРЗ симптомы коклюша угасают.
Вакцинация против коклюша
Основным профилактическим мероприятием является вакцинация. Вакцинация позволяет сформировать иммунитет к коклюшу после введения в организм специальных иммунобиологических препаратов. Современные вакцины против коклюша входят в состав комплексных вакцин отечественного и зарубежного производства. В состав комплексных вакцин кроме коклюшного компонента может входить дифтерийный и столбнячный анатоксин, вакцина против гепатита В, гемофильной инфекции и полиомиелита (таблица 1).
В соответствии с Национальным календарём профилактических прививок вакцинация показана детям с трёх месяцев жизни. Курс прививок в первый год состоит из трёх вакцинаций с интервалом 45 дней. Дальнейшие прививки проводят на втором году жизни (через год от последней вакцинации). Вакцинацию против коклюша можно сочетать с другими прививками Национального календаря прививок: грипп, пневмококковая инфекция. Все вакцины, содержащие коклюшный компонент, взаимозаменяемы.
Таблица 1. Компоненты комплексных вакцин для профилактики коклюша
Комплексные вакцины имеют ограничение применения по возрасту пациента (таблица 2). У детей вакцинация от коклюша возможна до 4-6 лет. Длительность иммунного ответа после вакцинации составляет до 5-6 лет.
Читайте также:

