Гематогенные инфекции что это такое
Обновлено: 18.04.2024
Пути инфицирования позвоночника. Классификация инфекций позвоночника
а) Вопросы лучевой диагностики с позиций анатомии. Возбудители инфекционных заболеваний могут проникать в органы и ткани человека различными путями, в т.ч. путем прямого контакта, лимфогенным путем, гематогенным путем или с током спинномозговой жидкости Контактный путь, как говорит само его название, предполагает прямое соприкосновение кости или мягких тканей с источником инфекции с развитием абсцесса мягких тканей или остеомиелита.
Если вести речь о позвоночнике, то такой путь инфицирования можно видеть, например, при развитии спондилита в области глубокого пролежня. Инфекционное поражение межпозвонкового диска может распространяться на окружающие паравертебральные мягкие ткани и приводить к формированию абсцессов поясничных мышц. Контактный путь также является механизмом развития эпидуральных абсцессов, расположенных краниальней или каудальней уровня поражения межпозвонкового диска. Этот путь инфицирования имеет место и при развитии интрамедуллярных абсцессов спинного мозга, при которых возбудитель проникает в спинной мозг через эпителиальный ход и дефект в задних элементах позвонка.
Лимфогенный путь имеет ограниченное значение, поскольку при инфекционных поражениях позвоночника намного чаще мы видим контактный или гематогенный пути инфицирования. Лимфогенный путь может быть актуален, например, при поражении забрюшинных лимфоузлов при первичных злокачественных новообразованиях брюшной полости и таза.
б) Гематогенный путь инфицирования. Гематогенный путь является одним из самых главных механизмов развития инфекционных поражений костей аксиального скелета. При этом вопрос о том, какой именно гематогенный путь (артериальный или венозный) имеет большее значение, остается спорным. Артериальный путь распространения инфекции в отношении позвоночника традиционно считается более актуальным. В телах позвонков существуют области, с физиологической точки зрения очень похожие на метафизы длинных трубчатых костей. Области эти расположены вблизи передней продольной связки и характеризуются наличием разветвленной сети конечных артериол, которая делает их восприимчивыми к развитию инфекционного процесса.
Дистальные сосуды в этих областях характеризуются отсутствием сети анастомозов и медленным кровотоком, тромбоз их ведет к аваскулярному некрозу кости. Сегментарные артерии обычно кровоснабжают тела двух смежных позвонков и расположенный между ними диск, в связи с чем и картина инфекционного поражения позвоночника бывает достаточно типична. Венозный путь инфицирования традиционно реализуется через сплетение Батсона, представляющее собой продольно ориентированную сеть бесклапанных вен, расположенных параллельно позвоночному столбу. Вены эти располагаются за пределами брюшной или плевральных полостей. Сплетение Батсона сообщается с различными другими венозными системами, в т. ч. с полой веной, системой воротной вены, системой непарной вены, межреберными венами, легочными и почечными венами.
Направление тока крови в сплетении меняется в зависимости от градиента давления в грудной и брюшной полостях. Аналогичную функцию на уровне шейного отдела позвоночника выполняет глоточно-позвоночное сплетение. Непрерывность ликворных пространств полости черепа и дурального мешка обеспечивает возможность прямого распространения возбудителей инфекций или метастазов опухолей стоком ликвора. Внутричерепные новообразования таким образом могут давать отсевы с развитием метастазов в шейном, грудном или поясничном отделах дурального мешка. Точно также новообразования, расположенные в самых дистальных отделах дурального мешка, могут метастазировать с током ликвора в полость черепа.
(Слева) На схеме сагиттального среза показаны признаки инфекционного поражения поясничного межпозвонкового диска с распространением процесса на тела позвонков с развитием спондилита, деструкцией замыкательных пластинок и отеком костного мозга. Отражено формирование дорзального и вентрального абсцессов.
(Справа) Сагиттальный срез, Т1-ВИ FS с КУ, пациент со спондилодисцитом: контрастное усиление сигнала тел L5 и S1 позвонков и межпозвонкового диска, флегмонозные изменения превертебральных и эпидуральных тканей. (Слева) Аксиальный срез, Т1-ВИ с КУ, пациент со спондилодисцитом: распространение инфекционного процесса в превертебральные ткани, поясничные мышцы и дорзальные мышцы позвоночника. Флегмона проникает в вентральный отдел эпидурального пространства и вызывает сдавление дурального мешка.
(Справа) Аксиальный срез, Т2-ВИ FS: распространение воспалительного процесса в превертебральное пространство, на поясничные мышцы и дорзальные мышцы позвоночника. (Слева) Аксиальный срез, Т1-ВИ с КУ: случай диссеминированного кокцидиомикоза с диффузным поражением костной и мягких тканей, распространением процесса в паравертебральные ткани и легкое.
(Справа) Сагиттальный срез, Т2-ВИ: пациенте кокцидиомикозом: массивные паравертебральные абсцессы. Дуральный мешок в спинномозговом канале деформирован за счет пора -жения межпозвонкового диска и тел позвонков.
в) Патологическая лучевая анатомия. Варианты инфекционного поражения позвоночника можно разделить на инфекцию межтелового пространства/остеомиелит позвонков, субдуральную эмпиему, менингит, интрамедуллярный абсцесс спинного мозга и септический артрит/поражение дугоотростчатых суставов. Инфекция межтелового пространства характеризуется типичной картиной снижения интенсивности сигнала в Т1 -режиме в области соответствующего межпозвонкового диска, распространяющейся на смежные замыкательные пластинки. Типичной характеристикой является неровность контура замыкательных пластинок. В Т2-режиме характерна гиперинтенсивность сигнала межпозвонкового диска, не повторяющая анатомию диска и распространяющаяся на смежные тела позвонков. При контрастировании наблюдается неравномерное усиление сигнала межпозвонкового диска и диффузное усиление, распространяющееся на пораженные тела позвонков.
Важным аспектом инфекционного поражения позвоночника является распространение процесса на паравертебральные ткани, признаки чего будут видны в режимах подавления сигнала жировой ткани, постконтрастныхЛ -ВИ, на которых мы ищем признаки контрастного усиления сигнала паравертебральных тканей и поясничных мышц, или Т2-ВИ, характеризующихся усилением Т2-сигнала соответствующих анатомических образований. В протоколе исследования важно описать не только уровень поражения, но также признаки нестабильности или изменения анатомии позвоночника, если таковые имеют место, признаки распространения инфекционного процесса на паравертебральные ткани, эпидуральное пространство и поясничные мышцы.
г) Эпидуральный абсцесс и менингит. Изолированные эпидуральные абсцессы могут возникать и в отсутствии сопутствующей инфекции межпозвонкового диска, а также могут быть связаны с постоянной катетеризацией эпидурального пространства или перенесенным стабилизирующим вмешательством на позвоночнике. Изредка эпидуральный абсцесс может быть следствием гематогенного заноса инфекции. Менингит обычно проявляется на постконтрастных Т1 -ВИ как линейное усиление сигнала вдоль мягкой мозговой оболочки спинного мозга или корешков конского хвоста. При грибковых инфекциях наблюдается узелковый характер усиления сигнала, что напоминает картину метастатического поражения. Субдуральная эмпиема позвоночника встречается редко и может развиваться при тяжелом течении инфекционного процесса межпозвонкового диска с его распространением на эпидуральное пространство. Эмпиема является результатом в первую очередь прямого распространения процесса через твердую мозговую оболочку в субдуральное пространство.
Интрамедуллярные абсцессы спинного мозга встречаются редко и могут возникать как вследствие гематогенного, так и прямого распространения инфекции. У взрослых более типичным механизмом является контактный путь, у детей-также контактный путь через функционирующий эпителиальный ход. Септический артрит/поражение дугоотростчатых суставов может развиваться как вследствие гематогенного, так и контактного распространения инфекции. Ранние стадии инфекционного поражения могут характеризоваться лишь некоторым усилением интенсивности Т2-сигнала субхондральных участков суставных отростков в сочетании с выпотом в полость суставов.
д) Особенности течения инфекционного процесса у взрослых и детей. В силу анатомических особенностей пути распространения инфекции у взрослых и детей отличаются друг от друга. У взрослых в первую очередь поражаются замыкательные пластинки, затем процесс распространяется на межпозвонковый диск, смежные участки тел позвонков, паравертебральные ткани и эпидуральное пространство. У детей через толщу ростковой зоны проходят сосуды, за счет которых первичный очаг инфекционного поражения развивается в межпозвонковом диске с последующим вторичным распространением в тело позвонка. Наиболее частой локализацией инфекции межпозвонкового диска является поясничный отдел позвоночника, за которым следует грудной и шейный отделы. Факторы риска развития инфекции многочисленны и включают возраст старше 50 лет, сахарный диабет, ревматоидный артрит, СПИД, прием глюкокортикоидов, инородные тела мочевыводящих путей, перенесенную травму позвоночника и параплегию. Наиболее распространенной этиологической причиной инфекции является Staphylococcus aureus.
У лиц, употребляющих внутривенные наркотики, возбудителем могут бактерии рода Pseudomonas. Для пациентов с серповидноклеточной анемией классикой считаются поражения, вызванные бактериями рода Salmonella, однако и у них наиболее распространенными остаются стафилококковые поражения.
е) Классификация. Классификация инфекционных поражений костей подразделяет эти поражения на четыре анатомических типа заболевания и три вида ответа организма-хозяина и включает, таким образом, 12 клинических стадий заболевания. Четыре анатомических типа: (1) ранний гематогенный или медуллярный остеомиелит, (2) поверхностный остеомиелит (контактное инфицирование), (3) локальная или полнослойная секвестрация и (4) диффузный остеомиелит. Классификация ответа организма: (А) нормальный физиологический ответ, (В) локальный или системный патологический ответ и (С) лечение остеомиелита будет более тяжелым, чем лечение собственно инфекции.
Классификация туберкулеза позвоночника Mehta (2001) подразделяет заболевания на четыре группы: (1) стабильное поражение передней колонны без кифотической деформации, при котором показан передний дебридмент и костная пластика опорным трансплантатом, (2) тотальное поражение с кифотической деформацией и нестабильностью, показана задняя стабилизация и передняя костная пластика опорным костным трансплантатом, (3) пациенты высокого риска трансторакальных вмешательств, которым показана задняя декомпрессия и стабилизация, (4) изолированные задние поражения, при которых показана задняя декомпрессия.
ж) Клинические вопросы. Инфекционные поражения позвоночника составляют 2-5% всех остеомиелитов. Наиболее распространенным симптомом является боль в спине. Болевой синдром прогрессирует, развиваясь постепенно, он становится постоянным, не уменьшаясь даже в состоянии покоя. Температурная реакция вариабельна и присутствует в
Интрамедуллярные абсцессы оканчиваются фатально в 8% случаев, более, чем у 70% этих пациентов остается стойкий неврологический дефицит. Более, чем у 90% пациентов отмечается повышение СОЭ. Также повышается и уровень С-реактивного белка. Бактериологическое исследование крови оказывается положительным у 25-60% пациентов с остеомиелитом позвоночника.
Показания к хирургической санации очага и спондилодезу при инфекционном поражении позвоночника включают необходимость забора материала для бактериологического исследования, дренирование абсцесса, сохраняющийся неврологический дефицит, деформацию и нестабильность позвоночника, и неэффективность консервативного лечения. Первой линий терапии при условии отсутствия острого или прогрессирующего неврологического дефицита остается продленная внутривенная антибактериальная терапия. Курс внутривенной терапии антибиотиками обычно продолжается 6 недель, по завершении антибактериальная терапия может быть продолжена перорально. Может быть показана наружная иммобилизация позвоночника. Рецидивы инфекции проявляются рецидивирующими эпизодами бактериемии, формированием паравертебральных абсцессов и хронических функционирующих свищей. Наиболее распространенным и благоприятным исходом консервативного лечения является формирование спонтанного костного блока пораженных позвонков.
(Слева) На схеме сагиттального среза показаны эпителиальный ход, соединяющий поверхность кожи с конусом спинного мозга, абсцесс конуса спинного мозга и распространенный отек спинного мозга.
(Справа) Сагиттальный срез, Т2-ВИ: пациент с абсцессом шейного отдела спинного мозга и стрептококковым эндокардитом отмечается диффузное расширение спинного мозга с формированием на уровне С4-С6 в его толще кольцевидной зоны низкоинтенсивного сигнала (капсула абсцесса). (Слева) Сагиттальный срез, Т1-ВИ с КУ и подавлением сигнала жировой ткани: распространенная субдуральная эмпиема с периферическим контрастным усилением сигнала на протяжении всего шейного отдела позвоночника и распространением вдоль поверхности ската.
(Справа) Случай септического артрита дугоотростчатого сустава. Аксиальный срез, Т1-ВИ с КУ на уровне L4-L5: распространение инфекционного процесса на правый дугоотростчатый сустав с диффузным усилением сигнала суставных отростков и поражением околосуставных мягких тканей. (Слева) Аксиальный срез Т1-ВИ с КУ: признаки прямого распространения инфекционного процесса (аневризма аорты на фоне грибкового поражения) от аорты в тело позвонка с формированием зоны деструкции и развитием спондилита. Инфекция также напрямую распространяется на поясничную мышцу.
(Справа) Аксиальный срез с КУ: признаки прямого распространения инфекционного процесса (аневризма аорты на фоне грибкового поражения) от аорты в тело позвонка и на левую поясничную мышцу.
з) Дифференциальный диагноз. Первичным методом диагностики эпидуральных абсцессов является МРТ, чувствительность которой в отношении диагностики инфекционного поражения эпидурального пространства аналогична КТ-миелографии, однако она в то же время позволяет исключить другую патологию, например, грыжу диска, кисту, опухоль и инфаркт спинного мозга. МР-картина эпидурального абсцесса включает мягкотканное образование эпидурального пространства с конусовидными краями, оттесняющее дуральный мешок и спинной мозг. В Т1 -режиме абсцесс характеризуется изоинтенсивностью сигнала, в Т2-режиме — усилением сигнала.
Для полноценного трактования наблюдаемых изменений как признаков эпидурального абсцесса необходимо исследование с контрастированием. Картина контрастного усиления при эпидуральном абсцессе включает: (1) диффузное и гомогенное усиление, (2) неоднородное усиление и (3) тонкий ободок периферического усиления сигнала. Контрастирование является очень полезным дополнительным инструментом исследования, позволяющим оценить протяженность поражения в случаях, когда стандартные режимы МР-томографии оказываются недостаточно информативными. Контрастное усиление сигнала свидетельствует об активности инфекционного процесса и позволяет рационально ограничить зону интереса для последующей игольной биопсии или хирургического вмешательства. Эффективное медикаментозное лечение должно приводить к прогрессирующему снижению выраженности контрастного усиления сигнала паравертебральных мягких тканей, дисков и тел позвонков. На ранних стадиях развития инфекционного процесса, когда межпозвонковые диски еще интактны, только с использованием МРТ инфекционный процесс сложно дифференцировать с опухолевым поражением, дегенеративными изменениями замыкательных пластинок I типа или компрессионным переломом.
Для окончательного определения природы наблюдаемых изменений необходимо исследование в динамике.
Boden et al. предположили, что признаком инфекции позвоночника в послеоперационном периоде будеттриада из контрастного усиления сигнала межпозвонкового диска, контрастного усиления сигнала фиброзного кольца и контрастного усиления сигнала костного мозга позвонков в сочетании с соответствующими лабораторными изменениями, например, увеличением СОЭ. Однако бывают пациенты с неосложненным течением послеоперационного периода и признаками контрастного усиления сигнала фиброзного кольца (в зоне вмешательства), межпозвонкового диска и замыкательных пластинок и без признаков инфекционного поражения. В послеоперационном периоде в норме контрастное усиление сигнала межпозвонкового диска обычно определяется в виде тонких полос, параллельных смежным замыкательным пластинкам, а усиление сигнала костного мозга тел позвонков связано с дегенеративными изменениями замыкательных пластинок I типа.
Подобную МР-картину следует отличать от аморфного усиления сигнала межпозвонкового диска при инфекционном поражении.
и) Список использованной литературы:
1. Duarte RM et al: Spinal infection: state of the art and management algorithm. Eur Spine J. 22(12):2787-99, 2013
2. Malghem J et al: Necrotizing fasciitis: Contribution and limitations of diagnostic imaging. Joint Bone Spine. 80(2): 146-54, 2013
3. Go JL et al: Spine infections. Neuroimaging Clin N Am. 22(4):755-72, 2012
4. DeSanto J et al: Spine infection/inflammation. Radiol Clin North Am. 49(1):105-27,2011
5. Celik AD et al: Spondylodiscitis due to an emergent fungal pathogen: Blastoschizomyces capitatus, a case report and review of the literature. Rheumatol Int. 29(10):1237-41,2009
6. Hong SH et al: MR imaging assessment of the spine: infection or an imitation? Radiographics. 29(2):599-612, 2009
7. Karikari IO et al: Management of a spontaneous spinal epidural abscess: a single-center 10-year experience. Neurosurgery. 65(5):919-23; discussion 923-4, 2009
8. Mylona E et al: Pyogenic vertebral osteomyelitis: a systematic review of clinical characteristics. Semin Arthritis Rheum. 39(1): 10-7, 2009
9. Petruzzi N et al: Recent trends in soft-tissue infection imaging. Semin Nucl Med. 39(2): 115-23, 2009
10. Posacioglu H et al: Rupture of a nonaneurysmal abdominal aorta due to spondylitis. Tex Heart Inst J. 36(1):65-8, 2009
11. Sobottke R et al: Treatment of spondylodiscitis in human immunodeficiency virus-infected patients: a comparison of conservative and operative therapy. Spine (Phila Pa 1976). 34(13):E452-8, 2009
12. Thwaites G et al: British Infection Society guidelines for the diagnosis and treatment of tuberculosis of the central nervous system in adults and children. J Infect. 59(3):167-87, 2009
13. Dai LY et al: Anterior instrumentation for the treatment of pyogenic vertebral osteomyelitis of thoracic and lumbar spine. EurSpineJ. 17(8):1027-34, 2008
14. Mehta JS et al: Tuberculosis of the thoracic spine. A classification based on the selection of surgical strategies. J Bone Joint Surg Br. 83(6):859-63, 2001
15. Mader JT et al: Staging and staging application in osteomyelitis. Clin Infect Dis. 25(6):1303-9, 1997
16. Boden SD et al: Postoperative diskitis: distinguishing early MR imaging findings from normal postoperative disk space changes. Radiology. 184(3):765-71, 1992
Н.В. БЕЛОБОРОДОВА, доктор медицинских наук, профессор, главный научный сотрудник академической группы академика РАМН Ю.Ф. Исакова.
При участии Ж.И. АРХИПОВОЙ, кандидата медицинских наук, НИИ детской гематологии. Серьезные экологических изменения, происходящие на планете в последние десятилетия, не могли не сказаться на состоянии микроэкологии и иммунореактивности современного человека.
В этом - одна из глобальных причин роста грибковых заболеваний, которыми сегодня, по данным Всемирной организации здравоохранения, страдает каждый пятый житель планеты. Чаще проявлениями грибковых заболеваний являются различные локальные поражения кожи, ногтей, слизистых оболочек полости рта, кишечника, уретры и влагалища, однако при серьезных нарушениях иммунореактивности организма может наступить генерализация процесса, и тогда грибковые заболевания приобретают жизнеугрожающий характер.
На фоне достижений современной медицины, увеличения продолжительности жизни наиболее ослабленных больных (глубоконедоношенные дети, пациенты с опухолями и иммунодефицитами) в лечебных учреждениях наблюдается широкое распространение инвазивных микозов, которые составляют до 12% в этиологической структуре внутрибольничных инфекций и до 40% в структуре инфекционной летальности. Ученые из Центра контроля заболеваемости (Атланта, США) называют кандидоз внутрибольничной эпидемией последнего десятилетия, так как заболеваемость им иммунокомпрометированных больных возросла в 11 раз.
Колонизация слизистых грибами Candida у практически здоровых людей колеблется от 15 до 40% и может возрасти до 80% на фоне какой-либо патологии в условиях длительной госпитализации, но инвазивный микоз у них не развивается благодаря большому количеству защитных механизмов против грибковой инфекции. Защитные механизмы, не связанные с иммунной системой, включают барьеры в виде кожи и слизистых, а также конкурентные взаимодействия с нормальными бактериями, которые обеспечивают защиту от кандидоза и других микозов посредством соревнования за пищу и, возможно, посредством локальной продукции веществ с антифунгальной активностью. Само по себе разрушение барьеров химической травмой, ожогом или операцией, как и нарушение нормального биоценоза кишечника после длительного применения антибиотиков широкого спектра действия, крайне редко приводит к развитию системного микоза, но вызывает предпосылки для этого в виде локального избыточного накопления грибов в тех местах, где действие физиологических барьеров нарушено.
Общеизвестными факторами риска возникновения грибковой инфекции являются длительная антибиотикотерапия и снижение защитных сил организма. В нормальном организме нейтрофилы, макрофаги и эозинофилы фагоцитируют и убивают бластоспоры кандид, а альвеолярные макрофаги и нейтрофилы способны блокировать прорастание спор аспергилл. Нейтрофилы и моноциты уничтожают также псевдогифы Candida и гифы Aspergillus. Поэтому первыми кандидатами на развитие диссеминированного кандидоза и аспергиллеза являются больные с количественными и функциональными дефектами нейтрофилов, особенно в условиях депрессии Т-клеточного звена иммунной сиcтемы. К специфическим условиям относится лекарственная нейтропения на фоне лечения цитостатиками, особенно глубокая (14 дней нейтрофилы
У пациентов с онкогематологическими заболеваниями к появлению специфических факторов риска инвазивного микоза приводит терапия. На современном этапе она обязательно включает мощные цитостатики, глюкокортикоиды и антибиотики широкого спектра действия. Помимо возникновения нейтропении цитостатики приводят к разрушению кожных и слизистых барьеров, глюкокортикоиды угнетают Т-лимфоциты и макрофаги, антибиотики нарушают биоценоз кишечника. Неудивительно, что в онкогематологических стационарах инвазивные микозы становятся все возрастающей проблемой.
Барьер №1 - конкурентное взаимодействие грибов с бактериями нормальной микрофлоры хозяина
Барьер №2 - целостность кожи и слизистых
Барьер №3 - фагоцитоз и иммунологические реакции
Основные факторы, способствующие разрушению барьеров
№1 - неадекватная (избыточная) антибиотикотерапия
№2 - повреждение эпителия (механическое, токсическое, воспалительное), замедление регенерации, авитаминоз
№3 - снижение иммунореактивности под влиянием цитостатиков, стероидных гормонов
Еще в 80-е годы грибковые инфекции возникали в основном на фоне длительной госпитализации, продолжительной антибиотикотерапии и повторных курсов химиотерапии. Средняя продолжительность периода от момента установления диагноза онкогематологического заболевания до развития грибкового осложнения составляла 19 месяцев. В настоящее время все чаще грибковые инфекции стали наблюдаться на ранних этапах лечения цитостатиками. Это связано как с агрессивностью режимов полихимиотерапии, так и с широким применением современных супермощных антибиотиков.
Важно отметить, что инвазивные грибковые поражения могут развиваться не только у больных при явнымх дефектах иммунореактивности, но и у пациентов с любыми хирургическими заболеваниями в случае осложненного течения послеоперационного периода, реанимационных мероприятий, интенсивной терапии, длительной искусственной вентиляции легких. Мы наблюдали таких пациентов после тяжелых комбинированных травм, после повторных операций по поводу абдоминального сепсиса, после кардиохирургических, нейрохирургических операций и др. В этих случаях предрасполагающим моментом является совокупность факторов, снижающих барьерную функцию слизистых оболочек (стресс, нарушения гемодинамики, гипоксия, длительная невозможность энтерального питания и др.) в сочетании с массивной комбинированной антибиотикотерапией, к сожалению, необходимой у больных высокого риска по жизненным показаниям. Забегая вперед, следует отметить, что даже при выделении грибов из крови или очагов инфекции при проведении целенаправленной противогрибковой терапии у таких пациентов не представляется возможным отказаться от одновременного введения антибиотиков в связи с высокой опасностью септического шока.
Самым частым видом микоза является кандидоз. В списке возбудителей кандидоза лидирующее место занимает Candida albicans. Этим видом грибов вызывается более 80% кандидозов. Однако инфекция может быть вызвана и другими видами: С. tropicalis, С. parapsilosis, С. krusei, С. lusitaniae, Torulopsis glabrata.
Кандидоз в зависимости от степени поражения может быть классифицирован как поверхностный и глубокий. Поверхностный кандидоз включает кожный, орофарингеальный, мочеполовой и характеризуется поражением соответствующих слизистых. Наиболее опасен глубокий кандидоз, составляющий основной спектр кандидозных инфекций у иммунокомпрометированных больных, который может быть классифицирован как фунгемия, диссеминированный кандидоз и кандидоз отдельных органов.
Инвазивное кандидозное поражение желудочно-кишечного тракта (ЖКТ). Считается общепризнанным, что ЖКТ является основным эндогенным резервуаром Candida, откуда происходит проникновение грибов в кровь (феномен транслокации) и последующее распространение инфекции по организму. Однако у больного с агранулоцитозом локальное поражение ЖКТ грибами рода Candida не ограничивается хорошо описанной в литературе ролью "ворот" для диссеминации, а само по себе может вызвать жизнеугрожающие состояния: прогрессирование поражения быстро приводит к множественной инфильтрации или некрозам всей толщи стенки пищеварительного канала, вызывая такие тяжелые осложнения, как кишечная непроходимость, перитонит, желудочно-кишечное кровотечение, вплоть до летального исхода.
Поражение легких. Грибы рода Candida часто высеваются из респираторных секретов, однако клиническое значение таких высевов в большинстве случаев невелико, так как колонизация ротовой полости и верхних дыхательных путей приводит к контаминации мокроты. Более того, легочная инфекция грибами Candida обычно возникает в результате гематогенного распространения, и мокрота у таких больных не отделяется вовсе. Симптомы кандидозной пневмонии схожи с клиническими проявлениями бактериальной пневмонии, но носят более непостоянный характер. Обращает на себя внимание несоответствие выраженных нарушений дыхания скудным аускультативным и рентгенологическим признакам. Рентгенологические нарушения могут ограничиваться изменениями корня и усилением сосудистого рисунка, почти в половине случаев наблюдается рентгенонегативная кандидозная пневмония. В финале заболевания может развиться диссеминация по обоим легочным полям. Рентгенологически этот процесс характеризуется появлением множественных "мигрирующих" облаковидных теней. Сегодня для диагностики поражения легких у иммунокомпрометированных больных наиболее широко используется бронхоальвеолярный лаваж с последующим микробиологическим исследованием.
Поражение кожи встречается в 5-10% случаев острого диссеминированного кандидоза. Классически оно имеет вид плотных, приподнимающихся над поверхностью узлов 0,5-1 см в диаметре, розово-красного цвета, не исчезающих при надавливании. Однако у большинства больных изменения на коже представляют собой просто папулезную или пятнисто-папулезную сыпь, часто неотличимую от медикаментозной.
Изменения на коже и инфильтраты мягких тканей часто становятся информативным материалом для идентификации возбудителя, так как поверхностное расположение делает их удобными для биопсии. Сочетание посева с гистологическим исследованием значительно увеличивает этот показатель. Следует иметь в виду, что поражения кожи при кандидозе затрагивают дерму, в то время как поверхностный слой эпидермиса остается интактным, поэтому клиницист должен быть очень внимателен при заборе материала. При гистологическом исследовании обычно находят псевдомицелий грибов, фибрин и небольшие геморрагии в сочетании с отеком стенки сосудов и периваскулярной ткани.
Поражение ЦНС. Кандидозный менингит встречается относительно редко, наиболее характерен для новорожденных и недоношенных детей, а также как вторичное осложнение при шунтирующих нейрохирургических вмешательствах. В случае развития у имунокомпрометированных больных имеет исключительно агрессивное течение. Поражение оболочек головного мозга характеризуется достаточно ярко выраженными общемозговыми и менингеальными симптомами, а также нейтрофильным или лимфоцитарным плеоцитозом в ликворе - в зависимости от степени нейтропении. Candida имеет низкую высеваемость из ликвора, при морфологическом исследовании ликвора друзы гриба или псевдомицелий обнаружить, как правило, не удается, клинические симптомы (лихорадка, головная боль) не специфичны, поэтому грибковая природа менингита у больных с нейтропенией редко распознается при жизни. Внутримозговые абсцессы, связанные с Candida, могут вызывать очаговую неврологическую симптоматику, соответствующую их локализации.
Поражение сердца. Клиника кандидозного эндокардита не отличается от клиники бактериального, сопровождается длительной лихорадкой и формированием вегетаций на клапанах сердца. Особенностью этой локализации является частое сочетание с фунгемией: хотя бы однократный высев Candida из крови имеют до 80% больных кандидозным эндокардитом. На фоне иммунодефицита могут развиваться грибковые микроабсцессы в миокарде, что иногда проявляется аритмиями. Возможна закупорка грибковыми тромбоэмболами кардиальных артерий с развитием ишемии и сердечной недостаточности.
Хронический диссеминированный кандидоз (ХДК). Наиболее важный маркер ХДК - поражение печени и селезенки. Именно микроабсцессы в этих органах определяют хронический характер течения болезни. Термины "ХДК" и "гепатолиенальный кандидоз" в литературе являются синонимами. Клинически ХДК проявляется увеличением печени и селезенки на фоне длительной лихорадки. Иногда заболевание сопровождается желтухой или болями в правом подреберье. В крови отмечаются высокий лейкоцитоз и выраженная гипербилирубинемия (в основном за счет прямой фракции) в среднем у половины больных. Уровень трансаминаз повышается непостоянно и не более, чем в 3 раза. Наблюдения позволяют сказать, что в целом у большинства больных поражение печени грибами выглядит как холестатический гепатит. Такая особенность приводит к тому, что ХДК часто ошибочно принимается за токсическое поражение цитостатиками, особенно при отсутствии характерных изменений на УЗИ. Кандидозные микроабсцессы в паренхиматозных органах выглядят при ультразвуковом исследовании и компьютерной томографии как гипоэхогенные очаги, поэтому многие клиницисты считают обнаружение этих характерных изменений диагностическим критерием, подтверждающим инвазивную грибковую инфекцию.
Кандидемия. Многие авторы утверждают, что Candida spp., высеянная из крови, редко является контаминантом и должна быть принята во внимание как патоген практически во всех случаях. Фунгемия обнаруживается примерно в 30% случаев диссеминированного кандидоза и имеет важное диагностическое значение, так как служит основным прижизненным доказательством инвазивного кандидоза. Повторная (стойкая) кандидемия может быть результатом инфицирования центрального венозного катетера или проявлением деструктивного поражения глубоких тканей.
С момента возникновения проблемы грибковых инфекций в 60-70-е гг. огромные усилия медиков всего мира были направлены на разработку методов диагностики этих опасных осложнений, так как ранняя диагностика остается основным критическим моментом, определяющим успех в ведении больного с инвазивной инфекцией. Однако до настоящего времени от 20 до 75% случаев инвазивных микозов диагностируется лишь на аутопсии.
Кроме классических микробиологических методов серьезным подспорьем в лабораторной диагностике сегодня является определение маркеров кандидоза - Д-арабинитола и маннозы - методом газовой хроматографии. Даже при трудной локализации очага, недоступного для биопсии и посева, обнаружение высокого уровня маркеров в крови или спинномозговой жидкости позволяет подтвердить диагноз кандидоза, кроме того, в динамике объективно оценить эффект противогрибковой терапии.
Профилактика и лечение. Широко распространено мнение о необходимости одновременно с антибиотиками принимать нистатин, что гарантирует от грибковых осложнений. Действительно, нистатин препятствует массивному размножению кандид на слизистых ЖКТ. Однако крайне важно учитывать, что этот препарат не всасывается при приеме внутрь, то есть не способен воздействовать на клетки грибов, находящиеся вне просвета кишечника. Поистине революционным событием в этиотропной терапии кандидоза следует считать появление препарата флуконазола, наиболее известного под торговым названием дифлюкан. Хорошая биодоступность препарата обеспечивает высокую эффективность практически при любой локализации процесса - от распространенных кожных поражений до менингита. Почти всегда рекомендуется прием препарата внутрь за исключением редких случаев крайне тяжелого состояния больного, когда препарат вводят внутривенно. Благодаря отсутствию токсичности и низкой частоте побочных реакций флуконазол применяется даже у недоношенных детей. Очень важно правильно соблюдать режимы дозирования (см. табл.).
| Пациенты | Показания и дозы флуконазола | ||
| Новорожденные и дети раннего возраста | кандидоз кожи и слизистых 5-6 мг/кг 1 раз в день 5 дней | грибковый сепсис 10 мг/кг 1 раз в день 10-14 дней | грибковый менингит 15 мг/кг 1 раз в день 10-14 дней |
| Взрослые | кандидоз кожи и слизистых 50 мг 1 раз в день 5 дней | вагинальный кандидоз 150 мг однократно (!) | кандидемия, диссеминированный кандидоз 200-400 мг 1 раз в день 2-4 недели |
Когда терапия флуконазолом не дает эффекта, следует думать о кандидозе, вызванном природно резистентными видами кандид, например C.krusei. В этих случаях рекомендуется противогрибковая терапия эффективным, но потенциально токсичным препаратом амфотерицин В (относительно менее высокой токсичностью характеризуется препарат с торговым названием фунгизон). Лечение проводится только в стационаре под тщательным лабораторным контролем. Дозы амфотерицина В из-за опасности нефротоксических реакций не должны превышать 0,5-1 мг/кг в сутки внутривенно один раз в день или через день. При наличии микроабсцессов в печени, головном мозге и других органах наиболее эффективными являются липосомальные формы амфотерицина В (амфоцил и др.), которые, однако, малодоступны из-за высокой стоимости.
Таким образом, в настоящее время актуальность своевременной диагностики и раннего лечения кандидоза чрезвычайно высока.
Гематогенные формы менингита. Механизмы возникновения гематогенного менингита
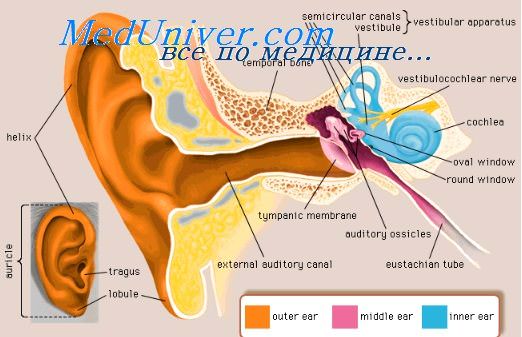
Гематогенная форма менингита обычно наблюдается тогда, когда инфекция переходит на мозговые оболочки по сосудам. Менингит возникает благодаря заносу бактерий и их токсинов в мозговые оболочки или вследствие поражения сосудов, соединяющих среднее ухо с твердой мозговой оболочкой.
Субстратом гематогенного пути являются мелкие костные вены сосцевидного отростка, а также капилляры (система гаверсовых сосудов) костной капсулы лабиринта, которые анастомозируют с сосудами среднего уха (Л. Н. Ямпольский).
Штейрер (Stcurer) большое значение в этом отношении также приписывает сосудистым связям, существующим между клетками сосцевидного отростка и твердой мозговой оболочкой, т. е. костным венам. Кроме того, инфекция из среднего уха может попасть в полость черепа по сосудистым тяжам, имеющимся на крыше барабанной полости.
Гематогенные формы менингита наблюдаются преимущественно при острых средних отитах. Они возникают в результате тромбоза вен, соединяющих среднее ухо с мозговыми оболочками. Менингит может также возникнуть при отогенном сепсисе или при другом гнойном процессе, который сопровождается генерализацией инфекции по организму. Известный интерес в этом отношении заслуживает описание случая менингита, опубликованное Маутнером (Mauthner). У больного, страдавшего острым средним гнойным отитом, почти в одно и то же время развились субдиафрагмальный абсцесс и гнойный менингит.
Автор считает, что менингит в данном случае развился метастатически. Подтверждением этому служит то, что в гнойных выделениях из среднего уха и абсцесса был обнаружен один и тот же вид стрептококка. Этот автор ссылается также на Руттина (Ruttin), приводящего историю болезни больного, у которого на почве острого среднего отита развился септический эндокардит и одновременно гнойный менингит. В литературе описано несколько случаев менингита с аналогичным патогенезом.
Гематогенная форма менингита отличается быстрым, нередко молниеносным развитием патологического процесса. Это объясняется тем, что инфекция быстро преодолевает защитные механизмы (слизистую оболочку, сосудистые стенки, твердую мозговую оболочку и т. п.) и попадает в полость черепа. Процесс сразу принимает диффузный характер. Гематогенные формы менингита наблюдаются, как уже сказано, при острых отитах, часто в их начальной стадии развития, т. е. в первые дни или даже часы. Иначе говоря, процесс развития менингита идет почти параллельно острому воспалительному процессу в ухе. Во время мастоидотомии кость в таких случаях оказывается макроскопически не измененной.
Нам кажется наиболее целесообразным деление отогенных менингитов на две формы: контактную и гематогенную. К первой относятся: а) случаи менингита, при которых патологический процесс переходит на мозговые оболочки непосредственно из кариозно измененной кости или из имеющегося уже в полости черепа гнойника (абсцесса мозга и т. д.); б) случаи, когда этот переход происходит по протяжению, например лабиринтогеyный менингит. Ко второй относится распространение инфекции по сосудам, соединяющим среднее ухо с мозговыми оболочками.
Говоря о гематогенном пути, мы, как уже сказано, различаем два вида заражения мозговых оболочек. Первый мы назвали бы сегментарно-васкулярным, исходя из тех соображений, что тут речь идет 6 поражении только сосудов уха, которые имеют связи с мозговыми оболочками. Инфекция в таких случаях не попадает в общее кровяное русло, т. е. она не генерализуется по организму, она только циркулирует от уха до мозговых оболочек. При метастатическом способе развитие менингита происходит вследствие генерализации инфекции по организму. Источником распространения инфекции может быть любой инфекционный процесс или гнойный очаг различной локализации (заболевания легких и бронхов и т. п.). Часто занос инфекции в полость черепа имеет место при сепсисе, в том числе сепсисе ушного происхождения.
При сегментарно-васкулярном способе реакции организма до поражения мозговых оболочек могут быть слабо выражены, так как процесс до определенной поры не выходит за пределы уха. При втором способе реакции организма резко выражены (высокая температура, ознобы) и они предшествуют воспалению мозговых оболочек. Метастазы при сепсисе возникают в различных органах и тканях малого и большого круга кровообращения. Метастазы в полости черепа выявляются в виде абсцессов мозга или менингита. Нередко метастазы возникают одновременно в различных местах, примером могут служить клинические наблюдения, приведенные нами выше.
На основании многочисленных клинических наблюдений, экспериментальных данных, а также гистологических исследований можно сказать, что отогенный менингит в большинстве случаев возникает в результате разрушения кости в области крыши барабанной полости и антрума. Этот путь наиболее частый. При нем патологический процесс из пораженной кости переходит на мозговые оболочки.
Для иллюстрации приведем данные наших наблюдений, касающихся 93 больных отогенным менингитом, находившихся на излечении в ЛОР-клинике Одесского медицинского института с 1947 до первой половины 1956 г.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
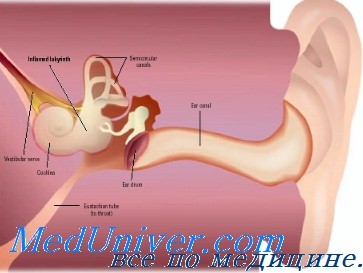
Лабиринтиты гематогенные. Диагностика и лечение гематогенных лабиринтитов
С такой точки зрения, основанной на единичных патологоанатомических и клинических наблюдениях, нельзя подходить ко всем лабиринтитам, наблюдающимся после некоторых общих инфекционных заболеваний препмущественно вирусной природы (эпидемический паротит, грипп и др.).
В ряде случаев ни клиническое наблюдение, ни исследование спинномозговой жидкости не дают основания устанавливать диагноз менингита и относить в связи с этим лабиринтит к группе менингогенных. Мы считаем, что в тех случаях, при которых отсутствуют данные о перенесенном менингите, нет оснований считать лабиринтит менингогенным; правильнее рассматривать его как инфекционный процесс, развившийся гематогенным путем.
Это подтверждается, по нашему мнению, на примере развития лабиринтита при эпидемическом паротите, когда одновременно наблюдается орхит. Здесь имеется распространение инфекции гематогенным путем с элективным поражением двух органов (лабиринта и половых желез).
На основе собственных наблюдений и литературных данных мы считаем правильным выявляемые при инфекционных заболеваниях метастатически-токсические процессы в лабиринте относить тоже в группу лабиринтитов. При оценке же генеза таких лабиринтитов, когда совершенно отсутствуют данные о наличии страдания мозговых оболочек, мы считаем более правильным эти заболевания называть инфекционным гематогенным лабиринтитом.
Не располагая данными патологоанатомичееких исследований при таких лабиринтитах, можно думать о серозном или гнойном течении их только на основании клинических данных и исходов заболевания.
Формы течения указанных лабиринтитов весьма различны. Начавшись характерными для всех острых лабиринтитов симптомами, они в дальнейшем имеют весьма различное течение: иногда заболевание ограничивается несколькими (8—10) днями и протекает преимущественно на фоне декомпенсаторных лабиринтных явлений раздражения — ощущение шума, спонтанный нистагм в больную или обе стороны, иногда повышенная реакция вестибулярного анализатора на калорическую пробу, умеренное понижение слуха.
В других случаях преобладают быстро наступающие явления выпадения лабиринтной функции (частичного или полного)— значительное понижение или полное выпадение слуха, спонтанный нистагм в здоровую сторону, понижение реакции вестибулярного анализатора на калорическую пробу, которые длятся значительно дольше и дают стойкие нарушения функции лабиринта.
Лечение. При указанной форме лабиринтита с течением преимущественно по типу серозного воспаления можно думать о решающем значении в течении заболевания повышенного давления в перилимфатическом пространстве. Из этих соображений показана по возможности более ранняя дегидратационная терапия (глюкоза внутривенно, уротропин внутрь по 0,5 три раза в день или внутривенное введение 40% раствора уротропина по 10 мл, потогонные чаи).
Ввиду инфекционной природы заболевания показано введение антибиотиков или сульфаниламидов в зависимости от основного заболевания.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

