Гемофильная палочка микробиологическая диагностика
Обновлено: 16.04.2024
Впервые гемофильные бактерии были выделены Р. Кохом в начале 80-х годов XIX века из конъюнктивального экссудата. Позднее М.И. Афанасьев (1891 г.) и Р. Пфейффер (1892 г.) похожего возбудителя выделили из трупа больного, погибшего от гриппа; отсюда его длительное время считали причиной гриппа, что получило отражение в видовом названии.
Классификация
Гемофильные бактерии относятся к семейству Pasteurellaceae, роду Haemophilus. Кроме него в семейство входят роды Pasteurella и Aggregatibacter. Род Haemophilus включает около 20 видов, среди них есть сапрофиты и патогенные микроорганизмы.
Наибольшую роль в патологии играет H. influenzae, вызывающий воспалительные процессы в респираторном тракте, а также менингиты, бактериемию и другие инвазивные инфекции.
По свойствам с ним сходны H. parainfluenzae, H. haemolyticus and H. parahaemolyticus (последние 2 вида проявляют гемолитическую активность).
H. ducreyi является возбудителем мягкого шанкра – заболевания, передаваемого половым путем.
Родственные микроорганизмы вида Аggregatibacter aprophilus могут вызывать подострый эндокардит.
Являются мелкими коккобактериями с выраженным полиморфизмом. Образуют капсулу, не имеют спор и жгутиков, по Граму окрашиваются отрицательно.
Культуральные свойства
Весьма прихотливы к питательным средам. Нуждаются в наличии факторов роста в среде.
Этими факторами являются факторы Х или V, которые содержатся в эритроцитах: Фактор V – термолабильный кофермент (НАД или НАДФ), содержится в дрожжах, в тканях растений и животных, участвует в энергетическом метаболизме; фактор Х – гемин, термостабилен, входит в состав железосодержащих пигментов. Гемофильные бактерии не способны к его синтезу.
Отсюда лучшими средами для культивирования являются кроличий или лошадиный кровяной агар и шоколадный агар. На этих средах чаще вырастают S- или М- (слизистые) формы колоний. Непатогенные, бескапсульные штаммы образуют R-формы колоний.
Оптимальная температура роста 37 0 С. Длительность роста – 36-48 часов. На кровяном агаре с добавлением сердечно-мозгового экстракта через 24 часа появляется рост мелких колоний с радужными переливами, гемолиз отсутствует. У беcкапсульных вариантов радужная расцветка не выявляется. На жидких средах с кровью рост чаще диффузный, реже – придонный.
Биохимические свойства
Факультативные анаэробы. Метаболизм смешанный.
H. influenzae разлагает глюкозу, обладает каталазой, оксидазой, нуждается в X-, V-факторах.
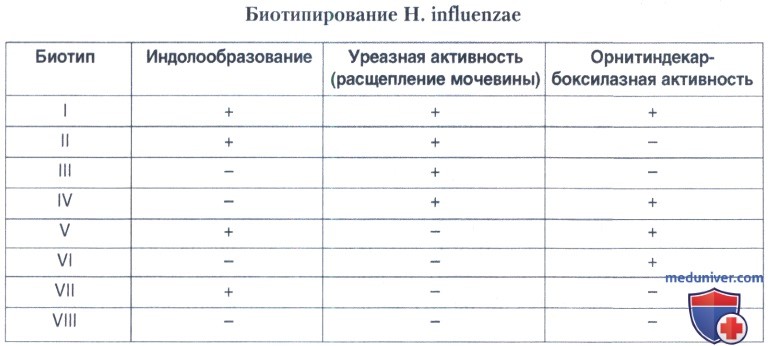
Часть штаммов образует индол и разлагает мочевину, по этим признакам проводится биотипирование H. influenzae.
H.ducreyi не обладает сахаролитической активностью, нуждается в X-факторе, имеет каталазу и оксидазу.
Дифференциация гемофильных бактерий по биохимическим свойствам представлена в таблице.
Антигенная структура
О – соматический (ЛПС) и К – капсульный полисахаридный антиген; по К-антигену выделяют в реакции агглютинации или преципитации с монорецепторными сыворотками 6 серовариантов (a, b, c, d, e, f). Бескапсульные штаммы обозначаются как нетипируемые.
Белковый антиген М имеется у непатогенных штаммов.
Факторы патогенности
Основным фактором вирулентности является капсула.
Большинство инвазивных инфекций вызывается капсульными штаммами Н. influenzae типа b (Hib).
Капсула Hib состоит из полирибозилрибитолфосфата (ПРРФ), то есть содержит в качестве мономера пентозу (рибозу) в отличие от других типов, содержащих гексозу, что и определяет более высокую вирулентность. ПРРФ является Т-независимым АГ.
Бактерии имеют многочисленные адгезины в составе пилей.
Обладают IgА-протеазами, разрушающими секреторный IgА, что подавляет местный иммунитет слизистых.
ЛПС клеточной стенки является эндотоксином.
Возбудитель может продуцировать β-лактамазы, что обусловливает устойчивость к антибиотикам данной группы.
Резистентность
Патогенез и характеристика заболевания
Наибольшую роль в патологии человека играет H. influenzae, а также H. ducreyi – возбудитель мягкого шанкра. A. aphrophilus иногда способен вызывать подострый эндокардит.
Н. influenzae является патогеном исключительно человека (антропонозная инфекция). Гемофильные палочки, преимущественно нетипируемые их штаммы, часто входят в состав нормальной микрофлоры слизистых оболочек верхних дыхательных путей у здоровых взрослых и детей.
Однако на фоне сопутствующих заболеваний и при снижении местного иммунитета H. influenzae размножается на слизистых оболочках внутри- и внеклеточно, попадает в кровь. При этом через гематоэнцефалический барьер возбудитель может проникать в мозговые оболочки, что приводит к менингиту.
H. influenzae вызывают большое количество различных инфекций. В целом все инфекции, обусловленные гемофильной палочкой, можно подразделить на 2 типа: неинвазивные и инвазивные.
Неинвазивные инфекции связаны с распространением и колонизацией бактериями слизистой оболочки верхних дыхательных путей. При этом страдает мукоцилиарный клиренс.
Гемофилы могут вызывать острый синусит, острый средний отит и обострение хронического бронхита. Обычно эти заболевания являются осложнениями вирусных и других респираторных инфекций.
Инвазивные инфекции вызываются главным образом штаммами варианта Hib и связаны с гематогенным распространением возбудителей.
К ним относятся тяжелые заболевания – менингит, эпиглоттит (острое воспаление надгортанника), пневмония, бактериемия и сепсис.
Основные виды инфекций H. influenzae представлены в таблице
Источники инфекции – больной человек и носители, в носоглотке которых локализуется возбудитель.
Пути передачи – воздушно-капельный, в меньшей степени контактный.
В первую очередь инфекции, вызванные H. influenzae, поражают детей младшего возраста до 4-5 лет. Для них эти возбудители представляют наибольшую опасность.
Низкая частота развития инвазивных инфекций у детей первых двух месяцев жизни обусловлена наличием материнских антител. После этого срока уровень антигемофильных АТ падает, и ребенок становится восприимчивым к инфекции.
Защитный уровень АТ постепенно приобретается к 5-6 годам, что обусловливает снижение частоты и тяжести заболеваний.
Основным факторов вирулентности является полисахаридная капсула типа b, состоящая из полирибозилрибитолфосфата. Она защищает микроорганизм от фагоцитоза, опсонизации и комплемент-опосредованного лизиса. С ростом популяции людей, обладающих антителами к полирибозилрибитолфосфату, уменьшается и частота инвазивных инфекций.
Наиболее тяжелым заболеванием, вызванным H. influenzae, является гнойный менингит. Возбудитель проникает в клетки эпителия носоглотки, далее инвазирует субэпителиальные слои и попадает в кровь. При низком уровне АТ капсула обеспечивает выживание бактерий в крови, и они проникают в сосудистые сплетения головного мозга. Возбудитель активирует острое пиогенное воспаление в ЦНС. Эндотоксин стимулирует воспалительный процесс и поражает сосуды микроциркуляции с развитием тромбофлебитов. Это приводит к некрозу мозговой ткани.
Заболевание стремительно прогрессирует, и без лечения летальность может превысить 90%. После болезни у 10% детей остаются неврологические осложнения (глухота, гидроцефалия, ментальные расстройства).
Вариантом местной пиогенной инвазии является гемофильный эпиглоттит. Он представляет собой острое гнойное воспаление надгортанника с некрозом, что в тяжелых случаях приводит к смерти от асфиксии.
У рожениц и новорожденных может развиваться гемофильный сепсис. Наиболее частой причиной его являются нетипируемые штаммы возбудителя.
У взрослых гемофильная инфекция чаще всего возникает вторично как осложнение после вирусных или бактериальных респираторных инфекций. В составе микробных ассоциаций возбудитель вызывает пневмонию или обострение бронхита
Иммунитет после заболевания стойкий, в основном гуморальный; естественный пассивный иммунитет от матери сохраняется до 2-3 месяцев.
Лабораторная диагностика
В связи с тем, что гемофильная палочка вызывает широкий спектр инфекций, для микробиологической диагностики может направляться различный клинический материал.
Наибольшую диагностическую значимость представляет исследование в норме стерильных биологических жидкостей: крови, плевральной, перикардиальной, синовиальной и спинномозговой жидкости (СМЖ).
Бактериоскопический метод носит ориентировочный характер, при окраске по Грамму выявляют грамотрицательные полиморфные бактерии, чаще с капсулой.
В качестве экспресс-методов выявляют антигены возбудителя в исследуемом материале.
Для быстрой диагностики инфекций, вызванных Н. influenzae типа b, используются серологические методы обнаружения капсульного антигена в СМЖ, крови, плевральной жидкости и моче: латекс-агглютинация, реакция коагглютинации со стафилококковым протеином А и иммуноферментный анализ.
Более простыми методами являются реакции латекс- и коагглютинации с образцами СМЖ. В настоящее время наиболее широко применяется иммуноферментный анализ.
При исследовании образца спинномозговой жидкости необходимо немедленно начать исследование или хранить материал в термостате при температуре 35-37°С (при невозможности – при комнатной температуре не более 30 мин). Образцы СМЖ не должны помещаться в холодильник. Длительной хранение образцов может привести к гибели бактерий и ложноотрицательным результатам (за исключением теста на определение антигенов).
Для обогащения материала проводят центрифугирование СМЖ. Проводят окрашивание осадка по Граму. Далее определяют антиген Hib в надосадочной жидкости.
Затем проводят бактериологическое исследование осадка. Выполняют посев нескольких капель осадка СМЖ на поверхность чашек с шоколадным и кровяным агаром. Чашки инкубируют при температуре 35-37°С в атмосфере с 5-10% СО2.
Другие биологические жидкости (синовиальная, перикардиальная, плевральная) также должны окрашиваться по Граму и исследоваться культурально.
Делают посев на среды с кровью, шоколадный агар. Идентификацию проводят по культуральным, биохимическим и антигенным свойствам с использованием специфических монорецепторных сывороток.
Параллельно проверяют потребность в X и V-факторах. Исследуемую культуру сеют сплошным газоном на плотную питательную среду. На посев накладывают два бумажных диска, смоченных, соответственно X и V-факторами. Если рост выявляется вокруг дисков, то подтверждают зависимость культуры от этих факторов.
Можно использовать тест сателлитных культур. На чашку с посевом культуры на кровяном агаре наносят в нескольких местах культуру S. aureus. При этом за счет выделяемого ими гемолизина вокруг колоний стафилококка наблюдается обильный рост исследуемой культуры. Аналогичные результаты можно получить при использовании диска с сапонином, который также лизирует эритроциты кровяного агара, высвобождая факторы X и V.
Гемофильный менингит требует немедленного назначения антибиотикотерапии. С учетом вероятной устойчивости возбудителя к ампициллину препаратами выбора являются цефалоспорины III поколения. Также назначают хлорамфеникол, фторхинолоны.
При лечении эпиглоттита применяют цефалоспорины III поколения, возможно назначение ингибитор-защищенных β-лактамов (амоксициллин-клавулановая кислота). Данные антибиотики используют также при отитах и синуситах.
Специфическая профилактика
Для предотвращения тяжелых, угрожающих жизни инфекций, вызываемых штаммами варианта Hib, разработаны химические комбинированные вакцины, отличающиеся высокой эффективностью и безопасностью, в том числе у детей младше 18 мес.
Они представляют собой очищенный капсульный полисахарид Hib, конъюгированный с другими АГ (например, столбнячным анатоксином или вакциной АКДС), что обеспечивает необходимую иммуногенность.
В настоящее время конъюгированная Hib вакцина внесена в расширенный календарь прививок в Республике Беларусь. Детей прививают четырехкратно в 3, 4, 5 и 18 месяцев.
Неспецифическая профилактика – изоляция и лечение больных, дезинфекция в очагах.
Инфекции вызванные Haemophilus influenzae, ducreyi: диагностика, лечение, профилактика
Бактерии рода Haemophilus — маленькие грамотрицательные коккобациллы, рост которых зависит от наличия в среде экзогенных факторов роста X (гемин) и V (никотинамидадениндинуклеотид). Поражают слизистые оболочки организма. Наиболее патогенные виды — Haemophilus influenzae и Н. ducreyi.
Инфекции вызываемые Haemophilus influenzae
Основной фактор патогенности Haemophilus influenzae — антифагоцитарная полисахаридная капсула (шесть разновидностей — от а до f). Кроме того, бактерия способна экспрессировать на своей поверхности липополисахарид и IgA протеазу. У непривитых пациентов вызывает септицемию, менингит и остеомиелит, обычно обусловленных серотипом b.
Клинические признаки инфекции вызванной Haemophilus influenzae. Инфекция обычно возникает в дошкольном возрасте и характеризуется гнойным менингитом, острым эпиглоттитом (воспаление надгортанника), септицемией, целлюлитом подкожно-жировой клетчатки лица и остеомиелитом. Штаммы, не образующие капсулу, считают представителями нормальной микрофлоры носоглотки. Иногда они могут быть причиной развития среднего отита, синусита и инфекций грудной клетки у пациентов с обструк-тивными болезнями лёгких.
Лабораторная диагностика инфекции вызванной Haemophilus influenzae. Для ранней диагностики менингита используют определение антигенов возбудителя. Выполняют посев спинномозговой жидкости, мокроты, крови или гноя на шоколадный агар и инкубацию в среде с 5% содержанием диоксида углерода. Обнаружение Haemophilus influenzae основано на зависимости их роста от наличия в среде X и V факторов.
Лечение и профилактика инфекции вызванной Haemophilus influenzae. Устойчивость большинства штаммов Н. influenzae к ампициллину обусловлена способностью бактерии вырабатывать b-лактамазу. Для лечения применяют амоксициллин + клавулановую кислоту, кларитромицин, тетрациклин или триметоприм. При тяжёлой инфекции рекомендовано применение устойчивых к b-лактамазе цефалоспоринов.
В настоящее время детскую инфекцию практически удалось победить благодаря белковой конъюгированной вакцине против возбудителей серотипа b. Штаммы Haemophilus, не образующие капсулу, распространены повсеместно, а потому лицам с ослабленным иммунитетом практически невозможно избежать заражения.
Инфекции вызванные Haemophilus ducreyi
Инфекции, вызываемые Haemophilus ducreyi, передаются половым путём и характеризуются развитием болезненных асимметричных мягких генитальных язв (мягкий шанкр). Заболевание сопровождается лимфаденопатией, а нагноение паховых лимфатических узлов приводит к образованию свищей. Инфекция в основном распространена в развивающихся странах и способствует передаче ВИЧ-инфекции.
Для профилактики заболевания применяют эритромицин или амоксициллин + клавулановая кислота. Большое значение имеет своевременное обнаружение и лечение носителей инфекции.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Возбудитель гемофильной инфекции- Haemophilus influenzae, способен вызывать гнойный менингит, острое воспаление верхних дыхательных путей, бронхит, пневмонию, эмпиему, конъюнктивит, отит и другие оппортунистические заболевания. Уровень носительства гемофильной палочки среди здоровых лиц высокий (до 90 %). Гемофильная инфекция у детей в возрасте до 3 лет протекает исключительно тяжело, особенно в случае возникновения острого эпиглоттита (воспаления надгортанника).
Бактериоскопический методможет быть использован при исследовании спинномозговой жидкости при подозрении на гнойный менингит (рис.18а).
а б
Рис. 18. Гемофильная палочка - Haemophilus influenzae. а –мазок из спинно-мозговой жидкости, б - мазок из чистой культуры.Окраска по Граму. мелкие грамотрицательные палочки. х900
Серозную и спинномозговую жидкости центрифугируют, осадок засевают бактериальной петлей на шоколадный агар (МПА с 5% дефибринированной крови человека, лошади или кролика выдерживают 2-3 минуты при температуре 80 0 С, повторно добавляют 5% крови и вновь выдерживают при той же температуре 2-3 минуты) или среду Филдса (МПА с добавлением пептического перевара крови лошади или барана). Параллельно делают посев на обычный МПА, на котором гемофильная палочка не растет.
Для идентификации Haemophilus influenzae применяют также тест сателлитных колоний, для чего на поверхность шоколадного МПА наносят исследуемую культуру и в некоторые участки среды - штамм Staphylococcus aureus. Гемофильная палочка вырастает в виде мелких сателлитных колоний, окружающих колонии S. aureus, так как стафилококк, гемолизируя кровь, высвобождает X и Vфакторы – стимуляторы роста Haemophilus influenzae.
Каталазу гемофильной палочки определяют по пенообразованию в капле 10% перекиси водорода на предметном стекле при внесении в нее исследуемой культуры. Оксидазу выявляют путем нанесения на диск фильтровальной бумаги, диаметром 5-7 см , 2-3 капель 1% раствора тетраметилпарафенилендиамина и исследуемой культуры, в результате чего через
10-15 сек. появляется фиолетовое окрашивание. Уреазу определяют общепринятым методом по разложению мочевины с образованием щелочных продуктов в присутствии индикатора фенолового красного; при наличии уреазы среда приобретает ярко-малиновый цвет. Порфириновый тествыявляет способность Н. influenceк синтезу Δ-аминолевуленовой кислоты (АЛК) - потребности в факторе X. При внесении АЛК в среду только АЛК-независимые гемофильные бактерии синтезируют и секретируют порфобилиноген и порфирины (промежуточные соединения биосинтеза гема), тогда как АЛК-зависимые гемофильные палочки, нуждающиеся в факторе X, не способны к образованию указанных продуктов. Исследуемые бактерии засевают на шоколадный МПА, наносят на поверхность среды диски, пропитанные АЛК, и после 24-часовой выращивания в термостате при 37 0 С облучают УФ-лучами. При наличии Х-независимых микроорганизмов наблюдают кирпично-красную флюоресценцию.
Для специфической профилактики гемофильной инфекции в России лицензирована полисахаридная вакцина, конъюгированная со столбнячным анатоксином (вакцина Act-HIB) фирмы Пастер Мерье Коннот, которая не содержит консервантов и антибиотиков.
Медицинская микробиология:
Бактериологическая диагностика гемофильной инфекции (H. influenzae, Hib)
Для подтверждения этиологии заболевания и определения чувствительности выделенного возбудителя к антимикробным препаратам обязательно микробиологическое исследование. Оно состоит из следующих основных этапов:
1) получение и транспортировка клинического материала;
2) предварительное исследование: микроскопия клинического материала;
3) выделение чистой культуры при исследовании спинномозговой жидкости, крови и другого клинического материала;
4) идентификация выделенной культуры.
а) Получение и транспортировка клинического материала. В связи с тем, что гемофильная палочка вызывает широкий спектр инфекций, для микробиологического исследования может направляться различный клинический материал. Наибольшую диагностическую ценность представляют исследования стерильных в норме биологических жидкостей: крови, плевральной, перикардиальной, синовиальной, спинно-мозговой жидкостей (СМЖ). Для доказательства этиологической роли Н. influenzae в инфекции НДП необходимо предупреждение контаминации клинического материала микрофлорой ВДП.
б) Предварительное исследование: микроскопия клинического материала. Предварительным этапом, предшествующим непосредственному выделению бактерий, является исследование мазков клинического материала, окрашенных по Граму и/или метиленовым синим. 11ри окраске по Граму бактерии рода Haemophilus представляют собой мелкие, бледно окрашенные сафранином или фуксином грамотрицательные палочки, обладающие полиморфизмом, иногда образующие длинные нити. При окраске метиленовым синим гемофилыгые палочки имеют синий цвет на серо-голубом фоне. Отрицательный результат микроскопии не исключает возможности гемофильной инфекции, гак как в клиническом материале может присутствовать недостаточное количество микробов. Поэтому обязательно культуральное бактериологическое исследование, которое остается золотым стандартом микробиологической диагностики.
При исследовании материалов, содержащих микробные ассоциации (мокрота, материал из среднего уха, пазух носа), следует провести микроскопическое исследование мазка. Критерием пригодности мокроты для посева является наличие более 25 сегментоядерных лейкоцитов и не более 10 эпителиальных клеток в поле зрения при просмотре 20 полей зрения мазка, окрашенного по Граму (при увеличении х100).
- капсульные штаммы образуют слизистые круглые сочные колонии сероватого цвета в диаметре до 2 мм, дающие радужную окраску в проходящем свете (иридиирующие);
- штаммы со слабовыраженной капсулой дают полупрозрачные круглые гладкие неиридиирующие колонии;
- бескапсульные штаммы образуют мелкие непрозрачные неиридиирующие колонии с неровными краями.
Дальнейший анализ проводится в соответствии со схемой, приведенной ниже, в которой этап накопления биомассы и приготовления мазка соответствует второму дню микробиологического исследования.
Третий день. Определение каталазной активности. Определение цитохромоксидазной активности. Посев на чашку для определения потребности в факторах X и V (или с тест-стрипами). Определение β-галактозидазной активности (предварительный учет). Определение чувствительности к ампициллину и другим антибактериальным препаратам на среде НТМ. Выявление β-лактамазы (тест с нитроцефином).
Четвертый день. Учет потребности в факторах X и V. Учет р-галактозидазной активности.
Ответ о наличии Н. influenzae или другого вида Haemophilus выдается при идентификации капсульного типа Н. influenzae с учетом результатов чувствительности к ампициллину и другим антибактериальным препаратам.
При необходимости биотипирования выделенного штамма производятся постановка пробы на индолообразование, определение наличия уреазы, определение наличия орнитиндекарбоксилазы..
Пятый день. Учет результатов биотипирования Н. influenzae.
3. Определение чувствительности к антибиотикам. Потенциальной активностью в отношении Н. influenzae обладают следующие антибиотики: аминопенициллины, ингибиторозащищенные пенициллины, цефалоспорины II—IV поколений, тетрациклины, фторхинолоны и др. В соответствии с международными и национальными рекомендациями, для выявления ампициллинорезистентности у гемофильной палочки в лабораторной практике достаточно определить чувствительность к ампициллину дискодиффузионным методом и провести тест на продукцию β-лактамаз с нитроцефином. Эти два теста позволяют подразделить штаммы Н. influenzae на ампициллиночувствительные, β-лактамазопродуцирующие ампициллинорезистентные (чувствительные к ингибиторозащищенным пенициллинам и цефалоспоринам II—IV поколений) и БЛНАР-штаммы, которые следует расценивать как резистентные к ингибиторозащищенным пенициллинам и некоторым цефалоспоринам.
Чашки с посевами и нанесенными на них дисками с антибиотиками инкубируют в течение 16-18 ч при 35°С в атмосфере с 5-7% CO2. Определяют чувствительность к ампициллину, амоксициллин/клавулонату, хлорамфениколу, тетрациклину, ципрофлоксацину или левофлоксацину, цефогаксиму или цефтриаксону, меропенему, ко-тримоксазолу, азитромицину.
Медицинская микробиология:
Бактерии Haemophilus influenzae: морфологические, культуральные, биохимические свойства
Бактерии рода Haemophilus, с одной стороны, входят в состав нормальной микрофлоры слизистой оболочки ротоглотки человека и животных, а с другой, — многие из них патогенны и являются облигатными паразитами. Типовой представитель рода — Haemophilus influenzae. В 1883 г. Р. Кох в гное больных конъюнктивитом обнаружил мелкие грамотрицательные палочки, а в 1891 г. М.И. Афанасьев и в 1892 г. Р. Пфейффер (R. Pfeiffer) впервые из мокроты больных гриппом выделили их в чистой культуре. Впоследствии эти бактерии были названы палочкой Афанасьева-Пфейффера.
Бактерии рода Haemophilus включают 21 вид и относятся к семейству Pasteurellaceae, в которое входят также роды Pasteurella и Actinobacillus.
Бактерии рода Haemophilus представляют собой полиморфные клетки (сферические, овальные или палочковидные), обычно мелкие, менее 1 мкм в ширину и различные по длине, иногда образуют нити. Они являются неподвижными грамотрицательными неспорообразующими факультативными анаэробами. Бактерии этого рода неустойчивы во внешнй среде, быстро погибают вне организма, поэтому распространяются в основном воздушно-капельным путем при личном контакте.
Почти все виды нуждаются в готовых факторах роста, присутствующих в крови, особенно в факторе X и/или V (поэтому их называют гемоглобинофильными бактериями или гемофилами). Фактор X термостабилен, представляет собой группу тетрапирольных соединений, входящих в состав железосодержащих пигментов, например, гемина. Виды гемофилов, нуждающиеся в факторе X, не способны синтезировать протопорфирин, что используется в качестве одного из идентификационных тестов. Большинство видов гемофилов нуждаются в термолабильном факторе V — никотинамидадениндинуклеотиде (НАД) или никотинамидадениндинуклеотидфосфате (НАДО), который участвует в окислительно-восстановительных реакциях.
Потребность бактерий в факторах X и V является критерием внутриродовой дифференциации бактерий рода Haemophilus, которые можно рассматривать как условно патогенные микроорганизмы. С человеком ассоциировано 9 видов.
Бактерия Н. influenzae связана с человеком; других резервуаров в природе не существует.

а) Морфологические, культуральные, биохимические и другие физиологические свойства. В состав клеточной стенки Н. influenzae серотипа b входит наружная мембрана, которая, как и у других грамотрицательных бактерий, состоит из фосфолипида, липополисахарида (ЛПС) и более 30 белков наружной мембраны, 6 из которых являются основными, выполняют различные функции и составляют 80% общего белка. ЛПС наружной мембраны состоит из липида А, ядра — кора и О-специфической цепи полисахарида, имеющего более короткие цепи липоолигосахаридов (ЛОС), чем классические ЛПС энтеробактерий.
Штаммы H. influenzae типа b обладают капсулой, которая представляет собой полимер рибозы и рибитола, скрепленных фосфорной кислотой (полирибозилрибитолфосфат, ПРФ).
Н. influenzae неподвижны, не имеют жгутиков; от поверхности клетки отходят пили, состоящие из белка пилина и отвечающие за адгезию к поражаемой клетке.
При изучении энергетического метаболизма Н. influenzae было показано, что существует компенсаторный механизм, благодаря которому потребление ими углеводов и состояние их электрон-транспортной системы взаимосвязаны. Гемофильные бактерии обладают ферментными системами углеводного метаболизма, которые имеются у большинства грамотрицательных бактерий. Следует подчеркнуть, что существуют видовые особенности гемофильных бактерий, связанные как со строением электрон-транспортной системы (состав хинонов и цитохромов), так и с наличием альтернативных путей углеводного метаболизма.
Бактерии рода Haemophilus отличаются биологическими особенностями, в частности, как отмечено выше, высокими питатательными потребностями: они растут на полноценных питательных средах, богатых аминокислотами, витаминами и требуют добавления факторов роста X и V, что является почти универсальным признаком принадлежности к этому роду бактерий. Другим характерным для ряда видов этого рода признаком является проявление каталазной активности. Исключение иногда составляют Н. parainfluenzae и Н. segnis, у которых этот признак вариабелен, и Н. aphrophilus, Н. paraphrophilus и Н. ducreyi, у которых он отсутствует.
Все виды гемофильных бактерий способны редуцировать нитраты до нитритов. Виды различаются по активности в отношении ферментов цитохромоксидазы, β-галактозидазы. Способностью вызывать β-гемолиз характеризуются только два вида — Н. haemolyticus и Н. parahaemolyticus, в то время как Н. influenzae и биовар aegyptius отличаются от других видов отсутствием β-галактозидазной активности. По способности гидролизовать мочевину виды рода Haemophilus и штаммы внутри видов Н. influenzae и Н. parainfluenzae различаются, и этот признак используется для биохимического типирования штаммов этих видов.
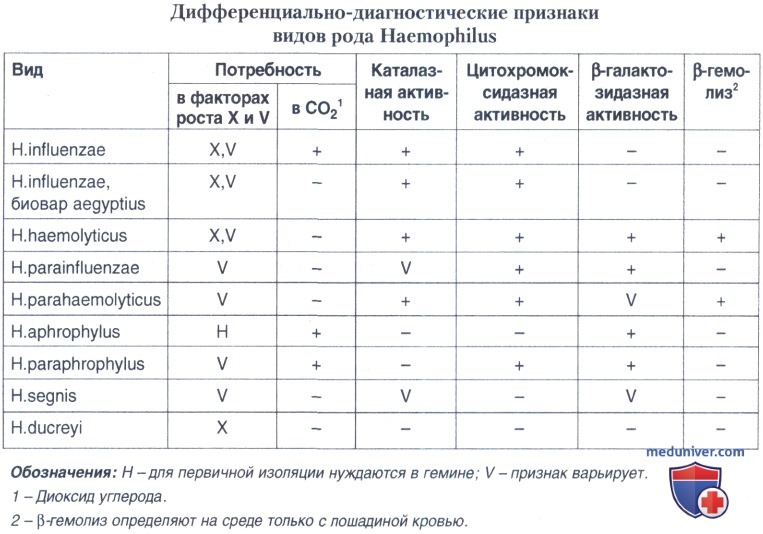
Н. influenzae обладают цитохромоксидазой и каталазой, нуждаются в V и X факторах роста и не обладают β-галактозидазной активностью. Это основные дифференциально-диагностические признаки данного вида микроорганизмов.
Бескапсульные штаммы обозначаются как нетипируемые и для их характеристики используют только биотипирование на основе биохимических тестов, предложенное М. Kilian, разделившей весь вид на 8 биотипов. Наиболее распространенными являются первые 3 биотипа, охватывающие от 70 до 85% всех изолятов. Наибольшей вирулентностью характеризуются штаммы биотипа I. Подавляющее большинство капсульных штаммов Н. influenzae серотипа b (Hib) относится к биотипу I и нередко к биотипу II. Биотип I преобладет среди изолятов, выделенных из крови, спинномозговой жидкости, мокроты, полученной от больных с бронхоэктазами, муковисцидозом.
Выявлена также большая частота изоляции этого биотипа от детей младше 1 года. Биотип II является наиболее распространенным среди штаммов, выделенных при различных инфекциях. К нему относятся как капсульные, так и нетипируемые штаммы, и зависимости частоты распространения этого биотипа среди изолятов из различных источников не выявлено. К биотипу III относятся изоляты, полученные из отделяемого глаз при конъюнктивитах. Биотип IV чаще вызывает инфекции женской половой сферы, перинатальные и неонатальные инфекционные заболевания.
б) Устойчивость к факторам внешней среды, к антибиотикам. Во внешней среде Н. influenzae нестабильны. Они погибают в течение 30 мин при температуре 55°С, под действием солнечных лучей и при высыхании. Дезинфицирующие растворы в обычно применяемых концентрациях убивают гемофильную палочку моментально.
Наиболее значимой, с клинической точки зрения, является проблема резистентности гемофильной палочки к аминопенициллинам за счет продукции β-лактамаз (ТЕМ-1 и ROB-1). Штаммы, продуцирующие β-лактамазы, обычно чувствительны к ингибиторозащищенным пенициллинам и цефалоспоринам II—IV поколений. В последние годы описаны β-лактамазонегативные амнициллинорезистентные штаммы (БЛНАР). Устойчивость к ампициллину у штаммов, не продуцирующих Р-лактамазы, обусловлена модификацией мишени действия этих антибиотиков — пенициллиносвязывающих белков в сочетании (или без) с активным выведением антибиотиков.
в) Антигенное строение. Антигенная структура бактерий рода Haemophilus, в частности Н. influenzae, наиболее опасного для человека и часто встречающегося вида, состоит из капсульных и соматических антигенов. М. Pittman более 70 лет тому назад определила наличие двух принципиально различных форм Н. influenzae — капсульной (инкапсулированной) и бескапсульной (или некапсульной, нетипируемой). Штаммы Н. influenzae, имеющие капсулу, в зависимости от ее полисахаридного состава подразделяются на 6 серотипов: a, b, с, d, е, f. Капсула является основным фактором вирулентности. Большинство инвазивных инфекций вызывается бактериями типа b (Hib). Серотипирование выделенных капсульных штаммов проводится при помощи сывороток к определенным типам.
Свойства соматических антигенов определяются структурой ЛПС. Анализ ЛПС 6 штаммов Н. influenzae, представляющих 6 известных капсульных серотипов, показал их сходство по качественному составу и различия в количественном соотношении компонентов, по их антигенной специфичности.
г) Факторы патогенности. Основным фактором патогенности Н. influenzae является капсула. Она препятствует фагоцитозу бактерий и обеспечивает их выживаемость в кровяном русле. Наиболее инвазивными капсульными штаммами являются Н. influenzae типа b (Hib), капсула которых состоит из ПРФ. Следует отметить, что капсула других типов содержит гексозу, что, вероятно, и определяет их меньшую вирулентность.
Пили — перитрихиальные образования длиной около 450 нм и с мол. массой около 27 кД, обусловливают прикрепление бактерий не только к муцину, но и к клеткам эпителия, фибронектину и эритроцитам.
Пили затрудняют фагоцитоз и способствуют адгезии бактерий к слизистой оболочке верхних дыхательных путей (ВДП) с последующим проникновением в подслизистое пространство, что приводит к местной воспалительной реакции, а более вирулентные штаммы проникают в лимфо- и кровоток верхних дыхательных путей. Белки наружной мембраны и пили играют ведущую роль в формировании на поверхности клетки биологической пленки, являющейся эффективным способом преодоления факторов иммунитета.
К другим факторам, усиливающим колонизацию гемофильных бактерий, относятся липополисахаридный (доминирует в развитии септического шока) и термостабильный гликопротеиновый (повреждающий реснички и поверхность эпителия), а также IgA1-протеаза, инактивирующая секреторные антитела. Известно, что ДОС гемофильных бактерий активируют продукцию воспалительных цитокинов моноцитами. Исследователями была показана тесная корреляция между капсульным серотипом и типом IgAl-протеазы. Так, Н. influenzae серотипов a, b, d, f продуцировали IgAl-протеазу I типа, которую никогда не обнаруживали у бескапсульных штаммов. Для серотипов с и е характерен II тип IgAl-протеазы. Эти данные важны для таксономии Н. influenzae и при эпидемиологических исследованиях.
д) Биологические модели. Модели, адекватной заболеванию человека, не существует. Отдельные этапы инфекционного процесса можно изучать при заражении новорожденных крыс, отит моделируют у шиншилл. Известно, что мыши линии BALB/c довольно восприимчивы к нетипируемым штаммам гемофильной палочки.
Читайте также:

