Генная инженерия и инфекции
Обновлено: 24.04.2024
Генная диагностика. Генная терапия. Что такое генная диагностика и генная терапия? Виды генной терапии.
Генная диагностика имеет большое будущее в экспресс-диагностике инфекционных болезней. На ранних этапах инфекции, когда AT в организме ещё не выработаны, диагностика основана на идентификации Аг, в том числе специфических генов возбудителя. Для этого выявления наиболее часто применяют методы гибридизации и амплификации ДНК (см. также главу 11).
14 сентября 1990 г. была проведена первая успешная попытка коррекции генных дефектов при наследуемом Т-клеточном иммунодефиците, связанном с недостаточностью фермента аде-нозин дезаминазы. Двум больным девочкам провели пересадку собственных Т-лимфоцитов, в которые был внесён трансген — нормальный ген недостающего фермента. В результате нескольких проведённых инфузий у обеих пациенток наступило полное выздоровление. В настоящее время несколько тысяч больных несут в своём организме клетки, генетически изменённые искусственным путём.
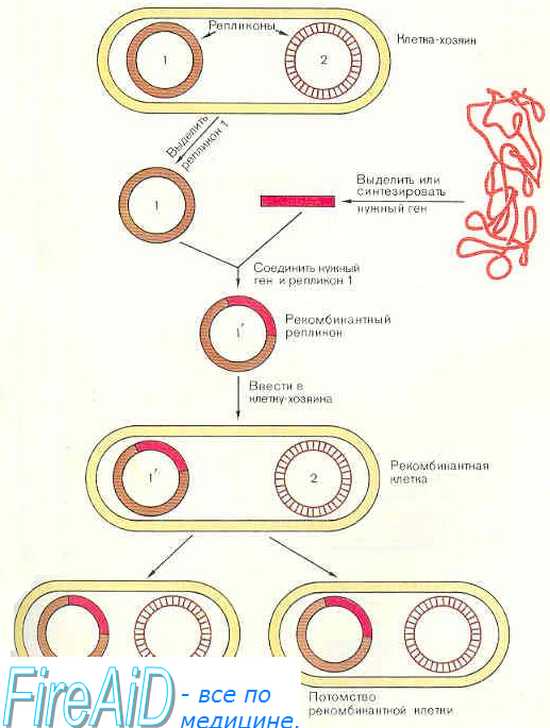
Виды генной терапии
В настоящее время разработаны три основных вида генной терапии, различаемых по способу доставки вектора в поражённые клетки.
Генная терапия ex vivo. Поражённые клетки выделяют из организма пациента, инкубируют с вектором, после чего генно-инженерные (генетически изменённые) клетки вносят в организм. Наиболее часто метод применяют в отношении клеток крови. Это связано с простотой их выделения и последующего обратного введения.
Генная терапия in situ. В этом случае вектор вводят непосредственно в поражённые ткани. Например, пациентам с муковисцидозом аденовирусные векторы доставляют непосредственно в трахею и бронхи; в некоторые опухоли непосредственно инъецируют вектор, несущий цитокин или токсин; в мышцу больного, страдающего мышечной дистрофией, производят инъекцию вектора, несущего ген дистрофина.
Генная терапия in vivo — вектор вводят в кровоток. До настоящего времени на практике этот метод не применяли, однако метод прост и удобен, поэтому его считают наиболее перспективным.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Генная инженерия представляет собой новое направление в сфере молекулярной биологии, которое получило широкое распространение во многих сферах медицины и биологии относительно недавно.
Генная инженерия позволяет целенаправленно, по заранее намеченной программе, экспериментально модифицировать геном с использованием генетической информации из разных гетерологических систем: вирусов, бактерий, насекомых, животных и человека. Применяя методы генной инженерии, ученые способны модифицировать структуру генов, а также создавать гибридные гены.
Следует отметить огромный вклад генной инженерии в улучшение сферы медицинского обслуживания. Так, благодаря генной инженерии стало возможным создание новых диагностических препаратов, вакцин и препаратов для заместительной терапии, а также лечение наследственных заболеваний. Применение генной терапии в лечении такой патологии как первичные иммунодефициты является единственным терапевтическим методом, обеспечивающим полное излечение, что значительно улучшает качество жизни пациентов и снижает риск летального исхода. В последнее время рассматриваются новые варианты применения генной инженерии в трансплантологии и редактировании генома эмбрионов. Возможность применения этой инновационной технологии порождает множество биоэтических вопросов. Считаю, что анализ предполагаемых последствий применения генной инженерии для общества должен создавать рамки возможного вмешательства в геном организмов.
Среди многих достижений генной инженерии, получивших применение в медицине, наиболее значимое — получение человеческого инсулина в промышленных масштабах. Генные инженеры в качестве первой практической задачи решили клонировать ген инсулина. Клонированные гены человеческого инсулина были введены с плазмидой в бактериальную клетку, где начался синтез гормона, который природные микробные штаммы никогда не синтезировали.
Использование генно-инженерного инсулина не вызывало каких-либо патологических реакций в организме, в том числе и иммунопатологических, которые часто наблюдались у пациентов, использующих в терапии диабета инсулин животного происхождения. Масштабное использование генно-инженерного инсулина значительно снизило летальность от диабета, в особенности у пациентов детского возраста, так как именно у этой категории населения преимущественно развивается инсулинозависимый диабет 1 типа. Следующими разрабатываемыми генно-инженерными препаратами были интерфероны и интерлейкины, используемые в терапии вирусных и онкологических заболеваний.
Около 200 новых диагностических препаратов уже введены в медицинскую практику, и более 100 генно-инженерных лекарственных веществ находятся на стадии клинических исследований. Среди них лекарства, используемые в терапии артрозов, сердечно-сосудистых заболеваний, онкологических заболеваний.
Сферы использования генной инженерии в медицине значительно расширяются. Так актуальной является возможность применения генной инженерии в диагностике и терапии наследственных заболеваний.
В настоящее время известно более 4000 наследственных заболеваний, для большинства из которых не найдено эффективных способов лечения. Генные инженеры разрабатывают диагностические препараты, позволяющие обнаруживать генетические аномалии в период беременности, что дает возможность предотвратить рождение ребенка с генетической аномалией [4].
Так в 1989 году в Национальных Институтах Здоровья США впервые была предпринята попытка применить в клинической практике генную терапию для лечения пациентов с диагнозом тяжелая комбинированная иммунная недостаточность (ТКИН). Наиболее обнадеживающие результаты ожидают в тех случаях, когда заболевание обусловлено дефектом одного гена. В этом случае полагают, что удастся вводить нормальный ген в соматические клетки прицельно в то место на хромосоме, где находится дефектный ген. При гомологичной рекомбинации введенный ген заместит дефектный. Такой однократной процедуры в ряде случаев будет достаточно, чтобы излечить болезнь. Однако на практике очень трудно проконтролировать судьбу введенной в клетки ДНК, и на одно правильное встраивание в геном приходится более 1000 случайных. Разрабатывается и другой подход, когда введенный ген не заменяет дефектный, а компенсирует его функцию, встраиваясь в хромосому в другом месте.
Инновационной технологией в редактировании генома является технология CRISPR. По причине легкости редактирования генома с использованием технологии CRISPR существует значительный интерес к перспективам редактирования генома эмбриона человека.
Основной метод применения технологии CRISPR — доставка редактирующих агентов в клетки эмбриона, созданного путем оплодотворения in vitro. В последствии может оказаться более целесообразным и этически приемлемым редактировать гаметогенные клетки-предшественники у будущих родителей. Преимущество зародышевой коррекции аллелей генов, соответствующих патологическим состояниям, заключается в том, что они навсегда исчезнут из генома.
Еще одной сферой использования генной инженерии в медицине является CAR-T-терапия. На сегодняшний день одним из наиболее перспективных направлений в терапии онкологических заболеваний является адоптивная клеточная иммунотерапия. При проведении такой терапии выделяют, активируют и размножают аутологичные T-лимфоциты, а затем вводят их обратно пациенту, что приводит к частичной регрессии или эрадикации опухоли. Введение Т-клеток, модифицированных химерными антигенными рецепторами (CAR-T-клеток), является одним из наиболее активно развивающихся направлений иммуноонкологии [6]. CAR-T-клетки представляют собой генетически модифицированные собственные Т-клетки пациентов, которые содержат химерный антигенный рецептор. Этот рецептор содержит в себе часть антитела, специфического к антигену опухоли и часть, рецептора Т-клеток. С использованием CAR-T-терапии получены обнадеживающие результаты при гематологических опухолевых заболеваниях. Так, клинические испытания CAR-T-клеток, направленных против В-лимфоцитарного антигена CD19, показали их эффективность при лечении резистентных к химиотерапии опухолей В-клеточного происхождения.
Биоэтические проблемы
С точки зрения биоэтики возникает ряд вопросов о допустимости применения генной инженерии по отношению к человеку. Помимо биоэтических проблем существует ряд дополнительных вопросов как в непосредственно самой процедуре генетической модификации клеток организма человека, так и в отдаленных последствиях этой процедуры для отдельного человека и для человеческой популяции в целом.
Использование генной терапии в лечении наследственных заболеваний также сопровождается рядом проблем, так при лечении некоторых заболеваний отдаленным последствием такой терапии является развитие онкологических заболеваний.
Обратной стороной CAR-T-терапии является высокий риск возникновения системных и опасных для жизни побочных эффектов, в первую очередь, гиперцитокинемии (цитокиновый шторм, цитокиновый каскад, синдром выброса цитокинов и синдром лизиса опухоли). Эти осложнения могут спровоцировать развитие синдрома полиорганной недостаточности и, как следствие, привести к летальному исходу. Еще одна существенная проблема применения CAR-T-терапии – неспецифическая цитотоксичность, особенно актуальная в случае терапии солидных опухолей, к которым крайне сложно подобрать специфичные антигены. Неспецифическая цитотоксичность обусловлена развитием интенсивной и быстрой кросс-реакции введенных Т-клеток на здоровые клетки, что часто приводит к летальному исходу.
Примером этических суждений о конкретных последствиях может служить то, что граница между лечением и улучшением в области медицинской генетики не является очевидной, и улучшающая генная инженерия сама по себе может быть благом, но угрозу представляет социальное неравенство относительно распределения выгод генной инженерии так как это может привести к созданию серьезной и необратимой несправедливости. Любые генно-инженерные процедуры будут доступны в первую очередь для развитых стран, в то время как страны третьего мира будут лишены возможности использования генно-инженерных технологий.
Отдельные генетические последовательности, пригодные для улучшающей генной инженерии людей, в будущем могут быть запатентованы. Рынок улучшающей генной инженерии представляется перспективным: все люди будут заинтересованы в улучшении параметров своего потомства, но, иметь доступ к таким процедурам в первую очередь будут жители развитых стран.
Использование генной инженерии приведет не только к усугублению неравенства между жителями отдельных стран, но и к расслоению общества внутри этих стран. Генетически привилегированные люди могут стать не стареющими, здоровыми супер гениями безупречной физической красоты, отличающимися блестящим остроумием и обезоруживающим, умаляющим чувство собственного достоинства юмором, излучающими тепло, эмпатический шарм и ослабленную непоколебимость. Непривилегированные останутся сегодняшними людьми, возможно, не имеющими чувства самоуважения и страдающими от случайных приступов зависти. Мобильность между низшими и высшими классами может исчезнуть, и ребенок, рожденный в бедной семье, не имеющий генетического усовершенствования, не сможет успешно соперничать с супер детьми богатых родителей. Даже если не случится дискриминация или эксплуатация низшего класса, все еще будет что-то разрушительное в перспективе общества с такими крайними формами неравенства.
Примерами категорических суждений являются изменение уникальности и ценности личности человека, подвергшегося воздействию генной инженерии, а также дискриминация по отношению к еще не родившемуся ребенку, в случае проведения генно-инженерных процедур на зародышевой линии.
В воспроизводстве наиболее важными вопросами являются интересы ребенка, который не может дать свое предварительное согласие или свободно вступать в любую форму договора. Ведь эмбрион является будущей личностью, которая не давала разрешения на проведение опытов.
Еще одним вопросом является то, что сегодня никто не может даже приблизительно оценить те последствия, которые повлечет за собой размножение живой материи, созданной искусственно.
Экспертами в области биоэтики также рассматривается вероятность создания биологического оружия при использовании генной инженерии. Наиболее часто рассматриваются варианты создания генно-модифицированных организмов в качестве инфекционного агента, приводящего к развитию пандемий.
Также хочется осветить биоэтические вопросы генетического тестирования. Наиболее глубокие проблемы, относящиеся к прогнозированию, лежат в сфере здравоохранения, где проводится генетическое тестирование. Генные технологии имеют отношение к правам человека и в судебных случаях — например, при установлении отцовства или материнства и при идентификации подозреваемых преступников. Права человека нарушаются и тогда, когда насильственное или даже добровольное тестирование методами генной технологии может представлять угрозу частной жизни индивида, если информация помещается в общедоступную базу данных. Нарушение прав человека в данном случае состоит в том, что подозреваемым становится любой, кто отказывается подвергнуться ДНК-тестированию.
Двигаться вперед или остановиться? Предлагаем поразмышлять….
Автор — Валерия Пугачева
Лещинская, И. Б. Генетическая инженерия / И. Б. Лещинская // Соросовский образовательный журнал. – 1996. – № 1. – С. 32-394.
Мохов, А. А. Использование технологии геномного редактирования: достижения и перспективы / А. А. Мохов, А. А. Чапленко, А. Н. Яворский // Биомедицина. – 2019. – Т. 15, № 2. – С. 34-42.
Молекулярные подходы к безопасной и контролируемой Т-клеточной терапии / Р. С. Калинин [и др.] // Acta Naturae. – 2018. – Т. 10, № 2. – С. 17-25.
Воронцова, З. И. Философские и социокультурные проблемы биогенных технологий / З. И. Воронцова // Новые технологии. – 2009. – № 4. – С. 13-19.
Найдыш, В. М. Философские проблемы антропогенетики генной инженерии (статья вторая) / В. М. Найдыш, Е. Н. Гнатик // Вестник РУДН. – 2009. – № 3. – С. 31-38.
Воронцов, С. А. Морально-этические проблемы развития биотехнологии / С. А. Воронцов // Вестник молодежной науки. – 2017. – Т. 5, № 12. – С. 22-27.
International Union of Immunological Societies: 2017 Primary Immunodeficiency Diseases Committee Report on Inborn Errors of Immunity / C. Picard [et al.] // J. Clin. Immunol. – 2018. – Vol. 38, N 1. – P. 96-128.
Первичные иммунодефициты: принципы терапии и организации медицинской помощи / Н. Chapel [et al] // Frontiers in Immunology. – 2014. – Т. 5, № 12. – С. 1-15.

Обзор
иллюстрация автора статьи
Автор
Редакторы

Смертельные клешни
Человечество столкнулось с этой загадочной болезнью еще до нашей эры. Ее пытались понять и лечить ученые мужи в самых различных уголках мира: в Древнем Египте — Еберс, в Индии — Сушрута, Греции — Гиппократ. Все они и многие другие медики вели борьбу с опасным и серьезным противником — раком. И хоть эта битва продолжается до сих пор, сложно определить, есть ли шансы на полную и окончательную победу. Ведь чем больше мы изучаем болезнь, тем чаще возникают вопросы — можно ли полностью излечить рак? Как избежать болезни? Можно ли сделать лечение быстрым, доступным и недорогим?
Мутации: погибнуть или жить вечно?

Рисунок 1. Генетическая модель рака: рак толстой кишки. Первый шаг — потеря или инактивация двух аллелей гена АРS на пятой хромосоме. В случае семейного рака (familiar adenomatous polyposis, FAP) одна мутация гена АРС наследуется. Потеря обоих аллелей ведет к образованию доброкачественных аденом. Последующие мутации генов на 12, 17, 18 хромосомах доброкачественной аденомы могут привести к трансформации в злокачественную опухоль.
Очевидно, что развитие определенных видов рака включают в себя изменение большинства или даже всех этих генов и может проходить различными путями. Из этого следует, что каждую опухоль следует рассматривать как биологически уникальный объект. На сегодняшний день существуют специальные генетические информационные базы по раку, содержащих данные о 1,2 млн. мутаций из 8207 образцов тканей, относящихся к 20 видам опухолей: атлас Ракового Генома (Cancer Genome Atlas) и каталог соматических мутаций при раке (Catalogue of Somatic Mutations in Cancer, COSMIC) [2].

Рисунок 2. Распространение метастазов
Однако клетки вооружены специальными механизмами, защищающими от развития опухолей:
-
— механизм эпигенетических модификаций, который контролирует нормальный рост и правильное развитие организма. Любые нарушения в метилировании определенных генов могут поспособствовать возникновению рака. Например, в исследованиях было обнаружено, что потеря импринтинга после инактивации материнского аллеля гена IgF2 увеличивает риск развития рака прямой кишки в 3–5 раз [3]; (например, однонуклеотидная эксцизионная репарация защищает ДНК от мутаций, вызванных канцерогенными агентами) [4]; — используют специфичные белки-мессенжеры, такие как ATM, ATR и комплекс RAD17-RFC для поиска повреждений в молекулах ДНК. Сигнальные белки активируют р53 и инактивируют циклин-зависимые киназы, что, в свою очередь, ингибирует клеточный цикл от G1 до S (G1/S точка рестрикции), репликацию ДНК в S-фазе и G2-фазу (G2/M-точка рестрикции) [5];
- программируемая клеточная смерть — апоптоз и связанные регуляторные гены имеют огромное влияние на возникновение злокачественного фенотипа. Некоторые онкогенные мутации нарушают апоптоз, что приводит к инициации канцерогенеза и метастазирования [6];
- иммунная система — активация естественных киллеров (NK — natural killer cells), макрофагов, нейтрофилов, эозинофилов и специфических Т-цитотоксических клеток; синтез цитокинов и специфических антител [7].
Традиционные методы и их недостатки
- хирургическая (полное удаление опухоли). Используется, когда опухоль имеет небольшие размеры и хорошо локализована. Также удаляют часть тканей, которые контактируют со злокачественным новообразованием. Метод не применяется при наличии метастазов;
- лучевая — облучение опухоли радиоактивными частицами для остановки и предотвращения деления раковых клеток. Здоровые клетки тоже чувствительны к этому излучению и часто погибают;
- химиотерапия — используются лекарства, тормозящие рост быстро делящихся клеток. Лекарства оказывают негативное воздействие и на нормальные клетки.
Вышеописанные подходы не всегда могут избавить больного от рака. Часто при хирургическом лечении остаются единичные раковые клетки, и опухоль может дать рецидив, а при химиотерапии и лучевой терапии возникают побочные эффекты (снижение иммунитета, анемия, выпадение волос и др.), которые приводят к серьезным последствиям, а часто и к смерти пациента. Тем не менее, с каждым годом улучшаются традиционные и появляются новые методы лечения, которые могут победить рак, такие как биологическая терапия, гормональная терапия, использование стволовых клеток, трансплантация костного мозга, а также различные поддерживающие терапии. Наиболее перспективной считается генная терапия, так как она направлена на первопричину рака — компенсацию неправильной работы определенных генов.
Генная терапия как перспектива
По данным PubMed, интерес к генной терапии (ГТ) раковых заболеваний стремительно растет, и на сегодняшний день ГТ объединяет ряд методик, которые оперируют с раковыми клетками и в организме (in vivo) и вне его (ex vivo) (рис. 3).

Рисунок 3. Две основные стратегии генной терапии. ex vivo — генетический материал с помощью векторов переносится в клетки, выращиваемые в культуре (трансдукция), а затем трансгенные клетки вводят реципиенту; in vivo — введение вектора с нужным геном в определенную ткань или орган.
Вирусные векторы
В качестве вирусных векторов используют ретровирусы, аденовирусы, аденоассоциированные вирусы, лентивирусы, вирусы герпеса и другие. Эти вирусы отличаются по эффективности трансдукции, по взаимодействию с клетками (распознавание и заражение) и ДНК. Главным критерием является безопасность и отсутствие риска неконтролируемого распространения вирусной ДНК: если гены вставляются в неправильном месте генома человека, они могут создать вредные мутации и инициировать развитие опухоли. Также важно учитывать уровень экспрессии перенесенных генов, чтобы предотвратить воспалительные или иммунные реакции организма при гиперсинтезе целевых белков (табл. 1).
| Вектор | Краткое описание |
|---|---|
| Вирус кори (measles virus) | содержит отрицательную последовательность РНК, которая не вызывает защитного ответа в раковых клетках |
| Вирус простого герпеса (HSV-1) | может переносить длинные последовательности трансгенов |
| Лентивирус | производный от ВИЧ, может интегрировать гены в неделящиеся клетки |
| Ретровирус (RCR) | не способный к самостоятельной репликации, обеспечивает эффективное встраивание чужеродной ДНК в геном и постоянство генетических изменений |
| Обезьяний пенистый вирус (SFV) | новый РНК-вектор, который передает трансген в опухоль и стимулирует его экспрессию |
| Рекомбинантный аденовирус (rAdv) | обеспечивает эффективную трансфекцию, но возможна сильная иммунная реакция |
| Рекомбинантный аденоассоциированный вирус (rAAV) | способен к трансфекции многих типов клеток |
Невирусные векторы
Синтетические катионные липосомы в настоящее время признаны перспективным способом доставки функциональных генов. Положительный заряд на поверхности частиц обеспечивает слияние с отрицательно заряженными клеточными мембранами. Катионные липосомы нейтрализуют отрицательный заряд цепи ДНК, делают более компактной ее пространственную структуру и способствуют эффективной конденсации. Плазмидно-липосомный комплекс имеет ряд важных достоинств: могут вмещать генетические конструкции практически неограниченных размеров, отсутствует риск репликации или рекомбинации, практически не вызывает иммунного ответа в организме хозяина. Недостаток этой системы состоит в низкой продолжительности терапевтического эффекта, а при повторном введении могут появляться побочные эффекты [12].
Электропорация является популярным методом невирусной доставки ДНК, довольно простым и не вызывающим иммунного ответа. С помощью индуцированных электрических импульсов на поверхности клеток образуются поры, и плазмидные ДНК легко проникают во внутриклеточное пространство [13]. Генная терапия іn vivo с использованием электропорации доказала свою эффективность в ряде экспериментов на мышиных опухолях. При этом можно переносить любые гены, например, гены цитокинов (IL-12) и цитотоксические гены (TRAIL), что способствует развитию широкого спектра терапевтических стратегий. Кроме того, этот подход может быть эффективным для лечения и метастатических, и первичных опухолей [14].
Выбор техники
В зависимости от типа опухоли и ее прогрессии, для пациента подбирается наиболее эффективная методика лечения. На сегодняшний день разработаны новые перспективные техники генной терапии против рака, среди которых онколитическая вирусная ГТ, пролекарственная ГТ (prodrug therapy), иммунотерапия, ГТ с использованием стволовых клеток.
Онколитическая вирусная генная терапия
Для этой методики используются вирусы, которые с помощью специальных генетических манипуляций становятся онколитическими — перестают размножаться в здоровых клетках и воздействуют только на опухолевые. Хорошим примером такой терапии является ONYX-015 — модифицированный аденовирус, который не экспрессирует белок Е1В. При отсутствии этого белка вирус не может реплицироваться в клетках с нормальным геном p53 [15]. Два вектора, сконструированных на базе вируса простого герпеса (HSV-1) — G207 и NV1020 — также несут в себе мутации нескольких генов, чтобы реплицироваться только в раковых клетках [16]. Большим преимуществом техники является то, что при проведении внутривенных инъекций онколитические вирусы разносятся с кровью по всему организму и могут бороться с метастазами. Основные проблемы, которые возникают при работе с вирусами — это возможный риск возникновения иммунного ответа в организме реципиента, а также неконтролируемое встраивание генетических конструкций в геном здоровых клеток, и, как следствие, возникновение раковой опухоли.
Геноопосредованная ферментативная пролекарственная терапия
Минус терапии состоит в том, что в опухолях присутствуют все защитные механизмы, свойственные здоровым клеткам, и они постепенно адаптируются к повреждающим факторам и пролекарству. Процессу адаптации способствует экспрессия цитокинов (аутокринная регуляция), факторов регуляции клеточного цикла (отбор самых стойких раковых клонов), MDR-гена (отвечает за восприимчивость к некоторым медикаментам).
Иммунотерапия
Благодаря генной терапии, в последнее время начала активно развиваться иммунотерапия — новый подход для лечения рака с помощью противоопухолевых вакцин. Основная стратегия метода — активная иммунизация организма против раковых антигенов (ТАА) с помощью технологии переноса генов [18].
Главным отличием рекомбинантных вакцин от других препаратов является то, что они помогают иммунной системе пациента распознавать раковые клетки и уничтожать их. На первом этапе раковые клетки получают из организма реципиента (аутологичные клетки) или из специальных клеточных линий (аллогенные клетки), а затем выращивают их в пробирке. Для того чтобы эти клетки могли узнаваться иммунной системой, вводят один или несколько генов, которые производят иммуностимулирующие молекулы (цитокины) или белки с повышенным количеством антигенов. После этих модификаций клетки продолжают культивировать, затем проводят лизис и получают готовую вакцину.
Когда было доказано, что большинство видов рака имеют специфические антигены и способны индуцировать свои защитные механизмы [22], была выдвинута гипотеза, что блокировка иммунной системы раковых клеток облегчит отторжение опухоли. Поэтому для производства большинства противоопухолевых вакцин в качестве источника антигенов используют опухолевые клетки пациента или специальные аллогенные клетки. Основные проблемы иммунотерапии опухолей — вероятность возникновения аутоиммунных реакций в организме больного, отсутствие противоопухолевого ответа, иммуностимуляция роста опухоли и другие.
Стволовые клетки
Заключение
Если подвести итоги, можно с уверенностью говорить, что наступает эпоха персонализированной медицины, когда для лечения каждого онкобольного будет подбираться определенная эффективная терапия. Уже разрабатываются индивидуальные программы лечения, которые обеспечивают своевременный и правильный уход и приводят к значительному улучшению состояния пациентов. Эволюционные подходы для персонализированной онкологии, такие как геномный анализ, производство таргетных препаратов, генная терапия рака и молекулярная диагностика с использованием биомаркеров уже приносят свои плоды [17].
В конце ноября мир облетела весть о том, что в Китае появились на свет трансгенные дети. О чем идет речь, были ли еще подобные эксперименты, и почему общество не всегда приветствует изменение генома человека?
Ученый Хе Цзянькуй (He Jiankui) из города Шэньчжэнь заявил, что создал генетически модифицированные эмбрионы, а женщина, которая их получила, забеременела и недавно родила двух девочек. Перед открытием научной конференции в Гонконге Хе Цзянькуй также рассказал коллегам, что подсаживал измененные эмбрионы семерым бесплодным женщинам, но выносила и родила только одна.
Каких-либо подтверждений в научной литературе этому факту пока нет, однако ученый подтвердил свои слова в интервью агентству Associated Press.
Доктор Хе сообщил журналистам, что им был создан эмбрион, геном которого отредактирован таким образом, что в случае попадания вируса иммунодефицита человека (ВИЧ) в организм человек не будет носителем этой инфекции, и у него не разовьется СПИД.
Сообщается, что после широкой огласки этого факта собственный университет приостановил деятельность ученого, в руководстве научного учреждения заявили, что ничего не знают об эксперименте. Но эта информация спровоцировала очередную острую дискуссию о законодательном регулировании таких экспериментов и их моральной стороне.
Это недобросовестная практика. эксперименты на людях — это аморально или этически необоснованно,
— заявил в интервью агентству AP доктор Киран Мусунуру (Kiran Musunuru) из Университета Пенсильвании, эксперт по генному редактированию и редактор журнала о генетике.
Это слишком преждевременно, — считает доктор Эрик Топол (Eric Topol), глава Научно-исследовательского института Скриппса в Калифорнии. — Тут мы, по сути, создаем "инструкцию по эксплуатации" человеческого существа. Это серьезная задача.
Другой известный ученый из Гарвардского университета Джордж Черч (George Church) встал на защиту генного редактирования как средства от ВИЧ. Он назвал вирус крупнейшей и растущей угрозой здоровью людей. Иными словами, ученый считает возможной модификацию человека для защиты от вируса уже на данном этапе развития медицины.
Другие наблюдатели задаются вопросом о том, насколько обоснованно вмешательство в геном в этом конкретном случае? Ученые давно работают над созданием вакцины против ВИЧ, но даже ее испытания — процедура небезопасная.
Однако китайский эксперимент на реальных людях — не первая попытка внесения изменений в геном человека.
Репродуктивная медицина
В конце прошлого века мир облетела сенсация: ученые из штата Нью-Джерси в США помогли родиться детям, имеющим ДНК трех родителей.
Действительно, в Медицинском центре Института репродуктивной медицины и репродуктологии Святого Варнавы благодаря методу так называемой ооплазменной трансплантации в 1997 году на свет появились 15 здоровых младенцев. Но речь шла о новом способе лечения бесплодия, чуть более усовершенствованном ЭКО. Цитоплазму (желеобразный материал, окружающий ядро клетки) трансплантировали из донорской яйцеклетки в яйцеклетку бесплодной женщины, которую уже затем оплодотворили и подсадили обратно в организм будущей матери. Таким образом, считают ученые, они помогли забеременеть женщинам, имеющим дефект яйцеклетки.
Споры о том, является ли эта технология недопустимым вмешательством в геном, продолжаются.
Модифицированные космонавты
Много лет ведутся дискуссии и о том, можно ли проводить генетический отбор среди людей тех или иных профессий. Или вообще как-то изменять их геном для повышения уровня их профессионализма, когда такое станет возможным.
Вентер также заявил о возможности изменять геном космонавтов с тем, чтобы они легче справлялись со сложностями космического полета. Например, бактерия Deinococcus radiodurans выдерживает (ее ДНК восстанавливается) уровень радиации в семь тысяч раз выше того, который убивает человека. Если ученые смогут перенести ее ДНК в геном космонавта, люди, как он считает, забудут о проблеме сильной солнечной радиации в космосе.
Генная терапия
Как правило, при разработке и подборе генной терапии для тяжелых болезней ученые среди прочего выясняют: будет ли безопасна экспрессия (преобразование информации в белок или РНК) нового гена, насколько безопасно попадание реконструированного гена в другие ткани, как долго будет функционировать модифицированная клетка, будут ли атакованы новые клетки иммунной системой организма хозяина.
Считается, что большие перспективы есть у лечения таким способом онкологических заболеваний, тяжелых иммунодефицитов, сахарного диабета и других серьезных недугов.
Однако особенностью генной терапии является экспериментальный подход. Это означает, что до конца не изученными являются последствия, которые влекут за собой манипуляции с генетическим материалом, отмечают юристы.
В целом, по мнению исследователей, важно четко различать две разные цели генной терапии: коррекцию генетических дефектов в клетках уже родившегося человека и коррекцию в клетках зародыша или на самых ранних стадиях развития зиготы (клетки, образующейся в результате оплодотворения). До сих пор первая цель практически не вызывала сомнений, тогда как второй вариант большинство исследователей либо отвергают, либо относятся к нему весьма скептически.
Но ни предлагаемая модификация генома космонавта, ни китайский проект не имеют отношения к генной терапии, так как в этих случаях речь идет об изменении генома здорового и даже не предрасположенного к какому-то заболеванию человека или эмбриона.
В чем вопрос?
Большая часть замечаний к проектам изменения генома человека содержит одну основную мысль: любая модификация человеческого генома должна иметь серьезные обоснования и использоваться в том случае, когда другие способы неэффективны.
Вмешательство в геном человека, направленное на его модификацию, может быть осуществлено только в профилактических, терапевтических или диагностических целях и только при условии, что подобное вмешательство не направлено на изменение генома наследников данного человека,
— гласит международная Конвенция о правах человека и биомедицине, принятая Комитетом министров Совета Европы в 1996 году. Россия пока не присоединилась к этому документу.
Общественные организации, например, известная американская ETC и сотни тысяч ее единомышленников во всем мире считают, что такие модификации не должны быть уделом бизнес-компаний, и на них не должно распространяться патентное право.
Активисты также уверены, что если геном человека подвергается изменению, это должно происходить в рамках жесткого законодательного регулирования.
Подписывайтесь на канал "Царьград" в Яндекс.Дзен
и первыми узнавайте о главных новостях и важнейших событиях дня.

- получать рекомбинантные РНК и ДНК;
- выделять гены из организма (клеток);
- осуществлять манипуляции с генами и вводить их в другие организмы.
Плазмида — внехромосомная молекула ДНК бактерий или дрожжей, как правило, кольцевая, способная к автономной репликации. В генной инженерии используется как вектор.
Значение генной инженерии для медицины
Продукты генной инженерии как‑то исподволь, но прочно вошли в медицинскую практику: лекарства для лечения редких болезней, рекомбинантный инсулин, вакцины против вируса гепатита В — без них современному врачу трудно представить себе мир. Генно-инженерными методами производят некоторые высокоселективные аллергены для кожных проб, некоторые реагенты для иммуноферментного анализа и многое другое. На этапе доклинических испытаний медикаментов приносятся в жертву миллионы генетически измененных животных.
Ниже в порядке усложнения технологии и степени отрыва от реальности представлены основные примеры применения генной инженерии в медицине.
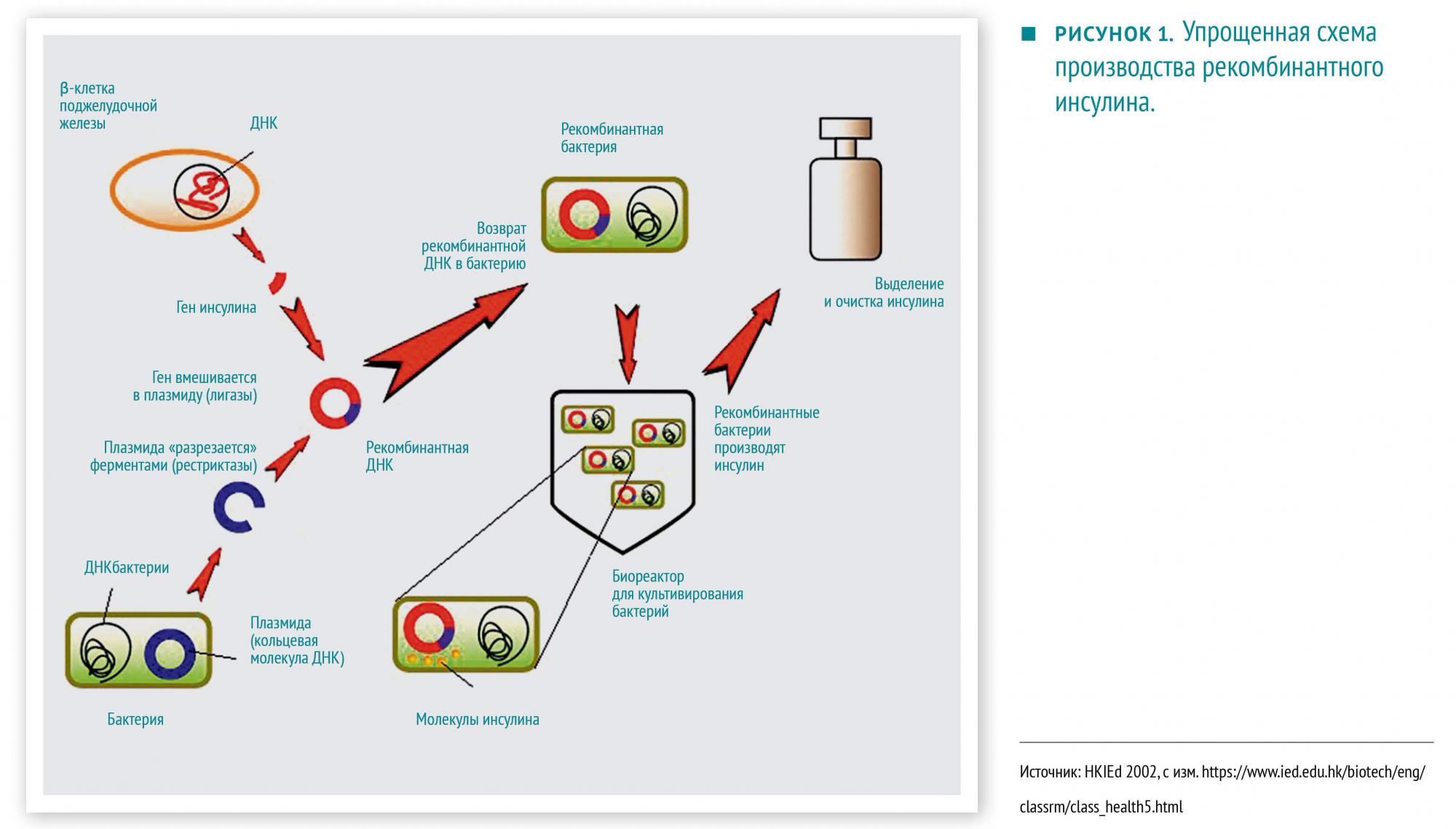
Сегодня на вооружении у врачей есть ряд препаратов, для которых критически важно точное соответствие аналогам в организме. Это препараты заместительной терапии при эндокринологических заболеваниях, гематологических болезнях (эритропоэтин, гранулоцитарный колониестимулирующий фактор, факторы свертывания крови, некоторые моноклональные антитела и др.), вирусных инфекциях (интерфероны), инфаркте миокарда и ишемическом инсульте (фибринолитики) и многих других.
- Идентичность веществ по структуре человеческим. Инсулин, производившийся из поджелудочных желез свиней и крупного рогатого скота, отличался от человеческого по одной и трем аминокислотам, соответственно, это часто приводило к нежелательным реакциям.
- Более низкая цена и удобное производство. Для получения 200 г сухого вещества того же инсулина требуется поджелудочных желез от более чем 6000 коров (или свиней). То же количество может быть произведено бактериями, содержащимися в 1000 л культуральной жидкости.
- Отказ от специфического сырья, которое полностью не очищается, например, гипофизы трупов использовались для получения соматотропного гормона, а моча женщин в менопаузе — традиционный источник фолликулостимулирующего и лютеинизирующего гормонов.
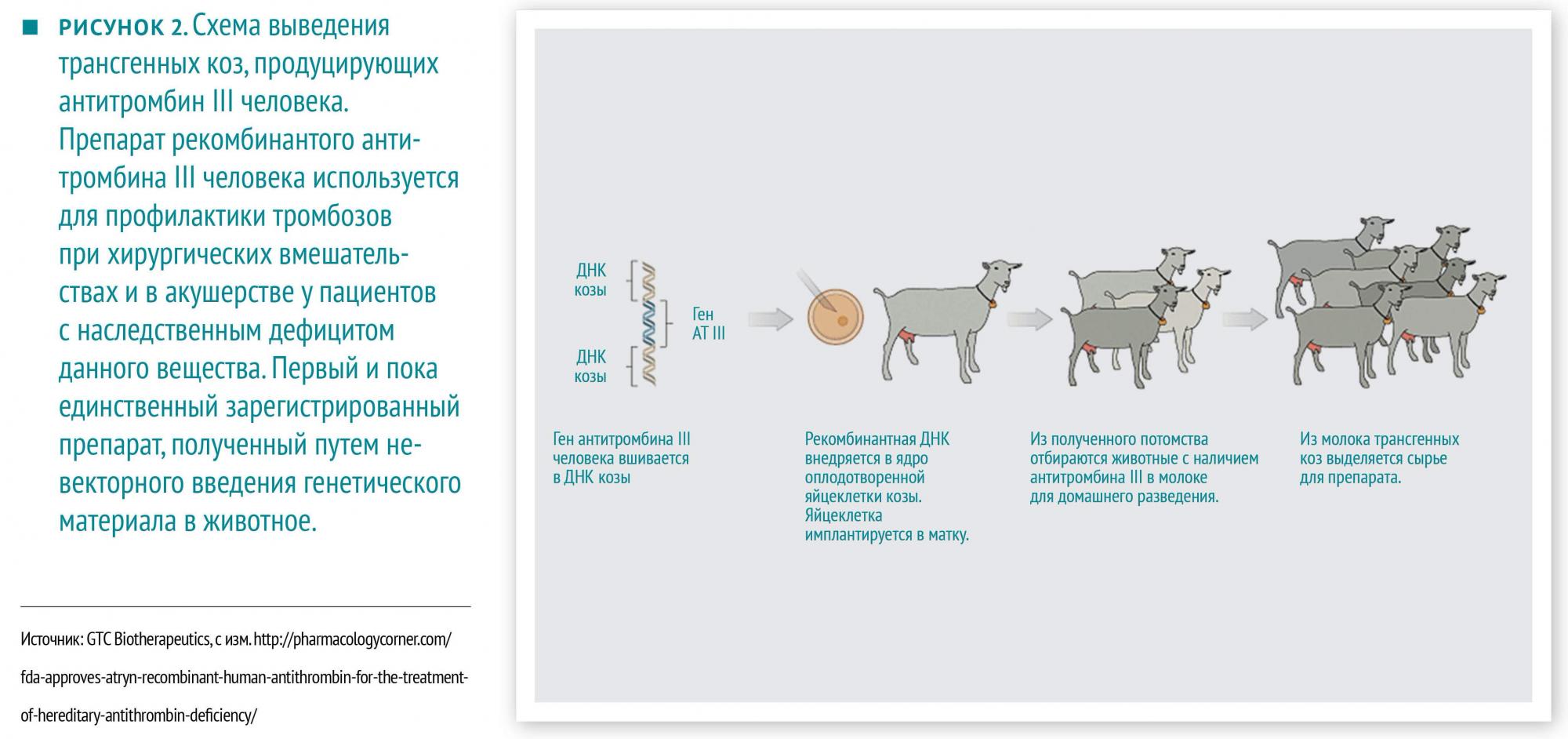
Дальнейшее развитие данной отрасли науки привело к появлению генной терапии. Тут уже всё по‑взрослому, хотя пока и экспериментально. Устраняются посредники типа бактерий, коз и бананов. Как правило, так пытаются лечить тяжелые и редкие наследственные или спорадически возникающие заболевания, патогенез которых обусловлен дефектом какого‑либо одного гена, например, первичные иммунодефициты. При этом другие методы лечения неэффективны или труднодоступны, и терять, в общем, нечего. Результаты впечатляющие, но и цена нежелательных реакций высока.
В начале 2000‑х гг. в Англии и Франции проводились клинические испытания генной терапии Х-сцепленного тяжелого комбинированного иммунодефицита, при котором нарушен синтез общего рецептора нескольких цитокинов, отвечающих за дифференцировку и пролиферацию лимфоцитов. При отсутствии аллогенной трансплантации гемопоэтических стволовых клеток дети умирают от тяжелых инфекций в 1‑й год жизни. В ходе испытаний 20 маленьким пациентам были трансплантированы собственные (то есть дефектные) стволовые клетки костного мозга, в которые был введен ретровирусный вектор, несущий ген нормального белка рецептора и вирусный промотор. Блестящие результаты — восстановление функций иммунной системы, отсутствие рецидива в течение всего периода наблюдения (4–11 лет) — были омрачены развитием Т-клеточного острого лимфобластного лейкоза у 5 детей (известно, что один ребенок погиб). Выяснилось, что ген белка и вирусный промотор у всех 5 заболевших встроились в ДНК рядом с протоонкогенами, т. е. генами, при усилении экспрессии которых возможно неконтролируемое деление клеток. Встраивание генного материала в ДНК хозяина в наше время в основном дело случая.
Первые ошибки были учтены, в настоящее время исследователи выбирают неонкогенные вирусы с известными местами встраивания в человеческую ДНК, или плазмиды.
В общем, в генной инженерии остается достаточно технологических трудностей, иммунологического несоответствия, опасности инфицирования человека вирусами животных с потенциальным появлением новых болезней. Всего этого упрямые и беспринципные ученые не очень‑то и боятся. Понятно, что у человечества хватит мозгов, чтобы как‑то решить эти проблемы, остается надеяться, что хватит ума не наделать новых.
Читайте также:

