Гэрб эндоскопически негативная с кандидозным эзофагитом
Обновлено: 17.04.2024
Термином гастроэзофагеальная рефлюксная болезнь (ГЭРБ) обозначают хроническое рецидивирующее заболевание, причиной развития которого является патологический заброс (рефлюкс) содержимого желудка в пищевод. ГЭРБ (наряду с эзофагоспазмом, функциональной диспепсией, дискинезиями двенадцатиперстной кишки, желчевыводящих путей, синдромом раздраженного кишечника) входит в группу заболеваний, основным патогенетическим механизмом развития которых является нарушение моторики желудочно-кишечного тракта.
В нормальных условиях в нижней трети пищевода рН составляет 6,0 (что регистрируется при пищеводной рН-метрии). О наличии рефлюкса свидетельствует значение рН < 4,0 (кислотный рефлюкс) или рН >7,0 (щелочной, или желчный рефлюкс).
Гастроэзофагеальный рефлюкс возможен как физиологическое явление, его регистрируют и у здоровых людей, преимущественно в дневное время после или между приемами пищи и значительно реже в ночное время (в горизонтальном положении). При физиологическом рефлюксе время, в течение которого в пищеводе значение рН < 4,0, составляет не более 5% общего времени пищеводной рН-метрии. Некоторые авторы несколько по-иному формулируют критерии нормальных показателей этого исследования, в частности, допускают наличие в физиологических условиях не более двух эпизодов рефлюкса в течение суток, с продолжительностью каждого не более 5 мин.
Патогенез
В развитии ГЭРБ участвует комплекс патологических факторов:
- снижение непосредственно функции антирефлюксного барьера (снижение давления в нижнем пищеводном сфинктере, увеличение числа эпизодов его спонтанного расслабления);
- снижение клиренса пищевода (химического – вследствие уменьшения продукции нейтрализующих биологических жидкостей – слюны и бикарбонатов слизи; механического – вследствие снижения перистальтической активности и тонуса грудного отдела пищевода);
- агрессивные свойства рефлюктата (желудочный сок, особенно при гиперсекреции соляной кислоты; щелочные жидкости – желчь, панкреатический сок);
- снижение тканевой резистентности пищевода (нарушение ее функциональной и структурной целостности, кровоснабжения).
К наиболее важным естественным антирефлюксным механизмам, которые способствуют поддержанию оптимального отношения внутрипищеводного давления к внутрижелудочному на уровне выше 1 (“состоятельности кардии”), относятся давление в нижнем пищеводном сфинктере и анатомическая конфигурация (длина) брюшного отдела пищевода. Кроме гладкомышечного нижнего пищеводного сфинктера в формировании “запирательного” антирефлюксного барьера участвуют ножки пищеводного отверстия диафрагмы и угол Гиса.
Выделяют несостоятельность антирефлюксных механизмов первичного и вторичного характера.
Первичный обусловлен снижением давления в нижнем пищеводном сфинктере в результате наличия врожденного дефекта гладкомышечных клеток или идиопатического нарушения иннервации сфинктера.
Вторичный – разнообразными причинами, в частности, такими как курение, злоупотребление алкоголем, кофе, приемом препаратов, обладающих способностью снижать тонус гладкой мускулатуры (нитраты, антагонисты кальция, теофиллин, опиаты, бензодиазепины), беременностью, склеродермией, висцеральной полинейропатией, деструктуризацией кардиального жома.
Частичная или полная деструктуризация кардиального жома – приобретенное состояние, чаще является следствием развития грыжи пищеводного отверстия диафрагмы (при этом ножки диафрагмы не участвуют в антирефлюксном механизме, сглаживается угол Гиса), миотомией нижнего пищеводного сфинктера или пневмокардиодилатацией (при лечении ахалазии кардии).
Заброс желудочно-кишечного содержимого в пищевод поддерживается рядом факторов: увеличением объема желудочного содержимого (в результате гиперсекреции, приема больших количеств пищи, гастростаза), горизонтальным и наклонным положением тела, повышением внутрибрюшинного давления (избыточная масса тела, беременность, асцит и пр.).
Клиническая картина
Выраженность клинических проявлений и тяжесть течения ГЭРБ зависит от качеств рефлюктата, частоты и продолжительности рефлюксов.
При тщательных, целенаправленных опросах симптомы ГЭРБ выявляются у 20–40% жителей развитых стран (по некоторым данным, почти у половины взрослого населения). По распространенности это заболевание можно сравнить с функциональной (неязвенной) диспепсией. Наиболее характерными клиническими признаками являются изжога, отрыжка, срыгивание, нередко – боли в грудной клетке, требующие дифференцирования со стенокардитическими. Эзофагиты на фоне ГЭРБ могут сопровождаться одинофагией (болезненностью при глотании). Ежедневно симптомы ГЭРБ испытывают до 10% населения, еженедельно – 30%, ежемесячно – 50% взрослого населения.
Эндоскопически позитивная форма ГЭРБ – рефлюкс-эзофагит – представляет собой воспалительные и эрозивно-язвенные изменения слизистой оболочки дистального отдела пищевода, выявляемые при эзофагоскопии. Явления рефлюкс-эзофагита обнаруживается у 6–12% всех пациентов, которым проводится эндоскопическое исследование верхних отделов желудочно-кишечного тракта. Это составляет примерно 50% всех пациентов с клиническими симптомами ГЭРБ.
При наличии клинической симптоматики отсутствие видимых изменений слизистой пищевода при эзофагоскопии при не исключает наличия ГЭРБ.
Прогноз пациента, страдающего ГЭРБ, определяется, в основном, ее осложениями. Они наблюдаются у 10–15% больных. При тяжелом течении рефлюкс-эзофагита возможно развитие пептических язв и стриктур пищевода, пищеводных кровотечений, перфорации. Эзофагит в ряде случаев сопровождается структурной перестройкой эпителия слизистой оболочки пищевода (по типу желудочной или кишечной метаплазии) с исходом в так называемый пищевод Баррета, который является фоном для развития аденокарциномы.
Пищевод Баррета, по разным данным, отмечается у 8–20% взрослых и 7–13% детей с клинически манифестным течением ГЭРБ. Существуют доказательства его патогенетической связи с ГЭРБ, полученные в эксперименте и при клинических исследованиях. Так, у пациентов с пищеводом Баррета, как правило, обнаруживается значительное снижение давления в нижнем пищеводном сфинктере и перистальтической активности пищевода. Повреждение сквамозного эпителия пищевода соляной кислотой, пепсином, а также дуоденальным содержимым предрасполагает к формированию метаплазии.
Курируя больного, длительно страдающего рефлюкс-эзофагитом, необходимо проводить тщательный анализ жалоб для своевременного выявления дисфагии – свидетельства развития стриктуры или опухоли пищевода.
В последние годы в клинической картине ГЭРБ стали выделять ее “внепищеводные проявления”. Показано, что желудочно-пищеводный рефлюкс играет значительную, а иногда и определяющую роль в патогенезе рецидивирующих пневмоний, хронического бронхита, бронхообструктивного синдрома, пароксизмального ночного апноэ, рефлюксного ларингита и фарингита, поражения зубов. ГЭРБ может привести к возникновению экстрасистолии и нарушениям проводимости. Внепищеводные проявления могут иметь место и при эндоскопически негативном течении.
Диагностика
Наиболее старым из методов обследования является рентгенологическое исследование, которое имеет ограниченное применение. Рентгеноскопия важна при диагностике грыжи пищеводного отверстия диафрагмы – весьма частой причины развития недостаточности кардии.
Эзофагоскопия позволяет диагностировать эндоскопически позитивные формы ГЭРБ (эзофагиты). Тест Берштейна, заключающийся в введении 0,1 н раствора HCl в пищевод, полезен в диагностике эндоскопически негативных форм (введение кислоты сопровождается появлением клинической симптоматики).
Высокоинформативным специальным тестом, применяемым в диагностике ГЭРБ, является 24-часовая рН-метрия пищевода. Эта методика позволяет не только установить факт наличия патологического рефлюкса, но и оценить его характер (кислый, щелочной), продолжительность эпизодов, проанализировать их связь с различными факторами и субъективными ощущениями, рекомендовать индивидуальный режим приема лекарственных препаратов.
Эзофаготонокимография позволяет определить тонус в различных отделах пищевода, давление в нижнем пищеводном сфинктере.
Лечение
Лечение, назначаемое при ГЭРБ, должно быть направленным на: уменьшение выраженности рефлюкса, снижение повреждающих свойств рефлюктата, повышение пищеводного клиренса, защиту слизистой оболочки пищевода. Больным рекомендуют общие меры по устранению патологического заброса желудочного содержимого в пищевод (приподнять головной конец кровати; не ложиться сразу после еды; ограничить потребление жирной пищи; бросить курить; уменьшить потребление алкоголя и пр.). При неэффективности подобных мероприятий назначают антациды. При эрозивно-язвенных эзофагитах предписывают прием антисекреторных препаратов (Н2- блокаторов, ингибиторов протонной помпы).
Прокинетики повышают давление в нижнем пищеводном сфинктере, пищеводный клиренс и уменьшают внутрижелудочное давление (благодаря восстановлению желудочной аккомодации к приему пищи, улучшению опорожнения желудка за счет нормализации антрально-дуоденальной координации, устранению дуодено-гастрального рефлюкса). Таким образом, назначение препаратов этого класса при ГЭРБ патогенетически обосновано.
Без применения прокинетиков попытки лечения гастроэзофагеального рефлюкса и эзофагита, развившихся на фоне системной склеродермии с поражением пищевода, сахарного диабета, осложнившегося висцеральной полинейропатией. Прокинетики, безусловно, показаны для терапии ГЭРБ, сопровождающейся внепищеводными проявлениями.
Лекарственные средства этого ряда достигают эффекта либо посредством стимуляции холинорецепторов (ингибиторы холинэстеразы), стимуляции серотониновых рецепторов, либо за счет блокады дофаминовых рецепторов (метоклопрамид, домперидон). Холиномиметики и ингибиторы холинэстеразы назначают редко вследствие наличия у них системных побочных эффектов. Исследуются в экспериментах прокинетики из других групп: антагонисты холецистокинина, агонисты k-рецепторов и другие, однако они в настоящее время не находят клинического применения.
Метоклопрамид (Церукал) в течение многих лет положительно зарекомендовал себя в практике лечения заболеваний пищеварительной системы, сопровождающихся расстройствами моторики. Он является блокатором центральных и периферических дофаминовых рецепторов, и такое “дублированное” действие обеспечивает достаточно мощный прокинетический потенциал. В частности, препарат повышает тонус нижнего пищеводного сфинктера, усиливает сократительную способность желудка, улучшает координированность сокращений антрального отдела желудка и двенадцатиперстной кишки, предупреждает возникновение дуоденогастрального рефлюкса. Все эти эффекты способствуют снижению внутрижелудочного давления, уменьшению частоты и объема рефлюксов.
После приема внутрь действие метоклопрамида наступает быстро: максимальная концентрация в плазме крови отмечается уже спустя 1 ч. Высокая биологическая доступность препарата (80%) и небольшой период полувыведения (в течение 24 ч через почки выводится 80% активного вещества) определяют его оптимальные фармакокинетические параметры.
Метоклопрамид (Церукал) хорошо переносится пациентами, развивающиеся побочные действия обычно лишь умеренно выражены и носят обратимый характер. Препарат доступен по цене большинству больных.
При терапии ГЭРБ метоклопрамид обычно назначают внутрь: взрослым и подросткам старше 14 лет по 10–15 мг 3–4 раза в сутки (средняя продолжительность курса лечения – 4–6 нед, в отдельных случаях – до 6 мес). Препарат следует принимать за 30 мин до приема пищи. Для детей в возрасте до 14 лет рекомендуемая однократная доза составляет 0,1 мг метоклопрамида на 1 кг массы тела. При пониженной функции почек дозу препарата корригируют.
Литература
1. Гастроэнтерология (справочник). Под ред. В.Т. Ивашкина, С.И. Рапопорта М.: Русский врач, 1998; 96.
2. Шептулин А.А., Голочевская В.С. Прокинетики в лечении гастроэнтерологических заболеваний. Клин. фармакол. тер., 1996; 5 (1): 94–6.
3. Шептулин А.А., Трухманов А.С. Новые возможности диагностики и лечения гастроэзофагеального рефлюкса и ахалазии кардии. Клиническая медицина, 1998; 76(5): 15–9.
4. Абидин З.У., Ивашкин В.Т., Шептулин А.А., Трухманов А.С., Охлобыстин А.В. Роль 24-часового мониторирования внутрипищеводного рН в диагностике гастроэзофагеального рефлюкса и оценке эффективности лечения. Клин. мед., 1999; 77(7): 39–42.
5. Kahrilas PJ. Gastroesophageal reflux disease. JAMA 1996; 276: 983–8.
6. Tytgat GNJ, Janssens J, Reynolds J, Wienbeck M. Update on the pathophysiology and management of gastro-oesophageal reflux disease: the role of prokinetic therapy. Eur J Gastroenterol Hepatol 1996; 8: 603–11.
7. Schindibeck NE, Klauser AG, Voderholzer WA, et al. Empiric therapy for gastroesophageal reflux disease E Arch Intern Med 1995; 155: 1808–12.
7. Freston J., Malagelada J., Petersen H. et al. Critical issues in the management of gastroesophageal reflux disease. Eur. J. Gastroenterol. Hepatol. 1995; 7: 557–86.
8. Harrison’s Principles of Internal Medicine. Fourteenth Edition // Copyright (c) 1998 by The McGraw-Hill Companies, Inc., USA.
Пособие адресовано практическим врачам, терапевтам-гастроэнтерологам, студентам-медикам, руководителям лечебно-профилактических учреждений, курсантам квалификационных и сертификационных циклов усовершенствования врачей.
В пособии даётся определение сущности, эпидемиологии, патогенеза, вариабельности клинических проявлений гастроэзофагеальной рефлюксной болезни. Включены различные методы диагностики с наиболее подробным описанием метода суточной рН-метрии. Описаны различные методы подхода и схемы лечения этой патологии с применением современных лекарственных средств, с учётом возможной резистентности к проводимой терапии.
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) – хроническое полисимптомное рецидивирующее заболевание, характеризующееся развитием воспалительных изменений слизистой оболочки дистального отдела пищевода и/или характерных клинических симптомов вследствие повторяющегося заброса в пищевод желудочного и/или дуоденального содержимого.
Основной причиной развития рефлюксной болезни является дисфункция нижнего пищеводного сфинктера (НПС), наличие грыжи пищеводного отверстия диафрагмы, нарушения двигательной функции пищевода. ГЭРБ нередко характеризуется внепищеводными симптомами.
К 21.0 Гастроэзофагеальный рефлюкс с эзофагитом,
К 21.9 Гастроэзофагеальный рефлюкс без эзофагита.
- эпизоды рефлюкса частые и/или продолжительные;
- заброс желудочного содержимого в пищевод сопровождается развитием клинической симптоматики с воспалением или повреждением слизистой оболочки пищевода, внепищеводными симптомами.
Достоверных цифр заболеваемости ГЭРБ нет. Данное обстоятельство связано с тем, что не все больные обращаются к врачу, большинство из них занимается самолечением. Эпидемиологические исследования показывают, что около 30% взрослого населения имеют различные проявления ГЭРБ. Распространённость пищевода Баррета составляет 376 больных на 100 тыс. населения. Заболеваемость и обращаемость больных за медицинской помощью напоминают айсберг, надводная часть которого составляют меньшую часть больных, около 40% (В.Б. Симоненко, П.А. Дулин, М.А. Маканин, Т.В. Уткина, 2007; А.С. Трухманов, 2006).

Рис. 1. Спектр кислотозависимых заболеваний пищевода
Различают две формы ГЭРБ:
1. Эндоскопически-негативная рефлюксная болезнь, или неэрозивная рефлюксная болезнь (НЭРБ). На её долю приходится около 70% случаев заболевания.
2. Рефлюкс-эзофагит (РЭ) – около 30% случаев заболевания.
Наиболее распространены две классификации РЭ - Лос-Анджелесская (табл.1) и по Savary-Miller (табл. 2).
Табл. 1. Лос-Анджелесская классификация РЭ
В Лос-Анджелесской классификации эритемы и отек слизистой пищевода не считаются признаками РЭ.
Среди больных РЭ более чем у 80% наблюдается эзофагит степеней А или В. Эзофагит степени D наблюдается только в 5-6% случаев эрозивной ГЭРБ.
Табл. 2. Эндоскопическая классификация эзофагитов по степени тяжести по Savary-Miller
ГЭРБ относится к группе кислотозависимых заболеваний, т.к. соляная кислота (желудочный сок) является одним из ведущих патогенетических факторов.
Развитие заболевания во многом определяет клиническую картину заболевания. К другим патогенетическим факторам относится нарушение функции НПС, снижение пищеводного клиренса, состояние слизистой оболочки пищевода, агрессивность рефлюктата (соляная кислота, пепсин, желчные кислоты), нарушенная эвакуация содержимого из желудка, повышение внутрибрюшного давления, длительность и частота ГЭР. Патологический ГЭР появляется при снижении базального давления НПС ниже 2 мм рт. ст. Если давление выше 5 мм рт. ст., оно способно предотвратить высокую частоту рефлюксов.
- клинический;
- эндоскопический; ; ;
- рентгенологический;
- желудочно-пищеводная сцинтиграфия; ;
- УЗИ.
Рис. 2. Пищеводные проявления ГЭРБ
Нередко встречаются и внепишеводные проявления ГЭРБ. К ним относятся: постоянный, особенно ночной, кашель; рецидивирующие пневмонии; хронический бронхит с астматическим компонентом; ретростернальные боли и боли в прекардиальной области по типу стенокардии, иногда с нарушением ритма сердца; хронический ларингит; фарингит; кариес зубов (рис. 3).
Рис. 3. Внепищеводные проявления ГЭРБ
При осмотре больного симптомы патогномоничные для ГЭРБ отсутствуют.
Патогномоничные для ГЭРБ изменения в анализах отсутствуют.
Инструментальные исследования являются определяющими в диагностике ГЭРБ.
Эзофагогастродуоденоскопия проводится, как правило, неоднократно как для постановки диагноза (см. классификацию ГЭРБ), так и для оценки проводимого лечения и, при необходимости, динамического наблюдения. При осложнённом течении заболевания (наличие изъязвлений слизистой оболочки пищевода Баррета, стриктур) необходимо проводить биопсию.
К числу важных инструментальных методов относится 24-часовая внутрипищеводная рН-метрия. Особенно необходимо проведение исследования при эндоскопически негативной форме ГЭРБ, при её атипичных формах – для верификации некардиальной боли за грудиной, хроническом кашле. Подробно о рН-метрии пищевода, желудка и двенадцатиперстной кишки написано в монографии: Рапопорт С.И. и др. рН-метрия пищевода и желудка при заболеваниях верхних отделов пищеварительного тракта / Под ред. академика РАМН Ф.И. Комарова. – М.: ИД МЕДПРАКТИКА-М, 2005, 208 с.
Исследование выполняется с помощью рН-зонда, вводимого трансназально в пищевод больного. Датчик рН устанавливается на 5 см выше верхней границы НПС (рис. 4) и измеряет величину рН в пищеводе в течение 24 часов. рН-зонд подключен к регистрирующему блоку, закрепляемому на поясе больного. Пациент при исследовании ведет нормальный образ жизни и отмечает на клавиатуре регистрирующего блока события и симптомы, потенциально связанные с ГЭРБ: прием пищи, сон, положение стоя или лежа, приём лекарств, появление изжоги, болей в груди и т.п. По истечении 24 часов информация из регистрирующего блока передаётся на компьютер для автоматической обработки и подготовки заключения.
Рис. 4. Расположение рН-зонда при суточной рН-метрии пищевода
В норме слизь пищевода имеет рН=6-7. При забросе кислого содержимого из желудка в пищевод рН в пищеводе на некоторое время уменьшается до 4 и менее. Уровень рН=4 считается граничным, т.е. эпизоды, при которых рН в пищеводе опускается ниже 4, считают кислыми гастроэзофагеальными рефлюксами. Рефлюксы могут быть нормальными физиологическими и патологическими. Различие между ними в количестве и длительности (рис. 5, 6).
Рис. 5. рН-грамма пищевода с физиологическими рефлюксами
Рис. 6. рН-грамма пищевода больного ГЭРБ
При расшифровке 24-часовых рН-грамм в пищеводе в первую очередь оцениваются показатели, представленные в табл. 3. Расчет этих параметров выполняется автоматически.
Табл. 3. Основные показатели 24 часовой рН-метрии
Дополнительным методом исследования является внутрипищеводная манометрия, позволяющая выявить недостаточность НПС. Определённую помощь в дифференциальной диагностике характера кардиальных болей играют электрокардиография, холтеровское мониторирование, нагрузочные пробы, тест с ингибитором протонной помпы (ИПП). В случае положительного эффекта следует думать о пищеводном происхождении болей.
Лечение ГЭРБ направлено на лечение эзофагита, профилактически – на уменьшение количества эпизодов ГЭР, снижение повреждающих свойств рефлюктата, улучшение пищеводного клиренса и защиты слизистой оболочки пищевода.
Рис. 7. Терапия ГЭРБ
Отказаться от курения. Больные ГЭРБ должны избегать физических нагрузок, сопряжённых с наклонами, качанием пресса, поднятием тяжести и других упражнений, повышающих внутрибрюшное давление. Избегать переедания, приёма газированных напитков, холодной и горячей пищи. Исключить или ограничить продукты с кислотостимулирующим действием, в частности цитрусы, шоколад, выпечку, свежий белый хлеб, чёрный хлеб, бульоны, специи, грибы, жареную и жирную пищу, редьку, редис, кофе, крепкий чай. После еды целесообразно не ложиться два часа. Спать на кровати с приподнятым на 15 см головным концом.
Рекомендуется следить за массой тела.
Следует иметь в виду, что некоторые фармпрепараты могут усугублять рефлюкс. Противопоказаны М-холинолитики (атропин, метацин, платифиллин), миогенные спазмолитики (но-шпа, папаверин, галидор), теофиллин, диазепам, блокаторы кальциевых каналов, b-адренергические агонисты (изопретенол), нитраты, прогестерон, a-адренергические антагонисты (фентоламин), ферментные препараты, содержащие желчь (фестал, дигестал, холензим, аллохол) и др.
Включает, как правило, три группы препаратов – антисекреторные средства, прокинетики, антациды.
Наиболее эффективным препаратами для лечения ГЭРБ являются ингибиторы протонной помпы II класса – замещённые бензидазолы: омепразол, лансопразол, пантопразол. Ингибиторы протонной помпы (ИПП) более эффективны, чем блокаторы Н2-рецепторов гистамина и обычно не дают побочного эффекта. Рекомендации по обследованию и лечению больных ГЭРБ Российской гастроэнтерологической ассоциации предлагают использовать ИПП париет в дозе 20-40 мг/сутки, омепразол в дозе 20-60 мг/сутки, нексиум (эзомепразол) в дозе 20-40 мг/сутки в течение 6-8 недель. Препараты эффективны и безопасны при длительном применении (месяцами).
При лечении ГЭРБ применяют невсасывающиеся антациды трёх поколений: I-е поколение – фосфалюгель (алюминия фосфат в сочетании с антисептиком и агар-агаром), II-е поколение – алюминиево-магниевые антациды (маалокс, мегалак, алмагель и др.), III-е поколение – алюминиево-магниевые антациды в комплексе с альгинатами (топалкан, гевискон и др.). Наиболее эффективны невсасывающиеся антациды II-ого поколения, прежде всего маалокс. Он назначается по 15-20 мл 4 раза в день через час-полтора после еды. Ориентировочно антациды назначаются в течение 4-6-8 недель. Они также могут назначаться симптоматически, когда изжога беспокоит редко.
В качестве прокинетика применяют мотилиум по 10 мг (1 таб.) 3 раза в день до еды.
Курс лечения при катаральном или эндоскопически негативном эзофагите длится около 4 недель, при эрозивном 6-8 недель, при отсутствии эффекта лечение может быть продолжено до 12 недель и более. При щелочном (желчном) рефлюксе показан урсосан или урсофальк 250-500 мг. Критерием ремиссии является исчезновение клинических симптомов и данные эндоскопического исследования.
Хирургическое лечение показано в случаях отсутствия эффекта от терапевтического, а также в осложнённых случаях – повторные кровотечения, стриктуры пищевода, пищевод Баррета с явлениями дисплазии высокой степени.
Соблюдение пациентом вышеперечисленных правил. Возможен длительный приём омепразола 20 мг однократно на ночь.
Больному необходимо знать о возможных осложнения болезни, признаках обострения заболевания, подчеркнуть необходимость соблюдения рекомендаций. В случае появления отрыжки пищей, изжоги (не систематической) рекомендуется приём в течение нескольких месяцев ИПП. При подозрении на пищевод Баррета необходимо клинико-эндоскопически-морфологическое наблюдение, периодичность которого определяется врачом (месяц – 2-3 месяца – полгода – год).
Пациента следует проинформировать о возможных осложнениях ГЭРБ и рекомендовать ему обращаться к врачу при возникновении симптомов осложнений:
- дисфагии или одинофагии;
- кровотечения;
- потери массы тела;
- раннего чувства насыщения;
- кашля и приступов удушья;
- болей в грудной клетке;
- частой рвоты.
Больные ГЭРБ должны находиться под динамическим наблюдением врача, т.к. заболевание является хроническим, часто рецидивирует (до 80%), и даже латентное течение заболевания снижает качество жизни.
Министерство здравоохранения и социального развития РФ.
Московская медицинская академия им. И.М. Сеченова.
ГАСТРОЭЗОФАГЕАЛЬНАЯ РЕФЛЮКСНАЯ БОЛЕЗНЬ.
Заслуженный деятель науки РФ, доктор медицинских наук, профессор С.И. Рапопорт.
Пособие для врачей.
Москва. 2009.
Кандидоз пищевода — это микотическая инфекция, которая вызвана грибками рода Кандида (Candida). Заболевание проявляется затруднениями при глотании, загрудинными болями и дискомфортом. При длительном существовании кандидоза возникает потеря веса, тяжелые авитаминозы. Основу диагностики грибковой инфекции составляет осмотр пищевода при ЭФГДС с последующим морфологическим анализом биоптатов для выявления частиц возбудителя. Дополнительно проводится микробиологический посев биоматериала. Для лечения пищеводного кандидоза применяют различные по химической структуре противогрибковые препараты системного действия.
МКБ-10
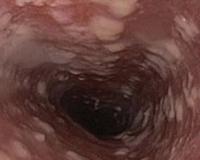
Общие сведения
Кандидоз пищевода (кандидозный эзофагит) считается оппортунистической инфекцией. Среди пациентов общего профиля частота заболевания составляет 1-2%, при наличии сахарного диабета микоз встречается намного чаще — в 5-10% случаев. У больных с ВИЧ-инфекцией и СПИДом распространенность грибкового поражения пищевода достигает 30%. Уровень заболеваемости кандидозом среди людей пожилого возраста в 2 раза выше, чем в среднем в популяции, в старческом возрасте (после 75 лет) — в 6 раз выше. Инфекция иногда возникает у детей на фоне первичных иммунодефицитов.

Причины
Возбудителями инфекционного заболевания пищевода являются грибки рода Candida. Всего насчитывается более 150 видов грибов Кандида, но в 60-90% случаев патология вызвана C. albicans. При иммуносупрессии возрастает роль других видов — C. glablata, C. kefir, C. lucitanies и C. krusei. Микроорганизмы в естественных условиях находятся в форме бластомицетов или псевдомицелия. Развитию кандидоза способствует ряд предрасполагающих факторов:
- Иммунодефициты. Поражение слизистых пищеварительного тракта грибами Кандида является одним из маркеров прогрессирующей ВИЧ-инфекции. Высокая заболеваемость наблюдается при первичных генетически обусловленных иммунодефицитах: синдроме Ди Джорджи, синдроме Брутона, болезни Вискотта-Олдрича и др.
- Лекарственная иммуносупрессия. Частота кандидоза возрастает при продолжительном лечении кортикостероидами, которые угнетают активность иммунной системы. Негативное влияние оказывает лучевая и химиотерапия онкологических больных, которая нарушает местные и общие факторы иммунной защиты.
- Эндокринные заболевания. Вероятность появления микоза повышается у страдающих сахарным диабетом, аутоиммунным полиэндокринным синдромом, гипотиреозом. Антифунгальная резистентность снижается при ожирении и других проявлениях метаболического синдрома.
- Местные факторы. К локальным причинам микотического процесса относят хронические воспалительные и атрофические изменения в эзофагеальной стенке, ксеростомию, дегенеративно-деструктивные нарушения в полости рта. Патология вдвое чаще встречается у тех, кто пользуется съемными зубными протезами.
Факторы риска
Факторы риска развития кандидоза пищевода: истощение, авитаминозы, хронические соматические болезни, сопровождающиеся астенией. Вероятность микоза возрастает после операций по трансплантации органов.
Широкая распространенность кандидоза у пожилых людей связана с инволютивным угасанием функций иммунитета, нарушениями микроциркуляции вследствие атеросклероза, атрофией слизистого слоя пищевода. В формировании кандидоза большую роль имеет полипрагмазия, а именно неконтролируемое применение антибиотиков, гормонов и антисекреторных препаратов.
Патогенез
Первым этапом механизма развития заболевания является адгезия (прикрепление) клеток грибка к поверхности эзофагеальной слизистой. В дальнейшем микроорганизмы способны трансформироваться в нитевидную форму и внедряться в более глубокие слои стенки пищевода. Поражение тканей происходит вследствие продукции возбудителем специфических ферментов. Большое значение в манифестации кандидоза играют дефекты Т-клеточного звена иммунитета.
Характер инфекции определяется состоянием факторов антифунгальной защиты организма. При правильной работе иммунной системы возникает транзиторное носительство. При дефектах иммунитета обычно встречается персистирующее носительство без клинических симптомов. При наличии у человека одной или нескольких предпосылок развивается типичный кандидоз.
Классификация
Согласно анатомической классификации, поражение пищевода грибками-кандидами относится к поверхностным формам кандидоза. В практической гастроэнтерологии широко применяется эндоскопическая классификация, которая необходима для систематизации различных вариантов поражения эзофагеальной слизистой. Клиницисты выделяют 3 варианта изменений в пищеводе при кандидозе:
- Катаральный эзофагит. Характеризуется гиперемией слизистой пищевода и умеренной отечностью. На кандидозную инфекцию указывает тонкий паутинообразный налет на эпителии, контактная кровоточивость.
- Фибринозный эзофагит. В пищеводе образуются беловато-серые налеты в виде бляшек размером до 0,5 см. Гиперемия, отечность и кровоточивость слизистой оболочки выражены интенсивнее, чем при катаральной форме.
- Фибринозно-эрозивный эзофагит. Кандидоз проявляется множественными налетами грязно-серого цвета, после удаления которых на слизистой оболочке визуализируются эрозии. Характерна спонтанная кровоточивость.
Симптомы кандидоза пищевода
Типичные признаки кандидоза пищевода — затруднения и боли в момент глотания. Человек испытывает дискомфорт при употреблении твердой и сухой пищи, тогда как при питье неприятные ощущения не беспокоят. Болезненность ощущается при прохождении пищевого комка по пищеводу. Некоторые пациенты для облегчения боли и жжения запивают каждый кусочек пищи водой.
Характерен дискомфорт за грудиной, который возникает независимо от употребления продуктов питания. Реже появляется отрыжка с неприятным запахом, изжога. При тяжелом поражении пищевода во время еды бывают очень сильные боли, поэтому больные сокращают объем порций и кратность приема пищи. Вследствие длительного недоедания отмечается потеря массы тела, присоединяются симптомы авитаминоза.
Осложнения
Вследствие контактной ранимости слизистой типичны постоянные малоинтенсивные кровотечения при травмировании пищевода кусочками плохо пережеванной пищи. Хроническая кровоточивость приводит к железодефицитной анемии. У пациентов, страдающий тромбоцитопенией, возможно профузное кровотечение с геморрагическим шоком. Очень опасна перфорация пищевода, которая проявляется болевым шоком, пневмомедиастинумом и подкожной эмфиземой шеи.
Диагностика
При кандидозе пищевода отсутствуют патогномоничные симптомы, поэтому диагностический поиск включает ряд лабораторных и инструментальных методов. Иногда при осмотре врач-гастроэнтеролог замечает очаги грибкового поражения ротовой полости, что косвенно указывает на микотическую этиологию дисфагии. Для подтверждения диагноза используются следующие методы исследования:
Лечение кандидоза пищевода
Основу терапии кандидозной инфекции составляют специфические антифунгальные средства. Они угнетают синтез химических веществ, входящих в клеточную стенку грибов. Существует 3 группы антимикотиков, которые различаются по степени усвояемости при пероральном приеме. Чаще всего в клинической практике используются азольные противогрибковые средства, которые необходимо принимать в течение 2-3 недель.
При неэффективности стандартной схемы антимикотик меняют либо переходят на парентеральное введение лекарства. Прием препарата длится до полного исчезновения клинико-лабораторных симптомов. Для больных со СПИДом обязательным условием излечения является снижение вирусной нагрузки и повышение уровня CD4-клеток. Для этого рекомендуют современные схемы антиретровирусной терапии.
Прогноз и профилактика
Вероятность полного выздоровления зависит от условий и причин, вызвавших кандидоз. У людей с нормальным иммунным статусом прогноз благоприятный — для излечения требуется 1 курс противогрибковой терапии. Если больной принадлежит к категории носителей ВИЧ-инфекции либо по состоянию здоровья принимает иммуносупрессоры, существует риск рецидива грибковой инфекции.
Меры первичной профилактики включают контролируемое назначение иммуносупрессоров и антибиотиков, раннее выявление и лечение орофарингеального кандидоза. Для предотвращения рецидивов иммунокомпрометированным пациентам показан ежедневный прием противогрибкового препарата в невысокой дозе. Реже прибегают к профилактическому еженедельному приему удвоенных дозировок антимикотика.
1. Особенности кандидоза пищевода у больных пожилого и старческого возраста/ Д.М. Албегова// Проблемы медицинской микологии. — 2012.
Кандидозный эзофагит входит в группу инфекционных эзофагитов, к которым также относятся цитомегаловирусный и герпетический эзофагиты.
Как правило, большинство случаев эзофагита связано с неинфекционными причинами, в основном с гастроэзофагеальной рефлюксной болезнью. Если выявляется инфекционный эзофагит, то следует прежде всего думать, что у данного пациента имеется то или иное нарушение иммунитета.

Полный текст статьи:
Хотя Candida считается представителем нормальной микрофлоры желудочно-кишечного тракта человека, этот микроорганизм может стать причиной эзофагита. Связано это с нарушением защитных сил макроорганизма. В целом многие виды рода Candida могут вызывать развитие клинических синдромов, но чаще всего называют C. albicans. Считается, что следует точно идентифицировать вид Candida, так как существуют межвидовые отличия, заключающиеся в большей или меньшей устойчивости к антигрибковой терапии.
Кандидоз пищевода наиболее часто диагностируется у больных
- · с гемобластозами,
- · со СПИДом,
- · после трансплантации органов,
- · у получающих стероидную терапию [4, 11].
Кандидозный эзофагит встречается
- · у больных общего профиля в 1–2% случаев,
- · у страдающих сахарным диабетом 1-го типа — в 5–10%,
- · у больных СПИДом — в 15–30% [2].
Наиболее характерным симптомом кандидоза пищевода является одинофагия, т. е. боль по ходу пищевода при проглатывании пищи.
- · Диагноз кандидозного эзофагита устанавливается, как правило, при эзофагоскопии, когда выявляются белые и белесовато-желтые бляшки и бляшкоподобные налеты на слизистой оболочке пищевода. Зачастую участки белесоватого налета носят диффузный характер, и покрывают всю поверхность слизистой оболочки пищевода.
- · Патогномоничным признаком кандидозного эзофагита является тот факт, что налет с трудом снимается биопсийными щипцами и после его удаления остаются участки осаднения слизистой оболочки.
Эндоскопическая классификация кандидозного эзофагита по Kodsi
Степень I: Несколько приподнятых белесоватых бляшек размерами до 2 мм в диаметре, с гиперемией, но без отека или язв.
Степень II: Множественные приподнятые белесоватые бляшки размерами более чем 2 мм в диаметре с гиперемией вокруг, но без отека или язв
Степень III: Сливные линейные и узловатые приподнятые бляшки, с гиперемией и язвами
Степень IV: Те же изменения, что и при III степени, плюс контактная кровоточивость слизистой оболочки и иногда сужение просвета пищевода
При гистологическом исследовании биопсийного материала из пораженных участков видны дрожжевые грибы с псевдогифами, проникающими в эпителиальный слой слизистой оболочки. Иногда отмечается проникновение микроорганизма в глубокие слои стенки органа.
- · Герпетический эзофагит,
- · Цитомегаловирусный эзофагит,
- · Лекарственный эзофагит,
- · Эозинофильный эзофагит.
- · Данный вид эзофагита требует системной противогрибковой терапии.
- · У пациентов с перечисленными выше факторами риска и с симптомами одинофагии или дисфагии уместна эмпирическая противогрибковая терапия.
- · Эзофагогастродуоденоскопия (ЭГДС) может быть выполнена, если симптомы не стихают примерно после 3 дней лечения, его продолжительность составляет 2–3 недели.
- · Внутривенная терапия может оказаться необходимой у пациентов с тяжелой формой заболевания, которые не могут принимать препараты перорально [2].
Рекомендуемый пероральный препарат флуконазол следует назначать с начальной дозы 400 мг, затем по 200–400 мг один раз в день в течение 2–3 недель, но в упорных случаях применяют и другие азолы, такие как позаконазол, вориконазол или итраконазол в виде раствора. Иные лекарства, в том числе эхинокандины или амфотерицин B, также весьма эффективны [2, 5].
Особенности лечения беременных:
- · Амфотерицин может использоваться для лечения кандидозного эзофагита в период беременности, что специально отражено в показаниях к клиническому применению препарата.
- · Надо подчеркнуть, что азолы являются тератогенными и не должны использоваться особенно в течение первого триместра беременности.
- · К сожалению, нет данных относительно применения эхинокандинов во время беременности.
Список литературы:

Несколько приподнятых белесоватых бляшек размерами до 2 мм в диаметре, с гиперемией, но без отека или язв.
Множественные приподнятые белесоватые бляшки размерами более чем 2 мм в диаметре с гиперемией вокруг, но без отека или язв
Степень III
Сливные линейные и узловатые приподнятые бляшки, с гиперемией и язвами
Те же изменения, что и при III степени, плюс контактная кровоточивость слизистой оболочки и иногда сужение просвета пищевода
Список литературы:
1 Yakoob J, Jafri W, Abid S et al. Candida esophagitis: risk factors in non-HIV population in Pakistan. World J Gastroenterol 2003; 9 (10): 2328–31. 2 Chocarro Martinez A, Galindo Tobal F, Ruiz-Irastorza G et al. Risk factors for esophageal candidiasis. Eur J Clin Microbiol Infect Dis 2000; 19 (2): 96–100. 3 Underwood J A, Williams J W, Keate R F. Clinical findings and risk factors for Candida esophagitis in outpatients. Dis Esophagus 2003; 16 (2): 66–9. 4 Baehr P H, McDonald G B. Esophageal infections: risk factors, presentation, diagnosis, and treatment. Gastroenterology 1994; 106 (2): 509–32. 5 Wilcox C M, Schwartz D A. Endoscopic-pathologic correlates of Candida esophagitis in acquired immunodeficiency syndrome. Dig Dis Sci 1996; 41 (7): 1337–45. 6 Werneck-Silva A L, Prado I B. Role of upper endoscopy in diagnosing opportunistic infections in human immunodeficiency virus-infected patients. World J Gastroenterol 2009; 15 (9): 1050–6. 7 Weerasuriya N, Snape J. A study of candida esophagitis in elderly patients attending a district general hospital in the UK. Dis Esophagus 2006; 19 (3): 189–92. 8 Wilcox C M, Karowe M W. Esophageal infections: etiology, diagnosis, and management. Gastroenterologist 1994; 2 (3): 188–206. 9 Mimidis K, Papadopoulos V, Margaritis V et al. Predisposing factors and clinical symptoms in HIV-negative patients with Candida oesophagitis: are they always present? Int J Clin Pract 2005; 59 (2): 210–3. 10 Bianchi Porro G, Parente F, Cernuschi M. The diagnosis of esophageal candidiasis in patients with acquired immune deficiency syndrome: is endoscopy always necessary? Am J Gastroenterol 1989; 84 (2): 143–6. 11 Wilcox C M, Alexander L N, Clark W S, Thompson S E 3rd. Fluconazole compared with endoscopy for human immunodeficiency virus-infected patients with esophageal symptoms. Gastroenterology 1996; 110 (6): 1803–9. 12 Antinori A, Antinori A, Ammassari A et al. Presumptive clinical criteria versus endoscopy in the diagnosis of Candida esophagitis at various HIV-1 disease stages. Endoscopy 1995; 27 (5): 371–6. 13 Nishimura S, Nagata N, Shimbo T et al. Factors associated with esophageal candidiasis and its endoscopic severity in the era of antiretroviral therapy. PLoS ONE 2013; 8 (3): e58217. 14 Lopez-Dupla M, Mora Sanz P, Pintado Garcia V et al. Clinical, endoscopic, immunologic, and therapeutic aspects of Clinical factors for severe CE 5 © 2013 Wiley Periodicals, Inc. and the International Society for Diseases of the Esophagus oropharyngeal and esophageal candidiasis in HIV-infected patients: a survey of 114 cases. Am J Gastroenterol 1992; 87 (12): 1771–6. 15 Larner A J, Lendrum R. Oesophageal candidiasis after omeprazole therapy. Gut 1992; 33 (6): 860–1. 16 Karmeli Y, Stalnikowitz R, Eliakim R, Rahav G. Conventional dose of omeprazole alters gastric flora. Dig Dis Sci 1995; 40 (9): 2070–3. 17 Kodsi B E, Wickremesinghe C, Kozinn P J, Iswara K, Goldberg P K. Candida esophagitis: a prospective study of 27 cases. Gastroenterology 1976; 71 (5): 715–9. 18 Kurnatowska I, Pazurek M, Nowicki M. Case of esophagitis in a posttransplant female patient. Ann Transplant 2007; 12 (3): 39–42. 19 Gaissert H A, Breuer C K, Weissburg A, Mermel L. Surgical management of necrotizing Candida esophagitis. Ann Thorac Surg 1999; 67 (1): 231–3. 20 Jones J M, Glass N R, Belzer F O. Fatal Candida esophagitis in two diabetics after renal transplantation. Arch Surg 1982; 117 (4): 499–501. 21 Kanzaki R, Yano M, Takachi K et al. Candida esophagitis complicated by an esophago-airway fistula: report of a case. Surg Today 2009; 39 (11): 972–8. 22 Svedlund J, Sjodin I, Dotevall G. GSRS – a clinical rating scale for gastrointestinal symptoms in patients with irritable bowel syndrome and peptic ulcer disease. Dig Dis Sci 1988; 33 (2): 129–34. 23 Sim J, Wright C C. The kappa statistic in reliability studies: use, interpretation, and sample size requirements. Phys Ther 2005; 85 (3): 257–68. 24 Kulich K R, Madisch A, Pacini F et al. Reliability and validity of the Gastrointestinal Symptom Rating Scale (GSRS) and Quality of Life in Reflux and Dyspepsia (QOLRAD) questionnaire in dyspepsia: a six-country study. Health Qual Life Outcomes 2008; 6: 12. 25 Revicki D A, Wood M, Wiklund I, Crawley J. Reliability and validity of the Gastrointestinal Symptom Rating Scale in patients with gastroesophageal reflux disease. Qual Life Res 1998; 7 (1): 75–83.
Читайте также:

