Герпетический энцефалит при вич
Обновлено: 18.04.2024
Изучены особенности клинического течения локализированных и генерализированных форм герпетической инфекции, обусловленной вирусом простого герпеса І и ІІ типов у 100 больных на разных стадиях ВИЧ-инфекции. Установлено, что локализированные формы герпетической инфекции – лабиальный и генитальный герпес – преобладают у пациентов с І и ІІ стадиях ВИЧ-инфекции. Они отличаются от аналогичных форм у пациентов без ВИЧ-инфекции более тяжелым течением, рецидивирующим характером, склонностью элементов сыпи к распространению на соседние анатомические участки. Висцеральные и генерализированные формы герпетической инфекции, которые свидетельствуют о выраженной иммуносупрессии, характерны для стадии СПИДа. Они проявлялись эрозивно-язвенным эзофагитом, проктитом, интерстициальной пневмонией, энцефалитом, который был непосредственной причиной смерти таких больных. Как СПИД индикаторное заболевание следует рассматривать и локализированные формы герпетической инфекции – лабиальный и генитальный герпес – при эрозивно-язвенном, диссименированном характере поражений продолжительности более 1 месяца.

1. Бабий Н.А. Ко-инфекции вирусного генеза у больных ВИЧ-инфекцией / Н.А. Бабий, А.М. Щербинская // Инфекционные болезни. – 2007. – № 2. – С. 23–26.
2. Баринский И.Ф. Герпесвирусные инфекции – иммунодефицитные заболевания ХХ века / И.Ф. Баринский // Аллергология и иммунология. – 2004. – Т. 5, № 1. – С. 202–204.
3. Запорожан В.Н. ВИЧ-инфекция и СПИД / В.М. Запорожан, М.Л. Аряев. Изд. перераб. и доп. – Киев: Здоровье, 2004. – 636 с.
4. Казмирчук В.Е. Клиника, диагностика и лечение герпесвирусных инфекций человека / В.Е. Казмирчук, Д.В. Мальцев – М.: Феникс, 2009. – 247 с.
5. Казмирчук В.Е. Клиническая иммунология и аллергология / В.Е. Казмирчук, Л.В. Калюжная Л.Д. Ассоциации инфекций, передающихся половым путем у ВИЧ-инфицированных / Л.Д. Калюжная, Л.В. Гречанський // Украинский журнал дерматологии, венерологии, косметологии. – 2004. – № 1.– С. 78–80.
6. Лабораторная диагностика герпесвирусной инфекции человека / Л.А. Панченко, И.И. Торяник, Н.Г. Попова [и др.]. // Инфекционные болезни. – 2006. – № 3. – С. 62–66.
7. Малый В.П. СПИД-ассоциированные инфекции и инвазии: учебное пособие / В.П. Малый, И.С. Кратенко. – Харьков: Фолио, 2007. – 287 с.
8. Маричев И.Л. Герпесвирусы-СПИД маркерные заболевания / И.Л. Маричев // Современные инфекции. – 2005. – № 3–4. – С.55–59.
9. Маричев И.Л. Герпетическая инфекция у ВИЧ-инфицированных / И.Л. Маричев / Инфекционные болезни. – 2006. – № 2. – С.15–17.
10. Медико-профилактические аспекты ВИЧ-инфекции и СПИДа в врачебной практике / Б.М. Дикий, И.Г. Грижак, А.Д. Щербинская [и др.]. – Киев: Изд-во ИФДМУ, 2007. – 236 с.
Введение
Цель нашего исследования - провести ретроспективный анализ течения герпетической инфекции у больных с учетом стадии ВИЧ-инфекции на основании анализа данных медицинских карт стационарных и амбулаторных больных.
Материалы и методы исследования. Проведен ретроспективный анализ медицинской документации 100 больных ВИЧ-инфекцией. В исследуемую группу входили больные на разных стадиях заболевания в возрасте от 18 до 40 лет. I стадия - 24, II - 37, III - 22, IV - 17 больных. Установлено, что среди больных, которые находились на учете в областном Центре борьбы и профилактики ВИЧ/СПИДа, инфицированы ВИЧ парентеральным путем 42 человека, половым - 58. Диагноз ВИЧ-инфекции установлен на основании данных эпидемиологического, клинического и лабораторного обследования, подтверждено двукратным выявлением антител (АТ) к ВИЧ методом иммуноферментного анализа (ИФА). Диагноз ГИ устанавливали на основании выявленных изменений со стороны органов и систем, учитывая политропность возбудителя и генерализированный характер поражений в терминальной стадии заболевания. Этиологическая расшифровка ГИ базировалась на результатах полимеразной цепной реакции (ПЦР).
Ни одного случая острой ГИ у пациентов с ВИЧ-инфекцией не зарегистрировали. Во всех диагностировали различные формы хронической ГИ, реактивация которой имела место в 38 %, а рецидивирующее течение - в 62 % случаев. Так, ВПГ 1 вызывал рецидивы назального и лабиального герпеса (30 больных), его первые клинические проявления (10 больных), а также гингивостоматит (5 больных) и фаринготонзиллит (2 больных) только в I (21) и ІІ (26) стадиях ВИЧ-инфекции. Количество больных, у которых диагностировали ГИ в указанных стадиях, составляло соответственно 87,4 % и 70,2 %.
ВИЧ-ассоциированная ГИ с поражением кожи и слизистых характеризовалась не только более обильными и распространенными элементами везикулезной сыпи, но и замедленным ее регрессом, продолжительностью более 1 месяца (от 6 до 8 недель). Кроме этого, в 30,7 % больных во ІІ стадии ВИЧ-инфекции наблюдали эрозивно-язвенную форму ГИ - глубокие эрозии с трансформацией в язвы, которые медленно заживали. Следует отметить, что герпетические поражения кожи в виде сгруппированных пузырьков с серозным содержимым отмечали не только в местах их типичной локализации - на губах, крыльях носа. У больных во ІІ стадии ВИЧ-инфекции они распространялись на лоб, щеки, уши. Поражение слизистой ротоглотки всегда сопровождалось постоянной и выраженной болезненностью, гиперемией, гиперсаливацией, язвенным гингивитом.
Рецидивы лабиального герпеса у ВИЧ-инфицированных больных характеризовались большей частотой и выраженностью клинических проявлений в сравнении с больными, не инфицированными ВИЧ. У инфицированных ВИЧ ежемесячные рецидивы лабиального герпеса регистрировали у 26 больных, каждые 3 месяца они развивались у 20 больных и проявлялись групповыми (12 больных) и множественными (8 больных) везикулами, которые распространялись на щеки и околоушную область. У не инфицированных ВИЧ ежемесячных рецидивов не было, каждые 3 месяца они развивались у 4 больных, а каждые 6 месяцев - у 8. При этом элементы сыпи были единичными, не распространялись за пределы губ.
Рецидивы гингивостоматита сопровождались субфебрилитетом, умеренной интоксикацией, множественными глубокими эрозиями с отеком и гиперемией слизистой оболочки полости рта, тогда как у больных без ВИЧ-инфекции они протекали в более легкой форме, без нарушения общего состояния больного, с менее выраженними изменениями слизистой оболочки.
Данные анамнеза свидетельствуют, что до инфицирования ВИЧ рецидивы лабиального герпеса чаще всего имели место каждые 6 месяцев - у 13 больных, тогда как после инфицирования ВИЧ рецидивы у большинства больных (26) наблюдались ежемесячно.
Генитальный герпес (ГГ) чаще диагностировали у больных в ІІІ стадии ВИЧ-инфекции (49,9 %) в сравнении с больными во II стадии (24,3 %) и I (12,0 %). Заболевание имело рецидивирующее течение у 18,9 % больных во II стадии и 40,9 % больных в ІІІ стадии ВИЧ-инфекции. Если в I стадии поражались только наружные половые органы, то во II и III - еще и внутренние (вагинит, цервицит) в виде множественных глубоких эрозий и язв. В IV стадии ВИЧ-инфекции проявления ГГ наблюдали в 11,7 % больных в виде поражений только внутренних половых органов (язвенно-некротический вагинит, цервицит). Нередко ГГ проявлялся еще и экстрагенитальными поражениями, которые обнаруживали на ягодицах, задней и внутренней поверхности бедер у каждого второго больного с II и во всех с III и IV стадиями ВИЧ-инфекции. Явлениями тазового ганглионеврита сопровождался ГГ у 5,4 % лиц с II и 18,1 % с ІІІ стадией ВИЧ-инфекции. Кроме сыпи на больших и малых половых губах, слизистой влагалища, шейке матки, промежности, ГГ проявлялся язвенным поражением уретры и прямой кишки в III и IV стадиях ВИЧ-инфекции. Герпетический уретрит диагностировали у 13,6 % больных в ІІІ стадии, а герпетический проктит - соответственно в 18,1 % и 23,5 % больных в III и IV стадиях заболевания.
Для рецидивов ГГ у ВИЧ-инфицированных больных характерна большая частота и выраженность клинических проявлений, чем у больных не инфицированных ВИЧ. Среди инфицированных ВИЧ ежемесячные рецидивы ГГ наблюдались у 9 больных, каждые 3 месяца они развивались у 5 больных, проявлялись групповыми (2 больных) и множественными (3 больных) везикулами. Каждые 6 месяцев рецидивы ГГ с множественными элементами сыпи возникали у 2 больных. У не инфицированных ВИЧ ежемесячных рецидивов ГГ не было, регистрировались рецидивы каждые 3 месяца - в 3, каждые 6 месяцев - у 2 больных.
Анализируя данные анамнеза, мы установили, что до инфицирования ВИЧ рецидивы ГГ у больных чаще всего имели место каждые 6 месяцев (8 пациентов), тогда как после инфицирования ВИЧ максимальной была частота ежемесячных рецидивов (9 пациентов).
Диагностировали не только локализированные, но и висцеральные и генерализорованные формы ГИ. Гематогенная диссеминация ВПГ 1 в IV стадии ВИЧ-инфекции приводила к поражениям внутренних органов. Диагностировали эзофагит у 29,4 %, а интерстициальную пневмонию - 17,6 % больных. У всех больных пневмония сочеталась с эзофагитом. Генерализация ГИ на фоне выраженного ВИЧ-иммунодефицита сопровождалась поражением ЦНС. Оно проявилось в 17,6 % больных подострым энцефалитом, который был непосредственной причиной смерти. Тяжесть энцефалита обусловлена его некротическим характером.
Клинически у этих больных не наблюдали проявлений общей интоксикации и менингеальных симптомов. Очагово-неврологическая симптоматика развивалась постепенно, проявлялась различными расстройствами сознания с формированием симптомов поражения лобных, височных и теменных отделов мозга. О локальном и мозаичном поражение коры головного мозга свидетельствовали нарушение восприятия, мышления и памяти. Типичными клиническими проявлениями энцефалита были симптомы поражения передних отделов головного мозга - психические расстройства (афазия, дисфазия), агнозия, амнезия, центральные гемипарезы, а также невриты и плегия.
Ликвор при исследовании был прозрачным, бесцветным, ликворное давление нормальное или несколько повышено, плеоцитоз не превышал сотни клеток в 1 мкл, преобладали лимфоциты, белок в пределах нормы, белково-клеточной диссоциации не наблюдалось. По результатам МРТ выявляли гиподенсивные очаги размерами от 1,5 до 5 см в диаметре с локализацией в левой височно-теменной, правой лобной и затылочной долях. Очаги имели неправильную форму, с нечеткими контурами, незначительным перифокальным отеком и геморрагическим пропитыванием.
У больных, умерших от энцефалита, при гистиологическом исследовании тканей головного мозга обнаружили выраженные структурные изменения в сосудах и нервных клетках, которые возникли на фоне отека-набухания головного мозга. Энцефалит характеризовался преимущественно некротическими изменениями с образованием очагов деструкции в сером веществе передних отделов головного мозга (медио-базальных, лобных, височных и теменных) и воспалительной реакцией различной степени выраженности. В меньшей степени поражались оболочки мозга. Мягкие оболочки были утолщены, набухшие, умеренно инфильтрованны гистиоцитарными элементами, лимфоидными клетками, реже нейтрофильными лейкоцитами. Отмечались геморрагии и субарахноидальные кровоизлияния, глубокая дистрофия нейронов: гомогенизация и гиперхромия цитоплазмы, перераспределение хроматина в ядрах нейронов, их пикноз, лизис и гибель нервных клеток. Обнаруживали зоны выпадения нейронов и очаги некроза нервной ткани. В сосудах различного калибра, чаще в капиллярах, во всех случаях наблюдали проявления ДВС-агрегации эритроцитов, сладж и формирование тромбов, наличие геморрагий без периваскулярной инфильтрации.
У таких пациентов наблюдали очагово-некротические изменения в печени и надпочечниках, подобные очаги некрозов на слизистой оболочке ротовой полости, в легких - отек стенок альвеол, интерстициальную пневмонию.
Учитывая очень широкий спектр поражений - от кожи и слизистых оболочек до внутренних органов и ЦНС, диагностика ГИ на фоне ВИЧ-инфекции достаточно сложна. Поэтому без лабораторного подтверждения диагноза у таких больных она невозможна. При этом обнаружение вируса и его антигенов является основным, а антител к вирусу - вспомогательным методом диагностики ГИ.
Нами проанализированы серологические маркеры ВИЧ-ассоциированной ГИ в зависимости от числа СD4 + Т-лимфоцитов у больных без иммунодефицита (>500), с умеренным (500-350), выраженным (350-200) и глубоким (<200) иммунодефицитом.
Установлено, что титры IgG к ВПГ 1/2 у пациентов с ВИЧ-ассоциированной ГИ были разными. Их уровень в большинстве случаев был умеренным (50-100 МЕ/мл) - 51,0±5,0 %, значительно реже низким (100 МЕ/мл) - 22,0±4,1 %. Наблюдали зависимость диагностических уровней ІgG к ВПГ 1/2 от наличия иммунодефицита, обусловленного ВИЧ, и степени его тяжести. Высокий специфический гуморальный ответ на ГИ давали только больные без иммунодефицита (22,0±4,1 %), умеренный - больные с умеренным иммунодефицитом (40,0±4,9 %), незначительный процент с выраженным иммунодефицитом (3,0±1,7 из 13,0±3,4 %) и без иммунодефицита (8,0±2,7 из 0,0±4,6 %). Низкий гуморальний ответ на ГИ характерен для пациентов с глубоким иммунодефицитом (17,0±3,7 %) и большинства с выраженным иммунодефицитом (10,0±3,0 из 13,0±3,4 %).
Таким образом, диагностика ВИЧ-ассоциированной ГИ сопровождается значительными трудностями. Они связаны со сложностью верификации диагноза при помощи специфических серологических маркеров на фоне иммунодефицита. Угнетение синтеза противогерпетических антител класса IgG, низкие их титры у ВИЧ-положительных маскируют истинную частоту активных форм ГИ. Изучение специфических лабораторных маркеров ГИ у ВИЧ-инфицированных показало, что на основании только серологических обследований невозможно установить активность инфекционного процесса и определить тактику лечения больных.
Наиболее информативными являются результаты ПЦР, позволяющие своевременно выявлять активные формы инфекции, что имеет принципиальное значение для тактики лечения больных. Одновременно с серологическими обследованиями выявляли ДНК ВПГ 1/2 методом ПЦР. Герпес кожи и слизистых оболочек подтверждали методом ПЦР в 10,0 % пациентов с поражением слизистой ротоглотки и полости рта у 15,0 % пациентов с нетипичным поражением кожи (эрозивно-язвенным, геморрагически-некротическим, импетигоподобным). В 75,0 % случаев при типичном характера сыпи на коже в виде везикул диагноз не вызывал сомнения. У больных с ГГ чаще получали положительные результаты ПЦР при исследовании материала из влагалища и цервикального канала (соответственно 56,3 и 43,7 %), значительно реже - из прямой кишки и уретры (соответственно 12,5 и 9,38 %).
Положительные результаты ПЦР при исследовании крови, подтверждающие вирусемию и свидетельствующие о репликации ВПГ на системном уровне, получили в 62,5 % больных с генерализованной ГИ. Вирусемия сопровождалась герпетическим эзофагитом (62,5 %), пневмонией (37,5 %), проктитом (25,0 %). Поражались не только пищевод, легкие, прямая кишка, но и ЦНС. Герпетическая этиология энцефалита подтверждена у 100 % больных с генерализованной ГИ при исследовании ликвора методом ПЦР.
Ассоциированную с ВИЧ-инфекцией ГИ следует, по нашему мнению, называть не только СПИД-ассоциированным заболеванием, а суперинфекцией, патогенетически связанной с ВИЧ-инфекцией. На фоне вторичного иммунодефицита, обусловленного ВИЧ, ГИ приобретает генерализированный характер с множественными поражениями внутренних органов и ЦНС. Если в организме здорового иммунокомпетентного человека иммунные механизмы контролируют персистенцию ВПГ в паравертебральных нервных ганглиях, обеспечивая латентную форму ГИ, то на фоне ВИЧ-инфекции, сопровождающейся выраженным иммунодефицитом, ГИ приобретает рецидивное, манифестное течение с системными поражениями, генерализацией инфекционного процесса.
На основании анализа течения и диагностики ВИЧ-ассоциированной ГИ можно сделать следующие выводы:
1. Течение ГИ зависит от стадии ВИЧ-инфекции. У больных в I и II стадиях заболевания диагностировали только локализованные формы ГИ с поражением кожи, слизистой ротоглотки, гениталий, которые отличались рецидивирующим течением, склонностью элементов сыпи к распространению.
2. Клиника ГИ у больных в III и IV стадиях ВИЧ-инфекции полиморфная и проявляется поражениями внутренних органов, которые не наблюдаются у пациентов с ГИ без ВИЧ-инфекции. В условиях иммунодефицита ВИЧ-этиологии ГИ приобретает системный, нередко генерализированный характер с поражением внутренних органов (эзофагит, пневмония, проктит), ЦНС (энцефалит), характеризуется тяжелым и часто является непосредственной причиной смерти больных СПИДом.
3. Как СПИД индикаторное заболевание следует рассматривать и локализованные формы ГИ - лабиальный и генитальный герпес - при эрозивно-язвенном, диссиминированном характере поражений продолжительностью более 1 месяца.
4. Для своевременной диагностики генерализованных форм ГИ необходимо использовать метод ПЦР, диагностическая информативность которого при исследовании крови составляет 62,5 %, а ликвора у больных энцефалитом - 100 %. Диагностическая информативность ПЦР при исследовании материала из влагалища и цервикального канала составляет 100 % у больных с герпетическим цервицитом и вагинитом.
Рецензенты:
ВИЧ-энцефалопатия (ВИЧ-энцефалит) у ребенка
ВИЧ-1 является ретровирусом, который инфицирует клетки, несущие CD4-рецепторы и хемокиновые рецепторы (например, CCR5, CXCR4), включая Т-хелперы (CD4-клетки) и моноциты. Новорожденные могут быть инфицированы внутриутробно, при рождении или при кормлении грудью, но в большинстве случаев инфицирование происходит во время родов. Нагрузка материнской плазмы вирусами ВИЧ — наиболее важный прогностический фактор ВИЧ-инфекции новорожденных, но риск передачи повышается при преждевременных родах, длительном безводном периоде, других инфекциях, передающихся половым путем, при хориоамнионите и родах через естественные родовые пути с оперативным пособием (Abrams et al, 1995; Peckham и Gibb, 1995). В группах без грудного вскармливания выявлено 15-20% инфицированных по сравнению с 30-40% в популяции с грудным вскармливанием (European Collaborative Study, 1991,1994; Newell et al, 2004).
Вмешательства, включая антиретровирусную терапию во время беременности, во время родов и в послеродовом периоде; кесарево сечение до начала родовой деятельности и воздержание от кормления грудью может уменьшить передачу вирусов от матери к плоду до уровня менее 1% (Hawkins et al., 2005).
Вирус иммунодефицита человека относится к нейротропным вирусам, хотя продуктивная инфекция в ЦНС, вероятно, ограничивается макрофагами и микроглией. Вовлечение ткани головного мозга происходит вскоре после инфицирования инфицированность микроглии определяется уже через семь дней после переливания зараженной крови. In vitro ВИЧ инфекция приводит к активации эндотелия сосудов мозга, повышая риск проникновения клеток и частиц вируса в ЦНС.
ВИЧ-индуцированная экспрессия ICAM-1 (англ. Inter-Cellular Adhesion Molecule 1 — молекула межклеточной адгезии) на эндотелиальных клетках микрососудов головного мозга человека увеличивает краевое скопления лейкоцитов в сосудистом русле мозга, приводя тем самым к появлению большего количества мишеней ВИЧ-инфекции в пределах ЦНС (Stins et al, 2003). Небольшое педиатрическое исследование продемонстрировало связь между воспалительными медиаторами Т-клеток в ликворе и вирусной нагрузкой ВИЧ-инфекцией в СМЖ (McCoig et al., 2004). ВИЧ в ЦНС способствует воспалительному процессу, который со временем приводит к смерти клеток и выпадению нейронов, возможно, посредством апоптоза (Epstein и Gendelman, 1993). Патологические данные (Sharer et al., 1986) включают уменьшение веса мозга с возрастом.
Воспалительный клеточный инфильтрат, состоящий из микроглии, лимфоцитов, плазматических клеток и особенно из многоядерных гигантских клеток, распределяется по всему мозгу, но особенно заметен в глубинных структурах, таких как базальные ганглии и стволе мозга. Присутствуют выраженные воспалительные изменения и кальцификация мелких или средних сосудов, особенно в глубоких структурах мозга. Это может объяснить возникновение ишемических инфарктов и инсультов у детей с ВИЧ-инфекцией (Frank et al., 1989; Parketal, 1990). В спинном мозге только в редких случаях развивается вакуолярная миелопатия, частая у взрослых (Dickson et al., 1989).
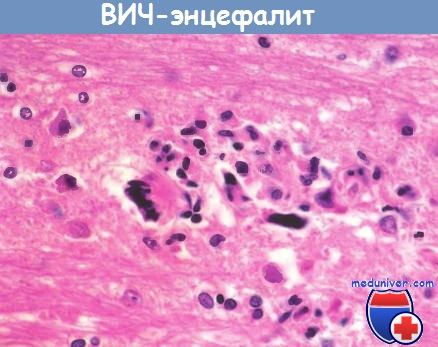
ВИЧ-энцефалит.
Обратите внимание на микроглиальные узелки
и многоядерные гигантские клетки.
Более тонкие когнитивные расстройства встречаются по крайней мере у 30% детей с ВИЧ-инфекцией, и у многих возникают сложности языкового и речевого характера и проблемы при обучении в школе (Tardieu et al., 1995; Pearson et al., 2000). В классических случаях у новорожденных представлены задержка в развитии, микроцефалия и двусторонний двигательный дефицит. Данная патология часто сочетается с другими оппортунистическими инфекциями, включающими в себя цитомегаловирусную и пневмоцистную пневмонии. В одном детальном исследовании, проведенном в США, у детей инфицированных как ВИЧ, так и ЦМВ отмечалось существенное повышение риска развития заболевания ЦНС с худшим отдаленным неврологическим прогнозом (Kovacs et al., 1999). У этих новорожденных клиническая картина напоминает таковую у детей со стойкими неврологическими повреждениями и проблемами развития; для них не характерна картина деменции, наблюдаемая у инфицированных взрослых или детей старшего возраста с более зрелой тканью мозга (Tardieu et al., 2000).
Более чем в двух третях случаев симптоматического течения на КТ выявляется атрофия мозга, повышенное размягчение белого вещества и примерно в четверти случаев кальцификация базальных ядер (Belman et al., 1986, DeCarli et al., 1993; Pearson et al., 2000). В большинстве случаев при MPT выявляются усиление сигнала в области белого вещества и признаки дегенеративных изменений коры головного мозга (Chamberlain et al., 1991; Pavlakis etal., 1995).
У маленьких детей в связи с персистентностью трансплацентарных материнских антител требуются прямые методы определения, включая либо ВИЧ РНК ПЦР, bДНК ВИЧ ПЦР, либо провирусную амплификацию ДНК ВИЧ. Прогрессирование ВИЧ заболевания и потребность в антиретровирусной терапии определяется клинической оценкой и подсчетом количества CD4 и вирусной нагрузки ВИЧ в плазме.
До эпохи успешного лечения ВИЧ инфекции лишь около 50% зараженных детей доживали до 10-летнего возраста, а при наличии неврологических признаков и симптомов присутствовал очень высокий риск стремительного прогрессирования заболевания во всех возрастных группах (Pearson et al., 2000). С появлением комбинированной антиретровирусной терапии (APT), большинство ВИЧ-инфицированных детей, вероятно, имеют больше шансов (Gibb et al., 2003).
Решающим является раннее выявление ВИЧ-инфицированных новорожденных с риском развития энцефалопатии, поэтому лечение может быть начато достаточно рано, чтобы предотвратить необратимое нейротоксическое повреждение, если это возможно (Sanchez-Ramon et al., 2003). По данным французского исследования, у 40 детей с APT до 6-месячного возраста не отмечено раннего начала тяжелой ВИЧ-инфекции, включая энцефалопатию на протяжении первых 24 месяцев жизни, тогда как в группе с отсроченной терапией (n=43) у 3 пациентов развилась энцефалопатия (Faye et al., 2004).
Хотя эти показатели незначительны, лечение в младенческом возрасте целесообразно для предотвращения необратимых неврологических осложнений. Однако в случаях, когда нейротоксическое повреждение двигательных нейронов уже произошло в детском возрасте, неудивительно, что оно не может восстановиться при комбинации APT (Foster et al., 2006). Тем не менее было подтверждено, что APT может предупредить или улучшить более тонкие нейропсихологические проблемы (Sanchez-Ramon et al., 2003). На данной стадии можно лишь предполагать, будут ли выжившие при вертикальной инфекции ВИЧ (с APT или без нее) иметь повышенный риск раннего развития ВИЧ-деменции или других неврологических синдромов во взрослом возрасте.
КТ-исследование ребенка с ВИЧ-энцефалопатией: кальцификация базальных ядер. Нейропатогенез ВИЧ.
Предположительно вирус инфицирует эндотелиальные клетки капилляров мозга и проникает через базолатеральную поверхность этих клеток к астроцитам, выстилающим гематоэнцефалический барьер (ГЭБ).
Инфицирование обоих типов клеток приводит к нарушению целостности ГЭБ и проникновению в мозг инфицированных Т-клеток и макрофагов.
В результате этого осуществляется ВИЧ-инфицирование других клеток мозга (например, олигодендроцитов и микроглии).
Затем начинается продукция ВИЧ и вирусных белков, а также высвобождение различных цитокинов (в частности, TNF и низкомолекулярных веществ).
Эти вещества могут вызывать нарушение межклеточной передачи сигнала, блокируя действие нейротропных факторов.
Прямое инфицирование клеток, а также высокая концентрация вирусных белков (например, гликопротеинов оболочки, Tat, Nef) и цитокинов оказывают прямое токсическое действие на нервные клетки, повреждая их мембрану.
Герпетический энцефалит у ребенка - причины, клиника, диагностика, лечение
Первичные энцефалиты характеризуются наличием вирусов и их репликацией в клетках-мишенях в ЦНС. Хотя большое число вирусов может индуцировать первичный энцефалит, в Западной Европе одним из наиболее распространенных возбудителей является вирус простого герпеса. Энтеровирусы также могут стать причиной первичного энцефалита. Однако в других странах, включая Северную Америку, важнейшим этиологическим фактором являются арбовирусы.
Не менее 90% случаев связаны с вирусом простого герпеса 1 типа, хотя и ВПГ-2 является широко распространенным возбудителем диссеминированной инфекции и энцефалитов новорожденных (Kennedy и Chaudhuri, 2002). До появления ацикловира смертность от герпетического энцефалита составляла более 70% и менее 3% пациентов выживали без тяжелых последствий. В западных странах заболевание среди всех возрастных групп встречается от 1 на 200000 до 1 на 400000 населения в год, что составляет около 10% всех тяжелых вирусных инфекций ЦНС.
31% случаев относятся к возрасту до 20 лет, из них 12% среди детей от 6 месяцев до 10 лет (Whitley et al., 1982b; Whitley и Kimberlin, 2005).
Первоначально большинство случаев герпетического энцефалита приписывали реактивации латентной вирусной инфекции, но геномный анализ вирусных штаммов от пациентов показал, что случаи энцефалита вызываются путем первичной инфекции, реактивации латентной инфекции и реинфекции новыми штаммами (Whitley и Alford, 1982). Первичное инфицирование у новорожденных и детей раннего возраста встречается в норме.
Герпетический энцефалит крайне цитопатический, патоморфологически характеризующийся некротическими поражениями, которые чаще всего имеют геморрагический характер с обширными участками размягчения и, в тяжелых случаях, с полной утратой нейрональных и глиальных элементов. Повреждение преобладает в орбитальной, средней височной, поясной и островковой коре и в некоторых случаях может распространяться на ствол мозга (Duarte et al., 1994). У перинатально инфицированных новорожденных повреждение обычно распространяется по всему мозгу. Внутриядерные эозинофильные включения (тельца Каудри типа А) можно обнаружить в нейронах, олигодендроцитах и астроцитах, а вирус может быть выделен из ткани и СМЖ.
Клиническим симптомам энцефалита в 60% случаев предшествуют продромальные явления, которые могут быть чисто системными, такими как лихорадка и недомогание, но встречаются и более специфичные при наличии очевидных расстройств памяти и поведения. Продромальная фаза обычно длится несколько дней с усилением симптомов угнетения сознания, патологического поведения и высокой лихорадки. Наиболее полная картина включает симптомы, обычные для всех случаев энцефалита, т.е. вялость, оглушенность или кома и судорожные припадки.
Судороги особенно часто встречаются и повторяются в случаях герпетической инфекции и почти всегда бывают очаговыми, особенно поражая лицо и верхнюю конечность, отражая грубую асимметрию повреждений, что несомненно является патологическим. Может также встречаться эпилептический статус фокальных судорог. ВЧД зачастую повышено, и отек зрительного сосочка представлен у 15% пациентов. Часто становятся заметны гемиплегия и афазия, нередко они являются первой находкой у более старших детей и подростков. Могут проявляться изменения, указывающие на очаговый некроз височнобазальных структур, такие как аносмия, обонятельные галлюцинации и расстройства поведения (Whitley et al., 1981).
С момента появления более чувствительного метода ПЦР для диагностики герпесных энцефалитов спектр заболеваний ЦНС, вызываемых этим вирусом у взрослых и детей, расширился за счет включения более легких и атипичных форм (Dennett et al., 1996). Общепризнано, что заболевание у пациентов с иммуносупрессией протекает длительнее (Kleinschmidt-DeMasters и Gilden, 2001).
В отличие от диффузных медленных волн на ЭЭГ при других менингитах, запись при ВПГ обычно очень асимметрична, и часто выявляется четкий очаг спайков при патологически замещенной фоновой активности. Низкая амплитуда в одной или многих областях, особенно над височной долей, не является необычной. В этих же областях часто имеются периодические комплексы через 1-3 секунды, но обычно они имеют транзиторный характер (Mizrahi и Tharp, 1982). Периодические комплексы возникают чаще всего между 2-15 сутками болезни и реже выявляются в более поздние сроки (Schauseil-Zipf et al., 1982). Они не специфичны, но могут встречаться при энцефалите, вызванном М. pneumoniae (Hulihan et al., 1992) или вирусом Эпштейна-Барр.
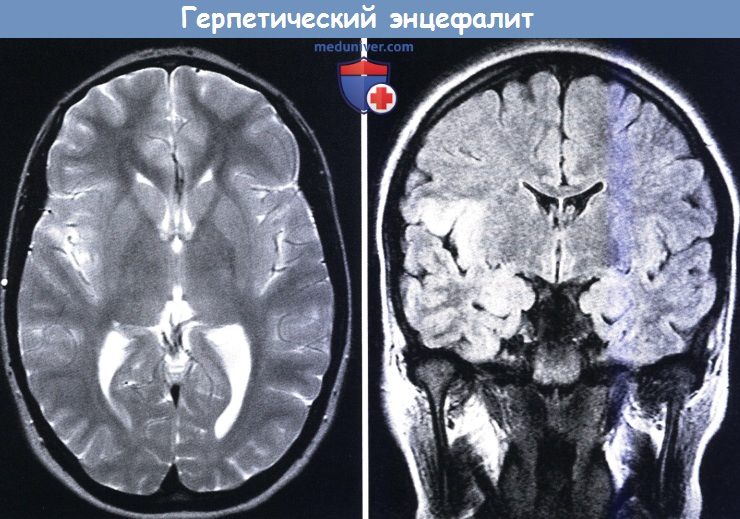
FLAIR (слева) и Т2-взвешенное (справа) МРТ:
гиперинтенсивные зоны в правой островковой коре и задне-базальной части лобной доли как вторичные проявления герпетического энцефалита.
Сканирование мозга может дать нормальные показатели в первые 24-48 часов после начала заболевания, а изменения на МРТ визуализируются до изменений на КТ (Kapur et al., 1994). На МРТ можно увидеть очаговый отек в средних отделах височной и орбитальной поверхности лобных долей, коры островка и угловой извилины. Патологическая КТ обычно показывает сниженное затухание в одной или обеих лобных или височных долях и иногда участки гиперэхогенности, представляющие небольшие кровоизлияния, в более чем 50% случаев также может быть смещение срединных структур (Greenberg et al., 1981; Dutt и Johnston, 1982).
В ходе течения болезни может наблюдаться начальное распространение поражения (Koskiniemi и Ketonen, 1981). Позже постепенно появляется и остается атрофия паренхимы с отчетливым преобладанием в перисильвиевой и височной области, иногда развивается кальцификация. Полное исчезновение патологических изменений на КТ у детей отмечается редко, но бывает у взрослых.
Ликвор может быть нормальным у 20-25% пациентов. В большинстве случаев он находится под повышенным давлением и содержит избыточное количество клеток, обычно лимфоцитов, и менее, чем 50 мононуклеаров/мм 3 приблизительно в четверти случаев (Whitley et al., 1982b). СМЖ часто геморрагическая или ксантохромная из-за некротического и геморрагического характера поражений.
Диагностика герпетического энцефалита основана на ПЦР амплификации ДНК вируса простого герпеса из ликвора. Этот метод высоко чувствительный (>95%) и специфичный (>95%), но могут встречаться ложноотрицательные результаты ПЦР в образцах, взятых рано, в течение первых 24-48 часов или позднее, через 10-14 дней и у пациентов, получавших лечение ацикловиром (Lakeman и Whitley, 1995; Koskiniemi et al., 1996; Davis, 2000). Количественное соотношение ДНК-копий вируса в миллилитре ликворной жидкости и степени повреждения ЦНС до сих пор не изучалось (Tyler, 2004). При отрицательном результате ПЦР наличие четырехкратного увеличения титра антител против ВПГ-1 инфекции в СМЖ является значимым, но требуется не менее 10-14 дней для их появления (Koskiniemi et al., 1984).
Изначально антитела принадлежат к классу IgM, позднее сменяющимся типом IgG. Они связаны с наличием олигоклонального белка в СМЖ (Mathiesen et al., 1988). Антитела и олигоклональные структуры могут персистировать годами, после приступа герпетического энцефалита (Tardieu и Lapresle, 1980), отражая сохранение ВПГ в ЦНС.
При наличии анамнестических, клинических и/или полученных при визуализации признаков герпетического энцефалита лечение должно быть начато немедленно. Биопсия мозга показана только в исключительных случаях детям, у которых после сканирования мозга предполагается другой диагноз, требующий иного лечения, а не для подтверждения диагноза ВПГ. Такие диагнозы могут включать абсцессы мозга, опухоли или гранулематозный менингит (Whitley et al, 1989). Другие состояния, имитирующие герпетический энцефалит, такие как паранеопластический лимбический энцефалит или митохондриальная энцефаломиопатия с лактоцизом и инсультоподобные эпизоды (MELAS) (Johns et al., 1993), у детей встречаются редко.
Лечение герпетического энцефалита проводится аналогом нуклеозидов — ацикловиром, который ингибирует ДНК-полимеразу ВПГ и таким образом, вирусную репликацию (Skoldenberg et al., 1984; Whitley et al, 1986). Ацикловир фосфорилируется в активную форму с помощью вирусной тимидин-киназы в ВПГ инфицированных клетках и поэтому нетоксичен для здоровых клеток хозяина. В оригинальном рандомизированном контролируемом исследовании Skoldenberg et al., смертность среди взрослых с лечением ацикловиром составила 19% в отличие от 70% смертельных исходов без лечения, существенные последствия встречались в 14%, а 56% пациентов были выписаны с полным выздоровлением.
Даже при начале лечения вскоре после начала заболевания почти у двух третей выживших сохраняются остаточные неврологические расстройства, а у детей в возрасте менее 12-18 месяцев наблюдались наиболее неблагоприятные прогнозы по показателям заболеваемости и смертности (Whitley и Kimberlin, 2005). Среди последствий выделяют гемиплегию (Rautonen et al., 1991), билатеральный оперкулярный синдром (van der Poel et al., 1995) и тяжелую эпилепсию, которая у новорожденных может проявляться в виде инфантильных спазмов. Часто наблюдаются изменения в поведении. Обычно имеется афазия из-за частых поражений височной локализации, которая может быть глобальной или более специализированной.
Резистентные штаммы ВПГ у детей встречаются редко; они более распространены у пациентов с ослабленным иммунитетом, которых часто лечили ацикловиром и в таких случаях может потребоваться использование других противовирусных средств, таких как фоскарнет или цидофовир (Whitley, 2002). Применение кортикостероидов совместно с противовирусными препаратами оправдано для устранения отека, но в связи с сопутствующим риском снижения реакции хозяина их использование не рекомендуется (Wood et al., 1994).
Как и у взрослых, лечебная дозировка ацикловира у детей составляет 10 мг/кг (или 500 мг/м 2 ) внутривенно каждые 8 часов (доза в мг/м 2 несколько превышает общую суточную дозу при дозировании в мг/кг). Внутривенное введение препарата рекомендовано для поддержания адекватной дозы, проникающей в ЦНС. В целом дети очень хорошо переносят ацикловир, хотя при высоких дозах при отсутствии достаточной дегидратации возможна нефротоксичность. В подтвержденных случаях курс терапии проводится 21 день; более короткие курсы лечения были связаны с повышенным риском рецидивов. Дети раннего возраста и новорожденные, по всей видимости, более подвержены риску или рецидиву (Davis, 2000; Ito et al„ 2000; Love et al., 2004; Valencia et al., 2004).
Хотя в некоторых случаях рецидив обусловлен возвратом вируса в ЦНС, другим этиологическим фактором может быть иммуноопосредованный механизм, связанный со вторичной демиелинизацией (Barthez et al., 1987; Pike et al, 1991; Rautonen et al., 1991; De Tiege et al., 2003, 2005). Рецидив у детей может быть связан с хореоатетоидным синдромом, который имеет плохой прогноз (Barthez et al, 1987; Shanks et al., 1991; Wang et al., 1994; Valencia et al., 2004). Рецидив также может быть связан с отсутствием выработки антител против ВПГ в ликворе (De Tiege et al., 2006).
У новорожденных более высокая доза ацикловира (20 мг/кг внутривенно каждые 8 часов до 21 дня) увеличила эффективность по показателям смертности и заболеваемости (Kimberlin et al., 2001). Увеличение дозы сопровождалось легкой нейтропенией у большинства пациентов, но при более тяжелой форме проводили поддержку колониестимулирующим фактором гранулоцитов. В связи с более обширным и диффузным поражением ЦНС и незрелым иммунным ответом у новорожденных, рекомендуется повторить исследование СМЖ методом ПЦР после лечения для подтверждения очистки от вирусов (Kimberlin, 2004). Кроме того, постоянная профилактика высокими дозами перорального ацикловира в первые 1-2 года жизни рекомендуется для снижения риска реактивации вируса и дальнейшего поражения ЦНС (Tiffany et al., 2005). Спорным остается вопрос о необходимости профилактики младенцам и детям после неонатального периода.
Обычная клиническая дилемма возникает при отрицательном результате ПЦР ликвора в случае начатого лечения пациента с фебрильным энцефалитом. Можно ли остановить начатое лечение ацикловиром, особенно с учетом того, что трехнедельное внутривенное введение препарата весьма обременительно для маленьких детей? Если не было выявлено иного диагноза, наш прагматичный подход при таких обстоятельствах допускает раннее прекращение лечения ацикловиром только в тех случаях, если клинически состояние ребенка возвращается к нормальному, данные ЭЭГ в пределах нормы, и УЗ-сканирование мозга хотя бы 5-7 дней не выявляет патологии. Но при выявлении очаговых патологических изменений при УЗ-сканировании или ЭЭГ необходимо провести полный курс (21 день).
Другие герпесвирусные энцефалиты. Они менее распространены и чаще всего связаны с иными механизмами, чем прямое внедрение.
• Вирус ветряной оспы. Первичное инфицирование ВОГ (ветряной оспы) может вызвать как постинфекционный энцефалит, обычно мозжечковый энцефалит, так и первичный энцефалит, чаще с более размытым проявлением, возникающим в первые пять дней вместе с высыпанием новых везикулярных элементов. Сообщалось о нескольких случаях раннего преэруп-тивного начала энцефалита (Maguire и Meissner, 1985). Манифестация патологии ЦНС, вызванной ВОГ, также встречается при повторной инфекции ветряной оспы или даже без каких-либо кожных поражений, что более характерно для взрослых или для пациентов с ослабленным иммунитетом (Koskiniemi et al., 2002). Количественный анализ ДНК ВОГ в ликворе показывает повышенные уровни у пациентов с более тяжелым течением заболевания (Aberle et al., 2005). Ветряная оспа может вызывать и синдром Рейе.
Ветряночный церебеллит обычно имеет легкое течение, проявляясь острой атаксией у детей с недавней перенесенной инфекцией в анамнезе и в большинстве случаев с полным выздоровлением через несколько недель. В одном из небольших исследований у некоторых детей с таким постинфекционным состоянием были выявлены высокие титры аутотоантител, реагирующих на ткань мозга или мозжечка (Adams et al., 2000). Лечение ацикловиром (500 мг/м 2 /дозу через каждые 8 часов) может быть эффективным против острого энцефалита, но не требуется при постинфекционном церебеллите.
Диагноз энцефалита, вызванного ВГЧ-6/7, основывается на выделении вируса из ликвора и/или сероконверсии в крови. Эти вирусы имеют отношение также к энцефалитам у у детей с ослабленным иммунитетом.
• Вирус Эпштейна-Барр. Большинство случаев инфицирования ВЭБ на раннем этапе жизни бессимптомно; позднее могут развиваться симптомы инфекционного мононуклеоза. Неврологические проявления инфекции В-клеточным лимфотропным вирусом герпеса встречаются редко, но первичное инфицирование может быть связано с энцефалитическими поражениями (Domachowske et al., 1996; Hung et al., 2000). Другие неврологические проявления включают острый паркинсонизм с последующим полным выздоровлением (Hsieh et al., 2002); энцефалит ствола мозга, имитирующий опухоль (Angelini et al., 2000); и постинфекционные энцефалитные синдромы (Weinberg et al., 2002). Реактивация латентной инфекции ВЭБ также может проявляться в виде неврологического заболевания, и в одном из исследований наблюдалась связь с продолжительными последствиями, включающими гиппокампальный склероз (Hausler et al., 2002).
ДНК вируса может быть амплифицирована из СМЖ в течение острого энцефалита, хотя более высокие уровни ДНК ВЭБ обнаруживаются у пациентов с иммунодефицитом с вызываемой ВЭБ лимфомой ЦНС (Weinberg et al., 2002).
• Цитомегаловирус. Инфицирование плода ЦМВ может привести к тяжелому повреждению ЦНС, тогда как первичная инфекция в детском возрасте обычно имеет бессимптомное течение, хотя в редких случаях возможно заболевание, подобное инфекционному мононуклеозу. Как и при всех других герпесвирусах, первичная инфекция может быть представлена в виде латентной с последующей реактивацией. Она также обычно бессимптомная, исключая хозяев с ослабленным иммунитетом, у которых могут развиваться симптомы сочетанных заболеваний.
Герпетический энцефалит — это диффузное или очаговое поражение мозгового вещества, вызванное герпесвирусами ВПГ-1, ВПГ-2, Varicella Zoster. Основные симптомы болезни: фебрильная лихорадка, прогрессирующее угнетение сознания, судорожные приступы. По завершении острого периода инфекции в течение длительного времени сохраняются резидуальные неврологические нарушения. Для установления диагноза необходимо проведение ПЦР-диагностики ликвора, томографии головного мозга, электроэнцефалограммы. Лечение патологии включает противовирусные препараты, противоотечную, нейрометаболическую и противосудорожную терапию.
МКБ-10
Общие сведения
Энцефалит герпетического происхождения составляет до 15-20% всех вирусных воспалительных процессов в мозговой ткани. Симптомы встречаются с частотой 4-5 случаев на 1 млн. населения, причем до трети больных составляют дети, а еще около 20% приходится на возрастную категорию старше 60 лет. Заболевание не теряет своей актуальности в современной неврологии, поскольку для успешного исхода патологии необходимо вовремя поставить диагноз и начать лечение, а промедление в оказании медицинской помощи чревато смертью пациента.

Причины
Болезнь в 95% случаев вызывается вирусом простого герпеса 1 типа, что объясняется высокой распространенностью возбудителя. По данным ВОЗ, около 2/3 населения мира в возрасте до 50 лет инфицированы ВПГ-1. На втором месте по частоте находится Varicella Zoster Virus (VZV) — возбудитель ветряной оспы, опоясывающего герпеса. Энцефалит, вызванный ВПГ-2, встречается редко, преимущественно у иммунокомпрометированных пациентов.
Ведущим среди факторов риска служит сниженный иммунный статус. Герпетическая инфекция протекает латентно, активизируется на фоне нарушения общей резистентности организма (при переохлаждении, стрессе, менструации у женщин). В группе риска находятся люди с врожденными и приобретенными иммунодефицитами, больные, получающие лечение иммуносупрессивными препаратами. К триггерам относят реинфицирование другими штаммами герпесвирусов, сопровождающееся аутоиммунными реакциями.
Патогенез
Первичное заражение ВПГ-1, как правило, происходит в детстве при попадании вирусных частиц на слизистые оболочки, после чего возбудитель начинает размножаться, мигрирует в нервные ганглии, где длительное время находится в состоянии латентной инфекции. Заражение ВПГ-2 наблюдается после начала сексуальной жизни через слизистые половых путей, а дальнейший путь развития патогена сходен с ВПГ-1.
Симптомы болезни в большинстве случаев возникают при реактивации инфекции под действием провоцирующих факторов. Герпесвирусы проникают в головной мозг гематогенным путем либо по нервным стволам (через тройничный или обонятельный нерв). Из гассерова узла они распространяются на таламус, подкорковые ядра, кору больших полушарий. При распространении по ольфакторному тракту первой страдает лимбическая система (гиппокамп, височная кора).
Симптомы герпетического энцефалита
В типичном течении острого мозгового воспаления выделяется несколько последовательных стадий: ранняя, период разгара болезни, регресс признаков, стадия остаточных явлений. В 70% патология манифестирует с внезапно возникшей высокой лихорадки (более 39°С), сопровождающейся интенсивными головными болями в лобно-височной зоне, сильной сонливостью, рвотой, не связанной с приемом пищи.
На вторые-третьи сутки симптомы дополняются нарушениями сознания: больные начинают путаться во времени и пространстве, не узнают родственников, испытывают разнообразные галлюцинации. По мере усугубления тяжести состояния появляются фокальные или генерализованные судорожные припадки. Изредка наблюдается оперкулярный автоматизм — повторяющиеся причмокивающие или сосательные движения.
В среднем через 3 дня заболевание переходит в стадию разгара. Основное проявление — глубокое угнетение сознания вплоть до комы. Пациенты не отвечают на звуковые и тактильные раздражители, однако двигательные реакции на болевые стимулы остаются в пределах нормы. Также могут возникать симптомы декортикации или децеребрации, аритмичное дыхание, двусторонние моторные нарушения.
Если пациенту было предоставлено комплексное лечение, с 3-4 недели начинается обратное развитие симптомов герпетического энцефалита. Этот этап длится от нескольких месяцев до 1 года, характеризуется постепенным восстановлением временно утраченных неврологических функций. По окончании третьей стадии около 80% больных имеют стойкие резидуальные (остаточные) явления, которые могут сохраняться пожизненно.
Осложнения
В остром периоде прогностическим неблагоприятным является прогрессирование отека мозга, что чревато его вклинением. При височно-тенториальной форме вклинения возникает триада признаков: потеря сознания, гемипарез, анизокория. Симптомами транстенториальной формы являются отсутствие реакции зрачков на свет, фиксация глазных яблок по срединной линии, двусторонний гипертонус мышц. Зачастую нарушается работа дыхательного центра.
Патология имеет тяжелое течение, при отсутствии своевременной медицинской помощи летальность достигает 70%. Даже если проводится этиотропное лечение, смертельный исход регистрируется у 15-20% пациентов, чаще у младенцев, пожилых людей, больных из группы риска. У выздоровевших полный регресс неврологической симптоматики наблюдается только в 20% случаев, а остальные сталкиваются с резидуальными симптомами.
Наиболее опасным хроническим осложнением заболевания считается прогрессирующее вегетативное состояние (акинетический мутизм), характеризующийся необратимым разрушением высших психических функций. У больных сохранено сознание, витальные функции (дыхание, кровообращение), однако полностью отсутствует познавательная деятельность. Такие пациенты не говорят, не реагируют на внешние раздражители, требуют постоянного ухода.
К типичным последствиям герпетической формы энцефалита относится синдром Клювера-Бьюси, при котором развиваются тяжелые длительные расстройства психической и когнитивной сферы. Симптомы расстройства включают ажитированное состояние, агрессивность, патологическую гиперсексуальность. Также наблюдаются интеллектуальные нарушения, проблемы с концентрацией внимания, ослабление памяти.
Диагностика
Обследованием пациента занимаются инфекционисты, неврологи, врачи экстренной помощи и реанимационного отделения. Заподозрить энцефалит удается по острому началу, наличию фебрильной лихорадки, сочетанию общемозговых и очаговых симптомов. Для подтверждения заболевания, уточнению этиологии воспалительного процесса назначаются следующие методы исследования:
Лечение герпетического энцефалита
Консервативная терапия
Герпетический энцефалит характеризуется быстрым нарастанием неврологического дефицита, прогрессированием общемозговых симптомов, поэтому комплексное лечение должно начинаться в максимально ранние сроки. Наилучшие шансы на полное выздоровление у пациентов, которые начали получать этиотропные препараты в первые сутки манифестации болезни. Лечение заболевания включает следующие группы медикаментов:
Реабилитация
Благотворное влияние на состояние ЦНС после перенесенного герпетического энцефалита оказывают витаминные комплексы (витамины группы В, аскорбиновая кислота) в сочетании с антиоксидантами. Восстановительное лечение также включает ноотропы и нейрометаболические препараты для улучшения когнитивных мозговых функций. Коррекция иммунологического статуса проводится адаптогенами, актопротекторами, неспецифическими иммуномодуляторами.
Для восполнения энергозатрат организма, стимуляции репаративных процессов показано адекватное по калорийности и витаминному составу энтеральное питание. Большое внимание уделяется физиотерапевтическим процедурам, массажу и лечебной физкультуре, направленным на улучшение двигательной функции. При наличии показаний рекомендуются занятия с логопедами, дефектологами.
Прогноз и профилактика
Несмотря на проводимое этиотропное лечение, прогноз при герпетическом энцефалите остается неблагоприятным, показатель летальности составляет 15-20%. У большинства выздоровевших сохраняется неврологический дефицит. Для предупреждения заболевания необходима рациональное лечение герпеса кожи и слизистых оболочек, своевременное консультирование больных с диссеминированной герпетической инфекцией.
2. Менингиты и энцефалиты: уч. пос. для врачей/ Д. А. Валишин, Р. Т. Мурзабаева, А. П. Мамон, М. А. Мамон, Л. В. Мурзагалеева. — 2012.
3. Герпетическое поражение нервной системы/ М.Н. Лебедюк, М.Э. Запольский, Ю.И. Горанский// Украинский журнал дерматологии, венерологии, косметологии. — 2011. — №2.
4. Герпетический энцефалит/ Т.В. Матвеева, Н.В. Токарева, Г.А. Шакирзянова// Неврология. — 2006. — №16.
Читайте также:

