Герпетический ганглионит черепных и спинальных нервов
Обновлено: 18.04.2024
Вирус герпеса третьего типа varicella zoster (VZV) вызывает два клинически обособленных заболевания - ветряную оспу и опоясывающий герпес (Баринский И.Ф. и др., 1986; Haanpaa M., 2001). Оба заболевания, прежде всего, характеризуются везикулярной сыпью. Первичная инфекция манифестирует в форме ветряной оспы (ветрянки), а реактивация латентного VZV обусловливает появление локализованных высыпаний - опоясывающего лишая (Хахалин Н.Н., 2002). Мысль о связи между ветрянкой оспой и опоясывающим лишаем впервые была высказана в 1888 венским врачом Яношом Бокеем (von Bokay J., 1909).
Эпизод ветряной оспы в детстве способствует формированию специфической клеточной и гуморальной иммунной защиты. Считается, что рецидив инфекции у таких пациентов может развиться только на фоне недостаточности иммунной защиты, вследствие снижения активности специфических натуральных киллеров, Т-киллеров и системы интерферонов (Fleming D.M. et al., 2004). После первичной инфекции излюбленным местом персистенции VZV являются ганглий тройничного нерва и спинномозговые ганглии чувствительных корешков грудного отдела спинного мозга, где VZV находится в латентном состоянии. В течение этого времени вирус не размножается и не проявляет патогенных свойств. По-видимому, время латентного состояния вируса определяется уровнем специфических антител к VZV. Снижение их количества ведет к реактивации вируса, вирусной репликации (размножению), что на клиническом уровне и проявляется в виде опоясывающего лишая (Arvin A., 2005). Данный вывод подтверждается высокой корреляцией между вероятностью возникновения опоясывающего лишая у людей пожилого возраста и возрастным ослаблением активности клеточного звена иммунитета (Gilden et al., 2000)., На это также указывают данные, свидетельствующие о более высокой заболеваемости опоясывающим герпесом среди лиц, инфицированных вирусом иммунодефицита человека (Gilson I.H. et al., 1989), однако точные механизмы, лежащие в основе перехода вируса из латентного состояния в активное неизвестны.
В случае реактивации VZV ганглии чувствительных нервов становятся местами репликации вируса, именно в них обнаруживаются наиболее выраженные дегенеративные повреждения нейронов (Zerboni L. et al., 2005; Reichelt M. et al., 2008). В результате развивается ганглионит, сопровождаемый распространением инфекции вниз по нервным аксонам к коже. Каким образом происходит транспортировка вируса в поврежденных аксонах неизвестно. Инфекция также может распространяться центрально, приводя к воспалению оболочек в области передних и задних рогов спинного мозга (Gray F. et al. 1994). Отдельные патолого-анатомические наблюдения также свидетельствуют о наличии воспалительных изменений и в контралатеральных спинномозговых ганглиях (Miller S. E. et al., 1997), отмечается снижение количества нейронов и наличие воспалительных инфильтратов в ганглиях, периферических нервах, и спинномозговых корешках (Gowrishankar K. et al., 2007). В некоторых случаях отмечается выраженные некротические изменения в спинномозговых ганглиях. Большинство изменений в периферическом нерве протекает по типу Валлериановской дегенерации, имеющей место, как в толстых, так и в тонких волокнах. (Denny-Brown et al., 1944).
Острая VZV инфекция клинически характеризуется стадией продрома и стадией везикулярных высыпаний (Arvin A., 2005).
Сыпь обычно локализуется в одном или нескольких смежных дерматомах и сопровождается развитием острой невропатической боли. У 50% больных сыпь встречается на туловище, у 20% - на голове, у 15% - на руках, и у 15% - на ногах (Arani R.B. et al., 2001).
Клинический диагноз опоясывающего лишая в типичных случаях достаточно прост. Однако иногда требуется проведение лабораторной диагностики с целью идентификации вируса. Наиболее быстрым и высокочувствительным методом является полимеразная цепная реакция.
В остром периоде болезни или после него возможно развитие осложнений, захватывающих различные системы организма. Наиболее серьезными считаются неврологические осложнения. В структуре неврологических расстройств ведущее место занимает поражение периферической нервной системы. При данном заболевании воспалительный процесс затрагивает региональные, чувствительные ганглии с развитием ганглиолитов. Наличие у больных корешковых болей, парастезий, сегментарных нарушений чувствительности отмечается практически у каждого больного (Stankus S. et al., 2000; Thyregod H. G. et al., 2007). Болевой синдром имеет выраженную вегетативную окраску в виде жгучих, приступообразных, резких болей, усиливающихся в ночное время. В головном мозге при опоясывающем герпесе могут быть обнаружены явления отека, выраженная диффузная инфильтрация подпаутинного пространства, геморрагии в белом веществе, базальных ганглиях (Sissoko D. et al., 1998). Следует заметить, что осложнения со стороны головного и спинного мозга в настоящее время встречаются редко. В случаях развития VZV-инфекции в области тройничного нерва часто наблюдаются осложнения со стороны глаз - кератит, ирит, ретинит, офтальмит. Ранее, при отсутствии специфической противогерпетической терапии, к частым осложнениям VZV-инфекции относились пневмонии, энцефалиты или гепатиты, иногда приводившие к летальному исходу.
Вместе с тем, из всех перечисленных осложнений VZV инфекции самым распространенным считается постгерпетическая невралгия (Dworkin R.H., Portenoy R.K., 1996).
Различают острую герпетическую невралгию (в течение 30 дней после начала заболевания) и постгерпетическую невралгию (Choo P. et al.,1997). К ПГН относят упорные боли в областях, затронутых герпесной инфекцией после заживления кожи (Dworkin R. et al. 2003). Наиболее хорошо установленными факторами риска для ПГН являются пожилой возраст, большая распространенность высыпаний на коже и выраженная боль перед везикулярной сыпью (Desmond R.A. et al., 2002; Fleming D.M. et al., 2004). Все эти факторы находятся во взаимосвязи, поэтому пациенты 50 лет и старше в большинстве случаев испытывают тяжелую, нестерпимую боль и значительные кожные высыпания, что гораздо чаще приводит к развитию ПГН. У пациентов со всеми этими факторами риск развития ПГН превышает 50-75 % (Gnann J., Whitley R. 2002; Jung B.F., 2004). Постгерпетическая невралгия может развиться в любом возрасте, однако для нее характерна прямая корреляция частоты встречаемости и длительности ПГН с возрастом. Более 50% всех пациентов с ПГН - старше 60 лет, 75% больных с указанной патологией приходится на возрастную группу старше 75 лет (Nurmikko T.J., 2001). Половина всех пациентов с ПГН старше 60 лет испытывает постоянную боль более 6 месяцев, в то время как в возрастной группе 30-50 лет ПГН более 6 месяцевь наблюдается у 10% больных (Whitley R. et al. 1996). В США ежегодно регистрируется 100-200 тыс. новых случаев ПГН (Nurmikko T.J., 2001). Однако, истинная распространенность ПГН не известна, не только потому, что эпидемиологические данные недостаточны, но также из-за отсутствия конценсусса по определению ПГН. Некоторые авторы относят к ПГН боли, возникающие в любой период герпесной инфекции, другие считают, что ПГН - это боль, сохраняющаяся спустя 3 месяца после заживления кожи. В первом случае определения ПГН ее распространенность составляет 8%, во втором - 4,5% (Choo P. et al. 1997). Постоянную боль в течение 1 мес после сыпи испытывают до 15% пациентов и около 4% пациентов от общего количества перенесших опоясывающий лишай отмечают сохранение боли в течение года (Lancaster T. et al. 1995).
Классическое проспективное исследование, проведенное Hope-Simpson (1975), продемонстрировало, что из 321 пациента с опоясывающим лишаем 10 % имеют выраженную боль спустя 3 месяца после острой герпетической инфекции, а 4 % - и через 12 месяцев. Подобные результаты были получены и в других проспективных исследованиях (Helgason S. et al. 1996; 2000; Scott F.T. et al., 2006), в которых также было показано, что наибольший риск пролонгации болевого синдрома после перенесенного опоясывающего лишая имеют пациенты в возрасте около 60 лет.
Постгерпетическая невралгия занимает третье место по частоте встречаемости среди различных типов невропатической боли и уступает только болям в нижней части спины и диабетической невропатии (Montero H.J. et al., 2005; Breivik H. et al, 2006; Torrance N. et al., 2006).
Локализация болевого синдрома практически всегда соответствует зоне кожных высыпаний. Интенсивность болевого синдрома как правило высокая. Кроме глубоких ноющих и стреляющих болей очень характерны поверхностные жгучие боли и наличие стимулозависимых болей - динамической гипералгезии и аллодинии (Baron R., 2004).
При клиническом осмотре в зоне болей выявляются нарушения поверхностной чувствительности. Качество боли в острый период опоясывающего лишая и при ПГН различно. Вместе с тем, несмотря на разный выбор дескрипторов из МакГилловского болевого вопросника, пациенты с опоясывающим лишаем и ПГН для описания своих болевых ощущений выбирают похожие по смыслу слова, например, горячая и жгучая боль или пронзающая и простреливающая боль (Bennett M., 2001).
Схожие проявления наблюдаются и при описании вызванной боли пациентами с опоясывающим лишаем и ПГН. И те, и другие отмечают наличие схожих типов гипералгезии и аллодинии (Haanpaa M. et al., 2000; Berry J.D., Rowbotham M.C., 2004).
У большинства пациентов боль, связанная с ПГН, уменьшается в течение первого года. Однако у части больных она может сохраняться годами и даже в течение всей оставшейся жизни, причиняя немалые страдания (Cunningham A.L., Dworkin R.H., 2000). Затяжной, тяжелый характер заболевания с длительным, выраженным болевым синдромом способствует формированию расстройств психики (Dworkin R.H., et al., 1992). У таких пациентов выявляются тревожно-депрессивные расстройства, когнитивные нарушения - снижение активного внимания, памяти, затруднения осмысления происходящего, отмечается некритичность, нетерпеливость, неряшливость, страх боли, неуверенность в завтрашнем дне, отмечается снижение социальной активности (Haythornthwaite J.A. et al., 2003). ПГН оказывает значительное отрицательное влияние на качество жизни и функциональный статус пациентов особенно пожилого возраста (Lydick E. et al., 1995). У пациентов с ПГН отмечается хроническая усталость, снижение массы тела, физической активности, нарушения сна (Morin C.M., Gibson D., Wade J., 1998).
В основе боли, связанной с ПГН, лежат воспалительные изменения или повреждения ганглиев задних корешков спинного мозга и периферических нервов в пораженных зонах тела. Такие боли относят к невропатическим болям, их выделяют в отдельную самостоятельную группу и определяют как боли, возникающие вследствие первичного повреждения соматосенсорной нервной системы (Treede R.D. et al., 2008).
Патофизиологической основой невропатических болевых синдромов являются нарушения генерации и проведения ноцицептивного сигнала в нервных волокнах, а также механизмов контроля возбудимости ноцицептивных нейронов в структурах спинного и головного мозга (Кукушкин М.Л., Хитров Н.К., 2004; Baron R. 2000).
Лечебная тактика при опоясывающем лишае включает два основных направления: противовирусная терапия и купирование невропатической боли, как в острый период заболевания, так и в стадии постгерпетической невралгии. Результаты нескольких рандомизированных контролируемых испытаний свидетельствуют о том, что раннее начало лечения простого герпеса может предотвратить развитие постгерпетической невралгии или способствовать ее скорейшему разрешению (Исаков В.А. и др., 2004; Helgason S. et al., 1996; Jackson J.L. et al., 1997 ; Volmink J. et al., 1996).
Наиболее широкое применение нашли такие специфические противогерпетические препараты, как ацикловир, фамцикловир и валацикловир, которые, являясь нуклеозидными аналогами, блокируют вирусную репликацию (Романцев М.Г., 1996; Beutner K. et al., 1995; Bruxelle J., 1995). Важно, что противовирусное лечение проявляет наивысшую активность, если назначено в течение 72 ч от начала герпетических высыпаний (Johnson R., 2001; Johnson R., Dworkin R.H., 2003). В ряде исследований доказана высокая эффективность ацикловира в уменьшении тяжести, продолжительности острой герпесной инфекции и профилактике ПГН, особенно при его раннем назначении. Оценка эффективности фамцикловира также продемонстрировала уменьшение времени до разрешения сыпи (Dworkin R.H. et al., 1998). В сравнительном исследовании ацикловира и валацикловира показана эквивалентная эффективность в сокращении продолжительности невропатической ПГН (Beutner K. et al. 1995). В другом клиническом испытании установлена терапевтическая эквивалентность фамцикловира и валацикловира для неосложненного герпеса (Tyring S. et al. 2000). Возможно также сочетанное использование противовирусной терапии и глюкокортикостероидов (Whitley R. et al. 1999). Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных аспектов качества жизни пациентов. Комбинация ацикловир+преднизолон значительно быстрее купирует острую невралгию и возвращает пациента к обычной жизнедеятельности, но существенно не влияет на течение ПГН, то есть она наиболее показана в остром периоде в старших возрастных группах для терапии острого болевого синдрома. Доказано, что хотя преднизолон является иммуносупрессором, его использование не увеличивает частоты развития ПГН и в этом смысле его действие сравнимо с влиянием плацебо, то есть данная комбинация может быть спокойно использована в старших возрастных группах. Для некупируемых тяжелых случаев ПГН некоторые исследователи рекомендуют интратекальное введение метилпреднизолона (Kost R., Straus S., 1996).
В настоящее время в США делается акцент на профилактику герпетической инфекции. С 1995 г. в США проводится всеобщая вакцинация от ветряной оспы, особенно пожилых лиц, и с 1999 г. отмечается резкое снижение заболеваемости (Hambleton S., Gershon A., 2005; Oxman M.N. et al., 2005).
При постгерпетической невралгии препаратами с доказанной эффективностью (класс А - терапия первой линии) являются: пластины с 5% лидокаином, габапентин, прегабалин, трициклические антидепрессанты, трамадол (Attal et al., 2006).
На сегодняшний день эффективность применения пластин с 5% лидокаином (Версатис, Grunenthal Gmbh) убедительно доказана при лечении ПГН. Так, в нескольких рандомизированных клинических исследованиях установлено, что применение пластин с 5% лидокаином статистически достоверно более значимо облегчает проявления болевого синдрома у пациентов с постгерпетической невралгией по сравнению с плацебо (Rowbotham M.C., 1996; Galer B.S., 1999, 2002). На основании полученных данных FDA одобрило применение данного препарата в качестве стартовой терапии у пациентов с постгерпетической невралгией. (Richard L. et al., 2004)
Версатис - это топический анальгетик, который действует непосредственно там, где болит. Он выпускается в виде мягких пластин размером 10х14 см, которые наклеиваются на неповрежденную кожу без признаков воспаления. Медленно высвобождающийся из пластины лидокаин создает более или менее значительную концентрацию лишь в поверхностных слоях кожи, где проходят тонкие волокна, обеспечивающие болевую и температурную чувствительность (Gammaitoni AR, Davis MW. 2002.). Лидокаин лишь в незначительной степени проникает в более глубокие слои кожи, где проходят кровеносные сосуды, поэтому его попадание в системный кровоток сведено к минимуму. У пациентов, использовавших пластины Версатис, не наблюдалось никаких известных системных эффектов лидокаина (влияние на деятельность ЦНС и сердечно-сосудистой системы). Таким образом, важнейшим преимуществом пластин Версатис служит отсутствие системного действия, что гарантирует безопасность лечения. Практически полное отсутствие системного эффекта позволяет назначать Версатис совместно с любыми другими препаратами для лечения нейропатической боли.
Механизм лечебного эффекта препарата Версатис не ограничивается только действием высвобождающегося из них лидокаина. Важное значение имеет также то, что пластина выполняет роль механического барьера, препятствуя раздражению участка кожи с измененной чувствительностью (аллодиния), а также оказывает не него легкое охлаждающее действие (Galer BS, Gammaitoni AR, Oleka N et al., 2004)
Пластины Версатис рекомендуется прикреплять на 12 ч в течение суток, затем следует 12-часовой перерыв. Обезболивающий эффект часто начинается в течение 30 мин после прикрепления пластины, но может проявляться и позже, нарастает в течение 4 ч и затем поддерживается в течение длительного времени, пока пластина прикреплена к коже. Более того, он может сохраняться и после ее удаления.
Для объективной оценки эффективности каждого из препаратов при лечении ПГН используется показатель NNT (number needed to treat - количество больных, которых нужно пролечить, чтобы получить у одного 50% снижение боли). Чем ниже NNT, тем более эффективен препарат при данной патологии. NNT для пластин с 5% лидокаином при лечении пациентов с ПГН составляет 2,0; для амитриптилина - 2,6; габапентина - 4,4; прегабалина - 4,6 (Wu C.L., Raja S.N., 2008); для трамадола - 3,9 (Kalso E., 2006).
Кроме того, в клинической практике очень важен показатель NNH (number needed to harm - число пациентов, которых необходимо пролечить данным препаратом, чтобы получить развитие 1 случая неблагоприятной побочной реакции, приводящей к отмене препарата). Он показывает, насколько безопасен данный препарат при его использовании. Величина NNH для трамадола, рассчитанная по результатам нескольких клинических исследований, составила 9.0, для ТЦА 14.7, для габапентина 26.1. Рассчитать показатель NNH для пластин с 5% лидокаином не представляется возможным в связи благоприятным профилем безопасности препарата, сравнимым с плацебо.
Таким образом, оценка препарата Версатис с позиций доказательной медицины делает его препаратом выбора при лечении постгерпетической невралгии, что подтверждено в соответствующих рекомендациях.
СПИСОК ЛИТЕРАТУРЫ
Для цитирования: Фищенко О.Н., Степанченко О.А., Шаров М.Н., Рачин А.П. Постгерпетические тригеминальные невралгии в общеклинической практике: подходы к диагностике, терапии и медицинской реабилитации. РМЖ. 2015;16:961.
Актуальность проблемы, классификация
Боль в области лица после перенесенной вирусной герпетической инфекции представляет собой достаточно актуальную проблему вповседневной клинической практике ивызывает трудности нетолько при проведении дифференциальной диагностики, ноипри подборе адекватной терапии имедицинской реабилитации [1].
ПГН — самое частое осложнение инфекции, особенно у пожилых людей и пациентов с нарушением иммунитета. Herpes zoster, или опоясывающий лишай, — это острое болезненное состояние. После перенесенной в детстве ветряной оспы вирус Varicella zoster остается в организме в латентном состоянии, локализуясь преимущественно в сенсорных ганглиях, расположенных в задних корешках спинальных нервов и чувствительных корешках тройничного нерва. При реактивации ( иногда после вакцинации) вирус вызывает образование характерной везикулярной сыпи, расположенной по дерматомному типу, в зоне иннервации соответствующего сенсорного нерва. У 50% больных сыпь встречается на туловище, у 20% пациентов — на голове, у 15% — на руках и у 15% — на ногах. Через несколько дней сыпь трансформируется в пустулезную, затем образуются корочки, и к концу 3 нед. заболевания она исчезает [3].
Хотя у некоторых пациентов острая фаза опоясывающего герпеса протекает бессимптомно, в большинстве случаев развивается ПГН. Это осложнение наблюдается у 50% больных старше 60 лет. В основе боли, связанной с ПГН, лежат воспалительные изменения или повреждения ганглиев задних корешков спинного мозга и периферических нервов в пораженных зонах тела. Если поражен задний корешок или его ганглий, в соответствующей зоне иннервации также происходят характерные патологические изменения. ПГН возникает при поражении корешков задних рогов спинальных нервов, чаще всего торакальных и тройничного нервов.
По данным исследования, проведенного среди 27 658 пациентов общей врачебной практики, распространенность ПГН в Великобритании составляет 70 случаев на 100 тыс. населения, а ежегодная заболеваемость — 11 новых случаев на 100 тыс. населения. Однако есть определенные трудности в сравнении данных о ПГН из различных исследований, поскольку авторами используются неоднородные критерии этого осложнения.
Наиболее часто ПГН определяют как боль, сохраняющуюся:
- в течение 3 мес. после появления сыпи;
- после исчезновения сыпи.
Тригеминальная ПГН (ПГТН) — постоянная или периодически возникающая лицевая боль в течение не менее 3 мес. от дебюта герпетической инфекции, имеет достаточно высокую распространенность и вызывает трудности при проведении дифференциальной диагностики и терапии [4].
Невралгия обусловлена снижением иммунных свойств в пожилом возрасте и активацией длительно сохранявшегося в организме вируса ветряной оспы. Varicella virus по лимфатическим путям достигает тригеминального ганглия, поражает сенсорный корешок тройничного нерва и преимущественно первую, офтальмическую ветвь тройничного нерва вследствие наименьшей ее миелинизации.
Выделяют несколько стадий заболевания: продромальную, проявляющуюся неспецифическими общеинфекционными симптомами, односторонней сыпью с последующим заживлением кожи с формированием депигментации.
Для невролога важной является диагностика продромальной фазы ПГТН, когда высыпаний еще нет, но болевой синдром уже появился. Предположить вероятную продрому опоясывающего герпеса можно, выявив розовые пятна на коже, в зоне которых имеют место зуд, жжение, боль и отек лица. Спустя 3–5 дней эритрематозный фон исчезает, и возникают пузырьки на здоровой коже. После появления высыпаний постановка диагноза не представляет трудностей [5].
Среди лиц, перенесших острую герпетическую инфекцию, только у 10–20% в дальнейшем развивается ПГН. Причем в 50% случаев заболевают лица после 60 лет. Факторами риска возникновения ПГН являются: пожилой возраст, женский пол, наличие и выраженность боли в продромальной стадии и остром периоде, а также выраженность кожных высыпаний и последующих рубцовых изменений [6].
Клиническая картина ПГТН
Основной жалобой больных ПГТН является постоянная лицевая боль, которая возникает после отпадания корочек (после заживления кожи на месте высыпаний) в течение 1,5–2 мес. в 15% случаев, а у 25% пациентов — в течение года.
При синдроме Ханта пациенты в первую очередь обращают внимание на парез лицевой мускулатуры, а боль в области уха, языка и в глубине полости рта носит второстепенный характер. Парез мимических мышц у больных синдромом Ханта в зависимости от уровня локализации сопровождается нарушением слезо- и слюноотделения и вкусовых ощущений на передних 2/3 языка [9, 10].
В настоящее время выделяют 4 варианта течения синдрома Ханта.
вариант — герпетическая инфекция коленчатого узла без неврологических проявлений. — герпетический ганглионит коленчатого узла с периферическим парезом лицевой мускулатуры. вариант — герпетическая инфекция коленчатого узла с нарушением функции лицевого и нерва. вариант характеризуется поражением коленчатого узла, сопровождается периферическим парезом мимических мышц, шумом в ухе, снижением слуха на стороне поражения и вестибулярными симптомами.
Однако в клинической практике более целесообразно использовать упрощенную классификацию синдрома Ханта. Синдром Ханта 1 является формой опоясывающего герпеса при поражении коленчатого узла и имеет несколько синонимов, таких как: невралгия коленчатого узла, синдром коленчатого узла, ганглионит коленчатого узла, геникуляторная невралгия, herpes zoster oticus.
Расстройства слюноотделения при этом варианте синдрома не носят выраженного характера за счет компенсаторного усиления секреции слюны околоушной слюнной железой, иннервируемой языкоглоточным нервом [11]. Болевой синдром обычно регрессирует в течение нескольких недель после дебюта заболевания, тогда как нарушение функции мимической мускулатуры (хотя обычно в минимальном объеме, постневритическая контрактура) может сохраняться длительное время [12].
Синдром Ханта 2 представляет собой множественное герпетическое поражение ганглиев черепных нервов: , языкоглоточного, редко — блуждающего нерва, а также ганглиев и разветвлений 2–3 шейных спинномозговых нервов. Герпетические высыпания дополнительно локализуются на волосистой части головы. Нарушение слюноотделения более выражено, чем при синдроме Ханта 1, и проявляется ксеростомией. Возникают горизонтальный нистагм, головокружение и атаксия. С первых же часов заболевания развивается периферический парез лицевой мускулатуры.
Алгоритм клинической диагностики ПГН включает анализ следующих проявлений.
1. Локализация герпетических высыпаний (или участков трофических изменений кожи после заживления).
Для ПГН тройничного нерва характерны рубцы в области лба и волосистой части головы на фоне гипер- или гипопигментации кожи.
При синдроме Ханта 1 герпетические высыпания локализованы на барабанной перепонке, в области наружного слухового прохода, ушной раковины, на мягком небе, небных миндалинах и передних 2/3 языка.
2. Характер и локализация болевого синдрома.
вариант синдрома Ханта 1 проявляется умеренным болевым синдромом в глубине наружного слухового прохода с ретроаурикулярной иррадиацией, регрессирующий в течение нескольких недель после дебюта заболевания.
Сочетание перманентного и пароксизмального компонентов лицевой боли характерно как для ПГН тройничного нерва, так и для , и вариантов синдрома Ханта 1, кроме того, эти варианты дополнительно характеризуются иррадиацией боли в затылок и шею.
3. Триггерные участки.
Триггерные участки специфичны для ПГН тройничного нерва и локализованы на коже головы, лба и век. Боль, как правило, представляет собой единичные малоинтенсивные прострелы, которые провоцируются соприкосновением ресниц или прикосновением к коже лба на стороне поражения (симптом расчески).
4. Болезненность точек выхода тройничного нерва.
Болезненность в области надглазничной вырезки, реже — подглазничного отверстия типична для ПГН тройничного нерва в отличие от синдрома Ханта 1.
5. Сенсорные и вегетативные расстройства.
Для ПГН тройничного нерва характерны чувствительные расстройства в виде интенсивного жжения и зуда, а также таких проявлений, как аллодиния, гипестезии, дизестезии, гипералгезия в области лба и волосистой части головы.
вариант синдрома Ханта 1 сопровождается гипестезией уха, а вариант — снижением вкусовых ощущений на передних 2/3 языка, гипестезией ипсилатеральной части языка, ксеростомией и нарушением слезоотделения. вариант синдрома Ханта 1 характеризуется снижением слуха.
7. Горизонтальный нистагм, головокружение и атаксия. Данные клинические проявления, как правило, обнаруживаются при варианте синдрома Ханта 1.
Лечение ПГТН
В современном лекарственном арсенале врача имеется достаточное количество эффективных препаратов для лечения ПГТН [13, 14].
Направления лечения постгерпетической прозапалгии.
I. Противовирусная терапия.
Исследования нового перорального противовирусного препарата (валацикловира) продемонстрировали укорочение острой фазы герпеса и снижение частоты стойкого болевого синдрома.
Полученные результаты подтверждают, что раннее лечение специфическими противовирусными препаратами реально снижает частоту развития ПГН.
Согласно современной классификации, противогерпетические препараты разделяют на следующие классы:
1. Средства этиотропной фармакотерапии:
- противовирусные химиопрепараты (аномальные нуклеозиды): ацикловир, валацикловир (Валогард) и др.;
- препараты интерферонов: природные и рекомбинантные;
- индукторы интерфероногенеза: амизон и др.
2. Средства патогенетической терапии (иммунотропные средства):
- препараты, реставрирующие Т- и клеточного иммунитета: тималин и др.;
- иммуноглобулины: обычный и противогерпетический.
3. Герпетические вакцины и др.
Валацикловир — противовирусное средство, представляющее собой сложный эфир ацикловира. Ацикловир является аналогом пуринового нуклеозида (гуанин).
Первая стадия фосфорилирования требует активности ферментов. Для ВПГ таким ферментом является вирусная тимидинкиназа, которая присутствует в пораженных вирусом клетках. Активация ацикловира специфическим вирусным ферментом в значительной степени объясняет его селективность.
Процесс фосфорилирования ацикловира (превращение из моно- в трифосфат) завершается клеточными киназами. Ацикловиртрифосфат конкурентно ингибирует вирусную и, будучи аналогом нуклеозида, встраивается в вирусную ДНК, что приводит к облигатному разрыву цепи, прекращению синтеза ДНК и, следовательно, блокированию репликации вируса.
У пациентов с сохраненным иммунитетом ВПГ с пониженной чувствительностью к валацикловиру встречаются крайне редко, но иногда могут быть обнаружены у пациентов с тяжелым нарушением иммунитета, например с трансплантатом костного мозга, у больных, получающих химиотерапию по поводу злокачественных новообразований, и у .
Резистентность обычно обусловлена дефицитом тимидинкиназы, что приводит к чрезмерному распространению вируса в организме хозяина. Иногда снижение чувствительности к ацикловиру обусловлено появлением штаммов вируса с нарушением структуры вирусной тимидинкиназы или . Вирулентность этих разновидностей вируса напоминает таковую у его дикого штамма.
Рекомендуемая доза Валогарда для терапии ПГН составляет 1000 мг 3 р./сут в течение 7 дней. В более тяжелых случаях дебюта заболевания лечение следует начинать как можно раньше, а его продолжительность должна быть увеличена с 7 до 10 дней.
Важно! Идеальным условием эффективной терапии ПГТН является назначение препарата Валогард в продромальном периоде или сразу после появления первых симптомов заболевания!
II. Лечение болевого синдрома
В соответствии с рекомендациями EFNS (2006), лечебные мероприятия для купирования боли при ПГН включают препараты первого ряда, к которым относятся: трициклические антидепрессанты (амитриптилин) и локальные средства, содержащие 2,5 и 5,0% лидокаин [14].
При нормальном иммунном статусе и выраженном болевом синдроме, резистентном к анальгетикам, можно использовать кортикостероиды и/или симпатические блокады.
В клинической практике терапия постгерпетических прозопалгий представляет собой трудную задачу, особенно у лиц пожилого и старческого возраста.
Медицинская реабилитация пациентов с ПГТН
Значительная распространенность прозопалгий, сложность и стойкость нарушения функций, сопровождающихся порой длительной утратой трудоспособности, делают реабилитацию пациентов, страдающих данной патологией, одной из важнейших проблем.
Современные методологические подходы к реабилитации пациентов с ПГТН отличает соблюдение следующих принципов.
1. В настоящее время целесообразным считается максимально раннее начало реабилитации. Нейрореабилитация как неотъемлемая составная часть лечебного процесса не может рассматриваться только как долечивание; ее использование вторым этапом после завершения лечения малоэффективно. Целесообразное сочетание лечебных и реабилитационных мероприятий — рациональная профилактика функциональных нарушений, связанных непосредственно с лечением, а при их комплексном совмещении возможно сокращение общих сроков излечивания больных с болевыми синдромами в области лица.
3. Важным моментом является индивидуализация реабилитационных программ, составленная членами мультидисциплинарной команды.
4. Не менее значима социальная установка — повышение уровня адаптации пациента с целью улучшения качества жизни.
5. Ключевая рекомендация состоит в необходимости осуществления реабилитационных программ мультидисциплинарной командой, в состав которой входят невролог, физиотерапевт, рефлексотерапевт, психотерапевт и кинезотерапевт.
В силу полиморфности причин развития болевого синдрома нередко необходимо активное участие стоматолога, клинического фармаколога, нейрохирурга, вертебролога и других специалистов.
6. В целях повышения эффективности проведения медицинской реабилитации болевых синдромов в области лица реализована концепция эффективного взаимодополняющего сочетания консервативных методов, направленных на устранение причин, препятствующих полноценной реабилитации больных. Следует учитывать, что чем больше компонентов этого порочного круга становятся мишенями для лечения, тем выше вероятность его успеха.
7. Оценка статуса пациента и мониторинг эффективности реабилитационных мероприятий должны базироваться на клинических данных с применением стандартных количественных тестов, данных нейровизуализации (компьютерная и томография) и результатов нейрофизиологического обследования (транскраниальная магнитная стимуляция, вызванные потенциалы, электронейромиография).
Заключение
Следует отметить, что в последние предложены новые технологии терапии и идеологии медицинской реабилитации пациентов, страдающих ПГН. При этом первоочередными задачами специалистов, занимающихся данной проблемой, должны являться совершенствование знаний о патогенезе, клинической картине, диагностике и терапии ПГТН, а также использование новых инновационных технологий при проведении медицинской реабилитации этой категории больных [15].
Эффективную терапию ПГН может обеспечить назначение Валогарда в дозе 1000 мг 3 р./сут в течение 7 дней в продромальном периоде или сразу же после появления первых симптомов заболевания.
Ганглионит крылонебного узла — воспалительное поражение крылонебного нервного узла преимущественно инфекционной этиологии. Ганглионит крылонебного узла проявляется болевыми приступами в пораженной половине лица, которые сопровождаются вегетативными симптомами (слезотечением, покраснением кожи, отечностью, слюнотечением). Диагностика заболевания основывается на его клинической картине и исключении других причин лицевой боли. Лечится ганглионит крылонебного узла комплексным применением обезболивающих, противовоспалительных, антибактериальных, ганглиоблокирующих и противоаллергических средств; смазыванием носовой полости раствором дикаина; физиотерапевтическими средствами (УВЧ, электрофорезом, ДДТ, грязелечением).
МКБ-10

Общие сведения
Крылонебный узел находится в крыловидно-небной ямке, расположенной в подвисочной области. Его образуют 3 корешка: чувствительный — образован ветвями от верхнечелюстного нерва (II ветвь тройничного нерва), симпатический — представлен ветвью внутреннего сонного сплетения и парасимпатический — большой каменистый нерв, являющийся ветвью лицевого нерва. Ветви, исходящие из крылонебного узла, иннервируют глазницу, слезную железу и клиновидную пазуху (глазничные ветви); слизистую оболочку носа и решетчатую пазуху (носовые ветви); мягкое и твердое небо, верхнечелюстную пазуху (небные ветви).
В неврологии ганглионит крылонебного узла носит также название синдром Сладера по имени автора, описавшего его в 1908 году. Ганглионит крылонебного узла является достаточно распространенным видом поражения вегетативных ганглиев. При вовлечении в воспалительный процесс не только крылонебного узла, но и входящих в его состав нервных корешков, заболевание расценивают как ганглионеврит.

Причины ганглионита крылонебного узла
Ганглионит крылонебного узла чаще всего развивается в результате проникновением в узел инфекционных агентов, обуславливающих развитие в нем воспалительного процесса. Источником инфекции зачастую являются локальные воспалительные заболевания носоглотки: синусит, хронический ринит, фарингит; реже — артрит височно-нижнечелюстного сустава. Ганглионит крылонебного узла может возникнуть в результате токсического воздействия на нервный узел при хроническом тонзиллите, хроническом гнойном отите. Факторами, способствующими возникновению ганглионита крылонебного узла, являются недосыпание, переутомление, стрессовые ситуации, прием алкоголя, громкий шум.
В некоторых случаях ганглионит крылонебного узла выступает в качестве нейростоматологического осложнения при кариесе зубов, сопровождающемся развитием пульпита и периодонтита. Ганглионит крылонебного узла может наблюдаться на фоне общих инфекционных заболеваний: ОРВИ, герпетической инфекции, туберкулеза, ревматизма. Возникновение ганглионита крылонебного узла возможно в результате травмы с повреждением структур крыловидно-небной ямки.
Симптомы ганглионита крылонебного узла
Основу клинической картины ганглионита крылонебного узла составляет спонтанно возникающий приступ интенсивной лицевой боли. Ганглионит крылонебного узла никогда не проявляется болевым синдромом, ограниченным областью расположения узла. Множественные анастомозы крылонебного узла его корешков и ветвей обуславливают разнообразную локализацию боли и ее распространенный характер.
Доминирующей является боль в областях, которые иннервируются непосредственно ветвями от крылонебного узла: в глазном яблоке, верхней челюсти, у основания носа, в твердом небе. Иногда боли распространяются на область десен и/или зубов нижней челюсти. Зачастую ганглионит крылонебного узла сопровождается иррадиацией боли в затылочную область, шею, ушную раковину, висок, реже — в плечо, предплечье, а иногда даже в кисть. Анастомозы крылонебного узла с узлами симпатического ствола в некоторых случаях приводят к распространению болевого синдрома на всю половину туловища.
Приступ ганглионита крылонебного узла может иметь различную продолжительность от минут до нескольких часов и даже дней. Наиболее часто подобные приступы возникают в ночное время. В послеприступном периоде при ганглионите крылонебного узла могут сохраняться слабо выраженные вегетативные симптомы. Ганглионит крылонебного узла имеет хроническое пароксизмальное течение и может длиться годами. Для него типичны обострения в весеннее и осеннее время. Они могут быть спровоцированы перенесенной ОРВИ, переохлаждением, стрессовой ситуацией, снижением иммунитета или изменениями погоды.
Диагностика ганглионита крылонебного узла
Следует дифференцировать ганглионит крылонебного узла от других заболеваний, сопровождающихся лицевой болью (прозопалгией): невралгии тройничного нерва, воспалительных заболеваний уха (наружного отита, острого среднего отита, мастоидита), стоматологической патологии (острой зубной боли, пульпита, периодонтита). В процессе диагностики необходимо выявить или исключить наличие воспалительного очага, который может служить источником инфицирования крылонебного узла и поддерживать воспалительный процесс в нем. С этой целью могут проводиться консультации невролога, стоматолога, отоларинголога, отоскопия и фарингоскопия, рентгенография околоносовых пазух и рентгенография зубов.
Лечение ганглионита крылонебного узла
В комплексном лечении ганглионита крылонебного узла на первое место выходят мероприятия по купированию болевого синдрома. Они включают введение в полость носа турунд с новокаином и смазывание носовой полости дикаином. Резко выраженные боли являются показанием для назначения ганглиоблокаторов (азаметония бромида, бензогексония), в особо тяжелых случаях производят блокаду крылонебного узла анестетиками (лидокаином, новокаином и пр.).
Лечение ганглионита крылонебного узла инфекционно-воспалительной этиологии сочетается с применением противоинфекционных (антибиотики) и противовоспалительных средств. Эффективным способом терапии ганглионита крылонебного узла является введение в область крылонебного узла раствора гидрокортизона. Обязательно назначаются противоаллергические препараты (хлоропирамин, лоратадин, дезлоратадин). Показано применение общеукрепляющих средств, витаминов группы В.
В комплексную терапию по показаниям могут быть включены спазмолитические препараты, нейролептики, антидепрессанты, холинолитики и др. Пациентам пожилого возраста рекомендован прием сосудистых и антисклеротических медикаментов, улучшающих мозговое и сердечное кровообращение. Из физиотерапевтических методов лечения наиболее эффективны при ганглионите крылонебного узла УВЧ, ДДТ, эндоназальный электрофорез новокаина, грязелечение, массаж мышц лица и шеи.
Следует отметить, что комплексное лечение ганглионита крылонебного узла в большинстве случаев позволяет снизить выраженность клинических проявлений заболевания. Однако не во всех случаях оно способно избавить пациентов от рецидивов заболевания.
Что такое невралгия тройничного нерва? Причины возникновения, диагностику и методы лечения разберем в статье доктора Новиков Ю. О., остеопата со стажем в 41 год.
Над статьей доктора Новиков Ю. О. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Невралгия тройничного нерва (НТН, Neuralgia n. trigemini, Prosopalgia) — хроническое заболевание, для которого характерны интенсивные боли стреляющего и/или жгучего характера в области лица, при этом расстройств чувствительности не выявляется.
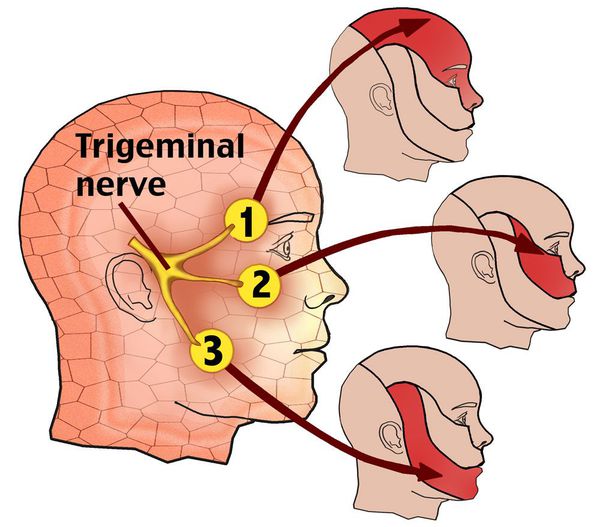
По данным Всемирной организации здравоохранения, распространённость заболевания находится в пределах 2-4 человек на 100 000 населения. Чаще встречается у женщин 50-69 лет. Преобладает правосторонняя локализация. [1] [2] Примерно в 3% случаев возможен двусторонний процесс, частота которого возрастает в ходе увеличения длительности заболевания. [3]
Причины невралгии тройничного нерва
Невралгия V нерва может быть проявлением как поражения отдельных ветвей, так и его ядер в области ствола головного мозга и продолговатого мозга.
Поражения отдельных ветвей V нерва возникают в связи с переломом черепа, менингитом или рассеянным склерозом, объёмными образованиями головного мозга, саркоидозом или аневризмами близлежащих сосудов.
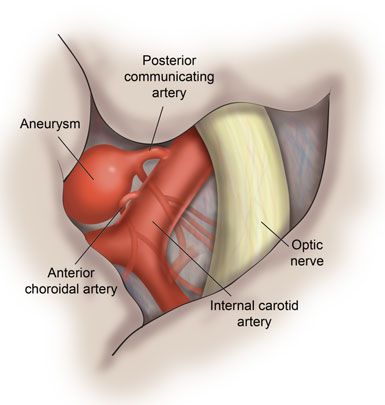
Поражение комплекса ядер также может быть связано с сосудистым процессом, объёмными образованиями, различными энцефалитами, рассеянным склерозом, сирингобульбией и сирингомиелией.
Кроме того, поражение V нерва может быть одним из признаков краниальной полиневропатии, связанной с отравлением трихлорэтиленом и другими химическими веществами, или ранним признаком некоторых заболеваний соединительной ткани, таких как склеродермия.
Некоторые проявления НТН возможны как сопутствующие признаки невропатии VII (лицевого) нерва. Это связано с единым кровоснабжением.
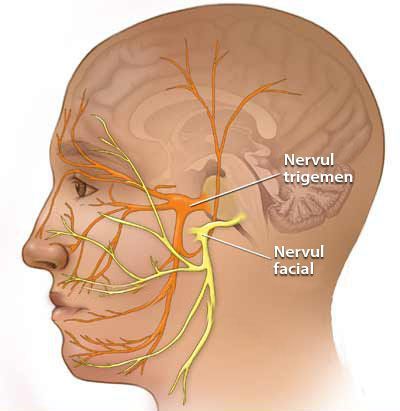
Также существует эссенциальная или идиопатическая НТН.
Факторы риска невралгии тройничного нерва
К факторам риска развития заболевания некоторые авторы относят:
- Генетический дефект в хромосоме 32Р, брахидактилию и наследственную форму гипертензии, которая передаётся от одно из родителей. Эти нарушения сочетаются с патологической извитостью или стенозом задней нижней мозжечковой или позвоночной артерий, что приводит к сдавлению переднебоковых отделов продолговатого мозга. , который снижает эластичность сосудов и увеличивает механическое воздействие пульсовой волны на корешок тройничного нерва.
- Сдавление ветвей тройничного нерва в костном канале, на месте которого повреждается оболочка, окружающая нервные волокна.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы невралгии тройничного нерва
Основной симптом невралгии тройничного нерва — это интенсивная боль в области лица. Боли при невралгии бывают двух видов:
- постоянные, тупые, периодически усиливающиеся боли без широкой иррадиации, возникающие в области распространения той или другой ветви нерва и не сопровождающиеся выраженными вегетативными реакциями;
- боли пароксизмального характера, длящиеся от нескольких минут до нескольких часов. [4][5]
Интенсивность приступов различна: от несильных, но частых, продолжающихся несколько секунд, до сильных и непереносимых, продолжающихся минутами и причиняющих сильные страдания.
Приступы нередко возникают спонтанно, без каких-либо раздражителей, либо в результате попадания твёрдой и холодной пищи в рот, прикосновений, сквозняков, переохлаждений под кондиционером, движений челюстями и т. п.
Приступ начинается обычно с болей в одной ветви нерва — месте первичного поражения, затем боль распространяется на другие ветви, нередко иррадиирует в затылок, к ушным нервам, в шею и даже в область грудных нервов.
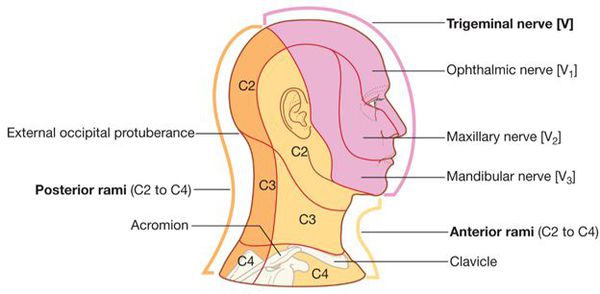
Сильные приступы обычно сопровождаются вегетативными рефлекторными реакциями: покраснением лица, слезотечением, жидкими выделениями из носа, слюнотечением, иногда отёком щеки, века, небольшим припуханием половины носа.
К симптомам воспаления тройничного нерва также относится общее беспокойство, потирание болевой зоны рукой, давление на эту зону, причмокивание. Это наслоение новых раздражений, очевидно, ускоряет момент возникновения тормозного состояния в центре болевых восприятий, которым обычно сменяется приступ.
В качестве двигательных проявлений в связи с болевым приступом возникают тикообразные подёргивания мышц или спазматические сокращения. Максимальные подёргивания или сокращения мышц соответствуют, в основном, зонам, с которых начинается боль, т. е. местам первичного поражения.
При длительном заболевании иногда отмечается поседение волос головы на поражённой стороне.
Иногда пароксизмальные невралгии сопровождаются высыпанием herpes zoster (опоясывающий герпес), располагающегося соответственно первичным поражениям тех или других ветвей, иногда поражающего слизистую роговицы.
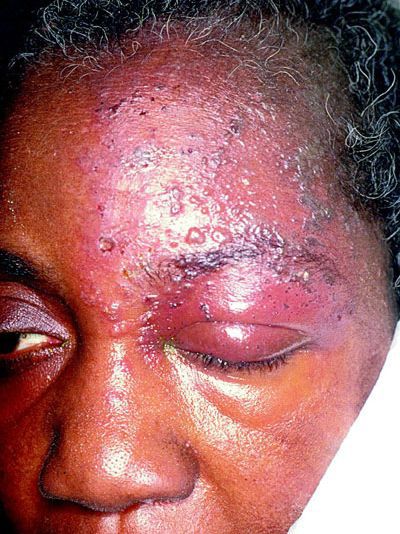
Периоды обострений могут чередоваться с периодами ремиссий, которые длятся месяцами, иногда годами.
Вне приступа обычно не наблюдается никаких расстройств: ни болевых точек, ни объективных расстройств чувствительности. Иногда можно отметить снижение болевой чувствительности главным образом в районе той ветви, которая являлась местом первичного поражения. Реже снижение чувствительности обнаруживается в области всех ветвей тройничного нерва. В отдельных случаях вне приступов больные испытывают лёгкие тупые боли. Болевые ощущения возникают в любое время, но чаще во сне. [6] [7]
Патогенез невралгии тройничного нерва
Патогенез невралгии тройничного нерва, как и локализация процесса, остаётся до конца неясным. Считается, что причиной данного страдания является сдавление корешка нерва в месте его выхода из моста изменёнными сосудами или опухолью, а причиной патологии у больных с рассеянным склерозом — образование бляшки в области чувствительного ядра тройничного нерва.
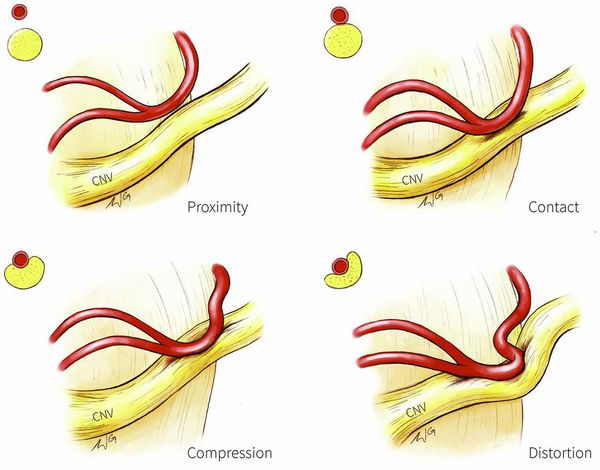
Предполагают центральную локализацию поражения на уровне понтобульбоспинальных центров, есть мнения о поражении в нисходящем корешке, связанном с ядром, или на уровне задних корешков. Имеющиеся патологоанатомические исследования, как правило, обнаруживали в гассеровых узлах изменения воспалительного или рубцового характера. Патологический очаг, изменяющий функцию узлов, влечёт за собой функциональные нарушения в расположенном выше зрительном бугре. Очаг раздражения в узле периодически под влиянием обычно внешних раздражений ведёт к возбуждению последнего с последующим возбуждением в расположенных выше центрах. Начавшись с одной точки, возбуждение затем распространяется по этим центрам. Далее сверхсильное возбуждение клеток сменяется торможением, которое распространяется в том же порядке, в каком происходила иррадиация болей. Результатом полного тормозного состояния является прекращение болей.
В этой схеме, объясняющей возникновение приступа пароксизмальной невралгии, имеется аналогия с эпилептическими припадками, только с той разницей, что реализация невралгических припадков ограничивается областью подкорки, и эти припадки никогда не ведут к последующему разлитому торможению коры головного мозга. Впрочем, это бывает иногда и при истинной парциальной эпилепсии. Если исходить из данного положения, то станет понятным, что наслаивание новых раздражений ускорит наступление тормозного состояния, т.е. конца приступа. К этим приёмам обычно и прибегают больные для купирования приступа. [8] [9]
Классификация и стадии развития невралгии тройничного нерва
Невралгия тройничного нерва бывает:
- первичной — истинной (эссенциальная или идиопатическая);
- вторичной — симптоматической:
- центральной;
- периферической (компрессионной).
Классификация по этиологическому фактору:
- травматическая НТН;
- инфекционная НТН;
- НТН в результате патологии обмена веществ в организме.
Классификация по уровню поражения:
- дентальная плексалгия;
- невралгия носоресничного нерва (синдром Чарлина);
- невралгия ушно-височного нерва (синдром Фрейя);
- синдром крылонебного узла (синдром Сладера);
- глоссофарингиальная невралгия;
- SUNCT-синдром;
- синдром поражения полулунного узла.
Классификация по нарушению функций:
- нарушение чувствительной функции тройничного нерва;
- нарушение двигательной функции тройничного нерва.
Осложнения невралгии тройничного нерва
Осложнения симптоматических вариантов НТН зависят в первую очередь от этиологии. При нейроинфекционных процессах, объёмных образованиях, аневризмах близлежащих сосудов, демиелинизирующих заболеваниях наиболее вероятны осложнения от основных заболеваний, вплоть до инвалидизации и летального исхода.
В случае идиопатической НТН чаще всего наблюдается переход в хроническую стадию: болезнь носит длительный характер, тянется непрерывно или с интервалами различной продолжительности, почти не поддаваясь окончательному излечению. Однако в некоторых случаях отмечают длительную ремиссию до 5-7 лет, но затем боли возобновляются. В периоды ремиссий типично щадящее поведение пациентов с НТН — они предпочитают жевать одной половиной рта, даже в тёплую погоду укрывают голову.
В начальных стадиях болезни, когда её причина установлена, соответствующее лечение может быстро ликвидировать воспалительный процесс без остаточных явлений в виде образования рубцов. Если рубцы образуются, рецидив болезни почти неизбежен — она приобретает хроническое течение.
В случае длительно протекающих невралгий нередки признаки нарушения трофики (питания) тканей в зоне иннервации нервного корешка, таких как сальность и истончение кожи. В случае НТН I ветви вероятны выпадение ресниц и бровей, вплоть до трофических язв роговицы. Кроме того в зоне иннервации снижается тактильная и/или температурная чувствительность.
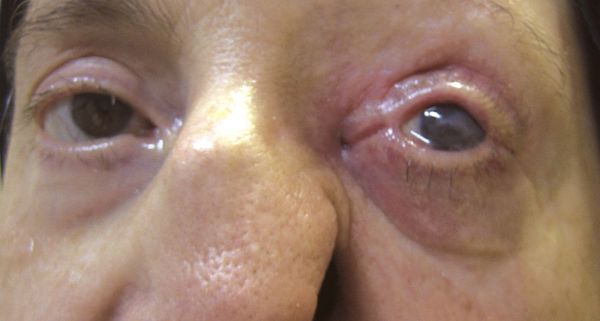
Диагностика невралгии тройничного нерва
Когда следует обратиться к врачу
При НТН посетить доктора нужно как можно раньше, так как в некоторых случаях боль может быть вызвана новообразованием, инфекцией или демиелинизирующим заболеванием.
Подготовка к посещению врача
Особая подготовка не требуется. Если у пациента есть результаты нейровизуализации, то снимки стоит взять с собой.
Инструментальная диагностика
В первую очередь при подозрении на НТН необходимо выполнить магнитную томографию или компьютерную томография головы с целью исключения серьёзной патологии.
Важно дифференцировать НТН с сирингомиелией и сирингобульбией, иногда начинающихся болями в области тройничного нерва, которые могут приобрести пароксизмальный характер. Наличие характерных для сирингомиелии симптомов и дефектов физического развития позволяют установить правильный диагноз.
Иррадиирующие боли при заболеваниях придаточных полостей носа, зубов сравнительно легко дифференцируются от невралгии. Боли тупые, не носят пароксизмальный характер, исчезают бесследно после излечения вызвавших их заболеваний. Если после излечения боли не проходят, следует думать о невралгии. Смешение невралгии с болями, иррадиирующими из зубов, нередко ведёт к ошибочному диагнозу и удалению здоровых зубов.
Боли в районе первых ветвей тройничных нервов, наблюдаемые при тиреотоксикозах, необходимо относить к токсическим невралгиям. Они всегда двусторонние, часто сочетаются с затылочными болями, носят упорный характер. Специальное лечение обычно снимает эти боли.
Дифференциальная диагностика
Инфекционные невралгии тройничного нерва приходится дифференцировать с невралгиями неинфекционной этиологии. В пожилом возрасте такие невралгии могут быть обусловлены склеротическими изменениями отверстий, через которые проходят ветви тройничного нерва, с кровоизлияниями в нерв или гассеров узел.
Этиологический диагноз приходится ставить только на основании анамнестических данных. Клинические признаки могут быть сходны только при склеротическом поражении одной ветви, пароксизмы не так сильны и не приобретают широкой иррадиации. Невралгии, возникшие в результате оболочечных воспалительных процессов и неопластических процессов в области гассерова узла и корешков, тройничного нерва, кариозных заболеваний пирамидки распознаются сравнительно легко. При всех этих заболеваниях обычно в процесс вовлекаются другие черепные нервы: слуховой, лицевой, отводящий. [12] [13]
Лечение невралгии тройничного нерва
Медикаментозное лечение
Препаратами второго ряда являются баклофен, тизанидин и антидепрессанты, которые вначале назначаются в условиях стационара, а затем применяются в амбулаторных условиях с постепенной отменой при достижении улучшения.
Также дополнительно применяют витамины группы B и сосудистые препараты.
Используют блокады анестетиками в местах выходов соответствующих ветвей тройничного нерва, акупунктуру и остеопатические методы коррекции.
Физиотерапия
Из физиотерапевтических методов в остром периоде заболевания и во время приступа местно используют умеренное тепловое и/или ультрафиолетовое воздействие. Широко применяют курсовое воздействие диадинамическими токами, которые оказывают обезболивающее и противовоспалительное воздействие. В упорных случаях возможно использование анальгетиков типа прокаин, тетракаин, эпинефрин.
В подостром периоде положительно зарекомендовал себя эндоназальный электрофорез 4% раствора прокаина и 2% раствор витамина В1.
В случае хронических форм НТН показан массаж лица, грязевые или парафин-озокеритовые аппликации на воротниковую область.
Многообещающие перспективы сосредоточены на использовании ботулинического токсина. [18]
Хирургическое лечение
При неэффективности консервативной терапии показаны нейрохирургические методы лечения:
- невротомию или нервэктомию (перерезание или удаление нерва);
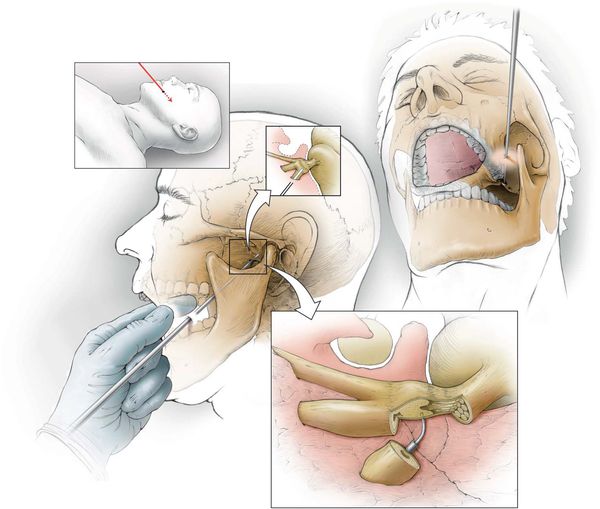
- клипирование аневризматически расширенных артерий — на мешотчатое расширение артерии накладывается металлическая скобка, прекращающая кровоток в этом расширении;
- ликвидация сдавления нерва в костных каналах внутри черепа — частично удаляются костные стенки канала;
- термическая коагуляция узла тройничного нерва;
- операции на гассеровом узле и чувствительном корешке тройничного нерва — электрокоагуляция, криодеструкция. [14][15][16][17]
Дополнительные методы лечения
Также используются когнитивно-поведенческая терапия, физические упражнения, релаксация, биологическая обратная связь, окклюзионные шины и трейнеры, массаж и многое другое как дополнительные методы помощи при хронических лицевых болях. [19]
Как снять боль при невралгии тройничного нерва
Самолечение при невралгии тройничного нерва может навредить пациенту. Уменьшить и предотвратить вероятность новых приступов можно, если своевременно лечить воспалительные и инфекционные заболевания, уменьшить психоэмоциональное перенапряжение, соблюдать режим труда и отдыха, не злоупотреблять алкоголем, острыми и горячими блюдами.
Прогноз. Профилактика
Прогноз эффективности лечения и длительности ремиссии зависит от степени нарушения тройничного нерва, своевременности начатого лечения, а также возраста пациента. Бесспорно, наилучший прогноз восстановительного лечения НТН можно ожидать при вторичных симптоматических проявлениях, когда причина не вызывает сомнения и хорошо поддаётся соответствующей терапии (например, одонтогенная или инфекционная НТН). При идиопатических НТН, этиология которых не ясна, курация наиболее затруднительна.
Профилактика прозопалгий имеет большое значение вследствие малых надежд на полное излечение хронических форм невралгий, поэтому профилактические мероприятия, в основном, сводятся к своевременному лечению заболеваний, которые могут провоцировать развитие НТН. Особое внимание необходимо уделить санации зубов, лечению ринитов и гайморита.
Важным условием профилактики является отсутствие переохлаждений и сквозняков. Необходимо избегать психотравмирующих факторов, закаляться. Немаловажная роль в профилактике принадлежит саногенезу, так как любое интеркуррентное заболевание как инфекционного, так и соматического плана, приводящее к ослаблению защитных сил организма, может привести к обострению НТН. [20] [21]
Читайте также:

