Гистологические окраски на туберкулез
Обновлено: 22.04.2024
ФГБУ "Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии";
Медицинский факультет Санкт-Петербургского университета
Санкт-Петербургскогий государственный университет, Санкт-Петербург, Россия
Санкт-Петербургский НИИ фтизиопульмонологии
Информативность различных методов идентификации кислотоустойчивых микобактерий в зависимости от степени активности туберкулезного процесса
Журнал: Архив патологии. 2018;80(3): 40‑45
ФГБУ "Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии";
Медицинский факультет Санкт-Петербургского университета
Окраска карболовым фуксином по Цилю—Нильсену является основным используемым с конца XIX века методом выявления микобактерий туберкулеза в тканях. При этом количество микобактерий часто не соответствует активности инфекционного процесса как по клиническим, так и по морфологическим данным. Цель исследования — выявление морфологических особенностей микобактерий туберкулеза у пациентов с длительно протекающим туберкулезом. Материал и методы. Изучены 24 случая аутопсии верифицированного фиброзно-кавернозного туберкулеза. Парафиновые срезы окрашивали гематоксилином и эозином, карболовым фуксином по Цилю—Нильсену, аурамин-родамином (с последующим исследованием с помощью люминесцентного микроскопа), проводили иммуногистохимическое (ИГХ) исследование с сывороткой к РАВ (Protein antigen B). Результаты и обсуждение. Во всех наблюдениях выявлены характерные для прогрессирующего туберкулеза изменения. При окраске по Цилю—Нильсену обнаруживали единичные скопления кислотоустойчивых бактерий (менее чем в 10 полях зрения, общее число не более 1000). При окраске аурамин-родамином число обнаруженных микобактерий оказалось достоверно выше (в 10—50 полях зрения, общее число от 1000 до 10 000), а наибольшим оно было при ИГХ-исследовании (более чем в 50 полях зрения , общиее число более 10 000). При этом локализация микобактерий при всех видах исследования была исключительно внеклеточной. Доля типичных палочек при окраске по Цилю—Нильсену (85—95%, в среднем 88,13±2,14%) значительно больше таковой, выявленной при окраске аурамин-родамином (50—85%, в среднем 64,38±4,24%) , и еще значимо больше, чем при проведении ИГХ-исследования (50—70%, в среднем 57,29±2,78%). Столь же сильно разнятся показатели для атипичных морфологических форм микобактерий, выявляемых при окраске по Цилю—Нильсену в минимальном количестве и обнаруживаемых в большом количестве при флюоресцентном и ИГХ-исследовании. Заключение. Доказана способность микобактерий к морфологическому полиморфизму, а также необходимость уточнения патогенеза туберкулеза.
ФГБУ "Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии";
Медицинский факультет Санкт-Петербургского университета
Санкт-Петербургскогий государственный университет, Санкт-Петербург, Россия
Санкт-Петербургский НИИ фтизиопульмонологии
Морфологические методы выявления микобактерий туберкулеза (МБТ) незаменимы в рутинной практике фтизиатрических, инфекционных и многопрофильных стационаров, дополняя клинические, радиологические, микробиологические и иммунологические подходы. При этом число микобактерий, обычно оцениваемое по количеству кислотоустойчивых палочек при окраске по Цилю—Нильсену (Ziehl—Neelsen), часто не соответствует активности инфекционного процесса как по клиническим, так и морфологическим данным, что, однако, не послужило пока предметом масштабных исследований [1, 2].
Основным, используемым с конца XIX века, методом окрашивания микобактерий является метод Циля—Нильсена с использованием карболового фуксина. Состав красителя и протокол окрашивания варьируют в модификациях разных авторов, но суть метода неизменна: карболовый фуксин задерживается в клеточной стенке микобактерий и сохраняется в ней даже после обработки кислотой, обесцвечивающей все остальные структуры и микроорганизмы.
Альтернативным методом селективного окрашивания МБТ является использование раствора аурамина О и родамина В, предполагающее исследование ткани с применением люминесцентной микроскопии, что ограничивает его широкое использование. Как и карболовый фуксин, аурамин образует комплекс с миколовыми кислотами в составе микобактерий, но, по-видимому, обладает к ним большим сродством, поэтому правильно окрашенные препараты с полноценно обесцвеченным фоном обеспечивают высокую контрастность микобактерий и позволяют обнаруживать их в большем количестве по сравнению с окраской по Цилю—Нильсену [3, 4].
Обсуждается возможность выявления МБТ в тканях при использовании иммуногистохимии (ИГХ) и метода полимеразной цепной реакции (ПЦР). Применительно к ИГХ проблемой является перекрестная чувствительность антител как к микобактериям туберкулезного комплекса, так и к нетуберкулезным микобактериям. Применение метода ПЦР существенно ограничивают значительные технические трудности, связанные с его проведением, а также отсутствие возможности достоверного определения количества возбудителей и их локализации [5—8].
В качестве сыворотки для ИГХ-исследования используются моноклональные антитела к антигену РАВ (Protein antigen B)—гликопротеину с молекулярной массой 38 кДа, обнаруживаемому вне зависимости от состояния клеточной стенки микобактерий [9].
Неоднородность результатов даже при правильно выполненной классической окраске по Цилю—Нильсену может рассматриваться как повод для изучения свойств возбудителя.
Одним из важных факторов, влияющих на взаимодействие МБТ с макроорганизмом, является иммуносупрессия прежде всего при ВИЧ-инфекции, в результате чего морфологическая картина туберкулеза в большинстве случаев становится нетипичной за счет меньшей выраженности гранулематозной реакции и большей альтерации, при этом число обнаруживаемых кислотоустойчивых палочек, как правило, больше [10]. Тем не менее и у пациентов без иммуносупрессии регулярно встречается ситуация, при которой ожидаемая с учетом клинических данных морфологическая картина далека от классических представлений о строении туберкулезной гранулемы, локализации и форме кислотоустойчивых микобактерий [11—14].
Слабое окрашивание карболовым фуксином или полное отсутствие такового, зачастую безосновательно трактуемое как технологический дефект, в действительности может быть связано с изменением самого возбудителя, предполагающим полную или частичную утрату микобактериями клеточной стенки (возможно, по типу образования L-форм), чей химический состав и пространственная структура определяют их тинкториальные свойства. Трансформация в L-формы является универсальным свойством многих видов бактерий, обеспечивающих адаптацию в неблагоприятных условиях [15]. В случае с МБТ в качестве неблагоприятных условий можно рассматривать как иммунный ответ, так и специфическую терапию. Показано, что потеря клеточной стенки может быть одним из факторов формирования лекарственной устойчивости к противотуберкулезным препаратам [16, 17].
Кроме непостоянства тинкториальных свойств микобактерий, также требует изучения феномен, при котором обнаруживаются атипичные формы возбудителя: кокковидные, булавовидные, ветвящиеся и прочие, отличные от классических палочек Коха [18].
Образование подобных форм может происходить как в процессе изменения структуры клеточной стенки, так и в результате изменения жизненного цикла причем и при ускорении размножения, и при его угнетении с преобладанием старых форм. В любом случае атипичная морфология микобактерий требует сопоставления с клиническими проявлениями заболевания и эффективностью терапии [19—22].
Материал и методы

Изучены 24 случая аутопсии клинически, рентгенологически и микробиологически верифицированного фиброзно-кавернозного туберкулеза легких. Большинство пациентов мужчины, средний возраст 49,67±5,77 года. У большей части пациентов зафиксирована широкая лекарственная устойчивость (ШЛУ) МБТ — 14 случаев либо множественная лекарственная устойчивость (МЛУ) МБТ — 5 случаев (невосприимчивость заболевания соответственно к четырем или двум противотуберкулезным препаратам первой линии), при этом ни в одном случае не выявлено сочетания туберкулеза с ВИЧ. Во всех наблюдениях имело место длительное течение заболевания и продолжительное лечение в профильных стационарах (см. таблицу). Характеристика исследованных умерших Примечание. М — мужчины, Ж — женщины.
Непосредственной причиной смерти большинства пациентов стала интоксикация вследствие прогрессирования инфекционного процесса, также были зафиксированы случаи смерти от легочного кровотечения, тромбоэмболии легочной артерии и сердечно-легочной недостаточности. На вскрытии диагноз фиброзно-кавернозного туберкулеза во всех случаях подтвержден.
Кусочки легких для гистологического исследования фиксировали в 10% нейтральном формалине с последующей проводкой в спиртах и заливкой в парафин по общепринятым методикам. Срезы окрашивали гематоксилином и эозином, карболовым фуксином по Цилю—Нильсену, аурамин-родамином (с последующим исследованием с помощью люминесцентного микроскопа), также проводили ИГХ-исследование с использованием моноклональных антител к антигену РАВ.
Исследование включало оценку выраженности морфологических изменений в области каверн и активности туберкулезного процесса по классификации Б.М. Ариэля [23], подсчет количества микобактерий при увеличении в 400 раз и количества полей зрения, в которых они визуализируются, определение соотношения между различными морфологическими формами возбудителя (палочковидными, кокковидными и прочими), а также их локализация (внутриклеточно, внеклеточно либо в виде адгезированных на поверхности фагоцитов).
После оценки процентного соотношения различных морфологических форм микобактерий подсчитывали среднее значение для каждой формы, затем вычисляли абсолютную погрешность с доверительной вероятностью p=0,95. Значимость различий между методами исследования оценивали путем вычисления t-критерия Стьюдента и сравнения с критическими значениями.
Результаты
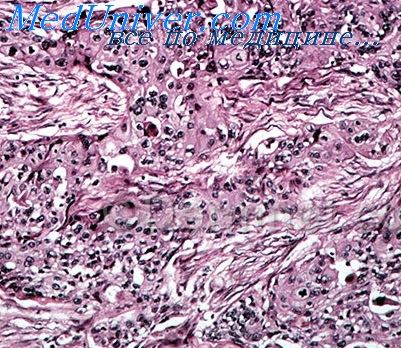
При окраске гематоксилином и эозином во всех наблюдениях выявлены характерные для туберкулеза изменения, соответствующие прогрессированию инфекционного процесса (активность IV—V степени по классификации Б.М. Ариэля): крупные каверны с широкой фиброзной капсулой в стенках каверн и в окружающей легочной ткани, определялись гранулемы и более крупные очаги отсева, представленные округлыми эозинофильными фокусами казеозного некроза с мелкими фрагментами клеточного детрита различного размера, окруженными клеточным валом, представленным лимфоцитами, плазмоцитами и в большей степени макрофагами с эпителиоидно-клеточной трансформацией и тенденцией к слиянию с формированием единичных гигантских многоядерных клеток Лангерганса типичного строения с примесью единичных нейтрофильных гранулоцитов. В других полях зрения отмечали утолщение межальвеолярных перегородок за счет фиброза, дистелектазы, очаговый антракоз, умеренный интерстициальный и альвеолярный отек, паретическое полнокровие сосудов, очаговые диапедезные кровоизлияния. Бронхи малого и среднего размера характеризовались лимфоцитарной инфильтрацией, склерозом, гипертрофией мышечного слоя, очаговой атрофией мерцательного эпителия (рис. 1, 2). Рис. 2. Стенка каверны у пациента с фиброзно-кавернозным туберкулезом. Окраска гематоксилином и эозином, ×100. Рис. 1. Типичная картина туберкулезного воспаления. Окраска гематоксилином и эозином, ×100.
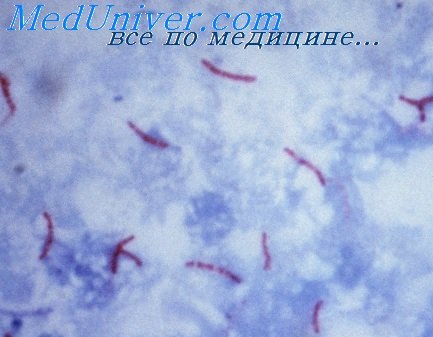
При окраске карболовым фуксином по Цилю—Нильсену в патологических очагах обнаруживали единичные скопления внеклеточно расположенных кислотоустойчивых бактерий в среднем менее чем в 10 полях зрения общим числом не более 1000 (рис. 3, 4). Рис. 3. Типичные кислотоустойчивые внеклеточно расположенные палочки. Окраска по Цилю—Нильсену, ×400. Рис. 4. Очаговая тенденция к формированию одиночных скоплений палочек. Окраска по Цилю—Нильсену, ×1000. Подавляющее большинство (85—95%, в среднем 88,13±2,14%) возбудителей имело палочковидную форму, также встречались кокковидные формы (5—13%, в среднем 9,33±1,17%), на прочие морфологические формы вместе взятые приходилось менее 3% наблюдаемых микобактерий .
При окраске аурамин-родамином и последующем исследовании в люминесцентном микроскопе обнаруживали очаговые скопления внеклеточно расположенных микобактерий в 10—50 полях зрения общим числом от 1000 до 10 000, преимущественно палочковидных (50—85%, в среднем 64,38±4,24%), а также кокковидных (10—45%, в среднем 27,29±3,84%), гранул (2—10%, в среднем 6±1,09%), булавовидных (1—5%, в среднем 1,96±0,6%) и ветвящихся (до 1%) форм микобактерий (рис. 5, 6). Рис. 6. Палочковидные и атипичные формы микобактерий. Окраска аурамин-родамином. Люминесцентная микроскопия, ×1000. Рис. 5. Внеклеточно расположенные одиночные микобактерии и их скопления. Окраска аурамин-родамином. Люминесцентная микроскопия, ×400.
При ИГХ-исследовании (рис. 7, 8) Рис. 7. Множественные внеклеточные скопления микобактерий. ИГХ-исследование, ×400. Рис. 8. Атипичные морфологические формы микобактерий. ИГХ-исследование, ×1000. обнаруживали множественные скопления внеклеточно расположенных микобактерий более чем в 50 полях зрения общим числом более 10 000, характеризовавшихся большим разнообразием форм: на палочки приходилось 50—70% (в среднем 57,29±2,78%), на кокковидные — 20—39% (в среднем 28,71±2,31%), на гранулы — 5—13% (в среднем 9,04±1,04%), на булавовидные — 1—7% (в среднем 3,71±0,64%) и на ветвящиеся — 1—3% (в среднем 1,25±0,47%).
Обобщая полученные данные, можно сказать, что доля типичных палочек, выявленных посредством классической окраски по Цилю—Нильсену, значимо больше таковой (t=10,4; p≤0,05), выявленной при окраске аурамин-родамином, и еще более значимо (t=18,2; p≤0,05), чем при проведении ИГХ-исследования. Столь же сильно разнятся показатели для атипичных морфологических форм микобактерий, выявленных при окраске по Цилю—Нильсену в минимальном количестве и обнаруженных в большом количестве при флюоресцентном и ИГХ-исследовании.
Несмотря на типичную картину активного туберкулезного поражения с большим объемом казеозных масс, окраска по Цилю—Нильсену не выявила многочисленных кислотоустойчивых бактерий, подтвердив встречаемый в практике феномен. Принципиально важным при этом является выбор для исследования именно пациентов с фиброзно-кавернозным туберкулезом, чей анамнез предполагал длительное волнообразное течение заболевания и продолжительную терапию, корректировавшуюся в ходе лечения, с учетом ее неэффективности вследствие устойчивости микобактерий к противотуберкулезным препаратам.
Такие случаи можно считать самыми сложными для классического бактериоскопического выявления МБТ ввиду предшествовавшего длительного процесса адаптации возбудителя, что сопровождалось периодами активации и угнетения размножения, а также изменением структуры клеточной стенки с сохранением вирулентности. Именно особенности жизненного цикла могут объяснить присутствие в большом количестве атипичных форм микобактерий, наиболее убедительно выявленных при ИГХ-исследовании.
Важно отметить отсутствие во всех наблюдениях (как при окраске по Цилю—Нильсену, так и при флюоресцентном исследовании) внутриклеточной локализации возбудителя. Микобактерии отсутствовали как в эпителиоидных клетках, макрофагах и в гигантских клетках Лангерганса, так и в нейтрофильных гранулоцитах. Наиболее информативным следует считать ИГХ-исследование, так как, если следовать теории, что явление дормантности возбудителя сопровождается полной или частичной потерей им клеточной стенки для последующей внутриклеточной персистенции, то отсутствие окрашивания внутриклеточно расположенных микобактерий карболовым фуксином по Цилю—Нильсену можно объяснить именно структурными изменениями клеточной стенки. Однако ИГХ-исследование не зависит от состояния и компонентов клеточной стенки, следовательно, обеспечивает выявление микобактерий, находящихся на любом этапе жизненного цикла, в том числе с изменением своих тинкториальных свойств.
В ходе ИГХ-исследования, как и в случае с окраской по Цилю—Нильсену и аурамин-родамином, не выявлено достоверных признаков присутствия возбудителя внутри фагоцитов, что идет вразрез с традиционными взглядами на локализацию микобактерий в туберкулезном очаге, сформированными на основе экспериментальных моделей заболевания у грызунов [24, 25]. В ряде наблюдений зафиксирована адгезия единичных микобактерий на поверхности макрофагов и нейтрофильных гранулоцитов. Не исключено, что подобное расположение способно симулировать внутриклеточную локализацию.
Необходимо отметить, что в обследованной группе у пациентов имелась определенная гетерогенность, связанная с возрастом, варьировавшим в пределах от 31 года до 84 лет, и длительностью заболевания (от 2 до 33 лет), однако морфологическая картина туберкулеза и характеристика микобактерий практически идентичны у всех пациентов вне зависимости от возраста и давности заболевания.
Принципиальным моментом также явилось расположение в ряде случаев скоплений МБТ по периферии очагов казеозного некроза на границе с прилегающим к зоне некроза валом эпителиоидных клеток и фиброзной стенкой каверны. Данная локализация микобактерий может натолкнуть на мысль о формировании ими биопленок, что может быть одним из объяснений возникновения лекарственной устойчивости, хотя этот вопрос и требует специального изучения.
Выводы
1. Проведенное исследование подтвердило, что микобактерии туберкулеза могут выявляться в тканях с помощью различных методов и иметь разную морфологию, при этом наличие даже небольшого числа кислотоустойчивых бактерий при окраске по Цилю—Нильсену является важным диагностическим признаком, но их отсутствие не свидетельствует об отсутствии туберкулеза.
2. При использовании всех бактериоскопических методов на светооптическом уровне на нашем материале внутриклеточных форм возбудителя не обнаружено.
3. Наибольшая доля атипичных морфологических форм микобактерий обнаруживается при флюоресцентном (35,62%) и ИГХ- исследованиях (42,71%), что демонстрирует их более высокую чувствительность, в то время как при окраске по Цилю—Нильсену атипичные микобактерии выявляются в сравнительно небольшом количестве (11,87%).
4. Микробиологическая сущность и клиническое значение морфологического полиморфизма микобактерий требуют дальнейшего изучения. Более того, можно утверждать, что в уточнении нуждается и патогенез туберкулеза.
Концепция и дизайн исследования — В.А.Ц., М.М.А.
Сбор и обработка материала — А.Н.О., М.М.А.
Статистическая обработка — М.М.А.
Написание текста — В.А.Ц., М.М.А.
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Цитологические методы диагностики туберкулеза. Гистологические методы диагностики туберкулеза.
Цитологические и гистологические методы играют важную, а нередко и решающую роль в распознавании заболеваний органов дыхания. Большое значение имеет исследование клеточного состава мокроты. В нативных и специально окрашенных препаратах находят лейкоциты, эритроциты, клетки плоского и цилиндрического эпителия, альвеолярные макрофаги, пылевые, эпителиоидные, гигантские и опухолевые клетки, кристаллы холестерина и Шарко—Лейдена, неизмененные, обызвествленные коралловидные волокна, микобактерии туберкулеза, неспецифическую флору, друзы актиномицетов, аспергиллы, дрожжевые грибы, сферулы кокцидиоидногэ микоза и т. д.
Следует иметь в виду, что обызвествленные очаги в легких определяются иногда при хроническом абсцессе легкого и гистоплазмозе. Клетки метаплазированного эпителия бронхов со значительной атипией, весьма сходные с элементами злокачественного новообразования, встречаются при хронической пневмонии или бронхите.
Эпителиоидные и гигантские клетки Пирогова— Лангханса можно обнаружить не только при туберкулезе, но и при саркоидозе. Вот почему результаты цитологического анализа мокроты приобретают важное диагностическое значение, если они подтверждаются другими методами исследования.
Частота обнаружения тех или иных клеточных элементов в мокроте или в смывах из бронхов зависит от фазы и динамики процесса, локализации патологического образования в легких, например, при центральном или периферическом раке. Результативность цитологического диагноза, указывал в 1961 г. Umiker, обратно пропорциональна расстоянию опухоли от бифуркации трахеи. Этими факторами следует объяснить различную частоту выявления клеток опухоли при раке легких: в 70—87,6% по данным А. Я. Альтгаузена (1962), Н. Н. Шиллер-Волковой и соавт. (1964), в 24,6—38—45% по наблюдениям Р. Д. Блиновой (1972).
Тот же метод исследования оправдывает себя в диагностике периферических лимфаденитов. При туберкулезе характер обнаруживаемых тканевых изменений зависит от фазы процесса (Е. Д. Тимашева, 1953; М. Г. Абрамов, 1974). В I гиперпластической стадии определяется лишь гиперплазия лимфаденоидной ткани, во II стадии (гранулематозной) находят элементы туберкулезного бугорка, в III — массивный казеозный некроз, в IV — гной, в V (фиброзной) — соединительнотканные волокна, мелкие клеточные элементы.
При раке в пунктатах из лимфатических узлов обнаруживают клетки опухоли, при саркоидозе — эпителиоидные и гигантские клетки без признаков творожистого некроза, при лимфогранулематозе — клетки Березовского—Штернберга и большое число эозинофилов, при лимфолейкозе— картину мономорфной гиперплазии лимфоидной ткани и т. д.
Те или иные патологические изменения удается обнаружить при цитологическом исследовании пунктатов печени, селезенки, костного мозга. Пользуясь этим методом, Olderhauser и соавт. выявили туберкулезные бугорки в печени у 25,3 % больных диссеминированным туберкулезом и у 7,3% — при других его формах. Почти в 60% случаев при пункции печени находят гранулемы, характерные для саркоидоза, особенно при I его стадии (Scadding, 1967, и др.). Сочетая этот способ исследования с пери-тонеоскопией, Tachibana и соавт. (1971) выявили такие тканевые изменения в печени у 70%, a Liehr (1971) — у 90% больных саркоидозом.
Известное значение в дифференциальной диагностике приобретает цитологическое изучение материала, полученного при трансторакальной пункции легкого. Этот метод исследования, который впервые использовал Leyden .еще в 1883 г., в последнее время получил более широкое применение. В пунктате, помимо альвеолярного и бронхиального эпителия, можно обнаружить при туберкулезе эпителиоидные и гигантские клетки и элементы творожистого некроза, при саркоидозе — эпителиоидные и гигантские клетки, при раке и других злокачественных новообразованиях — клетки опухоли и т. д.
Sabow и соавт. при изучении пунктатов установили диагноз рака легкого у 117 больных, между тем как при бронхоскопии — у 81, а при цитологическом исследовании мокроты — лишь у 59 из них. По данным Р. Д. Блиновой (1972), диагноз рака удается верифицировать при пункции легкого у 91,9% больных, по наблюдениям И. С. Мечевой (1973), Н. А. Шмелева (1959) и др. — у 57—80%, а по материалам М. Г. Виннера и М. Л. Шулутко (1971) — у 50% больных. Менее результативна диагностическая пункция при аденоме, гамартохондроме и других доброкачественных образованиях легких. Однако Otto и Frick (1971) на обширном материале (1000 диагностических пункций легкого, произведенных на протяжении 1967—1971 гг. у больных со злокачественными и доброкачественными новообразованиями, туберкулезом, микозами, пневмокониозом, хроническим воспалительным процессом и т. д.) удалось подтвердить диагноз в среднем в 3/4 случаев.
Пункцию легкого целесообразно производить при периферической локализации процесса и достаточной величине патологического образования в легком. Не рекомендуется пользоваться этим методом при подозрении на асбсцесс или гангрену, кисту или эхинококкоз ввиду возможности инфицирования плевральной полости, а также при аневризме легочных сосудов. Его нельзя применять у больных с геморрагическим диатезом, при легочно-сердечной недостаточности у пожилых людей.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Гистология активности туберкулеза. Классификация туберкулом
Предлагаемое деление на основании морфологических признаков имеет целью классифицировать туберкуломы по степени их активности и тяжести прогноза.
Действительно, к I группе отнесены случаи, где гистологические проявления активности туберкулеза несомненны. Оказалось, что чаще всего (в 44 случаях из 63) имеется то или иное их сочетание в капсуле, казеозных массах и окружающей ткани.
Значит, прогрессирование таких туберкулом возможно всеми путями: лимфогенным, бронхогенным (при прорыве расплавленных мате в бронх, и путем перехода воспаления с капсулы на прилегающую легочную ткань. В 78% случаев уже обычная бактериоскопия казеозных масс обнаружила здесь микобактерии туберкулеза и, как правило, в большом количестве.
Наоборот, отложения извести удалось выявить лишь в 4 случаях из 63. Высокая активность этих туберкулом подтверждается, наконец, и тем, что они сравнительно часто вызывали характерные клинические симптомы. Все это позволяет считать их прогноз плохим, а оперативное удаление — абсолютно показанным.
Отличительная особенность туберкулом II группы — сочетание старого расплавления творожистых масс с незначительными специфическими изменениями в капсуле. Расплавление, пусть и старое, повышает опасность кавернизации туберкуломы, тем более, что в подавляющем большинстве случаев (в 16 из 18 на нашем материале) оно захватывает либо всю туберкулому, либо ее краевые отделы.
Бактериоскопия казеозных масс выявила микобактерии туберкулеза в 61% наблюдений. Клинические проявления в виде бациллярности мокроты и рентгенологических симптомов распада, инфильтрации и свежих очагов вокруг были у каждого шестого больного. Все это дает основания для неблагоприятного прогноза: аппозиционный рост или лимфогенное распространение здесь маловероятны ввиду выраженности фиброзной капсулы, но бронхогенный путь вполне реален, а потому показания к хирургическому лечению вряд ли можно оспаривать.
В туберкуломах группы 3 морфологическая картина указывает на процессы заживления. В 8 туберкуломах из 22 найдены отложения извести. Рентгенологически определяемый распад был только у 1 больного, интоксикация тоже у одного. Наряду с этим, микобактерии туберкулеза в казеозных массах выявлены в 77% случаев, бациллярность мокроты отмечена у каждого четвертого больного, изменения рентгеновской тени в пределах последних 6 месяцев — у каждого третьего.
Ясно, что здесь еще необходимо лечение. Но не исключено, что к окончательной потере активности туберкулезного процесса могут привести консервативные меры, а, значит, показания к оперативному удалению становятся сомнительными.
В туберкуломах 4-й группы морфологических признаков активного специфического воспаления нет. В 11 из 12 таких туберкулом найдены отложения солей кальция. Микобактерии туберкулеза обнаружены лишь в каждой четвертой туберкуломе. Однократное бацилловыделение в дооперационном периоде было лишь у одного больного. По-видимому, такие туберкуломы, если они не сопровождаются клиническими проявлениями, не должны быть поводом ни для оперативного, ни для консервативного лечения.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Туберкулез кожи. Гистология туберкулеза кожи
Если здоровой, в прошлом не инфицированной морской свинке ввести подкожно достаточную дозу туберкулезных палочек, через 8—12 дней на месте прививки развивается плотный узел, который вскоре изъязвляется. Регионарные лимфатические узлы увеличиваются и иногда изъязвляются [комплекс Гона (Ghon)].
При гистологическом исследовании первичной язвы, произведенном через 10—14 дней после прививки, обнаруживается выраженная воспалительная реакция с большим количеством полиморфноядерпых лейкоцитов и туберкулезных палочек. В течение двух последующих недель гистологическая картина меняется, полиморфноядерные лейкоциты замещаются лимфоцитами и эпителиоидными клетками.
Через 3—4 недели после инокуляции на ее месте, а также в регионарных лимфатических узлах развиваются отчетливые бугорки или туберкулоидная структура. Одновременно с появлением эпителиоидных клеток количество туберкулезных палочек быстро уменьшается (Сульцбергер).
Типичный бугорок состоит из скоплений эпителиоидных клеток, окруженных валом из лимфоцитов. Обычно между эпителиоидными клетками обнаруживается несколько гигантских клеток типа Лангханса. В центре бугорка, состоящего из эпителиоидных клеток, можно наблюдать различную степень казеоза. Если обнаруживаются такие типичные бугорки, говорят о бугорковом (туберкулезном) инфильтрате.
Часто, однако, при туберкулезе не удается обнаружить типичных бугорков, а видны лишь неравномерные скопления эпителиоидцых клеток внутри воспалительного инфильтрата; явления казеоза, а также клетки Лангханса могут обнаруживаться, но могут и отсутствовать. В таких случаях говорят о туберкулоидном инфильтрате.
Важно знать, что бугорковый и особенно туберкулоидный инфильтрат не обязательно говорит о наличии туберкулеза. Он может наблюдаться и при других заболеваниях, особенно при сифилисе, лепре и некоторых глубоких микозах. Закон Ядассона-Левандовского гласит: тенденция к развитию бугоркового или туберкулоидного строения бывает в тех случаях, когда микроорганизмы или продукты их жизнедеятельности нейтрализуются в результате местных иммунобиологических реакций.
Представляют интерес исследования Сабина, который, впрыскивая внутрикожно различные фракции туберкулезных палочек, пришел к выводу, что протеиновая фракция вызывает развитие некротизирующей и лимфоцитарной реакции, а фос-фолипоидиая фракция — эпителиоидноклеточной реакции.
Гистологическая диагностика различных форм туберкулеза кожи зависит от взаимоотношения между степенью казеозного некроза, количеством воспалительного инфильтрата и степенью сосудистых изменений, а также от отношения бугорков к кровеносным и лимфатическим сосудам.
Казеозный некроз получил свое наименование из-за макроскопического сходства пораженных тканей с сыром. Микроскопически в очагах казеозного некроза отмечается полное нарушение строения тканей. Ядерный материал бледно окрашивается, причем, кроме случаев резко (выраженного некроза, часть ядер сохраняется. Большинство же ядер находится в состоянии пикноза (сжатия) или кариорексиса (фрагментации).
При очаговой туберкулезной инфекции казеозный некроз вызывается действием только бактериальных токсинов. При гематогенной инфекции развиваются облитеративные изменения сосудов. Отсутствие резко выраженного воспалительного инфильтрата в очагах туберкулеза является доказательством сравнительной резистентности макроорганизма или ослабления инфекции. Общепринятой классификации туберкулеза кожи ее существует.

Туберкулез кожи.
Инфекция началась в форме маленького узла на носу и выросла в большую инфильтративную опухоль, которая поразила центр лица.
Диагноз подтвержден биопсией кожи и обнаружением микобактерий в культуральном анализе.
Опухоль прореагировала на антибиотики почти полным разрешением через 4 мес.
- Вернуться в оглавление раздела "гистология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Изобретение относится к медицине и представляет собой способ ускоренной окраски гистологических препаратов для выявления микобактерий туберкулеза, включающий приготовление гистологических препаратов по общепринятой методике, окрашивание их по Циль-Нильсону, отличающийся тем, что после стандартной подготовки препаратов к окраске срезы проходят процедуру депарафинизации путем последовательного помещения их в ксилол и спирты нисходящей концентрации по 5 минут в термостат при температуре 54°C с последующим помещением их в воду, затем в 1% раствор йодной кислоты на 2 минуты и промыванием в проточной воде в течение 10 секунд, после чего на срез, покрытый фильтровальной бумагой, наливают карбол-фуксин Циля и подогревают над пламенем спиртовки до появления паров в течение 2 минут, оставляют краску на срезе после прекращения подогревания на 3-5 минут, убирают фильтровальную бумагу и ополаскивают срезы в воде, дифференцируют их 1% кислотным буфером, ополаскивают в водопроводной воде в течение 1 минуты, после чего на срез помещают раствор метиленового синего по Лефлеру и подогревают над пламенем спиртовки до появления паров, промывают в воде, дифференцируют в 1% кислотном буфере и хорошо промывают водой, обезвоживают в спиртах восходящей крепости в течение 1 минуты, помещают в ксилол и заключают в бальзам. 1 пр.
Формула изобретения
Способ ускоренной окраски гистологических препаратов для выявления микобактерий туберкулеза, включающий приготовление гистологических препаратов по общепринятой методике, окрашивание их по Циль-Нильсону, отличающийся тем, что после стандартной подготовки препаратов к окраске срезы проходят процедуру депарафинизации путем последовательного помещения их в ксилол и спирты нисходящей концентрации по 5 минут в термостат при температуре 54°C с последующим помещением их в воду, затем в 1% раствор йодной кислоты на 2 минуты и промыванием в проточной воде в течение 10 секунд, после чего на срез, покрытый фильтровальной бумагой, наливают карбол-фуксин Циля и подогревают над пламенем спиртовки до появления паров в течение 2 минут, оставляют краску на срезе после прекращения подогревания на 3-5 минут, убирают фильтровальную бумагу и ополаскивают срезы в воде, дифференцируют их 1% кислотным буфером, ополаскивают в водопроводной воде в течение 1 минуты, после чего на срез помещают раствор митиленового синего по Лефлеру и подогревают над пламенем спиртовки до появления паров, промывают в воде, дифференцируют в 1% кислотном буфере и хорошо промывают водой, обезвоживают в спиртах восходящей крепости в течение 1 минуты, помещают в ксилол и заключают в бальзам, причем просветление в карбол-ксилоле не допустимо, так как это может привести к вымыванию красителя.
Описание изобретения к патенту
Изобретение относится к медицине, в частности к патологической анатомии и фтизиатрии, и касается способа ускоренной методики окраски гистологических препаратов для выявления микобактерий туберкулеза.
Известно большое количество способов окраски для выявления микобактерий туберкулеза. Ближайший аналог: это метод, описанный Г.Г.Автандиловым (Основы патологоанатомической практики. - Москва - 1994 г. - С.383). Методика окраски: срезы депарафинируют и доводят до спирта. На срез, покрытый фильтровальной бумагой, наливают карбол-фуксин и подогревают над пламенем спиртовки до появления паров. Потом подогревание ведут в течение 1-2 минут, затем краску оставляют на срезе после прекращения подогревания еще на 20-25 минут. Краску сливают, снимают фильтровальную бумагу. Дифференцируют в 1% солянокислом спирте (70°) до появления бледно-розового тона. Промывают в водопроводной воде 1-2 минуты. Докрашивают срезы метиленовым синим Лефлера в течение 0,5-0,6 минуты. Окрашивают несильно, затем дифференцируют в 0,5-1% солянокислом спирте и хорошо промывают в воде. Быстро проводят через спирты, ксилол и заключают в бальзам.
Однако предложенный способ неудобен тем, что окраска препаратов занимает большое количество времени. Поэтому необходимо усовершенствовать данный метод для достоверности и объективизации посмертного патологоанатомического исследования туберкулеза с целью более быстрой диагностики.
Задачей настоящего изобретения является разработка ускоренного метода окраски, позволяющего за более короткий промежуток времени достоверно проводить посмертную диагностику туберкулеза легких.
Сущность изобретения заключается в том, что в способе ускоренной окраски гистологических препаратов для выявления микобактерий туберкулеза, включающем приготовление гистологических препаратов по общепринятой методике, окрашивание их по Циль-Нильсону, после стандартной подготовки препаратов к окраске срезы проходят процедуру депарафинизации путем последовательного помещения их в ксилол и спирты нисходящей концентрации по 5 минут в термостат при температуре 54°C с последующим помещением их в воду, затем в 1% раствор йодной кислоты на 2 мин и промыванием в проточной воде в течение 10 секунд, после чего на срез, покрытый фильтровальной бумагой, наливают карбол-фуксин Циля и подогревают над пламенем спиртовки до появления паров в течение 2 минут, оставляют краску на срезе после прекращения подогревания на 3-5 минут, убирают фильтровальную бумагу и ополаскивают срезы в воде, дифференцируют их 1% кислотным буфером, ополаскивают в водопроводной воде в течение 1 минуты, после чего на срез помещают раствор митиленового синего по Лефлеру и подогревают над пламенем спиртовки до появления паров, промывают в воде, дифференцируют в 1% кислотном буфере и хорошо промывают водой, обезвоживают в спиртах восходящей крепости в течение 1 минуты, помещают в ксилол и заключают в бальзам, причем просветление в карбол-ксилоле не допустимо, так как это может привести к вымыванию красителя.
Задача достигается следующим образом.
По общепринятой методике ткань легких, лимфатических узлов, бронхов извлекаются при аутопсии. Помещаются в емкость, заполненную 10% раствором нейтрального формалина. Через 12-24 часа из материала вырезаются продольные кусочки исследуемых тканей толщиной до 05, -1,0 см и вновь погружают в емкость с 10% раствором нейтрального формалина. Затем через 12 часов после тщательной промывки в течение 5 часов в проточной воде материал обезвоживают в спиртах восходящей крепости (50% (3 часа), 60% (3 часа), 70% (12 часов), 80% (12 часов), 96% (12 часов), 100% (12 часов)) с последующим погружением в касторовое масло на 12-24 часа.
Для удаления спиртов кусочки погружают в хлороформ (3 порции со сменой через 1,5 часа), далее для удаления хлороформа помещают поочередно в три порции расплавленного парафина по 1,5 часа в каждой. После всего этого кусочки заливаются расплавленным парафином в специальные бумажные коробочки с этикетировкой материала. Полученные блоки наклеиваются на пластиковую кассету и с помощью микротома изготавливаются гистологические срезы толщиной 5 мкм. И наклеиваются на предметное стекло с последующим окрашиванием по Циль-Нильсону. Сначала срезы проходят процедуру депарафинизации путем последовательного помещения их в ксилол и спирты нисходящей концентрации по 5 минут в термостат при температуре 54°C с последующим помещением в воду. Затем срезы помещают в 1% раствор йодной кислоты на 2 мин. Промывают в проточной воде в течение 10 секунд. На срез, покрытый фильтровальной бумагой, наливают карбол-фуксин Циля и подогревают над пламенем спиртовки до появления паров в течение 2 минут, затем оставляют краску на срезе после прекращения подогревания на 3-5 минут. Далее убирают фильтровальную бумагу и ополаскивают срезы в воде, дифференцируют 1% кислотным буфером, ополаскивают в водопроводной воде в течение 1 минуты. Далее на срез помещают раствор метиленового синего по Лефлеру и подогревают над пламенем спиртовки до появления паров, промывают в водопроводной воде, дифференцируют в 1% кислотном буфере и хорошо промывают водой. Обезвоживают в спиртах восходящей крепости в течение 1 минуты, помещают в ксилол и заключают в бальзам. Просветление в карбол-ксилоле не допустимо, так как это может привести к вымыванию красителя. Общее время окраски данным методом 20-25 минут, а предложенными методами других авторов более одного часа.
Пример использования предложенного способа.
Предложенным способом были окрашены ткань легких, лимфатических узлов и бронхов у 105 умерших больных лекарственно-устойчивым туберкулезом в возрасте от 21 до 60 лет. Исследуемый материал извлекался, фиксировался, промывался, обезвоживался и заливался в парафин. Далее проводилась окраска по Цилю-Нильсону. Сначала срезы проходят процедуру депарафинизации путем последовательного помещения их в ксилол (5 минут в термостате при температуре 54°C) и спирты нисходящей концентрации (5 минут в термостате при температуре 54°C) с последующим помещением в воду. Затем срезы помещают в 1% раствор йодной кислоты на 2 мин. Промывают в проточной воде в течение 10 секунд. На срез, покрытый фильтровальной бумагой, наливают карбол-фуксин Циля и подогревают над пламенем спиртовки до появления паров в течение 2 минут, затем оставляют краску на срезе после прекращения подогревания на 3-5 минут. Убирают фильтровальную бумагу и ополаскивают срезы в воде, дифференцируют 1% кислотным буфером, ополаскивают в водопроводной воде в течение 1 минуты. Далее на срез помещают раствор метиленового синего по Лефлеру и подогревают над пламенем спиртовки до появления паров, промывают водой, дифференцируют в 1% кислотном буфере и хорошо промывают водой. Обезвоживают в спиртах восходящей крепости в течение 1 минуты, помещают в ксилол и заключают в бальзам. Просветление в карбол-ксилоле не допустимо, так как это может привести к вымыванию красителя. Общее время окраски данным методом 20-25 минут, а предложенными методами других авторов более одного часа.
Технический результат использования изобретения:
1. Достоверность и объективизация посмертной патологоанатомической диагностики туберкулеза.
2. За счет нагревания растворов в термостате и над пламенем спиртовки улучшается качество окраски гистологических срезов.
3. Сокращается время исследования, что позволяет сделать заключение в более ранние сроки, снизить токсическое влияние реагентов на медицинский персонал.
4. Данный способ может применяться для дифференцированной диагностики различных гранулематозных образований.
5. Способ может быть использован для срочной интраоперационной диагностики (путем изготовления гистологических срезов на замораживающем микротоме).
1. Автандилов Г.Г. Основы патологоанатомической практики. - Москва, 1994, - с.383.
3. Гринберг Л.М. Баранова Е.Ю, Кондратов Д.Л. Гистобактериоскопия в морфологической диагностике туберкулеза легких: Пособие для врачей.- Уральский НИИ фтизиопульмонологии. - Екатеренбург, 2004.
4. Цинзерлинг А.В. Обработка и окраска мазков и срезов для выявления микроорганизмов // Архив патологии 1992. № 5, - с.35-40.
5. Хмельницкий O.K., Белянин В.Л. Выявление возбудителей инфекционных болезней при морфологическом исследовании: Пособие для врачей. - Санкт-Петербург: СПбМАПО, 1996, - с.62.
Читайте также:

