Гистологическое исследование стенок кишечника при протозойной инвазии
Обновлено: 24.04.2024
Proto-screen for identification of intestinal parasitosis (giardiasis, amebiasis, blastocyst invasion, cryptosporidiosis, isosporosis), PCR.
Распространенность гельминто-протозойных инфекций достаточно высока. Паразитозы способствуют более частому возникновению соматических и обострению хронических заболеваний, оказывая многостороннее воздействие на организм хозяина.
Значительное количество простейших-комменсалов, обитающих в желудочно-кишечном тракте человека, не вызывает инфекций и связанных с ними симптомов. Из простейших, которые могут инфицировать желудочно-кишечный тракт, обычно встречаются общепризнанные патогенные простейшие Giardia lamblia и Giardia duodenalis, виды Cryptosporidium, Entamoeba histolytica, Dientamoeba fragilis, Cyclospora cayetanensis и Isospora belli. Патогенный потенциал Blastocystis spp. остается спорным.
Протозойные инфекции в первую очередь связаны с желудочно-кишечными симптомами (диарея), варьирующими от легких до умеренных, а также с потерей веса и хронической усталостью, которые могут сохраняться в течение нескольких лет после эрадикации паразитов. Возбудители протозоозов ответственны за большую часть инфекционных гастроэнтеритов. Считается, что эта патология встречается в два раза чаще, чем бактериальный гастроэнтерит.
Первоначально при клиническом подозрении протозойной инвазии проводится микроскопический анализ на присутствие простейших в кале, который остается эталонным методом диагностики кишечных протозойных инфекций. Однако этот метод требует временных затрат. Поэтому в связи с клинической важностью своевременной идентификации возбудителей кишечных инфекций и для рационального лечения требуется быстрый и чувствительный метод обнаружения патогенов. Мультиплексные ПЦР-тесты в реальном времени все чаще используются в качестве первой линии диагностики в клинической паразитологии, заменяя микроскопию.
Своевременная и точная диагностика и лечение протозойных инвазий имеет большое значение как для каждого отдельного пациента, так и для общественного здравоохранения в целом.
Полип прямой кишки (толстой кишки) - причины, признаки, лечение
Полип - это описательный термин, обозначающий любое возвышающееся образование на слизистой. Характеристика полипа основана на:
• Особенностях прикрепления к стенке кишки (например, полип на ножке, сидячий, плоский).
• Патоморфологических данных (например, гиперпластический, гамартомный или аденома).
• Гистологической картине (например, тубулярный, тубулярно-ворсинчатый, ворсинчатый).
• Характере роста (доброкачественный, злокачественный).
Неэпителиальные полипы представлены липомами и другими мезенхимальными образованиями.
а) Эпидемиология полипов:
• Заболеваемость: у 25-40% лиц со средней степенью риска старше 50 лет выявляется, по крайней мере, один полип.
• Дистальные полипы являются индикатором 5 кратного повышения риска возникновения более проксимальных новообразований; более чем в 50% случаев растущих аденом проксимальных отделов полипы в дистальных отделах отсутствуют.
• Наличие аденоматозных полипов в 2-4 раза увеличивает риск развития метахронных полипов (по сравнению с общей популяцией). Повторные колоноскопии с интервалом 1-3 года => 3-5% растущих аденом.
б) Симптомы полипов. Полипы (независимо от типа) обычно бессимптомны; крупные полипы => кровь в кале, анемия, инвагинация, обструкция; большие ворсинчатые аденомы => обильное выделение слизи, электролитные нарушения.
г) Патоморфология аденоматозных полипов. По крайней мере, дисплазия низкой степени => дисплазия высокой степени: неправильное ветвление, решетчатая структура желез, потеря полярности, частые митозы:
• Тубулярная аденома: плотно упакованные эпителиальные трубочки с сохраненной апико-базальной дифференцировкой и узкой полоской стромы => небольшая деформация, гиперхромные ядра, редкие фигуры митоза.
• Тубулярно-ворсинчатая аденома: комбинация тубулярного и ворсинчатого компонентов.
• Ворсинчатая аденома: > 80% пальцеобразных выростов.
е) Обследование при полипах
Необходимый минимальный стандарт:
• Скрининг и мониторинг колоректального рака (в соответствии со стандартами).
• Обследование толстой кишки у больных с симптомами.
• Гистологическое исследование удаленных полипов (или биоптатов) => руководство для дальнейшего обследования.
Дополнительные исследования (необязательные). Генетическая консультация при семейном анамнезе/молодом возрасте больного.
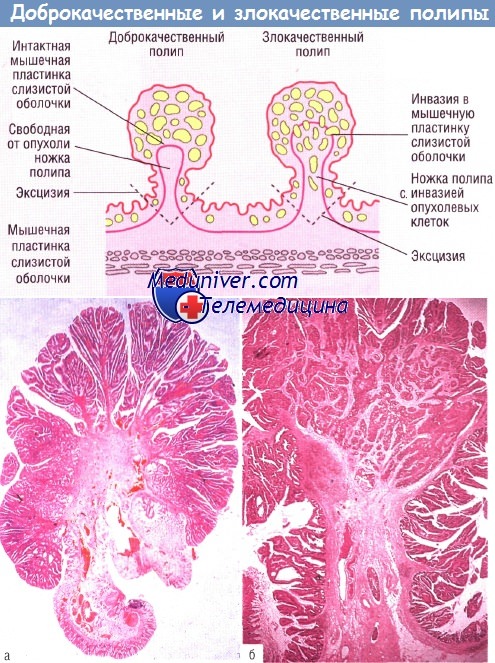
Гистологическая картина различий в строении между доброкачественной и злокачественной аденомой.
Доброкачественная аденома (а), мышечная пластинка слизистой оболочки интактна. Злокачественная аденома (б), инвазия злокачественного эпителия в мышечную пластинку слизистой оболочки.
Близко от основания ножки аденомы видны злокачественные железы в лимфатических сосудах. Окраска гематоксилин-эозином (х 8).
ж) Классификация полипов. Классификация Haggit для малигнизированных полипов => степень опухолевой инвазии в полип на ножке или сидячий полип:
• Полипы на ножке:
- 1 степень: инвазия ограничена верхушкой полипа.
- 2 степень: инвазия в шейку полипа.
- 3 степень: инвазия в ножку полипа.
- 4 степень: инвазия в основание полипа, т.е. в подслизистый слой на уровне кишечной стенки => 10% риск метастазирования в лимфатические узлы (как и при других Т1 опухолях).
• Сидячие полипы => относятся к 4 степени, дополнительно степень инвазии подразделяется по Kudo (Sm1, Sm2, Sm3).
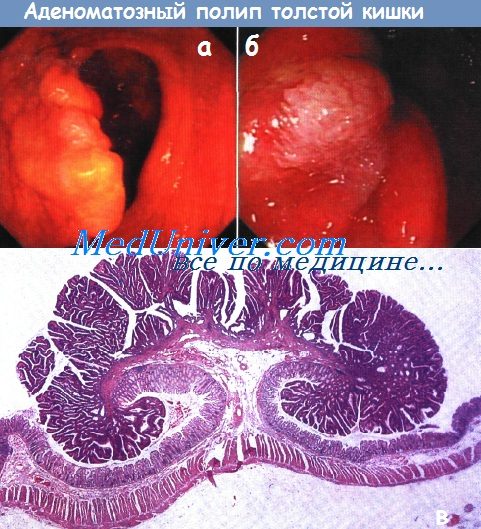
а - Тубулярно-ворсинчатая аденома.
б - Ворсинчатая аденома.
в - Тубулярно-ворсинчатая аденома: гистологический срез через тубулярно-ворсинчатую аденому на короткой ножке.
Заметны утолщение и расширение мышечной пластинки слизистой оболочки на верхушке полипа, непрерывность подслизистого слоя верхушки полипа, ножки полипа и стенки толстой кишки.
з) Неоперативное лечение полипов:
• Эндоскопическая полипэктомия и наблюдение.
• Химиопрофилактика: ингибиторы циклооксигеназы, кальций, аспирин => снижение частоты возникновения метахронных полипов на 35-45%.
• Отсутствие преимуществ резекции по онкологическим принципам: полное удаление (петлей без фрагментации) малигнизированных полипов 1, 2 и 3 степени по Hagitt, хорошо дифференцированных и без лимфоваскулярной инвазии, края > 2 мм.
и) Хирургическое лечение полипов
Показания:
• Любой полип, неподходящий для эндоскопического удаления (помимо прямых противопоказаний).
• Малигнизированный полип с инвазией в подслизистый слой (4 степень по Hagitt, глубокая инвазия на уровень Sm3), края
Хирургический подход:
• Полип толстой кишки: метка татуировкой во время колоноскопии => лапароскопическая или открытая сегментарная резекция (в соответствии с онкологическими требованиями) с первичным анастомозом.
• Полип прямой кишки:
- Трансанальное иссечение или трансанальная эндоскопическая микрохирургия (ТЭМ).
- Низкая передняя резекция (НПР).
к) Результаты лечения полипов:
• Эндоскопическая полипэктомия: снижение заболеваемости раком на 76-90% (в сравнении с историческим уровнем заболеваемости).
• Риск осложнений полипэктомии: перфорация - 0,1-0,3%, кровотечение - 0,5-3% случаев.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Протозойные заболевания или протозоозы - это заболевания, вызванные простейшими микроорганизмами. Такие инфекции могут быть системными (поражать весь организм) и кишечными (поражают желудочно-кишечный тракт).
К системным протозоозам относятся малярия, бабезиоз, лейшманиоз, токсоплазмоз, трипаносомоз.
В этой статье мы поговорим о простейших, которые поражают желудочно-кишечный тракт и вызывают кишечные инфекции.
Кишечные простейшие передаются фекально-оральным путем. Встречаются простейшие, а соответственно и инфекции, вызванные ими, по всеми миру, но наиболее широко распространены в областях с плохими санитарно-гигиеническими условиями и контролем за состоянием воды. Токсоплазмоз, кстати, тоже передается орально-фекальным путем, но при этом не поражает ЖКТ (подробнее по ссылке). Некоторые простейшие могут распространяться половым путем, например при орально-анальных контактах. Несколько разновидностей простейших вызывают тяжелые инфекции у пациентов с ВИЧ-инфекцией в продвинутой стадии.
Наиболее важными кишечными протозойными патогенами являются лямблии и амебы, криптоспоридии, бластоцисты и др.
Многие патогенные и непатогенные микроорганизмы могут находиться в кишечнике в одно и то же время. При этом инфекции, вызванные кишечными простейшими, в большинстве случаев характеризуются либо бессимптомным течением, либо стертой клинической симптоматикой. Настороженность по поводу паразитарных заболеваний имеет место при хронических диареях, кожных высыпаниях неясной этиологии, в некоторых случаях при длительно сохраняющейся эозинофилии в крови.
Постановка диагноза основывается на сборе эпидемиологического анамнеза, на выявлении симптомов и физикального обследования, а также на результатах лабораторного исследования кала на простейшие, а при наличии возможностей - на антигены возбудителей (криптопроридии, амебы, лямблии) или выявление генетического материала простейших с помощью молекулярно-генетических методов.
Микроскопический анализ кала является скрининговым методом диагностики, но может потребовать повторных исследований, методов концентрации и специальных окрашиваний. Наиболее информативным в этом плане может быть анализ трехдневного кала с применением специальных методов обогащения, с интервалом в две недели при первом отрицательном результате. Два последовательных отрицательных результата исследования кала на я/гельминтов и простейшие с интервалом в 14 дней позволяют исключить паразитарную (и глистную) инвазию, и дообследоваться в другом направлении.
Entamoeba histolytica/E. dispar .
Кишечный амебиаз распространен повсеместно, преимущественно в Центральной Америке, западной Южной Америке, Западной и Южной Африке и на индийском субконтиненте. В развитых странах большинство случаев происходит среди недавних иммигрантов и туристов, вернувшихся из эндемичных областей. Амебиаз является третьей по распространенности причиной смерти от паразитозов после малярии и шистосомоза.
Разновидностей амеб множество, но наиболее часто выявляются E.histolytica и E. dispar. Принято считать, что E.dispar непатогенна, но при ее выявлении в совокупности с клинической картиной заболевания, необходимость лечения рассматривается индивидуально.
Человек инфицируется при заглатывании цист с пищей или водой, или при оральных сексуальных контактах. После попадания в организм человека из цисты выходит трофозоит, который по мере продвижения по кишечнику может либо проникать в ткани кишечника, либо выводиться с калом (как в виде цист, так и в виде трофозоитов). Для заражения опасны только цисты.
В 90% случаев течение болезни бессимптомное. Если все же есть клиническая картина, то она может варьировать от легкой диареи до тяжелой дизентерии (боль в животе, диарея с кровью и слизью, снижение веса, повышение Т тела) и даже вызывать опасные осложнения: перфорацию кишечника, кишечные кровотечения и др. К факторам риска тяжелого течения относятся молодой возраст, беременность, лечение кортикостероидами, злокачественные новообразования, недоедание и алкоголизм, а также ВИЧ-инфекция.
Амебная инфекция может стать хронической и проявляться в виде диареи с болью в животе, слизью, метеоризмом, потерей веса. Могут обнаруживаться безболезненные, пальпируемые скопления - амебомы - по ходу толстого кишечника.
При внекишечном амебиазе наиболее часто поражается печень (абсцесс печени). Симптомы включают боль или дискомфорт в области печени, иррадиирующие в правое плечо, неустойчивую лихорадку, потливость, озноб, тошноту, рвоту, слабость и потерю веса. Абсцесс может перфорировать в поддиафрагмальное пространство, правую плевральную полость, правое легкое, перикард.
Основным методом диагностики, помимо общеклинических исследований (при которых можно обнаружить лейкоцитоз, эозинофилию, повышение СОЭ, повышение уровня трансаминаз печени и др.) является микроскопия кала. При этом 3х-кратное исследование повышает чувствительность до 95%. Чувствительностью до 100% обладают иммунохроматографические методы, основанные на выявлении антигена амеб в кале, кроме того они позволяют дифференцировать E.dispar и E.Histolytica. Так же могут использоваться молекулярно-генетические методы - ПЦР, и серологические методы - определение наличия антител к амебам, но серологические данные нельзя интерпретировать отдельно от других.
Из инструментального обследования информативным может быть колоноскопия, при которой выявляются характерные изъязвления стенки кишечника, а дальше проводится биопсия и гистологическое исследование материала, где могут быть выявлены трофозоиты амеб.
При подозрении на внекишечный амебиаз используют Р-графию органов грудной клетки, УЗИ органов брюшной полости, КТ с контрастированием или МРТ.
Лечение проводится только после лабораторного подтверждения диагноза. И оно включает в себя несколько схем последовательно применяемых противомикробных препаратов (действующих как на ткани кишечника, так и в просвете кишечника), в зависимости от тяжести заболевания, формы (кишечная или внекишечная), индивидуальной непереносимости препаратов и другого-другого-другого.
Лямблиоз не менее широко распространен - лямблии наиболее часто обнаруживаются при исследовании кала. Пути передачи те же, инфицирование происходит при проглатывании цист. После попадания в организм из цист выходит трофозоит, который паразитирует в тканях тонкой кишки, дозревает, а затем выводится в окружающую среду с калом в виде цист.
Характер клинических проявлений у человека, вероятно, зависит от ряда факторов, включая вирулентность изолята, паразитарную нагрузку и иммунный ответ хозяина. Половина переносит без симптомов, 15 процентов выделяют цисты без симптомов (бессимптомная инфекция встречается как у детей, так и у взрослых, а бессимптомное выделение кист может длиться шесть месяцев и более), 35-45% отмечают клинические симптомы острой или хронической инфекции.
Острый лямблиоз: диарея, недомогание, стеаторея, спазмы в животе и вздутие, метеоризм, тошнота, снижение веса, рвота, лихорадка, запор, крапивница. Симптомы обычно развиваются после инкубационного периода от 7 до 14 дней. Возникновение острых желудочно-кишечных симптомов в течение одной недели после контакта вряд ли может быть связано с инфекцией Giardia . Симптомы могут длиться от двух до четырех недель.
Симптомы хронического лямблиоза могут включать: жидкий стул, но обычно не диарея, стеаторея, потеря веса (от 10 до 20 процентов веса тела), мальабсорбция, задержка роста, недомогание, усталость, депрессия, спазмы в животе, метеоризм, отрыжка. Проявления могут усиливаться и уменьшаться в течение многих месяцев.
Нарушение всасывания может быть причиной значительной потери веса, которая может возникнуть при лямблиозе. Даже в случаях бессимптомной инфекции может возникнуть нарушение всасывания жиров, сахаров, углеводов и витаминов. Это может привести к гипоальбуминемии и дефициту витаминов A, B12 и фолиевой кислоты. Приобретенная непереносимость лактозы встречается примерно у 40 процентов пациентов - клинически это проявляется обострением кишечных симптомов после употребления молочных продуктов. Восстановление может занять много недель даже после избавления от паразита.
Осложнения: мальабсорбция, потеря веса, у путешественников длительная диарея, у детей может привести к задержке роста. Редко - сыпь, крапивница, афтозные язвы и реактивный артрит или синовит, холецистит, холангит или гранулематозный гепатит. При этом лямблиоз не ассоциирован со смертностью даже у иммунокомпрометированных лиц.
Диагностика основана на обнаружении простейших (трофозоитов или цист) при микроскопии кала, на выявлении антигена лямблий в кале иммунохроматографическими методами, обнаружении генетического материала методом ПЦР. При подозрении на лямблиоз и получении 5 негативных результата исследования кала необходимо рассмотреть возможность исследования дуоденального содержимого. Стоит помнить, что на обнаружение паразита могут влиять прием антибактериальных, антацидных препаратов, а также обследования с использованием контрастных веществ.
Лечение проводится только при лабораторном подтверждении диагноза и при наличии клинических проявлений заболевания, лечение бессимптомных носителей осуществляется в случае, если они контактируют с беременными, с больными муковисцидозом, если это дети, посещающие ДДО или работники пищевой промышленности.
Спорообразующие простейшие (Cryptosporidium parvum, Isospora belli, Cyclospora cayetanensis, Mycrosporidia)
Жизненный цикл для всех спорообразующих простейших одинаков и начинается после проглатывания спор, из которых в тонком кишечнике высвобождаются спорозоиты и начинают активно размножаться в энтероцитах, а затем способствуют развитию новых спор, выделяющихся с калом после гибели энтероцитов. При паразитировании данных микроорганизмов значительно страдает архитектоника ворсинок, что нарушает всасывание.
Из всех спорообразующих наиболее изучены криптоспоридии - о них и пойдет речь.
Путь передачи - фекально-оральный, инфицирование при проглатывании цист с водой, пищей, от человека к человеку, от животных к человеку. Факторами риска тяжелого течения могут быть ВИЧ-инфекция, трансплантация органов, дефицит IgA, гипогаммаглобулинемия и прием иммунодепрессантов.
В 30% случаев встречается бессимптомное течение. У пациентов, у которых развиваются симптомы, инкубационный период обычно составляет от 7 до 10 дней (от 2 до 28 дней). Диарея, связанная с криптоспоридиозом, может быть острой или хронической, кратковременной, прерывистой или непрерывной, скудной или обильной, с водянистым стулом до 25 л/день. Часто пациенты отмечают недомогание, тошноту и анорексию, спастические боли в животе и субфебрильную температуру. У иммунокомпетентных людей болезнь обычно проходит без лечения в течение 10–14 дней, хотя может сохраняться дольше или рецидивировать после первоначального улучшения. У людей с ослабленным иммунитетом криптоспоридиоз может стать хроническим изнурительным заболеванием с постоянной диареей и значительным истощением. Наиболее подвержены риску люди, живущие с ВИЧ, не принимающие антиретровирусную терапию и имеющие низкий уровень СД4+ менее 100-50кл/мкл.
Диагностика основана на выявлении микроорганизмов при микроскопии кала, выявлении их генетического материала методом ПЦР, обнаружение антигенов криптоспоридий в фекалиях, гистологическом исследовании биоптатов слизистой оболочки кишечника.
Если пациент с иммунодефицитом, то лечение может вызвать некоторые трудности - чаще это длительная, комбинированная терапия, которая может не дать желаемых результатов. При наличии ВИЧ-инфекции у пациента следует незамедлительно начать антиретровирусную терапию, в некоторых случаев этого бывает достаточно, но все же иногда необходимо добавить и противопаразитарные препараты.
У иммунокомпетентных лиц лечение криптоспоридиоза не требуется, если только клинические проявления не длятся более двух недель.
Распространен повсеместно. Фекально-оральный путь передачи. У людей паразитирует в толстом кишечнике, чаще встречается у пациентов с ВИЧ-инфекцией. Патогенез развития заболевания изучен не до конца. Вопрос о том, действительно ли этот паразит является патогеном для человека, остается спорным. Выделение этого паразита с диареей у пациентов с трансплантацией почек и другими иммунодефицитами коррелирует, но практически не связано со смертностью. У людей с ВИЧ-инфекцией и бластоцистозом симптомы исчезают самопроизвольно или подтверждается другая их этиология.
Клинические проявления при бластоцистозе могут включать: диарею, тошноту, анорексию, спазмы в животе, вздутие живота, метеоризм, крапивницу и усталость. Обычно описывается водянистая диарея (может быть острой или хронической). Лихорадка обычно отсутствует.
Диагностика - микроскопия и ПЦР-исследование кала, а также культуральные методы.
Пациенты с обнаруженными бластоцистами в кале и без клинических проявлений не нуждаются в лечении. Если все же есть клинические проявления, то необходимо исключить другую их этиологию, и только в случае исключения другой этиологии рассматривается вопрос о лечение.
Балантидиаз человека наиболее распространен в тропических и субтропических регионах и развивающихся странах. Путь передачи фекально-оральный, при заглатывании цист при употреблении зараженной пищи или воды. Источником инфекции являются свиньи. Эксцистация происходит в тонкой кишке, паразит колонизирует подвздошную и толстую кишки, могут проникать в ткани, цисты формируются в просвете кишечника и выделяются с калом.
Большинство случаев протекает бессимптомно. Риск развития симптомов увеличивается при сопутствующей инфекционной патологии. Симптомы могут включать тошноту, рвоту, потерю веса, боль в животе и заметную диарею с примесью крови. Фульминантное течение заболевания с перфорацией кишечника возникает редко.
Диагноз инфекции B. coli устанавливается путем обнаружения трофозоитов или цист при исследовании кала или соскобах слизистой оболочки, полученных при колоноскопии или ректороманоскопии.
Оптимальный подход к лечению балантидиаза неясен. В целом, лечение целесообразно при симптоматическом течении инфекции. Если симптомы не исчезают после проведенной терапии, необходимо повторить исследование кала для исключения другой этиологии.
Ранее считалась комменсалом. Путь передачи фекально-оральный, инфекция ассоциирована с энтеробиозом.
Инфекция может быть симптоматической или бессимптомной. Общие симптомы включают боль в животе, острую и рецидивирующую диарею, тошноту, рвоту, метеоризм. D. fragilis может проявляться периферической эозинофилией и/или эозинофильным колитом. Диарея обычно длится 1-2 недели, тогда как боль в животе может сохраняться в течение 1-2 месяцев. Из-за очень высокой связи с острицами у некоторых пациентов также может проявляться анальный зуд, инфекции нижних мочевыводящих путей.
Диагноз ставится путем обнаружения трофозоитов при микроскопии образцов стула или с помощью молекулярно-генетических методов.
У бессимптомного человека обычно не требует лечения, но инфекции, вызванные D. fragilis, следует лечить, если организм обнаруживается как единственный патоген в образцах стула пациентов с абдоминальной болью или диареей более 1 недели.
Несколько непатогенных простейших обитают в кишечном тракте и могут быть идентифицированы в образцах стула, отправленных в клиническую лабораторию для исследования яиц и паразитов. Поскольку диагностическая лаборатория может сообщить об этих непатогенных паразитах, важно уметь различать организмы, требующие лечения, и организмы, которые этого не требуют.
Непатогенные простейшие можно разделить на две группы: амебы и жгутиковые.
Подслизистые новообразования желудочно-кишечного тракта представляют собой гетерогенную группу заболеваний, общим признаком которых является локализация патологического очага под слизистой стенки полого органа. Наиболее часто они выявляются при эндоскопическом исследовании в виде округлой или овоидной формы образований, деформирующих просвет органа и в большинстве наблюдений покрытых неизмененной слизистой.

Подслизистые новообразования составляют 5% всех образований верхних отделов желудочно-кишечного тракта и включают разные опухоли мышечного, неврогенного, сосудистого и смешанного происхождения, а также пороки развития в виде эктопии поджелудочной железы и дупликационных кист (табл. 1) [1]. Наиболее распространенными мезенхимальными опухолями желудочно-кишечного тракта являются гастроинтестинальные стромальные опухоли (ГИСО), составляющие до 1% всех злокачественных опухолей этой локализации 5.
Длительное время подслизистые новообразования рассматривались хирургами в качестве доброкачественных опухолей, преимущественно подлежащих динамическому наблюдению. Исключение составляли новообразования больших размеров, имеющие клинические проявления, которые определяли показания к оперативному вмешательству. Однако выделение в структуре подслизистых опухолей ГИСО, которые считаются потенциально злокачественными, заставило кардинально изменить тактические подходы к лечению. В связи с возросшим за последнее время интересом врачей к этим новообразованиям все большее число исследований посвящено их морфологии, методам диагностики и тактике лечения.
Материал и методы

В нашей работе проведен анализ эндоскопической диагностики и результатов лечения 38 пациентов с 39 подслизистыми новообразованиями верхних отделов желудочно-кишечного тракта, которые были госпитализированы в Институт хирургии им. А.В. Вишневского в период с 2005 по 2009 г. (табл. 2). Наиболее частой нозологической формой были лейомиома (12 из 38) и ГИСО (8 из 38). При этом лейомиомы наиболее часто локализовались в пищеводе (8 из 12), а ГИСО выявлялись только в желудке (6 из 8) и двенадцатиперстной кишке (2 из 8). Липомы были диагностированы у 5 пациентов, дупликационные кисты также были выявлены в 5 наблюдениях. Эктопированная поджелудочная железа с локализацией в желудке диагностирована у 6 пациентов. При этом у одной пациентки выявлено два, располагающихся рядом, не связанных друг с другом образования. Единичные наблюдения представлены лейомиобластомой и гастриномой желудка.
Результаты и обсуждение
Все пациенты обследованы по стандартному протоколу, включающему общеклинические и биохимические исследования, ультразвуковое исследование, компьютерную томографию, магнитно-резонансную томографию, эзофагогастродуоденоскопию. Эндоскопическая ультрасонография (ЭУС) как самый точный метод диагностики подслизистых новообразований была выполнена 37 (97,4%) пациентам.
Первым этапом диагностики являлось определение органной принадлежности новообразования. Сложности возникали при больших размерах образования и при интимном прилегании экстраорганной опухоли к стенке желудка со смещением его слоев (рис. 1 и далее на цв. вклейке). Рисунок 1. Эндосонограмма. Гемангиома печени, тесно прилежащая к стенке желудочка. Только тщательный осмотр с детальным изучением всех слоев стенки полого органа позволяет определить, является образование экстраорганным или исходит из стенки желудка (рис. 2). Рисунок 2. ГИСО желудка. А - транскутанное УЗИ: невозможно дифференцировать новообразование от левой доли печени; Б - эндосонография: четко визуализируется образхование мышечного слоя стенки желудка, которое отделяется от печени тонкой прослойкой соединительной ткани (указана стрелками).
Вторым этапом эндосонографической диагностики являлось определение эхогенности образования. Различия в эхогенности позволяют выделить три вида новообразований - анэхогенные, гипер- и гипоэхогенные.

Анэхогенная структура образования свидетельствует о его жидкостном характере, что может соответствовать патологическим сосудистым трансформациям или дупликационной кисте. Сосудистые новообразования, такие как варикозный узел, легко дифференцировать по наличию кровотока, определяемого при допплерографии (рис. 3). Рисунок 3. Эндосонограмма варикозного узла пищевода. А - анэхогенное образование, локализирующееся в подслизистом слое; Б - при допплерографии в образовании регистрируется турбулентный кровоток.

Дупликационные кисты обычно исходят из 4-го (мышечного) или реже 3-го (подслизистого) эхослоя и нередко достигают больших размеров. При других лучевых методах исследования их нередко принимают за кисты поджелудочной железы или печени. С учетом доброкачественного характера этих образований своевременная и точная диагностика позволяет при доступной локализации использовать различные варианты малоинвазивного хирургического лечения (эндоскопическая, лапароскопическая или робот-ассистированная операция). В одном из наших наблюдений было выявлено кистозное новообразование верхнего отдела брюшной полости, которое на основании данных ультразвукового исследования и компьютерной томографии было расценено как киста поджелудочной железы или неорганная забрюшинная опухоль. Только проведение эндосонографии позволило установить, что киста, имеющая размер более 4 см, связана со стенкой желудка и исходит из 4-го эхослоя (мышечный слой стенки, рис. 4). Рисунок 4. Эндосонограмма дипликационной кисты желудка: анэхогенное образование, исходящее из 4-го (мышечного) эхо-слоя желудка (указан стрелками). Пациенту была выполнена робот-ассистированная клиновидная резекция желудка. Гистологическое исследование операционного материала подтвердило диагноз дупликационной кисты.
Гиперэхогенные новообразования в большинстве наблюдений являются липомами. Обычно они локализуются в 3-м эхослое, однако в 2 наших наблюдениях липомы выявлялись и во 2-м слое. Наиболее часто липому необходимо дифференцировать с нейроэндокринной опухолью, эктопированной поджелудочной железой, а также с ГИСО.
Гипоэхогенные новообразования вызывают наибольшие сложности в диагностике, так как такую структуру могут иметь все остальные подслизистые опухоли, включая эктопированную поджелудочную железу.

Ввиду сложности в достоверной дооперационной верификации потенциально злокачественных ГИСО большинство пациентов с подслизистыми новообразованиями (29 из 38) были оперированы (табл. 3). Динамическому наблюдению подлежали пациенты с мелкими новообразованиями размером до 2 см, без признаков злокачественности, особенно исходящими из мышечного слоя стенки пищевода. При определении показаний к динамическому наблюдению мы принимали во внимание ряд соображений. ГИСО с локализацией в пищеводе встречается крайне редко, составляя 1-2% желудочно-кишечных стромальных опухолей всех локализаций. В большинстве наблюдений в пищеводе выявляются истинные миогенные опухоли - лейомиомы. Радикальное удаление опухоли, исходящей из мышечного слоя, требует полнослойной резекции органа из традиционного торакотомного или торакоскопического доступа, что определяет несоответствие травматичности оперативного вмешательства и риска прогрессирования доброкачественного заболевания. Лишь прогрессирующее увеличение размеров новообразования по данным динамического обследования определяет показания к хирургическому лечению.
Все остальные пациенты были оперированы. Выбор объема оперативного вмешательства определяли на основании предположительного характера новообразования, его размера, топической принадлежности к определенному слою стенки органа и распространенности за его пределы.
При ГИСО отдавали предпочтение клиновидной резекции желудка с использованием лапароскопического или традиционного доступа, а при локализации опухоли в двенадцатиперстной кишке выполняли ее изолированную сегментарную резекцию или панкреатодуоденальную резекцию открытым способом. При выборе хирургического доступа также принимали во внимание прогнозируемую степень злокачественности опухоли. Признаками злокачественного потенциала по данным ЭУС являлись:
- размер опухоли более 3-4 см;
- неровный контур новообразования;
- наличие внутренних фокусов повышенной эхогенности или кист;
- инвазия опухоли в слизистую или выход ее за пределы стенки полого органа;
- быстрый рост при динамическом наблюдении [4, 6].

При наличии признаков злокачественности или больших размерах новообразования считали предпочтительным выполнение широкой резекции органа, которую удобнее реализовать при лапаротомии (рис. 5). Рисунок 5. ГИСо двенадцатиперстной кишки. А - эндомонограмма; Б - МРТ (опухоль указана стрелками); В - резецированная кишка с опухолью. Всего из лапаротомного доступа выполнено 9 оперативных вмешательств. В 4 наблюдениях произведена клиновидная резекция желудка, по одному наблюдению - энуклеация опухоли желудка, резекция двенадцатиперстной кишки и панкреатодуоденальная резекция. Двум пациентам выполнено удаление дупликационной кисты после дуодено- и эзофаготомии.
Во всех остальных наблюдениях считали возможным выполнение малоинвазивных вмешательств - эндоскопических и лапароскопических операций. При этом выбор способа удаления образования определяли с учетом принадлежности новообразования к определенному слою стенки полого органа. Определение топической локализации опухоли являлось третьей задачей эндосонографического исследования. При локализации новообразования в мышечной пластинке слизистой или в подслизистом слое предпочтение отдавали внутрипросветным эндоскопическим методам лечения, при локализации его в мышечном слое считали целесообразным и более оправданным лапароскопическое вмешательство.

Лапароскопическая клиновидная резекция желудка выполнена 5 больным. В 3 наблюдениях выявлены ГИСО с низким индексом пролиферации, в 2 наблюдениях - эктопия ткани поджелудочной железы. Одному больному выполнено лапароскопическое трансгастральное удаление опухоли желудка, представляющей собой лейомиобластому. При лапароскопическом удалении образования стремились к наименьшей деформации желудка. Для этого использовали интраоперационную гастроскопию. Под двойным эндоскопическим и лапароскопическим контролем производили маркировку основания опухоли со стороны серозной оболочки стенки желудка. Выполняли аппаратную клиновидную резекцию желудка с вскрытием или без вскрытия его просвета (рис. 6). Рисунок 6. ГИСО желудка. А - эндофотография: новообразование округлой формы, покрытое неизмененной слизистой; Б - эндосонограмма: гипоэхогенная опухоль, исходящая из 4-го эхо-слоя; В - лапароскопическая резекция желудка; Г - вид удаленного новообразования.
Во всех наблюдениях после эндоскопического удаления новообразования производили тщательную ревизию зоны резекции с обязательной электро- или аргоноплазменной коагуляцией сосудов.

Среди осложнений наиболее вероятны перфорация полого органа и кровотечение. В одном наблюдении небольшое подслизистое новообразование, локализующееся в дне желудка, подвижное при инструментальной пальпации, с несмещаемой слизистой над ним было ошибочно расценено как исходящее из 2-го эхослоя. Эндоскопическую ультрасонографию не производили. Однако при его удалении произошла перфорация стенки желудка. Дефект был клипирован со стороны слизистой желудка. В послеоперационном периоде проводили консервативную терапию. Оперативное вмешательство не потребовалось. При гистологическом исследовании выявлена лейомиома, исходящая из мышечной стенки желудка. Это наблюдение еще раз подчеркивает роль эндосонографии в выборе метода хирургического лечения. Еще в одном наблюдении после удаления липомы бульбодуоденального перехода двенадцатиперстной кишки в послеоперационном периоде при КТ брюшной полости в забрюшинном пространстве выявлено небольшое скопление воздуха без клинических проявлений, характерных для перфорации полого органа (рис. 10). Рисунок 10. Компьютерная томограмма брюшной полости. Стрелками указано скопление воздуха в забрюшинном пространстве с инфильтратом вокруг. Мы расценили наличие воздуха как результат его диффузии из просвета кишки, а также избыток инсуффляции аргона при проведении аргоноплазменной коагуляции, через мышечные волокна стенки без формирования перфоративного отверстия. Проводили антибактериальную и противоязвенную терапию с положительным эффектом. Оперативного вмешательства не потребовалось. У одного пациента в 1-е сутки после фенестрации кисты пищевода развилось кровотечение из края резецированной слизистой; был произведен эндоскопический гемостаз методом склеротерапии, дальнейшее течение без осложнений.
В последние годы интерес к подслизистым новообразованиям желудочно-кишечного тракта значительно возрос. Активно изучаются их визуальные и лучевые признаки, гистологическое строение и иммуногистохимические характеристики, проводятся исследования результатов хирургического и химиотерапевтического лечения пациентов с различными подслизистыми новообразованиями желудочно-кишечного тракта. Наиболее часто они встречаются в желудке, составляя 60% всех подслизистых новообразований верхних отделов желудочно-кишечного тракта, на долю пищевода приходится 30%, на долю двенадцатиперстной кишки - 10% [1]. В связи с выделением ГИСО в отдельную группу потенциально злокачественных опухолей мы изменили подход к тактике ведения пациентов с подслизистыми новообразованиями желудочно-кишечного тракта. Эти новообразования ранее расценивались как лейомиомы, лейомиобластомы и лейомиосаркомы, однако иммуногистохимические исследования показали их особую природу. Необходимость удаления подслизистых новообразований объясняется невозможностью точной дифференциальной диагностики с ГИСО без проведения иммуногистохимических исследований. Подслизистые новообразования наиболее часто выявляются при эндоскопическом исследовании или при рентгенологическом исследовании желудочно-кишечного тракта. При рентгенологическом исследовании данные новообразования выглядят, как пристеночно расположенные дефекты наполнения округлой или овоидной формы. Однако данное исследование не позволяет провести дифференциальную диагностику между образованием стенки полого органа и экстраорганно расположенным патологическим очагом. Наиболее эффективным методом диагностики подслизистых опухолей до последнего времени оставалось эндоскопическое исследование, при котором визуализируются округлой или овоидной формы образования, покрытые в большинстве наблюдений неизмененной слизистой. По косвенным эндоскопическим признакам можно предположить, что данное образование исходит из стенки полого органа, однако четкие критерии, позволяющие провести дифференциальный диагноз между подслизистым образованием и экстраорганной компрессией, отсутствуют. Также визуальное эндоскопическое исследование не дает ответа на вопрос о структуре образования и не позволяет определить принадлежность к слоям стенки полого органа [1].
Трансабдоминальное УЗИ, как правило, малоинформативно, так как новообразования располагаются в стенке воздухсодержащих органов и визуализация их затруднена вследствие экранирования ультразвуковых волн воздухом. КТ и МРТ выявляют крупные новообразования, однако часто возникают трудности с определением органной принадлежности опухоли (подслизистые образования расцениваются как опухоли печени, поджелудочной железы, неорганные забрюшинные опухоли). Точная топическая диагностика опухоли возможна только при проведении эндоскопической ультрасонографии, на основании результатов которой определяют тактику хирургического лечения и выбирают оптимальный оперативный доступ. Этот метод позволяет не только достоверно различать новообразования стенки и экстраорганные структуры, но и определять слой, из которого происходит новообразование, а также, оценивая его эхогенную характеристику, четко дифференцировать неэпителиальные опухоли и неопухолевые образования желудочно-кишечного тракта [1]. При выявлении неэпителиальных опухолей перед эндосонографическим исследованием встает задача определения признаков их злокачественности.
По нашему мнению, все подслизистые новообразования, при которых сохраняется даже малый процент вероятной ошибки в дифференциальной диагностике их с ГИСО, подлежат оперативному лечению с последующим гистологическим и иммуногистохимическим исследованием.
Задачами эндосонографического исследования являются определение органной принадлежности новообразования, его структуры и локализации в стенке полого органа, т.е. из какого именно слоя оно происходит. Тактику лечения таких пациентов следует определять, основываясь преимущественно на данных, полученных при эндосонографии [2], за исключением наблюдений, в которых развиваются осложнения, требующие оперативного лечения независимо от размеров и локализации опухоли.
При опухолях, не выходящих за пределы органа и не имеющих признаков злокачественности, возможно выполнение малоинвазивных операций. При локализации опухоли в мышечной пластинке слизистой и подслизистом слое целесообразно эндоскопическое удаление. При локализации образования в мышечном слое необходимо выполнение лапароскопической резекции стенки органа, несущего опухоль. Опухоли большого размера, выходящие за пределы органа и имеющие дооперационные признаки высокого риска злокачественности, требуют резекции из лапаротомного доступа с соблюдением всех онкологических принципов.
Таким образом, современный взгляд на диагностику и лечебную тактику предусматривает необходимость удаления подслизистых образований независимо от их вида и размера, что объясняется невозможностью точной дифференциальной диагностики с гастроинтестинальной стромальной опухолью без проведения иммуногистохимических исследований. Эндоскопическая ультрасонография является ведущим методом диагностики подслизистых новообразований и позволяет определить тактику лечения и выбрать оптимальный оперативный доступ.
Proto-screen for identification of intestinal parasitosis (giardiasis, amebiasis, blastocyst invasion, cryptosporidiosis, isosporosis), PCR.
Распространенность гельминто-протозойных инфекций достаточно высока. Паразитозы способствуют более частому возникновению соматических и обострению хронических заболеваний, оказывая многостороннее воздействие на организм хозяина.
Значительное количество простейших-комменсалов, обитающих в желудочно-кишечном тракте человека, не вызывает инфекций и связанных с ними симптомов. Из простейших, которые могут инфицировать желудочно-кишечный тракт, обычно встречаются общепризнанные патогенные простейшие Giardia lamblia и Giardia duodenalis, виды Cryptosporidium, Entamoeba histolytica, Dientamoeba fragilis, Cyclospora cayetanensis и Isospora belli. Патогенный потенциал Blastocystis spp. остается спорным.
Протозойные инфекции в первую очередь связаны с желудочно-кишечными симптомами (диарея), варьирующими от легких до умеренных, а также с потерей веса и хронической усталостью, которые могут сохраняться в течение нескольких лет после эрадикации паразитов. Возбудители протозоозов ответственны за большую часть инфекционных гастроэнтеритов. Считается, что эта патология встречается в два раза чаще, чем бактериальный гастроэнтерит.
Первоначально при клиническом подозрении протозойной инвазии проводится микроскопический анализ на присутствие простейших в кале, который остается эталонным методом диагностики кишечных протозойных инфекций. Однако этот метод требует временных затрат. Поэтому в связи с клинической важностью своевременной идентификации возбудителей кишечных инфекций и для рационального лечения требуется быстрый и чувствительный метод обнаружения патогенов. Мультиплексные ПЦР-тесты в реальном времени все чаще используются в качестве первой линии диагностики в клинической паразитологии, заменяя микроскопию.
Своевременная и точная диагностика и лечение протозойных инвазий имеет большое значение как для каждого отдельного пациента, так и для общественного здравоохранения в целом.
Читайте также:

