Гистология плаценты при инфекции
Обновлено: 24.04.2024
Плацентарная недостаточность (ПН), несмотря на успехи современного акушерства, занимает ведущее место в структуре перинатальной заболеваемости и смертности. Плацентарная дисфункция служит основной причиной внутриутробной гипоксии, синдрома задержки роста плода (СЗРП). Частота ПН варьирует по данным различных авторов от 13 до 42% [10, 15].
В то же время отсутствует единство взглядов на ведение беременных с ПН, дискутируется вопрос о длительности лечения, сроках и методах родоразрешения беременных. Актуальным остается изучение адаптационных и компенсаторных изменений в плаценте на ультраструктурном уровне с последующей разработкой подходов к коррекции этих процессов.
Плацентарная недостаточность — это симптомокомплекс, при котором возникают морфофункциональные нарушения плаценты и плода вследствие различных экстрагенитальных, гинекологических заболеваний и акушерских осложнений. При этом нарушается кровообращение плаценты и плода, что сопровождается в ряде случаев задержкой роста плода [9, 10, 14].
Выделяют следующие факторы риска, приводящие к развитию плацентарной недостаточности: возраст младше 17 лет и старше 30 лет; неблагоприятные социально-бытовые условия; вредные пристрастия; экстрагенитальная патология; инфекционные и гинекологические заболевания; отягощенный акушерско-гинекологический анамнез [10, 17].
Несмотря на полиэтиологичную природу ПН, в развитии осложнения на фоне инфекции имеются определенные особенности. К первичным звеньям в патогенезе недостаточности плаценты относят нарушение созревания плаценты, отставание формирования котиледонов, снижение маточно-плацентарного и плодово-плацентарного кровообращения [21].
Под влиянием одного или нескольких патологических факторов возникает активация функции плаценты и компенсаторно-приспособительных процессов, при угнетении которых развивается стадия дезорганизации и угнетения функции плаценты, с возможным развитием в ней необратимых деструктивных процессов [1].
Воздействие инфекционного фактора, при истощении компенсаторно-приспособительных реакций всех звеньев в функциональной системе мать – плацента – плод, способствует инфекционному поражению плаценты с последующим заражением плода [1]. Развивается токсинемия, расстройства метаболизма, циркуляторные нарушения в данной системе.
Плацентарная недостаточность, обусловленная неспецифическим воздействием микробных токсинов и метаболитов, поступающих в материнский кровоток из очага инфекции, создает предпосылки для развития хронической гипоксии и гипотрофии плода. Не оспорим тот факт, что в развитии инфекционного поражения плаценты и плода, степени тяжести их нарушений, локализации патологического процесса, имеют значение сроки беременности, вид возбудителя и его вирулентность, тропизм возбудителя к плаценте, органам и тканям плода, пути проникновения микроорганизмов от матери к плоду, защитные резервы матери и плода [17].
При наличии инфекции в амниотической жидкости повышается уровень липополисахаридов с последующей активацией деятельности клеток фетального трофобласта, что приводит к усиленному синтезу ими цитокинов: IL 1, 6, 8, 10, TNF. Они, в свою очередь, создавая условия для повышения метаболизма цАМФ, выступают посредниками в развитии воспалительных и иммунных реакций в системе мать – плацента – плод [16]. При участии цитокинов, под воздействием эндотоксинов и фосфолипаз микроорганизмов происходит высвобождение арахидоновой кислоты из тканевых фосфолипидов, вызывая синтез простагландинов. Простагландины Е2 и F2α являются медиаторами деградации интерстициального коллагена I типа, дилатации шейки матки и развития родовой деятельности [15]. Однако по данным зарубежной литературы, концентрации регуляторных цитокинов IL 4 и IL 10 оказываются меньше значений, чем у здоровых женщин [20].
Циркуляция вирусов в крови или наличие гнойно-воспалительного очага в организме матери способствует гематогенному или трансплацентарному пути передачи инфекции к плоду [3, 5]. Отмечены случаи трансдецидуального пути проникновения инфекции (из гнойных очагов между стенкой матки и плодными оболочками) и нисходящего пути (через маточные трубы из возможных очагов в брюшной полости). В тоже время, наличие массивной инфекции у женщин вирусной или бактериальной этиологии может не вызывать инфицированности у плода [3, 9, 14, 15].
Таким образом, степень выраженности патологического влияния инфекции на плод и новорожденного зависит от характера изменений иммунного статуса беременной. Повышенный рост титра активных антител, может выступать в качестве прямых патогенных факторов по отношению к плоду. В свою очередь тяжесть общего клинического состояния и частота нарушений физиологического течения раннего неонатального периода зависит от выраженности изменений содержания данных антител.
Во время физиологически протекающей беременности меняются функции Т-системы иммунитета у матери за счет выработки цитотрофобластом иммунодепрессантов, возникает состояние физиологической иммуносупрессии и развитие вторичного иммунодефицита, создавая хорошие условия для реактивации хронической инфекции [19]. У беременных с персистирующей бактериальной инфекцией снижается интерфероносинтезирующая функция лейкоцитов, развивается ферментативный дисбаланс иммунокомпетентных клеток [14]. При вирусных заболеваниях снижается количество лимфоцитов, угнетается их бластная трансформация, с последующим подавлением ими синтеза α и γ-интерферона [8].
При выявлении плацентарной недостаточности инфекционного генеза необходимо определение причины, которая ее вызвала [1]. Методы диагностики плацентарной недостаточности включают в себя: 1) стандартные, свидетельствующие о степени и характере изменений происходящих в плаценте, 2) специфические обследования на вид возбудителя у беременных с высоким риском развития ПН.
К стандартным методам относятся исследования гормональной (плацентарного лактогена, трофобластического бета-1-гликопротеина (ТБГ), хорионического гонадотропина, эстриола и кортизола в сыворотке крови беременных) [10] и метаболической функции плаценты, ультразвуковое исследование, допплерометрия кровотока в сосудах фетоплацентарного комплекса, морфологическая диагностика плаценты [2, 11]. Причем оценка нарушений метаболизма (изменение уровня плацентарной щелочной фосфатазы), образование продуктов свободно-радикальных реакций, сдвиги кислотно-основного состояния позволяют диагностировать хроническую ПН на доклиническом этапе.
При развитии инфекционного процесса определение белков острой фазы (БОФ), например, лактоферрина (ЛФ) [4], позволяет определить напряженность организма, связанную с бактериальной агрессией, при этом концентрация ЛФ в плазме крови не зависит от степени ее насыщения железом [7]. ЛФ синтезируются клетками сыворотки крови нейтрофилами [7], стимулируют фагоцитарные и цитотоксические свойства макрофагов, повышая их бактерицидную активность, а так же угнетают реакцию СЗ и С5 компонентов комплемента с иммунными комплексами по классическому пути, оказывая супрессивное действие на выработку IL 1 [6].
При ПН инфекционного генеза и ВУИ важную роль играет исследование амниотической жидкости на противовоспалительные цитокины (IL 6). Так повышение содержания IL 6 в слизи цервикального канала у беременных с вирусной инфекцией служит маркером ВУИ у плода [10].
При инфекционном процессе в репродуктивном тракте беременных происходит активация клеток иммунной системы, приводящее к индукции клеточного иммунного ответа и продукции провоспалительных цитокинов [13]. Выявление в сыворотке крови повышенной концентрации цитокинов говорит о нарушении принципа локальности функционирования цитокиновой системы, развивающееся при воспалительных процессах, и в дальнейшем сопровождающееся генерализованной активацией клеток иммунной системы [12]. Развитие воспалительного процесса в урогенитальном тракте беременных сопровождается антигенной стимуляцией макрофагов, нейтрофилов, лимфоцитов, усиленной продукцией цитокинов (IL 1, IL 6, IL 8, TNF и т.д.) с развитием синдрома системного воспалительного ответа [12,17]. В результате этого, по мере развития инфекционного процесса, возникает гипоксия плода. В зависимости от компенсаторных возможностей организма имеющиеся метаболические расстройства у плода, могут приводить к нарушению функционального состояния матери и плода [2]. Развитие явлений плацентита при ПН инфекционного генеза приводит к системным нарушениям гормонального баланса, иммунного и цитокинового статусов [11, 18].
Учитывая короткий период полужизни цитокинов, тесный биологический эффект одного цитокина, с действием других нацеливает клиницистов на поиск новых маркеров активации иммунной системы.
Таким образом, диагностика плацентарной недостаточности инфекционного генеза, особенно на ранних этапах ее развития, требует детального исследования беременных на инфекции, передаваемые половым путем и выделение пациенток в группу риска по развитию ВУИ. Необходимо своевременное проведение ультразвуковой диагностики ПН и ВУИ, с назначением адекватной терапии с учетом сложившейся клинической ситуации.
Список использованных источников:
1. Бубнова Н.И., Зайдиева З.С., Тютюнник В.Л. Морфология последа при генитальной герпетической инфекции// Акушерство и гинекология. – 2001. – № 6. – С. 24-29.
2. Введение в клиническую морфологию плаценты человека/ Под ред. А.Ф.Яковцевой.- Саратов: Изд-во Саратовского ун-та, 1991.- 168 с.
3. Веденеева Г.Н., Фоменко Б.А., Евсюкова И.И., Сельков С.А. Состояние и последующее развитие новорожденных детей от матерей с ЦМВИ// Российский вестник перинатологии и педиатрии. – 1997. – № 3. – С. 25-29.
4. Гнипова В.В. Оптимизация патогенетической терапии у женщин с привычным невынашиванием беременности I триместра на основании исследования состояния эндометрия: Автореф. дис. … канд. мед. наук. - М., 2003. - 20 с.
5. Димитрова В.И. Оздоровление женщин после неразвивающейся беременности: Автореф. дис. … канд. мед. наук. - М., 2006.-22 с.
7. Ефремов С.Н., Цхай В.Б., Пуликов А.С., Макаренко Т.А. Морфофункциональные особенности плаценты при хламидиозе// Вестник перинатологии, акушерства и гинекологии. – Красноярск, 2000. – Вып. 7. – С. 46-49.
8. Запертова Е.Ю. Роль ряда цитокинов и интегринов в генезе привычного невынашивания беременности: Автореф. дис. … канд. мед. наук. -М., 2005.- 24 с.
10. Макаров И.О. Функциональное состояние системы мать-плацента-плод при гестозе: Дис. . докт. мед. наук. – М. – 1998.
12. Назаров П.Г. Реактанты острой фазы воспаления. – СПб.: Наука, 2001. – 423с.
13. Останин А.А., Макагон А.В., Леплина О.Ю. Показатели иммунитета плода в ранней диагностике внутриутробной инфекции// Медицинская иммунология. – 2001. – Т. 3, № 4. – С. 515-524.
14. Савичева А.М., Башмакова М.А., Аржанова О.Н. и др. Инфекции у беременных// Журналъ акушерства и женскихъ болезней.-2002.-Вып.2-Т.LI.- С.71-77.
15. Серов В.Н., Тютюнник В.Л., Зубков В.В., Зайдиева З.С. Перинатальные исходы у беременных с инфекционными заболеваниями и плацентарной недостаточностью// Акушерство и гинекология. – 2002. – № 3. – С. 16-21.
16. Тареева Т.Г. Перинатальные аспекты смешанной урогенитальной инфекции (патогенез, прогнозирование, профилактика): Дис. . докт. мед. наук. – М. – 2000.
17. Тютюнник В.Л. Хроническая плацентарная недостаточность при бактериальной и вирусной инфекции (патогенез, диагностика, профилактика, лечение): Дис. . докт. мед. наук. – М. – 2002.
18. Шуршалина А.В. Хронический эндометрит у женщин с патологией репродуктивной функции: Автореф. дис. . докт. мед. наук. -М., 2007.- 38 с.
19. Hallman M. Intrauterine infections and the fetus// Duodecim. – 1999. – Vol. 115, № 14. – P. 1437-1438.
20. Yamada H., Kato E.H., Tsuruga R. et al. Insulin response patterns contribute to different perinatal risks in gestational diabetes// Gynecol.Obstet.Invest.-2001.-Vol.51.-P.103-109.
21. Kingdom R., Gupta N., Nair D. et al. Screening for TORCH-infections in pregnant women: a report from Delhi// Southeast. Asian. J. Trop. Med. Public. Health. – 1999. – Vol. 30, № 2. – P. 284-286.
Подписано в печать: 12.01.2012
Цель исследования: определить частоту и локализацию воспалительных изменений в последах у женщин со своевременными и преждевременными родами. Проведен анализ заключений гистологического исследования последов у 327 родивших женщин, взятых методом сплошной выборки. При преждевременных родах воспалительные изменения были обнаружены в 77,8 % случаев, что достоверно чаще, чем при своевременных родах – 36,7% (р 2 и точный тест Фишера.
Результаты
Таблица 1
Частота и локализация воспалительных изменений в последе при своевременных и преждевременных родах по данным патоморфологического исследования
р
1. Поражение плаценты:
Базальная пластинка (базальный децидуит)
Базальная пластинка, ворсинчатый хорион (базальный децидуит, виллузит)
2. Поражение плодных оболочек:
Париетальная пластинка, гладкий хорион
Париетальная пластинка, гладкий хорион, амнион (мембранит)
3. Сочетанные поражения плаценты, оболочек, пуповины:
Сочетанное поражение базальной и париетальной пластинок
(базальный и париетальный децидуит)
Сочетанное поражение плодных оболочек и пуповины
Сочетанное поражение плодных оболочек, плаценты и пуповины (плацентит)
Также были получены достоверные отличия по степени распространения внутриматочного воспаления между подгруппами с разными сроками родов (табл. 2). При очень ранних преждевременных родах (22 недели – 27 недель 6 дней), которые произошли в 1 случае, было выявлено сочетанное поражение плаценты, плодных оболочек и пуповины (плацентит).
При ранних преждевременных родах (28 недель – 33 недели 6 дней) воспалительные изменения в последе были установлены в 85,7 % случаев. При этом, в отличие от своевременных родов, достоверно чаще они были представлены мембранитом (в том числе сочетанием его с фуникулитом) – в 21,4 %, виллузитом – в 14,3 % случаев и плацентитом – в 7,1 %. Вместе с тем в превалирующем числе наблюдений, так же, как и при своевременных родах, присутствовали такие формы, как хориодецидуит (28,6 %) и сочетанное поражение базальной и париетальной пластинок (14,3 %).
Таблица 2
Частота и локализация воспалительных изменений в последе при своевременных и преждевременных родах по данным патоморфологического исследования
Плацентит – это воспаление плаценты, которое возникает под действием неинфекционных и инфекционных факторов. Патология плаценты может проявиться на любом сроке, симптомы зависят от выраженности воспаления. Плацентит приводит к дисфункции фето-плацентарного комплекса, его исходом становятся плацентарная недостаточность, задержка развития плода, внутриутробное инфицирование. Значительно возрастает риск преждевременных родов и гибели новорожденного. Для диагностики используется УЗИ, которое позволяет заметить нарушение структуры плаценты, плацентарного кровотока. Лечение плацентита проводится антибиотиками, а также препаратами, улучшающими функцию плаценты.
МКБ-10
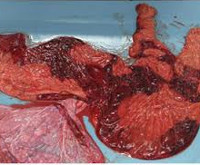
Общие сведения
Плацентит – инфекционно-воспалительное заболевание, чаще всего является результатом восходящего распространения инфекции. У 98% женщин приводит к неблагоприятному течению беременности и развитию осложнений. Угроза прерывания, ассоциированная с плацентитом, отмечается у 76% беременных. В большинстве случаев плод страдает от внутриутробной гипоксии, 9% детей рождается с признаками гипотрофии. Инфекция вызывает несвоевременное излитие вод у 38% беременных, у трети женщин это приводит к аномалиям родовой деятельности. Риск внутриутробного инфицирования существует у 6% детей, которые развиваются в условиях плацентита.

Причины плацентита
У всех беременных наблюдается физиологическая иммуносупрессия, вызванная повышением выработки прогестерона. При наличии очагов хронической или острой инфекции она может распространиться на плаценту. Чаще всего инфицирование происходит восходящим путем из влагалища через шейку матки. К плацентиту приводят различные виды микроорганизмов и действие неинфекционных факторов:
- Бактерии. У женщин с плацентитом в мочеполовых путях обнаруживаются стрептококки группы В (Streptococcus agalactiae), другие гноеродные бактерии. Возбудителями плацентита могут быть листерии, спирохеты. Микобактерии туберкулеза проникают в плаценту гематогенным путем и вызывают специфическое воспаление.
- Вирусы. В 7-25% случаев вирусного плацентита причиной воспаления является вирус простого герпеса. Морфологические изменения по типу плацентита характерны для парвовирусной (B19V), респираторно-синтициальной инфекции, цитомегаловируса, ВИЧ-инфекции.
- Простейшие. Причиной плацентита может явиться токсоплазмоз. У беременных инфекция может протекать в острой или бессимптомной форме, приводить к тяжелым осложнениям. Редко регистрируется плацентит, вызванный малярийным плазмодием. Эта инфекция характерна для жарких стран, заражение беременной может произойти во время путешествия.
- Неинфекционные причины. Воспалительный ответ тканей плаценты возможен при изменении показателя рН амниотических вод, который в норме составляет 7,0-7,5. При острой или хронической гипоксии плода, преждевременном старении плаценты, переношенной беременности к плацентиту приводит появление мекония в околоплодных водах.
Патогенез
Воспаление может возникать в различных слоях плаценты. Воспалительная реакция сопровождается миграцией лейкоцитов и инфильтрацией тканей, нарушением кровообращения, которое вызвано микротромбозами межворсинчатого пространства, микроинфарктами, ишемией концевых ворсин. Также определяется полнокровие и отек стромы. В зависимости от вовлеченного слоя различают следующие формы плацентита:
- Базальный децидуит – воспаление в базальной пластинке плаценты. Для него характерны некротические изменения, дистрофия клеток, пролиферативные изменения стенок спиральных артерий и вен.
- Интевиллузит - плацентит межворсинчатого пространства, очаговое поражение части ворсин с миграцией воспалительных клеток.
- Виллузит - воспаление ворсин хориона, может быть терминальным или стволовым, в зависимости от типа поврежденных структур.
- Плацентарный хориоамнионит – это более тяжелая форма, которая сопровождается интервиллузитом и ангиитом сосудов пуповины.
Плацентит не всегда приводит к инфицированию плода, но может сказаться на состоянии эндометрия после родов и ухудшить прогнозы для следующих беременностей. Одновременно внутриутробная инфекция у ребенка может протекать без признаков плацентита. Такой вариант течения наблюдается при некоторых вирусных инфекциях. Для каждого типа возбудителя характерна своя гистологическая картина.
Симптомы плацентита
Патология может быть следствием острой либо хронической инфекции. У нее нет специфических проявлений, при латентном течении симптомы могут вовсе отсутствовать. Учитывая восходящий путь инфицирования, беременную могут беспокоить вагинальные выделения. Они могут быть белыми, с желтоватым или сероватым оттенком, с неприятным запахом или без него. При остром течении вагинита из-за близкого расположения мочеиспускательного канала появляются дизурические расстройства. Женщина жалуется на неприятные ощущения во время мочеиспускания, походы в туалет становятся чаще. Выделения сопровождаются зудом и жжением, покраснением половых губ.
Боль внизу живота является следствием воспаления. При плацентите и возникновении угрозы преждевременных родов боли появляются в нижней части матки. Они тянущие, ноющие, могут отдавать в промежность или поясницу. На появление угрозы прерывания беременности указывает тонус матки, схваткообразная боль. Плод реагирует на недостаток кислорода увеличением двигательной активности или снижением количества шевелений. Настороженность должны вызывать подтекание околоплодных вод или их дородовое излитие. Это повод срочно обратиться за медицинской помощью в гинекологическое отделение на сроке до 22 недель, а на более позднем сроке – в роддом.
Осложнения
Плацентит вызывает осложнения беременности, некоторых из них становятся показанием для досрочного родоразрешения. У каждой 5-ой беременной отмечается преждевременное излитие околоплодных вод. Для беременных с плацентитом характерна плацентарная недостаточность. При декомпенсации состояния у плода развивается острая гипоксия, которая может привести к антенатальной гибели или тяжелым повреждениям центральной нервной системы ребенка. Чем раньше возник плацентит, тем выше вероятность тяжелых осложнений. Течение беременности может осложниться гестозом, внутриутробной инфекцией ребенка, преждевременными родами.
Диагностика
При нарушении самочувствия, боли в животе, появлении выделений из половых путей беременной необходимо обратиться к врачу акушеру-гинекологу, у которого она состоит на учете. Объем диагностических процедур подбирается индивидуально, опираясь на клинические проявления, данные анамнеза и предыдущих исследований. Базовая диагностика плацентита проводится неинвазивными инструментальными методами:
- Гинекологический осмотр. Отмечаются патологические выделения из влагалища, признаки воспаления в виде отека и гиперемии слизистой. Но при вирусном плацентите в половых путях изменений может не быть. При угрозе прерывания беременности из шейки выделяется кровь. На подтекание вод указывает наличие прозрачной жидкости во влагалище. Если произошло дородовое излитие вод, предлежащая часть плода опускается в полость малого таза и хорошо пальпируется.
- Акушерский осмотр. Матка в повышенном тонусе, возбудима. При длительно существующем плацентите в тяжелых случаях может наблюдаться отставание размеров матки от срока беременности, что указывает на внутриутробную задержку развития. О гипоксии говорят приглушенные тоны сердца плода. Отсутствие сердцебиения и шевеления – признак антенатальной смерти.
- УЗИ плода. Определяется утолщение плаценты, кистозные полости, кальцификаты. На раннем сроке может наблюдаться расширение межворсинчатого пространства. Неблагоприятный признак – сегментарные сокращения матки, признаки старения плаценты. При развитии фето-плацентраной недостаточности плод отстает в размерах от срока гестации, его двигательная активность снижена.
- Допплерометрия сосудов плаценты. Регистрируются нарушения гемодинамики. При плацентите, который затрагивает плодовую или материнскую часть плаценты, отмечается ее гиповаскуляризация. При диффузном плацентите компенсаторная реакция приводит к гиперваскуляризации плаценты. О выраженности плацентита судят по индексу васкуляризации и кровотока.
- Лабораторная диагностика. В общем анализе крови признаки воспаления – ускорение СОЭ, повышенное количество лейкоцитов. Для вирусного плацентита характерно увеличение лимфоцитов. В лейкоцитарной формуле отмечается сдвиг влево из-за образования молодых форм лейкоцитов. Биохимический анализ крови показывает повышенный С-реактивный белок.
Подтверждается плацентит после родов. Плодное место с оболочками и пуповиной отправляется на гистологическое исследование. По его результатам можно предположить тип инфекции, если обследование не проводилось во время беременности. Для нормального восстановления в послеродовом периоде и профилактики эндометрита назначается лечение.
Лечение плацентита
Женщина с плацентитом госпитализируется для проведения качественного обследования, лечения и выбора акушерской тактики. Консервативная терапия оправдана при недоношенной беременности и признаках незрелого плода, но при сохранении его нормальной гемодинамики. При некупирующейся острой гипоксии плода и в других тяжелых случаях показано досрочное родоразрешение путем кесарева сечения. При плацентите проводится:
- Антибактериальная терапия. Применяются антибиотики широкого спектра действия из группы защищенных пенициллинов, цефалоспоринов, макролидов. В тяжелых состояниях их вводят инъекционно с последующим переходом на формы для приема внутрь. Курс составляет 7-14 суток. Антибиотики обязательно назначаются при безводном промежутке более 12 часов для профилактики хориоамнионита.
- Токолитики. Необходимы для снижения тонуса матки и пролонгирования беременности. Назначают магния сульфат капельно, в качестве экстренного средства допускается применение гексапреналина. Но по клиническим рекомендациям предпочтение отдается фенотеролу. Токолитики не используют после излития вод.
- Глюкокортикоиды. Назначаются в случаях, когда есть высокая вероятность досрочного родоразрешении или после отхождения вод на сроке меньше 36 недель. Необходимы для ускорения созревания легких плода и профилактики болезни гиалиновых мембран новорожденного. Схема и продолжительность терапии подбирается индивидуально.
- Антиагреганты и антикоагулянты. Необходимы для улучшения кровотока в плаценте, профилактики тромботических осложнений. Применяют курантил, пентоксифиллин в таблетках длительным курсом. По показаниям назначаются низкомолекулярные гепарины в виде инъекций. Использование прекращают за 2 недели до предполагаемых родов.
Прогноз и профилактика
При плацентите прогноз зависит от срока развития воспаления и способностей организма компенсировать сосудистые нарушения. Для плода плацентраная недостаточность увеличивает риск задержки развития, внутриутробного инфицирования и гипоксии, которая может завершиться внутриутробной гибелью. Профилактика плацентита заключается в прегравидарной подготовке, своевременном лечении хронических воспалительных процессов половых органов. Мазки на чистоту влагалища, которые берутся при постановке на учет, позволяют вовремя заметить воспалительные изменения, провести дополнительное обследование и лечение.
1. Особенности плацентарного кровотока при плацентитах./Фомина М.П.//Вестник Витебского государственного медицинского университета. - 2012.
2. Перинатальные исходы при инфицированной плаценте./Новикова О.Н., Мустафина Л.Р., Ушакова Г.А., Логвинов С.В.// Мать и дитя в Кузбассе. 2015 - №2(61).
3. Влияние плацентита на течение и исход беременности./Донгузова Е.В.// III Всероссийская неделя медицинской науки с международным участием. – 2014.
Хориоамнионит — это инфекционное воспаление плодных оболочек и амниотической жидкости, вызванное полимикробными ассоциациями. Проявляется гипертермией, болью в области матки, гнойными или сукровичными выделениями из влагалища. Возможно субклиническое течение заболевания с минимальной симптоматикой. Диагностируется с помощью гинекологического осмотра, КТГ плода, лабораторных исследований, УЗИ малого таза. Тактика ведения беременной предполагает срочное родоразрешение через естественные родовые пути или путем кесарева сечения с одновременным назначением интенсивной антибактериальной, противовоспалительной, инфузионной терапии.
МКБ-10
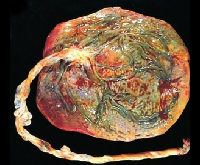
Общие сведения
Хориоамнионит (интраамниотическая инфекция, амниотический инфекционный синдром) чаще возникает во II триместре и, по данным разных авторов, выявляется у 0,9-10,5% беременных. Развитие заболевания в III триместре обычно связано с длительным безводным периодом после преждевременного излития вод. Патологию чаще обнаруживают у женщин, страдающих хроническими генитальными и экстрагенитальными инфекциями. Актуальность своевременной диагностики и лечения антенатального инфицирования обусловлена тем, что хориоамнионит является одной из наиболее распространенных причин преждевременного прерывания беременности, повышает вероятность возникновения угрожающих жизни осложнений для плода и женщины.

Причины хориоамнионита
Воспаление окружающих плод оболочек — полимикробное инфекционное заболевание, вызванное ассоциацией из двух и более патогенных или условно-патогенных микроорганизмов. Непосредственными возбудителями хориоамнионита могут стать стрептококки группы В, пептострептококки, стафилококки, кишечные палочки, микоплазмы, уреаплазмы, энтерококки, хламидии, трихомонады, гонококки, гарднереллы, кандиды, бактероиды, вирус простого герпеса, цитомегаловирус и др. Для начала воспалительного процесса, как правило, требуется сочетание нескольких предрасполагающих условий, основными из которых являются:
- Наличие инфекционного очага. Инфицирование амниотических оболочек обычно происходит восходящим путем. Риск развития хориоамнионита повышается при наличии бактериального вагиноза, вульвовагинита, кольпита, эндоцервицита, эндометрита. Нисходящее инфицирование возможно при сальпингитах, оофоритах, аднекситах. Не исключен гематогенный занос микроорганизмов из существующих экстрагенитальных очагов хронической инфекции.
- Доступ к матке и плодному пузырю. В 98% случаев физиологической беременности амниотическая жидкость стерильна. От инфицирования ее защищают плодные оболочки и слизь, замыкающая канал шейки матки. Действие этих защитных механизмов ослабляется при истмико-цервикальной недостаточности, подтекании околоплодных вод, разрыве плодного пузыря. Вероятность воспаления особенно возрастает в родах с безводным промежутком более 24 часов.
- Инвазивные диагностические и лечебные манипуляции. В некоторых случаях при осложненном течении беременности, подозрении на аномалии развития или болезни плода выполняют исследования с проникновением в полость матки и плодный пузырь. Наиболее опасными в плане развития хориоамнионита являются амниоскопия, амниоцентез, кордоцентез, плацентоцентез. Инфицирование также возможно в ходе амниоинфузии и внутриутробного переливания крови.
- Снижение иммунитета. Более активное размножение условно-патогенных и патогенных микроорганизмов происходит при ослаблении защитных сил организма. Провоцирующими факторами иммунной недостаточности становятся простудные заболевания, обострения экстрагенитальной патологии, длительные или интенсивные физические и психические нагрузки, прием медикаментов с прямым или вторичным иммуносупрессорным эффектом.
Риск возникновения хориоамнионита также возрастает с началом естественных родов, особенно если в их ходе многократно проводятся пальцевые влагалищные исследования после вскрытия плодных оболочек или выполняется внутренняя кардиотокография плода для получения объективных данных о его состоянии и характеристиках сократительной активности матки.
Патогенез
При нормальном течении беременности развитию воспалительных изменений в хорионе и других плодных оболочках препятствуют естественные плацентарные механизмы защиты, представленные несколькими видами Toll-подобных рецепторов, которые определяют присутствие лигандов микроорганизма и инициируют протективную реакцию в ответ на повреждение эпителия. Выделение дефензинов, секреторных лейкоцитарных ингибиторов протеиназ, элафинов способствует лизису бактерий и инактивации их повреждающих факторов. Массивное восходящее, нисходящее или гематогенное поступление инфекционных агентов провоцирует срыв местного иммунитета, а вырабатываемые ими протеазы разрушают волокна коллагена, входящего в состав плодных оболочек, оказывают прямое повреждающее действие на плаценту.
Опосредованные эффекты, способствующие развитию воспалительного процесса при хориоамнионите, связаны с выделением цитотоксичных цитокинов и матриксных металлопротеаз, апоптозом. Повышенная концентрация микробных фосфолипаз в околоплодной жидкости способствует усиленному синтезу простагландинов из тканевых фосфолипидов, что сопровождается преждевременным началом родовой деятельности. Заглатывая инфицированную амниотическую жидкость, плод внутриутробно заражается. Более чем в 80% случаев заболевания страдает фетоплацентарный комплекс – воспаление распространяется на межворсинчатое пространство, тромбируются сосуды базальной децидуальной оболочки.
Классификация
При систематизации клинических форм хориоамнионита учитывают течение патологического процесса — скорость его развития и выраженность клинических проявлений. С остротой воспаления напрямую связаны морфологические изменения, происходящие в тканях околоплодных оболочек, и вероятность возникновения осложнений. Специалисты в сфере акушерства и гинекологии, различают два вида хориоамнионита:
- Острый. Наиболее распространенная форма заболевания. Воспаление развивается быстро, проявляется выраженной симптоматикой. В оболочках, окружающих плод, формируются лейкоцитарные инфильтраты, в процесс обычно вовлечены плацента, хорион, амнион, пуповина. Характерно поражение сосудов в виде хориональных васкулитов, фуникулита.
- Хронический. Наблюдается крайне редко, преимущественно у пациенток с герпесом, сифилисом, токсоплазмозом. Сочетается с артериальной гипертензией, сахарным диабетом, Rh-конфликтом. Определяется по наличию осложнений. Морфологически обнаруживается лимфоцитарная инфильтрация внеплацентарных оболочек и хронический виллит.
Симптомы хориоамнионита
При остром течении заболевания у беременной появляются боли различной интенсивности в нижней части живота. Она могут иррадиировать в паховую область, крестец, усиливаться при прощупывании матки через переднюю брюшную стенку. Температура тела зачастую повышена до 38° С и выше, у пациентки возникает выраженный озноб, пульс учащается до 100 сокращений в минуту и выше. Общее самочувствие женщины ухудшается, она испытывает слабость, быструю утомляемость. Могут наблюдаться патологические влагалищные выделения с неприятным запахом — серо-зеленые (гнойные) или с примесью крови. В ряде случаев хориоамнионит протекает бессимптомно и диагностируется после внезапно прервавшейся беременности или по наличию характерных осложнений послеродового периода.
Осложнения
Наиболее серьезными осложнениями хориоамнионита являются фетоплацентарная недостаточность, преждевременный разрыв плодных оболочек, отслоение нормально расположенной плаценты, досрочные роды во 2-3 триместрах. У таких беременных чаще возникают бактериемия, слабость родовой деятельности, атонические послеродовые кровотечения, тромбоэмболии, послеродовые эндометриты, акушерские перитониты, тазовые абсцессы, инфекционные осложнения травматических ран, полученных в родах. Возможны коагулопатии, септический шок, респираторный дистресс-синдром.
Нарушение нормального функционирования фетоплацентарного комплекса при хориоамнионите может спровоцировать задержку развития плода. У новорожденных повышен риск получения травм в родах, развития врожденных неонатальных инфекций (пневмонии, сепсиса, менингита), церебрального паралича и смерти.
Диагностика
Поскольку хориоамнионит представляет серьезную угрозу дальнейшему течению беременности, при подозрении на развитие заболевания все обследования выполняются в экстренном порядке. Диагностический поиск направлен на выявление признаков локального воспаления околоплодных оболочек, оценку состояния плода и определение возможных возбудителей. Наиболее информативны для постановки диагноза:
- Осмотр на кресле. Бимануальное влагалищное исследование позволяет обнаружить болезненность маточной стенки, расширение цервикального канала. За счет отека тканей размеры беременной матки могут быть больше гестационного срока. При осмотре в зеркалах заметны характерные выделения.
- Кардиотокография плода. Признаком нарушения работы фетоплацентарного комплекса и возможного внутриутробного инфицирования ребенка при хориоамнионите считается компенсаторная тахикардия. Частота сердечных сокращений плода при воспалении оболочек превышает 160 ударов в минуту.
- Лабораторные анализы. Типичными лабораторными признаками расстройства являются лейкоцитоз свыше 15∙10 9 /л и ускорение СОЭ в общем анализе крови. Об общевоспалительных изменениях также свидетельствует сдвиг лейкоцитарной формулы влево. Уровень C-реактивного белка превышает 5,0 мг/л.
- УЗИ матки и плода. УЗ-критерии хориоамнионита включают утолщение плацентарной ткани, расширение межворсинчатого и субхориального пространств. Хориальная пластинка обычно гипоэхогенна. Выявляются признаки преждевременного созревания плаценты, изменено количество и качество околоплодных вод.
- Бактериологические исследования. Микроскопия и бактериальный посев влагалищного мазка дают возможность определить возможных возбудителей инфекционно-воспалительного процесса. По показаниям микробиологические анализы дополняют специальными методами выявления инфекций (РИФ, ИФА, ПЦР).
Дополнительными признаками воспалительного поражения плодных оболочек служат падение уровня эстриола, увеличение содержания хорионического гонадотропина, усиление тромбоагрегации в сочетании с нарушениями плазменного звена гемостаза. После родов наличие воспаления обнаруживается при гистологическом исследовании плодных оболочек. Дифференциальная диагностика проводится с эндометритом, другими воспалительными заболеваниями репродуктивных органов, острой хирургической патологией брюшной полости. При необходимости назначают консультации хирурга, инфекциониста, уролога, неонатолога.
Лечение хориоамнионита
Воспаление оболочек плода является показанием для экстренной госпитализации беременной и ее перевода на постельный режим. Тактика ведения пациентки предполагает как можно более быстрое родоразрешение (стимулированные роды или кесарево сечение) с назначением массивной антибактериальной и симптоматической терапии, которые продолжаются в послеродовом периоде. Выбор метода родоразрешения зависит от выраженности воспалительных изменений, срока безводного периода (при преждевременном излитии околоплодных вод), состояния женщины и плода. Схема медикаментозного лечения направлена на решение таких терапевтических задач, как:
- Борьба с инфекционными агентами. Обычно при хориоамнионите еще до получения результатов антибиотикограммы применяют антибиотики широкого спектра действия, воздействующие в том числе на хламидии и микоплазмы. В последующем возможна коррекция назначений в зависимости от чувствительности флоры.
- Профилактика осложнений антибиотикотерапии. С учетом фаркотерапевтических и фармакодинамических характеристик антибактериальных средств пациентке могут быть рекомендованы противогистаминные, противокандидозные препараты. Для восстановления нормальной микрофлоры используют эубиотики.
- Инфузионная терапия. При выраженных нарушениях гемодинамики, признаках общей интоксикации назначают дезинтоксикационные, коллоидные и солевые растворы. По показаниям возможно капельное введение препаратов, улучшающих сердечную деятельность, периферическую микроциркуляцию, показатели гемостаза.
- Воздействие на воспалительные процессы. Применение нестероидных противовоспалительных средств позволяет уменьшить секрецию медиаторов воспаления, снизить температуру тела при значительной гипертермии. НПВС также способны ослабить боль за счет повышения порога болевой чувствительности рецепторов.
Назначение пациенткам с хориоамнионитом витаминно-минеральных комплексов, иммуностимулирующих средств ускоряет процесс выздоровления и снижает вероятность осложнений. Во время восстановительного периода показано физиотерапевтическое лечение с использованием УВЧ-терапии, инфракрасной лазеротерапии, электроимпульсной терапии.
Прогноз и профилактика
При своевременной постановке диагноза прогноз хориоамнионита для беременной благоприятный. Вероятность положительного исхода для плода повышается по мере увеличения гестационного срока, на котором возникло заболевание. Профилактические мероприятия предполагают раннюю постановку на учет в женской консультации для выявления и лечения генитальных инфекций, экстрагенитальной патологии. Рекомендованы обоснованный подход к назначению инвазивной пренатальной диагностики, экстренная госпитализация и выбор оптимальной тактики ведения беременности и родов при преждевременном отхождении околоплодных вод.
Инфаркт плаценты — некроз плацентарной ткани, обусловленный нарушением ее кровоснабжения. При больших участках повреждений проявляется изменением частоты и интенсивности шевелений плода, кровянистыми выделениями из влагалища. При постановке диагноза используют данные УЗИ матки, допплерографии плацентарного кровотока, КТГ и фонокардиографии плода, лабораторных анализов. Схема лечения инфаркта плаценты включает этиотропные средства для коррекции основной патологии, сосудорасширяющие, токолитические, противогипоксические, антиоксидантные препараты. Беременность прерывают в исключительных случаях при возникновении угрозы плоду или женщине.
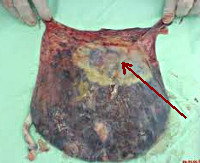
Общие сведения

Причины инфаркта плаценты
Некротические изменения в плацентарной ткани обычно становятся результатом локальных расстройств гемодинамики. Таким образом, к инфаркту приводят заболевания и нарушения, которые оказывают влияние на состояние эндотелия, тонус и хрупкость сосудистой стенки, свертывающую систему крови. По наблюдениям специалистов в сфере акушерства и гинекологии, наиболее распространенными причинами некрозов плаценты являются:
- Длительный спазм спиральных артерий. Повышение сосудистого тонуса в системе плацентарного кровотока наблюдается у беременных с гипертонической болезнью, гестозом, симптоматическими артериальными гипертензиями при заболеваниях почек (диффузном гломерулонефрите, хроническом пиелонефрите, амилоидозе, гипоплазии, поликистозе), врожденных и приобретенных пороках сердца и аорты, опухолях мозга, феохромоцитоме, альдостероме, других эндокринопатиях. Со временем тоническое сужение сосудов усугубляется снижением их эластичности и отложением на стенках нерастворимых соединений.
- Повреждение эндотелиальной оболочки. Нарушение целостности внутреннего слоя сосудистой стенки повышает ее адгезивные свойства, провоцирует начало микротромбообразования и склерозирования. Такие расстройства характерны для пациенток с инсулинозависимым, инсулинонезависимым и гестационным диабетом, генерализованными васкулитами, аутоиммунными процессами, в том числе – вызванными хроническими эндометритами. Выраженный капилляротоксикоз развивается при ряде инфекционных заболеваний: острой ангине, кори, скарлатине, ветрянке, герпесе, хламидиозе, токсоплазмозе, цитомегаловирусной инфекции.
- Гиперкоагуляция крови. Хронометрическая гиперкоагуляция, возникающая во втором триместре беременности, — вариант нормы, предотвращающий значительную кровопотерю в родах. Патологическая высокая свертываемость крови отмечается при увеличении содержания и активности прокоагулянтов у пациенток с тромбоцитозами, гиперпротромбинемией. Действие антикоагулянтных факторов нарушается в случае шока, сепсиса, больших ожогов, ДВС-синдрома. Тромбофилия является одним из клинических проявлений антифосфолипидного синдрома (АФС), гипергомоцистеинемии и ряда наследственных ферментопатий.
- Эмболия сосудов плаценты. Инфаркты развиваются при внезапной закупорке сосуда различными инородными субстанциями, которые в норме отсутствуют в кровяном русле. Причинами эмболии становятся оторвавшиеся тромбы при варикозной болезни и тромбофлебите нижних конечностей, жировая ткань при обширных переломах бедренной и других крупных трубчатых костей, ткани поврежденных органов при массивных травмах или распаде опухолей. Попадание пузырьков воздуха в кровоток возможно при неправильном выполнении некоторых инвазивных медицинских манипуляций (внутривенных инъекций, инфузионных вливаний).
Дополнительными провоцирующими факторами для начала некротических процессов в плаценте являются курение, физические и психоэмоциональные нагрузки, избыточный вес. Никотин оказывает повреждающее воздействие на сосудистый эндотелий и усиливает спазм периферических сосудов. Негативный эффект стрессов и ожирения связан с возможным повышением артериального давления и уровня глюкозы в крови.
Патогенез
Пусковой момент инфаркта плаценты — прекращение нормального кровоснабжения плацентарной ткани. Нарушение кровотока может быть острым (закупорка при тромбоэмболии, тромбирование сосудистого русла при ДВС-синдроме, разрыв сосуда) или постепенно нарастающим (постепенная обтурация просвета со склерозированием сосудистой стенки при диабете, гипертонии, гестозе и пр.). Нарушение местного кровоснабжения активирует анаэробные механизмы гликолиза. Истощение внутренних резервов клеток приводит к их перенасыщению токсичными метаболитами и гибели (некрозу). Через некоторое время отмершие участки подвергаются лизису и постепенному замещению соединительной тканью. Всасывание в кровь продуктов разрушения плацентарной ткани при массивных инфарктах способно спровоцировать общую интоксикацию организма и усугубить течение основного заболевания.
Классификация
При систематизации различных форм инфаркта плаценты учитывают такие факторы как патофизиологические изменения, происходящие в зоне некроза, размеры и локализацию пораженного участка, количество очагов отмирания ткани. Небольшие краевые инфаркты являются одним из признаков физиологического старения плаценты, большие единичные очаги, расположенные в толще органа, обычно возникают при наличии предрасполагающих расстройств. По механизму формирования различают инфаркты:
- Красные. Ткани плаценты пропитаны кровью, поступающей из одного или нескольких материнских сосудов децидуальной оболочки. Обычно являются ранней стадией острых инфарктов, при отсутствии преждевременного прерывания беременности переходят в белую форму.
- Белые. Зона поражения имеет светлую сероватую или желтоватую окраску, характерную для ишемизированных тканей. Такие некрозы развиваются на фоне постепенной закупорки сосудов и отложения нитей фибрина либо становятся завершающей стадией красных инфарктов.
- Известковые. Участок некроза обызвествлен, содержит белые твердые включения. Инфаркты этого типа обычно формируются постепенно по мере старения плаценты или на фоне склерозирования спазмированных сосудов, на поврежденном эндотелии которых осаждается кальций.
Симптомы инфаркта плаценты
Клиническая картина при некрозе детского места зависит от размеров зоны ишемии и количества поврежденных участков. Единичные краевые инфаркты небольших размеров протекают бессимптомно, зачастую расцениваются как вариант нормы. Если инфаркт вызван разрывом крупного сосуда в центральной части плаценты, обычно формируется ограниченная гематома. В таком случае возможно возникновение болезненных ощущений в области матки, на больших сроках беременности при расположении плаценты на передней маточной стенке иногда удается прощупать плотное образование. Разрыв периферических сосудов приводит к развитию маточного кровотечения. Однако обычно при некрозах плаценты выраженная симптоматика отсутствует, заподозрить патологию удается только по изменению активности плода вследствие кислородного голодания. Прогностически неблагоприятным признаком является внезапное резкое учащение шевелений ребенка с его последующим замиранием на 6 и более часов.
Осложнения
Наибольшую угрозу инфаркт плаценты представляет для плода. Его самым распространенным последствием является фетоплацентарная недостаточность с гипоксией, задержкой развития плода и даже внутриутробной гибелью ребенка. Первые признаки недостаточного поступления кислорода и питательных веществ появляются при наличии множественных микроинфарктов диаметром до 3 см и обширном повреждении более 15% плацентарной ткани. Если площадь некроза превышает 30%, состояние оценивается как угрожающее для плода и требует неотложной медицинской помощи.
Отдаленными последствиями ФПН, возникшей на фоне некроза плаценты, считаются повышенный риск асфиксии околоплодными водами в родах, задержки умственного и речевого развития, гипервозбудимость ребенка, другие неврологические расстройства. Кроме фетоплацентарной недостаточности инфаркт способен спровоцировать преждевременную отслойку плаценты и массивное кровотечение. В редких случаях отмирание больших участков нарушает эндокринную функцию органа, а снижение секреции эстрогенов, плацентарного лактогенного гормона, хорионического гонадотропина приводит к слабости родовой деятельности, гипотоническим кровотечениям в родах, гипогалактии в послеродовом периоде.
Диагностика
При появлении признаков фетоплацентарной недостаточности или мажущих кровянистых выделений из влагалища у женщины, предрасположенной к сосудистым и тромботическим расстройствам, диагностический поиск направлен на оценку морфологических процессов в тканях плаценты и функционального состояния ребенка. План обследования включает следующие методы:
- УЗИ матки и плода. Сонография позволяет выявить зону инфаркта, которая обычно имеет вид множественных небольших или единичного обширного гиперэхогенного включения с четкими контурами. При исследовании также определяется соответствие фетометрических показателей сроку беременности
- Кардиотокография и фонокардиография плода. Методики направлены на получение данных о сердечной деятельности ребенка. О возможной плацентарной недостаточности как последствии инфаркта свидетельствует изменение ритма и частоты сокращений сердца — тахикардия, брадикардия, аритмия.
- Допплерография маточно-плацентарного кровотока. Допплерографическое исследование обеспечивает объективную оценку особенностей циркуляции крови в плаценте и выявляет отсутствие пульсации в сосудах при некрозе ткани. Метод имеет диагностическое значение во второй половине беременности.
- Лабораторные исследования крови. В общем анализе с учётом основной патологии может отмечаться уменьшенное или увеличенное содержание тромбоцитов, эритропения и снижение уровня гемоглобина. При исследовании системы гемостаза изменены тромбиновое время, АЧТВ и ряд других показателей.
Дополнительно для уточнения причин, вызвавших некротические нарушения в плаценте, назначают биохимический анализ крови, диагностику иммунного статуса, исследования для определения возбудителей инфекционных болезней (РИФ, ИФА, ПЦР). Дифференциальную диагностику проводят с тяжелыми формами гестозов, преждевременной отслойкой плаценты, изосерологической несовместимостью крови матери и плода, хориоамнионитом и другими причинами фетоплацентарной недостаточности. По показаниям пациентку осматривают эндокринолог, инфекционист, иммунолог, кардиолог, уролог.
Лечение инфаркта плаценты
При наличии признаков гипоксии и задержки роста плода лечебные мероприятия направлены на устранение причин, приведших к некрозу детского места, и компенсации расстройств в фетоплацентарной системе. Если нет угрозы жизни плода и беременной, рекомендована комплексная консервативная терапия. Экстренное родоразрешение в виде стимуляции преждевременных родов или операции кесарева сечения выполняют только по жизненным показаниям. Стандартная схема ведения беременных предполагает решение следующих задач:
- Воздействие на этиологический фактор. С учетом нозологии, осложнившейся некрозом плаценты, применяют гипотензивные, сахароснижающие, антибактериальные, гормональные средства, иммунокорректоры. При нарушениях в системе гемостаза назначают антикоагулянты, антиагреганты и другие препараты, влияющие на свертываемость крови. К выбору медикаментов для лечения основного заболевания привлекают специалиста соответствующего профиля.
- Стабилизация маточно-плацентарной системы. Для улучшения перфузии питательных веществ и кислорода в интактной части плаценты используют средства с сосудорасширяющим эффектом, низкие дозы токолитиков. Эффективны препараты, улучшающие реологию крови и микроциркуляцию. Чтобы повысить устойчивость плода к возникшей гипоксии, применяют актовегин, антиоксиданты, назначение которых снижает вероятность повреждения мозга.
Прогноз и профилактика
В большинстве случаев прогноз при инфаркте плаценты благоприятный. Маленькие участки некрозов не влияют на развитие ребенка, а своевременная диагностика и адекватное лечение при больших поражениях позволяют предотвратить или свести к минимуму возможные последствия патологии. С профилактической целью беременным из группы риска рекомендуется своевременная постановка на учет в женской консультации, регулярные посещения акушера-гинеколога и УЗИ-скрининги, тщательное выполнение рекомендаций по лечению сопутствующей патологии. Важную роль в профилактике инфаркта детского места играет отказ от курения, соблюдение диеты, нормализация режима сна и отдыха.
Читайте также:

