Гнойно септические осложнения после инъекций
Обновлено: 05.05.2024
Как показывают статистические данные, из всех первичных обращений к хирургу поликлиники до 70 % приходится на гнойно-воспалительные заболевания мягких тканей. Чаще всего по такому поводу приходят рабочие, в основном имеющие низкую
Анализ первичных посещений пациентов хирургического кабинета поликлиники выявляет факт преобладания обращений больных с неосложненными формами гнойно-воспалительных заболеваний на поздних сроках. Основная часть больных обращалась к хирургу только на 4–5-е сутки после появления признаков местного воспаления. Сбор анамнеза и беседа с пациентом показывают, что основными причинами позднего визита больных являются неосведомленность о заболевании и его возможных осложнениях и последствиях, попытки самолечения гнойно-воспалительных заболеваний мягких тканей в домашних условиях (применение мазей, компрессов, прикладывания капустного листа и т. п.), нежелание рабочих обращаться за листком временной нетрудоспособности, а также несерьезное отношение к своему заболеванию. Решению проблемы может способствовать комплекс организационных мероприятий, включающий в себя активную санитарно-просветительскую работу, своевременное выявление больных с гнойно-воспалительными заболеваниями мягких тканей, в частности профилактический осмотр на предприятиях рук рабочих на наличие микротравм и гнойных осложнений, а также повышение квалификации терапевтов поликлинического звена в вопросах диагностики и профилактики этих заболеваний.
Однако у ряда пациентов после адекватно проведенного местного лечения (вскрытия гнойно-воспалительного очага, эвакуации гнойно-некротических масс, санации и в конечном итоге полного заживления полости гнойника) возникают часто рецидивирующие фурункулы других локализаций, т. е. речь идет о фурункулезе. Хронический рецидивирующий фурункулез характеризуется вялотекущим течением с периодическими обострениями, наличием множественных очагов различной локализации, резистентностью к проводимой антибактериальной терапии. Высокий уровень заболеваемости пиодермией и фурункулезом обусловлен в первую очередь широким распространением в природе стафилококков и стрептококков, являющихся этиологическими агентами, вызывающими эти заболевания. Наиболее частый причинный агент — стафилококки (золотистый и в последнее время эпидермальный).
В патогенезе фурункулеза, помимо вирулентности и патогенности различных штаммов кокков, имеет большое значение наличие предрасполагающих сопутствующих заболеваний (в первую очередь сахарного диабета или нарушения толерантности к глюкозе, заболеваний ЖКТ и печени, астении на фоне перенесенных инфекций или операций, длительного лечения глюкокортикостероидными препаратами). В ряде работ (S. Laube) отмечено наличие аллергического компонента при фурункулезе у лиц старшего возраста, сопровождающегося повышением общего IgE.
По результатам работы, выполненной в НИИ иммунологии, фурункулез является одним из клинических проявлений так называемой спонтанной иммунологической недостаточности. В изучении возникновения и развития хронического фурункулеза, наряду с особенностями возбудителя, его патогенными, вирулентными и инвазивными свойствами, большое внимание уделяется нарушению нормального функционирования и взаимодействию различных звеньев иммунной системы. Наиболее диагностически значимыми являются изменения фагоцитарного и гуморального иммунитета, а также их сочетанная патология.
Часто больные с рецидивирующими фурункулами становятся постоянными клиентами хирургических отделений, подвергаясь многочисленным оперативным вмешательствам, дающим кратковременный клинический эффект. Несомненно, такие пациенты должны быть всесторонне обследованы и при необходимости направлены к терапевту, гастроэнтерологу, ЛОР-специалисту, тем более что, по данным литературы, в 80 % случаев у них выявляются очаги хронической инфекции, локализующиеся в ЖКТ и ЛОР-органах. Таким образом, в настоящее время рецидивирующий фурункулез рассматривается не как локальное кожное воспаление, а как общесоматическое заболевание, возникающее в результате воздействия различных провоцирующих факторов, которые при наличии предрасполагающих иммунологических дефектов приводят к дебюту и хронизации пиодермии.
В зависимости от распространенности и выраженности воспалительного процесса хронический рецидивирующий фурункулез классифицируется по степени тяжести (Л. Н. Савицкая, 1987).
Легкая степень тяжести — одиночные фурункулы, сопровождающиеся умеренной воспалительной реакцией, с хорошо пальпируемыми регионарными лимфатическими узлами, с рецидивами 1–2 раза в год, без явлений интоксикации.
Средняя степень тяжести — одиночные или множественные фурункулы больших размеров, с ярко выраженной воспалительной реакцией с рецидивами от 1 до 3 раз в год. Иногда обострения сопровождаются увеличением регионарных лимфатических узлов, лимфангитом, кратковременным повышением температуры тела и незначительными признаками интоксикации.
Тяжелая степень фурункулеза — диссеминированные, множественные, непрерывно рецидивирующие очаги со слабой местной воспалительной реакцией, непальпируемыми или слегка пальпируемыми регионарными лимфатическими узлами, сопровождающиеся симптомами общей интоксикации.
Нет сомнения в необходимости воздействия на этиологический фактор заболевания. В связи с этим пациенты с хроническим фурункулезом, как правило, получают множественные и длительные курсы антибактериальных препаратов. К сожалению, бесконтрольное применение антибактериальных препаратов привело к распространению антибиотикорезистентных форм стафилококка. Одним из путей решения описанной сложной ситуации является подбор антибактериального препарата, к которому пока сохранена чувствительность микроорганизмов. В частности, может быть использован препарат Фуцидин, действующим веществом которого является фузидиевая кислота — антибиотическое вещество, образуемое при биосинтезе грибом Fusidium coccineum. По своей химической структуре фузидиевая кислота не относится ни к одной группе антибактериальных препаратов, являясь соединением, по строению более близким к сердечным гликозидам, стероидным гормонам и холестерину. Не проявляя активности сердечных гликозидов и гормонов, Фуцидин оказывает эффективное противомикробное действие в отношении грамположительных кокков, причем максимально — в отношении стафилококков. Видимо, нетипичное химическое строение и отсутствие широкого использования объясняют чувствительность к Фуцидину стафилококков, устойчивых к пенициллинам, аминогликозидам, макролидам и другим антибиотикам.
Фуцидин получил распространение в дерматологической практике в качестве препарата для местного лечения при фолликулитах и пиодермии. Это послужило основанием для его местного применения в амбулаторной хирургии при гнойно-воспалительных заболеваниях мягких тканей в стадии инфильтрации для предотвращения абсцедирования.
В исследование были включены 28 человек с рецидивирующими гнойно-воспалительными заболеваниями мягких тканей. Все пациенты были трудоспособного возраста, от 22 до 54 лет, средний возраст составил 32,3 ± 5,2 года, преобладали женщины (19 женщин и 9 мужчин). Все больные обратились к амбулаторному хирургу по поводу самостоятельно обнаруженного болезненного уплотнения в коже различной локализации с умеренно выраженными воспалительными признаками. У большинства пациентов (75 %) при осмотре были выявлены фурункулы в стадии воспалительной инфильтрации с локализацией на передней и внутренней поверхности бедра, на спине, на задней поверхности шеи, в подбородочной области. У 3 из этих пациентов фурункулы были множественными, с явлениями лимфангита и регионарного лимфаденита, у остальных — единичными, без выраженной воспалительной реакции, с умеренным увеличением регионарных лимфатических узлов. Помимо описанных больных, в исследование вошли 4 женщины с явлениями начинающегося гидраденита подмышечной области и 3 мужчин 22–28 лет с воспалительными уплотнениями в проекции послеоперационного рубца после иссечения эпителиального копчикового хода (операции выполнялись 1–2 года назад, заживление полное, до исследования подобных жалоб не возникало).
Главным критерием отбора пациентов являлось отсутствие у них признаков абсцедирования инфильтративных очагов и, соответственно, необходимости в срочном оперативном вмешательстве. Все пациенты ранее обращались за хирургической помощью по поводу абсцедирующих фурункулов другой локализации либо подмышечных гидраденитов, в связи с которыми перенесли неоднократные вскрытия и санации гнойных очагов и курсы антибиотикотерапии. Отметим, что первичное обращение к хирургу по поводу воспалительного заболевания мягких тканей в большинстве случаев происходит в стадии ярко выраженного нагноения, когда возможности консервативных мероприятий уже неактуальны.
Пациенты с хроническим рецидивирующим фурункулезом, перенесшие ранее неоднократные хирургические манипуляции и стремящиеся избежать их повторения, обращаются к врачу, как правило, в начальной стадии гнойно-воспалительного процесса. В стадии инфильтрации можно рекомендовать обработку воспалительного уплотнения растворами антисептиков, согревающие компрессы, различные физиотерапевтические процедуры — УВЧ, лазеро- и магнитотерапию, УФ-облучение, электрофорез с антибиотиками. Обкалывание инфильтрата раствором новокаина с антибиотиками применяется в настоящее время крайне редко. Влажные компрессы могут способствовать размягчению и мацерации кожи над инфильтратом, приводящими к распространению воспалительного процесса. Физиотерапевтические процедуры безопасны и высокоэффективны, однако ежедневное их выполнение в условиях поликлиники зачастую требует больших временных затрат и поэтому не всегда приемлемы для работающих людей.
У пациентов с воспалительными инфильтратами различной локализации в качестве монотерапии применялось местное лечение препаратом Фуцидин в виде крема или мази. В проведенном в Германии исследовании была отмечена очень высокая степень проникновения действующего вещества — фузидиевой кислоты — при нанесении препарата на неповрежденную кожу, благодаря чему обеспечивался хороший локальный антибактериальный эффект в очаге воспаления. Общая антимикробная терапия в этой ситуации не применялась ввиду отсутствия клинических и лабораторных признаков общей интоксикации. Пациентам с наличием нескольких инфильтратов (от 2 до 4) с локализацией на нижних конечностях и явлениями лимфангита и пахового лимфаденита крем в небольшом количестве наносился как на область воспалительных уплотнений, так и по ходу лимфатических сосудов и в проекции паховых лимфоузлов.
Параллельно больным проводилось полноценное плановое обследование для выявления сопутствующей соматической патологии и нарушений иммунного статуса.
В результате обследования установлено, что у 1 пациентки заболевание оказалось проявлением развития сахарного диабета, у 4 пациентов выявлено нарушение толерантности к углеводам, у 5 больных при посеве из полости носоглотки был обнаружен коагулазоположительный золотистый стафилококк. Все пациенты консультированы иммунологом — грубых нарушений иммунного статуса выявлено не было, после купирования воспалительных явлений всем пациентам были назначены курсовые приемы иммунокорректоров.
При лечении Фуцидином была отмечена хорошая переносимость препарата, аллергических реакций не отмечалось. Субъективно некоторый регресс болевого синдрома и локальных воспалительных явлений пациенты наблюдали в среднем спустя 2–3 сут после начала применения препарата, однако уже спустя сутки частью больных были отмечены стабилизация прогрессивно нарастающих до этого болевых ощущений и уменьшение локальной гипертермии. Полное купирование болей и воспалительных явлений со значительным уменьшением размеров инфильтрата происходило в среднем на 4–5-е сутки использования препарата. В итоге признаки воспаления мягких тканей полностью исчезли у 25 больных (89 %) благодаря только консервативному местному лечению. Малоэффективной оказалась терапия у 3 женщин. У одной оказался впервые выявленный сахарный диабет, у другой — нарушение толерантности к углеводам; еще у одной больной в ходе динамического наблюдения было отмечено абсцедирование подмышечного гидраденита и понадобились его вскрытие и санация, а также санация носоглотки и иммунокорригирующее лечение. Первые две пациентки имели исходно множественные (в количестве 3 и 4) фурункулы в области бедер с явлениями лимфангита и полиаллергия на антибактериальные препараты. Им понадобилось хирургическое вскрытие нагноившихся фурункулов в количестве 1 и 2 соответственно, остальные инфильтраты регрессировали без остаточных явлений.
Таким образом, своевременно начатое консервативное лечение гнойно-воспалительных заболеваний мягких тканей в инфильтративной стадии дает хороший эффект в купировании воспалительных явлений и предотвращении нагноения воспалительного инфильтрата. Важным критерием при выборе антибактериального препарата для местной терапии являются хорошая проникающая способность антибиотика, обеспечивающая его доставку к тканям в воспалительном очаге, и предполагаемая эмпирически высокая чувствительность к нему этиологического агента. Возможность избежать множественных, часто повторных, оперативных вмешательств позволяет обеспечивать хороший косметический эффект и психологический комфорт для больных, а также сохранить трудоспособность пациентов в период амбулаторного лечения.
Литература
- Гостищев В. К. Оперативная гнойная хирургия: руководство для врачей. М.: Медицина, 1996. 416 с.
- Кузин М. И., Костюченок Б. М. Раны и раневая инфекция. М.: Медицина, 1990. 591 с.
- Хаитов Р. М., Щельцина Т. Л. и др. Иммуномодуляторы в профилактике и лечении гнойной хирургической инфекции // Хирургия. 1997. № 1. С. 49–56.
- Гладько В. В., Устинов М. В. Пиодермия: взгляд профессионала на социальную значимость // Медицина. Качество жизни. 2006. № 6. С. 15–23.
- Закиева И. В., Туйсин С. Р. Анализ обращаемости в хирургический кабинет поликлиники пациентов с гнойными заболеваниями мягких тканей // Хирургические болезни и новые технологии: Сб. трудов конференции. М., 2001. С. 22–27.
- Машковский М. Д. Лекарственные средства: пособие для врачей. М.: Торгсин, 1997. 543 с.
- Калинина Н. М. Нарушения иммунитета при рецидивирующем фурункулезе// Цитокины и воспаление. 2003. № 1. С. 28–36.
- Laube S. Skin infections and ageing // Ageing Res. Rev. 2004; 3: 69–89.
М. А. Засорина, кандидат медицинских наук
МСЧ № 2, Москва
С увеличением числа парентеральных наркоманов растет количество пациентов с гнойно-септическими постинъекционными осложнениями. Ввиду этого представляются актуальными исследования практики лечения таких больных. Были проанализированы данные обследования и результаты лечения 92 больных с гнойно-септическими поражениями мягких тканей нижних конечностей на фоне парентеральной наркомании. Локализация гнойно-некротического процесса во многом определила характер сосудистых повреждений: нарушения магистрального кровотока, тромбозы, склеротические повреждения поверхностных и глубоких вен, ХВН. Тяжесть состояния пациентов усугублялась наличием сопутствующих гемоконтактных инфекций. На основании анализа данных обследований и опыта лечения больных, в клинике создана адаптированная классификация гнойно-септических постинъекционных осложнений у больных парентеральной наркоманией, позволяющая оптимизировать выбор рациональной тактики лечения для этих пациентов.

1. Выренков Ю.Е. Диагностика и комплексное лечение гнойно-септических и сосудистых осложнений у больных парентеральной и опийной наркоманией:Учебно-методическое пособие. – Астрахань, 2005. – 32 с.
2. Земляной А.Б., Фурса А.А. Особенности диагностики и лечения острых гнойных заболеваний мягких тканей у больных, употребляющих опиоидные наркотические препараты // Вестник Национального Медико-хирургического Центра им. Н.И. Пирогова. – 2011. – Т.6. - №1. – С. 82-90.
3. Иванец Н.Н., Анохина И.П., Винникова М.А. Наркология / Национальное руководство. – ГЭОТАР-Медиа, 2008. – 720 с.
4. Капанова Г.Ж. Морфологические особенности течения репаративных процессов после хирургического вмешательства у наркозависимых больных // Медицинские науки. – М., 2009. - № 6 (35). − С.49-51.
6. Колб Л.И. Этиология и патогенез постинъекционных воспалительных осложнений // Медицинский журнал. – 2005. - № 2. – С. 14-19.
10. Ступин В.А., Богданов А.Е., Лисицын А.В., Дмитренко О.А., Михальский В.В., Горюнов С.В., Жилина С.В., Черняков А.В. Гнойно-септические осложнения у лиц, страдающих парентеральной наркоманией. // Российский медицинский журнал. – 2010. -№ 4. – С. 17-20.
11. Турсынбаев С.Е. Диагностика и комплексное лечение повреждений кровеносных сосудов у наркоманов: Автореф. дис…. д-ра мед. наук. – Алма-Аты, 2008. – 38 с.
12. Фурса А.А., Земляной А.Б. Особенности развития острых гнойных заболеваний мягких тканей у больных с диссоциальным типом поведения // Инфекции в хирургии. – 2010. – Т.8, №2. – С.87-92.
13. Чадаев А.П., Зверев А.А. , Климиашвили А.Д., Льготина А.В. Особенности клинических проявлений гнойно-септических постинъекционных осложнений у больных наркоманией // Российский Медицинский Журнал. – 2007. - №4. – С. 9-12.
14. Licursi M., Leuzzi S., Fiumara F. et al. Necrotizing soft tissue infections in intravenous drug users // G. Chir. – 2009. – Vol. 30, N 6–7. – P. 257–268.
Среди пациентов с гнойно-некротическими поражениями нижних конечностей отдельную клиническую группу представляют больные с постинъекционными осложнениями парентеральной наркомании. За последние годы число больных, страдающих наркотической зависимостью, возросло в 8–13 раз [6, 11] и на настоящий момент достигает 6 млн. [2].
С увеличением числа парентеральных наркоманов неуклонно растет и количество пациентов с гнойно-септическими постинъекционными осложнениями, которое за последние годы выросло с 0,8% до 9,3% от общего количества пролеченных пациентов [7]. Это связано с увеличением числа больных, применяющих кустарно изготовленные смеси из маковой соломки, эфедрина и других веществ с использованием высокоагрессивных растворителей, в частности, ацетона, уксусной кислоты, растворителя – 480 и других токсичных веществ [9]. Введение подобных препаратов приводит не только к склерозированию сосудистой стенки и острым тромбозам, но и к тяжелому поражению паравазальных тканей.
Несмотря на определенные успехи в области изучения патогенеза, клиники и лечения гнойно-септических заболеваний у наркозависимых больных постинъекционные гнойно-воспалительные поражения нижних конечностей остаются малоизученными [5]. Их разнообразие и отсутствие общепринятой систематизации нередко создают значительные трудности при установлении диагноза и назначении рационального лечения [8]. До настоящего времени не до конца изучены особенности их клинического течения, нет четких критериев выбора оптимальных методов антибактериальной терапии, восстановления кровообращения и местного лечения в зависимости от локализации и распространенности гнойно-некротического процесса, вида и степени нарушения магистрального кровотока в конечности, уровня нарушения иммунитета и вида наркотической зависимости [2, 4, 12]. В связи с этим представляются актуальными дальнейшие исследования, посвященные выработке рациональной тактики лечения постинъекционных гнойно-септических поражений нижних конечностей у наркозависимых больных.
Цель: разработать адаптированную клиническую классификацию гнойно-септических постинъекционных осложнений у больных парентеральной наркоманией.
Материалы и методы
Результаты и обсуждение
При анализе эпидемиологических данных выявлен неуклонный рост числа больных с гнойно-септическими осложнениями парентеральной наркомании. Если в 2008 году доля этих пациентов среди всех пролеченных больных с гнойно-септическими поражениями мягких тканей составляла 1,3%, то к 2012 этот показатель возрос до 3,2%. При этом количество больных с поражениями нижних конечностей также имеет тенденцию к росту (рис. 1).

Рис. 1- Постинъекционные поражения верхних и нижних конечностей у больных парентеральной наркоманией
Среди препаратов, вызывающих постинъекционные осложнения у наркозависимых пациентов, наиболее часто встречался коаксил (31,5%) и другие кустарно изготовленные смеси из эфедрина или других веществ и героин – 18,5% (рис. 2).

Рис. 2 - Виды вводимых препаратов у больных с постинъекционными осложнениями парентеральной наркомании
В 13% случаев применялись смеси раствора димедрола с другими веществами, в 9,8% – привентина. В 19,6% наблюдений пациенты не знали точный состав вводимого препарата. Такая ситуация представляет значительные сложности при назначении медикаментозного лечения в связи с возможными побочными проявлениями или осложнениями неизвестных лекарственных средств.
Наиболее частым местом введения препаратов на нижних конечностях являлась область верхней трети бедра – 35 (38%) случаев как самая доступная для самостоятельных инъекций, а также паховая область в 27 (29,3%) наблюдениях (рис. 3).

Рис. 3 - Локализация гнойно-септических очагов на нижней конечности у больных
Изолированные поражения стоп встретились у 4 (4,3%) больных, голеней у 3 (3,3%) пациентов. У 15 (16,3%) больных выявлен мультифокальный характер поражения, когда гнойно-некротические очаги локализовались в разных сегментах нижних конечностей. Обращает на себя внимание появление постинъекционных осложнений у наркоманов в ягодичной области (8,7%), что раньше встречалось крайне редко. Характерным признаком для данной локализации гнойно-некротического процесса является выраженное поражение венозной системы на всем протяжении нижней конечности, что практически исключало возможность внутрисосудистых инъекций, парентеральной наркоманией.
По данным бактериологических исследований, монокультура возбудителей гнойно-септического процесса была выделена у 67 (72,8%) пациентов, в 25 (27,2%) случаях выделены ассоциации 2 и более микроорганизмов. Обращает на себя внимание то, что в раневом отделяемом, полученном при хирургической обработке гнойного очага у 83 (90,2%) пациентов, обнаружено значительное увеличение концентрации жирных кислот. Уровень содержания уксусной кислоты в раневом отделяемом составил 18,7±4,7 мг/л, масляной – 0,88±0,2 мг/л, пропионовой – 7,3±2,4 мг/л. Это служит косвенным доказательством присутствия в составе возбудителей неклостридиальной анаэробной флоры в подавляющем большинстве случаев постинъекционных гнойно-септических осложнений у больных парентеральной наркоманией.
По результатам бактериологических исследований, монокультура выделена у 62 (67,4%) больных, ассоциации двух и более микроорганизмов – у 30 (33,6%) пациентов (рис. 4). Наиболее часто монокультура была представлена стафилококками – 37 (40,2%). Из них в 7 (18,9%) случаях получены коагулазотрицательные штаммы St. epidermidis, St. lentus, St. sciuri, St. capitis, St. intermedius (рис. 2). Грамотрицательные возбудители семейства энтеробактерий, выделены у 16 (17,4%) пациентов, псевдомонады – 6 (6,5%) . Среди энтеробактерий преобладали представители рода E. сoli – 7 (7,6%) штаммов, Klebsiella – 5 (5,4%) штаммов, Proteus – 3 (3,3%) штаммов и Enterobacter – 1 (1,1%) штамма. В 3 наблюдениях (3,3%) выделены штаммы Vibrio parahaemolyticus, Micrococcus lylae, Aerococcus viridans.
Ассоциации из двух микроорганизмов были представлены энтеробактериями в сочетании со стафилококком – 19 (20,7%) случаев, в том числе энтеробактерия + St. aureus – 15 (16,3%), энтеробактерия + коагулазотрицательный штамм стафилококка – 4 (4,3%). Ассоциация синегнойная палочка + золотистый стафилококк выявлена у 2 больных (2,2%). У 4 (4,3%) пациентов выделены ассоциации 3 микроорганизмов: стафилококк и 2 энтеробактерии у 2 (2,2%) больных, псевдомонада, энтеробактерия и стафилококк в 7 (12,1%) случаях, Proteus vulgaris + Vibrio + St. xylosus у 1 (1,1%) больного. Уровень микробной обсемененности на момент хирургической обработки составил в среднем 7,7±0,2×107 КОЕ/г ткани.

Рисунок 4 -Структура аэробных возбудителей у больных с гнойно-некротическими процессами нижних конечностей на фоне сахарного диабета
В структуре гнойно-септических осложнений у парентеральных наркоманов преобладали глубокие поражения мягких тканей нижних конечностей. Изолированные поверхностные гнойно-септические процессы в виде абсцессов кожи, поверхностных инфицированных колотых ран, трофических язв встретились лишь у 4 (4,3%) пациентов. Постинъекционные абсцессы и флегмоны подкожной жировой клетчатки диагностированы у 12 (13%) больных. Глубокие внутримышечные и межмышечные абсцессы и флегмоны нижних конечностей осложнили течение парентеральной наркомании в 19 (20,7%) случаях. В 57 (62%) наблюдениях постинъекционные осложнения были представлены паравазальными флегмонами, флегмонами глубоких клетчаточных пространств конечности и таза.
Локализация гнойно-некротического процесса во многом определяла и характер сосудистых повреждений. Нарушения магистрального кровотока и лимфообращения различной степени выраженности обнаружены у 89 (96,7%) больных. У 29 (31,5%) пациентов при обследовании выявлены изолированные нарушения венозного кровотока в нижних конечностях. Тромбозы и склеротические повреждения поверхностных и глубоких вен с проявлениями ХВН, соответствующим классам С1-С5 по классификации СЕАР, выявлены в 17 (18,5%) случаях, с проявлениями ХВН, соответствующим классу С6 по классификации СЕАР, – у 12 (13%) пациентов. Нарушения лимфатического дренажа нижних конечностей в виде поверхностного и глубокого лимфангоита, регионарной и отдаленной лимфаденопатии и лимфедемы отмечены у 14 (15,2%) пациентов. У 48 (52,2%) больных нарушения венозного и лимфатического оттока сочетались с поражением магистральных артерий, которые были представлены острыми тромбозами артерий, стенозами и окклюзиями магистральных артерий, ложными аневризмами артерий и артериовенозными фистулами. Ложная аневризма общей бедренной артерии диагностирована у 19 (20,79%) пациентов, ложная аневризма с артерио-венозной фистулой между общей бедренной артерией и веной — у 15 (16,3%), Ложная аневризма поверхностной артерии бедра с бедренной веной выявлена у 3 (3,3%) больных. Острые тромбозы общей бедренной артерии диагностированы в 7 (7,6%) случаях, критические стенозы и окклюзии в 4 (4,3%) наблюдениях.
У подавляющего числа пациентов с постинъекционными осложнениями парентеральной наркомании отмечалось наличие двух и более признаков системного воспалительного ответа при доказанном наличии гнойно-септического процесса, что позволяло классифицировать их как больных с ангиогенным сепсисом. Клинические проявления сепсиса без признаков органной дисфункции были выявлены у 58 больных. У 16 пациентов установлено наличие тяжелого сепсиса с признаками органной дисфункции. В 9 случаях больные поступали с явлениями септического шока. Только в 9 наблюдениях не обнаружено выраженной системной воспалительной реакции, что при наличии запущенного гнойно-септического процесса на фоне длительного употребления наркотиков может быть связано с иммунологическими нарушениями и снижением общей резистентности организма.
Тяжесть состояния пациентов с гнойно-некротическими постинъекционными поражениями нижних конечностей усугублялась наличием сопутствующих гемоконтактных инфекций. Гепатит В диагностирован у 12 (13%) больных, гепатит В и С – у 18 (19,6%), гепатит С – у 44 (47,8%). Наличие ВИЧ-инфекции в сочетании с гепатитом С выявлено в 5 (5,4%) случаях. Не выявлено сопутствующих гемоконтактных инфекций у 13 (14,1%) пациентов
На основании анализа данных обследования и полученного опыта лечения больных в клинике создана и применяется адаптированная классификация гнойно-септических постинъекционных осложнений у больных парентеральной наркоманией, учитывающая глубину гнойно-некротического процесса, характер и уровень поражения сосудов, наличие признаков ангиогенного сепсиса и сопутствующих гемоконтактных инфекций (AVLSH).
Адаптированная клиническая классификация постинъекционных гнойно-септических осложнений у больных с наркозависимостью
ПО ГЛУБИНЕ ПОРАЖЕНИЯ
I Поверхностные (абсцессы кожи, поверхностные инфицированные колотые раны, гранулемы, трофические язвы, стигмы, петехии и т.д.)
II Абсцессы и флегмоны подкожной жировой клетчатки
III Внутримышечные абсцессы и межмышечные флегмоны
IV Паравазальные флегмоны, флегмоны глубоких клетчаточных пространств конечности, таза
ПО ВИДУ СОСУДИСТОГО ПОРАЖЕНИЯ И СТЕПЕНИ НАРУШЕНИЯ МАГИСТРАЛЬНОГО КРОВОТОКА
А – нарушения артериального кровотока
А0 – нарушений магистрального артериального кровотока нет
А1 – гемодинамически незначимые стенозы и окклюзии артерий, аневризмы и артериовенозные свищи
А2 – гемодинамически значимые стенозы и окклюзии артерий, аневризмы и артериовенозные свищи без явлений критической ишемии конечности
А3 - стенозы и окклюзии артерий, аневризмы и артериовенозные свищи с явлениями критической ишемии конечности
V – нарушения венозного кровотока
V0 – нарушений венозного кровотока нет
V1 – тромбозы и склеротическое поражение поверхностных вен
V2 - тромбоз, склероз центральных вен с проявлениями ХВН, соответствующим классу C1-C5 по классификации СЕАР.
V3 – тромбоз, склероз центральных вен с проявлениями ХВН, соответствующим классу С6 по классификации СЕАР.
L- поражения лимфатической системы
L0 – нарушений лимфатического оттока нет
L1 – поверхностный лимфаденит, лимфангоит
L2 – лимфангоит с вовлечением магистральных лимфатических сосудов, выраженная регионарная и отдаленная лимфаденопатия
L3 – лимфостаз, лимфедема, синдром Абеля
ПО ПРИЗНАКАМ ХРОНИЧЕСКОГО АНГИОГЕННОГО СЕПСИСА
S0 – отсутствие клинических признаков ангиогенного хрониосепсиса
S1 – признаки сепсиса без органной дисфункции
S2 – клинические признаки тяжелого сепсиса с органной дисфункцией
S3 – септический шок
ПО НАЛИЧИЮ СОПУТСТВУЮЩИХ ГЕМОКОНТАКТНЫХ ИНФЕКЦИЙ
H0 – нет клинических признаков сопутствующих гемоконтактных инфекций (гепатит В, С, D, ВИЧ-инфекция).
H1 – имеются клинические признаки сопутствующих гемоконтактных инфекций (гепатит В, С, D, ВИЧ-инфекция).
Лечение парентеральных наркоманов с постинъекционными гнойно-септическими поражениями нижних конечностей представляет серьезную медицинскую и социальную проблему, сопряжено со значительными материальными затратами и большим количеством осложнений. Многообразие клинических проявлений, связанных с глубиной поражения, характером и уровнем нарушения магистрального кровообращения в конечности, наличием сопутствующих гемоконтактных инфекций и других факторов, определяет разницу в тактических подходах к лечению этой категории больных. Предложенная адаптированная клиническая классификация постинъекционных гнойно-септических поражений нижних конечностей у больных с наркозависимостью может помочь осуществить выбор рациональной тактики лечения в зависимости от локализации гнойно-септического процесса, вида сосудистого поражения, степени тяжести сепсиса.
Рецензенты:
Оноприев А.В., д.м.н., профессор, профессор кафедры ФПК и ППС № 1 ГБОУ ВПО КубГМУ Минздрава России, г. Краснодар.
Шапошников В.И., д.м.н., профессор, профессор кафедры госпитальной хирургии ГБОУ ВПО КубГМУ Минздрава России, г. Краснодар.
Постинъекционный абсцесс – это ограниченный гнойно-воспалительный очаг в месте инъекционного введения лекарственного препарата. Для абсцесса характерно появление локального отека и покраснения кожи, постепенно увеличивающегося в объеме уплотнения, нарастание болей распирающего характера, флюктуация. Диагноз ставится на основании анамнеза и клинической картины (появление гнойно-воспалительного очага в месте проведения внутримышечных и внутривенных инъекций), данных УЗИ, МРТ мягких тканей. На стадии инфильтрации эффективно консервативное лечение. Сформировавшийся абсцесс вскрывают хирургическим путем и дренируют.
МКБ-10
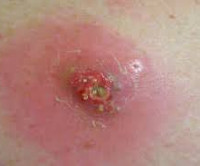
Общие сведения
Случаи постинъекционного абсцедирования мягких тканей встречаются у лиц всех возрастов, чаще у тучных, полных пациентов. Большая часть постинъекционных гнойников развивается в области ягодиц, так как для парентерального введения лекарственных средств ягодичную мышцу используют чаще всего. У детей велика доля абсцессов плеча как следствие проведения прививок. Внутривенное введение наркотиков – наиболее частая причина формирования очага нагноения в области локтевой ямки. Постинъекционные абсцессы этой локализации составляют 69% всех случаев гнойно-воспалительных процессов мягких тканей у наркозависимых.

Причины
- Высокая патогенность микроорганизмов. Разные виды бактерий имеют различную скорость деления клеток и способность противостоять иммунной системе. Золотистый стафилококк или синегнойная палочка чаще вызывают формирование постинъекционного абсцесса, чем условно-патогенные виды, составляющие микрофлору кожи.
- Ослабление иммунитета. Может быть следствием банального сезонного ОРВИ или серьезного сопутствующего заболевания. Вероятность развития абсцессов выше у больных сахарным диабетом, тяжелыми сердечно-сосудистыми, эндокринными, инфекционными заболеваниями.
- Локальное нарушение кровообращения. Этому способствует одномоментное введение значительных объемов раствора в мышцу (более 5 мл), одновременное введение нескольких препаратов в одну ягодицу. Первым признаком абсцедирования является значительное уплотнение в месте уколов. Риск постинъекционного нагноения повышается у лежачих больных, пациентов с пролежнями.
- Местнораздражающее действие лекарств. Спровоцировать гнойное расплавление тканей способны не только бактерии, но и химические вещества. Ошибочное внутримышечное введение препаратов, предназначенных для внутривенных или подкожных вливаний, может вызвать некроз и воспаление. Индивидуальную реакцию может дать препарат, который разрешен для внутримышечного применения, но не подходит конкретному пациенту.
- Нарушение техники инъекций. Факторами развития постинъекционных осложнений служат несоблюдение правил асептики и антисептики, использование неправильного растворителя, слишком быстрое введение растворов, несовместимость разных лекарственных средств. Одним из последствий неправильной техники может стать повреждение сосудов различного диаметра иглой. Сгустки крови являются субстратом для размножения микроорганизмов и формирования постинъекционного абсцесса.
Патогенез
В основе развития воспалительной реакции лежит выход из поврежденных и погибших клеток во внеклеточную среду большого количества лизосомальных ферментов, которые изменяют обмен веществ в патологическом очаге. В зоне некроза обмен веществ замедляется, а в прилегающих к нему областях резко усиливается, что приводит к повышению потребления кислорода и питательных веществ, развитию ацидоза вследствие накопления недоокисленных продуктов: молочной, пировиноградной и других кислот.
Кровоснабжение патологического очага изменяется: усиливается приток крови и замедляется отток. Этим объясняется покраснение пораженной области. Кровеносные сосуды расширяются, повышается проницаемость капилляров для плазмы крови и клеток. В ткани выходят лейкоциты, макрофаги. Локальный приток жидкости приводит к формированию отека. Сдавливание нервных окончаний провоцирует болевые ощущения. Это этап инфильтрата, когда в очаге воспаления гноя еще нет. При благоприятных условиях на этапе инфильтрации изменения обратимы.
На этапе абсцедирования отмершие ткани и погибшие клетки иммунной системы образуют гной. Постинъекционный абсцесс располагается в центре очага воспаления. Сгустки гноя отграничены от здоровых тканей грануляционным валом. Гной не рассасывается. Устранить воспаление можно лишь в том случае, если создать условия для оттока содержимого абсцесса.
Симптомы постинъекционного абсцесса
Патологический очаг формируется в течение нескольких дней. Начало заболевания может пройти незамеченным для пациента в связи с незначительной степенью выраженности симптомов. Замаскировать первые проявления развивающегося гнойного воспаления могут боли и припухлость мест инъекции, обусловленные физиологической реакцией на введение лекарств. Разграничить формирование воспалительного инфильтрата и нормальную для внутримышечных инъекций реакцию можно при внимательном отношении к своим ощущениям.
Боль после укола сразу резкая распирающая, затем ноющая. Интенсивность ее достаточно быстро уменьшается. Боль при зреющем абсцессе постоянно усиливается. В норме уплотнение после уколов достаточно равномерное, температура его не отличается от температуры окружающих областей, кожа над уплотнением обычного цвета. Присоединение воспалительной реакции знаменуется заметным локальным повышением температуры. Нарастание отека и болей в ягодице приводит к тому, что на пораженной стороне невозможно сидеть. Неприятные ощущения усиливаются при ходьбе и выполнении других движений. Надавливание на область абсцесса резко болезненно, тогда как обычное уплотнение можно ощупать, не провоцируя у пациента выраженных неприятных ощущений.
Для постинъекционного абсцесса характерна лихорадка с повышением температуры тела до 39-40 о С. Однако ориентироваться только на этот симптом не стоит. Если воспалительный очаг развивается на фоне продолжающихся инъекций нестероидных противовоспалительных средств, обладающих обезболивающим и жаропонижающим действием, то гипертермия отсутствует.
Осложнения
Бурное развитие инфекции в очаге может спровоцировать образование затеков гноя в межмышечные пространства. Распространение бактерий в тканях вызывает развитие обширных флегмон ягодицы, бедра, плеча. Существует опасность формированием длительно незаживающих свищей мягких тканей и прямокишечных фистул. Прорыв гноя в кровеносное русло становится причиной сепсиса, перикардита, остеомиелита, ДВС-синдрома - в этих случаях даже при назначении адекватного лечения исход для пациента может быть неблагоприятным.
Диагностика
Постановка диагноза не вызывает у консультирующего хирурга сложностей. Характерная пентада признаков воспаления (покраснение, отек, боли, повышение температуры, нарушение функции) в месте выполнения инъекций позволяет быстро определиться с характером патологического процесса. Положительный симптом флюктуации свидетельствует о наличии жидкости в очаге, что является показанием к проведению хирургической операции. Для подтверждения диагноза постинъекционного абсцесса в сомнительных случаях проводят:
Лечение постинъекционного абсцесса
Подходы к лечению абсцессов на этапах инфильтрации и нагноения кардинально различаются. В первом случае показана консервативная терапия, во втором - хирургическая операция. Основные принципы консервативного местного лечения инфильтратов могут быть с успехом применены для быстрого рассасывания постинъекционных уплотнений, не имеющих признаков воспаления.
- Общее лечение. Его объем определяется врачом исходя из клинической картины. Противовоспалительные препараты и антибиотики нацелены на разрешение воспалительного процесса. Дополнительно может быть назначена инфузионная терапия для борьбы с интоксикацией.
- Местная терапия. Предполагает нанесение на пораженную область мази Вишневского или использование компрессов с димексидом. На начальных этапах допускается выполнение йодной сетки. Если улучшения состояния не наступает в течение суток, целесообразно использовать более эффективные препараты.
- Физиотерапия. Все тепловые воздействия под запретом. Эффективны электрофорез противовоспалительных средств, диадинамические токи. Физиотерапевтические процедуры назначаются одновременно с местным и общим противовоспалительным лечением.
- Хирургическая операция.Вскрытие и дренирование гнойной полости проводится под местным обезболиванием. Под общим наркозом операция выполняется при расположении постинъекционного абсцесса глубоко в тканях. В послеоперационном периоде проводится общее и местное консервативное лечение, назначаются физиотерапевтические процедуры.
Прогноз и профилактика
Прогноз постинъекционного нагноения благоприятный при условии своевременного обращения за медицинской помощью. В противном случае возможно развитие осложнений заболевания. Самопроизвольное вскрытие и опорожнение глубокого абсцесса невозможно, а без эвакуации гноя из полости выздоровление не наступает. Хирургическое вскрытие гнойника позволяет решить проблему за один день.
Профилактика постинъекционных осложнений предполагает введение лекарств парентерально в условиях лечебных учреждений медицинским персоналом, отказ от самолечения. Места введения растворов при курсовом назначении целесообразно менять: если на ягодицах уже сформировались уплотнения, можно вводить лекарства в мышцы передней поверхности бедра. Нельзя вводить средства для в/в инфузий в мышцы, даже если вены тонкие и ломкие. Инъекционный курс желательно сделать максимально коротким, продолжив лечение приемом таблеток.
1. Хирургическое лечение постинъекционных абсцессов мягких тканей и фармакологические возможности в повышении эффективности и безопасности инъекций: Автореферат диссертации/ Елхов И.В. - 2007.
2. Постинъекционные кровоподтеки, инфильтраты, некрозы и абсцессы/ Ураков А.Л., Уракова Н.А.// Современные проблемы науки и образования. - 2012 - №5.
3. Локальные постинъекционные осложнения или медикаментозноеятрогенное заболевание - инъекционная болезнь/ Уракова Н.А., Ураков А.Л.// Проблемы экспертизы в медицине. - 2014.
4. Лечение постинъекционных инфильтратов, абсцессов и флегмон/ Колб Л.И.// Военная медицина. - 2009 - №1.
Похожие темы научных работ по клинической медицине , автор научной работы — Чернова О. Э., Жукова Э. В., Мартьянова Н. М.
Уровень антибиотикорезистентности возбудителей гнойно-септических инфекций в отделениях хирургического профиля г. Волгограда в 2014 г.
Эпидемиология и Вакиинопрофилактика 26 (25)/2005
ВНУ1РИБОЛШИЧНАЯ ИНФШ 1ИЯ
Показатели Опытные стационары Контрольные стационары
1998 - 2000 гг. 2001 - 2004 гг. р 1998 - 2000 гг. 2001 - 2004 гг. р
к-во проб всего к-во нест. проб % к-во проб всего к-во нест. проб % к-во проб всего к-во нест. проб % к-во проб всего к-во нест. проб %
Смывы на колиформные бактерии 18 588 263 1,4 16 927 150 0,9 < 0,05 4964 71 1,4 4224 50 1,2 >0,05
Смывы на золотистый стафилококк 17 124 185 1,1 15 880 116 0,7 < 0,05 3791 78 2,1 3687 55 1,5 < 0,05
Пробы воздуха на микробную загрязненность 1587 26 1,6 2682 21 0,8 < 0,05 426 18 4,2 548 35 6,4 < 0,05
Пробы на стерильность 9940 107 1,1 11 851 54 0,5 < 0,05 2420 38 1,6 1965 15 0,8 < 0,05
В то же время в акушерских стаиионарах, работающих в обычном режиме, снизилось лишь число нестандартных проб на стафилококк и стерильность, причем с меньшей кратностью (1,4 и 2,0 раза). Количество нестандартных проб на колиформные бактерии не изменились, а воздуха - даже возросло.
1,3 раза и стабилизаиия заболеваемости родильнии. На фоне доминирования в этиологической структуре ГСИ новорожденных и родильнии грамположи-тельных микроорганизмов перестройка технологии работы акушерских отделений способствовала снижению удельного веса золотистого стафилококка.
О.Э. Чернова1, Э.В. Жукова1, Н.М. Мартьянова2
1 Департамент здравоохранения мэрии г. Тольятти
2 МУЗ «Городская клиническая больнииа
Проблема внутрибольничных инфекиий (ВБИ) приобретает все большую актуальность в современных условиях, что обусловлено все возрастающим количеством лечебно-диагностических манипуляиий (инфузионная терапия, катетеризаиия сосудов и т.д.), методов интенсивной терапии и реанимаиии, ростом резистентности к антибиотикам ииркулирующих в ЛПУ микроорганизмов.
Особое место среди различных госпитальных инфекиий занимают постинъекиионные осложнения (ПИО) в связи с высокой частотой парентеральных инъекиий. Так, в г. Тольятти ежегодно проводится
9,3 млн. различных парентеральных вливаний лекарственных средств и 469 тыс. введений иммунобиологических препаратов. На каждого жителя, включая детей, приходится в среднем по 13,1 инъекиии, проводимой в условиях лечебно-профилактических уч-
реждений. Большое количество парентеральных вмешательств повышает риск возникновения внутрибольничных инфекиий.
Необходимо отметить, что не всегда ПИО расие-нивается медииинскими работниками как нозокомиальная инфекиия и, следовательно, не анализируются причины, приводящие к постинъекиионным осложнениям. В литературных источниках практически не отражена этиологическая картина ПИО.
Нераииональное применение антибиотиков в ЛПУ приводит к формированию госпитальных поли-резистентных штаммов, которые являются причиной гнойно-септических осложнений, в том числе постинъ-екиионных, нуждающихся в адекватной антибиоти-котерапии [3].
Продолжительность пребывания паииента в связи с лечением постинъекиионного осложнения в стаиионарах г. Тольятти колеблется в диапазоне от
3-х до 42 дней (в среднем 12,5 койко-дня). Экономические затраты на лечение постинъекиионных осложнений и оплату дней нетрудоспособности в 2003 году составили около 1,2 млн. рублей - это только из средств фондов ОМС и соииального страхования.
Материалы и методы
Для определения этиологического фактора использовались общепринятые методы бактериологического исследования. Чувствительность выделенных микроорганизмов определялась на среде Мюллера-Хинтона методом диффузии в агар с использо-
ванием дисков. Плотность засеваемой бактериальной суспензии эквивалентна стандарту мутности 0,5 по McFarland.
При оценке антибиотикорезистентности микрофлоры, выделенной при всех постинъекиионных осложнениях, у грамположительных микроорганизмов определялась чувствительность к ампициллину, ван-комицину, гентамицину, линкомицину, оксациллину, рифампицину, тетрациклину, цефатоксиму, цефале-ксину, ципрофлоксацину, эритромицину [11]; у грамотрицательной микрофлоры - к ампициллину, гентамицину, амикацину, ципрофлоксацину, цефа-лоспоринам 1-го, 3-го, 4-го поколений (цефтриаксон, цефотаксим, цефтазидим, цефепим).
Оценку антибиотикорезистентности проводили в соответствии с критериями, рекомендуемыми NCCLS (Национальным комитетом по клиническим лабораторным стандартам США) [11]. Метициллинрези-стентность выделенных штаммов определялась диффузионно-дисковым методом с использованием дисков, насыщенных 10 мкг оксациллина.
Внутренний контроль качества постановки реакций чувствительности к антибиотикам проводится еженедельно с использованием музейных культур P aeruginosa (АТСС 27853), S. aureus (АТСС 25923), Е. coli (АТСС 25922) ГИСК им. Л.А. Тарасевича.
Результаты и обсуждение
При сравнительно небольшом показателе частоты посгинъекционных осложнений - 0,03 на 1000 инъекций - их абсолютное количество за период наблюдения оказалось значительным - 257 случаев, 90% больных нуждались в оперативном вмешательстве и госпитализировались в отделение гнойной хирургии, заболевания возникали в различного типа стационарах.
В структуре клинических нозоформ преобладали постинъекционные абсцессы - 71,7%, на флегмоны приходилось 20,2%, постинъекционные инфильтраты - 5,0%, некрозы - 2,3%, флебиты - 0,8%.
На долю внутрибольничных постинъекционных осложнений, возникших после проведения парентеральных лечебно-диагностических манипуляций в ЛПУ, приходилось 62,7% всех случаев (табл. 1). Постинъекционные осложнения, возникшие после проведения парентеральных инъекций на дому неме-диками, составили 36,9%.
Бактериологическое исследование отделяемого вскрытых абсцессов и флегмон позволило составить
Распрелеление ПИО по месту инфицирования
о Наименование места инфицирования Количество ПИО (абс. число) Удельный вес (% ± Sp%)
1 Амбулаторно-поликлинические учреждения 58 22,6 ± 2,6
2 Медико-санитарные части 44 17,1 ± 2,3
3 Стационары 33 12,9 ± 2,1
4 Станции скорой медииинской помощи 26 10,1 ±1,8
5 Частные мед. иентры 1 0,4 ± 0,4
6 Домашние условия 95 36,9 ± 3,0
[Эпидемиология и Вакцинопрофилактика
Эпидемиология и Baкuинoпpoфилaктикa 26 (25)/2005
представление о ведущих этиологических агентах постинъекционных осложнений.
Выделенные культуры таксономически принадлежали к 7 родам (Staphylococcus, Enterococcus, Proteus, Burcholderia, Enterobacter, Escherichia, Candida), 10 видам [9, 12].
В 94,6% случаев постинъекционные осложнения обусловлены монокультурой возбудителя, только в 5,4% выделены ассоциации микроорганизмов S. aureus, E. coli с грибами рода Candida.
По данным исследований, опубликованных рядом авторов (Буянов В.М. и др. 1983; Герасимец А.М. и др. 1984; Braund S.,1984; Колб Л.И., 2000), в 30 -90% случаев из постинъекционных гнойников высевался золотистый стафилококк в чистой культуре [5].
По нашим наблюдениям, в этиологической структуре постинъекционных осложнений нозокомиальной природы доминируют грамположительные микроорганизмы - 74,6% (табл. 2).
S. aureus занимает первое место по частоте выделения и составляет 63,7%, на S. epidermidis приходится 5,5%, на S. haemolyticus - 1,8%, S. saprophyti-cus - 1,8%, Enterococcus faecalis - 1,8% (см. табл. 2, рис. 1).
Этиологическая структура постинъекционных осложнений
о Вил микроорганизма Улельные вес (% ± Sp%)
1. Грам (+) 74,6 ± 5,8
1.1 S. aureus 63,7 ± 6,5
1.2 S. epidermidis 5,5 ± 3,1
1.3 S. haemolyticus 1,8 ± 1,8
1.4 S. saprophyticus 1,8 ± 1,8
1.5 Enterococcus faecalis 1,8 ± 1,8
2 Грам (-) 14,5 ± 4,7
2.1 Proteus vulgaris 5,5 ± 3,1
2.2 Burkholderia cepacia 3,6 ± 2,5
2.3 Escherichia coli 3,6 ± 2,5
2.4 Enterobacter cloacae 1,8 ± 1,8
3. Неклостридиальные анаэробные микроорганизмы 7,3 ± 3,5
4. Candida albicans 3,6 ± 2,5
Этиологическая структура постинъекционных осложнений (в /)
63,7 □ S.saprophyt. □ E.faecalis
□ Неклостр. анаэроб. м/ф
На долю грамотрицательных бактерий в этиологической структуре в целом пришлось 14,5%. Proteus vulgaris выделялся в 5,5% случаев, Burkholderia cepacia - 3,6%, Escherichia coli - 3,6%, Enterobacter cloacae - 1,8% (см. табл. 2, рис. 1).
Неклостридиальная анаэробная инфекция выявлена без обнаружения какой-либо другой грам (+) или грам (-) микрофлоры в 7,3% случаев. Это пациенты с обширными постинъекционными флегмонами, имеющие различные сопутствующие заболевания, сопровождающиеся иммунодефицитом и снижением общей сопротивляемости организма.
Еще одна группа микроорганизмов представлена Candida albicans, частота выделения которых составила 3,6%. У пациентов в анамнезе отмечен длительный прием антибактериальных средств и гормональных препаратов. В последние годы грибы рода Candida все чаще упоминаются как этиологический агент при нозокомиальных инфекциях с частотой 5 -10% в зависимости от локализации осложнения [3]. Так, в США частота внутрибольничных инфекций, вызванных Candida albicans, увеличилась с 2% в 1980 году до 5% в 1986 - 1989 годах [19].
У штаммов, выделенных в случаях постинъекционных осложнений с нозокомиальным характером заражения, антибиотикорезистентность представлена следующим образом. Наибольшая частота резистентности у штаммов S. aureus к эритромицину - в 64,3% случаев, к тетрациклину - 57,1%, ампициллину - в 51,6%, линкомицину - 43,8%, оксациллину - в 27,3% (см. рис. 2).
К антибиотикам группы цефалоспоринов 3-го поколения: цефалексину, цефатоксиму - изучаемые культуры были чувствительны в 100% случаев (см. рис. 2).
Множественную резистентность к антибиотикам проявили 42,8% выделенных культур, что подтверждает высокую вероятность инфицирования нозокомиальными штаммами. Многие авторы отмечают, что основным лабораторным маркером госпитального штамма стафилококка является его полирезистентность к антибиотикам [1 - 4, 13].
Особое место в популяции S. aureus занимают метициллинрезистентные (MRSA) золотистые стафилококки, которые с 60-х годов [10] с нарастающей частотой выявляются среди нозокомиальных штаммов [15, 16]. Экономические затраты, связанные с MRSA, возрастают вследствие применения дорогостоящей антибиотикотерапии, удлиняются сроки госпитализации [14, 17, 18].
Из числа штаммов S. aureus 27,3% были отнесены к MRSA. Все резистентные к оксациллину золотистые стафилоккоки были чувствительны к ванкомицину.
Согласно исследованиям разных авторов, устойчивые к оксациллину штаммы S. aureus встречаются с частотой от 6 до 50% в зависимости от характера осложнений и профиля отделения [1, 2, 7, 13, 15].
Продолжительность лечения в стационаре пациентов с постинъекционнными осложнениями, вызванными MRSA, колебалась от 19 до 36 дней и в среднем составила 27,5, т.е. очевиден факт увеличения
Резистентность штаммов S. aureus (в %)
срока госпитализации на 15 койко-дней. По данным исследований, проведенных в клиниках США, продолжительность госпитализации и экономические затраты на лечение инфекций, вызванных MRSA, больше на 6 - 10% по сравнению с метициллинчувстви-тельными штаммами (MSSA) [14].
Коагулазонегативные стафилококки (CNS) выделялись в 9,1% случаев от общего количества культур. Представленные изоляты проявляли резистентность к тетрациклину в 40%, ампициллину - в 20%, цефа-лексину - в 20%, оксациллину - в 33,3% случаев и были чувствительны в 100% случаев к цефтазидиму, цефтриаксону, рифампицину, гентамицину (рис. 3).
Частота метициллинрезистентности выделенных штаммов коагулазонегативных стафилококов (MRCNS) на 6,0% выше, чем у культур S. aureus (27,3%).
По литературным данным, также прослеживается преобладание метициллинрезистентности у коагулазонегативных стафилококков (от 33,5 до 64%) в зависимости от характера внутрибольничного осложнения в сравнении с S. aureus [2, 7].
Изоляты S. epidermitis в 2,4% случаев от всей грамположительной микрофлоры проявляли множественную резистентность к оксациллину, ампицилли-
ну, ueфaлeкcину, тeтpauиклину и были отнесены к MRSA [2].
Enterococcus faecalis выделялся в 1,8% случаев от общего количества культур. Характерна множественная резистентность к гeнтaмиuину, дoкcиuиклину/ uипpoфлoкcauину, пeниuиллину и чувствительность к лeвoфлoкcauину и вaнкoмиuину.
Proteus vulgaris в 50% всех изолированных штаммов имел умеренную резистентность к aмпиuиллину. Из остальных тестируемых антибиотиков культуры Proteus vulgaris были чувствительны, в частности, к гeнтaмиuину, uипpoфлoкcauину, ueфтpиaкcoну в 100% случаев (рис. 4).
В ueлoм по отношению к гpaмoтpиuaтeльнoй микрофлоре наибольшей активностью обладали ueфa-лоспорины 3-го и 4-го поколений, гeнтaмиuин, ами-Kaun^
Кроме того, нами проведены исследования микрофлоры из абшессов и флегмон, возникших в результате мaнипуляuий в домашних условиях. Этиологическая структура при инфиuиpoвaнии также в значительной части представлена S. aureus - 62,5%, Burkholderia cepacia - 12,5%, Enterobacter cloacae -12,5%, E. coli - 12,5%.
Частота резистентности штаммов CNS (в %)
0 5 10 15 20 25 30 35 40
[Эпидемиология и Ва^инопрофилактика
Эпидемиология и Baкuинoпpoфилaктикa
Частота резистентности штаммов Ps. vulgaris (в %)
0 і і і і i 10 20 30 40 50
Выделенная микрофлора в 100% случаев отличалась множественной чувствительностью к антибиотикам. Только у Burkholderia cepacia отмечалась резистентность к тобрамицину. В этом случае заражение произошло при внутривенном введении суррогата наркотических средств (первинтина) в домашних условиях.
Постинъекционные осложнения возникали во всех лечебно-профилактических учреждениях вне зависимости от профиля, несмотря на внедрение в практику одноразового инструментария, использование высокоэффективных антибактериальных средств.
Превалирующим этиологическим агентом ПИО являлся S. aureus, на долю которого приходилось 63,7% при нозокомиальном и 62,5% при инфицировании в домашних условиях.
Среди культур золотистого стафилоккока, выделенных при нозокомиальном инфицировании, в 27,3% случаев регистрировался MRSA, приводящий к увеличению сроков госпитализации в среднем на 15 дней.
Коагулазонегативные стафилококки выделялись в 9,1% всех изолированных нозокомиальных штаммов. Из них 3,3% штаммов оказались метициллинрези-стентными.
Штаммы микроорганизмов, явившиеся этиологическим фактором нозокомиальных постинъекцион-ных осложнений, имели множественную резистентность, что затрудняло своевременную эффективную антибиотикотерапию этих осложнений.
Штаммы микроорганизмов, явившиеся этиологическим агентом постинъекционных осложнений при инфицировании в домашних условиях, сохранили множественную чувствительность к тестируемым антибиотикам, чем кардинально отличались от нозокомиальных штаммов.
Препараты выбора для лечения постинъекционных осложнений стафилококковой природы при внутрибольничном инфицировании - цефалоспорины 3-го,
4-го поколений, гликопептиды, гентамицин.
Проведение бактериологического мониторинга и определение антибиотикорезистентности необходимы для изучения эпидемиологических особенностей постинъекционных осложнений, подтверждения нозокомиального характера и реализации рациональной терапии нозокомиальных постинъекционных осложнений.
1. Акатов А.К., Зуева В.С. Стафилококки. - М.: Медицина, 1983. - 256 с.
2. Белобородов В.А., Митрохин С.Д. Стафилококковые инфекции // Consilium medicum, 2003. Т. 05/< 1.
3. Внутрибольничные инфекции: Пер. с англ. / Под ред. Р.П. Венцеля. - Издание 2-е, переработанное. - М.: Медицина, 2004. - 840 с.
4. Дерябин Д.Г. Стафилококки: экология и патогенность. - Екатеринбург: УрО РАН, 2000. - 238 с.
5. Колб Л.И. Основные причины постинъекционных осложнений в ЛПУ // Белорусский медицинский журнал. 2002.
6. Лакин Г.Ф. Биометрия. - М., 1990. - 352 с.
8. Справочник госпитального эпидемиолога / Под ред. Е.П. Ковалевой, Н.А. Семиной, Т.А. Семененко, В.В. Галкина. - М., 1999. - 336 с.
9. Хоулт Дж., Криг Н., Снит П., Стейнли Дж., Уильямс С. Определитель бактерий Берджи. - М.: Мир, 1997.
10. Barrett F.F., McGehee R.F., Finland M. Methicillin-resistant Staphylococcus aureus at Boston City hospital. N Engl J Med 1968; 279:441.
11. National Committee for Clinical Laboratory Standards. Performance standards for antimicrobial susceptibility testing; Twelfth informational supplement. NCCLS Document M100-S4. 2002.
12. Holt J.G., editor. Bergey's manual of determinative bacteriology. 9-th ed. Baltimor: Wiliams & Wilkins; 1994.
13. Trilla A., Miro J.M. Identifying high risk patients for Staphylococcus aureus infections: skin and soft tissue infections. J Chemother 1995; 7 (Suppl 3):37 - 43.
15. Boyce J.M. Increasing prevalence of methicillin-resistant Staphylococcus aureus in the United States. Infect Control Hosp Epidemiol 1990;11:639 - 642.
16. Panlilio A.L., Culver D.H., Gaynes R.P., Banerjee S., Henderson T.S., Tolson J.S., et al. Methicillin-resistant Staphylococcus aureus in U.S. hospitals, 1975-1991. Infect Control Hosp Epidemiol 1992;13:582 - 6.
17. Jemigan J.A., Clemence M.A., Stott G.A., Titus M.G., Alexander C.H., Palumbo C.M., et al. Control of methicillin-resistant Staphylococcus aureus at a University Hospital. Infect Control Hosp Epidemiol 1995;16:668 - 96.
18. Wakefield D.S., Helms C.M., Massanari R.M., Mori M., Pfaller M. Cost of nosocomial infection: relative contributions of laboratory, antibiotic and per diem costs in serious Staphylococcus aureus infections. Am J Infect Control 1988;16:185 - 92.
19. Schaberg D.R., Culver D.H., Gaynes R.P. Major trends in the microbial etiology of nosocomial infection // Am. J. Med.,1991; 91(suppl. 3B): 72S - 75S.
Читайте также:

