Гнойно септические осложнения в послеоперационном периоде
Обновлено: 25.04.2024
Диагностика гнойных и септических осложнений ранений шеи, груди и живота
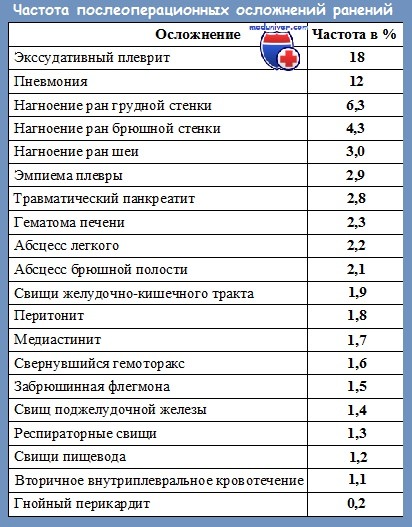
Послеоперационные осложнения при сочетанных ранениях шеи, груди и живота в наших наблюдениях имели место у 18,7 % пациентов, причем у одного пациента наблюдали от 1 до 5 различных осложнений.
Причиной острой дыхательной недостаточности, развивающейся в раннем послеоперационном периоде, чаще всего являются ателектазы ткани легкого, гипергидратация, острый респираторный дистресс-синдром и пневмония.
Острая сердечно-сосудистая недостаточность развивается вследствие некомпенсированной гиповолемии. Позже может наблюдаться развитие почечной, печеночной недостаточности, тромбоэмболических осложнений и полиорганной недостаточности.
Гнойно-септические осложнения ранений шеи, груди и живота
Гнойные осложнения, как известно, проходят неспецифическую стадию острой фазы воспаления, которая характеризуется усиленной продукцией гормонов, активизацией нейтрофилов и макрофагов. Течение процесса определяется балансом воспалительных и противовоспалительных медиаторов. Существование механизма сохранения такого баланса создает предпосылки для заживления ран, сохранения гомеостаза и уничтожения микроорганизмов в очаге воспаления.
Однако если на фоне декомпенсированной кровопотери и иммунодефицита превалируют медиаторы воспалительного каскада, их деструктивное действие начинает доминировать.
Нейтрофилы и макрофаги, активизированные в результате жизнедеятельности бактерий, выделяют чрезмерное количество биологически активных веществ, которые повреждают клетки путем пероксидации мембранных фосфолипидов, денатурации ферментов, нуклеиновых кислот базальных мембран и полисахаридных комплексов межуточной ткани. Основная роль в этом процессе принадлежит синтезу простагландинов и лейкотриенов из арахидоновой кислоты и оксида азота, в результате чего образуются свободные радикалы, легко соединяющиеся с любыми белковыми структурами.
Нарушается функция эндотелия капилляров с повышением проницаемости, формируется системная воспалительная реакция с дизрегуляцией метаболизма. Прогрессирование (генерализация) воспалительных реакций приводит к сепсису, проявлением которого служит резкое нарастание эндогенной интоксикации, гиперметаболизм, синдром диссеминированного внутрисосудистого свертывания и полиорганная недостаточность.
Клинические проявления гнойно-септических послеоперационных осложнений на фоне интенсивной инфузионной и антибактериальной терапии появляются поздно и в стертой форме. Действительно, появление на фоне нормальной температуры тела энцефалопатии, жажды, тахикардии, болевых ощущений в области шеи, груди и живота при глубоком дыхании свидетельствует о развернутой воспалительной реакции и хирургическое вмешательство по поводу этого гнойного осложнения может быть запоздалым. Поэтому главное внимание должно быть уделено следующим лабораторным показателям:
• появление сдвига лейкоцитарной формулы влево со снижением процентного содержания лимфоцитов;
• нарастание количества средних молекул;
• изменения иммунограммы;
• повышение содержания С-реактивного белка, интерлейкина и прокальцитонина.
Высокое содержание в крови С-реактивного белка, интерлейкина-6 и прокальцитонина с большой достоверностью свидетельствует о наличии у пострадавшего сепсиса: уровень прокальцитонина при этом может повышаться (в прямой зависимости от тяжести течения гнойного процесса) до 500 нг/мл (при норме — 0,5 нг/мл).
В то время как содержание в крови только прокальцитонина в первые несколько суток после сочетанных ранений груди и живота может повышаться, по данным М. Maier и соавт., до 9-11 нг/мл.
С появлением таких объективных методов, как УЗИ и КТ, диагностика послеоперационных осложнений стала возможной на самых ранних этапах.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Гнойная инфекция - наиболее распространенный вид осложнений в хирургической практике, включающий раневую, внутри- или забрюшинную инфекцию, инфекции мочевыводящих путей, легочных осложнений, гнойный тромбофлебит и другие. Ее частота варьирует в зависимости от характера операции и способа профилактики. За счет относительной герметичности брюшной полости и снижения травматичности вмешательства в эндоскопической хирургии инфицирование ран встречается относительно редко. Однако полностью избежать подобных осложнений невозможно. В зависимости от потенциальной вероятности инфицирования раны принята следующая классификация оперативных вмешательств:
1. Чистые (асептичные) - операции при отсутствии воспаления и без вмешательства на желудочно-кишечном тракте, дыхательных и мочевыводящих путях. Рану при этом не дренируют, накладывают первичные швы.
2. Условно-инфицированные - операции на дыхательном или желудочно-кишечном трактах без загрязнения раны их содержимым, вмешательства на влагалище, моче- и желчевыводящих путях, не сопровождающиеся воспалением, аппендэктомия с минимальными нарушениями правил асептики.
3. Инфицированные - вмешательства, при которых имеет место значительное нарушение правил асептики с массивным истечением кишечного содержимого в рану, и операции, сопровождающиеся травмой или вскрытием мочевого пузыря или желчных протоков с инфицированным содержимым.
4. Гнойные - вмешательства, которые сопряжены с острым воспалением (даже если нет гноя), перфорацией внутренних органов, травматические раны с некрозом тканей, присутствием инородных тел, кишечного содержимого, а также случаи, когда лечение воспалительного заболевания было начато поздно.
Патогенные микроорганизмы, вызывающие инфекцию, обычно проникают в рану интраоперационно. Возбудителями могут быть бактерии самого пациента и/или штаммы, находящиеся в окружающей среде.
Для профилактики гнойных осложнений рекомендуется:
1. Дооперационная санация местных очагов инфекции.
2. Сокращение периода пребывания пациента в стационаре перед операцией (профилактика госпитальной инфекции).
3. Подготовку операционного поля следует проводить с минимальной травматизацией наружного слоя эпителия (электрической бритвой или методом химической эпиляции).
4. Тщательно контролировать полноту гемостаза.
5. При катетеризации мочевого пузыря использовать закрытые дренажные системы. Продолжительность дренирования, в зависимости от ситуации, следует сократить до минимума.
6. Разумная и обоснованная антибиотикотерапия.
7. Профилактическая антибиотикотерапия. Профилактическая антибиотикотерапия рекомендуется при следующих эндохирургических (лапароскопических) вмешательствах:
- холецистэктомия при остром холецистите или эмпиеме желчного пузыря;
- холецистэктомия, сопровождающаяся вскрытием просвета желчного пузыря по ходу вмешательства;
- аппендэктомия при остром аппендиците;
- операции на толстой кишке;
- гнойно-воспалительные заболевания брюшной полости ("second-look" в лечении перитонита, ушивание перфоративной язвы, покрытие внутрибрюшных абсцессов и др.);
- гнойно-воспалительные заболевания придатков матки;
- цистэктомия, сопровождающаяся вскрытием дермоидной или любой инфицированной кисты придатков матки;
- при исходной анемии,
- при гипопротеинемии,
- при снижении иммунитета вследствие длительной болезни,
- при локальных травмах тканей с образованием гематомы, некроза.
Известно, что профилактическое использование антибиотиков сокращает в послеоперационном периоде:
- в 2 раза - количество больных с лихорадкой,
- в 3 раза - частоту гнойных осложнений.
Е.В. Коханевич, Т.А. Однокоз,
Киевская медицинская академия последипломного образования им. П.Л. Шупика, кафедра акушерства, гинекологии и репродуктологии
В настоящее время в гинекологической практике гнойно-септические осложнения, развивающиеся в послеоперационный период, составляют от 1 до 6,9% (по данным А. Celoratio, В.П. Сметник, Л.П. Тумилович указать год издания). При этом частота осложнений и их степень более выражены при операциях большого объема, таких, как простая и расширенная экстирпация матки с маточными трубами или с придатками матки.
В связи с этим больным, у которых предполагается выполнение операции такого объема в плане предоперационного обследования проводится бактериоскопическое, бактериологическое, цитологическое исследование влагалищных мазков, а при положительной койлоцитарной реакции — ПЦР-диагностика.
В комплексной предоперационной подготовке при наличии эндоцервикозов и дисплазий эпителия шейки матки нами применялись по показаниям Лаферон, Бета-дин, Полижинакс, Тержинан.
В данной работе проанализированы результаты лечения 120 (100%) больных с симптомными фибромиомами матки, лейомиомами, сочетанными с аденомиозом, опухолями и опухолевидными образованиями придатков матки. Из них у 60 женщин (1-я группа — 50%) в предоперационный период использовали Тержинан, у других 60 женщин (2-я группа — 50%) — комплекс перечисленных выше препаратов: Лаферон, Бетадин, Полижинакс. При предоперационном обследовании у этих больных установлено наличие инфекции в области шейки матки и до операции у 60 (50%) из них проводилось лечение Тержинаном.
Контрольную группу 60 (100%) человек составили больные с разрывами кист и апоплексией яичников, перекрутом ножки кисты, подслизистой лейомиомой с геморрагическим синдромом, нуждающиеся в неотложном хирургическом вмешательстве.
В контрольной группе после ургентных хирургических вмешательств гнойно-септические осложнения развились у 4 (6,7%) больных.
Таким образом, применение препарата Тержинан в плане предоперационной подготовки позволяет снизить частоту гнойно-септических осложнений при гинекологических операциях и уменьшить фармакологическую нагрузку на организм женщины.
Введение: основными этиологическими факторами гнойно-септических осложнений (ГСО) являются эндогенное инфицирование — микробная контаминация операционной раны при вскрытии просвета кишки, а также микробная транслокация эндогенной микрофлоры. С учетом высокого риска развития ГСО в группе больных пожилого и старческого возраста с осложненными формами колоректального рака (КРР) актуальным вопросом на этапе предоперационной подготовки остается антибиотикопрофилактика.
Цель исследования: оценка результатов пролонгированного использования цефалоспоринов III поколения в составе расширенной предоперационной подготовки у больных пожилого возраста с субкомпенсированной кишечной непроходимостью на фоне КРР.
Ключевые слова: новообразование, антибиотикопрофилактика, колоректальный рак, кишечная непроходимость, послеоперационный период, гнойно-септические осложнения.
Для цитирования: Максимова К.И., Засорин А.А. Результаты профилактики гнойно-септических осложнений при оперативном лечении больных пожилого возраста с субкомпенсированной кишечной непроходимостью опухолевой этиологии. РМЖ. Медицинское обозрение. 2020;4(3):143-147. DOI: 10.32364/2587-6821-2020-4-3-143-147.
K.I. Maksimova 1,2 , A.A. Zasorin 1,2
1 Ural State Medical University, Yekaterinburg, Russian Federation
2 Clinical Hospital “Russian Railways-Medicine” of the city of Ekaterinburg, Yekaterinburg, Russian Federation
Background: pyogenic septic complications predominantly occur as a result of endogenous infection, i.e., microbial contamination of surgical wound when opening the intestine or bacterial translocation of endogenous microflora. Considering high risk of pyogenic septic complications in elderly and senile patients with complicated colorectal cancer (CRC), preoperative antibiotic prophylaxis remains an important issue.
Aim: to assess the outcomes of long-term use of third-generation cephalosporins as a part of advanced preoperative care in elderly patients with bowel obstruction resulting from CRC.
Patients and Methods: retrospective case-control study has included 110 medical records of patients with acute large bowel obstruction resulting from CRC who have undergone surgery in 2015–2019. A total of 110 patients were divided into a study group (n=60) and
a control group (n=50). Mean age was 74 years (no significant differences between the groups). Standard pr eoperative care (no more than 24 hours) with ceftriaxone administration 40 min before the surgery was provided in the control group. Advanced preoperative care with peroral cefixime 200 mg twice daily throughout the preoperative period was provided in the study group.
Keywords: tumor, antibiotic prophylaxis, colorectal cancer, bowel obstruction, postoperative period, pyogenic septic complications.
For citation: Maksimova K.I., Zasorin A.A. Prevention of pyogenic septic complications after the surgery for malignant bowel obstruction in elderly patients. Russian Medical Inquiry. 2020;4(3):143–147. DOI: 10.32364/2587-6821-2020-4-3-143-147.
Введение
Актуальность проблемы послеоперационных гнойных осложнений обусловлена сохраняющейся высокой частотой их развития — 24–38% в структуре нозокомиальных инфекций (700 тыс. пациентов ежегодно) [1]. При этом эффективность качественно выполненной хирургической операции может значительно уменьшиться вследствие развития гнойно-септических осложнений (ГСО) на послеоперационном этапе. Основными этиологическими факторами развития ГСО являются эндогенное инфицирование — микробная контаминация операционной раны при вскрытии просвета кишки, а также микробная транслокация эндогенной микрофлоры [1]. При этом полностью избежать контаминации раны не представляется возможным даже при идеальном соблюдении правил асептики и антисептики. К моменту завершения оперативного вмешательства в 80–90% случаев рана обсеменена различной микрофлорой. Основными возбудителями ГСО являются грамотрицательные бактерии (52,1%), среди которых на первом месте остается Escherichia coli [1, 2].
На этапе предоперационной подготовки следует оценивать возможные факторы риска развития ГСО. В группе больных пожилого и старческого возраста с осложненными формами колоректального рака (КРР) (основным осложнением является кишечная непроходимость) можно выделить следующие основные факторы риска:
гипотрофия (развивается у большинства онкологических больных, обусловлена, кроме того, возрастными особенностями рассматриваемой группы пациентов);
нарушения белкового обмена;
наличие сопутствующей патологии (гипертоническая болезнь, сахарный диабет, облитерирующий атеросклероз);
наличие инфицированного выпота в брюшной полости;
высокая степень контаминации операционной раны при вскрытии просвета кишки;
обструктивные формы рака;
оперативное вмешательство на неподготовленной кишке.
С учетом высокого риска развития ГСО в группе больных пожилого и старческого возраста с осложненными формами КРР актуальным вопросом на этапе предоперационной подготовки остается антибиотикопрофилактика.
Вопросы объема и продолжительности антибиотикопрофилактики до сих пор остаются спорными, хотя еще в 1970-х гг. группой исследователей во главе с R. Condon, R. Nichols и S. Gorbach была доказана эффективность периоперативного использования антибиотиков в сравнении с плацебо в снижении частоты послеоперационной раневой инфекции [3]. В настоящее время при проведении антибиотикопрофилактики при операциях на толстой кишке руководствуются положениями, изложенными в рекомендациях Американского общества колоректальных хирургов (American Society of Colon and Rectal Surgeons) за 2007 г. Основной принцип заключается в достижении эффективного терапевтического уровня концентрации антибактериального препарата в крови на момент начала оперативного вмешательства. Широко используемая схема антибиотикопрофилактики подразумевает введение антибактериального препарата за 30–60 мин до начала оперативного вмешательства с последующим его введением в послеоперационном периоде на протяжении 3–4 дней. Наиболее часто используемым препаратом является цефтриаксон — цефалоспорин III поколения, обладающий широким спектром действия, терапевтическая концентрация которого при внутривенном введении достигается через 30 мин.
Однако в условиях высокого риска развития ГСО у больных пожилого и старческого возраста с осложненными формами КРР однократного введения антибактериального препарата за 30–60 мин до начала оперативного лечения может быть недостаточно. В данном случае речь идет о предоперационной антибиотикотерапии, или селективной деконтаминации кишечника (СДК), которая направлена на устранение риска развития инфекции за счет контаминации тканей во время оперативного вмешательства, синергидного действия микроорганизмов или транслокации бактериальной флоры. Первое применение СДК у больных с политравмой было описано H.K.F. van Saene и С.Р. Stoutenbeek в 1983 г., этот метод и в настоящее время широко применяется [3].
Представленные в ряде исследований результаты дали основание для расширения применения СДК в качестве профилактики и терапии у больных хирургического профиля, показав значимое снижение уровня нозокомиальных инфекционных осложнений (с 81% до 16% в исследуемой группе) [4–6]. Условно-патогенная микрофлора желудочно-кишечного тракта (ЖКТ) является дополнительным источником эндогенной контаминации и инфицирования у больных с различными формами тяжелого абдоминального сепсиса, что, по результатам исследований, явилось еще одним обоснованием для включения СДК в терапию [4–6]. Это положение подтверждено многочисленными экспериментальными и клиническими исследованиями при первичном, вторичном и третичном перитоните различной этиологии, механической кишечной непроходимости, деструктивном панкреатите, холангите и механической желтухе, циррозе печени с печеночной недостаточностью [4–6]. Доказано, что при данных нозологических формах синдром кишечной недостаточности приводит к развитию нарушения барьерной функции ЖКТ с транслокацией условно-патогенных микроорганизмов за пределы кишечной трубки. При этом эндогенная микрофлора ЖКТ и ее токсины поступают не только в брюшную полость и забрюшинное пространство, но и в портальный и системный кровоток. Основными группами препаратов, используемых при СДК, являются аминогликозиды, фторхинолоны, цефалоспорины.
Цель исследования: оценить эффективность пролонгированного применения цефалоспоринов III поколения в комплексе предоперационной подготовки у больных пожилого и старческого возраста с осложненными формами КРР в целях профилактики развития ГСО в послеоперационном периоде.
Материал и методы
В зависимости от локализации злокачественного новообразования (ЗНО) объем оперативного вмешательства включал правостороннюю гемиколэктомию, резекцию поперечной ободочной кишки, левостороннюю гемиколэктомию, резекцию сигмовидной кишки, переднюю резекцию прямой кишки или брюшно-промежностную экстирпацию прямой кишки.
Критерии включения: больные старше 65 лет с субкомпенсированной толстокишечной непроходимостью, с подтвержденным ЗНО толстой кишки в анамнезе. Сформированы группа исследования и группа контроля. Критерии включения в группу контроля — стандартная предоперационная подготовка (купирование электролитных расстройств, гиповолемии, сифонные клизмы до 3 раз) в сочетании с введением цефтриаксона за 40 мин до начала оперативного лечения, продолжающаяся не более 24 ч. Критерии включения в группу исследования — расширенная предоперационная подготовка (дополнительно к описанной стандартной предоперационной подготовке проводилась коррекция белковых расстройств, расстройств микроциркуляции, многократные очистительные клизмы до достижения декомпрессии выше- и нижележащих отделов толстой кишки, в т. ч. с использованием фиброколоноскопии) в сочетании с пероральным применением цефиксима 200 мг 2 р./сут на протяжении всего предоперационного периода. Длительность предоперационной подготовки составила более 24 ч при эффективности консервативных мероприятий, что могло быть определено как подготовка к отсроченному оперативному вмешательству.
В группу исследования вошли 60 пациентов (средний возраст — 74 года), в группу контроля — 50 пациентов (средний возраст — 75 лет). Соотношение мужчин и женщин в группе исследования составило 38% и 62% соответственно, в группе контроля — 46% и 54% соответственно. Частота встречаемости сопутствующей патологии сопоставима в группе исследования и в группе контроля и отражена в таблице 1.

Статистическая обработка данных проводилась с помощью программного обеспечения Gretl 2015d. Значением центральной тенденции данных являлось среднее арифметическое (M), мерой рассеяния — стандартное отклонение (σ), для оценки достоверности различий между значениями, выраженными в процентах, и суррогатными показателями использовали анализ χ 2 . Для оценки достоверности различий между группами использовали непарный Т-критерий Стьюдента. Достоверность изменений средних величин признавали при достижении уровня значимости р
Результаты и обсуждение
Из поступивших 110 больных все были оперированы: 101 пациенту (91,8%) были выполнены радикальные операции, 8 (7,2%) — паллиативные, эксплоративное вмешательство — 1 пациенту (0,9%). Оценка эффективности антибиотикопрофилактики проводилась согласно рекомендациям Национальной ассоциации специалистов по контролю инфекций, связанных с оказанием медицинской помощи [7]. Минимальная оценка качества выполнения периоперационной антимикробной профилактики (ПАП) КПАП в группе исследования и группе контроля составила 100% и была рассчитана по формуле:
КПАП = (число операций, при которых ПАП проведена / число операций, при которых ПАП показана) × 100%.
Однако индикаторы качества выполнения ПАП различались по группам. Частота инфекции в области хирургического вмешательства составила 1,6% в группе исследования и 10% в группе контроля. Показатель адекватного выбора антибиотиков (ПАБ) за указанный период времени составил 54,5% среди всех больных:
ПАБ = (количество пациентов, которые получали антибиотики, соответствующие протоколу / общее количество пациентов, получавших АБ-терапию) × 100%.
Развитие 1 случая нагноения послеоперационной раны в группе исследования было вызвано Klebsiella pneumoniae, не чувствительного, по результатам исследования, к группе цефалоспоринов; 5 случаев нагноения послеоперационной раны в группе исследования были вызваны Staphylococcus aureus и Enterococcus faecalis, чувствительными к группе цефалоспоринов. Более подробно спектр чувствительности каждого из возбудителей представлен в таблице 2.

Микрофлора кишечника содержит как аэробные, так и анаэробные микроорганизмы, которые, обладая синергидным эффектом, вызывают развитие послеоперационных инфекций [6]. Достижение перед операцией полной эрадикации анаэробов, обитающих в толстом кишечнике, представляется маловероятным, что связано с их большим количеством. Более того, удаление анаэробов нежелательно в связи с тем, что они обеспечивают колонизационную резистентность ЖКТ [6]. В то же время можно добиться полной или значительной эрадикации из толстого кишечника грамотрицательных аэробов, представленных в меньшем количестве. Оценивая полученные результаты, можно утверждать, что стандартная периоперационная антибиотикопрофилактика у больных пожилого и старческого возраста с явлениями кишечной непроходимости на фоне КРР не является достаточно эффективной. Развитие ГСО в послеоперационном периоде значительно ухудшает результаты проведенного хирургического лечения, а в некоторых случаях может привести к летальному исходу. Исходя из этого, пролонгированное использование цефиксима в качестве препарата СДК в составе расширенной предоперационной подготовки приводит к достоверному снижению частоты развития ГСО.
Заключение
Таким образом, представленная методика профилактики развития инфекций в области хирургического вмешательства с использованием цефтриаксона за 40 мин до оперативного лечения в сочетании с СДК — пероральным применением цефиксима 200 мг 2 р./сут на протяжении всего предоперационного периода у больных пожилого и старческого возраста с осложненными формами КРР достоверно снижает частоту развития ГСО в послеоперационном периоде в 6,2 раза. Данная схема предоперационной подготовки позволяет добиться эрадикации из просвета толстой кишки грамотрицательных аэробов, одновременно проводится профилактика инфекций в области хирургического вмешательства, достоверно снижающая риск ГСО.
Сведения об авторах:
About the authors:
Kristina I. Maksimova — assistant of the Department of Surgical Diseases and Cardiovascular Surgery, Ural State Medical University, 3, Repin str., Yekaterinburg, 620028, Russian Federation; surgeon of the Surgical Division
No. 1, Clinical Hospital “Russian Railways-Medicine” of the city of Ekaterinburg, 9, Grazhdanskaya str., Yekaterinburg, 620107, Russian Federation, ORCID iD 0000-0002-7071-6114.
Aleksandr A. Zasorin — Dr. of Sci. (Med.), Associate Professor of the Department of Surgical Diseases and Cardiovascular Surgery, Ural State Medical University, 3, Repin str., Yekaterinburg, 620028, Russian Federation; Head of the Surgical Division No. 1, Clinical Hospital “Russian Railways-Medicine” of the city of Ekaterinburg, 9, Grazhdanskaya str., Yekaterinburg, 620107, Russian Federation, ORCID iD 0000-0002-9561-6064.
Читайте также:

