Городского центра по лечению тяжелого сепсиса
Обновлено: 18.04.2024
В том же 2016 году в США было проведено исследование затратности медицинской помощи, оказываемой в интенсивном краткосрочном режиме. Среди состояний, требующих наиболее дорогостоящего неотложного ответа, сепсис оказался на первом месте (остеоартрит на втором, перинатальная патология на третьем, осложнения имплантации на четвертом, инфаркт миокарда на пятом).
В 2018 году было доказано, что внедрение новых протоколов интенсивной терапии сепсиса достоверно снижает летальность. Тем не менее, она остается высокой и оценивается на уровне 20-35%, а при септическом шоке (наиболее тяжелой, предельно выраженной форме сепсиса) варьирует в диапазоне 30-70%.
С 2015 года в Санкт-Петербурге активно работает мультидисциплинарное Общество специалистов по сепсису.
13 сентября отмечается Всемирный день борьбы с сепсисом.
Причины
Причиной сепсиса теоретически может быть любой микроорганизм, – будь то бактерия, вирус, грибок, простейшее, – способный вызывать у человека инфекционно-воспалительный процесс.
На практике чаще всего выявляются гноеродные стрептококки и стафилококки, менингококки, пневмококки, клебсиелла, кишечная палочка и др. Первичным очагом примерно в половине диагностированных случаев оказывается легочная инфекция, затем следуют кишечные и урогенитальные инфекции. Однако диагностировать определенный первичный очаг не удается, по меньшей мере, в каждом третьем случае.
Главными факторами риска выступают ослабленный иммунитет (в частности, именно поэтому высока частота постоперационных, послеродовых, посттравматических сепсисов, а также сепсисов у пожилых и новорожденных, больных ВИЧ/СПИД, онкопатологией, заболеваниями печени и почек).
В основе патогенеза лежат грубые нарушения тканевой микроциркуляции крови, запускающие каскад взаимопотенцирующих патологических процессов (орган за органом, система за системой начинают дисфункционировать и угрожают полным отказом), а также общая интоксикация продуктами жизнедеятельности возбудителя инфекции (экзо- и эндотоксинами). Тем и определяется клиническая картина сепсиса.
Симптоматика
В ряде случаев при выраженной почечной, печеночной, легочной, сердечной недостаточности на фоне сепсиса изменения в тканях становятся необратимыми и спасти больного не удается.
Диагностика
Лечение
Первоочередными направлениями интенсивной терапии при сепсисе и/или септическом шоке включают санацию первичного очага инфекции (в ряде случаев необходимо экстренное хирургическое вмешательство или ударные дозы мощных бактериостатиков); восстановление нормальной гемодинамики и, в частности, микроциркуляции, а также сердечной деятельности и дыхания; детоксикация; предотвращение тромбоза, геморрагий, дегидратации (обезвоживания); нормализация психического статуса, стабилизация общего состояния пациента.
Дальнейшие реабилитационные мероприятия разрабатываются в каждом случае индивидуально.
В том же 2016 году в США было проведено исследование затратности медицинской помощи, оказываемой в интенсивном краткосрочном режиме. Среди состояний, требующих наиболее дорогостоящего неотложного ответа, сепсис оказался на первом месте (остеоартрит на втором, перинатальная патология на третьем, осложнения имплантации на четвертом, инфаркт миокарда на пятом).
В 2018 году было доказано, что внедрение новых протоколов интенсивной терапии сепсиса достоверно снижает летальность. Тем не менее, она остается высокой и оценивается на уровне 20-35%, а при септическом шоке (наиболее тяжелой, предельно выраженной форме сепсиса) варьирует в диапазоне 30-70%.
С 2015 года в Санкт-Петербурге активно работает мультидисциплинарное Общество специалистов по сепсису.
13 сентября отмечается Всемирный день борьбы с сепсисом.
Причины
Причиной сепсиса теоретически может быть любой микроорганизм, – будь то бактерия, вирус, грибок, простейшее, – способный вызывать у человека инфекционно-воспалительный процесс.
На практике чаще всего выявляются гноеродные стрептококки и стафилококки, менингококки, пневмококки, клебсиелла, кишечная палочка и др. Первичным очагом примерно в половине диагностированных случаев оказывается легочная инфекция, затем следуют кишечные и урогенитальные инфекции. Однако диагностировать определенный первичный очаг не удается, по меньшей мере, в каждом третьем случае.
Главными факторами риска выступают ослабленный иммунитет (в частности, именно поэтому высока частота постоперационных, послеродовых, посттравматических сепсисов, а также сепсисов у пожилых и новорожденных, больных ВИЧ/СПИД, онкопатологией, заболеваниями печени и почек).
В основе патогенеза лежат грубые нарушения тканевой микроциркуляции крови, запускающие каскад взаимопотенцирующих патологических процессов (орган за органом, система за системой начинают дисфункционировать и угрожают полным отказом), а также общая интоксикация продуктами жизнедеятельности возбудителя инфекции (экзо- и эндотоксинами). Тем и определяется клиническая картина сепсиса.
Симптоматика
В ряде случаев при выраженной почечной, печеночной, легочной, сердечной недостаточности на фоне сепсиса изменения в тканях становятся необратимыми и спасти больного не удается.
Диагностика
Лечение
Первоочередными направлениями интенсивной терапии при сепсисе и/или септическом шоке включают санацию первичного очага инфекции (в ряде случаев необходимо экстренное хирургическое вмешательство или ударные дозы мощных бактериостатиков); восстановление нормальной гемодинамики и, в частности, микроциркуляции, а также сердечной деятельности и дыхания; детоксикация; предотвращение тромбоза, геморрагий, дегидратации (обезвоживания); нормализация психического статуса, стабилизация общего состояния пациента.
Дальнейшие реабилитационные мероприятия разрабатываются в каждом случае индивидуально.

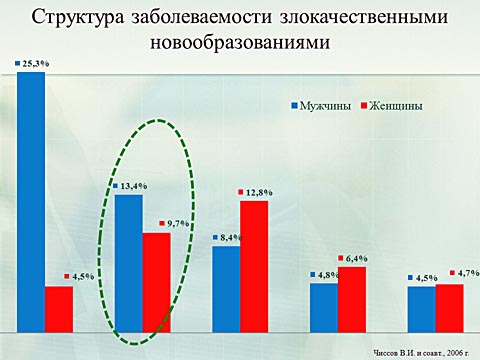

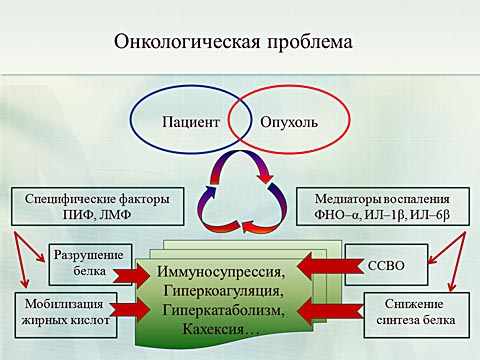
Техника и объем операций так же определяет общие проблемы послеоперационного периода. Все перечисленные на слайде осложнения приводят к развитию перитонита. Который в 70% сопровождается развитием сепсиса.

И так вернемся к нашему клиническому наблюдению. В феврале 2008 года пациенту 51 года — был диагностирован рак антрального отдела желудка, высокодифференцированная аденокарцинома. В апреле в плановом порядке выполнена операция субтотальная резекция желудка по РУ, холецистэктомия.
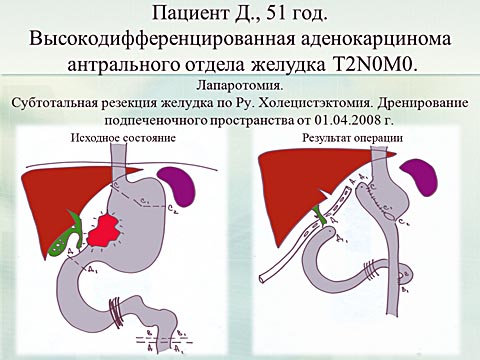
Течение вторых послеоперационных суток осложнилось развитием острого отечного панкреатита. Консервативная терапия — не эффективна. В связи с развитием перитонита выполняется экстренная релапаротомия. Интраоперационно: деструктивный панкреатит, из особенностей отмечено расширение приводящей петли тощей кишки до энтере-энтероанастомоза с явлениями венозного стаза. Выполнена адекватная санация, дренирование брюшной полости и декомпрессия кишечного тракта.
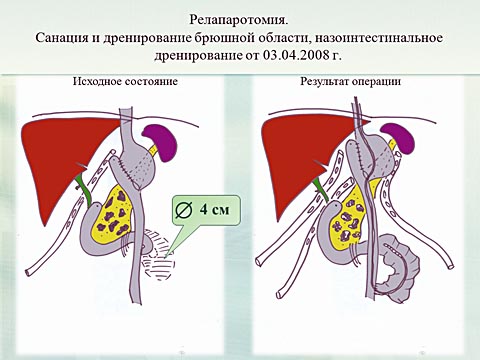
На третьи сутки клинические признаки перфорации полого органа. Выполнена экстренная релапаротомия. Интраоперационно выявлен некроз культи кишки и участка приводящей петли тощей кишки. Выполнена дуоденэктомия, резекция некротизированного участка тощей кишки, дренирование панкреатического и общего желчного протоков.
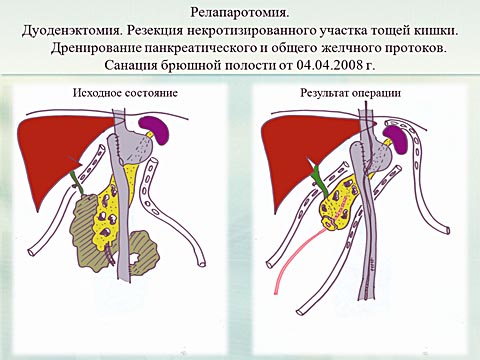
Септический шок развился интраоперационно. Начат комплекс интенсивной терапии. ИВЛ, инотропная поддержка. С целью экстракорпоральной детоксикации проведен 72 —х часовой сеанс вено-венозной гемофильтрации с высокими объемами замещения.

На этом фоне состояние стабилизировалось. Отмечено значительное снижение инотропной поддержки, улучшение показателей транспорта кислорода.
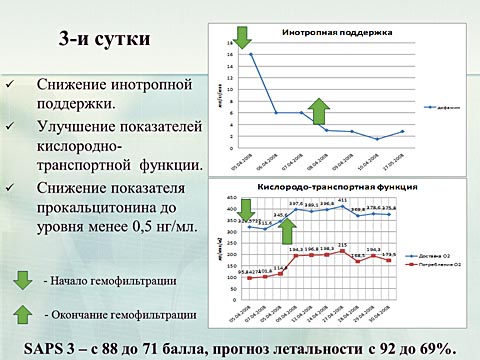
Течение заболевания осложнялось формированием вторичных гнойных очагов.

Выявление и санация которых проводилась по алгоритму комплексной терапии абдоминального сепсиса. Который подразумевает интенсивное наблюдение за пациентом. При нарастании эндогенной интоксикации — своевременная диагностика, хирургическая обработка. Нашей задачей является разорвать порочный круг. Прошу аудиторию обратить внимание. Сроки диагностики и эрадикации инфекционного агента — прямо пропорциональны срокам выздоровления.
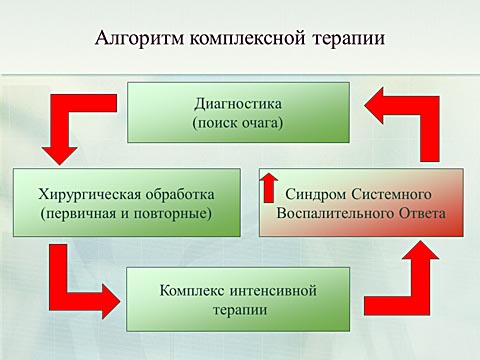
Проведение комплекса диагнотсики и хирургической обработки проходило на фоне течения тяжелого абдоминального сепсиса, требовавшего органо-заместительной терапии. В связи с прогрессированием почечной недостаточности проводились сеансы почечно-заместительной терапии, в очередной раз доказавшей своё стабилизирующее и органопротективное действие.
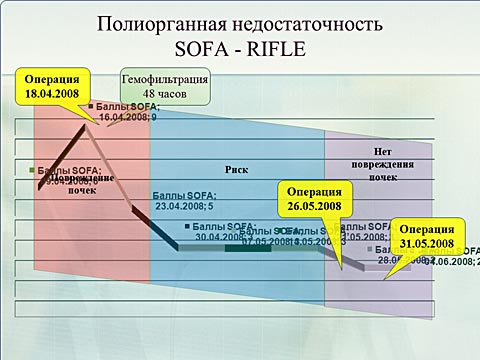
Тяжелое течение полисегментарной пневмонии с дыхательной недостаточностью требовало проведения длительной ИВЛ.
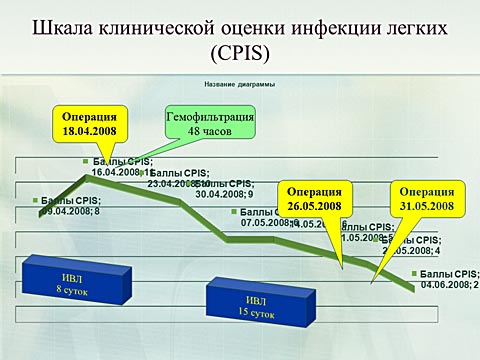
Большие потери из панкреатического и желчного свищей, синдром гиперкатаболизма. Полностью компенсировались изменением объемного и качественного состава парентерального питания и инфузионной терапии. На сутки пациент был переведен в хирургическое отделение. Через месяц на фоне стабилизации состояния, улучшения функции пищеварения пациент был выписан.
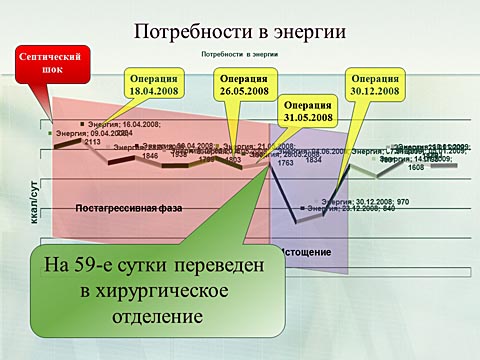
К сожалению по месту жительства пациент за медицинской помощью не обращался. Через пять месяцев с ухудшением состояния повторно госпитализирован в Пироговский центр. Состояние было тяжелое, обусловленное хронической интоксикацией, гипотрофией 2 степени.

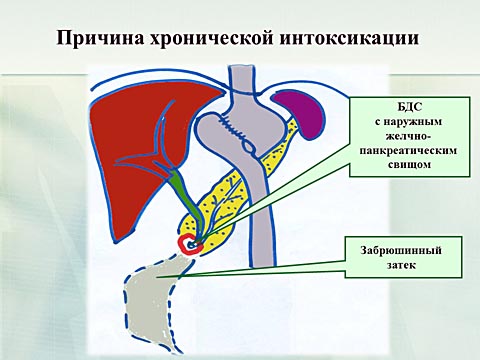
Причиной интоксикации явилась выявленная многокамерная полость располагающаяся по всему правому фланку. Возникла неоднозначная клиническая ситуация: с одной стороны наличие гнойного очага требовало срочной санации, с другой стороны операция на фоне выраженного истощения — заведомо привело к неблагоприятному исходу. Больной консультирован академиком Юрием Леонидовичем Шевченко. Принято решение компенсировать метаболические нарушения с последующим выполнением реконструктивной операции направленной на восстановление целостности желудочно-кишечного тракта.
Интенсивная предоперационная подготовка привела к переключению метаболических реакций в сторону повешения основного обмена. И на этом фоне .
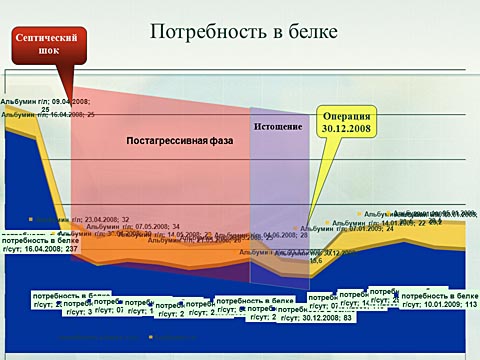
30.12.2008 года выполнена плановая реконструктивно-восстановительная операция. Выполнено вскрытие, санация, дренирование отграниченного забрюшинного затёка, наложение холедохопанркеатоеюностомии с тонкокишечным анастомозом по Брауну. Послеоперационный период протекал относительно гладко.
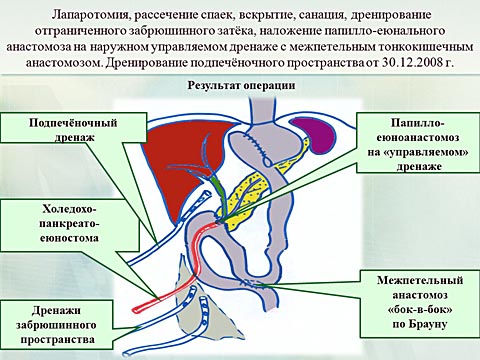
На 76 сутки пациент восстановил массу тела, был выписан. Месяц назад пациент прошел контрольный осмотр: прогрессирования онкологического процесса не выявлено, клинико-лабораторные показатели в пределах нормы. Приступил к работе. Таким образом данный клинический случай демонстрирует уникальные возможности лечебно-диагностической инфраструктуры Пироговского центра в проведении комплексного лечения онкологического пациента с тяжелым абдоминальным сепсисом.


-
— круглосуточно. — понедельник-пятница, с 08:00 до 21:00; суббота, с 09:00 до 18:00; воскресенье, с 09:00 до 18:00.
В летний период: понедельник-пятница, с 08:00 до 21:00; суббота, с 09:00 до 18:00; воскресенье, с 09:00 до 15:00.
В летний период: понедельник-пятница, с 08:00 до 21:00; суббота, с 09:00 до 18:00; воскресенье, с 09:00 до 15:00.
Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, Российская Федерация
Прогнозирование и дифференцированный подход в лечении больных с вторичным перитонитом и абдоминальным сепсисом
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2020;(5): 27‑33
Цель исследования. Выделить наиболее значимые для прогнозирования течения заболевания критерии групп риска, а также оптимальные параметры предоперационной подготовки и объема хирургического вмешательства. Материал и методы. Проведено проспективное исследование результатов лечения 43 пациентов с разлитым вторичным перитонитом (19 (44%) мужчин и 24 (56%) женщины), поступивших в отделение скорой медицинской помощи или в отделение хирургической реанимации. Средний возраст больных составил 60±20 лет. Тяжелый сепсис диагностирован у 23 (53%) пациентов, септический шок — у 5 (12%) пациентов. В динамике проводили расширенный мониторинг клинических и лабораторных данных в момент поступления в стационар и в последующие 3 сут после оперативного вмешательства. В послеоперационном периоде ежедневно оценивали тяжесть состояния больных по шкале SOFA, показатели синдрома системной воспалительной реакции, прокальцитониновый тест и уровень С-реактивного белка. Результаты. Достоверными прогностическими критериями оказались индекс коморбидности Чарлсона (p=0,001) и органная дисфункция, оцениваемая по шкале SOFA в течение первых 3 сут от момента поступления. Быстрый регресс органной дисфункции (SOFA1 — p=0,0001, SOFA2 — p=0,012, SOFA3 — p=0,017) и сокращение времени обследования и предоперационной подготовки (пороговое значение 520 мин от момента поступления) являются предикторами благоприятного исхода заболевания у больных с разлитым вторичным перитонитом. Заключение. Индекс коморбидности Чарлсона и органная дисфункция (SOFA), оцененная как при поступлении, так и в динамике, являются статистически значимыми предикторами исхода течения разлитого вторичного перитонита. Динамика регресса SOFA может использоваться как показатель адекватности лечения. Сокращение времени обследования и предоперационной подготовки статистически значимо снижает вероятность летального исхода у этой категории больных. Устранение инфекции — основополагающий принцип ведения пациентов с распространенным вторичным перитонитом. Применение тактики сокращенной лапаротомии у нестабильных пациентов может расцениваться как элемент реанимационных мероприятий.
Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, Российская Федерация
Введение
Цель исследования — выделить наиболее значимые для прогнозирования течения заболевания критерии групп риска, а также оптимальные параметры предоперационной подготовки и объема хирургического вмешательства.
Материал и методы
Среди 43 пациентов было 19 (44%) мужчин и 24 (56%) женщины. Средний возраст больных составил 60±20 лет. Тяжелый сепсис диагностирован у 23 (53%) пациентов, септический шок — у 5 (12%). Распределение больных по источнику перитонита представлено в табл. 1.

Таблица 1. Распределение пациентов по источнику вторичного перитонита
В 42 случаях оперативное пособие произведено в полном обьеме, и только у 1 больного в связи с тяжестью состояния операция выполнена в сокращенном объеме (резекция некротизированного участка тонкой кишки без восстановления непрерывности) с запланированной релапаротомией, до которой пациент не дожил. У 4 (9%) больных произведена релапаротомия в связи с прогрессированием интраабдоминальной инфекции, 3 из них умерли.
Во время всех оперативных вмешательств выполняли микробиологический анализ выпота из брюшной полости. Структура причинно-значимых возбудителей была типична и соответствовала результатам большинства исследователей (табл. 2).

Таблица 2. Результаты микробиологического исследования выпота из брюшной полости при вторичном перитоните, %
Статистически значимой корреляции между возбудителем и исходом лечения не получено (р=0,799).
Умерли 15 (35%) больных. Анализ структуры летальности показал, что только 3 (7%) пациента умерли вследствие прогрессирования интраабдоминальной инфекции в послеоперационном периоде, тогда как основными причинами летальных исходов в большинстве случаев явились тяжелый сепсис и септический шок — 6 (14%) больных и внутрибольничная полирезистентная пневмония — 6 (14%) пациентов.
Для объективной оценки тяжести состояния пациентов и определения прогностической значимости в динамике проводили расширенный мониторинг клинических и лабораторных данных в момент поступления в стационар и в последующие 3 сут после оперативного вмешательства. Кроме того, при поступлении осуществляли оценку тяжести состояния больных и перитонита по шкалам SOFA, APACHE 2, MODS, MPI, WSES. В послеоперационном периоде ежедневно оценивали тяжесть состояния больных по шкале SOFA, показатели синдрома системной воспалительной реакции, прокальцитониновый тест и уровень С-реактивного белка.
Так как пациенты, поступающие в клинику, различались по возрасту, сопутствующим заболеваниям, исходной антибактериальной терапии, в исследовании учитывали также индекс коморбидности Чарлсона, контакт с системой здравоохранения до заболевания, наличие онкологического заболевания в анамнезе, проводимую ранее химио- или лучевую терапию.
Как свидетельствуют данные литературы [13], немаловажную роль в исходе лечения тяжелого абдоминального сепсиса играют показатели, связанные с самим оперативным пособием. Поэтому также изучали такие данные, как время от поступления больного в стационар до операции, длительность самого оперативного вмешательства и общего обезболивания (особенно у пациентов пожилого возраста), объем операции и бактериологическое исследование раневого отделяемого.
При сравнении по группам в случае измеряемых и шкалируемых величин использовали t-критерий для показателей, выборочные значения которых согласовывались с нормальным распределением, и критерий Манна—Уитни для несогласованных с нормальным распределением выборок. Для зависимых выборок в случае согласованности с нормальным распределением использовали парный t-критерий, в случае отсутствия согласованности — критерий Уилкоксона. Для подсчитываемых значений использовали точный критерий Фишера. Во всех случаях пороговым значением р выбирали 0,05.
Алгоритмы решений строили с помощью оптимизации информационного выигрыша (information gain ratio).
Результаты
С помощью статистического анализа определены значимые различия среди исследуемых параметров у 43 пациентов и сформированы 2 выборки в зависимости от исхода лечения: выборка 0 — 15 (35%) пациентов с летальным исходом, выборка 1 — 28 (65%) выписавшихся. Статистически различными выборки оказались по 17 параметрам (всего оценивали 127 показателей), представленным в табл. 3.

Таблица 3. Значимые параметры различия между двумя выборками в зависимости от исхода лечения, среднее значение (стандартное отклонение)
Примечание. APACHE II (Acute Physiology And Chronic Health Evaluation) — шкала оценки тяжести состояния и прогноза заболевания; SOFA (Sequential Organ Failure Assessment) — шкала Американской ассоциации анестезиологов, служит для оценки органной недостаточности, риска смертности и сепсиса у пациентов в отделении интенсивной терапии и реанимации, используется для оценки степени операционно-анестезиологического риска; MODS — шкала полиорганной дисфункции Маршалла; MPI — Мангеймский перитонеальный индекс, позволяет определить риск летальности при перитоните; SIRS — синдром системного воспалительного ответа.
На основании проведенного анализа сформировали 2 алгоритма, позволяющие выделить группы риска неблагоприятного исхода пациентов с разлитым вторичным перитонитом. В первый алгоритм вошли немоделируемые показатели: органная дисфункция, оцениваемая при поступлении по шкале SOFA (р=0,004), и индексе коморбидности Чарлсона (р=0,001) (рис. 1).

Рис. 1. Алгоритм для оценки вероятности неблагоприятного исхода у больных разлитым вторичным перитонитом, осложненным абдоминальным сепсисом, при поступлении.
Следует отметить, что пациенты с высоким уже при поступлении значением органной дисфункции (оценка по SOFA 6 баллов и более) вне зависимости от каких-либо других факторов в нашем исследовании умерли. Исход лечения больных с менее выраженной органной дисфункцией в большинстве случаев зависел от индекса коморбидности (пороговое значение индекса Чарлсона 9 баллов). Валидизация этого алгоритма не противоречит принципам формальной логики и ранее проведенным исследованиям (WISS study 2015), в которых выявили прямую корреляцию между степенью выраженности органной дисфункции и исходом перитонита [14, 15].
Выработанный алгоритм обладает высокой специфичностью (хорошо распознает выживших) — 92,9% и низкой чувствительностью (плохо распознает умерших) — 66,7%. При этом получены средние предсказательные способности благоприятного (83,9%) и летального (83,3%) исходов.
Следует отметить, что использование первого алгоритма позволяет только предсказать исход лечения вторичного разлитого перитонита, но не дает возможности ввиду неконтролируемых показателей (органная дисфункция при поступлении и индекс Чарлсона) корректировать тактику лечения и, как следствие, влиять на течение и исход заболевания.
Второй алгоритм явился результатом всестороннего статистического анализа и сравнения исследуемых показателей, полученных не только при поступлении больных, но и в течение первых суток лечения. Были учтены характеристики предоперационной подготовки и параметры оперативного пособия (рис. 2).

Рис. 2. Алгоритм для оценки вероятности неблагоприятного исхода у больных разлитым вторичным перитонитом, осложненным абдоминальным сепсисом, с учетом результатов лечения в первые сутки госпитализации.
Как показал проведенный анализ, математическая последовательность, построенная на основе данных, полученных при поступлении, во время операции и в первые сутки нахождения в отделении реанимации и интенсивной терапии, обладает средней чувствительностью (81,8%) и специфичностью (85,7%), низкой предсказательной способностью летального исхода (69,2%), высокой предсказательной способностью выживания (92,3%).
Анализируя второй алгоритм, важно отметить появление такого моделируемого фактора, как время от момента поступления до операции, которое составило 520 мин. Это вычисленное пороговое значение, после которого прооперированные пациенты с распространенным вторичным перитонитом, изначально поступившие даже без органной дисфункции, умерли после операции. В 67% случаев такой длительный временной промежуток обосновывали в медицинских картах необходимостью предоперационной подготовки.
Мы разделили 520-минутный промежуток на равные отрезки по 130 мин и изучили результаты оперативных вмешательств. Кроме того, проанализировали характер медицинской помощи, оказанной каждому пациенту с сепсисом, тяжелым сепсисом и септическим шоком до операции (предоперационная подготовка). Оценивали объем инфузии, начало ее проведения от момента поступления, наличие или отсутствие антибактериальной терапии, ее характер, время и длительность проведения. Никакой статистически значимой зависимости между результатом лечения и перечисленными показателями не выявлено (р>0,05) (табл. 4). Вероятность летального исхода находилась в прямой зависимости только от сроков начала оперативного вмешательства.

Таблица 4. Зависимость исхода от предоперационной подготовки
Таким образом, именно раннее оперативное вмешательство, направленное на контроль источника перитонита, является главным элементом комплексного лечения пациентов с тяжелым абдоминальным сепсисом и септическим шоком. Чем быстрее прооперирован больной, тем больше вероятность благоприятного исхода. Обращает на себя внимание тот факт, что у больных разлитым вторичным перитонитом без органной дисфункции определяющим фактором также служило время начала проведения оперативного пособия, а не характер предоперационной подготовки.
Кроме того, как показали результаты исследования, достоверным прогностическим показателем у этих больных была динамика показателей органной дисфункции, оцененной по шкале SOFA в течение первых 3 дней от момента поступления, — чем быстрее регрессирует SOFA, тем больше вероятность благоприятного исхода (SOFA1 — р=0,0001, SOFA2 — р=0,012, SOFA3 — р=0,017).
Следовательно, важным компонентом улучшения результатов лечения пациентов с разлитым вторичным перитонитом являются мероприятия, направленные на сокращение времени начала оперативного пособия и сроков купирования органной дисфункции, в течение первых суток и в динамике. С учетом полученных результатов и данных литературы перспективным направлением лечения пациентов с распространенным вторичным перитонитом и абдоминальным сепсисом может быть концепция сокращенной лапаротомии (abbreviated laparotomy) [15—18].
Таким образом, индекс коморбидности Чарлсона и органная дисфункция, оцененная по шкале SOFA как при поступлении, так и в динамике, являются статистически значимыми предикторами исхода течения разлитого вторичного перитонита. Динамика регресса SOFA может использоваться как показатель адекватности лечения. Сокращение времени обследования и предоперационной подготовки (пороговое значение — 520 мин от момента поступления) статистически значимо снижает вероятность летального исхода у этих больных. Устранение или контроль источника инфекции — основополагающий принцип ведения пациентов с распространенным вторичным перитонитом. Применение тактики сокращенной лапаротомии у нестабильных пациентов может расцениваться как элемент реанимационных мероприятий.
Участие авторов:
Концепция и дизайн исследования — С.А. Шляпников, И.М. Батыршин
Сбор и обработка материала — Ю.С. Остроумова, И.М. Батыршин, Д.С. Склизков, Д.В. Фомин
Читайте также:

