Госпитальные штаммы внутрибольничных инфекций
Обновлено: 24.04.2024
Хараева З.Ф. 1 Балахова Б.О. 1 Белимготова Р.Р. 1 Мустафаев И.М. 1 Тугушева Д.С. 1 Чочуева Н.А. 1 Шекихачева Ф.Ю. 1
Несмотря на поиск и внедрение новых методов борьбы с госпитальными микробами, внутрибольничные инфекции являются актуальной темой исследования из-за постоянного изменения свойств микрофлоры. При санитарно-бактериологическом исследовании выявлены госпитальные штаммы: Proteus spp., Staphylococcus aureus, Acinetobacter spp., Streptococcus spp., Klebsiella pneumoniae, Enterobacter и плесневые грибы. Так как наиболее часто встречаемыми штаммами являлись штаммы Staphylococcus aureus, были исследованы характеристики золотистого стафилококка. Выделенные штаммы золотистого стафилококка обладали высоким персистентным потенциалом, множественной резистентностью к антибиотикам и некоторым дезинфектантам, что позволяло патогенной микрофлоре длительное время находиться в окружающей среде и противостоять защитным силам макроорганизма. Высокий персистентный потенциал выделенных штаммов стафилококков является фактором риска для пациентов, приводя к развитию затяжных гнойно-воспалительных заболеваний.

2. Бухарин О.В., Усвяцов Б.Я.. Бактерионосительство (методико-экологический аспект). – Екатеринбург: УрО РАН, 1996. – 207 с.
3. Бухарин О.В., Усвяцов Б.Я., Малышкин А.П., Немцева Н.В. Метод определения антилизоцимной активности микроорганизмов // Журн. микробиол. эпидемиол. и иммунобиол. – 1984. – N 2. – С. 27–28.
4. Бухарин О. В., Фадеев С.Б., Исайчев Б.А. Динамика видового состава, антилизоцимной активности и антибиотикорезистентности возбудителей хирургической инфекции мягких тканей // Журн. микробиол., эпидемиол. и иммунобиол. – 1997. – № 4. – С. 51–54.
5. Верещагина С.А. Внутрибольничные инфекции в многопрофильном хирургическом стационаре: дис. … канд. мед. наук. – Иркутск, 2005. – 112 с.
6. Внутрибольничная инфекция / Шерертц, Хэмптон, Ристуцина / под ред. Р.П. Венцела. – М.: Медицина 1990.
7. Дерябин Д.Г., Курлаев П.П., Брудастов Ю.А. Роль персистентных характеристик в определении затяжного течения гнойно-воспалительного процесса // Журн. микробиол., эпидемиол. и иммунобиол. – 1996. – N 3. – С. 74–77.
8. Желтова В.И., Шульга И.А., Сафронов А.А. Антилизоцимная активность и биологические свойства стафилококков при гнойно-септических заболеваниях // Персистенция микроорганизмов / под ред. О.В. Бухарина. – Куйбышев, 1987. – С. 19–22.
9. Зыкова Л.С. Факторы персистенции уропатогенов в диагностике, прогнозировании и лечении пиелонефрита у детей: автореф. дис. . д-ра мед. наук. – Оренбург, 1998. – 35 с.
10. Кулаев И.С., Северин А.И., Абрамочкин Г.В. Бактериологические ферменты микробного происхождения в биологии и медицине // Вестник АМН СССР. – 1984. – № 8. – С. 64–69.
11. Паршута А.И., Усвяцов Б.Я. Роль факторов персистенции в формировании микробного биоценоза слизистой оболочки носа у стафилококковых бактерионосителей // ЖМЭИ. –1998. – № 1. – С. 18–21.
12. Санитарные правила устройства, оборудования и эксплуатации больниц, родильных домов и других лечебных стационаров № 5179-90 от 29.06.90 г.
13. Хараева З.Ф. Факторы персистенции возбудителей внутрибольничных инфекций: методические указания. – Нальчик. КБГУ, 2010. – 55 с.
Несмотря на поиск и внедрение новых методов борьбы с госпитальными микробами, проблема внутрибольничных инфекций остается одной из самых острых в современных условиях, приобретая все большую медицинскую и социальную значимость [1]. Актуальность проблемы внутрибольничных инфекций обусловлена появлением так называемых госпитальных (как правило, полирезистентных к антибиотикам и химиопрепаратам) штаммов стафилококков, сальмонелл, синегнойной палочки и других возбудителей. Они легко распространяются среди детей и ослабленных, особенно пожилых, больных со сниженной иммунологической реактивностью, которые представляют собой так называемую группу риска [7, 8, 9].
Заболеваемость госпитальными инфекциями колеблется от 5 до 20 % от общего числа пациентов, госпитализированных в лечебные учреждения [5]. По результатам ряда исследований, уровень смертности в группе госпитализированных и приобретших внутрибольничные инфекции пациентов в 8–10 раз превышает таковой среди госпитализированных больных без внутрибольничных инфекций [1, 5]. Возбудители госпитальных инфекций отличаются высоким персистентным потенциалом и быстро развивающейся устойчивостью к дезинфектантам и антибиотикам, что позволяет патогенной микрофлоре длительное время находиться в окружающей среде и противостоять защитным силам макроорганизма.
Основными возбудителями бактериальных инфекций являются стафилококки, пневмококки, грамотрицательные энтеробактерии, псевдомонады и представители строгих анаэробов. Главенствующую роль играют стафилококки (до 60 % всех случаев внутрибольничных инфекций), грамотрицательные бактерии, респираторные вирусы и грибы рода Candida. Штаммы бактерий, выделенные от пациентов с нозокомиальными инфекциями, как правило, более вирулентны и обладают множественной химиорезистентностью [9, 11].
В связи с этим целью данного исследования было выявление основных особенностей внутрибольничных штаммов Staphylococcus aureus нозокомиальных инфекций, включая персистентный потенциал, антибиотикорезистентность и чувствительность госпитальных штаммов к дезинфектантам.
Материалы и методы исследования
Бактериологическое исследование микробной обсемененности объектов внешней среды было проведено согласно методическим рекомендациям по санитарно-эпидемиологическому режиму [4]. Отбор проб с поверхностей различных объектов осуществляли методом смывов. Идентификацию штаммов производили с учетом их морфологических и культуральных признаков. В качестве факторов персистенции изучены антилизоцимная, антикомплементарная, каталазная активности [5]. Антибиотикочувствительность исследовали диско-диффузионным методом. Чувствительность выделенных штаммов к 0,01 % раствору анолита исследовали путем добавления в соответствующем разведении к жидкой бактериальной культуре. Статистическую обработку проводили стандартными методами.
Результаты исследования и их обсуждение
При исследовании смывов в лечебном учреждении в 35 % случаев были выделены штаммы Staphylococcus аureus, в 17 % проб были выделены штаммы Klebsiella pneumoniae, в 10 % – Proteus vulgaris и Proteus mirabilis, в 2–5 % – Enterobacter, Acinetobacter. Так как наиболее часто встречаемыми штаммами являлись штаммы Staphylococcus aureus, были исследованы характеристики золотистого стафилококка.
В качестве факторов персистенции исследовали антилизоцимную (АЛА), антиинтерфероновую (АИА), антикомплементарную (АКА) активности как возможные пути противостояния кислороднезависимому механизму фагоцитоза и активность антиоксидантного бактериального фермента – каталазы. Антилизоцимной активностью обладало 67 % (20 культур) из 30 изученных штаммов. АИА обладало 44 % (13 культур), АКА обладали 34 % (10 культур) изученных нами штаммов S.aureus.
Известно, что первичными бактерицидными факторами, выделяемыми фагоцитами, являются перекись водорода и продукты ее свободнорадикального разложения, такие как гипохлорид и гидроксильный радикал [5]. Стафилококки приспосабливаются выживать в среде с повышенной концентрацией перекиси водорода путем индукции генов раннего ответа на окислительное повреждение [5]. Белковыми продуктами этих генов являются, среди прочих, фермент каталаза, разлагающий перекись водорода до нейтральных продуктов – воды и молекулярного кислорода и фермент супероксиддисмутаза, разлагающий супероксид анион радикал до молекулярного кислорода. Каталазная активность была выявлена у 80 % штаммов, при количественной оценке каталазной активности бактерий обнаружено, что большая часть штаммов (55 %) обладала высокой активностью фермента (4,0–5,1 ед./20 млн).
35–42 % штаммов S. aureus обладали множественной резистентностью, проявляя при этом чувствительность к препаратам цефалоспоринов (цефтриаксон, цефотаксим, цефуроксим). Для исследования чувствительности к применяемым в лечебных учреждениях дезинфектантам была проведена серия опытов по определению чувствительности S. aureus к раствору анолита. Обнаружено, что выделенные штаммы проявили устойчивость более чем в 60 % случаев к 0,01 % раствору анолита.
Таким образом, при изучении основных особенностей внутрибольничных инфекций, включая персистентный потенциал, антибиотикорезистентность и чувствительность госпитальных штаммов к дезинфектантам можно сделать следующие выводы:
1. При дальнейшем подборе дезинфектантов в стационарах необходимо учесть, что выделенные штаммы проявили устойчивость к 0,01 % раствору анолита, применяемого в современных медицинских учреждениях для дезинфекции. Возможно, данный дезинфицирующий раствор необходимо применять в более высокой концентрации или заменить его другим раствором.
2. Высокий персистентный потенциал выделенных штаммов стафилококков является фактором риска для пациентов, приводя к развитию затяжных гнойно-воспалительных заболеваний. Поэтому изучение патогенетически значимых свойств микроорганизмов, направленных на инактивацию эффекторов противоинфекционого иммунитета и тем самым нарушающих процесс элиминации патогена из очага воспаления [10], может стать альтернативным подходом к прогнозированию длительности течения гнойно-воспалительных заболеваний и дает возможность своевременного подключения иммунокорригирующих препаратов.
Рецензенты:
Внутрибольничные инфекции – различные инфекционные заболевания, заражение которыми произошло в условиях лечебного учреждения. В зависимости от степени распространения различают генерализованные (бактериемию, септицемию, септикопиемию, бактериальный шок) и локализованные формы внутрибольничных инфекций (с поражением кожи и подкожной клетчатки, дыхательной, сердечно-сосудистой, урогенитальной системы, костей и суставов, ЦНС и т. д.). Выявление возбудителей внутрибольничных инфекций проводится с помощью методов лабораторной диагностики (микроскопических, микробиологических, серологических, молекулярно-биологических). При лечении внутрибольничных инфекций используются антибиотики, антисептики, иммуностимуляторы, физиотерапия, экстракорпоральная гемокоррекция и т. д.

Общие сведения
Внутрибольничные (госпитальные, нозокомиальные) инфекции - инфекционные заболевания различной этиологии, возникшие у пациента или медицинского сотрудника в связи с пребыванием в лечебно-профилактическом учреждении. Инфекция считается внутрибольничной, если она развилась не ранее 48 часов после поступления больного в стационар. Распространенность внутрибольничных инфекций (ВБИ) в медицинских учреждениях различного профиля составляет 5-12%. Наибольший удельный вес внутрибольничных инфекций приходится на акушерские и хирургические стационары (отделения реанимации, абдоминальной хирургии, травматологии, ожоговой травмы, урологии, гинекологии, отоларингологии, стоматологии, онкологии и др.). Внутрибольничные инфекции представляют собой большую медико-социальную проблему, поскольку утяжеляют течение основного заболевания, увеличивают длительность лечения в 1,5 раза, а количество летальных исходов - в 5 раз.

Этиология и эпидемиология внутрибольничных инфекций
Основными возбудителями внутрибольничных инфекций (85% от общего числа) выступают условно-патогенные микроорганизмы: грамположительные кокки (эпидермальный и золотистый стафилококк, бета-гемолитический стрептококк, пневмококк, энтерококк) и грамотрицательные палочковидные бактерии (клебсиеллы, эшерихии, энтеробактер, протей, псевдомонады и др.). Кроме этого, в этиологии внутрибольничных инфекций велика удельная роль вирусных возбудителей простого герпеса, аденовирусной инфекции, гриппа, парагриппа, цитомегалии, вирусных гепатитов, респираторно-синцитиальной инфекции, а также риновирусов, ротавирусов, энтеровирусов и пр. Также внутрибольничные инфекции могут быть вызваны условно-патогенными и патогенными грибами (дрожжеподобными, плесневыми, лучистыми). Особенностью внутригоспитальных штаммов условно-патогенных микроорганизмов служит их высокая изменчивость, лекарственная резистентность и устойчивость к воздействию факторов среды (ультрафиолета, дезинфектантов и пр.).
Источниками внутрибольничных инфекций в большинстве случаев выступают пациенты или медицинский персонал, являющиеся бактерионосителями или больными стертыми и манифестными формами патологии. Как показывают исследования, роль третьих лиц (в частности, посетителей стационаров) в распространении ВБИ невелика. Передача различных форм госпитальной инфекции реализуется с помощью воздушно-капельного, фекально-орального, контактного, трансмиссивного механизма. Кроме этого, возможен парентеральный путь передачи внутрибольничной инфекции при проведении различных инвазивных медицинских манипуляций: забора крови, инъекций, вакцинации, инструментальных манипуляций, операций, ИВЛ, гемодиализа и пр. Таким образом в медучреждении возможно заразиться гепатитами В, С и D, гнойно-воспалительными заболеваниями, сифилисом, ВИЧ-инфекцией. Известны случаи внутрибольничных вспышек легионеллеза при приеме больными лечебного душа и вихревых ванн.
Факторами, участвующими в распространении внутрибольничной инфекции, могут выступать контаминированные предметы ухода и обстановки, медицинский инструментарий и аппаратура, растворы для инфузионной терапии, спецодежда и руки медперсонала, изделия медицинского назначения многоразового использования (зонды, катетеры, эндоскопы), питьевая вода, постельные принадлежности, шовный и перевязочный материал и мн. др.
Значимость тех или иных видов внутрибольничной инфекции во многом зависит от профиля лечебного учреждения. Так, в ожоговых отделениях преобладает синегнойная инфекция, которая в основном передается через предметы ухода и руки персонала, а главным источником внутрибольничной инфекции являются сами пациенты. В учреждениях родовспоможения основную проблему представляет стафилококковая инфекция, распространяемая медицинским персоналом-носителем золотистого стафилококка. В урологических отделениях доминирует инфекция, вызываемая грамотрицательной флорой: кишечной, синегнойной палочкой и др. В педиатрических стационарах особую значимость имеет проблема распространения детских инфекций – ветряной оспы, эпидемического паротита, краснухи, кори. Возникновению и распространению внутрибольничной инфекции способствуют нарушение санитарно-эпидемиологического режима ЛПУ (несоблюдение личной гигиены, асептики и антисептики, режима дезинфекции и стерилизации, несвоевременное выявление и изоляция лиц-источников инфекции и т. д.).
К группе риска, в наибольшей степени подверженной развитию внутрибольничной инфекции, относятся новорожденные (особенно недоношенные) и дети раннего возраста; пожилые и ослабленные пациенты; лица, страдающие хроническими заболеваниями (сахарным диабетом, болезнями крови, почечной недостаточностью), иммунодефицитом, онкопатологией. Восприимчивость человека к внутрибольничным инфекциям увеличивается при наличии у него открытых ран, полостных дренажей, внутрисосудистых и мочевых катетеров, трахеостомы и других инвазивных устройств. На частоту возникновения и тяжесть течения внутрибольничной инфекции влияет долгое нахождение пациента в стационаре, длительная антибиотикотерапия, иммуносупрессивная терапия.
Классификация внутрибольничных инфекций
По длительности течения внутрибольничные инфекции делятся на острые, подострые и хронические; по тяжести клинических проявлений – на легкие, среднетяжелые и тяжелые формы. В зависимости от степени распространенности инфекционного процесса различают генерализованные и локализованные формы внутрибольничной инфекции. Генерализованные инфекции представлены бактериемией, септицемией, бактериальным шоком. В свою очередь, среди локализованных форм выделяют:
- инфекции кожи, слизистых и подкожной клетчатки, в т. ч. послеоперационных, ожоговых, травматических ран. В частности, к их числу относятся омфалит, абсцессы и флегмоны, пиодермия, рожа, мастит, парапроктит, грибковые инфекции кожи и др.
- инфекции полости рта (стоматит) и ЛОР-органов (ангина, фарингит, ларингит, эпиглоттит, ринит, синусит, отит, мастоидит)
- инфекции бронхолегочной системы (бронхит, пневмония, плеврит, абсцесс легкого, гангрена легкого, эмпиема плевры, медиастинит)
- инфекции пищеварительной системы (гастрит, энтерит, колит, вирусные гепатиты)
- глазные инфекции (блефарит, конъюнктивит, кератит)
- инфекции урогенитального тракта (бактериурия, уретрит, цистит, пиелонефрит, эндометрит, аднексит)
- инфекции костно-суставной системы (бурсит, артрит, остеомиелит)
- инфекции сердца и сосудов (перикардит, миокардит, эндокардит, тромбофлебиты).
- инфекции ЦНС (абсцесс мозга, менингит, миелит и др.).
Диагностика внутрибольничных инфекций
Критериями, позволяющими думать о развитии внутрибольничной инфекции, служат: возникновение клинических признаков заболевания не ранее чем через 48 часов после поступления в стационар; связь с проведением инвазивного вмешательства; установление источника инфекции и фактора передачи. Окончательное суждение о характере инфекционного процесса получают после идентификации штамма возбудителя с помощью лабораторных методов диагностики.
Для исключения или подтверждения бактериемии проводится бактериологический посев крови на стерильность, желательно не менее 2-3-х раз. При локализованных формах внутрибольничной инфекции микробиологическое выделение возбудителя может быть произведено из других биологических сред, в связи с чем выполняется посев мочи, кала, мокроты, отделяемого ран, материала из зева, мазка с конъюнктивы, из половых путей на микрофлору. Дополнительно к культуральному методу выявления возбудителей внутрибольничных инфекций используются микроскопия, серологические реакции (РСК, РА, ИФА, РИА), вирусологический, молекулярно-биологический (ПЦР) методы.
Лечение внутрибольничных инфекций
Сложности лечения внутрибольничной инфекции обусловлены ее развитием в ослабленном организме, на фоне основной патологии, а также резистентностью госпитальных штаммов к традиционной фармакотерапии. Больные с диагностированными инфекционными процессами подлежат изоляции; в отделении проводится тщательная текущая и заключительная дезинфекция. Выбор противомикробного препарата основывается на особенностях антибиотикограммы: при внутрибольничной инфекции, вызванной грамположительной флорой наиболее эффективен ванкомицин; грамотрицательными микроорганизмами – карбапенемы, цефалоспорины IV поколения, аминогликозиды. Возможно дополнительное применение специфических бактериофагов, иммуностимуляторов, интерферона, лейкоцитарной массы, витаминотерапии.
При необходимости проводится чрескожное облучение крови (ВЛОК, УФОК), экстракорпоральная гемокоррекция (гемосорбция, лимфосорбция). Симптоматическая терапия осуществляется с учетом клинической формы внутрибольничной инфекции с участием специалистов соответствующего профиля: хирургов, травматологов, пульмонологов, урологов, гинекологов и др.
Профилактика внутрибольничных инфекций
Основные меры профилактики внутрибольничных инфекций сводятся к соблюдению санитарно-гигиенических и противоэпидемических требований. В первую очередь, это касается режима дезинфекции помещений и предметов ухода, применения современных высокоэффективных антисептиков, проведения качественной предстерилизационной обработки и стерилизации инструментария, безукоснительного следования правилам асептики и антисептики.
Медицинский персонал должен соблюдать меры индивидуальной защиты при проведении инвазивных процедур: работать в резиновых перчатках, защитных очках и маске; осторожно обращаться с медицинским инструментарием. Большое значение в профилактике внутрибольничных инфекций имеет вакцинация медработников от гепатита В, краснухи, гриппа, дифтерии, столбняка и других инфекций. Все сотрудники ЛПУ подлежат регулярному плановому диспансерному обследованию, направленному на выявление носительства патогенов. Предупредить возникновение и распространение внутрибольничных инфекций позволит сокращение сроков госпитализации пациентов, рациональная антибиотикотерапия, обоснованность проведения инвазивных диагностических и лечебных процедур, эпидемиологический контроль в ЛПУ.
Ежегодно в США регистрируют около 1,7 млн случаев внутрибольничных инфекций, вызванных микроорганизмами, при этом 99 тыс. из них заканчиваются летально. В развитых странах Европы смертность от внутрибольничных инфекций составляет 25 тыс. случаев в год, из них две трети обусловлены грамотрицательными бактериями. В нашей стране внутрибольничные инфекции в два раза повышают риск летального исхода
Внутрибольничные инфекции
Изучение внутрибольничных инфекций (ВБИ) началось более 150 лет назад, но по-прежнему они остаются серьезной проблемой, приводя к удлинению сроков лечения, хронизации процесса, инвалидности, а в наиболее тяжелых случаях — к смерти больных. Согласно определению ВОЗ, внутрибольничными инфекциями считаются любые клинически выраженные заболевания микробного происхождения, поражающие больного в результате его госпитализации или посещения лечебного учреждения либо возникающие в течение 30 дней после выписки из больницы.
К внутрибольничным инфекциям также относятся инфицирование сотрудников больницы, связанное с их профессиональной деятельностью. Эти болезни отличаются механизмами и факторами передачи, особенностями течения эпидемиологического и инфекционного процессов, а также особой ролью медицинского персонала в возникновении, поддержании и распространении инфекции. Подобные инфекции могут быть обусловлены широким внедрением в практику инструментальных, эндоскопических, биохимических и других методов диагностики, которые сопряжены с нарушением целости покровов тела человека. Проблема в том, что конструкция некоторых медицинских приборов не позволяет произвести их полную стерилизацию после каждой процедуры, оставляя лазейку для проникновения нежелательных микробов во внутреннюю среду организма человека.
Агенты ВБИ
Всего насчитывается более 200 агентов, которые могут быть причиной внутрибольничных инфекций. До появления антибиотиков основными из них были стрептококки и анаэробные палочки. Однако после начала клинического применения антибиотиков возбудителями основных внутрибольничных инфекций стали ранее непатогенные или условно-патогенные микроорганизмы. К ним относятся стафилококки (Staphylococcus aureus, St. epidermidis, St. saprophiticus), стрептококки (Streptococcus spp.), энтерококки (Enterococcus faecalis, Enterococcus durans), эшерихия (Escherichia coli), клебсиелла (Klebsiella spp.), энтеробактер (Enterobacter spp.), протей (Proteus mirabilis), серрация (Serratia marcescens), псевдомонада (Pseudomonas aeruginosa). Нередко встречаются ВБИ, вызываемые Providencia spp., Stenotrophomona smaltophilia, Acinetobacter baumannii, Citrobacter spp., Clostridium difficile и другими микроорганизмами.
Всего насчитывается более 200 агентов, которые могут быть причиной внутрибольничных инфекций
Роль облигатно-патогенных микроорганизмов в развитии внутрибольничных инфекций невелика. В неинфекционных стационарах регистрируют несколько нозологических форм инфекций, вызванных возбудителями этой группы. К ним относятся вирусы гепатитов В, С, D, ВИЧ, гриппа и других ОРВИ, острых кишечных вирусных инфекций, герпеса, цитомегаловирусной инфекции, а также анаэробные клостридии и хламидии.
ВОЗ предупреждает
Эксперты ВОЗ совместно с отделом инфекционных заболеваний при Тюбингенском университете (Германия) назвали 12 бактерий, которые представляют наибольшую опасность для здоровья человека.
В первую критическую группу вошли Acinetobacter baumannii, Pseudomona saeruginosa и Enterobacteriaceae, которые часто выявляют в больницах и домах престарелых, причем заражение ими может привести к развитию смертельных инфекций, например пневмонии и заболеваний крови. Эти бактерии устойчивы к большинству антибиотиков, в том числе карбапенемам и цефалоспоринам.
Основные пути приспособления больничных штаммов — это устойчивость к одному или нескольким антибиотикам широкого спектра действия и снижение чувствительности к антисептикам
Во вторую группу списка ВОЗ включены Enterococcus faecium, Staphylococcus aureus, Helicobacter pylori, Campylobacter spp., Salmonellae и Neisseria gonorrhoeae. К третьей категории отнесены Streptococcus pneumoniae, Haemophilus influenzae и Shigella spp.
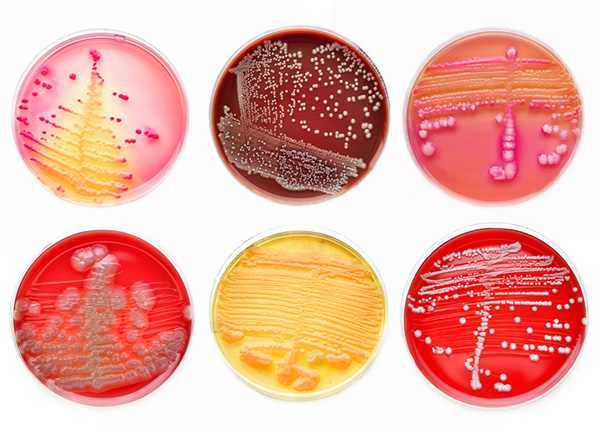
Госпитальные штаммы
Основные пути приспособления больничных штаммов — это устойчивость к одному или нескольким антибиотикам широкого спектра действия и снижение чувствительности к антисептикам. Госпитальные штаммы очень разнообразны, в каждой больнице или отделении возможно появление своего характерного штамма со свойственным только ему набором биологических свойств. При этом популяции возбудителей внутрибольничных инфекций отличаются не только гетерогенностью, но и динамичностью во времени.
Из больниц антибиотикорезистентные штаммы, особенно это касается грамотрицательных бактерий, постепенно начинают распространяться во внебольничную среду.
Эковары
Эковары — это варианты одного вида микроорганизма, которые приспособились к обитанию в определенной экосистеме. В данном случае выделяют больничные и внебольничные эковары. Больничными эковарами люди заражаются в основном во время инъекций, операций, переливания крови, гемосорбции, гемодиализа, мануальных и эндоскопических исследований и др.
Госпитальные инфекции, обусловленные внебольничными эковарами, часто возникают при нарушении целости покровов тела на фоне общего снижения иммунитета. Возбудители инфекций проникают во внутреннюю среду организма при повреждении слизистых оболочек, через ожоги, травматические раны, открытые гнойно-воспалительные очаги.
Устойчивые к большинству антибиотиков штаммы золотистого стафилококка (methicillinresistant Staphylococcus aureus — MRSA) стали настоящим бичом больниц. Несмотря на все усилия, ликвидировать инфекцию не удается
Больничные эковары способны вызывать госпитальную инфекцию не только при снижении функции иммунной системы, но и при нормальном иммунном ответе после инъекций или операций. Причем инфицирующая доза больничного эковара может быть относительно небольшой. Для появления инфекции, вызванной внебольничным эковаром, кроме снижения иммунитета, необходимо еще два условия: пассивное проникновение возбудителя во внешнюю среду организма и массивная инфицирующая доза.
Генетическая стабильность больничных инфекций Pseudomonas aeruginosa
Прежде считалось, что в больничной среде бактерии изменяются ускоренными темпами, увеличивая таким образом генетическое разнообразие внутрибольничной микрофлоры. Для изучения этого вопроса датские ученые проследили генетические изменения бактерии Pseudomonas aeruginosa, которые произошли с 70-х годов прошлого века в пределах одной из больниц Копенгагена. Для этого они использовали бактериальные штаммы, выделенные в анализах больных муковисцидозом, поскольку Pseudomonas aeruginosa является источником инфекций дыхательных путей, осложняя течение этой болезни.
Хирург и специалист по инфекционным заболеваниям Марк Шпигельман из Университетского колледжа в Лондоне считает, что повышенные требования к гигиене в хирургических клиниках парадоксальным образом способствуют распространению внутрибольничных инфекций
Один вариант штамма в течение 35 лет дал около 200 000 поколений, переходя от одного пациента к другому. В связи с высокой неоднородностью условий и длительным временем можно было бы ожидать широкой генетической диверсификации исходного штамма, но оказалось, что внутрибольничные инфекционные возбудители после периода быстрых адаптаций изменяются относительно мало, скорость мутирования у них низкая и расщепления на отдельные линии не происходит.
Эти наблюдения на первый взгляд кажутся противоречивыми, так как долгая эволюция в нестабильных условиях могла бы способствовать повышению генетического разнообразия. Тем не менее выяснилось, что, несмотря на то что внутренняя среда больного весьма неустойчива и разнородна из-за инфекций и постоянного лечения всевозможными препаратами, эта разнородность не способствует быстрому увеличению генетического разнообразия.
Clostridium difficile
Спорообразующая бактерия Clostridium difficile относится к стойким и трудноискоренимым возбудителям больничных инфекций. Заражение происходит через руки медицинского персонала, например, при измерении ректальной температуры, причем не помогает даже использование индивидуальных чехлов для датчиков.

У получавших антибиотики больных (даже однократно перед операцией) под влиянием токсинов Clostridium difficile возможно развитие псевдомембранозного колита, основным проявлением которого является диарея. У некоторых больных профузная диарея сопровождается интоксикацией, высокой лихорадкой, лейкоцитозом. Если пациент продолжает получать антибиотики вплоть до выписки, то псевдомембранозный колит может начаться дома.
MRSA — повод для изменений правил больничной гигиены
Устойчивые к большинству антибиотиков штаммы золотистого стафилококка (methicillinresistant Staphylococcus aureus — MRSA) стали настоящим бичом больниц. Несмотря на все усилия, ликвидировать инфекцию не удается. Вне больниц бактерия, как правило, теряет активность. Однако в последнее время все чаще отмечают случаи, когда инфекция выходит за пределы медицинских учреждений.
Хирург и специалист по инфекционным заболеваниям Марк Шпигельман из Университетского колледжа в Лондоне считает, что повышенные требования к гигиене в хирургических клиниках парадоксальным образом способствуют распространению внутрибольничных инфекций. При этом он указывает на два принципиальных факта, которые должны объяснить неэффективность борьбы с инфекцией в больницах. Во-первых, избыточные меры гигиены, применяемые в больницах, особенно в хирургических отделениях, уничтожают безвредные бактерии, создавая тем самым среду для заселения бактериями MRSA. Во-вторых, применение антибиотиков с гигиенической целью, в частности использование антибактериального мыла, не только приводит к появлению устойчивых к антибиотикам штаммов, но и активизирует защитные механизмы у бактерий, которые в менее агрессивной среде не действуют.
Как специалист по истории и развитию инфекционных заболеваний в древних человеческих популяциях Марк Шпигельман предлагает предпринять ряд мер по борьбе с инфекцией. Прежде всего надо строго разделить больницы, где используют антибиотики, от тех, где их не применяют (прежде всего это касается хирургических отделений). Разделение должно быть очень жестким. Персонал не должен совмещать работу в больницах разного типа.
В случае необходимости использовать антибиотики в клинике, где они запрещены, больного следует перевести в другое медицинское учреждение. Кроме того, выдвинуто неожиданное предложение по изменению гигиенических процедур. Предлагается вместо антибиотиков при подготовке к операции использовать пробиотики, которые помогут противостоять болезнетворным бактериям.
Аннотация научной статьи по фундаментальной медицине, автор научной работы — Шеховцова Елена Васильевна, Шаталова Е. В.
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Шеховцова Елена Васильевна, Шаталова Е. В.
Динамика структуры популяций возбудителей сме-шанной инфекции ожоговой травмы в условиях иммунодефицита и после применения иммуномодуляторов (экспериментальное исследование)
Этиопатогенез современных инфекций. Часть 2. Резистентность возбудителей к антибиотикам. Госпитальные инфекции. Перспективные средства терапии
The mechanism of formation of hospital strains of hospital-acquired infections agents and modes of prevention
The article deals with the mechanisms of formation of hospital strains through immunocompromized organism analyzed using the clinically significant signs. It is established that application of galavitum with lidocaine results in the saprophitization of agents in organism hence preventing the formation of strains with "hospital" signs.
2. При неизменном спектре приоритетных патогенов ГВЗ и ГСЗ снижается доля грамположительных кокков за счет уменьшения количества стрептококков и стафилококков, но увеличивается доля энтеробактерий и НГОБ.
3. Растет резистентность грамположительных кокков в отношении эритромицина, клиндамицина, ципрофлокса-цина; грамотрицательных палочек - в отношении ципроф-локсацина, цефалоспоринов III-IV поколения, амикацина. Наиболее высока резистентность у клинических изолятов MRSA, K. pneumoniae, A. baumannii. Ванкомицин активен в отношении всех грамположительных патогенов. Карбапене-мы активны в отношении всех энтеробактерий. В отношении НГОБ наиболее активны карбапенемы, цефоперазон/суль-бактам, пиперациллин/тазобактам, цефепим, а также нетил-мицин в отношении A. baumannii и полимиксин в отношении Р. aeruginosa.
5. Разработаны алгоритмы рациональной антимикробной химиотерапии ГВЗ и ГСЗ в отделении гнойной хирургии многопрофильного ЛПУ (ГУЗ Москвы ГКБ № 15 им. О. М. Филатова).
1. Амирасланов Ю. А., Земляной А. Б. // Избранный курс лекций по гнойной хирургии / Под ред. В. Д. Федорова, А. М. Светухина. -М., 2007.
3. Дехнич А. В. // Клин. микробиол. и антимикроб. химиотер. -1999. - Т. 1, № 1. - С. 89-91.
4. Дмитренко О. А. Молекулярно-генетические аспекты эпидеми-
ологии внутрибольничных инфекций, вызванных представителями вида Staphylococcus aureus, устойчивыми к метициллину/ оксациллину: Автореф. дис. . д-ра мед. наук. - М., 2008.
5. Ефименко Н. А., Гучев И. А., Сидоренко С. В. Инфекции в хирургии. Фармакотерапия и профилактика: Монография. - Смоленск, 2004.
6. Жуков А. О., Земляной А. Б., Блатун Л. А. и др. // Инфекции в хир. - 2009. - Т. 7, прил. 1. - С. 11-14.
7. Козлов Р. С. // Инфекции в хир. - 2009. - Т. 7, прил. 1. - С. 3-6.
8. Нехорошева А. Г., Скала Л. З., Поликарпова С. В. и др. // Клин. лаб. диагн. - 2000. - № 3. - С. 51-54.
9. Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений. Приказ Минздрава СССР № 535 от 22.04.1985. - М., 1985.
10. Практические аспекты современной клинической микробиологии / Скала Л. З., Сидоренко С. В., Нехорошева А. Г. и др. - Тверь, 2004.
11. Рычагов И. П. Теоретические и организационные основы управления эпидемических процессом внутрибольничных инфекций в хирургии: Автореф. дис. . д-ра мед. наук. - Кемерово, 2007.
13. Скала Л. З., Нехорошева А. Г., Лукин И. Н. и др. // Эпид. и инфекц. бол. - 2000. - № 5. - С. 36-41.
14. СубуроваТ.Н. Совершенствованиесистемымикробиологического мониторинга в специализированном хирургическом стационаре по лечению тяжелых ранений и травм: Автореф. дис. . д-ра биол. наук. - СПб., 2007.
15. Шныров А. В. Клинико-эпидемиологическое изучение висцеральных госпитальных гнойно-септических инфекций в специализированных (хирургическом и фтизиатрическом) стационарах: Автореф. дис. . канд. мед. наук. - СПб., 2008.
16. ЭдельштейнМ. В. // Клин. микробиол. и антимикроб. химиотер. - 2001. - Т. 3, № 3. - С. 223-242.
17. Mannual of clinical microbiology. - 7-th Ed. - 1999.
18. National Committee for Clinical Laboratory Standards. Performance standards for antimicrobial susceptibility testing. M 100. - 2005. -Suppl. 15.
О. В. Шеховцова, Е. В. Шаталова
механизм формирования госпитАльных штаммов возбудителей внутрибольничных инфекций и способ их предупреждения
Кафедра микробиологии, вирусологии, иммунологии Курского государственного медицинского университета
Ключевые слова: госпитальные штаммы, механизм формирования, профилактика
O.V. Shekhovtsova, Ye.V. Shatalova THE MECHANISM OF FORMATION OF HOSPITAL STRAINS OF HOSPITAL-ACQUIRED INFECTIONS
AGENTS AND MODES OF PREVENTION The article deals with the mechanisms of formation of hospital .strains through immunocompromized organism analyzed using the clinically significant signs. It is established that application of galavitum with lidocaine results in the saprophitization of agents in organism hence preventing the formation of strains with "hospital" signs.
Key words: hospital strains, formation mechanism, prevention
Одной из основных причин возрастания частоты внутри-больничных инфекций (ВБИ) является широкое распространение госпитальных штаммов условно-патогенных микроорганизмов, которые формируются в условиях стационара. Распространение госпитальных штаммов, прежде всего стафилококков, псевдомонад, энтеробактерий и в последнее время - дрожжеподобных грибов рода Candida spp. [3], обусловлено рядом особенностей последних, отражающихся на эпидемиологии внутрибольничных инфекций. Это обсеменение госпитальной среды носителями, контаминация медицинских приборов с образованием биопленки, длительная персистенция в окружающей среде, разнообразные механизмы устойчивости к антимикробным препаратам [5] и, что особенно важно, скопление в стационарах иммунокомпроме-тированных больных за счет основного заболевания. Все это позволяет этим микроорганизмам быстро адаптироваться, выживать и получать селективные преимущества в больничной среде с накоплением в популяциях вирулентных особей.
С учетом того, что организм иммунокомпрометирован-ных больных может быть биотопом для модификации факторов патогенности возбудителей ВБИ [4], что обусловит трудности их диагностики, профилактики и лечения и основу для формирования госпитальных штаммов, интерес представляет изучение механизмов и способы предупреждения формирования последних, что до сих пор изучено недостаточно.
Цель исследования - изучить структуру популяций Pseudomonas aeruginosa и дрожжеподобных грибов рода candida по признакам вирулентности и лекарственной устойчивости в условиях иммуносупрессии организма и разработать способ предупреждения формирования штаммов с признаками "госпитальных".
Материалы и методы. Эксперименты выполнены на мышах линии CBA, прошедших карантинный режим вивария КГМУ и не имевших внешних признаков каких-либо заболеваний. В контрольные и опытные группы входили животные одной массы и одного пола, полученные из вивария одновременно. Требования Международного комитета, изложенные в Конвенции по защите позвоночных животных, используемых для экспериментальных целей (Страсбург, Франция, 18 марта 1986 г) в работе полностью соблюдены.
Для создания иммуносупрессии в организме животных выбрана модель термического ожога IIIB степени площадью 30% поверхности тела, который вызывали с помощью прибора для нанесения дозированного ожога [2].
Заражение мышей производили путем внутрибрюшинно-го введения 0,2 мл 2 млрд взвеси суточной культуры микроорганизмов (грибы рода Candida - 12 штаммов и Pseudomonas aeruginosa - 12 штаммов), выделенных от больных с гнойно-воспалительными процессами. Через 2 сут после заражения животных выводили из опыта с помощью эфирного наркоза и в стерильных условиях извлекали селезенку. Производили посевы крови и взвеси селезенки на элективные среды (ЦПХ - агар для синегнойных бактерий и среда Сабуро - для грибов). Взвесью полученных культур заражали следующую партию животных, т. е. производили пассажи. Всего проведено по 6 пассажей. После каждого второго пассажа производили посев крови и взвеси селезенки для получения изолированных колоний. Структуру популяции по признакам лекарственной устойчивости изучали путем пересева 100 изолированных колоний со сред первичного посева на чашки с мясопептонным агаром, содержащим 25 мкг на 1 мл антибиотиков: карбенициллина, стрептомицина, полимиксина и канамицина (для синегнойных бактерий); амфотерицина B,
Шаталова Елена Васильевна, д-р биол. наук, проф.
Адрес: 305041, Курск, ул. К. Маркса, 3
леворина и нистатина (для грибов рода Candida). С целью изучения структуры популяции изучаемых штаммов по признакам патогенности те же 100 колоний засевали на 5% кровяной агар (гемолитическая активность) и на чашки Петри со свернутой лошадиной сывороткой (протеолитическая активность для псевдомонад). С целью изучения предупреждения формирования госпитальных штаммов структуру популяций микробов изучали на фоне применения галавита с лидокаи-ном. Галавит вводили внутримышечно в дозе 200 мкг на мышь сразу после воспроизведения ожоговой травмы 1 раз в сутки в течение 3 дней, лидокаин - внутрибрюшинно в те же сроки в дозе 8 мкг на 1 кг массы тела.
Показателями для изучения состояния уровня иммунной защиты были: фагоцитарная активность нейтрофилов периферической крови (% активных фагоцитов), фагоцитарное число (среднее количество фагоцитирующих микроорганизмов в расчете на один фагоцит), которые определяли по общепринятым методикам. Изучали фагоцитарный резерв нейтрофилов (ФРН) по реакции восстановления нитросинего тетразолия [1] и состояние бактерицидных систем нейтрофилов по наличию лизосомальных катионных белков (КБ) в их цитоплазме [6], что является, как известно, весомыми показателями при гнойно-воспалительных процессах любой этиологии.
Экспериментальные животные разделены на группы (по 25 животных в каждой):
2-я - животные с ожоговой травмой, инфицированные Pseudomonas aeruginosa - бактериальная инфекция;
3-я - животные с ожоговой травмой, инфицированные Candida albicans - грибковая инфекция;
4-я - животные с ожоговой травмой и бактериальной инфекцией, леченные галавитом и лидокаином;
5-я - животные с ожоговой травмой и грибковой инфекцией, леченные галавитом и лидокаином.
Статистическую обработку результатов проводили с помощью пакета прикладных программ Microsoft Office XP с применением критерия Стьюдента.
Результаты и обсуждение. Механизм дестабилизации иммунного статуса у животных и его стойкое угнетение за счет присоединения инфекционного процесса псевдомонад-ной и грибковой этиологии представлены в табл. 1.
Степень тяжести иммуносупрессии была более выраженной у животных с микоинфекцией относительно бактериальной.
На фоне глубокой иммуносупрессии у животных наблюдалась высокая микробная обсемененность селезенки и отмечалась выраженная прямая корреляционная связь между уровнем иммуносупрессии и непрерывным увеличением особей с признаками вирулентности (r = 0,981 ± 0,090) и резистентности к антибиотикам (r = 0,965 ± 0,081) в популяциях псевдомонад и дрожжеподобных грибов рода Candida (табл. 2). К концу эксперимента изначально гетерогенные популяции микроорганизмов становились однородными по содержанию высоковирулентных и устойчивых к антибиотикам клонов (p < 0,01).
Нарастание числа антибиотикорезистентных особей в популяциях культур происходило при отсутствии селективного давления антибиотиков, так как лечения животных антибиотиками не проводилось.
Принимая во внимание патогенез ожоговой болезни, для восстановления иммунологической реактивности организма
Влияние иммуномодуляторов на показатели антиинфекционной защиты организма
Изучаемый показатель Интактные ожог + инфицирование леченные галавитом с лидокаином
Pseudomonas aeruginosa Candida albicans Pseudomonas aeruginosa Candida albicans
Показатели в разные сроки исследования (пассажи) X± т (п = 25)
2-6 2 6 2 6 2 6 2 6
Активность фагоцитоза, % 60,5 ± 0,12 32,7 ± 2,5 35,8 ± 2,9* 30,2 ± 2,8 27,6 ± 1,7* 58,5 ± 1,7 68,2 ± -0,8** 50,2 ± 1,8 62,1 ± 1,2**
Фагоцитарное число 2,1 ± 0,05 0,8 ± 0,03 0,9 ± 0,02* 0,7 ± 0,02 0,6 ± 0,03* 1,5 ± 0,07 3,2 ± 0,02** 1,2 ± 0,05 2,9 ± 0,02**
ФРН, % 29,0 ± 2,3 10,0 ± 1,2 9,0 ± 1,4* 7,0 ± 0,9 8,0 ± 1,3* 12,0 ± 1,4 30,0 ± 2,8** 11,0 ± 1,7 30,0 ± 2,5**
КБ (средний гистохимический показатель) 0,1 ± 0,02 Пылевидные отложения КБ не обнаружены КБ не обнаружены 0,1 ± 0,03 0,28 ± 0,02 Пылевидные отложения 0,26 ± 0,03**
Обсеменен-ность селезенки, микробные клетки/орган Сплошной рост Сплошной рост 2,7 • 102** Отсутствие роста 3,0 • 102** Отсутствие роста
Влияние иммуномодуляторов на состав популяций возбудителей
Изучаемые признаки Процент особей в популяциях (из 100 колоний) Р
от нелеченых животных (ожог + инфицирование) от леченых животных (галавит + лидокаин)
Показатели в разные сроки исследования (пассажи)
Устойчивость: Популяция Pseudomonas aeruginosa
к карбенициллину 72,0 95,0 100,0 70,0 58,0 47,0 < 0,01
стрептомицину 75,0 98,0 100,0 65,0 50,0 30,0 < 0,01
полимиксину 50,0 65,0 95,0 50,0 42,0 34,0 < 0,01
канамицину 85,0 98,0 100,0 78,0 55,0 40,0 < 0,01
Гемолиз 85,0 100,0 100,0 80,0 50,0 38,0 < 0,01
Протеолиз 72,0 100,0 100,0 65,0 45,0 25,0 < 0,01
Устойчивость: Популяция Candida albicans
к амфотерицину В 58,0 70,0 95,0 49,0 45,0 30,0 < 0,01
леворину 65,0 78,0 100,0 62,0 50,0 34,0 < 0,01
нистатину 72,0 90,0 100,0 68,0 55,0 42,0 < 0,01
Гемолиз 55,0 62,0 85,0 39,0 30,0 25,0 < 0,01
Примечание. Достоверность различий с данными контрольной группы (нелеченые животные с ожогом и инфекцией).
животным вводили галавит с лидокаином. При этом предполагалась возможность их синергического действия и, соответственно, повышения терапевтического эффекта за счет неодинакового механизма их действия. Установлено, что сочетанное применение данных препаратов обладало выраженным иммуномодулирующим эффектом на все изучаемые показатели, достоверно (р < 0,01) усиливая и превышая их уровни даже у интактных животных (см. табл. 1).
Особого внимания заслуживают данные, свидетельствующие о существенных изменениях в составе популяций возбудителей гнойно-септических процессов на фоне иммуно-коррекции. Применение галавита с лидокаином способствует достоверной элиминации из состава популяций вирулентных и резистентных к антибиотикам особей, что приводит к са-профитизации возбудителей в организме, которая наблюдается уже с 4-го пассажа исследования (см. табл. 2).
Результаты защищены приоритетной справкой на патент.
организация лабораторной службы
1. Ваксман М. Е. Способ оценки функциональной активности нейтрофилов человека по реакции восстановления нитросинего те-трозолия: Метод. рекомендации. - Казань, 1979.
2. Минухин В. В., Шамрай В. Г. Устройство для нанесения дозированного ожога мелким животным. Деп. во ВНИИМИ. - 1985. - № Д-9976.
3. Сидоренко С. В., Резван С. П., Еремина Л. В. и др. // Антибиотики и химиотер. - 2005. - Т. 50, № 2-3. - С. 33-41.
4. Шабалов А. М., Кузьмина Д. А., Новикова В. П. и др. // Пробл. мед. микол. - 2010. - Т. 12, № 2. - С. 143.
5. Шагинян И. А., Чернуха М. Ю. // Клин. микробиол. и антимикроб. химиотер. - 2005. - Т. 7, № 3. - С. 271-285.
6. ШубичМ. Г. // Цитология. - 1974. - Т. 16, № 10. - С. 1321.
организация лабораторной службы
© в. т. морозова, е. в. Наумова, 2012
в. Т. Морозова, Е. в. Наумова
проблемы и основные принципы подготовки врачей клинической лабораторной диагностики
Кафедра клинической лабораторной диагностики Российской медицинской академии последипломного образования, Москва
В статье приведены основные положения о клинической лабораторной диагностике как самостоятельной клинической специальности и принципах профессиональной подготовки и совершенствования специалистов. Рассмотрены основные проблемы, осложняющие подготовку и совершенствование кадров, в соответствии с реальными потребностями лабораторной службы системы здравоохранения: наличие лабораторных субдисциплин, требующих углубленной специальной теоретической подготовки и технологических умений: потребность учитывать при подготовке специалистов разнообразие форм, размеров и типов лабораторных структур в различных медицинских учреждениях, в которых им приходится работать; необходимость особых программ подготовки многочисленных специалистов с немедицинским базовым образованием. Авторы выступают за сочетание действующей в нашей стране системы периодического совершенствования специалистов на кафедрах государственных образовательных учреждений с инициативным участием специалистов в различных общественных формах постоянного профессионального совершенствования (заседаниях профессионального научного общества, конференциях, интернет-семинарах и т. п.). Наряду с положительной оценкой сложившейся системы подготовки в государственных образовательных учреждениях и регламентирующих ее основных ведомственных документов высказана критика в отношении некоторых документов последнего времени, неправомерно ограничивающих должностные обязанности врачей клинической лабораторной диагностики, осложнивших подготовку бактериологов для клинических лабораторий.
Ключевые слова: клиническая лабораторная диагностика, подготовка специалистов клинической лабораторной диагностики
V.T. Morozova, Ye.V. Naumova
THE ISSUES AND BASIC PRINCIPLES OF TRAINING OF PHYSICIANS OF CLINICAL LABORATORY
The article considers the main positions concerning the clinical laboratory diagnostics as an independent clinical specialty and the principles of professional training and improvement of specialists. The basic issues complicating the training and improvement of personnel to be kept in line with actual needs of laboratory service ofpublic health system are discussed. Among them are the availability of laboratory academic sub disciplines demanding a profound special theoretical education and technical skills; the need to account in the process ofprofessional training the variety of forms, sizes and types of laboratory structures in different medical institutions; the need of special training programs for numerous specialists with non-medical basic education. The combination of the present system ofpost-graduate training of specialists on chairs of state educational organizations with initiative involvement of specialists in various public forms of permanent professional improvement (professional scientific societies meetings, research conferences, internet seminars, etc.) is supported. Along with a positive appraisal of the existing system of training in the state educational institutions and corresponding regulation documents, a critique is expressed regarding certain actual documents which improperly limit the administrative functions of physicians of clinical laboratory diagnostics and complicate training of bacteriologists for clinical laboratories.
Key words: clinical laboratory diagnostics, training, specialist
Клиническая лабораторная диагностика (КЛД) долгое время существовала как параклиническая дисциплина и только в конце XX века получила официальный статус. После Великой Отечественной войны в связи с развитием фундаментальной медицинской науки, появлением новых программ лечения, методов исследования возникла необходимость в
Циркулирующие в стационарах возбудители внутрибольничных инфекций постепенно формируют так называемые госпитальные штаммы, т. е. штаммы наиболее эффективно адаптированные к местным особенностям того или иного отделения.
Главной особенностью госпитальных штаммов является повышенная вирулентность (во всех случаях это первая и главная особенность госпитального штамма), а также специфическая адаптация к используемым лечебным препаратам (антибиотики, антисептики, дезинфектанты и т. п.). В настоящее время сложилась система, по которой о госпитальном штамме судят по спектру устойчивости к антибиотикам.

Это удобная и доступная в практических условиях система контроля формирования госпитального штамма возбудителями внутрибольничных инфекций, поскольку имеются неопровержимые данные о связи между используемыми антибиотиками в стационаре и спектром резистентности возбудителей. Но при этом надо иметь в виду, что такие штаммы оказываются чрезвычайно опасными не только из-за устойчивости к лечебным препаратам, но и в связи с их повышенной (причем иногда значительно) вирулентностью (у них меньшая инфицирующая доза, приобретены дополнительные факторы патогенности и т. д.).
Итак, госпитальный штамм — это штамм, который в процессе циркуляции адаптировался к условиям стационара, т. е. приобрел большие возможности к паразитированию, специфичному для больных данного стационара, а именно, вирулентность, устойчивость к неблагоприятным внешним факторам, также специфичным для данного стационара, и способность вызывать групповые внутрибольничные случаи заболеваний.
Госпитальные штаммы в результате устойчивой циркуляции в лечебном учреждении приобретают дополнительные внутривидовые характеристики, позволяющие эпидемиологам устанавливать эпидемиологические связи между пациентами, определять пути и факторы передачи.
Профилактика внутрибольничных инфекций. Гигиена рук медицинских работников. Мытье рук. Техника мытья рук.
Хотя многие меры борьбы с инфекционными заболеваниями, разрабатывавшиеся для традиционных инфекций, применимы и по отношению к внутрибольничным инфекциям, существует целый ряд мер, специально разрабатывавшихся или адаптированных для профилактики внутрибольничных инфекций.
Некоторые мероприятия вкратце охарактеризованы ниже, другие представлены в соответствующих главах, посвященных отдельным формам внутрибольничных инфекций.
Гигиена рук медицинских работников
В современной литературе гигиена рук медицинского персонала рассматривается как одна из самых важных мер инфекционного контроля, позволяющая прервать цепь развития внутрибольничных инфекций (ВБИ). Традиционно различают три уровня обработки (деконтамина-ции) рук: обычное мытье рук, гигиеническую антисептику и хирургическую антисептику.
Мытье рук подразумевает использование для обработки рук воды и мыла. Обычное мытье рук подразумевает использование простого, т. е. не содержащего антимикробных компонентов, мыла. Если используется мыло, содержащее антисептик, речь идет об антисептическом мытье рук. Мытье рук требуется, когда руки заметно грязные, или контаминированы содержащим белок материалом, или видимо загрязнены кровью или другими жидкостями человеческого организма.
Более эффективной, быстрой и безопасной для здоровья медицинского персонала является антисептика рук, подразумевающая применение химических веществ, обладающих антимикробным действием и предназначенных для использования на коже или других поверхностных тканях организма человека, для деконтаминации рук. Гигиеническая антисептика рук требуется перед непосредственным контактом с пациентом; перед надеванием стерильных перчаток при постановке центрального внутри-сосудистого катетера, перед постановкой мочевых катетеров, периферических сосудистых катетеров или других инвазивных устройств (если эти манипуляции не требуют хирургического вмешательства); после контакта с неинтактной кожей пациента (например, при измерении пульса или артериального давления, перекладывании пациента и т. п.), после контакта с секретами или экскретами организма, слизистыми оболочками, и повязками, если руки не были видимо загрязнены; при переходе от конта-минированных участков тела пациента к чистым при выполнении манипуляций по уходу за пациентом, после контакта с объектами окружающей реды, включая медицинское оборудование, находящимися в непосредственной близости от пациента, а также после снятия перчаток Хирургическая антисептика рук проводится членами операционной бригады в предоперационном периоде Антисептические препараты, которые используются для хирургической антисептики рук, должны, как правило, обладать персистируюшим (остаточным) действием
Для того чтобы все участки кожи рук при мытье или антисептической обработке были эффективно деконтаминированы, рекомендуется соблюдать соответствующую технику обработки рук, представленную на рисунке.
Читайте также:

