Гранулема майокки дерматофития что это такой
Обновлено: 19.04.2024
Luchsinger I, Bosshard BP, Kasper RS, Lautenschlager S. Tinea genitalis: a new entity of sexually transmitted infection? Case series and review of the literature.
Дерматофития гениталий как новая инфекция, передающаяся половым путем?
И Лучзингер, ФП Боззхард, РС Каспер, Д Райнхардт, С Лаутеншлегер, Клиника дерматологии б-цы Триемли, Больница Унивеситета Цюриха, Швейцария
Дерматофития туловища относится к поверхностным кожным инфекциям туловища и конечностей, встречается повсеместно, но наиболее распространена в тропических странах. T. interdigitale (T. mentagrophytes) вторым наиболее частым возбудителем в мире [1]. Заражение происходит при прямом контакте от человека к человеку, либо от животного к человеку, либо при контакте с почвой. Недавно, нами неоднократно были обследованы пациенты с распространенными дерматофитиями и поражением половых органов. Дерматофития половых органов встречается реже по сравнению с паховой эпидермофитией [2 – 5]. В литературе описано несколько случаев генитальной дерматофитии [6] в сочетании с паховой эпидермофитией, онихомикозом, эпидермофитией стоп и кистей [7,8]. В одном из случаев предполагаемым источником инфекции было животное [9]. В статье описывается 7 пациентов с дерматофитией половых органов, с вероятным половым путем заражения.
Пациенты и методы
В нашей клинике проходили обследование 7 пациентов (2 женщины и 5 мужчин, в возрасте от 18 до 55 лет) до с дерматофитией половых органов, возникшей после полового контакта в Юго – Восточной Азии, в период с марта по июль 2014 года. 5 пациентов проходили лечение в больнице Триемля и 2 – в университетской клинике Цюриха. Диагностика включала в себя микроскопию, культуральное исследование и ДНК – анализ. От каждого пациента было получено информированное согласие.
Образцы для исследования были получены методом соскоба с пораженного участка. Бактериоскопическое исследование проводилось окрашиванием 5% - додецилсульфатом натрия в растворе Конго красный. Культуру выращивали на селективной агарозной питательной среде (Selektivagar für pathogene Pilze 139e-20p, heipha Dr Müller GmbH, Germany) с добавлением циклогексимида и хлорамфеникола в течение 4 недель при температуре 25. ДНК – анализ проводили методом секвенирования с использованием набора геномных ДНК (Nexttec, Германия). Транскрибируемый участок амплифицирован с использованием праймеров ITSI и ITS4. Полученные результаты ДНК – анализа были сравнимы с доступной базой данных.
Результаты
Нашей первой пациенткой стала 18 – летняя женщина европеоидного происхождения и проживающая в Японии, кожных заболеваний в анамнезе не имела. У нее были неоднократные незащищенные половые контакты с мужчиной белой расы в Тайланде. Кроме того, она постоянно бреет лобковые волосы. Через неделю после первого полового контакта у нее появились красные шелушащиеся высыпания на коже половых органов. Ее половой партнер ранее также отмечал похожие симптомы. Она использовала крем Клотримазол. Однако через 2 недели отметила распространение сыпи и появление головной боли и недомогание. Было отмечено увеличение эритематозных бляшек в размере, появление фолликулярных пустул на половых губах и лобке (Рис.1). Регионарная лимфаденопатия отсутствовала. В анализе крови – лейкоцитоз до 14х109 /л и повышенный С – реактивный белок (30.8 мг/л). При микроскопии были обнаружены гифы грибов, а при культуральном исследовании выделили T. interdigitale. Был назначен Тербинафин ежедневно в дозе 250 мг, а при подозрении на присоединение вторичной бактериальной инфекции – Амоксиклав. Из – за выраженного болевого синдрома ее госпитализировали. После двух дней воспаление стихло. На коже в области лонного сочленения образовались язвенные узелки с серозно – гнойным содержимым (Рис.2). Тербинафин был заменен на итраконазол по 100 мг 3 раза в сутки, а также перорально вводили 50 мг преднизолона. Из –за выраженного болевого синдрома пациентка была госпитализирована в течение 14 дней. После 6 – недельного приема итраконазола и 3 недель преднизолона высыпания разрешились выраженным рубцеванием.
В период с марта по июнь мы обследовали еще 6 пациентов (5 мужчин и 1 женщину) с генитальной дерматофитией. Эти пациенты сообщили, что имели половые контакты 1 – 2 недели назад в Юго – Восточной Азии. Четверо мужчин имели половые контакты с местными проститутками. Все пациенты пользовались презервативами и не использовали смазку.
До консультации в нашей клинике, пациенты самостоятельно использовали топические глюкокортикостероиды, антибиотики и антимикотики. У всех пациентов была схожая симптоматика: на коже паховой области, больших половых губ и проксимального отдела ствола полового члена были резко ограниченные эритематозные бляшки с чешуйками, а у одного пациента высыпания были на коже мошонки (Рис.3). У двоих пациентов высыпания также располагались на коже ягодиц и шеи. У одного пациента были высыпания на верхней губе, а у другого – на предплечье. У 4 пациентов образовались фолликулярные пустулы, а у 3 были увеличены паховые лимфатические узлы. У 5 пациентов отсутствовали лобковые волосы. У всех пациентов высыпания сначала появились в области половых органов, а затем распространились на другие участки.
У всех пациентов при микроскопии были обнаружены гифы грибов, а при культуральном исследовании выделен T. interdigitale. При сравнении с полиморфизмом, изученным и опубликованным Хайдеманном и соавт. [11], было выявлено, что 3 штамма соответствовали III типу T.interdigitale и 3 штамма – IV типу T.interdigitale. Вероятно, что все штаммы были изначально зоофильного происхождения. У троих пациентов бактериальный посев был отрицательным. Обследование на инфекции, передаваемые половым путем, были отрицательные.
Всем пациентам были назначены системные противогрибковые препараты. 6 пациентам был назначен Тербинафин и одному пациенту – Итраконазол. Лечение длилось от 2 до 10 недель (в среднем 5 недель). Первоначально местно пациенты использовали: крем Циклопирокс (3 пациента), крем Клотримазол (2 пациента), крем Тербинафин (1 пациент) и крем с фузидовой кислотой (1 пациент), в сочетании с галометазоном/триклозаном и свечами Бетадин. Из – за выраженного воспаления 3 пациентам был назначено лечение системным преднизолоном в течение 6 – 21 дней. Трое пациентов дополнительно получали системные антибиотики. 5 пациентам потребовалась болеутоляющая терапия. Из – за выраженного болевого синдрома 2 пациента были госпитализированы (3 и 14 дней соответственно). 5 пациентов были признаны нетрудоспособными в течение 6 – 14 дней. 4 пациента были вылечены полностью.
Такие заболевания, как сахарный диабет, атопический дерматит и развитие иммуносупрессии, как правило, способствуют развитию генитальной дерматофитии [3 – 5 – 7]. Однако, у наших пациентов не было обнаружено предрасполагающих заболеваний. Интересно, что 4 пациента с тяжелым воспалительным процессов сообщили о постоянном бритье лобковой области. Бритье приводит к нарушению эпидермального барьера, и таким образом, способствует распространению инфекции в дерму [17]. Ороговевший материал из разрушенных фолликулов остается в дерме и служит питательным субстратом для размножения грибов. Гранулема Майокки на ногах у женщин чаще связана с регулярным бритьем [18]. Следовательно, постоянное бритье половых органов способствует распространению возбудителя вглубь вдоль структуры волос.
Зоофильные штаммы T. interdigitale, выделенные у 6 пациентов, как известно, провоцируют молниеносный воспалительный процесс в организме человека [19], и необходим наиболее длительный период лечения (около 5 недель). В современной литературе описан пример длительной терапии дерматофитии лобковой области с выраженным воспалением у женщины, студентки – ветеринара, после работы на животноводческой ферме. В этом случае при культуральном исследовании был выделен T. verrucosum, который также относится к зоофильным грибам. Кроме того, у пациентки была обнаружена гранулема Майокки в области вульвы, вызванная T. mentagrophytes. Её собака считалась вероятным источником инфекции [2]. Она лечилась топическими ГКС в течение многих лет, предполагая, что у нее экзема. Она получила лечение Итраконазолом перорально по 200 мг 2 раза в день в течение 2 месяцев. Фельдман и соавт. [21] сообщают о случае грибкового поражения перигенитальных фолликулов, вызванного зоофильным T. еrinacei, которое полностью разрешилось после лечения итраконазолом по 100 мг 2 раза в день в течение 1 недели.
Выделенные штаммы относятся к зоофильным штаммам, но нет никаких предположений относительно того, как они передаются от животного к человеку. Не было возможным обследовать половых партнеров наших пациентов на предмет источника инфекции. Одна из семи культ была отрицательной, но в образце у данного пациента были обнаружены гифы гриба при бактериоскопии. Так как противогрибковое лечение имело положительный результат, мы предполагаем диагноз генитальной дерматофитии. Причиной отрицательного результата культурального исследования может являться применяемое ранее местное лечение фузидовой кислотой /грамицидином/ неомицином / нистатином в течение нескольких недель.
У 7 пациентов заражение произошло вероятно половым путем, так как первые высыпания появились на половых органах после половых контактов. Половой партнер одной пациентки имел аналогичные высыпания. Таким образом, гетеросексуальную активность наших пациентов следует рассматривать в качестве ранее недооцененного фактора передачи T. interdigitale. Наши описанные клинические случаи являются уникальными и редкими и ранее не встречались в нашей клинике. Несмотря на то, что сексуальное поведение существенно влияет на распространенность и заболеваемость дерматофитий, критерии Handsfield не выполняются. Таким образом, генитальная дерматофития должна быть признана инфекцией, которая может передаваться половым путем, как гепатит С, метициллин – резистентный золотистый стафилококк или амебиаз, но не может рассматриваться как ИППП.
В заключение, клинический диагноз генитальной дерматофитии является трудной задачей, так как высыпания могут быть истолкованы в пользу экземы, бактериального фолликулита или псориаза. Особенно рассматривать диагноз генитальной дерматофитии необходимо при половых контактах. Во избежание развития необратимой рубцовой алопеции, необходимо раннее начало противогрибкового лечения, а также обязательно выделение и идентификация возбудителя. Наконец, использование презервативов не защищает от генитальной дерматофитии, и увеличение распространения инфекции в будущем будут способствовать поездки в тропические регионы, особенно молодыми людьми.
- Резко отграниченные бляшки на эритематозном фоне, пустулы в области половых органов должны рассматриваться в пользу генитальной дерматофитии, особенно после половых контактов в Юго – Восточной Азии
- Для предотвращения рубцовой алопеции необходимо раннее начало противогрибковой терапии. Важное значение имеет выделение и идентификация возбудителя
- Появление выраженного воспалительного процесса после начатого противогрибкового лечения требует назначения системного преднизолона.
Tinea genitalis: a new entity of sexually transmitted infection? Case series and review of the literature
Эти микроскопические грибки вызывают наиболее распространенные грибковые инфекции кожи — грибок стопы (Tinea pedis), грибок стопы (Tinea cruris), грибок головы (Tinea capitis), грибок ногтей (Tinea unguium), грибок тела (Tinea unguium). Tinea corporis). Грибок тела появляется на паху, лице, волосистой части головы или бороде.
Чаще всего грибковая инфекция дерматофитов поражает поверхностный слой кожи, доходя только до эпидермиса. Иногда дерматофиты поражают также волосяные фолликулы, дерму, тогда эту инфекцию называют гранулемой Майокки. Грибковая инфекция головы и бороды повреждает волосы, но не их фолликулы.

Грибковая инфекция головы
Грибковые инфекции, вызванные дерматофитами, можно заподозрить на основании клинических признаков, но для подтверждения диагноза также рекомендуются диагностические тесты, поскольку другие кожные заболевания могут вызывать очень похожие симптомы.
Инфекцию диагностируют с помощью гидроксида калия (КОН), культивирования грибковых культур или теста на дерматофиты. Если кожная дерматофитная инфекция не распознается и для начального лечения назначается кортикостероидная мазь, клинические симптомы меняются. Тогда бывает трудно распознать грибковую инфекцию, а сама болезнь продолжает прогрессировать и может достигать более глубоких слоев кожи, дермы, волосяных фолликулов. У больных появляется эритема, перхоть, исчезает сыпь.
Грибковые инфекции дерматофитов могут одновременно преобладать на нескольких участках (например, грибок стопы и паха, грибок стопы и ногтей). Пациента необходимо тщательно обследовать с головы до пят, кожу, волосы и ногти. Некоторые пациенты с грибковыми кожными инфекциями, вызванными дерматофитами, могут испытывать вторичную кожную реакцию вдали от очага инфекции. Это приводит к иммунологической реакции на грибковую инфекцию.
Для лечения используются противогрибковые препараты местного или системного действия:
- Дерматофитные кожные инфекции, поражающие только поверхностный слой кожи, лечат с помощью местных противогрибковых препаратов, таких как бутенафин, циклопирокс, толнафтат, аллиламин.
- Нистатин, который эффективен при лечении грибковых инфекций, вызванных Candida, не подходит и неэффективен при лечении грибковых инфекций, вызванных дерматофитами.
- Системные препараты (флуканозол, гризеофульвин , итраконазол или тербинафин) используются в случаях, когда грибковая инфекция является рецидивирующей, хотя и поверхностной, или когда поражены более глубокие слои (волосяные фолликулы, дерма) и ногти.
- Пациентам не следует назначать системный препарат кетоконазол из-за возможного поражения печени, надпочечниковой недостаточности и взаимодействия с другими препаратами.
Совместное применение противогрибковых препаратов с кортикостероидами средней и тяжелой степени может быть эффективным и может облегчить симптомы поверхностной дерматофитной инфекции кожи, но не рекомендуется, поскольку кортикостероиды не являются необходимыми для успешного лечения заболевания и могут вызывать атрофию кожи (2). Сообщалось, что такое лечение (противогрибковые препараты в сочетании с кортикостероидами) было совершенно неэффективным (3–5).
Иммуносупрессивные состояния являются одним из факторов риска развития грибковых инфекций, вызванных дерматофитами, что затрудняет их лечение и повторение инфекции после излечения. Пациента с трудноизлечимой дерматофитной инфекцией следует обследовать на иммунодефицитные заболевания.
В этой статье мы обсудим наиболее частые дерматофитные кожные инфекции, их симптомы, диагностику и лечение.
Грибок стопы: диагностика и лечение
Грибок стопы (Tinea pedis) — наиболее частая дерматофитная инфекция. Грибок стопы может возникать между пальцами ног, развиваться при гиперкератозе или везикобулезе, а в очень редких случаях может вызывать язвенное повреждение кожи.
Обычно грибок стопы преобладает между пальцами ног, часто грибок ногтя и стопы (паха) развивается вместе. Грибок стопы чаще всего диагностируется у взрослых (особенно у молодых мужчин). Подсчитано, что у 70% грибок стопы будет развиваться на протяжении всей жизни. человек. Грибок стопы вызывается дерматофитами Trichophyton rubrum, Trichophyton interdigitale и Epidermophyton floccosum. Заражение чаще всего происходит при ходьбе босиком в кабинках для переодевания, саунах или бассейнах при прямом контакте с патогенами.
Пациенты с грибком стопы между пальцами ног обычно жалуются на сильный зуд, перхоть между пальцами ног, покраснение кожи. Грибок чаще распространяется под подошвой, реже повреждается тыльная сторона стопы. В частности, между третьим и четвертым пальцами возникают трещины, которые могут быть очень болезненными. Менее распространенной формой заболевания является грибок ногтей на ногах вместе с язвами, когда следует подозревать вторичную бактериальную инфекцию.
Грибок гиперкератоза стопы (также называемый грибком мокасинового типа) проявляется в виде диффузного гиперкератоза подошв, латеральных и медиальных поверхностей стопы. Кожа чешуйчатая, всегда присутствует эритема.

Грибок гиперкератоза стопы
Воспалительный или пузырчатый грибок стопы болезнен, проявляется сильным зудом, волдырями и волдырями на коже, которые могут лопнуть. Эти поражения сопровождаются выраженной эритемой. Чаще всего травмируется медиальная сторона стопы.
Основные методы диагностики — исследование царапин на коже после окрашивания КОН. Микроскопическое исследование царапин кожи, окрашенных KOH, на которых видны сегментированные гифы мицелиальных грибов, помогает отличить грибок стопы от негрибкового заболевания стопы, а в случае инфекции Candida виден кластерный грибок с псевдогифией.
При везикулярной болезни везикулы используют для микробиологических исследований (посев на специальной среде). В случае образования язв, трещин на коже следует взять мазок и исследовать культуру на вторичную бактериальную инфекцию.
В клинической практике грибок стопы можно заподозрить исключительно на основании признаков и типа поражения, но рекомендуется подтвердить диагноз клиническими испытаниями, поскольку симптомы грибковой инфекции могут быть аналогичны другим дерматологическим заболеваниям — кандидозной инфекции пальцев рук, атопическому дерматиту.
Основные цели лечения — облегчить симптомы (зуд и боль), снизить риск вторичных бактерий и остановить дальнейшее распространение грибковой инфекции как на пациента, так и на окружающих.
- Препараты первого ряда — это противогрибковые препараты местного действия, а препараты системного действия — резервные, назначаемые в случаях, когда препараты местного действия неэффективны или неэффективны сами по себе.
- Противогрибковые препараты местного действия включают аллиламин, бутенафин, циклопирокс, толнафтат. Данные метаанализа 2005 г. подтверждают эффективность местного лечения опоясывающего лишая стопы.
Противогрибковые препараты местного действия назначают 1-2 раза в день и продолжение лечения не менее 4 недель. Пациенты, нуждающиеся в системной терапии, получают итраконазол (250 мг 2 раза / сут в течение 1 недели) и тербинафин (250 мг 1 раз / сут в течение 1 недели) 2 недели) или флуконазол (150 мг 1 неделю в неделю в течение 2-6 недель).

Противогрибковые препараты местного действия
Гризеофульвин также можно использовать для лечения грибка стопы, но он не так эффективен, как другие системные противогрибковые препараты, и требует более длительного лечения (1000 мг / день в течение 4-8 недель или 660 или 750 мг / день в течение 4-8 недель).
Помимо местных противогрибковых препаратов пациентам с гиперкератозом можно назначать слабые растворы салициловой кислоты (1). Повязку, смоченную этим продуктом, следует наложить на пораженные участки и удерживать в течение 2–0 минут, повторяя процедуру 2–3 раза в день.
Грибок тела: диагностика и лечение
Tinea corporis — дерматофитическая инфекция кожи . Самый распространенный грибок тела вызывается T. rubrum. Другие патогены могут включать Trichophytontonsurans, Microsporum canis, T. interdigitale, Microsporum gypseum, Trichophyton violaceum и Microsporum audouinii.

Tinea corporis — дерматофитическая инфекция кожи
Инфекция чаще всего возникает после прямого контакта кожи с больным грибком тела, может передаваться от животных или инфекция может распространяться на самого пациента из других мест, если у него есть грибок на голове, ногах или других областях. Взрослые могут заразиться грибком тела T.tonsurans от детей с грибком головы, который часто вызывается этим возбудителем. Инфекция M. canis передается от больных кошек или собак. Возможны вспышки грибка тела у юных спортсменов, много контактирующих с другими спортсменами (баскетболистами, борцами и т. д.),
Клиническими признаками грибка на теле являются зудящие, круглые или овальные, эритематозные, шелушащиеся бляшки, эксцентрично распространяющиеся. По мере прогрессирования болезни середина сыпи становится немного светлее, а края выступают вперед. Формируются круглые кольцевые пластины.
Эти бляшки могут сливаться и образовываться волдыри. Инфекции у животных, особенно у молодых котят и щенков, более тяжелые и преимущественно воспалительные. В случае широко распространенной сыпи следует учитывать возможность иммунодефицитного заболевания (например, ВИЧ-инфекции) или диабета.
Основной метод диагностики — исследование кожных царапин с помощью раствора КОН. Дерматофиты представляют собой сегментированные нитчатые гифы. Для анализа необходимо взять срезки кожи с наиболее активного очага заболевания — края круглой пластины.
Ряд дерматологических кожных заболеваний необходимо различать между грибком тела. Подозрение, что это не грибок организма, должно быть вызвано тем, что перхоти нет, лечение малоэффективно, отрицательный ответ на тест КОН, сыпь очень часто. Грибок на теле необходимо дифференцировать от других кожных заболеваний, которые проявляются в виде кольцевой сыпи. К таким заболеваниям относятся подострая кожная красная волчанка, круговая гранулема и центробежная круговая эритема .
Причина подострой красной волчанки идиопатическая, она может быть связана с системной красной волчанкой или с применением некоторых лекарственных препаратов. Заболевание проявляется на подверженных воздействию солнечных лучей участках тела в виде круговых эритематозных бляшек перхоти.
Круговая гранулем а — доброкачественный воспалительный дерматоз. Его клинические признаки — одна или несколько эритематозных кольцевых бляшек на конечностях, но перхоть отсутствует. Центробежная циркулярная эритема — воспалительное заболевание кожи неизвестной причины, также проявляющееся кольцевидными эритематозными бляшками.



Tinea corporis эффективно лечится местными противогрибковыми средствами, такими как азолы, аллиламин, бутенафин, циклопирокс и толнафтат (2). Исследования показывают, что лечение грибка тела и стоп двумя противогрибковыми препаратами очень эффективно (изучалось действие тербинафина и нафтифина) (2). Нистатин неэффективен при лечении дерматофитных инфекций. Препараты местного действия вводят 1-2 раза / сут. 3 недели. Лечение прекращают после исчезновения всех клинических признаков.
Системное лечение назначается пациентам, у которых было неэффективное лечение местными противогрибковыми препаратами или заболевание очень распространено. Наиболее распространенными вариантами лечения являются тербинафин (250 мг 1 день / день в течение 1-2 недель) и итраконазол (200 мг / день в течение 1 недели).

Тербинафин
Гранулема Майокки: диагностика и лечение
Гранулема Майокки — более редкая грибковая дерматофитная инфекция, поражающая более глубокие слои кожи — дерму, подкожную клетчатку и волосяные фолликулы. Наиболее частым возбудителем является T. rubrum, но инфекция также может быть вызвана другими дерматофитами. Развитие гранулемы Майокки может быть вызвано травмой кожи или окклюзией волосяных фолликулов.
Бритье ног — один из факторов развития гранулем Майокки. Пациенты с ослабленным иммунитетом и нарушенным иммунитетом подвергаются повышенному риску развития гранулемы Майокки. Кортикостероидная терапия при дерматофитных поверхностных инфекциях не рекомендуется, так как это может привести к местной иммуносупрессии и развитию гранулемы Майокки.
Клинические признаки инфекции возникают на локализованном участке тела, где видны эритематозные, перифоликулярные папулы или небольшие узелки, пустулы. У пациентов с иммуносупрессивными состояниями подкожно могут образовываться узелки и абсцессы. В редких случаях также возможно распространение болезни.

Гранулема Майокки
Заболевание диагностируется на основании истории болезни пациента и клинических признаков, диагноз подтверждается биопсией кожи, а патогистологическое обследование подтверждает наличие грибковых форм в дерме. Ответ на опрос посевов помогает определить точного возбудителя. Тест с КОН может быть отрицательным, поскольку грибковая инфекция в этом случае развивается в более глубоком слое кожи.
Местные противогрибковые препараты для лечения гранулем Майокки неэффективны, потому что они не проникают через дерму и подкожно. Рекомендуется лечение системными противогрибковыми препаратами. Обычная рекомендация — тербинафин 250 мг 1 в / день. 2–6 недель, продолжительность лечения зависит от реакции на лечение. Лечение продолжают до исчезновения всех клинических признаков.
Резюме
Грибковые инфекции кожи чаще всего вызываются дерматофитами из родов Trichophyton, Epidermophyton и Microsporum. Эти дерматофиты метаболизируют кератин и могут встречаться в различных частях тела — ногах, паху, голове, ногтях, волосах бороды, могут повредить более глубокий слой кожи, дерму и волосяные фолликулы.
Грибковые инфекции, вызванные дерматофитами, часто можно заподозрить, оценив клинические признаки, но диагноз также должен быть подтвержден тестами. В случае ошибочного диагноза пациенту могут быть назначены кортикостероиды, что затрудняет как подтверждение дерматофитного диагноза, так и сам процесс заживления.
Большинство кожных инфекций, вызванных дерматофитами, излечимы с помощью местных противогрибковых препаратов, таких как азол, аллиламин, циклопирокс, бутенафин и толнафтат.
Источники
- Adam O Goldstein, et al. Дерматофитные (дерматофитные) инфекции. 2019 г. UpToDate.
- Эль-Гохари М. и др. Местные противогрибковые препараты для опоясывающего лишая и тинея тела. Кокрановская база данных Syst Rev 2014.
- Гринберг Х.Л. и др. Клотримазол / бетаметазона дипропионат: обзор затрат и осложнений при лечении распространенных кожных грибковых инфекций. Pediatric Dermatol 2002.
- Розен Т., Елевски Б.Е. Неэффективность крема клотримазола-бетаметазона дипропионата при лечении инфекций Microsporum canis. J Am Acad Dermatol 1995.
- Гольдштейн А.О. и др. Грибковые инфекции. Эффективное лечение заболеваний кожи, волос и ногтей. Гериатрия. 2000.
- Кроуфорд Ф., Холлис С. Местные методы лечения грибковых инфекций кожи и ногтей стопы. Кокрановская база данных Syst Rev 2007.
- Гупта А. К., Купер Е. А.. Обновление противогрибковой терапии дерматофитий. Микопатология 2008.
Кольцевидная гранулема — это хроническое доброкачественное поражение кожи, которое имеет невыясненный этиопатогенез. Заболевание проявляется кольцевидными высыпаниями на коже, которые состоят из плотных багровых или кирпично-красных узелков, может протекать в локализованной, генерализованной или атипичной форме. Для диагностики состояния требуется тщательный клинический осмотр, гистологическое исследование биоптатов пораженных участков, расширенное лабораторное обследование. Лечение включает топические кортикостероиды, ретиноиды, иммуносупрессоры, аппаратные методы фракционного фототермолиза, криодеструкции.
МКБ-10
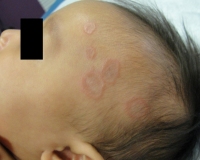
Общие сведения
Болезнь впервые описана английским ученым Т. Фоксом. В дерматологии отсутствуют масштабные исследования этого заболевания, поэтому частота встречаемости точно не установлена, и схемы лечения еще не разработаны окончательно. Женщины болеют в 2-2,5 раза чаще. Существует два возрастных пика заболеваемости: локализованная форма кольцевидной гранулемы типична для молодых больных до 30 лет, причем в большинстве случаев она имеет благоприятное течение, а распространенная форма возникает у людей старше 50 лет, сочетается с другими соматическими патологиями, с трудом поддается терапии.

Причины
В современной дерматологии до сих пор не определены точные этиологические факторы развития болезни. Ранее считалось, что патология носит идиопатический характер, однако новые исследования доказывают участие различных эндогенных нарушений здоровья и экзогенных факторов в механизме ее развития. На сегодня описаны следующие группы триггеров, специфичных для кольцевидной гранулемы:
- Отягощенная наследственность. Хронический дерматоз ассоциирован с генами главного комплекса гистосовместимости (HLA), причем для локализованных форм типично присутствие антигена HLA-B8, а для диссеминированной — антигена HLA-A29.
- Сахарный диабет. Люди с нарушениями обмена глюкозы намного чаще сталкиваются с симптомами кольцевидной гранулемы, для них характерна распространенная форма дерматоза с локализацией элементов на разных участках тела. Патология наиболее часто наблюдается при сахарном диабете 1-го типа, может возникать уже в детском возрасте.
- Хронические болезни. Провоцирующим фактором кожных поражений может выступать саркоидоз, ревматизм, аутоиммунный тиреоидит. Риск появления дерматоза резко повышается у больных с хроническим гепатитом В, туберкулезом.
- Злокачественные опухоли. По данным ряда авторов, появление кожных высыпаний возможно на фоне солидных опухолей молочной железы, шейки матки, предстательной железы, желудочно-кишечного тракта. Изредка причиной гранулемы становится онкопатология крови (лимфома Ходжкина, острый миелобластный лейкоз).
- Экзогенные факторы. Некоторые авторы связывают заболевание с чрезмерным и продолжительным по времени действием ультрафиолетового излучения. Иногда дерматоз развивается после укусов насекомых.
- Прием медикаментов. Триггером заболевания выступает туберкулиновая проба Манту, вакцинация против туберкулеза. Лечение препаратами золота, некоторыми противовоспалительными и гипотензивными медикаментами также может спровоцировать патологию.
Патогенез
Механизм развития кольцевидной гранулемы объясняется типичной реакцией гиперчувствительности замедленного типа, которая возникает идиопатически в ответ на действие неизвестных антигенов. В патогенезе важная роль отводится антигенпрезентирующим макрофагам, дендритным клеткам. Все клеточные элементы обеспечивают фагоцитоз антигена и его презентацию Т-лимфоцитам, что завершается пролиферацией антигенчувствительных клонов Th1.
При патоморфологическом исследовании в очаге кожного поражения определяются Th1-лимфоциты, повышенный уровень провоспалительных агентов: гамма-интерферона, фактора некроза опухолей, интерлейкинов второго и четвертого типов. Этот процесс завершается ограниченной дегенерацией коллагеновых волокон дермы, что отличает патологию от диффузного липоидного некробиоза.
Учитывая гистологическую картину, выделяют два варианта кольцевидной гранулемы: интерстициальный и палисадниковый. При интерстициальном типе заболевания между волокнами дермы формируются скопления муцина и гистиоцитов. Для палисадникового варианта дерматоза типичны гранулематозные инфильтраты в сосочковом слое дермы, в центре которых определяются скопления лейкоцитарных клеток в виде частокола.
Симптомы кольцевидной гранулемы
Локализованная форма
Такой вид патологии обычно встречается в практике дерматолога. Повреждение кожи представлено одним или несколькими округлыми очагами диаметром 1-5 см, края которых возвышаются над поверхностью кожи. Они состоят из тесно расположенных узелков розового либо синюшного оттенка. Центральная часть очагов представлена слегка пигментированной кожей. Очаги склонны к периферическому росту.
Для локализованной формы дерматоза характерно отсутствие шелушения и других вторичных элементов сыпи. Высыпания располагаются на тыльной стороне кистей, разгибательных поверхностях локтевых и коленных суставов, спереди голеней. Типично поражение мест, которые подвергаются хронической травматизации, имеют минимальный слой подкожной клетчатки. Кольцевидная гранулема не сопровождается зудом, болью или другими дискомфортными ощущениями. Хорошо поддается традиционным схемам лечения.
Генерализованная форма
Диссеминированный вариант болезни диагностирует у 8,9% больных. Средний возраст пациентов поражения кожи составляет 52 года. Состояние проявляется множественными изолированными или сливающимися высыпаниями, которые преимущественно размещаются на шее, туловище, ладонях и подошвах. Сыпь имеет вид узелков синюшного, желто-коричневого или телесного цвета, которые сопровождаются кожным зудом.
Подкожная форма
Данный вид патологии характерен для детского возраста, хотя описано несколько случаев дерматоза у взрослых. На кожных покровах возникают плотные безболезненные узлы не более 4 см в диаметре. Они преимущественно расположены на волосистой части головы, в периорбитальной зоне, на нижних конечностях — в области ягодиц, передневнутренней поверхности голеней, тыльной стороны стопы. Эти элементы подобны ревматоидным узелкам.
Перфорирующая форма
Редко встречающийся и наиболее опасный вариант патологии, который преимущественно выявляется у жителей Гавайских островов. Очаги дерматоза локализованы на тыле кистей, туловище, нижних конечностях. Высыпания представлены милиарными или лентикулярными папулами с пупковидным вдавлением в центральной части, которые могут вскрываться с выделением желатинообразной жидкости. После заживления элементов остаются атрофические рубцы.
Пятнистая форма
Такая разновидность кольцевидной гранулемы наиболее характерна для женщин старше 40 лет. Кожные элементы покрывают туловище, конечности, изредка дерматоз приобретает генерализованный характер. Больные замечают пятна красного, кирпичного или синюшного цвета с однородной окраской, которые не болят и не зудят, доставляют только эстетический дискомфорт.
Осложнения
Хотя кольцевидная гранулема является доброкачественным заболеванием, она может обусловить негативные последствия. Наиболее тяжело протекает генерализованный вариант дерматоза, лечение которого затруднено даже при использовании современных аппаратных методик. К тому же многие пациенты в течение нескольких месяцев или лет после прохождения терапевтического курса сталкиваются с рецидивами высыпаний.
Поскольку у страдающих кольцевидной гранулемой поражение распространяется на глубокие участки дермы, заживление крупных очагов дерматоза может происходить через стадию образования рубца. На кожном покрове пациентов появляются неэстетичные ярко-розовые шрамы, которые спустя 3-4 месяца заметно светлеют, а затем на протяжении полугода приобретают плотную структуру и окончательный вид.
Неэстетичные кожные проявления кольцевидной гранулемы не влияют на общее состояние здоровья, не вызывают системных осложнений. Необходимость своевременного обращения к врачу в большей степени продиктована важностью дифференциальной диагностики и исключения более опасных видов дерматозов, которые по клиническим признакам могут быть похожи на гранулему.
Диагностика
В типичных случаях постановка диагноза кольцевидной гранулемы выполняется врачом-дерматологом на основании данных клинического осмотра и сбора детального анамнеза. Поскольку для дерматоза характерен полиморфизм симптоматики, своевременное выявление патологии часто затруднено. Для подтверждения диагноза и начала лечения используются следующие методы исследования:
- Гистологический анализ. При исследовании биоптатов кожи поврежденных участков определяются клеточные инфильтраты в средних и нижних слоях дермы, очаги коагуляционного некроза, дегенерация коллагеновых волокон. Клеточный состав представлен лимфоцитами, гистиоцитами, фибробластами.
- Анализы крови. При локализованных вариантах кольцевидной гранулемы изменения в клинических и биохимических исследованиях отсутствуют. При диссеминированном варианте возможны проявления дислипидемии, гипертриглицеридемии, повышение СОЭ и острофазовых белков.
- Иммунограмма. Поскольку в патогенезе болезни важную роль играют аллергические реакции, для получения полной картины врачу требуются показатели разных фракций Т-лимфоцитов, уровней иммуноглобулинов, провоспалительных цитокинов.
- Микробиологическая диагностика. Исследования проводятся, чтобы исключить инфекционные дерматозы, клинические симптомы которых бывают сходны с проявлениями кольцевидной гранулемы, а также для проверки на хронические инфекции как типичный триггер заболевания.
- Консультации специалистов. При подозрении на хроническую соматическую патологию, которая спровоцировала развитие кольцевидной гранулемы, больному необходимо пройти расширенное обследование у эндокринолога, ревматолога, онколога.
Дифференциальная диагностика
При атипичных клинических вариантах необходимо произвести дифференциальную диагностику с инфекционными поражениями кожи (туберкулезная лепра, бугорковый сифилис), другими хроническими дерматозами (стойкой возвышающейся эритемой, кольцевидной формой липоидного некробиоза). Также требуется исключить мелкоузловой саркоидоз, ревматические узелки.
Лечение кольцевидной гранулемы
Медикаментозная терапия
Четкие клинические протоколы лечения кольцевидной гранулемы не разработаны. У детей дерматоз в основном регрессирует самостоятельно, взрослым, как правило, требуется специфическая терапия. Лечение подбирается врачом индивидуально с учетом клинической формы болезни, размеров и локализации высыпаний, степени эстетического дискомфорта. Используются следующие группы препаратов:
- Кортикостероиды. Для лечения местного воспалительного процесса применяются топические гормональные препараты в форме мазей и кремов. Поскольку патологические изменения происходят глубоко в дерме, рекомендуется вводить сильные стероиды, которые гарантированно окажут лечебный эффект. Лечение может включать инъекционное ведение гормонов внутрь кольцевидных очагов.
- Ретиноиды. Для улучшения гистологической структуры и внешнего вида пораженных кожных покровов рассматривается возможность подбора местных средств с ретинолом, его производными. В редких случаях лечение дополняется приемом системных ретиноидов.
- Иммуносупрессоры. Эффективны при диссеминированной кольцевидной гранулеме, чтобы повлиять на патогенетические механизмы ее образования и ускорить регресс очагов, покрывающих кожу. Ограниченную эффективность в лечении показывают медикаменты из группы сульфонов.
- Гиполипидемические средства. При генерализованной гранулеме у пациентов нередко наблюдаются явления гиперлипидемии и дислипидемии, которые требуют медикаментозной коррекции. Для повышения результативности лечение этими препаратами дополняется диетотерапией.
- Моноклональные антитела. Лечение тяжелых рецидивирующих форм заболевания может проводиться с применением препаратов, ингибирующих фактор некроза опухолей. Эти средства угнетают патофизиологические механизмы поражения дермы, уменьшают воспалительный компонент дерматоза.
Немедикаментозное лечение
Перспективным направлением лечения патологии считается фракционный фототермолиз. Лечение основано на обработке кожных элементов микролучами эрбиевого лазера, которые вызывают ограниченное разрушение клеток (микротермические лечебные зоны). Локальное воздействие запускает процессы регенерации здоровой кожи, способствует уменьшению или полному исчезновению высыпаний.
Чтобы ликвидировать большие очаги кольцевидной гранулемы, на открытых частях тела может быть показано малоинвазивное лечение. Для устранения косметического дефекта назначается лечение методами лазеродеструкции, криотерапии. Подобные методики проводятся только после курса консервативного лечения и спустя определенное время после диагностики болезни, поскольку не исключено самопроизвольное разрешение высыпаний.
Прогноз и профилактика
Комплексное лечение локализованной кольцевидной гранулемы способствует регрессу дермальных воспалительных очагов, поэтому прогноз для пациентов с данной формой патологии благоприятный. При генерализованном варианте дерматоза и редких формах гранулематозного поражения прогноз сомнительный, поскольку лечение не всегда эффективно, а вероятность рецидива составляет около 40%.
В профилактике болезни на первое место ставится своевременное выявление и лечение эндокринной патологии, системных заболеваний соединительной ткани, злокачественных опухолей. Рекомендуется избегать длительного пребывания на солнце в полуденные часы, а в периоды повышенной активности ультрафиолетовых лучей стоит использовать качественные солнцезащитные средства.
1. Опыт применение кольцевидного фототермолиза в терапии кольцевидной гранулемы/ М.Г. Харчилава, Г.Н. Пономаренко, В.Н. Плахов// Вопросы курортологии физиотерапии и лечебной физической культуры. — 2019. — №3.
3. Множественная кольцевидная эритема/ А.Н. Хлебникова, Ю.В. Молочкова, М.В. Эмирбекова// Российский журнал кожных и венерических болезней. — 2015. — №4.
Кафедра патологической анатомии ГБОУ "Первый МГМУ им. И.М. Сеченова"
Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова, Москва
Иммунное гранулематозное воспаление как приспособительная реакция организма
Журнал: Архив патологии. 2014;76(4): 39‑44
Пауков В.С., Коган Е.А. Иммунное гранулематозное воспаление как приспособительная реакция организма. Архив патологии. 2014;76(4):39‑44.
Paukov VS, Kogan EA. Immune granulomatous inflammation as the body's adaptive response. Arkhiv Patologii. 2014;76(4):39‑44. (In Russ.).
Кафедра патологической анатомии ГБОУ "Первый МГМУ им. И.М. Сеченова"
На основании собственных исследований и анализа литературы авторы выдвигают гипотезу о приспособительном характере хронического иммунного гранулематозного воспаления, возникающего при инфекционных заболеваниях, характеризующихся развитием нестерильного иммунитета. Предлагаемая гипотеза позволяет утверждать, что не всякое хроническое воспаление является выражением несостоятельности защитных сил организма при взаимодействии с повреждающим фактором. На примере туберкулеза и лепры показана несостоятельность ряда существующих представлений о пато- и морфогенезе эпителиоидно-клеточной и лепрозной гранулем. Авторы считают, что при туберкулезе резидентные макрофаги сохраняют функцию уничтожения микобактерий, благодаря чему иммунная система получает информацию об антигенных детерминантах возбудителей. Израсходовав все гидролазы на уничтожение микобактерий, макрофаги не образуют новые лизосомы из-за способности возбудителей препятствовать их образованию. В результате макрофаг, лишенный лизосом, трансформируется в эпителиоидную клетку, которая, сохраняя функцию фагоцитоза, теряет способность убивать возбудителей. Именно в ней протекает эндоцитобиоз. Периодически эти микроорганизмы разрушают эпителиоидную клетку и выпадают в зону творожистого некроза гранулемы. Часть из них вновь фагоцитирует эпителиоидные клетки для поддержания нестерильного иммунитета, а остальные уничтожаются воспалительными макрофагами. Принципиально аналогично протекает пато- и морфогенез лепрозной гранулемы, особенно ее туберкулоидного типа. Таким образом поддерживается нестерильный иммунитет, характерный для туберкулеза, лепры и, возможно, для других микобактериозов.
Кафедра патологической анатомии ГБОУ "Первый МГМУ им. И.М. Сеченова"
Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова, Москва
Настоящая работа является анализом как собственных многолетних разнообразных исследований воспаления, так и известных фактов и представлений о нем на основе закономерностей общей патологии в соответствии с взглядами И.В. Давыдовского [1, 2] о причинности в медицине и А.И. Струкова [5] о единстве структуры и функции.
Воспаление определяют как реакцию организма, направленную на уничтожение повреждающего фактора, его элиминацию и репарацию возникших повреждений. Сейчас уже не возникают дискуссии по поводу приспособительного характера острого воспаления. Вместе с тем хроническое воспаление рассматривается как выражение несостоятельности защитных сил организма при взаимодействии с повреждающим фактором, в том числе и с инфекционным возбудителем, и поэтому оно не может иметь адаптивного значения [2, 3, 7, 17].
Причины такой несостоятельности защитных систем могут быть разными - от биологических особенностей возбудителя до иммунодефицита, развившегося у больного [3, 8, 14, 15]. Поэтому хроническое воспаление не способно выполнить функцию, делающую воспаление как общебиологическую реакцию приспособительным процессом, так как не может уничтожить патогенный фактор или не способно воспрепятствовать перманентному возникновению рецидивов воспалительной реакции и обеспечить полноценную регенерацию поврежденных тканей. По мере увеличения длительности хронического воспаления нередко развивается вторичный иммунный дефицит, что еще больше снижает способность организма уничтожать патогенный фактор, а, следовательно, и завершить воспалительный процесс [4]. При этом возникает каскад других патологических реакций в разных органах, развивается порочный круг и хроническое воспаление становится типично патологическим процессом [3].
Это в первую очередь относится к хроническому гранулематозному воспалению, которое характерно для инфекций, сопровождающихся нестерильным иммунитетом, таким как туберкулез, лепра и некоторые другие. Пока что никто убедительно не объяснил, зачем организму нужен нестерильный иммунитет, но именно такой иммунитет характерен для хронических иммунных гранулем, в первую очередь для туберкулеза, лепры, особенно для ее туберкулоидного типа, возможно, и для некоторых других микобактериозов. Однако, несмотря на множество исследований этих болезней, особенно туберкулеза и лепры, в их патогенезе остается много неясного. Поэтому специалисты в своей практике пользуются сложившимися представлениями, часто не имеющими убедительных обоснований или объяснений.
Так, принято считать, что в формировании туберкулезной эпителиоидно-клеточной гранулемы и гранулемы при туберкулоидном типе лепры ведущую роль играет тот факт, что резидентные макрофаги теряют способность уничтожать микобактерии и поэтому в них происходит лишь эндоцитобиоз [7, 16]. Полагают, что это связано с особенностями бактерий, которые могут блокировать функцию лизосом [10]. Однако при анализе этого постулата возникает ряд вопросов.
Если макрофаги не способны уничтожать микобактерии туберкулеза, то каким образом и откуда иммунная система получает информацию об их антигенных детерминантах? Без такой информации невозможно формирование клеточного иммунитета по типу гиперчувствительности замедленного типа. Вместе с тем если макрофаги не уничтожают микобактерии, то возбудители должны размножаться внутри этих фагоцитов и в таком случае при туберкулезе и лепре количество микобактерий должно прогрессивно и быстро увеличиваться, что не может не сопровождаться нарастающей тяжелой интоксикацией с яркими клиническими и морфологическими проявлениями. Однако интоксикация развивается на более поздних этапах болезни и связана в основном с нарастающим казеозным некрозом и генерализацией процесса. Кроме того, при такой ситуации количество макрофагов должно быстро увеличиваться, так как их фагоцитарная функция сохраняется, а масса микобактерий также быстро нарастает. В этом случае гранулема достигала бы очень больших размеров и имела черты макрофагальной гранулемы, либо макрофаги не смогли бы локализоваться лишь в области гранулемы и распространялись с кровотоком, обусловливая генерализацию процесса. Если в макрофагах происходит эндоцитобиоз, то в чем смысл их трансформации в эпителиоидные клетки, которые практически не содержат лизосом, не образуют фагоцитарную вакуоль и, следовательно, не могут уничтожать микобактерии туберкулеза?
С этих позиций многое становится понятным в пато- и морфогенезе туберкулеза и лепры, если учесть, что эти болезни также характеризуются нестерильным иммунитетом, т.е. для поддержания иммунитета как основного фактора защиты организма необходимо сохранение микобактерий. Наилучшим механизмом такой защиты является образование иммунной гранулемы. Однако для этого иммунная система вначале должна получить информацию об антигенных детерминантах возбудителей, для чего необходимы резидентные макрофаги с их обычной фагоцитарной функцией и большим количеством лизосом в цитоплазме. Без уничтожения возбудителя антиген не может быть выявлен.
При первичном инфицировании гранулемы нет, но есть первичный аффект, представляющий собой очаг некроза, вызванного микобактериями, и перифокального серозного воспаления. При этом закономерно в зоне воспаления появляются резидентные, а затем воспалительные макрофаги. Они содержат большое количество лизосом, фагоцитируют микобактерии, образуют фагоцитарную вакуоль и уничтожают их с помощью гидролаз лизосом, выявляя при этом антигенные детерминанты возбудителя, передают информацию о них в иммунную систему, которая начинает нарабатывать CD4 + T-лимфоциты подтипа T h1 (рис. 1, а б). Рисунок 1. Макрофаг из области первичного туберкулезного аффекта. а — цитоплазма макрофага содержит множество микобактерий туберкулеза и лизосом (стрелки). ×18 000. Рисунок 1. Макрофаг из области первичного туберкулезного аффекта. б — фагоцитарная вакуоль, в которой расположена микобактерия туберкулеза (стрелка). ×42 000. Эти лимфоциты в свою очередь стимулируют макрофаги, а также дендритные клетки к продукции провоспалительных цитокинов, усиливают экспрессию костимуляторных молекул, активные метаболиты кислорода, производные азота и др. [9, 12]. Однако для передачи информации в иммунную систему и ее первичного ответа требуется около 3 нед, но в начале инфицирования должна формироваться нормергическая ответная реакция, которая не может остановить размножение возбудителей. Возможно, это связано с недостаточным количеством резидентных макрофагов в зоне первичного аффекта. В таком случае макрофаги будут фагоцитировать микобактерий больше, чем могут уничтожить с помощью гидролаз своих лизосом.
Мы проверили в эксперименте такую возможность, создав условия для фагоцитоза макрофагами туши, после чего вводили в ту же ткань взвесь стафилококков [4, 6]. Было установлено, что макрофаги фагоцитируют тушь и образуют фагоцитарные вакуоли. Если при этом остается часть лизосом, то затем при инфицировании ткани стафилококками макрофаги их фагоцитируют и уничтожают. Однако если количество фагоцитированных капель туши столь велико, что все лизосомы расходуются на образование фаголизосом, то поглощенные затем микроорганизмы не уничтожаются лизосомами и вокруг них не образуются фагоцитарные вакуоли. По существу в макрофагах происходит эндоцитобиоз. Таким образом, эндоцитобиоз может развиваться в макрофагах при фагоцитозе ими количества возбудителей, превышающего потенциальные возможности этих клеток.
Не исключено, что при первичном инфицировании туберкулезом и лепрой происходит то же самое и переполненные микобактериями, но не имеющие возможности их уничтожить макрофаги, с одной стороны, служат источником сенсибилизации организма, а с другой - могут способствовать прогрессированию первичного аффекта или лепроматоидного очага и образованию отсевов в различных органах.
В эпителиоидной клетке микобактерии находятся в дормантном состоянии, т.е. в состоянии своеобразного анабиоза, на что указывают и липидные скопления, состоящие из жирных кислот с длинными цепями, замедляющие их рост [16]. При этом они теряют часть генов и, следовательно, в них меняется генетический код и изменяются какие-то свойства, но они живы, в них протекает метаболизм [19, 20]. Не исключено, что метаболиты они получают за счет распада цитоплазмы эпителиоидной клетки и в конце концов разрушают ее, выпадая в окружающую ткань и вызывая в ней творожистый некроз. С таким механизмом образования казеоза согласны не все микробиологи. Разумеется, нельзя исключить развитие некроза и в результате действия Т-лимфоцитов, провоспалительных интерлейкинов и др., однако примечательно, что такой некроз возникает именно в туберкулезной гранулеме. Вокруг очага казеозного некроза, как известно, располагаются эпителиоидные клетки и макрофаги, которые вновь фагоцитируют микобактерии. При этом коль скоро антигенные детерминанты уже известны иммунной системе, новые возбудители ей не нужны, и они уничтожаются макрофагами, имеющимися в эпителиоидно-клеточной или лепроидной гранулеме. Необходимое количество микобактерий, дав новый стимул иммунной системе, вновь оказывается в эпителиоидных клетках. Тем самым поддерживается нестерильный иммунитет. Если часть живых микобактерий ускользнет из очага казеозного некроза, на их пути окажутся Т h1 -лимфоциты, воспалительные макрофаги и гигантские клетки Пирогова-Лангханса, которые фагоцитируют их и, возможно, дублируют функции эпителиоидных клеток. Вместе с тем активированные Т h1 -лимфоциты в качестве клеток памяти могут сохраняться годами.
Принципиально аналогичная ситуация наблюдается и при лепре, особенно при ее туберкулоидном типе, который также характеризуется образованием иммунной гранулемы, содержащей специфические пенистые макрофаги - клетки Вирхова, лимфоциты и эпителиоидные клетки. Различают два основных типа лепрозных гранулем - лепроматозный и туберкулоидный, между которыми несколько промежуточных типов. Можно провести аналогию между первичным аффектом при туберкулезе и лепроматозным типом лепры, с которого обычно начинается заболевание, когда много лепрозных клеток, т.е. макрофагов, при этом в них также скапливаются микобактерии, что расценивается как эндоцитобиоз, и иммунный ответ выражен отчетливо меньше, чем при туберкулоидном типе лепры. Туберкулоидный тип морфологически весьма схож с эпителиоидно-клеточной туберкулезной гранулемой. Эпителиоидные клетки не содержат лизосом, в них много микобактерий, находящихся в дормантном состоянии, но нет фагоцитарных вакуолей (рис. 3). Рисунок 3. Лепрозная гранулема, туберкулоидный тип. Эпителиоидная клетка содержит микобактерии лепры, но в ее цитоплазме нет лизосом. Сами микобактерии расположены в липидных каплях, образованных жирными кислотами (рис. 4), Рисунок 4. Лепрозная гранулема, туберкулоидный тип. В эпителиоидной клетке микобактерии расположены в липидных каплях, образованных жирными кислотами. которые микобактерии, находясь в дормантном состоянии, используют для своей жизнедеятельности [18]. Подобные же липидные капли в эпителиоидных клетках и в клетках Пирогова-Лангханса обнаруживаются и при туберкулезе.
Разумеется, лепра - это не туберкулез и нельзя искать в этих иммунных гранулемах полной аналогии, хотя обе болезни имеют много переходных форм, лишь часть имеет четкую форму гранулемы. Однако сами иммунные гранулемы имеют принципиальное сходство - и структурное, и функциональное.
Заключение
Таким образом, предложенная гипотеза ставит под сомнение ортодоксальный постулат о том, что хроническое воспаление всегда есть проявление неспособности организма обеспечить свою защиту от повреждающего фактора и поэтому является сугубо патологическим процессом. Она позволяет некоторые виды хронического воспаления, по крайней мере хроническое иммунное гранулематозное, рассматривать как приспособительный процесс, не только обеспечивающий защиту организма от генерализации инфекции, во всяком случае до тех пор, пока сохраняется достаточно высокая функция его иммунной системы, но и предохраняющий его от повторного заражения определенными микобактериями.
О том, что в организме здоровых людей, но перенесших инфицирование или заболевание туберкулезом, сохраняются микобактерии в очагах Гона, Симона и др., свидетельствует наличие у них специфических аллергических реакций, выявляемых известными пробами, а также то, что при ослаблении иммунитета у инфицированных больных в результате разнообразных дополнительных воздействий на иммунную систему развивается обострение туберкулеза и при этом гранулемы теряют черты эпителиоидно-клеточных. Мы понимаем, что эта гипотеза достаточно дискуссионна, может вызвать ряд возражений и нуждается в каких-то уточнениях, но полагаем, что она может заставить отказаться от сложившихся шаблонов и быть стимулом для попытки иного осмысления не вполне понятных механизмов патогенеза многих заболеваний и их осложнений.
На этом примере хотелось бы подчеркнуть, что если мы порой не можем что-то понять и объяснить какой-то феномен, повторяющийся у всех больных на протяжении многих сотен лет, не надо искать дефект в защите организма в виде нарушения функций определенных клеток - макрофагов, лейкоцитов, лимфоцитов и др. Если исходить прежде всего из целесообразности всех реакций организма и общих закономерностей развития патологических процессов, то часто за кажущимся дефектом защиты организма скрывается своеобразное приспособление. Понимание этого представляется нам принципиально важным для раскрытия патогенеза многих заболеваний и патологических процессов.
Читайте также:

