Гранулематозное воспаление при туберкулезе
Обновлено: 23.04.2024
Гранулематоз Вегенера и туберкулез. Туберкулез и аспергиллез легких.
Особый язвенно-некротический, респираторный вариант аллергического васкулита, известный как гранулематоз Вегенера, который мы наблюдали у отдельных больных, может также в какой-то мере напоминать остро или подостро протекающий диссеминированный туберкулез легких. При этом ряд авторов отмечают четыре часто последовательно развивающиеся стадии болезни. Вначале, в I стадии, помимо общих функциональных нарушений, анемии, лейкоцитоза, левого сдвига нейтрофилов, в части случаев эозинофилии и ускорения РОЭ, наблюдается гнойно-язвенный и гранулематозный процесс в носу, придаточных полостях, среднем ухе и трахее. При II стадии в легких оппеделяются множественные типичные гранулематозные узелки и инфильгративного типа фокусы. В результате почечной недостаточности и уремии на почве некротического очагового гломерулонефрита эта стадия болезни заканчивается летально.
Следует, однако, иметь в виду, что все указанные изменения могут иметь стертый характер и, в частности, не сопровождаться поражением верхних дыхательных путей (так называемая обезглавленная форма гранулематоза Вегенера). В этих случаях диагноз может быть подтвержден обнаружением при биопсии очагово-некротического васкулита.
Все чаще приходится теперь встречать больных, страдающих пневмомикозами различной этиологии, которые по своей клинико-рентгенологической картине нередко походят на диссеминированный туберкулез легких. К ним относятся, например, аспергиллез, большей частью имеющий вторичный, реже первичный характер. В первом случае он является эндогенным и обычно осложняет различные хронические заболевания легких и прежде всего туберкулез. Во втором случае — он носит экзогенный характер и протекает остро или хронически.
Острый первичный бронхо-легочный диссеминированный аспергиллез начинается под видом пневмонии, с высокой лихорадкой, кашлем, с выделением нередко кровянистой мокроты, одышкой и другими симптомами интоксикации. В легких прослушиваются преимущественно крепитирующие хрипы, а рентгенологически определяются множественные, различной величины, инфильтративного характера очаги и фокусы, иногда с наклонностью к распаду. Хронический аспергиллез протекает более торпидно, волнообразно и указанные выше симптомы при нем выражены в меньшей степени. В этих случаях в легких можно обнаружить различной величины рассеянные, четко контурированные очаги интерстициального склероза, что и дает повод заподозрить наличие диссеминированного туберкулеза. Однако по ряду признаков он отличается от аспергиллеза. При последнем отмечаются наклонность к частым кровохарканьям, а иногда и легочным кровотечениям; отхаркивание пушистых темно-коричневых или желтовато-зеленых комочков, представляющих собой скопления мицелия грибов; большое содержание эозинофилов в мокроте и крови; наличие в мокроте аспергилл различного типа: положительные реакция Оухтерлони и кожная проба с аопергиллином. Обнаруженные при рентгенологическом исследовании изменения локализуются преимущественно в средних и нижних отделах легких. При диссеминированном бронхо-легочном аспергиллезе отсутствует эффект от туберкулостатической терапии и в то же время он может быть, хотя и не всегда, достигнут при применении нистатина, леворина, йодида калия, амфотерицина В, микосептина и др.

В какой-то мере диссеминированный туберкулез напоминает и другое грибковое заболевание — кокцидиоидный микоз. Хотя первые сведения об этой болезни относятся еще к концу прошлого века, интерес к пей проявился только в последние десятилетия. Кокцидиомикоз встречается преимущественно в юго-западных штатах США, главным образом в Калифорнии, где почти 2/з местного населения, а также домашних и диких животных инфицированы им. Распространено это заболевание также в разных странах Южной Америки (Мексика, Аргентина, Венесуэла и др.). Спорадические случаи кокцидиоидного микоза встречаются, особенно в последнее время, в европейских государствах. Отдельных таких больных наблюдали в СССР А. Н. Аравийский и П. Н. Кашкин (1960), А. М. Ариевич и др. (1969), А. М. Ариевич и М. М. Чаусовская (1973) и др.
Между тем ряд признаков позволяет различить эти патологические процессы. К ним относятся преимущественно эндемический характер распространения кокцидиоидного микоза, его неконтагиозный характер; часто удовлетворительное общее состояние больных, несмотря на выраженные изменения в легких; своеобразная локализация очагов в легких; отсутствие при наличии полостей распада микобактерий в мокроте и обнаружение в ней сферул coccidioides immitis; отрицательные туберкулиновые пробы и положительные внутрикожные реакции на кокцидиоидин и серологические реакции агглютинации, преципитации и связывания комплемента; безуспешность туберкулостатической и эффект от противогрибковой терапии нистатином и леворином, амфотерицином В. Иногда в целях дифференциальной диагностики приходится прибегать к пункции печени, лимфатических узлов или легкого. Однако следует иметь в виду, что цито-или гистологическая картина обнаруживаемых изменений не всегда типична и может напоминать туберкулез. В этих случаях диагноз подтверждается обнаружением в мокроте сферул coccidioides immitis.
Особенно трудным становится распознавание характера процесса при сочетании кокцидиоидного микоза и туберкулеза, что, по данным Birsner, встречается у 5% больных. В этих случаях, очевидно, необходимы особенно тщательное и всестороннее исследование больных и динамический контроль за ними, в чем мы убедились при наблюдении за 6 больными кокцидиоидомикозом, из которых двое одновременно страдали туберкулезом. Примером может служить следующее наблюдение.
Больная В., 36 лет, в детстве имела контакт с больным туберкулезом отцом. В возрасте 9—11 лет проживала сначала в Австралии, а затем в Калифорнии. В 19-летнсм возрасте у нее были обнаружены очаги в верхпей доле правого легкого, которые после лечения стрептомицином рассосались. Спустя 7 лет возник правосторонний экссудативныи плеврит и вновь появились мелкоочаговые изменения в той же доле легкого, исчезнувшие после лечения туберкулостатическими препаратами. В 1969 г. появились симптомы интоксикации, сухой кашель. При флюорографии определялись мелкие очаги в верхних долях обоих легких. В промывных водах бронхов дважды были обнаружены сферулы кокцидиоидного микоза и один раз микобактерий туберкулеза. Больная положительно реагировала на туберкулин (5 ТЕ). В то же время у нее оказалась положительной реакция связывания комплемента с кокцидиоидином. Под влиянием лечения противомикотическим и туберкулостатическими препаратами наступил выраженный клинический эффект и рассосались свежие очаги в легких.
В данном случае, очевидно, имело место сочетанное заболевание кокцидиоидным микозом и туберкулезом, обострившимся под влиянием грибкового заболевания.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Кафедра патологической анатомии ГБОУ "Первый МГМУ им. И.М. Сеченова"
Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова, Москва
Иммунное гранулематозное воспаление как приспособительная реакция организма
Журнал: Архив патологии. 2014;76(4): 39‑44
Пауков В.С., Коган Е.А. Иммунное гранулематозное воспаление как приспособительная реакция организма. Архив патологии. 2014;76(4):39‑44.
Paukov VS, Kogan EA. Immune granulomatous inflammation as the body's adaptive response. Arkhiv Patologii. 2014;76(4):39‑44. (In Russ.).
Кафедра патологической анатомии ГБОУ "Первый МГМУ им. И.М. Сеченова"
На основании собственных исследований и анализа литературы авторы выдвигают гипотезу о приспособительном характере хронического иммунного гранулематозного воспаления, возникающего при инфекционных заболеваниях, характеризующихся развитием нестерильного иммунитета. Предлагаемая гипотеза позволяет утверждать, что не всякое хроническое воспаление является выражением несостоятельности защитных сил организма при взаимодействии с повреждающим фактором. На примере туберкулеза и лепры показана несостоятельность ряда существующих представлений о пато- и морфогенезе эпителиоидно-клеточной и лепрозной гранулем. Авторы считают, что при туберкулезе резидентные макрофаги сохраняют функцию уничтожения микобактерий, благодаря чему иммунная система получает информацию об антигенных детерминантах возбудителей. Израсходовав все гидролазы на уничтожение микобактерий, макрофаги не образуют новые лизосомы из-за способности возбудителей препятствовать их образованию. В результате макрофаг, лишенный лизосом, трансформируется в эпителиоидную клетку, которая, сохраняя функцию фагоцитоза, теряет способность убивать возбудителей. Именно в ней протекает эндоцитобиоз. Периодически эти микроорганизмы разрушают эпителиоидную клетку и выпадают в зону творожистого некроза гранулемы. Часть из них вновь фагоцитирует эпителиоидные клетки для поддержания нестерильного иммунитета, а остальные уничтожаются воспалительными макрофагами. Принципиально аналогично протекает пато- и морфогенез лепрозной гранулемы, особенно ее туберкулоидного типа. Таким образом поддерживается нестерильный иммунитет, характерный для туберкулеза, лепры и, возможно, для других микобактериозов.
Кафедра патологической анатомии ГБОУ "Первый МГМУ им. И.М. Сеченова"
Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова, Москва
Настоящая работа является анализом как собственных многолетних разнообразных исследований воспаления, так и известных фактов и представлений о нем на основе закономерностей общей патологии в соответствии с взглядами И.В. Давыдовского [1, 2] о причинности в медицине и А.И. Струкова [5] о единстве структуры и функции.
Воспаление определяют как реакцию организма, направленную на уничтожение повреждающего фактора, его элиминацию и репарацию возникших повреждений. Сейчас уже не возникают дискуссии по поводу приспособительного характера острого воспаления. Вместе с тем хроническое воспаление рассматривается как выражение несостоятельности защитных сил организма при взаимодействии с повреждающим фактором, в том числе и с инфекционным возбудителем, и поэтому оно не может иметь адаптивного значения [2, 3, 7, 17].
Причины такой несостоятельности защитных систем могут быть разными - от биологических особенностей возбудителя до иммунодефицита, развившегося у больного [3, 8, 14, 15]. Поэтому хроническое воспаление не способно выполнить функцию, делающую воспаление как общебиологическую реакцию приспособительным процессом, так как не может уничтожить патогенный фактор или не способно воспрепятствовать перманентному возникновению рецидивов воспалительной реакции и обеспечить полноценную регенерацию поврежденных тканей. По мере увеличения длительности хронического воспаления нередко развивается вторичный иммунный дефицит, что еще больше снижает способность организма уничтожать патогенный фактор, а, следовательно, и завершить воспалительный процесс [4]. При этом возникает каскад других патологических реакций в разных органах, развивается порочный круг и хроническое воспаление становится типично патологическим процессом [3].
Это в первую очередь относится к хроническому гранулематозному воспалению, которое характерно для инфекций, сопровождающихся нестерильным иммунитетом, таким как туберкулез, лепра и некоторые другие. Пока что никто убедительно не объяснил, зачем организму нужен нестерильный иммунитет, но именно такой иммунитет характерен для хронических иммунных гранулем, в первую очередь для туберкулеза, лепры, особенно для ее туберкулоидного типа, возможно, и для некоторых других микобактериозов. Однако, несмотря на множество исследований этих болезней, особенно туберкулеза и лепры, в их патогенезе остается много неясного. Поэтому специалисты в своей практике пользуются сложившимися представлениями, часто не имеющими убедительных обоснований или объяснений.
Так, принято считать, что в формировании туберкулезной эпителиоидно-клеточной гранулемы и гранулемы при туберкулоидном типе лепры ведущую роль играет тот факт, что резидентные макрофаги теряют способность уничтожать микобактерии и поэтому в них происходит лишь эндоцитобиоз [7, 16]. Полагают, что это связано с особенностями бактерий, которые могут блокировать функцию лизосом [10]. Однако при анализе этого постулата возникает ряд вопросов.
Если макрофаги не способны уничтожать микобактерии туберкулеза, то каким образом и откуда иммунная система получает информацию об их антигенных детерминантах? Без такой информации невозможно формирование клеточного иммунитета по типу гиперчувствительности замедленного типа. Вместе с тем если макрофаги не уничтожают микобактерии, то возбудители должны размножаться внутри этих фагоцитов и в таком случае при туберкулезе и лепре количество микобактерий должно прогрессивно и быстро увеличиваться, что не может не сопровождаться нарастающей тяжелой интоксикацией с яркими клиническими и морфологическими проявлениями. Однако интоксикация развивается на более поздних этапах болезни и связана в основном с нарастающим казеозным некрозом и генерализацией процесса. Кроме того, при такой ситуации количество макрофагов должно быстро увеличиваться, так как их фагоцитарная функция сохраняется, а масса микобактерий также быстро нарастает. В этом случае гранулема достигала бы очень больших размеров и имела черты макрофагальной гранулемы, либо макрофаги не смогли бы локализоваться лишь в области гранулемы и распространялись с кровотоком, обусловливая генерализацию процесса. Если в макрофагах происходит эндоцитобиоз, то в чем смысл их трансформации в эпителиоидные клетки, которые практически не содержат лизосом, не образуют фагоцитарную вакуоль и, следовательно, не могут уничтожать микобактерии туберкулеза?
С этих позиций многое становится понятным в пато- и морфогенезе туберкулеза и лепры, если учесть, что эти болезни также характеризуются нестерильным иммунитетом, т.е. для поддержания иммунитета как основного фактора защиты организма необходимо сохранение микобактерий. Наилучшим механизмом такой защиты является образование иммунной гранулемы. Однако для этого иммунная система вначале должна получить информацию об антигенных детерминантах возбудителей, для чего необходимы резидентные макрофаги с их обычной фагоцитарной функцией и большим количеством лизосом в цитоплазме. Без уничтожения возбудителя антиген не может быть выявлен.
При первичном инфицировании гранулемы нет, но есть первичный аффект, представляющий собой очаг некроза, вызванного микобактериями, и перифокального серозного воспаления. При этом закономерно в зоне воспаления появляются резидентные, а затем воспалительные макрофаги. Они содержат большое количество лизосом, фагоцитируют микобактерии, образуют фагоцитарную вакуоль и уничтожают их с помощью гидролаз лизосом, выявляя при этом антигенные детерминанты возбудителя, передают информацию о них в иммунную систему, которая начинает нарабатывать CD4 + T-лимфоциты подтипа T h1 (рис. 1, а б). Рисунок 1. Макрофаг из области первичного туберкулезного аффекта. а — цитоплазма макрофага содержит множество микобактерий туберкулеза и лизосом (стрелки). ×18 000. Рисунок 1. Макрофаг из области первичного туберкулезного аффекта. б — фагоцитарная вакуоль, в которой расположена микобактерия туберкулеза (стрелка). ×42 000. Эти лимфоциты в свою очередь стимулируют макрофаги, а также дендритные клетки к продукции провоспалительных цитокинов, усиливают экспрессию костимуляторных молекул, активные метаболиты кислорода, производные азота и др. [9, 12]. Однако для передачи информации в иммунную систему и ее первичного ответа требуется около 3 нед, но в начале инфицирования должна формироваться нормергическая ответная реакция, которая не может остановить размножение возбудителей. Возможно, это связано с недостаточным количеством резидентных макрофагов в зоне первичного аффекта. В таком случае макрофаги будут фагоцитировать микобактерий больше, чем могут уничтожить с помощью гидролаз своих лизосом.
Мы проверили в эксперименте такую возможность, создав условия для фагоцитоза макрофагами туши, после чего вводили в ту же ткань взвесь стафилококков [4, 6]. Было установлено, что макрофаги фагоцитируют тушь и образуют фагоцитарные вакуоли. Если при этом остается часть лизосом, то затем при инфицировании ткани стафилококками макрофаги их фагоцитируют и уничтожают. Однако если количество фагоцитированных капель туши столь велико, что все лизосомы расходуются на образование фаголизосом, то поглощенные затем микроорганизмы не уничтожаются лизосомами и вокруг них не образуются фагоцитарные вакуоли. По существу в макрофагах происходит эндоцитобиоз. Таким образом, эндоцитобиоз может развиваться в макрофагах при фагоцитозе ими количества возбудителей, превышающего потенциальные возможности этих клеток.
Не исключено, что при первичном инфицировании туберкулезом и лепрой происходит то же самое и переполненные микобактериями, но не имеющие возможности их уничтожить макрофаги, с одной стороны, служат источником сенсибилизации организма, а с другой - могут способствовать прогрессированию первичного аффекта или лепроматоидного очага и образованию отсевов в различных органах.
В эпителиоидной клетке микобактерии находятся в дормантном состоянии, т.е. в состоянии своеобразного анабиоза, на что указывают и липидные скопления, состоящие из жирных кислот с длинными цепями, замедляющие их рост [16]. При этом они теряют часть генов и, следовательно, в них меняется генетический код и изменяются какие-то свойства, но они живы, в них протекает метаболизм [19, 20]. Не исключено, что метаболиты они получают за счет распада цитоплазмы эпителиоидной клетки и в конце концов разрушают ее, выпадая в окружающую ткань и вызывая в ней творожистый некроз. С таким механизмом образования казеоза согласны не все микробиологи. Разумеется, нельзя исключить развитие некроза и в результате действия Т-лимфоцитов, провоспалительных интерлейкинов и др., однако примечательно, что такой некроз возникает именно в туберкулезной гранулеме. Вокруг очага казеозного некроза, как известно, располагаются эпителиоидные клетки и макрофаги, которые вновь фагоцитируют микобактерии. При этом коль скоро антигенные детерминанты уже известны иммунной системе, новые возбудители ей не нужны, и они уничтожаются макрофагами, имеющимися в эпителиоидно-клеточной или лепроидной гранулеме. Необходимое количество микобактерий, дав новый стимул иммунной системе, вновь оказывается в эпителиоидных клетках. Тем самым поддерживается нестерильный иммунитет. Если часть живых микобактерий ускользнет из очага казеозного некроза, на их пути окажутся Т h1 -лимфоциты, воспалительные макрофаги и гигантские клетки Пирогова-Лангханса, которые фагоцитируют их и, возможно, дублируют функции эпителиоидных клеток. Вместе с тем активированные Т h1 -лимфоциты в качестве клеток памяти могут сохраняться годами.
Принципиально аналогичная ситуация наблюдается и при лепре, особенно при ее туберкулоидном типе, который также характеризуется образованием иммунной гранулемы, содержащей специфические пенистые макрофаги - клетки Вирхова, лимфоциты и эпителиоидные клетки. Различают два основных типа лепрозных гранулем - лепроматозный и туберкулоидный, между которыми несколько промежуточных типов. Можно провести аналогию между первичным аффектом при туберкулезе и лепроматозным типом лепры, с которого обычно начинается заболевание, когда много лепрозных клеток, т.е. макрофагов, при этом в них также скапливаются микобактерии, что расценивается как эндоцитобиоз, и иммунный ответ выражен отчетливо меньше, чем при туберкулоидном типе лепры. Туберкулоидный тип морфологически весьма схож с эпителиоидно-клеточной туберкулезной гранулемой. Эпителиоидные клетки не содержат лизосом, в них много микобактерий, находящихся в дормантном состоянии, но нет фагоцитарных вакуолей (рис. 3). Рисунок 3. Лепрозная гранулема, туберкулоидный тип. Эпителиоидная клетка содержит микобактерии лепры, но в ее цитоплазме нет лизосом. Сами микобактерии расположены в липидных каплях, образованных жирными кислотами (рис. 4), Рисунок 4. Лепрозная гранулема, туберкулоидный тип. В эпителиоидной клетке микобактерии расположены в липидных каплях, образованных жирными кислотами. которые микобактерии, находясь в дормантном состоянии, используют для своей жизнедеятельности [18]. Подобные же липидные капли в эпителиоидных клетках и в клетках Пирогова-Лангханса обнаруживаются и при туберкулезе.
Разумеется, лепра - это не туберкулез и нельзя искать в этих иммунных гранулемах полной аналогии, хотя обе болезни имеют много переходных форм, лишь часть имеет четкую форму гранулемы. Однако сами иммунные гранулемы имеют принципиальное сходство - и структурное, и функциональное.
Заключение
Таким образом, предложенная гипотеза ставит под сомнение ортодоксальный постулат о том, что хроническое воспаление всегда есть проявление неспособности организма обеспечить свою защиту от повреждающего фактора и поэтому является сугубо патологическим процессом. Она позволяет некоторые виды хронического воспаления, по крайней мере хроническое иммунное гранулематозное, рассматривать как приспособительный процесс, не только обеспечивающий защиту организма от генерализации инфекции, во всяком случае до тех пор, пока сохраняется достаточно высокая функция его иммунной системы, но и предохраняющий его от повторного заражения определенными микобактериями.
О том, что в организме здоровых людей, но перенесших инфицирование или заболевание туберкулезом, сохраняются микобактерии в очагах Гона, Симона и др., свидетельствует наличие у них специфических аллергических реакций, выявляемых известными пробами, а также то, что при ослаблении иммунитета у инфицированных больных в результате разнообразных дополнительных воздействий на иммунную систему развивается обострение туберкулеза и при этом гранулемы теряют черты эпителиоидно-клеточных. Мы понимаем, что эта гипотеза достаточно дискуссионна, может вызвать ряд возражений и нуждается в каких-то уточнениях, но полагаем, что она может заставить отказаться от сложившихся шаблонов и быть стимулом для попытки иного осмысления не вполне понятных механизмов патогенеза многих заболеваний и их осложнений.
На этом примере хотелось бы подчеркнуть, что если мы порой не можем что-то понять и объяснить какой-то феномен, повторяющийся у всех больных на протяжении многих сотен лет, не надо искать дефект в защите организма в виде нарушения функций определенных клеток - макрофагов, лейкоцитов, лимфоцитов и др. Если исходить прежде всего из целесообразности всех реакций организма и общих закономерностей развития патологических процессов, то часто за кажущимся дефектом защиты организма скрывается своеобразное приспособление. Понимание этого представляется нам принципиально важным для раскрытия патогенеза многих заболеваний и патологических процессов.
ФГУ "НИИ пульмонологии" ФМБА России
ФГУ "НИИ пульмонологии" ФМБА России
Гистологическая дифференциальная диагностика гранулематозных болезней легких (часть I)
Журнал: Архив патологии. 2019;81(1): 65‑70
ФГУ "НИИ пульмонологии" ФМБА России
Гранулематозные болезни — это гетерогенная группа заболеваний различной этиологии, проявляющихся разнообразными клиническими синдромами и вариантами тканевых изменений, неоднородной чувствительностью к терапии и преобладанием общего доминирующего гистологического признака — наличием гранулем, определяющих клинико-морфологическую сущность каждой болезни. Гранулема является хронической воспалительной реакцией, в которой принимают участие клетки макрофагальной системы и другие клетки воспаления. После воздействия антигена происходит активация T-лимфоцитов, макрофагов, эпителиоидных клеток и гигантских многоядерных клеток, приводящая к образованию гранулемы. Гранулема включает также внеклеточный матрикс, продуцируемый фибробластами, позволяющий отграничить и изолировать антиген. Гранулематозные заболевания классифицируются по этиологии на инфекционные и неинфекционные. Однако, согласно последним исследованиям, патогенные микроорганизмы могут быть причиной развития гранулем при заболеваниях, ранее считавшихся неинфекционными. В ряде случаев классифицировать гранулематозный процесс как инфекционный и неинфекционный весьма трудно. Цель настоящего исследования — привлечь внимание читателей к разнообразию гранулематозных заболеваний, описать ключевые моменты патолого-анатомических проявлений различных болезней неинфекционной природы, а также определить подход к дифференциальной диагностике гранулематозов.
ФГУ "НИИ пульмонологии" ФМБА России
ФГУ "НИИ пульмонологии" ФМБА России
Гранулематозные болезни — гетерогенная группа заболеваний различной этиологии, проявляющихся разнообразными клиническими синдромами и вариантами тканевых изменений, неоднородной чувствительностью к терапии, при этом преобладает общий доминирующий гистологический признак — наличие гранулем, определяющих клинико-морфологическую сущность каждой болезни [3]. Настоящая публикация преследует цель привлечь внимание читателей к разнообразию гранулематозных заболеваний легких, описать ключевые моменты патолого-анатомических проявлений различных заболеваний инфекционной и неинфекционной природы, а также определить подход к дифференциальной диагностике гранулематозов.
При гранулематозных заболеваниях неинфекционной природы, как правило, развиваются ненекротические гранулемы, за некоторыми исключениями, о которых будет сказано ниже.
Саркоидоз
Значительное число лимфоцитов в ткани легких при саркоидозе представлено преимущественно Т-клетками. Для дифференциальной диагностики саркоидоза полезно оценивать бронхоальвеолярный смыв, в котором при этом заболевании среди лимфоцитов преобладают Т-хелперы (CD4+), соотношение CD4/CD8 составляет 3,5—10:1 (в норме 1,8:1). Гигантские клетки в составе гранулем могут содержать в цитоплазме включения, такие как астероидные тельца, тельца Шауманна или кристаллоидные структуры. Эти включения характерны для саркоидоза, однако не являются патогномоничными, так как могут присутствовать и при других гранулематозных заболеваниях [5].
При исследовании биоптатов бронхов и легких при гранулематозных заболеваниях, как правило, обнаруживают диссеминированное поражение с васкулитом, периваскулитом, перибронхитом; гранулемы чаще всего локализуются в межальвеолярных перегородках. Гранулематозное поражение бронхов и бронхиол при саркоидозе встречается часто и описано у 15—55% пациентов. Нередко гранулемы располагаются в стенке сосуда, частота гранулематозного васкулита может достигать 69%. В этих наблюдениях следует дифференцировать саркоидоз с некротизирующим саркоидным гранулематозом, который ряд авторов относят к узловой форме саркоидоза [6]. Для последнего характерно развитие некрозов.
Помимо саркоидоза, встречается так называемая неспецифическая саркоидная реакция в виде эпителиоидно-клеточного гранулематоза. Она обычно наблюдается в регионарных лимфатических узлах, но может встречаться и в ткани легких при псевдоопухолях, злокачественных новообразованиях, паразитарных заболеваниях, экзогенном аллергическом альвеолите, туберкулезе. Гистологически саркоидная реакция отличается ограниченностью и топической связью с указанными патологическими процессами.
Гиперсенситивный пневмонит
Хроническая аллергическая болезнь, вызванная металлами
Хронический бериллиоз представляет собой аллергический гранулематоз. Гранулемы сходны с таковыми при саркоидозе, могут быть несколько крупнее. Как и при саркоидозе, гранулемы располагаются перилимфатически, со сходным клеточным составом, включая субпопуляции T-лимфоцитов, характерно поражение лимфатических узлов. Такой же вариант гранулематоза может развиваться в результате действия циркония. Диагностику следует основывать на данных анамнеза и тесте трансформации лимфоцитов в ответ на действие того или иного металла [9].
Некротический гранулематоз встречается также при аллергическом ангиите с гранулематозом (ранее — болезнь Черджа—Стросса) в сочетании с некротическим васкулитом и эозинофильной пневмонией. Гранулемы при аллергическом ангиите с гранулематозом хорошо оформленные, с центральным некрозом, содержащим множество эозинофилов, имеет место эозинофильная инфильтрация стенок сосудов и бронхиол, некротический васкулит с наличием эозинофилов и гигантских многоядерных клеток. Однако классическая триада изменений в виде гранулематоза, некротического васкулита и эозинофильной пневмонии в легких встречается нечасто, поэтому для установления диагноза необходимы дополнительные клинические и лабораторные данные.

Некротические гранулемы могут формироваться в легком и при ревматоидном артрите, однако диагноз в этом случае следует формулировать с осторожностью. Прежде всего следует учитывать клинические данные, поскольку узелковые формы ревматоидного артрита развиваются только в активной фазе заболевания, у серопозитивных пациентов с наличием выраженного суставного синдрома. При этом заболевании некроз, как правило, окрашен эозинофильно, клеточный детрит располагается обычно между некрозом и окружающим его гистиоцитарным валом, может сочетаться с васкулитом, однако некротический васкулит нехарактерен (рис. 7) Рис. 7. Ревматоидный артрит: обширная зона некроза с гистиоцитарным валом по периферии, лимфоидная инфильтрация стенок сосудов с обтурацией просветов, ×40. [12]. Описанные гистологические изменения практически неотличимы от таковых инфекционного гранулематоза, кроме того, описаны редкие наблюдения сочетания ревматоидного артрита и туберкулеза, поэтому необходимо исключить наличие инфекции.
При дифференциальной диагностике васкулитов с развитием гранулематозной реакции, описанных выше, следует учитывать специфические серологические признаки того или иного заболевания.

Инфекционный гранулематоз следует также дифференцировать с НСГ. Последний имеет также некоторые сходства с полиангиитом с гранулематозом. При НСГ характерно развитие интерстициального некроза, который чаще эозинофильно окрашен, однако иногда может содержать клеточный детрит. Однако некроз при НСГ сочетается с имеющимися ненекротизирующими гранулемами саркоидного типа, состоящими преимущественно из эпителиоидных и гигантских многоядерных клеток с небольшим числом лимфоцитов, эти гранулемы имеют тенденцию к слиянию, часто располагаются вблизи кровеносных сосудов или в их стенке, не приводя, однако, к развитию васкулита (рис. 8) Рис. 8. Некротизирующий саркоидный гранулематоз: гранулематозный васкулит, ×100. [6]. Для диагностики НСГ необходимо наличие триады признаков: гранулемы саркоидного типа, гранулематозного васкулита и некротического воспаления.
Поскольку некроз при инфекционном гранулематозе может быть коагуляционного типа, его также следует дифференцировать с инфарктом легкого. В стадии организации инфаркты могут быть окружены фибробластами и клетками воспаления, напоминая гранулематозное воспаление. В резецированных кусочках легкого при инфаркте, как правило, можно обнаружить тромбы в ветвях легочной артерии, явившиеся причиной развития инфаркта [13].

Дифференциально-диагностические признаки основных неинфекционных заболеваний легких приведены в таблице. Ключевые диагностические признаки основных неинфекционных заболеваний легких [14]
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Саркоидоз. Туберкулез. Признаки туберкулеза легких.
При саркоидозе легкие, как правило, вовлекаются в патологический процесс в виде слабо выраженного альвеолита, гранулематоза и фиброза легочной ткани. При саркоидозе могут возникать мозаичные стенозы бронхов (в тех случаях, когда гранулемы расположены в стенках бронхов), очаговые ателектазы, зоны иррегулярной эмфиземы, очаги обызвествления в гранулемах, участки пневмосклероза и фибринозного плеврита. Иногда в центре гранулем можно определить фибриноидное набухание и коагуляционный, но не казеозный некроз.
Туберкулез. Признаки туберкулеза легких.
При диагностике туберкулеза важное значение имеет цитологическое исследование мокроты или бронхиального секрета, при котором цитобактериоскопически можно обнаружить кислотоустойчивые микобактерии.
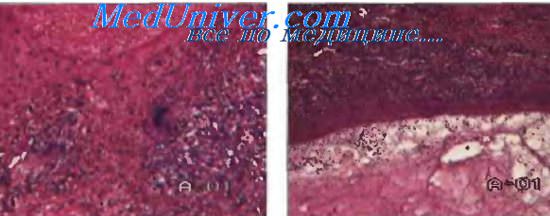
Морфологической основой туберкулеза является туберкулезная гранулема (узелок, бугорок), в центре которой очаг казеозного некроза, окруженный эпителиоидными клетками, гигантскими многоядерными клетками Пирогова-Лангханса, лимфоцитами, плазматическими клетками, макрофагами.
При затухании первичного туберкулеза на месте первичного очага возникает петрифицированный, а в дальнейшем оссифициронный очаг Гона.
Генерализация процесса может происходить гематогенным или лимфогенным путем, за счет роста первичного очага с возникновением лобарной казеозной пневмонии и/или первичной легочной каверны; принимая хроническое течение, развивается первичная легочная чахотка с наличием казеозного бронхаденита, что отличает ее от вторичного фиброзно-кавернозного туберкулеза.
У ослабленных больных может возникнуть смешанная форма прогрессирования - одновременный рост первичного очага, казеозныи бронхаденит и многочисленные туберкулезные отсевы в других органах. При длительной стероидной терапии возникает лекарственный туберкулез как проявление эндогенной инфекции. Хроническое течение первичного туберкулеза характеризуется чередованием вспышек и затиханий с поражением лимфоузлов (аденогенная форма). При гематогенном (послепервичном) туберкулезе выделяют три разновидности генерализованный гематогенный; гематогенный туберкулез с преимущественным поражением легких; гематогенный с преимущественно внелегочным поражением. При второй форме гематогенного туберкулеза развивается острый или хронический милиарный туберкулез (или гематогенно-диссеминированный туберкулез легких), который встречается только у взрослых.
Для такого туберкулеза характерны кортикоплевральные очаги в легких, продуктивная тканевая реакция, пневмосклероз, эмфизема, легочное сердце и внелегочный очаг туберкулеза.
Вторичный (рвинфекционный) туберкулез возникает у взрослых, перенесший первичный. Для такого туберкулеза характерны легочная локализация, контактное и каналикулярное (по бронхиальному дереву) распространение, смена клиникоморфологических форм, которые одновременно являются фазами туберкулеза. Выделяют восемь форм вторичного туберкулеза: очаговый, фиброзно-очаговый, инфильтративный, туберкулома, казеозная пневмония, острый кавернозный, фибозно-кавернозныи цирротический. При остром очаговом туберкулезе в 1-2-м сегментах, как правило, правого легкого обнаруживают один или два очага реинфекта Абрикосова. Начальные явления вторичного туберкулеза представлены специфическим зндо-, мезо- и панбронхитом внутридолькового бронха с лобулярной творожистой бронхопневмонией с образованием по периферии зпителиоидноклеточных гранулем.
При своевременном лечении эти очаги инкапсулируются и петрифицируются, оссификации их никогда не происходит. Такие очаги реинфекта называют очагами Ашоффа-Пуля. При новой вспышке инфекции вокруг этих очагов возникает казеозная пневмония, которая впоследствии инкапсулируется, не выходя за пределы 1-2-го сегментов. Эта фаза носит название фиброзно-очагового туберкулеза. Инфильтративный туберкулез развивается при прогрессировании острого очагового или обострении фиброзно-очагового. При этом экссудация может выходить за пределы дольки и даже сегмента. При захвате дольки следует говорить о лобите. Перифокальное воспаление преобладает над казеозными изменениями.
Туберкулома - своеобразная форма эволюции инфильтративного туберкулеза (очаг творожистого некроза в капсуле диаметром 2-5 см) в 1 -2-м сегментах, чаще правого легкого. Туберкулому следует прежде всего дифференцировать с периферическим раком легкого.
Казеозная пневмония возникает при прогрессировании инфильтративного или в терминальный период любой другой формы туберкулеза, при этом некроз преобладает над перифокальными изменениями. Распространенность - от ацинозного оча-I га до захвата всей доли.
Острый кавернозный туберкулез характеризуется быстрым образованием полости распада и каверны на месте инфильтрата или туберкуломы. Появление каверны чревато бронхогенным обсеменением легких. Каверны в 1 -2-м сегментах обычно овальной или округлой формы.
Фиброзно-кавернозный туберкулез (хроническая легочная чахотка) возникает в тех случаях, когда кавернозный туберкулез принимает хроническое течение. Процесс чаще выражен в одном правом легком и постепенно спускается в нижние отделы контактным путем или интраканаликулярно и может переходить на другое легкое. Более старые изменения локализуются в верхних отделах, а очаги казеозной пневмонии - в нижних.
Цирротический туберкулез - вариант фиброзно-кавернозного с разрастанием фиброзной ткани вокруг каверн. На местах заживших каверн остаются линейные рубцы, возникает деформация легочной ткани, развиваются плевральные спайки и очаг гиалиноза. Появляются многочисленные бронхоэктазы.
Осложнения туберкулеза многочисленны. При первичном часто развивается менингит, плеврит, перикардит, перитонит. При вторичном характерно развитие кровотечения из каверн, прорыв их содержимого в плевральную полость с развитием пневмоторакса и эмпиемы плевры.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

