Грибковая инфекция при лейкозе
Обновлено: 24.04.2024
Профилактика и лечение инфекционных осложнений острого лейкоза. Лечение инфекций при лейкозе
У многих пациентов уже до начала лечения выявляются лихорадка и нейтропения. Нераспознанные инфекции могут быстро диссеминировать и закончиться фатально, поэтому недопустима отсрочка назначения антибиотиков до появления развернутой клинической картины.
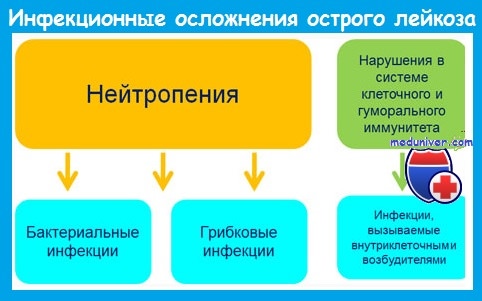
Наиболее важным предрасполагающим фактором развития инфекций является нейтропения. Риск инфекции зависит от уровня и длительности постцитостатической нейтропении и возрастает при количестве нейтрофилов меньше 1 • 10 9 /л.
При развитии агранулоцитоза (нейтрофилов меньше 0,5 • 10 9 /л) вероятность инфекции очень велика, а при количестве нейтрофилов меньше 0,1 • 10 9 /л инфекции развиваются у большинства пациентов и имеют чрезвычайно тяжелое течение.
До середины 1980-х годов грамотрицательные бактерии кишечного происхождения были причиной 70-80% бактериальных инфекций у больных острым лейкозом. В настоящее время 60-80% бактериальных инфекций вызывается грамположительными микроорганизмами. Это обусловлено:
1) использованием сосудистых катетеров;
2) проведением деконтаминации кишечника, подавляющей грамотрицательную микрофлору;
3) выбором антибактериальных препаратов для эмпирической антибактериальной терапии.
Наряду с бактериальными инфекциями большое значение у больных с нейтропенией имеют грибковые (кандидоз, аспергиллез), вирусные (вызванные herpes simplex и zoster, ЦМВ) и протозойные инфекции.
Инфекционные осложнения при остром лейкозе отличаются атипичным течением. Это обусловлено следующими обстоятельствами:
1) агранулоцитоз существенно изменяет реакцию организма на инфекционный агент, что клинически чаще всего проявляется развитием фебрильной температуры без других признаков локальной или системной инфекции;
2) многие антибиотики нарушают микрофлору больного, подавляют чувствительные микроорганизмы и способствуют пролиферации резистентных бактерий и грибов рода Candida (суперинфекция);
3) большое влияние на защитные механизмы оказывает химиотерапия, вызывающая миелосупрессию и повреждение эндотелия;
4) глюкокортикостероиды, часто вводимые больным как часть специфической терапии, также отрицательно влияют на защитные механизмы;
5) интубация, зондовое энтеральное питание и использование сосудистых катетеров вызывают нарушение целостности кожных покровов и/или повреждение слизистых оболочек.
В связи с высокой вероятностью развития инфекционных осложнений у больных острым лейкозом разработан комплекс профилактических мероприятий:
1) изоляция больного в период нейтропении, которая обеспечивает снижение частоты инфекций, передающихся воздушно-капельным путем;
2) обработка кожи и слизистых оболочек дезинфицирующими растворами (хлоргексидин и др.);
3) деконтаминация кишечника (per os назначаются неабсорбируемые антибактериальные препараты, например канамицин, и противогрибковые средства, чаще всего нистатин или суспензия амфотерицина В), позволяющая снизить количество грамотрицательных организмов кишечного происхождения;
4) гигиена ротовой полости (регулярное полоскание и использование мягких зубных щеток с целью предотвращения травмирования десен);
5) системная профилактика (бисептол или фторхинолоны);
6) отказ от ректальных и вагинальных манипуляций (кроме проводимых по неотложным и жизненным показаниям);
7) назначение препаратов гранулоцитарного или гранулоцитарно-моноцитарного колониестимулирующего фактора (КСФ) для более быстрого восстановления нейтрофилов и уменьшения вероятности инфекционных осложнений.
Показанием к назначению эмпирической антибактериальной терапии на фоне агранулоцитоза является фебрильная температура тела (выше 38 °С) более 2 часов, не связанная с инфузиями или аллергическими реакциями. Оптимально сочетание антипсевдомонального пенициллина или цефалоспорина с аминогликозидом.
Допустима монотерапия цефалоспорином 3-го или 4-го поколения или карбепенемом, например имепенемом. При отсутствии эффекта в течение 2-3 суток необходимо дополнение эмпирической антибактериальной терапии ванкомицином; в случае сохранения лихорадки в течение 4-6 дней назначается амфотерицин В в связи с высокой вероятностью системной грибковой инфекции. После идентификации возбудителя проводится целенаправленная антибактериальная, противовирусная и антимикотическая терапия.
Антибактериальная терапия проводится до повышения абсолютного содержания нейтрофилов в крови больше 0,5 • 10 9 /л и нормализации температуры тела. Длительность терапии у пациентов с документированной инфекцией должна быть не менее 10-14 дней.
Трансфузии гранулоцитов используются крайне редко. Единственным показанием к трансфузии является развившийся на фоне агранулоцитоза бактериальный сепсис при отсутствии ответа на адекватную антибактериальную терапию.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Кандидоз у больных лейкозом - частота, причины, механизмы развития
Эпидемиология кандидоза. Частота инвазивного кандидоза составляет 9—15 % при трансплантации гемопоэтических клеток крови (ТГКК), 1 — 13 % при острых лейкозах, 1—2 % при лимфомах, до 0,5 % при солидных опухолях. Из дрожжевых грибов наиболее частыми патогенами являются Candida albicans. Наблюдается тенденция к снижению частоты их выделения с 80-90 % (70-80-е годы) до 40-60 % (90-е годы).
Начиная с 90-х годов возрастает выделение Candida попalbicans: С. tropicalis, С. krusei, С. glabrata, С. kefyr, С. parapsilosis и др.. Одна из причин увеличения Candida non-albicans — проведение антифунгальной профилактики азоловыми препаратами. На долю инфекций, вызванных С. glabrata, приходится от 5 до 35 %, С. tropicalis — от 8 до 43 %.
С. lusitaniae, С. dubliniensis, С. guilliermondii относятся к редким патогенам. Высокая частота выделения Candida non-albicans при инвазивных микозах регистрируется прежде всего у больных с гемобластозами.
Факторы риска кандидоза
Определяющим фактором в развитии инвазивного кандидоза является длительность нейтропении. При нейтропении от 1 до 20 дней вероятность развития системного микоза не превышает 20 %, от 21 до 40 дней — 40 %, от 40 дней и более достигает 60 %. Другим не менее важным фактором возникновения инвазивного кандидоза является колонизация грибами слизистых оболочек.
Вероятность развития инвазивного кандидоза увеличивается, если при культуральном исследовании отделяемого со слизистых оболочек (рот, нос, влагалище, кишечник) определяются грибы рода Candida не из одного локуса, а из нескольких. Более значимым является выделение дрожжевых грибов в образцах, взятых из мест, не граничащих между собой (например, рост грибов в посевах изо рта и влагалища).
Это подтверждено в ряде исследований. Одно из них проведено P. Martino и соавт.. Системный кандидоз развился у 18 (32 %) из 56 больных при колонизации кандидами нескольких не граничащих между собой областей; только у 2 (1,2 %) из 170 пациентов при выявлении кандид из одного локуса и лишь у 1 (0,5 %) из 198 больных без признаков колонизации грибами.
Инвазивные микозы достоверно чаще регистрируются у больных с центральными венозными катетерами, находящихся на парентеральном питании, при терапии глюкокортикоидами. Чаще инвазивный кандидоз возникает у пациентов, которые получают антациды, Н2-блокаторы или иные средства, подавляющие кислотность желудочного сока, а также при длительном применении антибактериальных препаратов. Как правило, у больных с гранулоцитопенией имеется не один, а несколько факторов, потенцирующих развитие инвазивного кандидоза.
Патогенез кандидоза
Кандидоз — это прежде всего эндогенная инфекция. Кандиды могут заселять кожу, слизистую оболочку ротоглотки, кишечник, транслокация их происходит, особенно при нейтропении, через поврежденный эпителий кишечника после курсов цитостатической терапии. Описаны случаи передачи кандид от больного к больному при длительном пребывании их в стационаре через предметы окружающей среды.
В крови грибы циркулируют непродолжительное время, затем, повреждая эндотелий, они внедряются в органы, вызывая образование небольших абсцессов.
Нейтрофилы, моноциты и макрофаги составляют основное звено защиты для макроорганизма от инвазии такими грибами, как Candida spp., Aspergillus spp., Mucor spp. Инфекции, вызванные этими грибами, встречаются прежде всего при нарушенном фагоцитозе, что является следствием заболевания или результатом цитостатической терапии.
Течение инвазивного микоза может быть стремительно быстрым в случае развития его при глубокой нейтропении и вялым, медленным при возникновении у больных с невыраженной нейтропенией или при заболеваниях, сопровождающихся дефектами функции нейтрофилов.
Клеточное звено иммунитета является ведущим в защите от инвазии грибами Cryptococcus neoformans, Histoplasma capsulatum и Coccidioides immitis. При дефектах клеточного иммунитета чаще возникает диссеминированный микоз, вызванный этими грибами, чем ограниченный в легких. Выраженное поражение грибами рода Candida слизистых оболочек в отличие от инвазивного кандидоза развивается также при дефиците клеточного иммунитета.
Клинические симптомы кандидоза
Выделяют следующие формы кандидоза:
• поверхностный — поражение кожи и слизистых оболочек (при нейтропении чаще диагностируют орофарингеальный и эзофагеальный);
• инвазивный кандидоз, который включает кандидемию, острый диссеминированный кандидоз, хронический диссеминированный кандидоз, кандидозное поражение одного органа.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Профилактика грибковой инфекции у онкологических больных с нейтропенией - препараты
В последние десятилетия увеличилась заболеваемость системными микозами, особенно у больных с онкогематологическими заболеваниями. В связи с этим ведутся широкие исследования возможности профилактики этих инфекций. Меры профилактики грибковой инфекции могут быть направлены как на ограничение попадания грибковых возбудителей извне (воздух, пища, вода), так и на борьбу с колонизирующими организм патогенами (назначение противогрибковых препаратов).
Особенно высока вероятность развития аспергиллеза у больных, которым произведена трансплантация донорского костного мозга. Споры аспергилл находятся в воздухе жилых помещений, поэтому необходимы меры по его очистке. Обычно в отделениях трансплантации костного мозга используются НЕРА-фильтры, позволяющие высокоэффективно удалять пыль и споры грибов из поступающего в палаты воздуха. Применение такой фильтрации позволило значительно снизить частоту развития инвазивного аспергиллеза. В то же время эта дорогостоящая методика не может применяться во всех гематологических и онкологических отделениях.
Кроме того, она не может избавить от спор грибов, колонизирующих верхние дыхательные пути или попадающих в кишечник с пищей. Это соображение послужило основанием для профилактического назначения противогрибковых препаратов. В контролируемых исследованиях противогрибковые препараты назначали профилактически с целью как местного, так и системного воздействия.

Для местного воздействия на грибковую флору, колонизирующую кишечник, обычно применяли суспензии полиеновых производных (нистатин и амфотерицин В) для перорального приема, которые не абсорбируются в желудочно-кишечном тракте. Порошок нистатина также использовали для профилактики грибковых поражений кожи, а некоторые производные азолов — для профилактики кандидозов слизистых оболочек. Местное применение полиенов оказалось эффективным при профилактике и лечении поражений кожи и подкожных структур, но существенно не повлияло на частоту системных микозов.
Во многих исследованиях профилактически использовали системное назначение противогрибковых препаратов. В большинстве этих исследований применялись амфотерицин В (или его липидные производные), а также средства из группы триазолов — флуконазол (дифлюкан, форкан, флюкостат) и итраконазол (орунгал). Амфотерицин В обладает широким спектром активности, включающим, помимо большинства представителей семейства кандида, также плесневые грибы. В то же время при внутривенном введении препарат токсичен. Флуконазол способен эффективно излечивать инфекцию, вызванную грибами рода кандида (малочувствительны к препарату С. krusei и некоторые штаммы С. glabrata), хорошо всасывается в кишечнике и малотоксичен. Недостатком флуконазола является отсутствие активности в отношении аспергилл.
Итраконазол столь же активен, как и флуконазол в отношении грибов рода кандида, но, помимо этого, эффективен при инфекциях, вызываемых Aspergillus spp. Он также способен всасываться в желудочно-кишечном тракте, однако до последнего времени использование капсульной формы препарата не обеспечивало стабильной биодоступности. Кроме того, применение итраконзола сопровождается риском лекарственного взаимодействия с рядом препаратов, в том числе цитостатиков. Появление раствора итраконазола на основе циклодестрина для перорального и внутривенного введения позволило значительно улучшить его биодоступность. Системное назначение итраконазола, амфотерицина В и флуконазола оказалось действенным при первичной и вторичной профилактике инвазивных грибковых инфекций.
В некоторых случаях в группах высокого риска грибковой инфекции удалось значимо снизить смертность.
В настоящее время принята противогрибковая профилактика с использованием флуконазола или итраконазола у больных после аллогенной трансплантации костного мозга, особенно при неродственной или частично несовместимой родственной трансплантации. Решение о профилактическом использовании этих препаратов в других группах больных должно приниматься с учетом конкретной ситуации. Например, наличие кандидоза слизистых оболочек двух и более областей при проведении химиотерапии с предполагаемым повреждением слизистой оболочки (режимы, содержащие цитозар или антрациклины) может служить показателем к проведению профилактики системного распространения инфекции. Обычно профилактическая доза флуконазола составляет 200—400 мг, а итраконазола — 5 мг/кг.
Видео фармакологические, побочные эффекты противогрибковых препаратов (антимикотиков)
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
В статье представлена клиническая характеристика грибковых инфекций как частого осложнения у гематологических больных, получающих химиотерапию, глюкокортикоиды, иммуносупрессивную терапию. Рассмотрены рекомендации по назначению противогрибковой терапии у больных гемобластозами с использованием всего арсенала противогрибковых препаратов системного действия различной эффективности. Обоснована необходимость раннего назначения противогрибковых препаратов с профилактической целью.
Одной из важных проблем агрессивной терапии гемобластозов является беззащитность пациента от инфекции на фоне депрессии иммунитета и агранулоцитоза.
Одной из проблем является беззащитность пациента от инфекции на фоне депрессии иммунитета и агранулоцитоза. В последние годы возросла роль грибковых инфекций, приводящих к тяжелым осложнениям и смерти у пациентов с иммунодефицитными состояниями [8, 17]. Частота развития грибковых инфекций также высока и среди пациентов с гематологическими злокачественными новообразованиями. По данным американской Системы надзора за нозокомиальными инфекциями (NNIS), в течение последних 10 лет было отмечено увеличение числа грибковых инфекций с 2,0 до 3,8 на 1 000 поступлений [32]. Частота нозокомиальных грибковых инфекций мочевыводящих путей возросла с 9,0 до 20,5 на 10 000 госпитализированных больных, частота хирургической раневой инфекции, вызываемой грибковыми микроорганизмами – с 1,0 до 3,1, а частота фунгемии – с 1,0 до 4,9 [24].
В последние годы был отмечен дальнейший рост числа грибковых инфекций, особенно у иммунокомпрометированных больных, в т.ч. онкогематологических. Среди последних группой риска являются в первую очередь больные с фебрильной нейтропенией после проведения цитостатической терапии (особенно с острыми лейкозами), а также с осложнениями после хирургических вмешательств на брюшной полости и находящиеся в отделениях интенсивной терапии [16], получающие длительную и массивную антибактериальную терапию. Развитию грибковой суперинфекции, т.е. грибковой инфекции на фоне уже имеющейся бактериальной инфекции, наряду с антибиотикотерапией и угнетением иммунитета в результате агрессивной цитостатической терапии, способствуют лечение кортикостероидами, наличие хронических заболеваний, пожилой возраст больных [11].
Несмотря на то что потенциально патогенными для человека являются более 100 видов грибов, причиной нозокомиальных инфекций являются не более 20 из них, среди которых превалируют дрожжеподобные грибы рода Candida. Значительно реже встречаются другие дрожжеподобные грибы (геотрихии, сахаромицеты), а также аспергиллы, Mucor, Fusarium spp., другие плесневые грибы [14]. Большинство грибов рода Candida существуют как сапрофиты на коже, в желудочно-кишечном тракте и в области гениталий. Они обычно слабовирулентны и не способны вызывать микозы у пациентов без нарушения защитных барьерных функций организма. Немаловажную роль в развитии кандидозов играет предшествующая колонизация слизистых оболочек. В условиях значительного количества факторов риска слизистые оболочки полости рта, желудочно-кишечного и мочевыводящего трактов онкологических больных, колонизированные грибами, могут стать источником диссеминации.
Кандиды вызывают до 86% всех грибковых инфекций [26]. Грибы рода Candida входят в число 10 наиболее часто выявляемых патогенов в клинике.
Кандиды у человека занимают 6-е место в ряду лидирующих нозокомиальных патогенов в США, вызывая до 86% всех грибковых инфекций [26]. Инвазивные кандидозы составляют до 10–15% всех нозокомиальных инфекций, а Candida входит в число 10 наиболее часто выявляемых патогенов в клинике. Заболеваемость кандидозом у больных гемобластозами может достигать 10–30%, в связи с чем эти пациенты составляют главную группу риска.
Инвазивный кандидоз характеризуется тяжестью клинических проявлений и летальностью от 30 до 70%.
Важными факторами риска при развитии кандидоза являются:
- колонизация кандиды;
- центральные венозные катетеры;
- антибиотики широкого спектра действия;
- кортикостероиды и другие иммуносупрессоры;
- цитостатические препараты;
- нейтропения;
- мукозит;
- индуцированный химиолучевой терапией.
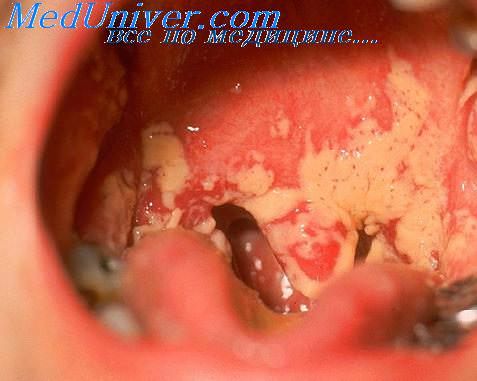
Одной из наиболее частых локализаций грибковой суперинфекции являются ротовая полость (орофарингеальный кандидоз, молочница ротовой полости) [10, 12, 15]. Кандидоз у онкогематологических больных может варьировать от бессимптомных или легких форм стоматитов до угрожающих жизни кандидемий и метастатических инфекций. В полость рта грибы попадают алиментарным путем, однако для того, чтобы возникла колонизация орофарингеальной зоны или инфекция, необходимо наличие факторов риска.
Лечение антибактериальными препаратами приводит к быстрой замене количественного и качественного состава микрофлоры полости рта с преобладанием некоторых видов микробов, в т.ч. Сandida spp. Поражение полости рта и глотки может проявляться в различных формах, чаще всего в виде молочницы, иногда в виде толстого коричневого налета на языке. Эти формы поддаются терапии не абсорбируемыми формами имидазолов, например клотримазолом. При рефрактерности флоры альтернативным вариантом является кетоконазол (Низорал) либо флуконазол (Дифлюкан) [7, 22].
Поражение пищевода может протекать бессимптомно примерно у 25% больных, но они часто жалуются на дисфагию, боли при глотании и за грудиной, реже – на рвоту, тошноту, подъем температуры либо кровотечение из желудочно-кишечного тракта. Диагноз ставится после эзофагоскопии и обнаружении в пищеводе белых налетов, эритематозных участков и язв. Определенно диагноз может быть поставлен только после проведения микроскопии, т.к. аналогичная картина отмечается при бактериальном и вирусном поражении. Эзофагоскопию не назначают детям раннего возраста и больным с некорригированной тромбоцитопенией, а также клинически нестабильным пациентам [10, 13]. В данной ситуации желательно ограничиться эмпирическим назначением антимикотиков и противовирусных препаратов. Лечение кандидозного поражения пищевода зависит от гематологического и клинического статуса больного. В легких случаях достаточно назначение Дифлюкана. Лихорадящим пациентам с агранулоцитозом и высоким риском диссеминации назначают Амфотерицин В [27]. При аутопсии у больных с гранулоцитопенией всегда выявляется колонизация желудочно-кишеченого тракта Candida, но эта форма инфекции редко диагностируется при жизни. Наиболее частые находки при эндоскопии желудка – эрозии, язвы, псевдомембраны. После хирургических вмешательств может возникнуть кандидозный перитонит. При перфорации чаще возникает инфекция, вызванная С. albicans, в то время как катетер-ассоциируемый перитонит чаще вызван C. tropicalis. При подозрении необходимо удалить интраперитонеальный катетер, т.к. штаммы Candida активно адгезируют на силастических поверхностях [18].
Клинико-лабораторные проявления гепатолиенального кандидоза неспецифичны и включают:
- стойкую резистентную к антибиотикам лихорадку, сохраняющуюся после выхода из нейтропении;
- боли в животе;
- гепатоспленомегалию;
- поверхностный грибковый мукозит;
- повышение в крови уровней щелочной фосфатазы (ЩФ) и γ-глутамилтрансферазы (γ-ГТФ), что является ранним маркером вовлечения печени в патологический процесс и часто появляется уже в период аплазии кроветворения;
- реактивный лейкоцитоз;
- более чем в 50% случаев негативную гемокультуру [3, 10, 14].
Подходы к терапии такие же, как и при хроническом диссеминированном кандидозе. В случае развития обструктивных уропатий показано хирургическое лечение. При лечении опухолевых заболеваний диссеминированный кандидоз с вовлечением в процесс различных органов является угрожающим жизни осложнением. На ранних стадиях диагноз очень трудно поставить. Кандидемия может быть поздней находкой уже при органном поражении. Candida albicans – наиболее частая причина кандидемии, а С. tropicalis, C. krusei, C. parapsilosis чаще выявляются у больных с тяжелой нейтропенией.
Инвазивные формы кандидоза варьируют от острых молниеносных, потенциально летальных форм до хронических, локализованных либо диссеминированных. Эти разграничения условны и определяются длительностью процесса. Для больных с нейтропенией и инвазивным кандидозом характерна постоянная либо рекуррентная лихорадка во время терапии антибиотиками широкого спектра действия [25, 31]. Начало может быть острое, с септическим шоком, фебрилитетом и ознобом, нарушением сознания и падением артериального давления, кардиоваскулярным коллапсом. Косвенным указанием на наличие инвазивного кандидоза могут быть миалгии, кандидурия, метастатические кожные эрозии (чаще всего округлые одиночные либо со скоплениями до 1 см в диаметре). С мацерированных поверхностей кожи нужно обязательно взять посев и соскоб на микроскопию. Диагноз инвазивного кандидоза можно поставить при выявлении Candida в культурах крови либо других жидкостях (цереброспинальной, перитонеальной, синовиальной, плевральной). В процесс могут быть вовлечены печень, селезенка, почки, сердце, легкие, суставы и кости [20, 21].
Легочный кандидоз чаще возникает при аспирации либо гематогенным путем. На рентгенограмме выявляются характерные округлые инфильтраты. Наиболее часто возбудителем грибковых инфекций бронхов и легких являются Candida albicans. Крайне редко инфекцию могут вызывать C. glabrata,C.tropicalis и C. parapsilosis
Грибы рода Candida в основном чувствительны к амфотерицину В, но для C. krusei и C. glabrata минимальная подавляющая концентрация данного препарата достаточно высока, поэтому при терапии микозов, обусловленных этими видами грибов, нужно назначать максимальные дозы препарата.
Одной из важнейших проблем, связанных с грибковой патологией человека, является правильное проведение комплексного лечения с назначением антифунгальных препаратов, различающихся по механизму и спектру действия. Представители рода Candida обладают различной чувствительностью к противогрибковым препаратам, что необходимо учитывать при назначении терапии и профилактики грибковых инфекций. Грибы рода Candida в основном чувствительны к амфотерицину В, но для C. krusei и C. glabrata минимальная подавляющая концентрация данного препарата достаточно высока, поэтому при терапии микозов, обусловленных этими видами грибов, нужно назначать максимальные дозы препарата. Описаны случаи резистентности С. lusitaniae к амфотерицину В в клиниках, где этот препарат используется в целях профилактики [25, 28].
Механизм действия большинства противогрибковых препаратов обусловлен воздействием на основные ферменты, влияющие на процесс биосинтеза эргостерола, входящего в состав мембраны клеток гриба, однако уровень этого воздействия различен. Как известно, синтез эргостерола проходит следующие стадии: ацетил-коэнзим А – сквален – ланостерин – эргостерол.
Полиеновые антибиотики – амфотерицин В, Амфоглюкамин, нистатин, леворин, натамицин – вызывают нарушение синтеза собственно эргостерола. Амфотерицин B деоксихолат остается стандартным антифунгальным агентом для лечения инвазивного кандидоза, но необходимо помнить о высокой токсичности этого препарата [1, 31].
Азолы (производные имидазола) – кетоконазол, клотримазол , канизон, миконазол, эконазол, изоконазол, бифоназол, тенонитрозол, флуконазол, итраконазол – воздействуют на этапе перехода ланостерина в эргостерол и жирные кислоты, угнетая ферменты цитохрома Р-450, С-оксидазу и С14 - диметилазу, что ведет к нарушению проницаемости клеточной стенки гриба, накоплению азольного препарата в клетке, изменению текучести мембран. Флуконазол хорошо абсорбируется в желудочно-кишечном тракте, более 90% препарата попадает в системный кровоток. Флуконазол является препаратом выбора при кандидозном эзофагите, кандидемии (при стабильном состоянии пациента), инфекции мочевыводящих путей, перитоните, раневой инфекции, используется в лечении фебрильных нейтропений. Клинический эффект при кандидозном эзофагите составляет 95,1% [25, 34]. При кандидозе мочевыводящих путей назначают флуконазол в дозе 400 мг с последующим переходом на дозу 200 мг. При кандидемии и стабильном состоянии больного применяют флуконазол в дозе 600 мг, при нормализации температуры – 400 мг. Показано, что активность флуконазола в дозе 400 мг при кандидемии (70%) сопоставима с активностью амфотерицина В в дозе 0,5–0,6 мг/кг (79%) [9]. При лечении инфекции, вызванной C. glabrata, можно назначать флуконазол в дозе 800 мг/сут. В отдельных случаях применяли дозу 1 200 мг/сут без каких-либо выраженных побочных эффектов [27]. Флуконазол является наиболее эффективным препаратом для профилактики диссеминированных кандидозных инфекций после трансплантации костного мозга [9]. При онкогематологических заболеваниях флуконазол назначали в дозе 200–400 мг/сут в течение 5–14 дней. Хорошо известна активность итраконазола при кандидозе слизистых оболочек, но появление внутривенных форм позволяет лечить инвазивные формы заболевания. Вориконазол в настоящее время выпускают в форме для приема per os и парентерального введения. Он, так же как и флуконазол, активен при кандидозе пищевода, хотя его применения связано с большими побочными эффектами, что было представлено в недавних исследованиях. На основе этих данных вориконазол лицензирован в Европейском сообществе для лечения резистентной к флуконазолу серьезной инвазивной кандидозной инфекции (включая C. krusei) [25].
Аллиламины – тербинафин, нафтифин – отличаются высокоспецифическим подавляющим влиянием на фермент скваленэпоксидазу, которая катализирует один из этапов синтеза эргостерола клетками гриба, т.е. аллиламины подавляют синтез стеринов в грибной клетке на ранней стадии. Каспофунгин – первый антифунгальный эхинокандин. Как и все препараты этого класса, он доступен в форме только для парентерального введения, а спектр его действия в значительной степени ограничен грибами рода Candida и Aspergillus. При выборе эмпирической терапии следует помнить, что препараты этого класса не активны против Cryptococcus neoformans и мицелиальных грибов кроме Aspergillus [30]. Как было установлено, каспофунгин эффективен при лечении орофарингеального и эзофагального кандидоза. Likewise, Mora-Duarte и соавт. обнаружили, что каспофунгин (70 мг доза насыщения и затем 50 мг/день у взрослых) эквивалентен, но лучше переносится, чем амфотерицин В деоксихолат (0,6–1,0 мг/кг/день) в случаях инвазивного кандидоза (83% из которых были с кандидемией, 10% – с перитонитом и 7% – смешанные случаи). Применение каспофунгина также было эффективно у 72% пациентов с резистентным к флуконазолу кандидозом пищевода [31]. Этот препарат заявлен как эффективный против всех видов Candida, хотя МИК некоторых штаммов C. parapsilosis и Candida guillermondii относительно более высокие. Таким образом, полученные данные свидетельствуют о том, что эхинокандины могут быть успешно использованы для лечения фунгемии, обусловленной C. Parapsilosis.
Начальная медикаментозная противогрибковая терапия кандидемии у больных гемобластозами должна включать каспофунгин, флуконазол и препараты амфотерицина В или комбинированную терапию флуконазол + амфотерицин В.
Начальная медикаментозная противогрибковая терапия кандидемии у больных гемобластозами должна включать каспофунгин, флуконазол и препараты амфотерицина В или комбинированную терапию флуконазол + амфотерицин В. Выбор между этими лекарственными средствами зависит от клинического статуса пациента, знания врачом вида гриба и/или чувствительности возбудителя к антифунгальным агентам, относительной лекарственной токсичности, наличия органной дисфункции, которая может влиять на клиренс, доступной информации об имеющемся опыте применения конкретного препарата и реакции пациента на первое введение. Терапия для кандидемии должна продолжаться в течение 2 недель после получения последнего положительного культурального исследования и разрешения симптомов и признаков инфекции. При длительной терапии амфотерицин В или каспофунгин могут быть заменены внутривенным или пероральным введением флуконазола [18, 19]. Пациенты, у которых во время развития кандидемии наблюдалась нейтропения, должны получать рекомбинантные цитокины, ускоряющие выход из нейтропении (гранулоцитарный колоний-стимулирующий фактор или гранулоцитарный моноцитарный колоний-стимулирующий фактор). Другие факторы иммуносупрессии также должны быть по возможности устранены или сведены к минимуму (например, за счет снижения дозы системных кортикостероидов). Обострение (или персистенция) кандидемии на фоне проводимой антифунгальной терапии предполагает вероятность присутствия инфицированного внутрисосудистого устройства, выраженной иммуносупрессии или микробиологической резистентности. В таких случаях следует начать лечение препаратами других классов, а выделенные штаммы необходимо идентифицировать до вида и провести тесты на их чувствительность к антимикотикам. Инфицированные внутрисосудистые устройства следует по возможности удалить и провести мероприятия для снижения иммуносупрессии [4].
Грибковые инфекции являются наиболее частым осложнением у больных гематологического профиля, требуют раннего профилактического назначения антимикотических средств, нуждаются в длительной терапии противогрибковыми препаратами системного действия, приводят к летальным исходам.
1. Багирова Н.С. Дрожжевые грибы: идентификация и резистентность к противогрибковым препаратам в онкогематологическом стационаре/Н.С.Багирова, Н.В.Дмитриева//Инфекции и антимикробная терапия. - 2001. - Т. 3. - №6. - С. 178–182.
2. Белобородов В.Б., Синякова Л.А. Нозокомиальная кандидурия: алгоритм диагностики и лечения/В.Б.Белобородов, Л.А.Синякова//Consilium medicum. – Т. 05. - №7. - С. 2.
3. Бурова С.А. Особенности течения и терапии грибковых инфекций у детей/С.А.Бурова//Доктор. Ру. - 2003. - №12. – С. 24–25.
4. Гельфанд Б.Р. Кандидозная инфекция в хирургии и интенсивной терапии/Б.Р.Гельфанд, В.А.Гологорский, Е.Б.Гельфанд//Инфекции и антимикробная терапия. – 2000. – Т. 2. – №1. – С. 24–28.
5. Грибковые инфекции у больных солидными опухолями и гемобластозами/Н.В.Дмитриева, И.Н.Петухова, Л.Ф.Иванова и др.//Инфекции и антимикробная химиотерапия. - 2001. - Т. 3. - №3. – С. 92–93.
6. Долгих Т.И. Лабораторная диагностика – основа информационного обеспечения диагностического процесса при оппортунистических инфекциях (обзор литературы)/И.Т.Долгих//Клин. лаб. Диагностика. – 2008. – 1. - С. 49–51.
7. Ивашкин В.Т. Гастроэнтерология XXI века/В.Т.Ивашкин, Т.Л.Лапина//Рус. мед. журн. – 2000. – Т. 8. – №17 (118). - С. 697–703.
8. Клясова Г.А. Микотические инфекции: клиника, диагностика, лечение/Г.А.Клясова//Инфекции и антимикробная терапия. - 2000. - Т. 2. - №6. - С. 184–189.
Грибовидный микоз — злокачественное опухолевое поражение лимфоидно-ретикулярной системы в первую очередь кожи, а в дальнейшем и внутренних органов. Грибовидный микоз является Т-клеточной лимфомой. В классическом варианте заболевание проходит эритематозную, бляшечную и опухолевую стадии. Диагностика заболевания в первой стадии затруднена из-за сходства клинической картины с псориазом, экземой и другими дерматозами. Гистологическая картина в этой стадии не имеет специфических признаков и в своевременной диагностике заболевания помогает только тщательное иммуногистохимическое исследование. Оно имеет большое значение, поскольку лечение, начатое на эритематозной стадии, позволяет продлить жизнь больных грибовидным микозом.
МКБ-10
Общие сведения
Грибовидный микоз — достаточно редкий вид Т-клеточной лимфомы кожи, заболевание наблюдается 1 случай на 345000 населения. В большинстве случаев (70-80%) заболевают люди от 40 до 60 лет. У мужчин заболевание встречается несколько чаще, чем у женщин. В основе грибовидного микоза лежит размножение и злокачественное перерождение Т-лимфоцитов. Точные причины, запускающие этот механизм, пока не определены. Предполагают, что определенную роль играют генетические факторы и хроническая антигенная стимуляция при персистирующей вирусной инфекции (герпетическая инфекция, ВПЧ и др.).

Симптомы грибовидного микоза
Классическая форма грибовидного микоза Алибера-Базена характеризуется 3 стадиями развития заболевания: эритематозной, бляшечной и опухолевой. В эритематозной стадии на коже появляются сильно зудящие пятна красно-синюшного, красного или желтовато-розового цвета. Они бывают от нескольких миллиметров в диаметре до 15-20 см. Пятна имеют шелушащуюся или мокнущую поверхность. Часто отмечается расположение элементов на туловище и разгибательных поверхностях рук и ног, однако высыпания грибовидного микоза бывают любой локализации. Зуд иногда предшествует появлению пятен. В большинстве случаев он является характерным для грибовидного микоза признаком, но может и отсутствовать.
Картина высыпаний при грибковом микозе бывает идентична картине парапсориаза, герпетиформного дерматита Дюринга, экземы или красного плоского лишая. Поэтому отдельные авторы полагают, что эритематозная стадия — это тот или иной дерматоз, который затем трансформируется в грибовидный микоз.
Переход эритематозной стадии классического грибовидного микоза в бляшечную происходит через различный период времени: от нескольких месяцев до десятка лет. В бляшечной стадии пятна грибовидного микоза инфильтрируются, становятся плотными и приподнимаются над поверхностью кожи, трансформируясь в бляшки. Площадь бляшки начинает расти, цвет приобретает багровый или кирпично-красный оттенок, поверхность становиться мелкобугристой. Характерно усиление зуда. Со временем бляшки могут претерпевать обратное развитие, которое начинается в их центре. При этом бляшка продолжает расти по периферии, образуя кольцо. Сливающиеся между собой бляшки с регрессом в центре образуют на коже причудливые фигуры в виде дуг и гирлянд.
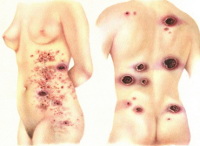
В опухолевой стадии грибовидного микоза кожные элементы переходят в опухолевые поражения, которые могут достигать размеров апельсина и имеют красновато-синий или красновато-желтый цвет. Наряду с такими опухолевыми образованиями на коже наблюдаются и элементы бляшечной стадии. Через несколько недель опухоли распадаются с образованием глубоких язв, покрытых гнойно-кровянистым отделяемым и массами некротизированных тканей. У пациента наблюдается недомогание, отсутствие аппетита, снижение массы тела. Опухолевая стадия протекает с поражением внутренних органов, в которых появляются образования, подобные кожным.
Все стадии грибовидного микоза протекают с увеличением лимфатических узлов, в первую очередь паховых и бедренных. Возможны подъемы температуры тела и ночная потливость. Почти у 70% больных грибовидным микозом возникают трофические нарушения: дистрофические изменения ногтей и волос, кожные гиперпигментации, нарушения потоотделения и др. Поражение слизистых встречается довольно редко. Элементы в таких случаях появляются обычно на твердом и мягком небе. Они быстро трансформируются в обширные язвы.
Форма Видаля-Брока (обезглавленный грибовидный микоз) относится к ретикулосаркоматозу кожи. Она характеризуется отсутствием эритематозной и бляшечной стадий и появлением на коже туловища, лица и конечностей сразу опухолевых образований.
Эритродермическая форма Галлопо-Бенье отличается распространенностью покраснения по всему кожному покрову, отечностью, выраженной инфильтрацией и шелушением кожи. Заболевание сопровождается высокой температурной реакцией, нарушением общего самочувствия.
Диагностика
В начале грибовидного микоза в крови, как правило, отмечается повышение лейкоцитов, лимфоцитов и эозинофилов. В опухолевой стадии и при эритродермической форме наблюдается снижение количества лейкоцитов и лимфоцитов, увеличение СОЭ. Для подтверждения грибовидного микоза проводят иммуногистохимическое исследование.
Изучение кожных элементов грибовидного микоза предварительно проводится путем дерматоскопии и УЗИ кожного новообразования. Гистологическое исследование участка кожи, взятого из патологического очага путем биопсии, в первой стадии грибовидного микоза выявляет в шиповатом слое эпидермиса отек и акантоз (потеря связей между клетками), скопление лимфоцитов, фибробластов, тучных клеток и эозинофилов. В бляшечной стадии резко выражен акантоз, выявляются гнездовидные скопления гистиоцитов и лимфоцитов. В опухолевой стадии инфильтрат распространяется не только на все слои дермы, но и на подкожную клетчатку, иногда захватывая подлежащие ткани.
В опухолевой стадии для выявления поражения внутренних органов проводят УЗИ органов брюшной полости и рентгенографию грудной клетки. Дифференцируют грибовидный микоз с синдромом Сезари и другими лимфомами, системными васкулитами, хроническими дерматитами, псориазом и др.
Лечение грибовидного микоза
В лечении грибовидного микоза применяют кортикостероиды (дексаметазон, преднизолон и др.), противоопухолевые антибиотики и цитостатики (метотрексат, сульфадиазин, циклофосфамид, проспидин, дипин). Чаще используют комбинированную терапию препаратами этих групп. Возможно проведение фототерапии, рентгенотерапии, экстракорпоральной фотохимиотерапии. Местно для уменьшения зуда применяют кортикостероидные мази.
Прогноз
Прогноз неблагоприятный. В зависимости от формы и тяжести заболевание может длиться от 2-х до 12-ти лет. Во многих случаях своевременная диагностика и начало лечения в первых двух стадиях грибовидного микоза позволяют добиться длительной ремиссии и продлить жизнь пациентов.
Читайте также:

