Группы инфекционного риска в акушерстве
Обновлено: 26.04.2024
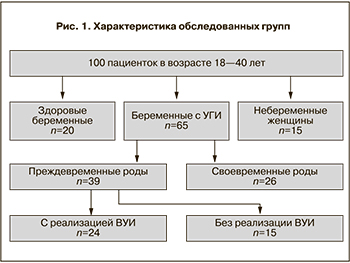
Цель исследования. Определение диагностической и прогностической значимости комплексного исследования интерферонового статуса у беременных высокого инфекционного риска. Материал и методы. Обследованы 100 пациенток и их новорожденных. В I (основную группу) вошли 65 беременных с урогенитальной инфекцией (УГИ): Iа подгруппа – 24 беременные с преждевременными родами (ПР) и реализацией внутриутробной инфекции (ВУИ); Iб подгруппа – 15 беременных с ПР без реализации ВУИ и Iв подгруппа – 26 беременных со своевременными родами. Во II (контрольную группу) вошли 20 пациенток без УГИ, у которых беременность завершилась своевременными родами. В III (группу сравнения) вошли 15 небеременных. Определение экспрессии генов цитокинов в мононуклеарных клетках периферической крови пациенток проводили с использованием метода обратной транскрипции и полимеразной цепной реакции. Определение выработки интерферонов (ИФН) и чувствительности лейкоцитов периферической крови (ЛПК) к препаратам интерферонов проводили биологическим методом. Пациентку считали чувствительной к препаратам ИФНα и ИФНγ, если ее ЛПК отвечали увеличением продукции интерферонов при примировании хотя бы одним из препаратов интерферонов. Результаты. Способность к индуцированной продукции ИФНα в культуре лейкоцитов беременных с ПР была выше, чем у здоровых беременных (35,5±11,6 Ед/мл по сравнению с 25,5±5,4 Ед/мл). Способность к продукции ИФНγ у беременных с ПР, напротив, была понижена (5,1±2,4 Ед/мл и 14,9±1,6 Ед/мл, соответственно; р
Проблема преждевременных родов (ПР) и внутриутробного инфицирования плода (ВУИ) в современном акушерстве продолжает оставаться актуальной и нерешенной [1–4].
На долю недоношенных детей приходится 60–70% ранней неонатальной смертности и 65–75% детской смертности. Мертворождаемость при ПР в 8–13 раз выше, чем при своевременных родах, а перинатальная смертность у недоношенных новорожденных в 33 раза выше, чем у доношенных [5, 6]. Следует отметить, что 40% ПР обусловлено инфекционными факторами, а ПР до 30 недель беременности имеют инфекционную этиологию в 80% случаев [7–10].
Несмотря на многочисленные научные и практические исследования в этой области, частота ПР не снижается, а в некоторых странах даже растет 11–13].
По современным представлениям, одной из причин развития ПР являются ограниченные возможности иммунной системы беременной своевременно распознавать и уничтожать инфекционные агенты. Это связано со смещением иммунного равновесия в организме беременной в сторону преобладания врожденного иммунитета над приобретенным [14–16].
Система цитокинов играет важную роль в течение всей беременности, регулируя процессы инвазии трофобласта, межклеточные взаимоотношения в эндометрии, воспалительные реакции [17]. При осложненном течении беременности на фоне урогенитальной инфекции (УГИ) отмечается увеличение в периферической крови провоспалительных цитокинов, что приводит к возрастанию продукции простагландинов и ферментов, способствующих сокращениям матки и раскрытию шейки матки [18, 19].
Дальнейшие исследования в этой области и поиск новых иммунологических маркеров невынашивания беременности позволят выявить пациенток групп риска по развитию ПР, своевременно проводить патогенетически обоснованную терапию с целью улучшения исходов беременности и родов, снижения перинатальной заболеваемости и смертности.
Целью нашего исследования стало определение диагностической и прогностической значимости комплексного исследования интерферонового статуса у беременных высокого инфекционного риска.
Материал и методы исследования
Нами проведено клинико-лабораторное обследование 100 пациенток и их новорожденных. Все пациентки были разделены на три группы. В I основную группу) вошли 65 беременных с наличием УГИ. Критериями включения пациенток в основную группу являлись: срок беременности от 25 до 32 недель, наличие УГИ, угроза ПР. Критериями исключения пациенток из основной группы являлись: многоплодная беременность, острые инфекционные, воспалительные заболевания, оперативное родоразрешение.
Основная группа проспективно в зависимости от исхода беременности была разделена на 3 подгруппы: Iа подгруппа – 24 беременные с ПР и реализацией ВУИ; Iб подгруппа – 15 беременных с ПР без реализации ВУИ и Iв подгруппа – 26 беременных со своевременными родами. Во II контрольную группу) вошли 20 пациенток без УГИ, у которых беременность завершилась своевременными родами. В III (группу сравнения) вошли 15 небеременных женщин (рис. ).
В обследованных группах изучали: данные соматического и акушерского анамнеза, течение настоящей беременности, особенности родового акта, состояние новорожденных. Всем пациенткам проводили комплексное клинико-лабораторное обследование (клинический анализ крови и мочи, определение группы крови и резус-фактора, биохимический анализ крови, гемостазиограмма, анализ микрофлоры влагалища и цервикального канала).
Определение экспрессии генов цитокинов в мононуклеарных клетках периферической крови пациенток проводили с использованием метода обратной транскрипции и полимеразной цепной реакции (ОТ-ПЦР) [20].
Бахарева И.В. , Ганковская Л.В. , Романовская В.В. , Мезенцева М.В. , Магомедова А.М. , Кузнецов П.А. , Греченко В.В.
Для цитирования: Орджоникидзе Н.В., Тютюнник В.Л. Алгоритм обследования беременных с высоким инфекционным риском. РМЖ. 2001;6:215.
Научный центр акушерства, гинекологии и перинатологии РАМН, Москва
В наступившем третьем тысячелетии у акушеров–гинекологов и неонатологов не вызывают сомнения приоритетность и значимость проблем, связанных с вирусной и/или бактериальной инфекциями, частота которых возрастает из года в год. Отмечено существенное увеличение доли оппортунистических инфекций (герпетической, цитомегаловирусной и др.), развитие которых возможно лишь в условиях иммунодефицита. Нарушения экологии, ускорение ритма жизни, рост стрессовых ситуаций и ятрогенных вмешательств в современных условиях неизбежно приводят к увеличению частоты иммунодефицитных состояний. Классической “моделью” физиологической иммуносупрессии является беременность. Поэтому сочетание инфекции и беременности представляется особо неблагоприятным.
Острые и хронические инфекции играют важную роль в развитии осложнений беременности (самопроизвольные выкидыши, неразвивающаяся беременность, пороки развития плода, преждевременные роды, аномалии прикрепления и предлежания плаценты, плацентарная недостаточность, синдром задержки развития плода и его гипоксия, внутриутробная инфекция и др.) и родов (несвоевременное излитие околоплодных вод, слабость родовой деятельности, острая гипоксия плода, аномалии отделения последа, гипотония матки, кровотечения и др.).
Современной медицинской науке известно до 2500 различных инфекций. Теоретически в период беременности и до ее наступления женщина может заболеть любой из них, и каждая инфекция может оказать негативное воздействие на рост и развитие эмбриона и плода. Спектр возбудителей перинатальных инфекций обширен. К безусловным возбудителям относят вирусы краснухи, цитомегалии, простого герпеса, Коксаки, гепатита В, аденовирус, вирус иммунодефицита человека (ВИЧ) и бактерии – листерии, трепонемы, микобактерии туберкулеза (редко), хламидии. К осложнениям у беременных могут привести и инфекционные заболевания, вызванные некоторыми видами условно–патогенной микрофлоры (стрепто– и стафилококками, Е. coli, клебсиеллой, уреа– и микоплазмами и др.), простейшими (токсоплазмой, плазмодиями – возбудителями малярии), а также грибами рода Candida. Причем известна акушерская аксиома: нет параллелизма между тяжестью инфекционного процесса у матери и у плода. Легкая, мало– или даже бессимптомная инфекция у беременной может привести к тяжелым поражениям плода, вплоть до его инвалидизации или даже гибели. Этот феномен в значительной степени обусловлен тропизмом возбудителей (особенно вирусных) к определенным эмбриональным тканям, а также тем, что клетки плода с их высочайшим уровнем метаболизма и энергетики являются идеальной средой для размножения (репликации) микробов. Именно этим и объясняется большое сходство эмбрио– и фетопатий, вызванных различными инфекционными агентами.
Все вышеотмеченное определяет важное значение алгоритма обследования беременных с высоким инфекционным риском, который включает:
I. Тщательный сбор анамнеза и выявление пациенток группы риска по развитию инфекции. Прежде всего выясняют возраст беременной и супруга (партнера), условия их труда и быта, особенности питания, наличие профессиональных вредностей и вредных привычек (курение, алкоголизм, наркомания, избыточное потребление кофе и др.), генетическую предрасположенность к заболеваниям, данные соматического, аллергологического, акушерско–гинекологического анамнеза. Особое внимание уделяют наличию хронических воспалительных заболеваний гениталий (часто рецидивирующие кольпиты, эктопии шейки матки, хронический эндометрит и сальпингоофорит и др.), дисфункции яичников, длительной внутриматочной контрацепции, бесплодия и т.д. Важное значение имеют и хронические воспалительные процессы в органах мочевыделительной, дыхательной, пищеварительной систем, другие экстрагенитальные заболевания. Необходимы данные о течении предыдущих беременностей (самопроизвольные выкидыши, неразвивающаяся беременность, пороки развития и антенатальная гибель плода, плацентарная недостаточность, хроническая гипоксия и/или задержка внутриутробного развития плода, преждевременные роды, внутриутробная инфекция, аномалии прикрепления плаценты и др.) и родов (несвоевременное излитие околоплодных вод, аномалии родовой деятельности и отделения последа, выраженный травматизм мягких тканей родовых путей и пр.).
Обращают внимание и на заболевания новорожденного (везикулез, конъюнктивит, пневмония, синдром дыхательных расстройств, воспалительные заболевания головного мозга, гипотрофия, тимо– и гепатоспленомегалия, сепсис и др.), наличие в семье детей–инвалидов с рождения, с детским церебральным параличом (ДЦП) или другими заболеваниями центральной нервной системы (ЦНС) различной степени тяжести, с отставанием в развитии.
II. Клинико–лабораторное обследование беременных с высоким инфекционным риском. Оно включает стандартные, специфические и дополнительные методы исследования.
Предварительно выявляют жалобы беременной, проводят общий и гинекологический осмотры.
К стандартным методам исследования относятся: определение группы крови, резус–фактора и титра антител к нему, серологические пробы на RW, ВИЧ, HBs– и HCV–антигены, клинические анализы крови и мочи, биохимические и реологические исследования крови беременной, микроскопия мазка влагалища. У всех беременных регулярно определяют вес, его прибавку, высоту стояния дна матки, окружность живота, измеряют пульс, артериальное давление. После 18–20 недель гестации обязательно выясняют данные о шевелении плода.
При неосложненной беременности до 28–й недели осмотры проводят 1 раз в месяц, с 28–й по 36–ю – 1 раз в 2 недели, а после 36–й недели – каждую неделю. При наличии вирусной и/или бактериальной инфекции наблюдения за беременной осуществляют чаще (как правило, по показаниям).
Весьма информативным является анализ показателей гемостаза. Так, например, при плацентарной недостаточности, которая встречается у беременных с инфекцией примерно в 60% случаев, характерными являются: тромбоцитопения, гиперфибриногенемия, увеличение агрегации тромбоцитов и эритроцитов, а также повышение структурной вязкости крови с развитием хронической формы ДВС–синдрома.
Необходимо также исследовать кровь беременной на титр антител к фосфолипидам, так как в данной группе пациенток именно антифосфолипидный синдром может быть непосредственной причиной самопроизвольных выкидышей и привычного невынашивания.
Назначают УЗ–исследование, в том числе плацентометрию и биометрию эмбриона и плода (в конце I триместра, во II триместре – при сроках гестации 16 и 22 недели и в III триместре – при 33 и 36–38 неделях беременности). Ультразвуковыми признаками внутриутробной инфекции (ВУИ) во II триместре гестации являются: структурные дефекты плода (петрификаты в легких и паренхиматозных органах, перивентрикулярный кальциноз и др.); синдром “инфекции околоплодных вод” (многоводие, утолщение оболочек и др.); плацентарная недостаточность (плацентит, кальциноз, инфаркты плаценты, другие воспалительные и деструктивные изменения). При необходимости УЗИ беременным проводят чаще.
С 19–20 недели гестации методом УЗ–допплерометрии определяют параметры кровотока в системе мать–плацента–плод. Данное исследование при нормативных показателях фето– и маточно–плацентарного кровотока повторяют каждые 3–4 недели, в случаях нарушения гемодинамики – в процессе и сразу после лечения.
С 32–33 недели беременности для оценки функционального состояния внутриутробного “пациента” назначают наружную кардиотокографию (КТГ) плода, определяют его биофизический профиль. КТГ обязательно повторяют перед родами. При наличии патологических значений кардиотокографии (показатель состояния плода (ПСП), вычисляемый по формуле, предложенной В.Н. Демидовым и соавт. [1977], – более 1.0), данный метод исследования повторяют в динамике и после курса терапии хронической гипоксии плода.
У беременных с высоким инфекционным риском обязательным является специфическое обследование на наличие бактериальной и/или вирусной инфекции. Для выявления первой необходим микробиологический анализ посева отделяемого из цервикального канала и заднего свода влагалища. При воспалительных заболеваниях органов мочевыделительной, дыхательной, пищеварительной систем проводят бактериологическое исследование биологических жидкостей (мочи, мокроты, крови, слюны, кала).
Для диагностики вирусной инфекции применяются следующие методы:
1. Вирусологический метод. Материалом для заражения культуры тканей могут служить кровь, цервикальное отделяемое, слюна, моча, амниотическая жидкость (при трансабдоминальном амниоцентезе). Наиболее сложным для интерпретации объектом исследования является моча, так как вирусурия часто наблюдается при бессимптомном течении заболевания. Достоверным признаком вирусной инфекции служит виремия, поэтому идентификация вирусов в крови является основным вирусологическим методом. Известны следующие его варианты: а) традиционное выявление способом культивирования считается достоверным и чувствительным методом диагностики. Но метод требует строгого соблюдения временных рамок доставки материала, занимает довольно много времени (до 2 месяцев), дорогостоящ и потому практического значения сегодня не имеет; б) “проба на оболочку” – экспресс–метод культивирования вируса с определением ранних вирусных антигенов с помощью моноклональных антител. Время выполнения анализа 24–48 часов, чувствительность – 85%; в) сенсибилизирование с предварительной обработкой культур тканей для увеличения чувствительности выделения вирусов.
2. Цитологический метод. Простой и доступный, его чувствительность равна примерно 50%. Возможен цитоскопический анализ осадков слюны и мочи, молока и других секретов после окраски по Папаниколау. Соскобы берутся у беременных со слизистой влагалища и канала шейки матки. Недостатками метода являются необходимость инвазивной процедуры, предварительного установления участка поражения органа, что не всегда возможно, в частности, при диссеминированном процессе.
3. Сероиммунологический метод. Из всех его вариантов для обнаружения специфических антител (проявления иммунного ответа) чаще всего применяется метод иммуноферментного анализа (ИФА). Его чувствительность – 99%, специфичность – 95%. В период беременности обязательным является сероиммунологическое обследование инфицированных женщин не реже 1 раза в 1,5–2 месяца для своевременного выявления IgM–антител или нарастания концентрации суммарных противоцитомегаловирусных антител (диагностически значимо 4–кратное повышение титров IgG в парных сыворотках). Обнаружение IgM–антител и увеличение титров суммарных антител у беременной являются показанием к обследованию крови плода с помощью ИФА, для чего проводят операцию кордоцентеза в сроки от 22 до 32 недель гестации. Серодиагностика дает ретроспективную информацию о наличии вирусов.
Из других сероиммунологических методов важное значение имеет метод прямого выявления вирусных антигенов, который является альтернативой обнаружения вируса в биологических жидкостях. При этом чаще всего используют иммунофлюоресцентный метод (чувствительность 88%).
4. Метод определения вирусного генома. Отличается высокой точностью и чувствительностью. Его разновидностью является метод полимеразной цепной реакции (ПЦР). Метод дает возможность качественного и количественного анализа ДНК вируса в биологических жидкостях и тканях. Достоинствами метода являются высокая специфичность (100%), чувствительность (90–97%), быстрота исследования (несколько часов), возможность определения концентрации вируса и активности инфекции, использования при скрининге сравнительно большого числа образцов. Метод позволяет выявить вирусы в любой клетке, если в ней есть хотя бы одна молекула вирусной ДНК, т.е. хотя бы один вирус. Концентрация ДНК вируса служит надежным прогностическим и диагностическим маркером развития явной вирусной инфекции.
С учетом возможной гипердиагностики вирусная инфекция должна быть верифицирована не менее чем двумя методами. Наиболее достоверная информация о наличии ВУИ и состоянии внутриутробного “пациента” при сроках беременности 16–18 до 32 недель может быть получена в высококвалифицированных акушерских стационарах при бактерио– и/или вирусологических исследованиях околоплодных вод (полученных при трансабдоминальном амниоцентезе) и фетальной крови (при кордоцентезе). В околоплодных водах определяют также уровень альфа–фетопротеина (АФП) (отклонения от его нормативных показателей со срока 17–18 недель гестации указывают на высокий риск перинатальной патологии), биохимические параметры (рН, рО2, pCO2, продукты свободно–радикальных реакций, уровни белка, глюкозы, лактата, креатинина, мочевины, электролитов, ферментов и др.).
Что касается фетальной крови, то в зависимости от полученного при кордоцентезе количества возможно также проведение ее клинического и биохимического анализов для диагностики анемии, гипоксии, гемолитической болезни, исследование кариотипа плода для выявления хромосомных аномалий.
При выявлении вирусной (герпетической, цитомегаловирусной, Коксаки, энтеро– и др.) инфекции обязательным является исследование параметров клеточного и гуморального иммунитета, интерферонового статуса. Известно, что у пациенток с вирусной инфекцией имеет место иммунодефицитное состояние, которое сопровождается нарушениями в клеточном звене иммунитета, с угнетением функциональной активности иммунокомпетентных клеток и клеток моноцитомакрофагального ряда, а также нарушением регуляторных взаимоотношений в иммунной системе. Так, при герпетической инфекции характерным является снижение абсолютного содержания Т–лимфоцитов (СД3 +), по–видимому, за счет значительного снижения Т–хелперов (СД4 +) и увеличения содержания В–лимфоцитов.
К дополнительным методам исследования у беременных с высоким инфекционным риском относятся следующие. При подозрении на порок развития эмбриона или плода возможно проведение биопсии трофобласта и хориона (при сроках от 5–6 до 9–11 недель гестации) с последующим анализом кариотипа. К недостаткам метода относятся: частота самопроизвольных выкидышей 1–3%; неинформативность при дефектах нервной трубки плода до 16 недель беременности; возможность развития аномалий пальцев у плода при проведении биопсии хориона до 9 недель гестации.
Беременным с высоким инфекционным риском показано проведение медико–генетического консультирования.
Перспективным для прогнозирования и диагностики ВУИ представляется определение уровней противовоспалительных цитокинов. Повышение содержания интерлейкина–6 в слизи цервикального канала во II и III триместрах гестации у пациенток со смешанной вирусной инфекцией служит маркером латентно протекающей ВУИ у плода. В то же время снижение уровня интерлейкина–6 в слизи и клетках цервикального канала ниже 250 нг/мл, отсутствие в сыворотке исследуемой крови противовоспалительных цитокинов является диагностическим тестом, дающим информацию об эффективности проводимой терапии.
Заключительный диагноз ставится после морфологического исследования последа и клинико–лабораторного обследования новорожденного.
Таким образом, риск перинатальной патологии у беременных с наличием вирусной и/или бактериальной инфекций оценивают на основании данных анамнеза, физикального и лабораторных исследований. Раннее обращение беременных группы высокого инфекционного риска в современные акушерские центры, соблюдение алгоритма обследования позволяют своевременно выявлять инфекционные заболевания, прогнозировать осложнения у матери и плода, проводить профилактические или лечебные меры, способствующие реальному снижению уровней материнской, перинатальной и детской заболеваемости и смертности.
Для цитирования: Новикова С.В., Логутова Л.С., Бочарова И.И. Оптимизация ведения беременных с высоким инфекционным риском. РМЖ. Мать и дитя. 2015;23(1):6.
Помнению ВОЗ, будущее инфекционной патологии человека будут определять оппортунистические инфекции. Огромный вклад вданную проблему внесут вторичные иммунодефицитные состояния, врожденная патология иммунной системы иантропогенное загрязнение окружающей среды.
Особый интерес для представляют перинатальные инфекции. Их возбудители в 1971 г. были включены в так называемый — группу инфекций, которые, несмотря на выраженные различия в структуре и биологических свойствах, имеют сходные клинические проявления и вызывают у плода стойкие дефекты различных систем органов, которые называются внутриутробными инфекциями (ВУИ). Большую группу инфекций в представляют вирусы: герпеса, энтеровирусы, вирусы гриппа. Практика показывает, что интеркуррентные инфекции представляют собой отдельную большую проблему. Масштаб данной проблемы поражает: среди всех случаев инфекционных болезней 90% квалифицируют как грипп и острые респираторные инфекции. Суммарные экономические потери при этих заболеваниях велики, а медицинские последствия часто непредсказуемы. В большей степени это относится к беременным особенностей гестационного иммунитета, что проявляется супрессией специфической ветви иммунного ответа, угнетением интерфероногенеза, снижением фагоцитарной активности лейкоцитов, изменением клеточного и цитокинового профиля на локальном и системном уровнях, изменением колонизационной реактивности организма.
Удельный вес инфекционных болезней в общей патологии человека составляет 70%. Общепризнанным является факт роста вирусных заболеваний, среди которых большую актуальность имеют болезни, обусловленные вирусами семейства герпеса: генитальный и лабиальный герпес, цитомегаловирус, опоясывающий лишай, ветряная оспа, инфекционный мононуклеоз. При острой (первичной) инфекции беременность может осложниться формированием первичной плацентарной недостаточности, бласто- и эмбриопатиями, потерей плода, развитием тяжелых врожденных инфекций с поражением центральной нервной системы (ЦНС). Но и непервичные (персистирующие) инфекции вызывают нарушение неспецифической резистентности организма, способствуют формированию аутоиммунного компонента воспалительного процесса, который в условиях гестационного иммунитета приводит к персистенции аутоантител, развитию гемостатических нарушений, формированию плацентарной недостаточности, развитию ВУИ. Однако и бактериальные агенты не сдают своих позиций, достаточно часто образуя ассоциации с вирусами. Согласно ранее проведенным исследованиям, острые формы инфекции, частые и длительные рецидивы хронической инфекции, а также наличие смешанной и инфекции являются факторами риска развития железодефицитной анемии (ЖДА) у беременных с инфекцией [1].
Анемия является достаточно часто встречающимся осложнением беременности, характеризуется снижением уровня гемоглобина и количества эритроцитов. Анемия при беременности делится на три степени тяжести, которые чаще определяются по уровню гемоглобина в крови. При легкой степени показатель составляет 110–90 , при средней — 90–70 , а при тяжелой — менее 70 . Анемия легкой степени при беременности обычно протекает бессимптомно и выявляется после исследования анализа крови. При анемии средней или тяжелой степени беременные предъявляют жалобы на общее ухудшение самочувствия (слабость, утомляемость, головокружение), одышку, учащенное сердцебиение. На вопрос, чем опасна анемия при беременности, можно однозначно ответить, что болезнь негативно влияет как на течение беременности, так и на роды и послеродовой период. Анемия при беременности может привести к развитию гестационных и перинатальных осложнений. Для плода анемия матери грозит формированием фетоплацентарной недостаточности с задержкой внутриутробного роста и хронической гипоксией плода. недостатка железа в организме матери во время беременности анемия нередко возникает у детей на первом году жизни [2].
Предметом особого внимания является наличие у беременных железодефицитных состояний (ЖДС). По данным ВОЗ, каждый человек в мире имеет дефицит железа. По уровню сывороточного железа у беременных этот дефицит составляет от 49% до 99%, по уровню гемоглобина частота ЖДА у беременных колеблется от 21% до 80%. В 98–99% наблюдений анемии у беременных являются следствием ЖДС [3]. Если проанализировать в популяции суточную потребность в железе, то у беременных она оказывается наиболее высокой и составляет 6 мг. ЖДС развивается поэтапно. На первом этапе снижается уровень железа в депо. Это прелатентный железодефицит, который клинически не диагностируется, с нормальным уровнем гемоглобина и трансферрина. Снижение уровня транспортного железа, потеря тканевого железа и снижение активности железосодержащих ферментных систем — это латентный дефицит, имеющий клинические и лабораторные проявления. Нарушение синтеза гемоглобина и появление гипохромной ЖДА свидетельствуют о манифестном железодефиците и ЖДА.
Результаты применения препарата Сорбифер Дурулес у беременных с первого триместра беременности отражены в таблице 2.
Таким образом, на фоне применения железосодержащего препарата Сорбифер Дурулес в течение 2 мес. для профилактики и лечения анемии с ранних гестационных сроков мы наблюдали повышение уровня гемоглобина в среднем на 10 . На протяжении всего гестационного периода и в послеродовом периоде этот показатель сохранял стабильность. Показатели числа эритроцитов и цветной показатель крови после лечения во время беременности и в послеродовом периоде также превышали исходные данные.
У пациенток с инфекцией и заболеваниями (ИВЗ), которым проводилась терапия препаратом Сорбифер Дурулес, во время беременности рецидивов инфекционного процесса не выявлено. После однократного курса антибактериальной терапии они в течение беременности получали антианемические средства и терапию, направленную на улучшение функции фетоплацентарного комплекса. У 5 (4%) из 125 наблюдавшихся была диагностирована умеренная преэклампсия, у 8 (6,4%) — отеки, вызванные беременностью, у 7 (5,6%) во втором триместре беременности проводилось лечение в связи с угрозой ее прерывания.
У новорожденных от матерей высокого инфекционного риска, которым помимо базовой терапии назначался железосодержащий препарат Сорбифер Дурулес, лишь в 5 (4%) наблюдениях из 125 были выявлены малые формы ВУИ: везикулопустулез (3) и конъюнктивит (2). Тяжелых форм ВУИ не отмечено.
Таким образом, эффективность железосодержащего препарата Сорбифер Дурулес, который наиболее часто назначается беременным врачами первичного звена (92,3%), определяется прежде всего его составом и удобным режимом дозирования. Сорбифер Дурулес содержит оптимальное количество двухвалентного железа — 100 мг, что дает возможность назначать 1–2 таблетки в сутки. Всасывание железа улучшается благодаря наличию в составе препарата аскорбиновой кислоты. Аскорбиновая кислота обладает также выраженными антиоксидантными свойствами. Минимальная ежедневная потребность в аскорбиновой кислоте во триместрах беременности составляет 60 мг, а именно такое количество входит в состав Сорбифера Дурулес.
Согласно рекомендации ВОЗ, все беременные женщины на протяжении года, а именно 6 мес. до родов и 6 мес. после родов, должны принимать препараты железа, учитывая повышенную потребность в этом микроэлементе. Кроме того, о назначении препаратов железа необходимо помнить, ориентируясь на данные по распространенности ЖДС в масштабах планеты и в связи с ростом инфекций среди женщин репродуктивного возраста [4].
Для увеличения эффективности лечения ЖДА не следует пренебрегать некоторыми правилами. Эффективная лечебная доза железа составляет 200 мг элементарного железа в сутки (2 таблетки препарата Сорбифер Дурулес), а эффективная профилактическая доза и терапия насыщения депо железа — 100 мг элементарного железа (1 таблетка препарата Сорбифер Дурулес). Принимать препарат следует за 1 час — 30 мин до приема пищи, запивая водой. Не следует совмещать прием препарата Сорбифер Дурулес с приемом антибиотиков. Интервал между приемами антианемических и антибактериальных препаратов должен составлять не менее 2 ч. Важно знать, что такой микроэлемент как кальций препятствует всасыванию железа, в связи с чем не рекомендуется прием железа с молочными и кисломолочными продуктами.
Следует помнить, что Сорбифер Дурулес обеспечивает самое быстрое восстановление уровня гемоглобина (уже через 2–3 нед.). Восстановление гемоглобина происходит быстрее, чем при приеме препаратов трехвалентного железа [5]. Препарат отлично переносится благодаря технологии замедленного высвобождения действующего вещества Дурулес. Немаловажным также является лучшее соотношение цены и качества в препарате.
Таким образом, проведение своевременной обоснованной терапии препаратом Сорбифер Дурулес и адекватной базовой противовоспалительной терапии у беременных с ЖДА в сочетании с заболеваниями позволило избежать обострения ИВЗ во время беременности, а также снизить частоту акушерских и перинатальных осложнений.
Цель исследования. Снижение частоты послеродового эндометрита у родильниц инфекционного риска.
Материал и методы. 117 родильниц инфекционного риска, разделенные на 2 группы: I – основная (n=49) и II – группа сравнения (n=68). Пациенткам I группы в послеродовом периоде помимо антибиотикопрофилактики внутриматочно вводился формованный сорбент, пациентки II группы получали только традиционную антибиотикопрофилактику.
Результаты. При исследовании микрофлоры родовых путей установлена ведущая роль бактериальной грамположительной микрофлоры с высокой антибиотикоустойчивостью. Выявлено напряжение Т-лимфоцитов, снижение иммунорегуляторного индекса, повышение активности провоспалительных цитокинов. После проведения традиционной антибиотикопрофилактики в полости матки более чем в 50% сохраняется патогенная микрофлора и высокая активность местных провоспалительных цитокинов.
Заключение. Предложенный способ профилактики послеродового эндометрита с внутриматочным введением формованного сорбента более эффективен по сравнению с традиционным подходом.
Гнойно‐септические заболевания послеродового периода остаются одной из актуальных проблем современного акушерства во многих странах. Послеродовой эндометрит (ПЭ) является наиболее распространенной формой послеродовой инфекции и вместе с тем одной из основных причин развития генерализованных форм инфекционного процесса, обусловливающих материнскую смертность [1–3]. Частота эндометрита после самопроизвольных физиологических родов составляет 1–5%, после патологических – 15–20%, после кесарева сечения – свыше 20% [4], у женщин с высоким инфекционным риском она достигает 80,4%. Даже при проведении антимикробной профилактики в родах частота данного осложнения остается достаточно высокой (от 0,06 до 10,6% после родов и от 8,8 до 35,3% после кесарева сечения) [1, 5–7].
Согласно современным данным, основными причинами роста частоты ПЭ являются изменение видового состава микробной флоры, возникновение агрессивных форм бактериальной инфекции, перераспределение значимости предрасполагающих факторов в связи с увеличением числа оперативных вмешательств в родах, широкое внедрение антибиотиков и нередко их нерациональное использование. Использование антибиотиков при лечении инфекционной патологии в акушерстве позволило добиться снижения частоты тяжелых форм гнойно‐воспалительных заболеваний, но на современном этапе одной из центральных проблем антимикробной терапии стала антибиотикорезистентность [8–10].
Высокая частота инфекционных осложнений послеродового периода и резистентность патогенной микрофлоры к проводимой терапии требуют разработки новых подходов к профилактике ПЭ.
Цель исследования: снижение частоты ПЭ у родильниц группы инфекционного риска на основе изучения патогенной флоры и иммунологических тестов с применением внутриматочного введения сорбента.
Материал и методы исследования
В исследование были включены 117 беременных высокого инфекционного риска, которые в послеродовом периоде были разделены на 2 группы: I – основная (n=49) и II – группа сравнения (n=68). Группы были сопоставимы по возрасту, данным соматического и акушерско-гинекологического анамнеза. Рандомизация производилась по четным и нечетным числам госпитализации в стационар.
Критериями включения служили добровольное информированное согласие пациенток, наличие хронического и острого многоводия на этапе беременности, обострение генитальных и экстрагенитальных заболеваний инфекционной природы во время беременности. Критериями исключения из данной группы были здоровые беременные, пациентки с активным течением специфических инфекционных (туберкулез, вирусные гепатиты B, C) и венерических (сифилис, гонорея, хламидиоз) заболеваний.
Родильницам основной группы в послеродовом периоде для профилактики инфекционных осложнений внутриматочно вводился формованный сорбент одновременно с внутривенным введением антибиотика. Размер пористого углеродного аппликатора: длина 6 см, ширина 1 см, толщина 1 см. В группе сравнения проводилась только традиционная антибиотикопрофилактика послеродовых гнойно-септических осложнений.
Формованный сорбент произведен ФГБУ науки Институт проблем переработки углеводородов Сибирского отделения РАН (директор – доктор химических наук, профессор, член-корреспондент РАН В.А. Лихолобов). Регистрационное удостоверение № ФСР 2008/03492 от 1 марта 2010 года – изделие медицинского назначения, разрешено к производству и продаже на территории Российской Федерации. Токсикологическое заключение № 219-08 от 28.08.2008: не токсичен, стерилен, апирогенен, отвечает требованиям нормативной документации. В качестве местного аппликационного средства сорбции использовался в абдоминальной хирургии [6], в акушерской практике применяется впервые. Исследование одобрено этическим комитетом, выписка из протокола № 51 от 10.10.2012.
Тирская Ю.И. , Баринов С.В. , Долгих Т.И. , Пьянова Л.Г. , Чернышев А.К. , Ковалева Ю.А. , Корнеев Д.В. , Шамина И.В.
Ирина Извекова, д.м.н., профессор кафедры инфекционных болезней педиатрического факультета Новосибирского медицинского университета, напомнила о заявлении ВОЗ и UNICEF, сделанном в апреле этого года в разгар пандемии коронавирусной инфекции, о возросшей важности национальных программ иммунизации для защиты жизни и экономики на международном уровне. В своем выступлении она осветила вопрос критического значения вакцинации для иммунокомпрометированных пациентов, находящихся в группе риска заражения и более тяжелого течения инфекционных заболеваний. С течением времени специалисты нарабатывают все больший объем знаний об иммуносупрессивных состояниях – были выделены группы аутоиммунных и аутовоспалительных заболеваний, и при анализе болезней, которым особенно подвержены такие пациенты на фоне получаемой ими иммуносупрессивной терапии, было установлено, что для них исключительно значимы инфекции, вызываемые инкапсулированными возбудителями, такими как менингококк, гемофильная палочка и пневмококк.
Пневмококк вызывает от 28 до 55% всех случаев острого среднего отита, которому подвергаются до 95% детей к 5 годам и заболеваемость которым в РФ находится на уровне 700 тыс. в год. 1 Крайне опасен пневмококковый менингит – показатель летальности от этого заболевания в 2018 г. составил 18%, а среди детей до 5 лет – 15%. 2 Одним из тяжелых последствий инфицирования S. Pneumoniae является пневмония.
Важная группа пациентов, для которых вакцинация имеет особое значение –больные с ревматическими заболеваниями. В этой категории пациентов риск пневмококковых пневмоний в 4 раза превышает аналогичный риск среди здоровой популяции, а вероятность развития опасных инвазивных пневмококковых инфекций выше в 4-7 раз.
Фармакоэкономический анализ показал, что вакцинация ПКВ13 65-летних граждан с хроническими заболеваниями и иммунодефицитными состояниями может являться эффективной с экономической точки зрения мерой по обеспечению снижения заболеваемости пневмококковыми инфекциями и связанной с ними летальности. При этом экономия средств бюджета может составить до 60,9% в пятилетней перспективе. 6 Вакцинация от пневмококковой инфекции детей первых двух лет жизни включена в Национальный календарь профилактических прививок (НКПП) РФ с 2014 года.
Несмотря на наличие вакцины и рекомендаций по иммунизации как российских специалистов, так и экспертов ВОЗ, удельный вес внебольничных пневмоний среди причин смерти от инфекционных заболеваний в России остается достаточно высоким – в детской популяции это 35%, среди взрослых – больше половины. 7
Лейла Сеймуровна представила схемы и подходы к вакцинации против пневмококковой инфекции, напомнила о приоритизации иммунизации восприимчивых групп населения вакцинами против пневмококковой инфекции и сезонного гриппа, что согласуется с руководством ВОЗ по плановой иммунизации по время пандемии COVID-19. 8
Вакцинация может помочь сохранить ресурсы системы здравоохранения за счет снижения вероятности заболевания серотип-специфичными инвазивными пневмококковыми инфекциями и внебольничными пневмококковыми пневмониями. 9, 10 Профилактика тяжелых инфекций, вызванных пневмококком, может быть полезна как фактор снижения нагрузки на систему здравоохранения.
Читайте также:

