Губчатый энцефалит и актовегин
Обновлено: 19.04.2024
Для цитирования: Шмырев В.И., Остроумова О.Д., Боброва Т.А. Возможности препарата Актовегин в профилактике и лечении деменции. РМЖ. 2003;4:216.
МГМСУ им. Н.А. Семашко, УНЦ МЦ Управления делами Президента РФ, Москва
П од деменцией понимают диффузное нарушение психических функций в результате органического поражения мозга, проявляющееся первичными нарушениями мышления и памяти и вторичными эмоциональными и поведенческими расстройствами. Деменция является крайней степенью снижения высших психических функций. О деменции принято говорить в тех случаях, когда нарушения памяти и других когнитивных функций выражены настолько, что препятствуют осуществлению профессиональной и социальной деятельности в прежнем объеме и качестве. В том случае, если у человека имеют место нарушения памяти, мышления или других высших психических функций, но они не препятствуют профессиональной деятельности и/или не вызывают дезадаптации пациента в быту, говорят о когнитивных нарушениях (когнитивном снижении).
Болезнь Альцгеймера и сосудистая деменция – самые распространенные виды деменции. В России именно сосудистая деменция занимает первое место по частоте (5,4%), ее удельный вес – от 10 до 39% всех случаев деменции. По определению МКБ–10 сосудистая деменция – результат инфарктов головного мозга вследствие заболевания церебральных сосудов, включая цереброваскулярную болезнь при артериальной гипертензии (АГ). Инфаркты, как правило, небольшие, но проявляется их кумулятивное действие.
Основную патогенетическую роль в формировании мнестических расстройств при подкорковых деменциях играет дисфункция лобных долей головного мозга, которая приводит к снижению активности, недостаточности планирования, нарушению последовательности и избирательности мнестических операций. Для пациентов с сосудистой деменцией характерны замедление всех психических процессов, сужение круга интересов. На поздних стадиях могут развиваться нарушения абстрактного мышления и суждений. Очаговых нарушений высших корковых функций (афазия, аграфия, алексия, апраксия, акалькулия), как правило, не развивается, что типично для когнитивных расстройств подкоркового типа. Появление такой грубой симптоматики сопровождает деменцию тяжелой степени.
Более чем у половины больных сосудистой деменцией наблюдается так называемое эмоциональное недержание (слабодушие, насильственный плач). Сосудистой деменции присущи длительные периоды стабилизации и даже известного обратного развития мнестико–интеллектуальных нарушений, и поэтому степень ее выраженности нередко колеблется весьма значительно в ту или иную сторону. В подобных случаях имеют значение колебания в состоянии регионального мозгового кровотока.
Помимо когнитивных нарушений, у пациентов с сосудистой деменцией имеются и неврологические проявления: подкорковый, псевдобульбарный, мозжечковый синдромы, нарушение контроля тазовых функций, в основном недержание мочи, парезы мышц конечностей, чаще негрубые и обычно не влияющие на функциональную активность больного. Сочетание когнитивных и отмеченных неврологических нарушений отличает сосудистую деменцию от дегенеративных заболеваний, в частности, болезни Альцгеймера, при которой доминируют когнитивные расстройства и симптомы нарушения высших корковых функций (афазия, апраксия).
Ведущую роль в формировании деменции при сосудистых поражениях головного мозга играет поражение белого вещества головного мозга и базальных ганглиев, что приводит к нарушению связи лобных долей головного мозга и подкорковых структур (феномен корково–подкоркового разобщения). Основным патогенетическим фактором развития этого феномена является АГ, которая приводит к изменениям сосудистой стенки (липогиалиноз), преимущественно в сосудах микроциркуляторного русла. Вследствие этого развивается артериолосклероз, что обусловливает изменение физиологической реактивности сосудов. В таких условиях снижение артериального давления (АД), в том числе вследствие неадекватной гипотензивной терапии, приводит к снижению перфузии и развитию ишемии белого вещества головного мозга.
Исходя из вышеизложенного профилактика и лечение сосудистой деменции и когнитивных нарушений прежде всего должны включать адекватную коррекцию повышенного АД. Достижение целевого АД обязательно, но темпы его достижения должны быть максимально щадящими. Они зависят от исходных цифр АД у данного больного, длительности и тяжести как АГ, так и сопутствующих заболеваний. Но в общем верно правило – резкое снижение АД для пожилого больного с АГ не менее, а, скорее, более опасно, чем его резкое повышение. Лечение АГ, ишемической болезни сердца, сердечной недостаточности, назначение антиагрегантов, хирургическая коррекция атеросклеротического сужения магистральных артерий способствуют профилактике нарастания когнитивных нарушений и, по некоторым данным, снижению уже имеющихся. Также необходим контроль гипергликемии и гиперлипидемии. Однако в ряде случаев патогенетическая терапия деменции до сих пор представляется невозможной, поскольку причина ее остается либо неизвестной (сенильная деменция типа Альцгеймера), либо не поддающейся воздействию (мультиинфарктная деменция).
Существующие в настоящее время подходы в лечении деменции основаны также на улучшении доставки и использования кислорода и глюкозы. Глюкоза и кислород необходимы клеткам мозга для осуществления аэробного гликолиза, в процессе которого вырабатывается 38 молекул АТФ, которые, в свою очередь, обеспечивают клеткам адекватный уровень функционирования. О значимости кислорода и глюкозы для поддержания нормального функционирования клеток головного мозга свидетельствует тот факт, что для жизнедеятельности головного мозга (вес которого составляет 2% от массы тела) из протекающей крови при нормальном объеме тотального кровотока экстрагируется 50% кислорода и 10% глюкозы. Действительно, ведь в условиях дефицита этих веществ происходят процессы не аэробного, а анаэробного гликолиза, в результате чего образуются лишь 2 молекулы АТФ. В таких условиях невозможно не только нормальное функционирование клеток мозга, но происходит их гибель.
Поэтому существуют и другие направления профилактики и лечения деменции. Так, уже достаточно давно в клинической практике с этой целью применяют препарат Актовегин – современный антигипоксант. Это высокоочищенный гемодиализат, получаемый методом ультрафильтрации из крови телят. Препарат содержит органические низкомолекулярные соединения: аминокислоты, олигопептиды, нуклеозиды; промежуточные продукты углеводного и жирового обмена; олигосахариды и гликолипиды, а также электролиты (натрий, кальций, фосфор, магний) (рис. 1). Технология получения гемодиализата исключает наличие белковых и других компонентов, обладающих антигенными и пирогенными свойствами.
Рис. 1. Состав препарата Актовегин
Основой фармакологического действия Актовегина является его влияние на процессы внутриклеточного метаболизма. Под влиянием этого препарата улучшается транспорт глюкозы в клетки и поглощение кислорода в тканях. Поступление в клетку большого количества кислорода приводят к активации процессов аэробного окисления, что увеличивает энергетический потенциал клетки (рис. 2). Под действием Актовегина активируются переносчики глюкозы, причем отмечено усиление транспорта глюкозы до 50% от максимального эффекта инсулина. Но это действие Актовегина является инсулиннезависимым: благодаря наличию гликолипидов в своем составе Актовегин непосредственно вызывает активацию переносчиков глюкозы.
Рис. 2. Фармакологическое действие Актовегина на процессы внутриклеточного метаболизма
Cуществует большое количество исследований, как отечественных, так и зарубежных, которые свидетельствуют об улучшении когнитивных процессов на фоне лечения Актовегином. Однако особый интерес, конечно, представляют результаты двойных слепых, плацебо–контролируемых исследований (рис. 3). Полученные результаты этих исследований свидетельствуют о том, что у больных с различными заболеваниями головного мозга на фоне лечения Актовегином отмечено достоверное по сравнению с плацебо улучшение конгитивных функций.
Рис. 3. Результаты двойных слепых плацебо-контролируемых исследований препарата Актовегин
Так, B.Saletu и соавт., применяя Актовегин в/в, обнаружили достоверное по сравнению с плацебо улучшение памяти, внимания и некоторых параметров мышления больных с возрастным снижением памяти. В данном исследовании принимали участие пациенты в возрасте от 50 до 80 лет (средний возраст 64 года) с возрастным снижением памяти, при этом ни у кого из пациентов не было диагностических критериев деменции. Указанный эффект Актовегина авторы отметили уже через 14 дней лечения.
Другая группа исследователей (W.M. Herrmann и соавт.) также использовали в/в способ введения Актовегина. Однако они обследовали пациентов с болезнью Альцгеймера и мультиинфарктной деменцией (рис. 5). Поэтому срок лечения Актовегином составил уже 4 недели. В группе Актовегина авторы обнаружили достоверное по сравнению с плацебо улучшение когнитивных процессов по сбору и обработке информации, выраженности симптомов деменции, общего самочувствия пациентов и потребности в уходе. При этом улучшение отмечено уже после второй недели терапии и было еще более выраженным после четырех недель. Несмотря на то, что выбранные сроки лечения являлись относительно малыми (по меньшей мере, необходимо три месяца), требуемый и значимый эффект все–таки был выявлен. Это может быть обусловлено внутривенным применением препарата, что могло вызвать более быстрое наступление эффекта.
Рис. 5. Данные обследования больных с болезнью Альцгеймера и мультиинфарктной деменцией после курса Актовегина (в/в)
В литературе имеются данные двойных слепых, плацебо–контролируемых исследований и об эффективности пероральной лекарственной формы Актовегина. Так, W.D. Oswald и соавт. показали, что Актовегин в достоверно большей по сравнению с плацебо степени увеличивает скорость когнитивных процессов у больных с синдромом органического поражения головного мозга легкой и средней тяжести (рис. 4). В этом исследовании пациенты старше 60 лет с легкой и средней степенью тяжести психоорганического синдрома получали 400 мг х 3 раза или плацебо в течение 8 недель.
Рис. 4. Данные двойных слепых плацебо-контролируемых исследований пероральной лекарственной формы Актовегина
W. Jansen и G.W. Brueckner у пожилых (60–72 года) больных с цереброваскулярной недостаточностью изучали терапевтическое воздействие драже Актовегина форте (200 мг активного вещества) и зависимость результатов терапии от дозы препарата. Пациенты были рандомизированы в 3 группы: Актовегин форте по 3 драже 3 раза в день (40 человек), Актовегин форте по 2 драже 3 раза в день (40 человек), плацебо (20 пациентов по 3 драже 3 раза в день, 20 пациентов по 2 драже 3 раза в день). Продолжительность терапии была больше, чем в исследовании W.D. Oswald и соавт., и составила 12 недель.
Для оценки интеллекта был выбран тест с мозаикой (за определенное время необходимо разобрать 16 колод по 7 узорам), который требует наличия синтетических и аналитических способностей и считается особенно сложным для пациентов со снижением интеллекта и престарелых (рис. 6). Этот тест также характеризует степень возрастного снижения интеллектуальных способностей. Авторы обнаружили, что оба режима дозирования Актовегина в достоверно большей степени, чем плацебо, улучшают мышление и внимание пожилых больных.
Рис. 6. Результаты теста с мозаикой по оценке интеллекта у пожилых при приеме Актовегина по схеме
H.V. Semlitsch и соавт. в двойном слепом, плацебо–контролируемом исследовании изучали влияние Актовегина на так называемый компонент Р300 вызванных потенциалов головного мозга у пациентов с возрастными расстройствами памяти. Поздний положительный компонент (Р300) потенциалов (син.: когнитивные вызванные потенциалы) используют в исследованиях когнитивных процессов и ноотропных препаратов, поскольку установлена тесная связь между Р300 и когнитивными функциями. Это означает, что потенциальный ноотропный препарат должен укорачивать латентность Р300 и/или увеличивать амплитуду Р300, и/или увеличивать активность источников Р300.
Каждый пациент в этом исследовании получал в течение 2–х недель терапию либо 250 мл 20% раствора Актовегина, либо 250 мл плацебо. После применения Актовегина в сравнении с плацебо увеличилась амплитуда париетальных Р300. Это может отражать улучшение когнитивных процессов в париетальном отделе коры головного мозга – регионе, который, с одной стороны, играет фундаментальную роль в формировании внимания, и, с другой стороны, функционально повреждается при деменции.
Результаты ЭЭГ–картирования головного мозга показали, что Актовегин в отличие от плацебо оказывает значительное положительное воздействие на функцию головного мозга человека (снижение дельта– и тета–активности и усиление смежной с альфа медленной бета–активности, снижение быстрой бета–активности). Топографически энцефалотропные эффекты лечения Актовегином были более выражены в париетальной, фронто–центральной и темпоро–окципитальной областях. При этом топографически наибольшие различия между Актовегином и плацебо также наблюдались в париетальных и темпоральных отделах. Эти данные представляют собой интерес, поскольку в последних исследованиях с ЭЭГ–картированием головного мозга при деменции типа Альцгеймера именно париетальные и темпоральные отделы отличались от таковых в контрольной группе здоровых лиц. Действительно, большинство изменений описываются невропатологами, нейробиохимиками и нейрорентгенологами именно в этих областях головного мозга. Описано значительное уменьшение массы коры головного мозга в париетальных и темпоральных областях, что согласуется с данными о снижении церебрального кровотока в центральной и парието–окципитальной областях и с данными о снижении метаболизма глюкозы в указанных областях, измеренного при помощи позитронной эмиссионной томографии (ПЭТ) при болезни Альцгеймера. R.P. Friedland и соавт. заметили, что в темпоро–париетальной коре наиболее страдает метаболизм глюкозы. Автор подчеркивает, что в этой же области наиболее выражены и гистопатологические изменения.
Таким образом, результаты двойных слепых, плацебо–контролируемых исследований свидетельствуют об эффективности препарата Актовегин для профилактики и лечения деменции.
Для профилактики деменции у больных с нарушением когнитивных функций обычно применяют Актовегин форте 200 мг х 3 раза в день в течение 1,5–2 месяцев. У пациентов с наличием сосудистой деменции обычно начинают с внутривенного введения Актовегина 400–800 мг (10–20 мл) в/в капельно в течение 10–14 дней, а затем переходят на пероральный прием Актовегина форте по 200 мг 3 раза в день.
Комплексный подход к лечению пожилых пациентов, включающих в том числе адекватное лечение сердечно–сосудистых заболеваний и применение препаратов с доказанной эффективностью, позволит повысить качество жизни лиц пожилого возраста, что имеет важное медицинское и социальное значение.
1. Верещагин Н.В., Гулевская Т.С., Ю.К.Миловидов. Неврологические аспекты проблемы сосудистой деменции.Журнал неврологии и психиатрии – 1993 – №3 – С.91–95.
2. Яхно Н.Н., Захаров В.В. Когнитивные и эмоционально–аффективные нарушения при дисциркуляторной энцефалопатии. // Русский медицинский журнал – 2002 – Том 10 – №12–13 – С. 539–542.
3. Преображенский Д.В., Сидоренко Б.А. Лечение артериальной гипертензии. Часть 1. – Москва, 1999. – С.4–23.
4. Калашникова Л.А., Кадыков А.С., Гулевская Т.С. и соавт. Когнитивные нарушения и деменция при субкортикальной артериосклеротической энцефалопатии в пожилом и старческом возрасте. // Клиническая геронтология – 1996 – №1 – С.22–26.
5. Медведев А.В. Сосудистая деменция // Cовременная психиатрия – 1998 – №4 – С.20–23.
6. Schaffler K., Wauschkuhn C.H., Hauser B. Pilоt–study to evaluate the encephalotropic potency of ActoHorm using electroretinography and visual evoked potentials unger hypoxyc conditions in 12 healthy volunteers. // Arzneimittel–Forschung – 1991 – Vol.41 – 398–403.
7. Saletu B., Grunberger J., Linzmayer L. et al. EEG Brain Mapping and Psychometry in age–associated memory impairment after acute and 2–week infusion with the impairment after acute and 2–week infusion with the hemoderivative Actovegin: double–blind, placebo–controlled trials. // Neuropsychobiology – 1990–91 – Vol.24 – P.135–148.
8. Herrmann W.M., Bohn–Olszewsky W.J., Kuntz G. Infusionstherapie mit Actovegin bei Patienten mit ptimar degenerativer Demenz vom Alzheimer Typ und Multiinfarkt–Demenz. // Z.Geriatrie – 1992 – Vol.5 – P.46–55.
9. Oswald W.D., Steger W., Oswald B. et al. Increase of fluid cognitive components as an aspect in evaluation drug efficacy. A double–controlled study with Actovegin. // Zeitschrift fur Gerontopsychologie und Psichiatrie – 1991 – Vol.4 – №4 – P.209–220.
10. Jansen W., Brueckner G.W. Лечение хронической цереброваскулярной недостаточности с использованием драже Актовегин форте (двойное слепое, плацебо–контролируемое исследование). // Русский медицинский журнал – 2002 – Том 10 – №12–13 – С.543–547.
11. Saletu B., Anderer P., Paulus E. et al. EEG brain mapping in SDAT and MID patients before and during placebo and xantinolnicotinate therapy: Reference considerations; in Samson–Dollfus D., Guieu JD, Gotman J, Etevenon P. (eds): Statistics and Topography in Quantitative EEG. Paris, Elsevier, 1988, pp. 251–275.
12. Najilerahim A, Bowen DM: Regional weight loss of the cerebral cortex and some subcortical nuclei in senile dementia of the Alzheimer type. // Acta neuropathol – 1988 – Vol.75 – P.509–512.
13. Duara R., Grady C., Haxby J et al. Positron emission tomography in Alzheimer’s disease. // Neurology – 1986 – Vol.36 – P.879–887.
14. Friedland RP., Budinger TF., Ganz E. et al. Regional cerebral metabolic alternations in demencia of the Alzheimer type. Positron emission tomography with (F) fluorodeoxyglucose. // J Comput Assist Tomogr – 1983 – Vol.7 – P.590–598.
15. Semlitsch H.V., Anderer P., Saletu B. Hochmayer I. Topographic mapping of cognitive event–related potentials in a double–blind, placebo–controlled study with the hemoderivative actovegin in age–associated memory impairment. // Neutopsychobiology – 1990–91 – Vol.24 – P.49–56.
М.Д. Дибиров (1), Р.У. Гаджимурадов (1, 2), О.Х. Халидов (1, 2), М.Р. Какубава (1, 2), М.В. Полянский
(1) Кафедра хирургических болезней и клинической ангиологии ГБОУ МГМСУ им. А.И. Евдокимова Минздрава России, Москва; (2) Городская клиническая больница № 81 ДЗ Москвы
Цель работы составила оценка эффектов препарата Актовегин в комплексном лечении хронических ран различной этиологии. Под наблюдением находились 118 пациентов, госпитализированных в отделение сосудистой хирургии и хирургии гнойных осложнений сахарного диабета. Больные были разделены по этиологическому фактору на три группы, включавшие в себя патологические состояния, вызывающие формирование 90% длительно незаживающих раневых дефектов. Каждая из групп была разделена на пациентов получавших только традиционную терапию, и пациентов получавших помимо традиционной терапии Актовегин. Результаты исследования показали: по сравнению с больными которым была назначена только традиционная терапия, у пациентов получавших Актовегин, на 3-4 суток раньше уменьшались размеры хронических ран, на 2-3 суток раньше снижался болевой синдром,. Вышеперечисленное позволяет рекомендовать Актовегин для лечения хронических ран различной этиологии.
Актуальность проблемы
Хронические раны представляют собой серьезную проблему для мирового здравоохранения на протяжении многих лет. Многие российские и зарубежные авторы занимались ее изучением, принимая различные определения этого понятия и предлагая множество методов лечения при данной патологии [1, 3, 6, 9]. Несмотря на массу научных трудов по этой тематике и сотни предложенных инновационных методов лечения, проблема лечения хронических ран и сейчас остро стоит перед хирургами во всем мире [2–4, 11, 12]. Ежегодные затраты на лечение хронических ран достигают 9 млрд долл. США и требуют массу времени и усилий медицинского персонала для организации длительного адекватного наблюдения за этой категорией пациентов [5, 6, 8, 10, 12].

Материал и методы
Под нашим наблюдением находились 118 пациентов в возрасте от 52 до 80 лет, госпитализированных в отделение сосудистой хирургии и хирургии гнойных осложнений сахарного диабета ГКБ № 81. Все пациенты находились на лечении в связи с наличием хронических раневых дефектов. Больные были разделены по этиологическому фактору на три группы, включившие патологические состояния, вызывающие формирование 90% длительно незаживающих раневых дефектов. В 1-ю группу были включены 54 пациента, страдавших длительно незаживающими трофическими язвами нижних конечностей вследствие хронической венозной недостаточности. У всех пациентов при ультразвуковом дуплексном сканировании (УЗДС) вен нижних конечностей диагностирована несостоятельность клапанов подкожных вен и наличие длительно существующих (от 2 до 48 месяцев) незаживающих раневых дефектов в области нижней и средней третях голеней. Всем больным выполнено этиопатогенетическое лечение: после курса антибактериальной терапии с учетом микробного пейзажа и очистки раневых дефектов была проведена кроссэктомия в сочетании с операцией Линтона. В послеоперационном периоде больные были разделены по 27 пациентов на две группы – основную и контрольную, идентичные по полу, возрасту и тяжести сопутствующей патологии. Больным проведена медикаментозная терапия и местное лечение в полном объеме. Пациенты основной группы помимо традиционного лечения получали Актовегин внутривенно (1200 мг 1 раз в сутки в течение 14 дней) и местно в форме геля, мази или крема в зависимости от стадии раневого процесса:
- в стадии экссудации использован Актовегин 20% в форме геля толстым слоем с последующим наложением компресса с Актовегином 5% в форме мази;
- в стадии пролиферации использована повязка с Актовегином 5% в форме крема;
- в стадии грануляции применена повязка с Актовегином 5% в форме геля.
После выписки больным назначен препарат Актовегин по 1 таблетке (200 мг) 3 раза в сутки в течение 30 дней. В контрольной группе местное лечение осуществлено мазевыми повязками (Бетадин, метилурацил, Левосин).
Во 2-ю группу включены 36 пациентов с симптомами хронической артериальной ишемии нижних конечностей, а также длительно незаживающими раневыми дефектами на различных уровнях стоп на фоне облитерирующего атеросклероза и эндартериита. При УЗДС артерий нижних конечностей диагностированы окклюзии бедренно-подколенно-берцового сегмента на различных уровнях. Всем больным по показаниям выполнена коррекция магистрального кровотока: бедренно-дистальные шунтирования аутовенной или синтетическими протезами, проведена консервативная гемореологическая (реополиглюкин, декстран и т.д.), антикоагулянтная (гепарин, Плавикс, Вессел Дуэ Ф), дезагрегантная (пентоксифилин, ацетилсалициловая кислота) терапия в полном объеме. В послеоперационном периоде пациенты были разделены по 18 человек на основную и контрольную группы, идентичные по полу, возрасту и тяжести сопутствующей патологии. Больные основной группы помимо стандартного лечения получали Актовегин внутривенно 1200 мг 1 раз в сутки в течение 14 дней, а также местно в различной лекарственной форме в зависимости от стадии раневого процесса:
- в стадии экссудации использован Актовегин 20% в форме геля толстым слоем с последующим наложением компресса с Актовегином 5% в форме мази;
- в стадии пролиферации использована повязка с Актовегином 5% в форме крема;
- в стадии грануляции применена повязка с Актовегином 5% в форме геля.
После выписки Актовегин назначался по 1 таблетке (200 мг) 3 раза в сутки в течение 30 дней. В контрольной группе Актовегин не применялся, а местное лечение осуществлено раствором Бетадин, мазью Левомеколь, метилурациловой мазью.
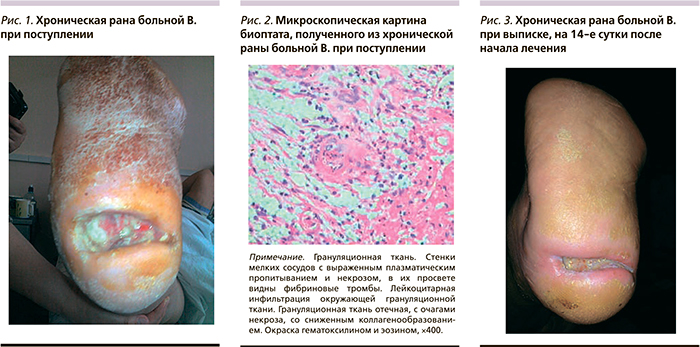
В 3-ю группу включены 28 пациентов, длительное время страдавших сахарным диабетом 2 типа, с клиническими признаками полинейропатии и длительно существующими раневыми дефектами нижних конечностей, не связанными с хронической артериальной или венозной недостаточностью. У этих пациентов проведены коррекция углеводного обмена (инсулинотерапия), местное лечение в объеме некрэктомии (по показаниям), гемореологическая и нейротропная терапия (Октолипен, Берлитион), ультразвуковая кавитация ран в регенерационном режиме через день, перевязки с гелем Hydrosorb, раствором Бетадин. Эти больные также были разделены по 14 человек на основную и контрольную группы, идентичные по полу, возрасту и тяжести сопутствующей патологии.
В основной группе больные помимо общепринятого лечения получали препарат Актовегин внутривенно 1200 мг 1 раз в сутки в течение 14 дней, а также местно в различной лекарственной форме в зависимости от стадии раневого процесса:
- в стадии экссудации использован Актовегин 20% в форме геля толстым слоем с последующим наложением компресса с Актовегином 5% в форме мази;
- в стадии пролиферации использована повязка с Актовегином 5% в форме крема;
- в стадии грануляции применена повязка с Актовегином 5% в форме геля.
После выписки Актовегин назначался по 1 таблетке (200 мг) 3 раза в сутки в течение 30 дней.
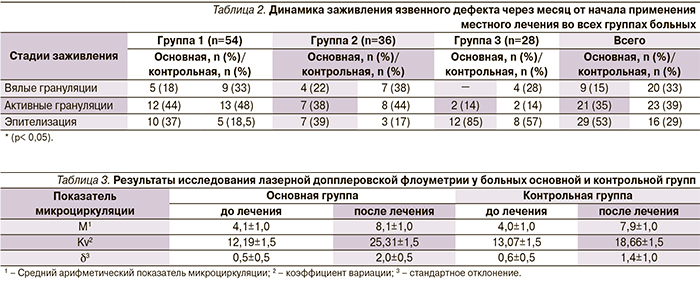
Во всех нозологических группах пациентов до и после курсов комплексной терапии произведен визуальный контроль ран по системе MEASURE [11], а также выполнены исследования микроциркуляции методом лазерной допплеровской флоуметрии. Датчик располагался в дне раневых дефектов. Помимо этого всем больным выполнено гистологическое исследование биоптатов из ран на протяжении всего срока стационарного лечения в динамике. Биоптаты фиксировали в 10%-ном нейтральном формалине и,по общепринятой методике заливали в парафиновые блоки. Изготовленные из парафиновых блоков гистологические срезы толщиной 4–5 мкм окрашивали гематоксилином и эозином.
Результаты и их обсуждение
У пациентов 1-й группы, проходивших лечение по поводу хронических ран, вызванных хронической венозной недостаточностью, уменьшение площади раневых дефектов (высчитывалась из линейных размеров ран) в основной группе отмечено на 4–5-е сутки, в контрольной группе – на 7–9-е послеоперационного периода.
В обеих группах на 3–4-е сутки послеоперационного периода уменьшалось количество экссудата с умеренного до скудного, причем качественно экссудат оценивался нами как серозный или серозно-геморрагический. Дно ран было представлено грануляционной тканью в обеих группах. В основной группе болевой синдром значительно уменьшился на 2–3-е сутки послеоперационного периода, тогда как в контрольной группе его интенсивность уменьшилась лишь на 5–6-е сутки. Деструкции в ранах не наблюдалось в обеих группах. Эпителизация краев раны в основной группе наблюдалась на 3–4-е сутки, тогда как в контрольной группе – на 6–7-е. На момент выписки хронические раны полностью зажили у 10 (37%) пациентов основной группы и у 5 (18,5%) – контрольной. Через 3 недели после выписки раны зажили в основной группе у всех (100%) больных, в контрольной группе – у 15 (55,5%) пациентов.
У пациентов 3-й группы, проходивших лечение по поводу хронических ран, на фоне нейропатической формы синдрома диабетической стопы, уменьшение площади раневых дефектов в основной группе отмечено на 2–3-е сутки, в контрольной группе – на 4–5-е сутки после начала лечения. Количество экссудата уменьшалось с умеренного до скудного в основной группе на 1–2-е сутки, в контрольной группе – на 2–3-е сутки, причем качественно экссудат оценивался нами как серозно-геморрагический. Дно ран было представлено грануляционной тканью в обеих группах. В основной группе болевой синдром значительно уменьшился на 2–3-е сутки послеоперационного периода, тогда как в контрольной группе его интенсивность уменьшилась лишь на 5–6-е сутки. Деструкции в ранах не наблюдалось в обеих группах. Эпителизация краев раны в основной группе наблюдалась на 3–4-е и на 5–6-е сутки в контрольной группе. На момент выписки хронические раны полностью зажили у 12 (85%) пациентов основной группы и у 8 (57%) пациентов контрольной группы. В течение первых 3 недель после выписки раны зажили у всех пациентов основной группы (100%) и у 12 (85,7%) пациентов контрольной группы.
Особое внимание уделено динамике заживления язвенного дефекта в обследуемых группах как одному из важнейших показателей эффективности терапии. Результаты исследования показали, что при сочетании применения Актовегина для наружного использования и внутривенных инфузий через месяц от начала лечения эпителизация язвенного дефекта наблюдалась более чем у половины (53%) пациентов, что статистически достоверно.
При применении Актовегина наружно в виде геля, крема и мази средние сроки очищения ран от гнойных и некротических масс появление грануляций были в среднем меньше по сравнению со сроками в контрольных группах на 3–4-е суток (табл. 1). Через месяц от начала терапии у 29 пациентов основной группы и у 16 контрольной наблюдали эпителизацию язвенного дефекта. У 9 больных основной группы наблюдались вялые грануляции с отложениями фибрина, в контрольной группе – у 20 больных (табл. 2).
Результаты исследования микроциркуляции методом лазерной допплеровской флоуметрии представлены в табл. 3.
При гистологическом анализе биоптатов из ран после срока стационарного лечения у всех пациентов, получавших Актовегин, по сравнению с пациентами контрольных групп отмечалась нормализация процессов пролиферации и дифференцировки грануляционной ткани (коллагенообразования и новообразования сосудов), менее выраженная лейкоцитарная инфильтрация, активные процессы эпидермизации участков поражения кожи (рост эпителиального пласта на границе с грануляционной тканью).
В качестве иллюстрации эффектов комплексной терапии приводим клинический пример.
В заключение стоит отметить, что назначение препарата Актовегин оказалось не случайным и обусловлено его фармакологическими свойствами: выраженным метаболическим и эндотелиопротекторным действиями на уровне микрососудистого русла. Актовегин улучшает коллатеральный кровоток, трофическое обеспечение кислородом тканей при их хронической ишемии, а также при сосудистых и нейропатических осложнениях сахарного диабета [1–3, 7]. Полученные результаты позволили сделать нам следующие выводы и рекомендации:
В комплексном лечении хронических ран ведущая роль принадлежит патогенетическому лечению.
Для лечения хронических ран различной этиологии применение Актовегина в составе комплексной терапии достоверно позволяет увеличивать ее эффективность. При применении Актовегина на 3–4 суток раньше уменьшаются размеры хронических ран, на 2-3 суток раньше снижается болевой синдром по сравнению с больными контрольной группы.
Назначение Актовегина позволяет достоверно улучшать микроциркуляцию в хронической ране (средний показатель микроциркуляции в среднем выше на 0,2 пФ в группе пациентов, получавших Актовегин).
Мы рекомендуем включать препарат Актовегин в схему комплексного лечения больных с хроническими ранами различной этиологии по следующей схеме: внутривенно по 1200 мг 1 раз в сутки в течение 14 дней. Далее переход на таблетированную форму: по 1 таблетке (200 мг) 3 раза в сутки в течение 30 дней.
Для местного лечения чистых хронических ран различной этиологии мы рекомендуем использовать Актовегин в форме геля 1 раз в сутки до полного заживления.
Литература
Об авторах / Для корреспонденции
М.Д. Дибиров – д.м.н., проф., зав. кафедрой хирургических болезней и клинической ангиологии ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, Москва; заслуженный деятель науки РФ, заслуженный врач РФ
Р.У. Гаджимурадов – д.м.н., проф. кафедры хирургических болезней и клинической ангиологии ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, врач сердечно-сосудистый хирург ГКБ №81 ДЗ Москвы
О.Х. Халидов – д.м.н., проф. кафедры хирургических болезней и клинической ангиологии ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, зам. глав.врача по хирургии ГКБ №81 ДЗ Москвы
М.Р. Какубава – к.м.н., ассистент кафедры хирургических болезней и клинической ангиологии ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, врач-хирург отделения гнойной хирургии ГКБ №81 ДЗ Москвы
М.В. Полянский – ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, ГКБ №81 ДЗ Москвы



Форма выпуска, упаковка и состав препарата Актовегин ®
Раствор для инъекций прозрачный, желтоватый.
| 1 мл | 1 амп. | |
| Актовегин ® концентрат (в пересчете на сухой депротеинизированный гемодериват крови телят)* | 40 мг | 80 мг |
Вспомогательные вещества: вода д/и - до 2 мл.
2 мл - ампулы бесцветного стекла (5) - упаковки ячейковые контурные (1) - пачки картонные × .
2 мл - ампулы бесцветного стекла (5) - упаковки ячейковые контурные (2) - пачки картонные × .
2 мл - ампулы бесцветного стекла (5) - упаковки ячейковые контурные (5) - пачки картонные × .
Раствор для инъекций прозрачный, желтоватый.
| 1 мл | 1 амп. | |
| Актовегин ® концентрат (в пересчете на сухой депротеинизированный гемодериват крови телят)* | 40 мг | 200 мг |
Вспомогательные вещества: вода д/и - до 5 мл.
5 мл - ампулы бесцветного стекла (5) - упаковки ячейковые контурные (1) - пачки картонные × .
5 мл - ампулы бесцветного стекла (5) - упаковки ячейковые контурные (2) - пачки картонные × .
5 мл - ампулы бесцветного стекла (5) - упаковки ячейковые контурные (5) - пачки картонные × .
Раствор для инъекций прозрачный, желтоватый.
| 1 мл | 1 амп. | |
| Актовегин ® концентрат (в пересчете на сухой депротеинизированный гемодериват крови телят)* | 40 мг | 400 мг |
Вспомогательные вещества: вода д/и - до 10 мл.
10 мл - ампулы бесцветного стекла (5) - упаковки ячейковые контурные (1) - пачки картонные × .
10 мл - ампулы бесцветного стекла (5) - упаковки ячейковые контурные (2) - пачки картонные × .
10 мл - ампулы бесцветного стекла (5) - упаковки ячейковые контурные (5) - пачки картонные × .
* В составе концентрата Актовегин ® присутствует натрия хлорид в виде ионов натрия и хлора, являющихся компонентами крови телят. Натрия хлорид не добавляется и не удаляется в процессе производства концентрата. Содержание натрия хлорида составляет около 53.6 мг (для ампул 2 мл), около 134 мг (для ампул 5 мл), около 268 мг (для ампул 10 мл).
× На пачку наклеивают прозрачные защитные наклейки круглой формы с голографическими надписями и контролем первого вскрытия.
Фармакологическое действие
Актовегин ® – антигипоксант, оказывающий три вида эффектов: метаболический, нейропротективный и микроциркуляторный. Актовегин ® повышает поглощение и утилизацию кислорода; входящие в состав препарата инозитол фосфо-олигосахариды положительно влияют на транспорт и утилизацию глюкозы, что приводит к улучшению энергетического метаболизма клеток и снижению образования лактата в условиях ишемии.
Рассматривается несколько путей реализации нейропротективного механизма действия препарата.
Актовегин ® препятствует развитию апоптоза, индуцированного пептидом бета-амилоида (Aβ25-35).
Актовегин ® модулирует активность ядерного фактора каппа В (NF-kB), играющего важную роль в регуляции процессов апоптоза и воспаления в центральной и периферической нервной системе.
Другой механизм действия связан с ядерным ферментом поли(АДФ-рибоза)-полимеразой (PARP). PARP играет важную роль в выявлении и репарации повреждений одноцепочечной ДНК, однако чрезмерная активация фермента может запускать процессы клеточной гибели при таких состояниях, как цереброваскулярные заболевания и диабетическая полиневропатия. Актовегин ® ингибирует активность PARP, что приводит к функциональному и морфологическому улучшению состояния центральной и периферической нервной системы.
Положительными эффектами препарата Актовегин ® , влияющими на процессы микроциркуляции и на эндотелий, являются увеличение скорости капиллярного кровотока, уменьшение перикапиллярной зоны, снижение миогенного тонуса прекапиллярных артериол и капиллярных сфинктеров, снижение степени артериоловенулярного шунтирующего кровотока с преимущественной циркуляцией крови в капиллярном русле и стимуляция функции эндотелиальной синтазы оксида азота, влияющей на микроциркуляторное русло.
В ходе различных исследований было установлено, что эффект препарата Актовегин ® наступает не позднее, чем через 30 мин после его применения. Максимальный эффект отмечается через 3 ч после парентерального и через 2–6 часов после перорального применения.
Как показало исследование ARTEMIDA (NCT01582854), целью которого было изучение терапевтического эффекта препарата Актовегин ® в отношении когнитивных нарушений у 503 пациентов с ишемическим инсультом, терапевтический эффект от использования препарата сохраняется еще как минимум 6 мес после прекращения применения препарата.
Как показало исследование APOLLO (NCT03469349), целью которого было изучение терапевтического эффекта препарата Актовегин ® в отношении дистанции безболевой ходьбы у 366 пациентов с хроническими облитерирующими заболеваниями артерий нижних конечностей IIВ стадии по классификации Фонтейна, терапевтический эффект от использования препарата сохраняется еще как минимум 3 мес после прекращения применения препарата.
Фармакокинетика
С помощью фармакокинетических методов невозможно изучить фармакокинетические параметры препарата Актовегин ® , поскольку он состоит только из физиологических компонентов, которые обычно присутствуют в организме.
Форма выпуска, упаковка и состав препарата Актовегин ®
Таблетки, покрытые оболочкой зеленовато-желтого цвета, круглые, двояковыпуклые, блестящие.
| 1 таб. | |
| компоненты крови: депротеинизированный гемодериват крови телят | 200.0 мг, |
| в виде Актовегин ® гранулята* | 345.0 мг |
* Актовегин ® гранулят содержит: активное вещество: компоненты крови: депротеинизированный гемодериват крови телят - 200.0 мг; вспомогательные вещества: повидон-К 90 - 10.0 мг, целлюлоза микрокристаллическая - 135.0 мг.
Вспомогательные вещества: магния стеарат - 2.0 мг, тальк - 3.0 мг.
Состав оболочки: акации камедь - 6.8 мг, воск горный гликолевый - 0.1 мг, гипромеллозы фталат - 29.45 мг, диэтилфталат - 11.8 мг, краситель хинолиновый желтый лак алюминиевый - 2.0 мг, макрогол-6000 - 2.95 мг, повидон-К 30 - 1.54 мг, сахароза - 52.3 мг, тальк - 42.2 мг, титана диоксид - 0.86 мг.
50 шт. - флаконы темного стекла (1) - пачки картонные × .
× На пачку наклеивают прозрачные защитные наклейки круглой формы с голографическими надписями и контролем первого вскрытия.
Фармакологическое действие
Актовегин ® - антигипоксант, оказывающий три вида эффектов: метаболический, нейропротективный и микроциркуляторный. Актовегин ® повышает поглощение и утилизацию кислорода; входящие в состав препарата инозитол фосфо-олигосахариды положительно влияют на транспорт и утилизацию глюкозы, что приводит к улучшению энергетического метаболизма клеток и снижению образования лактата в условиях ишемии.
Рассматривается несколько путей реализации нейропротективного механизма действия препарата.
Актовегин ® препятствует развитию апоптоза, индуцированного пептидом бета-амилоида (Aβ25-35).
Актовегин ® модулирует активность ядерного фактора каппа В (NF-kB), играющего важную роль в регуляции процессов апоптоза и воспаления в центральной и периферической нервной системе.
Другой механизм действия связан с ядерным ферментом поли(АДФ-рибоза)-полимеразой (PARP). PARP играет важную роль в выявлении и репарации повреждений одноцепочечной ДНК, однако чрезмерная активация фермента может запускать процессы клеточной гибели при таких состояниях, как цереброваскулярные заболевания и диабетическая полиневропатия. Актовегин ® ингибирует активность PARP, что приводит к функциональному и морфологическому улучшению состояния центральной и периферической нервной системы.
Положительными эффектами препарата Актовегин ® , влияющими на процессы микроциркуляции и на эндотелий, являются увеличение скорости капиллярного кровотока, уменьшение перикапиллярной зоны, снижение миогенного тонуса прекапиллярных артериол и капиллярных сфинктеров, снижение степени артериоловенулярного шунтирующего кровотока с преимущественной циркуляцией крови в капиллярном русле и стимуляция функции эндотелиальной синтазы оксида азота, влияющей на микроциркуляторное русло.
В ходе различных исследований было установлено, что эффект препарата Актовегин ® наступает не позднее, чем через 30 мин после его приема. Максимальный эффект отмечается через 3 ч после парентерального и через 2-6 ч после перорального применения.
Как показало исследование ARTEMIDA (NCT01582854), целью которого было изучение терапевтического эффекта препарата Актовегин ® в отношении когнитивных нарушений у 503 пациентов с ишемическим инсультом, терапевтический эффект от использования препарата сохраняется еще как минимум 6 мес после прекращения применения препарата. Как показало исследование APOLLO (NCT03469349), целью которого было изучение терапевтического эффекта препарата Актовегин ® в отношении дистанции безболевой ходьбы у 366 пациентов с хроническими облитерирующими заболеваниями артерий нижних конечностей IIВ стадии по классификации Фонтейна, терапевтический эффект от использования препарата сохраняется еще как минимум 3 мес после прекращения применения препарата.
Фармакокинетика
С помощью фармакокинетических методов невозможно изучить фармакокинетические параметры препарата Актовегин ® , поскольку он состоит только из физиологических компонентов, которые обычно присутствуют в организме.
Читайте также:

