Характеристика золотистого стафилококка как возбудителя внутрибольничной инфекции
Обновлено: 19.04.2024
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор раздела: Трубачева Елена Сергеевна, врач – клинический фармаколог, более 15 лет занимающаяся практическими вопросами лечения и профилактики внутрибольничных инфекций и эпидемиологического надзора. Автор множества печатных работ на указанную тематику.
"Идея "Азбуки антибиотиков" вынашивалась в течение трех лет как способ донести сложные вещи максимально понятным языком для тех, кто только начинает постигать этот действительно сложный раздел практической медицины, и дать импульс к дальнейшему изучению, не продираясь через дебри терминологии и смежных дисциплин, теряя интерес по дороге."
Сегодня мы поговорим не столько о коагулазонегативных стафилококках, сколько о катетер-ассоциированных инфекциях кровотока (КАИК), используя упомянутых стафилококков как повод к разговору.
История применения антибактериальных препаратов переживает определенную цикличность. В доантибиотиковую эру среди возбудителей тяжелых инфекций преобладали Гр(+) возбудители, потом пришли антибиотики, и во время второй мировой основными возбудителями стали Гр(-) возбудители (по принципу «свято место пусто не бывает), но тут Гр(+) опять подняли голову, т.к. выяснилось, что свыше 80% штаммов стафилококков продуцируют пенициллиназу и разрушают бензилпенициллин и аминопенициллины.
Прошло много лет после написания первой статьи, посвященной лечению инфекций, вызванных золотистым стафилококком. За это время автор, будем надеяться, немного помудрела и приобрела кое-какой опыт в более детальной диагностике вышеупомянутых состояний, чем и хотела бы поделиться с многоуважаемой аудиторией в надежде, что, возможно, поможет каждому из вас в рутинной ежедневной работе, так как с этой зверюшкой сталкивается буквально каждый, кто надел белый халат и уж тем более хирургический костюм.
Информация о препаратах, отпускаемых по рецепту, размещенная на сайте, предназначена только для специалистов. Информация, содержащаяся на сайте, не должна использоваться пациентами для принятия самостоятельного решения о применении представленных лекарственных препаратов и не может служить заменой очной консультации врача.
Свидетельство о регистрации средства массовой информации Эл № ФС77-79153 выдано Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций (Роскомнадзор) 15 сентября 2020 года.

Хараева З.Ф. 1 Балахова Б.О. 1 Белимготова Р.Р. 1 Мустафаев И.М. 1 Тугушева Д.С. 1 Чочуева Н.А. 1 Шекихачева Ф.Ю. 1
Несмотря на поиск и внедрение новых методов борьбы с госпитальными микробами, внутрибольничные инфекции являются актуальной темой исследования из-за постоянного изменения свойств микрофлоры. При санитарно-бактериологическом исследовании выявлены госпитальные штаммы: Proteus spp., Staphylococcus aureus, Acinetobacter spp., Streptococcus spp., Klebsiella pneumoniae, Enterobacter и плесневые грибы. Так как наиболее часто встречаемыми штаммами являлись штаммы Staphylococcus aureus, были исследованы характеристики золотистого стафилококка. Выделенные штаммы золотистого стафилококка обладали высоким персистентным потенциалом, множественной резистентностью к антибиотикам и некоторым дезинфектантам, что позволяло патогенной микрофлоре длительное время находиться в окружающей среде и противостоять защитным силам макроорганизма. Высокий персистентный потенциал выделенных штаммов стафилококков является фактором риска для пациентов, приводя к развитию затяжных гнойно-воспалительных заболеваний.

2. Бухарин О.В., Усвяцов Б.Я.. Бактерионосительство (методико-экологический аспект). – Екатеринбург: УрО РАН, 1996. – 207 с.
3. Бухарин О.В., Усвяцов Б.Я., Малышкин А.П., Немцева Н.В. Метод определения антилизоцимной активности микроорганизмов // Журн. микробиол. эпидемиол. и иммунобиол. – 1984. – N 2. – С. 27–28.
4. Бухарин О. В., Фадеев С.Б., Исайчев Б.А. Динамика видового состава, антилизоцимной активности и антибиотикорезистентности возбудителей хирургической инфекции мягких тканей // Журн. микробиол., эпидемиол. и иммунобиол. – 1997. – № 4. – С. 51–54.
5. Верещагина С.А. Внутрибольничные инфекции в многопрофильном хирургическом стационаре: дис. … канд. мед. наук. – Иркутск, 2005. – 112 с.
6. Внутрибольничная инфекция / Шерертц, Хэмптон, Ристуцина / под ред. Р.П. Венцела. – М.: Медицина 1990.
7. Дерябин Д.Г., Курлаев П.П., Брудастов Ю.А. Роль персистентных характеристик в определении затяжного течения гнойно-воспалительного процесса // Журн. микробиол., эпидемиол. и иммунобиол. – 1996. – N 3. – С. 74–77.
8. Желтова В.И., Шульга И.А., Сафронов А.А. Антилизоцимная активность и биологические свойства стафилококков при гнойно-септических заболеваниях // Персистенция микроорганизмов / под ред. О.В. Бухарина. – Куйбышев, 1987. – С. 19–22.
9. Зыкова Л.С. Факторы персистенции уропатогенов в диагностике, прогнозировании и лечении пиелонефрита у детей: автореф. дис. . д-ра мед. наук. – Оренбург, 1998. – 35 с.
10. Кулаев И.С., Северин А.И., Абрамочкин Г.В. Бактериологические ферменты микробного происхождения в биологии и медицине // Вестник АМН СССР. – 1984. – № 8. – С. 64–69.
11. Паршута А.И., Усвяцов Б.Я. Роль факторов персистенции в формировании микробного биоценоза слизистой оболочки носа у стафилококковых бактерионосителей // ЖМЭИ. –1998. – № 1. – С. 18–21.
12. Санитарные правила устройства, оборудования и эксплуатации больниц, родильных домов и других лечебных стационаров № 5179-90 от 29.06.90 г.
13. Хараева З.Ф. Факторы персистенции возбудителей внутрибольничных инфекций: методические указания. – Нальчик. КБГУ, 2010. – 55 с.
Несмотря на поиск и внедрение новых методов борьбы с госпитальными микробами, проблема внутрибольничных инфекций остается одной из самых острых в современных условиях, приобретая все большую медицинскую и социальную значимость [1]. Актуальность проблемы внутрибольничных инфекций обусловлена появлением так называемых госпитальных (как правило, полирезистентных к антибиотикам и химиопрепаратам) штаммов стафилококков, сальмонелл, синегнойной палочки и других возбудителей. Они легко распространяются среди детей и ослабленных, особенно пожилых, больных со сниженной иммунологической реактивностью, которые представляют собой так называемую группу риска [7, 8, 9].
Заболеваемость госпитальными инфекциями колеблется от 5 до 20 % от общего числа пациентов, госпитализированных в лечебные учреждения [5]. По результатам ряда исследований, уровень смертности в группе госпитализированных и приобретших внутрибольничные инфекции пациентов в 8–10 раз превышает таковой среди госпитализированных больных без внутрибольничных инфекций [1, 5]. Возбудители госпитальных инфекций отличаются высоким персистентным потенциалом и быстро развивающейся устойчивостью к дезинфектантам и антибиотикам, что позволяет патогенной микрофлоре длительное время находиться в окружающей среде и противостоять защитным силам макроорганизма.
Основными возбудителями бактериальных инфекций являются стафилококки, пневмококки, грамотрицательные энтеробактерии, псевдомонады и представители строгих анаэробов. Главенствующую роль играют стафилококки (до 60 % всех случаев внутрибольничных инфекций), грамотрицательные бактерии, респираторные вирусы и грибы рода Candida. Штаммы бактерий, выделенные от пациентов с нозокомиальными инфекциями, как правило, более вирулентны и обладают множественной химиорезистентностью [9, 11].
В связи с этим целью данного исследования было выявление основных особенностей внутрибольничных штаммов Staphylococcus aureus нозокомиальных инфекций, включая персистентный потенциал, антибиотикорезистентность и чувствительность госпитальных штаммов к дезинфектантам.
Материалы и методы исследования
Бактериологическое исследование микробной обсемененности объектов внешней среды было проведено согласно методическим рекомендациям по санитарно-эпидемиологическому режиму [4]. Отбор проб с поверхностей различных объектов осуществляли методом смывов. Идентификацию штаммов производили с учетом их морфологических и культуральных признаков. В качестве факторов персистенции изучены антилизоцимная, антикомплементарная, каталазная активности [5]. Антибиотикочувствительность исследовали диско-диффузионным методом. Чувствительность выделенных штаммов к 0,01 % раствору анолита исследовали путем добавления в соответствующем разведении к жидкой бактериальной культуре. Статистическую обработку проводили стандартными методами.
Результаты исследования и их обсуждение
При исследовании смывов в лечебном учреждении в 35 % случаев были выделены штаммы Staphylococcus аureus, в 17 % проб были выделены штаммы Klebsiella pneumoniae, в 10 % – Proteus vulgaris и Proteus mirabilis, в 2–5 % – Enterobacter, Acinetobacter. Так как наиболее часто встречаемыми штаммами являлись штаммы Staphylococcus aureus, были исследованы характеристики золотистого стафилококка.
В качестве факторов персистенции исследовали антилизоцимную (АЛА), антиинтерфероновую (АИА), антикомплементарную (АКА) активности как возможные пути противостояния кислороднезависимому механизму фагоцитоза и активность антиоксидантного бактериального фермента – каталазы. Антилизоцимной активностью обладало 67 % (20 культур) из 30 изученных штаммов. АИА обладало 44 % (13 культур), АКА обладали 34 % (10 культур) изученных нами штаммов S.aureus.
Известно, что первичными бактерицидными факторами, выделяемыми фагоцитами, являются перекись водорода и продукты ее свободнорадикального разложения, такие как гипохлорид и гидроксильный радикал [5]. Стафилококки приспосабливаются выживать в среде с повышенной концентрацией перекиси водорода путем индукции генов раннего ответа на окислительное повреждение [5]. Белковыми продуктами этих генов являются, среди прочих, фермент каталаза, разлагающий перекись водорода до нейтральных продуктов – воды и молекулярного кислорода и фермент супероксиддисмутаза, разлагающий супероксид анион радикал до молекулярного кислорода. Каталазная активность была выявлена у 80 % штаммов, при количественной оценке каталазной активности бактерий обнаружено, что большая часть штаммов (55 %) обладала высокой активностью фермента (4,0–5,1 ед./20 млн).
35–42 % штаммов S. aureus обладали множественной резистентностью, проявляя при этом чувствительность к препаратам цефалоспоринов (цефтриаксон, цефотаксим, цефуроксим). Для исследования чувствительности к применяемым в лечебных учреждениях дезинфектантам была проведена серия опытов по определению чувствительности S. aureus к раствору анолита. Обнаружено, что выделенные штаммы проявили устойчивость более чем в 60 % случаев к 0,01 % раствору анолита.
Таким образом, при изучении основных особенностей внутрибольничных инфекций, включая персистентный потенциал, антибиотикорезистентность и чувствительность госпитальных штаммов к дезинфектантам можно сделать следующие выводы:
1. При дальнейшем подборе дезинфектантов в стационарах необходимо учесть, что выделенные штаммы проявили устойчивость к 0,01 % раствору анолита, применяемого в современных медицинских учреждениях для дезинфекции. Возможно, данный дезинфицирующий раствор необходимо применять в более высокой концентрации или заменить его другим раствором.
2. Высокий персистентный потенциал выделенных штаммов стафилококков является фактором риска для пациентов, приводя к развитию затяжных гнойно-воспалительных заболеваний. Поэтому изучение патогенетически значимых свойств микроорганизмов, направленных на инактивацию эффекторов противоинфекционого иммунитета и тем самым нарушающих процесс элиминации патогена из очага воспаления [10], может стать альтернативным подходом к прогнозированию длительности течения гнойно-воспалительных заболеваний и дает возможность своевременного подключения иммунокорригирующих препаратов.
Рецензенты:
История применения антибактериальных препаратов переживает определенную цикличность. В доантибиотиковую эру среди возбудителей тяжелых инфекций преобладали Гр(+) возбудители, потом пришли антибиотики, и во время второй мировой основными возбудителями стали Гр(-) возбудители (по принципу «свято место пусто не бывает), но тут Гр(+) опять подняли голову, т.к. выяснилось, что свыше 80% штаммов стафилококков продуцируют пенициллиназу и разрушают бензилпенициллин и аминопенициллины.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: врач – клинический фармаколог Трубачева Е.С.
Staphylococcus aureus делится на две группы – мецитиллинчувствительные (MSSA) и мецитиллинрезистентные (MRSA):
1. MSSA вырабатывают беталактамазы – пенициллиназы, которые разрушают незащищенные пенициллины, но сохраняют высокую чувствительность к оксациллину и цефазолину. Кроме того они обладают лейкоцидином Пантона-Валентайна, который вызывает распад тканей практически в любом очаге, что служит косвенным подтверждением стафилококковой инфекции еще до получения микробиологического анализа.
2. MRSA в свою очередь подразделяются на госпитальные, которые характеризуются тем, что:
- являются полирезистентными, т.е. нечувствительные ко всему классу бета-лактамов, включая карбапенемы;
- у них отсутствует лейкоцидин Пантона-Валентайна, поэтому реже возникают деструктивные процессы (пациенты просто тихо и долго гниют, в отличие от инфекций, вызванных дикими штаммами)
- вызывают нозокомиальные пневмонии, инфекции кожи, ран, сепсис, бак эндокардит протезированных клапанов, инфекции имплантов.
и внебольничные MRSA, характеризующиеся:
- полирезистентностью;
- наличием лейкоцидина Пантона-Валентайна, благодаря которому они более агрессивны и вызывают некротизирующие заболевания кожи, сосудов и легких (особенно четко роль лейкоцидина Пантона-Валентайна видна в развитии некротизирующей пневмонии);
- в основном характерны для наркоманов и лиц без определенного места жительства.
Факторами риска MRSA инфекций являются
- назофарингеальная колонизация MRSA;
- лечение бета-лактамами (выбивается чувствительная флора и ее место занимает MRSA;
- нахождение в ОРИТ;
- повреждение кожи при длительной госпитализации более 2-х недель (п/о раны, ожоги, язвы);
- внутрисосудистые катетеры и импланты;
- мед. работники и члены их семей (соседи – реаниматологи или хирурги, если семьи между собой общаются)
Для чего мы все это вспоминаем? Дело в том, что основные проблемы, связанные со стафилококковой инфекцией, это:
- Широкое распространение в медицине и как следствие недооценка проблемы.
- Назначение эмпирической терапии без учета риска MRSA, и как следствие – отсрочка адекватной терапии, что в случае золотистого стафилококка в прямом смысле смерти подобно.
- Клиническая эффективность антибиотика in vitro не всегда тоже самое что in vivo (мы все таки отличаемся от чашки Петри).
- Неадекватное дозирование и длительность терапии (недостаточные дозы и короткие курсы) – отсюда осложнения и рецидивы.
- Высокая летальность при неадекватной терапии
Проводить антистафилококковую терапию меньше 3-х, а то и 4-х недель нельзя, так как для этого возбудителя характерно развитие метастатических очагов и весь процесс пойдет по новому, только с учетом еще и того, что возбудитель окажется резистентным к ранее проводимой терапии.
Когда можно лечить 2 недели стафилококковую инфекцию?
- В/в катетер или другой источник инфекции удален (хорошо если катетер, а если речь об импланте – его же не удалишь).
- Инфекционный эндокардит исключен по данным чрезпищеводной ЭХО-КГ.
- Отсутствуют импланты (протезированный клапан, кардиостимулятор, А-В фистула).
- Нормализация температуры и отрицательная гемокультура в течение 72 ч после удаления источника инфекции.
- Нет признаков метастатических очагов на других органах и тканях.
Во всех остальных случаях лечим 21-28 дней. А что происходит у нас? Максимум 10-14 дней пролечили и отпустили.
Антистафилококковые препараты мы обязаны назначить сразу как только получили положительную гемокультуру на стафилококк однократно! И только потом проводим повторную проверку, так как максимально раннее начало антибактериальной терапии в 2-3 раза снижает летальность.
Итак, как уже стало понятно, основную проблему представляют устойчивые формы S.aureus. Для их эрадикации были синтезированы и предлагаются к использованию следующие препараты
- Гликопептиды – Ванкомицин (1958 год) – категория доказательств IА
- Стрептогранины – Синерцид (в РФ отсут)
- Оксазолиндиноны – Линезолид – категория доказательств IА
- Липопептиды – Даптомицин – категория доказательств IА – Тигециклин – категория доказательств IIВ
1. Ванкомицин
Внедрен в практику в 1958 году, а первый устойчивый штамм стафилококка поймали только в 1996 году. Проблема с ванкомицинустойчивыми штамма стафилококка в том, что до сих пор нет отработанных схем преодоления этой самой устойчивости. Помимо прочего у возбудителей непрерывно нарастает МПК (минимальная подавляющая концентрация) к ванкомицину и сейчас при МПК 2 мы говорим о резистентном штамме.
Еще одна проблема – это плохо очищенные формы препарата. Если ванкомицин плохо очищен, то риск токсических нефропатий достигает 20%. К сожалению надо констатировать тот факт, что Ванкомицин отечественного разлива относится к плохо очищенным формам.
Основным и самым грозным осложнением является развитие острой почечной недостаточности, а она развивается у 40% пациентов, если дозировка препарата составляет более 4 гр/сут. А потому вводить данный препарат можно только под контролем клиренса креатинина (КК). То есть первый анализ мы проводим до введения препарата, второй через 2-3 дня и смотрим, если имеет место падение КК: если он падает на 25% – это говорит о нефротоксичном действии препарата, если на 50%, то препарат следует немедленно отменить.
Ванкомицин является бактериостатическим антибиотиком, эффективность действия мы оцениваем не ранее чем через 72 часа, а то и на 5-е сутки от начала терапии. Доза должна подбираться в соответствии с МПК возбудителя и под постоянным контролем клиренса креатинина. То есть для использования этого препарата нам необходимы хорошая клиническая и микробиологическая лаборатории.
Современные рекомендации по дозированию препарата выглядят следующим образом:
У Вас есть возможность это делать? У меня такой возможности не было и нет до сих пор, а потому мы до сих пор используем этот препарат как саперы на минном поле, где ошибиться можно только один раз.
Активность против MSSA у Ванкомицина сопоставима с плацебо, а значит применять его можно только при верифицированной MRSA, либо комбинировать с препаратами, активными против MSSA (цефазолином, например)
Следует так же помнить о том, что Ванкомицин, в виду строения его молекулы, а особенно ее размера, плохо проникает в ткани и проблемными его локализациями будут дыхательные пути, ЦНС, клапаны сердца и кости. А потому быстрого действия там не дождешься и терапия требуется очень и очень длительная.
В заключении хотелось бы сказать, что препарат хорош, но будет лучше, если вы его не будете назначать в самостоятельном режиме, а вызовете врача – клинического фармаколога, ибо назначение и дозировка таких вот препаратов входит в его непосредственные обязанности.
Что делать если клин. фарма нет, а пациент есть. И что надо соблюсти, чтобы безопасно применять ванкомицин?
- Использовать хроматографически очищенные препараты – Ванкоцин, Эдицин (в настоящих условиях это практически невозможно, торги они не выигрывают)
- Требуется коррекция гиповолемии, сердечной недостаточности (перфузия почек должна быть нормальное, иначе усугубим нефротоксический эффект)
- Избегать комбинаций с нефро- или ототоксичными препаратами (аминогликозидами, НПВС и т.д.)
- Коррекция режима дозирования по клиренсу креатинина. Если в течение 2-3-х дней он снизился вдвое от изначального, а данных за то, что он мог рухнуть не только от Ванко нет – это проявление нефротоксичности препарата.
2. Линезолид
Является чистым бактериостатиком. Производителем неоднократно заявлялось, что препарат эффективнее Ванкомицина, однако проведенные независимые метаанализы клинических исследований хорошего качества рандомизированных и с двойным слепым контролем показали, что единственное, где Линезолид имеет преимущество – это вентилятор-ассоциированный пневмонии, вызванные MRSA. В других случаях, в т.ч. и стафилококковой пневмонии, преимуществ нет никаких. Зато стоимость лечения повышается в разы.
Еще один момент, о котором умалчивается – это безопасность применения Линезолида. Да, нефротоксичности нет, но по данным того же метаанализа частота возникновения тромбоцитопений при его использовании в 11,72 раза выше чем в группе плацебо.
Таким образом, Линезолид является препаратом выбора при нозокомиальной вентилятор-ассоциированной MRSA пневмонии, где при его использовании летальность ощутимо ниже, чем при использовании ванкомицина.
3. Тигециклин (или тайгециклин)
Давайте разберемся и с ним, тем более к вам будут часто приходить и рассказывать про него как про самый препаратистый антибиотик в мире.
- Препарат позиционируется как новый класс антибиотиков, на деле это производный тетерациклина со всеми исходящими отсюда последствиями.
- Он является бактериостатиком, как все тетрациклины
- Имеет хорошую тканевую фармакокинетику, но при этом крайне низкие концентрации в плазме крови (ангиогенные инфекции из его показаний выпадают сразу)
А теперь о том, куда его следует применять:
- В качестве средства целенаправленной этиотропной терапии НИ, вызванных полирезистентными бактериями:
- БРЛС: альтернатива карбопенемам
- Ацинетобактер – альтернатива сульбактаму
- Клебсиела и E.coli – устойчивые к карбопенемам
- Stenotrophomonas maltophilia
Повторюсь еще раз, место его применения это ЦЕЛЕНАПРАВЛЕННАЯ ЭТИОТРОПНАЯ ТЕРАПИЯ, т.е. когда микроб четко установлен в результате бактериологического исследования вместе с чувствительностью к антибиотикам.
Повторюсь еще раз – место этого препарата в лечении грам-отрицательной инфекции, но никак не стафилококков. Да и вообще это препарат крайне глубокого резерва, как по характеристикам, так и по цене, т.к. в ближайшие 10 лет не будет ни одного нового препарата с Гр(-) активностью, так как их просто нет даже в проекте (медицина традиционно не успевает за возбудителями, а только пытается их догонять, о чем мы в самом начале и говорили, прослеживая эволюцию возбудителей)
4. Даптомицин.
Препарат появился у нас недавно, хотя во всем мире применяется уже очень давно (в Штатах с 2003 года)
Препарат относится к классу липопептидов и от всех имеющихся на данный момент антиMRSA препаратов отличается тем, что является бактерицидным. И этот самый эффект развивается у него очень быстро и нам не надо ждать нескольких дней. То есть антибактериальный эффект мы можем оценивать как и у всех бактерицидных препаратов через 48 часов от начала применения, а это очень важно у больных в тяжелом состоянии. Еще одним несомненным плюсом является то, что не происходит лизиса клеток и не увеличивается интоксикация.
Основными показаниями к применению являются:
- Эндокардит,
- Менингит,
- Остеомиелит,
- Инфекции у больных с нейтропенией,
- Сепсис стафилококковой этиологии
Также препарат может использоваться в эмпирической терапии (кстати, единственный из всех имеющихся на данный момент) Гр(+)инфекций, так как активность против MSSA и MRSA одинаковая.
Кроме того, препарат проявляет активность против MRSA в биопленках, а значит нет необходимости в удалении протезов и имплантов. А значит Даптомицин показан при ангиогенных инфекциях (бактериемиях), остеомиелите, бактериальном эндокардите.
- Препарат откровенно дорог
- В связи с крупным размером молекулы имеются проблемы с тканевой кинетикой, а потому пневмонии и инфекции ЦНС на данный момент мы им не лечим.
- Побочные эффекты – миалгии, производитель говорит о необходимости следить за КФК и обращать пристальное внимание на пациентов уже имеющих подобные проблемы.
- Описано несколько случаев эозинофильных пневмоний, а потому и на это следует обращать внимание, так как при своевременной диагностике и вовремя назначенной терапии, данный вид пневмонии проходит без следа.
Итак, сводя все к общему знаменателю:
Ванкомицин мы используем тогда, когда у нас верифицирован MRSA стафилококк, имеется хорошая микробиологическая лаборатория, которая нам даст его МПК и это МПК не будет больше 2 (иначе он уже резистентен), в наличие есть клинический фармаколог, который посчитает дозу, будет ее контролировать и корригировать согласно изменениям клиренса креатинина. Но при этом мы помним о том, что препарат не работает на MSSA. И конечно же мы продолжаем помнить о его высокой нефротоксичности, если не имеем возможности пользоваться высокоочищенными формами.
Тигециклину нечего делать антистафилококковой терапии, этот препарат предназначен только для этиотропной терапии Гр(-)инфекции.
В связи с высокой активностью против MRSA и MSSA, быстрым бактерицидным эффектом является препаратом выбора при ангиогенных инфекциях, сепсисе и инфекционном эндокардите, а также препаратом выбора при эмпирической терапии MRSA+MSSA. Не использовать при лечении нозокомиальных пневмоний и инфекций ЦНС.
Инфекции золотистого стафилококка (Staphylococcus aureus): диагностика, лечение, профилактика
Представители этого рода — неспорообразующие неподвижные грамположительные кокки, формирующие при росте колонии в виде виноградной грозди (кластера) и входящие в состав нормальной микрофлоры кожного покрова животных и человека.
Стафилококки — представители семейства Micrococcaceae. Существует свыше 26 видов стафилококков, но лишь некоторые из них представляют угрозу для здоровья человека. Самым опасным считают золотистый стафилококк (Staphylococcus aureus), отличающийся от остальных наличием фермента коагулазы.
Staphylococcus aureus
Этот вид долгое время считали единственным патогенным микроорганизмом в своём роде. Носительство S. aureus у человека обычно протекает бессимптомно; его обнаруживают у 40% здорового населения.
Обычно он локализуется на слизистой оболочке носа, коже подмышечной области и промежности.
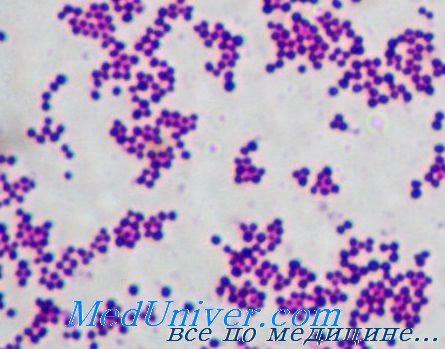
Патогенез инфекции золотистого стафилококка (Staphylococcus aureus)
Коагулаза, продуцируемая Staphylococcus aureus, катализирует реакцию превращения фибриногена в фибрин и помогает микроорганизму образовывать защитный барьер. Кроме того, наличие рецепторов к поверхностным структурам клеток хозяина и матричным белкам (например, фибронектину, коллагену) обусловливает возможность адгезии возбудителя.
Он вырабатывает экстрацеллюлярные лизирующие ферменты (липазу), разрушающие ткани и способствующие инвазии. Некоторые штаммы продуцируют сильнейший экзотоксин, вызывающий синдром токсического шока. Выделяемые бактерией энтеротоксины могут быть причиной диареи.
Клиническая значимость золотистого стафилококка (Staphylococcus aureus)
Staphylococcus aureus вызывает различные заболевания. Кожные инфекции возникают в условиях повышенной температуры и влажности, а также в связи с нарушением целостности кожного покрова при некоторых заболеваниях (экзема и др.), хирургических операциях, инъекциях или внутривенной катетеризации. Даже на здоровой коже может развиться поверхностная пиодермия (импетиго), которая затем передаётся от человека к человеку.
Пневмонию, вызванную S. aureus, наблюдают достаточно редко (в большинстве случаев в качестве осложнения гриппа). Инфекция быстро профессирует (часто наблюдают образование полостей или каверн); характерен высокий уровень смертности. Быстрое течение свойственно и стафилококковому эндокардиту, возникающему при неправильном подборе антибиотиков или вследствие микробной колонизации внутривенных устройств. Заболевание часто приводит к смерти пациента. Кроме того, S. aureus — наиболее распространённая причина остеомиелита и септического артрита.
Лабораторная диагностика золотистого стафилококка (Staphylococcus aureus)
• Бактериологическое исследование: S. aureus — грамположительные кокки, располагающиеся в микропрепарате в виде виноградной грозди. Быстро растут на большинстве питательных сред. Выдерживают высокие концентрации солей, поэтому диагностическая среда может быть приготовлена с учётом этой особенности микроорганизма.
• Изучение биохимических свойств: большинство штаммов S. aureus разлагают маннитол, поэтому добавление его и характерного красителя помогает идентифицировать субкультуру бактерий. Продуцируют коагулазу, ДНКазу, каталазу.
• Типирование S. aureus с помощью набора типовых стафилококковых бактериофагов или методом рестрицирования ДНК.
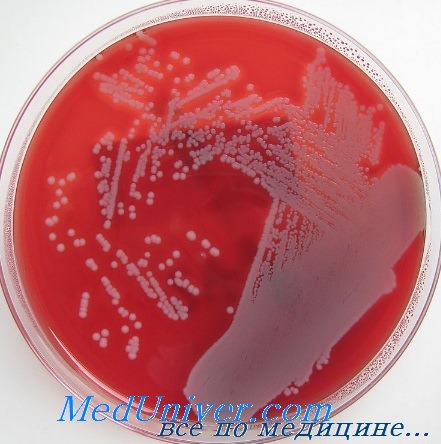
Чувствительность золотистого стафилококка (Staphylococcus aureus) к антибиотикам
Изменение чувствительности S. aureus к антибиотикам можно считать настоящим пособием по антимикробной химиотерапии. Сначала против золотистого стафилококка был в полной мере эффективен бензилпенициллин, но затем возникли штаммы, способные вырабатывать бета-лактамазы. Со временем они стали преобладать над всеми остальными. С внедрением в клиническую практику метициллина и родственных ему лекарственных средств (флуклоксациллина) именно они стали препаратами выбора и в настоящее время остаются таковыми при наличии чувствительных штаммов.
Позже возникли штаммы золотистого стафилококка, устойчивые к действию метициллина. Их резистентность обусловлена геном тесА+, кодирующим белки со сниженным сродством к пенициллинам. Некоторые из устойчивых штаммов способны вызвать эпидемические вспышки заболевания, для борьбы с которыми применяют ванкомицин и тейкопланин.
В настоящее время обнаруживают всё больше микроорганизмов со средней устойчивостью (или гетерорезистентностью) к гликопептидам. Описаны случаи полной гликопептидной резистентности у некоторых штаммов, обусловленной наличием генов vanA+ и vanB+ заимствованных у энтерококков.
Другими эффективными препаратами считают линезолид, аминогликозиды, эритромицин, клиндамицин, производные фузидовая кислота, хлорамфеникол и тетрациклин.
В отношении метициллинчувствительных штаммов активны цефалоспорины первого и второго поколения. Производные фузидовой кислоты применяют при комбинированной терапии инфекционных заболеваний костей и суставов. Лечение должно сопровождаться обязательным проведением теста на чувствительность к антимикробным препаратам.
Профилактика заболеваний вызванного золотистым стафилококком (Staphylococcus aureus)
Передача инфекций, вызываемых Staphylococcus aureus, происходит посредством аэрозольного и контактного механизма. Носителей или лиц, заражённых штаммами, устойчивыми к метициллину и гликопептидам, необходимо изолировать в отдельные боксы и соблюдать меры предосторожности во избежание раневого или энтерального проникновения бактерий.
Следует помнить, что медперсонал может стать носителем инфекции и способствовать её распространению в лечебном учреждении. Именно поэтому всем работникам больницы рекомендовано применение местных растворов мупироцина и хлоргексидина.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

