Хеликобактер и болезнь паркинсона
Обновлено: 16.04.2024
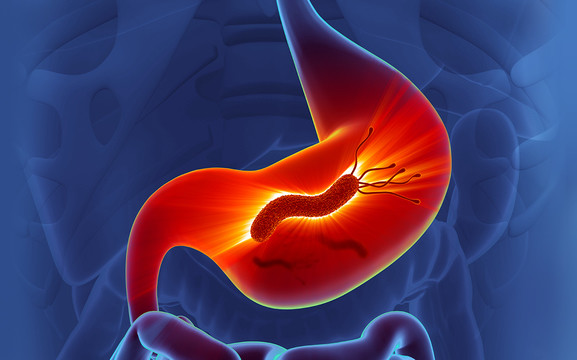
Дискомфорт, тяжесть в эпигастрии, изжога беспокоят многих пациентов. Без комплексного подхода, основанного на современных клинических рекомендациях, полностью решить проблему зачастую не удается. Неприятные переживания возвращаются снова и снова, если не устранена их возможная причина — хеликобактериоз. Он является важнейшим этиологическим фактором в развитии хронического гастрита и язвенной болезни, повышает риск ее малигнизации. Поэтому на первый план в комплексном лечении данной патологии выходит эрадикационная терапия, направленная на полное уничтожение Helicobacter pylori.

— Распространенность очень высокая. А если мы говорим о хеликобактериозе как о важном факторе риска, то до последнего десятилетия он встречался у 70-85% людей. Правда, сегодня этот показатель несколько снизился, по данным разных исследователей. Вероятно, это результат широкого применения эрадикационной терапии.
— Правда ли, что в этиопатогенезе хронического гастрита и язвенной болезни главную роль играет именно бактерия Helicobacter pylori?
— Да, это безусловно главный фактор. И к чему в итоге приведет возникшая язва, сказать сложно. Здесь действует правило одной пятой: примерно в 20% случаев происходит малигнизация (перерождение доброкачественных клеток в злокачественные) язвы желудка, и это высокий показатель. Поэтому мы выступаем за полную эрадикацию. Как известно, Всемирная организация здравоохранения отнесла H. pylori к канцерогенам I класса.
— Где и когда человек может заразиться H. pylori и что является источником инфекции? Можно ли, например, подхватить ее на курорте?
— Киотским глобальным консенсусом было признано, что хеликобактериоз — это инфекционное заболевание. Заразиться можно везде, в том числе на пляже. Возбудитель передается фекально-оральным путем. Источником инфекции могут быть контаминированные руки, общая посуда, белье и предметы ухода, поручни в общественном транспорте, туалеты и так далее. Поэтому самая главная мера профилактики хеликобактериоза — тщательное соблюдение правил личной гигиены.
— Может ли хеликобактериоз стать семейной инфекцией и передаваться от одного члена семьи к другим?
— Именно так и происходит. В семью H. Pylori, как правило, приносят дети, а затем инфекция распространяется среди других членов семьи.
— Нужно ли при выявлении хеликобактериоза у одного члена семьи обследоваться всем остальным?
— Да, и это входит во все международные рекомендации. Более того, нужно проводить терапию у всех членов семьи.
— Как именно H. pylori воздействует на желудок и вызывает гастрит или язвенную болезнь?
— Знаете, многие мои студенты удивляются, когда я им рассказываю, что в нашем желудке проживают более 100 различных видов микроорганизмов, в том числе различные штаммы хеликобактера. Так что ничего стерильного в нас нет! H. pylori является условным сапрофитом. До поры до времени он может не вызывать особых проблем, ведь слизистую оболочку желудка покрывает слой защитной слизи. Но человек сам разрушает его с помощью никотина и смол, содержащихся в сигаретах, этанола, горячей и острой пищи, соли, лекарственных препаратов (например, нестероидных противовоспалительных средств). И тогда H. pylori начинает разъедать стенку желудка — от слизистого слоя до мышечного. В итоге образуется язва, которая воспаляется. Организм пытается противостоять этому и запускает процессы регенерации. Но проблема в том, что на месте дефекта вместо желудочного эпителия образуется кишечный. Происходит кишечная метаплазия, а это уже предрак.
— По каким симптомам человек может заподозрить у себя хеликобактериоз, и что нужно делать, если его обнаружили?
— Не секрет, что вирус SARS-CoV-2, возбудитель COVID-19, способен поражать не только легкие, но и органы желудочно-кишечного тракта. Правда ли, что хеликобактериоз повышает риск инфицирования новым коронавирусом?
— Да, и это известно. H. pylori нарушает структуру защитной слизи, что облегчает проникновение SARS-CoV-2 в клетки желудочного эпителия. Поэтому, когда мир только столкнулся с новой угрозой, но пандемия еще не была объявлена, некоторые эксперты не рекомендовали назначать препараты, которые снижают секрецию слизи, так как это может способствовать инфицированию вирусом SARS-CoV-2. По данным разных авторов, от 3-4% до 40% случаев COVID-19 проявляется желудочно-кишечными расстройствами. Также они обнаруживаются почти у всех переболевших пациентов и у многих из них, к сожалению, печально заканчиваются.
— В течение долгого времени важная роль в комплексном лечении H. pylori-ассоциированной патологии желудка и двенадцатиперстной кишки отводится эрадикационной терапии. Правда ли, что в последнее время эффективность такого лечения снизилась, и с чем это связано?
Я полагаю, что будущее — за разработкой новых биологических методов лечения хеликобактериоза. Все-таки подобное нужно лечить подобным. И я фактически уже предложил такой подход своим коллегам. По сути дела, хеликобактериоз — это дисбиоз. Поэтому мне представляется, что очень важным направлением будет восстановление эубиотического равновесия в желудке с помощью определенных штаммов микроорганизмов, которые помогают устранить агрессивность H. pylori. И уже сегодня в рекомендации Всемирной гастроэнтерологической ассоциации по лечению хеликобактериоза такие штаммы включены. В их числе — штамм Lactobacillus reuteri DSMZ 17648.
Прорыв в борьбе с хеликобактериозом — уникальный препарат в России
— В чем уникальность штамма Lactobacillus reuteri DSMZ 17648?
— Уникальность этого штамма состоит в том, что он является природным антагонистом H. pylori. На это впервые обратили внимание немецкие микробиологи. С помощью специальной технологии они получили из данного штамма высокоактивную ферментированную субстанцию для целенаправленного решения главной задачи — элиминации H. pylori. Попадая в желудок, эта субстанция связывается с возбудителем, образуя коагрегаты, и естественным способом выводит его из организма.
— Выпускаются ли в России препараты, содержащие именно этот уникальный штамм?
— В России препарат, содержащий штамм Lactobacillus reuteri DSMZ 17648, только один — это
— Проводились ли масштабные клинические исследования эффективности Хелинорма и что они показали?
— Помимо масштабного немецкого исследования¹, большой интерес представляют результаты крупных исследований эффективности Хелинорма, проведенных в Москве и Санкт-Петербурге. Они показали, что при включении в схему эрадикационной терапии препарата Хелинорм ее эффективность повышалась примерно на 25%².
— Не способствует ли Хелинорм повышению резистентности H. pylori к антибиотикам?
— Нет, не способствует, и это уже доказано.
— Как правильно принимать Хелинорм, чтобы достигнуть лучшего результата? Какую длительность курса приема вы рекомендуете?
— Обычно мы назначаем эрадикационную терапию антибиотиками на 14 дней, а прием Хелинорма, на мой взгляд, целесообразно продолжать до месяца. Кстати говоря, субъективно он значительно улучшает переносимость антибиотиков.
— Нужно ли принимать Хелинорм в качестве средства профилактики всем членам семьи, если у одного из них выявлен хеликобактериоз?
— Полагаю, что возможно. Во всяком случае, в приеме Хелинорма как средства монопрофилактики в данной ситуации точно есть здравый смысл.
— Насколько безопасен Хелинорм? Можно ли его принимать детям, а также беременным и кормящим женщинам?
— Важное достоинство этого препарата — высокий профиль безопасности. Его можно применять даже у детишек старше 6 лет, а также у беременных и кормящих женщин.
— Правда ли, что Хелинорм способствует не только элиминации H. pylori, но и улучшению процесса пищеварения?
— Да, препарат способствует устранению дискомфорта в желудке и улучшению пищеварения.
— Как долго сохраняется эффект после завершения курса приема Хелинорма?
— Если мы провели полноценную эрадикацию, то случаи повторного инфицирования H. pylori встречаются нечасто.
Где найти препарат Хелинорм?
Метабиотик Хелинорм можно найти в аптеках вашего города или заказать доставку прямо из дома в ближайшую аптеку — через официальный сайт Эвалар, Фитомаркет, Аптека.ру.
Заражение этой инфекцией — основная причина гастрита и язвы, она может запускать аутоиммунные и кожные заболевания. ВОЗ признала связь между Helicobacter pylori и раком желудка и занесла эту бактерию в разряд достоверных канцерогенов. О том, что надо знать о коварной бактерии, рассказывает эксперт Центра молекулярной диагностики (CMD) ЦНИИ Эпидемиологии Марина Вершинина.
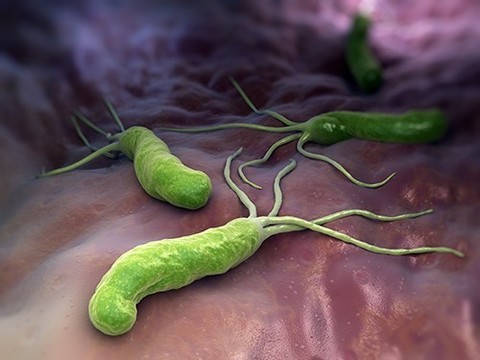
Заражение этой инфекцией — основная причина гастрита, язвенной болезни желудка и двенадцатиперстной кишки. ВОЗ признала связь между Helicobacter pylori (Хеликобактер) и раком желудка и занесла эту бактерию в разряд достоверных канцерогенов. Кроме того, Helicobacter pylori может запускать аутоиммунные процессы, установлена ее взаимосвязь и с некоторыми кожными заболеваниями. О том, что надо знать о коварной бактерии, рассказывает эксперт Центра молекулярной диагностики (CMD) ЦНИИ Эпидемиологии Роспотребнадзора Марина Вершинина.

Марина Вершинина. Фото: из личного архива
Что такое Хеликобактер
Микроскопический, но коварный враг нашего желудка Хеликобактер — это спиралевидная грамотрицательная бактерия, за открытие которой австралийским медикам Барри Маршаллу и Роберту Уоррену в 2005 году присудили Нобелевскую премию в области медицины. По некоторым данным, более половины населения планеты инфицировано этой бактерией. Хеликобактер обладает уникальной способностью колонизировать слизистую оболочку желудка и выживать в условиях высокой кислотности, что чревато развитием у человека гастрита и язвенной болезни. Кроме того, в соответствии с классификацией Международного Агентства по Изучению рака (IARC), Хеликобактер является достоверным канцерогеном и может приводить к развитию рака желудка. Считается, что она проникает в организм с зараженной водой или едой, передается при тесном физическом контакте с зараженным человеком, через слюну, а также при использовании общей посуды и предметов гигиены.
Почему эта бактерия такая живучая
В норме желудочный сок имеет резко кислую реакцию, необходимую для переваривания пищи (натощак на поверхности эпителия рН составляет 1,5-2,0). Но Хеликобактер приспособилась к выживанию в агрессивной среде желудка и при помощи своих жгутиков свободно передвигается в слизи, выстилающей его стенки. Еще один фактор, повышающий устойчивость коварной бактерии — ее способность образовывать микробные биопленки, охраняющие от воздействия антибиотиков и механизмов иммунной защиты носителя.
Вредоносная жизнедеятельность
После инфицирования Хеликобактер быстро преодолевает защитный слой и колонизирует слизистую оболочку желудка. Обосновавшись там, бактерия начинает выработку уреазы — особого фермента, расщепляющего мочевину пищевых продуктов с образованием аммиака. Аммиак нейтрализует соляную кислоту желудка и обеспечивает бактерии локальное поддержание комфортного для нее pH (около 6–7). Это приводит к раздражению слизистой желудка, вызывает ее воспаление, а затем и гибель клеток желудочного эпителия.
С другой стороны, чтобы преодолеть защелачивание среды и восстановить нормальную кислотность, в желудке происходит увеличение секреции гормона гастрина, повышается продукция соляной кислоты и пепсина, снижется уровень бикарбонатов. Эпителиальная оболочка, лишенная защитного слоя слизи под действием ферментов бактерий, становится уязвимой для собственной соляной кислоты и пепсина. Это также приводит к воспалению и изъязвлению тканей.
Основные симптомы
В числе основных симптомов поражения желудочно-кишечного тракта: нарушение аппетита и потеря веса, боли в разных отделах живота и за грудиной после употребления пищи, тошнота и ощущения давления в подложечной области, метеоризм и урчание в животе, чувство тяжести после еды и отрыжка с кислым привкусом и запахом тухлых яиц, изменения в работе кишечника — запоры или поносы.
Не только желудок
Ученые обнаружили взаимосвязь хеликобактерной инфекции с некоторыми болезнями кожи, среди которых хроническая крапивница, атопический дерматит, розацеа (розовые угри). Предполагается также, что Хеликобактер оказывает существенное влияние на патологический процесс при угревой сыпи (акне), псориазе, красном плоском лишае и многих других дерматологических и системных заболеваниях.
Этому есть несколько возможных объяснений. Во-первых, из-за деятельности бактерии повышается проницаемость слизистой оболочки желудочно-кишечного тракта, и человек становится более восприимчив к пищевым аллергенам. Кроме того, не исключено, что Хеликобактер пилори и сама является аллергеном.
Во-вторых, в процессе жизнедеятельности бактерии вырабатывается большое количество агрессивных веществ. Увеличивается концентрация оксида азота (NO) в сыворотке крови и тканях. Это может стать причиной расширения сосудов, повышения проницаемости сосудистой стенки, покраснения кожи.
В-третьих, Хеликобактер способна запускать каскад иммунных реакций, в результате которых может происходить выработка антител против собственных клеток и тканей человека.
И, наконец, не стоит забывать и об участии возбудителя в нарушении обменных процессов. Инфицирование Хеликобактер может привести к развитию железодефицитных состояний и авитаминозов, что также ведет к ухудшению состояния кожи, волос и ногтей.
Диагностика
Хеликобактер является далеко не единственной причиной заболеваний желудка. Патологические изменения в слизистой оболочке желудка могут возникать под влиянием многих факторов: генетической предрасположенности, стресса, нерационального питания, вредных привычек. Гастрит и язву желудка может вызвать прием некоторых лекарственных препаратов. Поэтому для назначения адекватной терапии необходима точная диагностика.
На сегодняшний день существует несколько видов анализов, позволяющих диагностировать хеликобактерную инфекцию: определение антител к Helicobacter pylori в венозной крови, уреазный дыхательный тест (УДТ) и анализ на антигены Helicobacter pylori в кале.
В мировой практике основным референсным методом диагностики является уреазный дыхательный тест. Этот тест рекомендован при неблагоприятной семейной истории заболеваний желудочно-кишечного тракта, частом применении нестероидных противовоспалительных препаратов или при наличии необъяснимой железодефицитной анемии. В нашей стране до недавнего времени этот анализ был малодоступен и проводился только в стационарных условиях. Однако методика проведения теста довольно проста.
Для исследования у пациента берут две пробы выдыхаемого воздуха: натощак и через несколько минут после приема специального раствора. Анализ выдыхаемого воздуха позволяет выявить присутствие выделяемой Хеикобактером уреазы, что свидетельствует о наличии активной бактериальной инфекции в желудке. Отрицательный результат уреазного дыхательного теста через четыре недели после проведенного лечения свидетельствует об эрадикации (уничтожении) бактерии.
Лечение
Установление бактериальной природы гастрита и язвы желудка, и включение в схему лечения антибиотиков позволило добиться в последние двадцать лет впечатляющих успехов. В целом, на сегодняшний день разработано несколько эффективных схем эрадикационной терапии, сочетающих применение антибактериальных средств и препаратов, воздействующих на секрецию соляной кислоты. В соответствии с V Маастрихтским соглашением, длительность курса терапии должна составлять 14 дней.
Обязательное условие успешности лечения гастрита и язвенной болезни — соблюдение щадящей диеты, исключающей употребление продуктов, повышающих выработку соляной кислоты (овощных, мясных и рыбных блюд в жареном виде, консервов, пряностей, алкоголя и газированных напитков, кофе, крепкого чая, черного хлеба) или вызывающих механическое раздражение желудка (овощей, богатых клетчаткой, фруктов с кожурой, хлеба грубого помола). По мере стихания обострения диета постепенно расширяется. Но соблюдать рекомендации по здоровому питанию следует на протяжении всей жизни — это основной способ профилактики возможных обострений.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Живущий в желудке почти у половины землян Helicobacter pylori так модифицирует холестерин, что тот вызывает дегенерацию допамин-продуцирующих клеток в мозгу - и это, увы, приводит к развитию болезни Паркинсона.
Желудочно-кишечная бактерия Helicobacter pylori, при всех её положительных качествах, является довольно опасным симбионтом: считается, что именно она - одна из основных причин язвенной болезни. Причём, если верить микробиологам из Центра исследований здоровья при Университете Луизианы (США), опасность этой бактерии даже преуменьшается, и серьёзно. Как показали эксперименты американцев, хеликобактер может провоцировать болезнь Паркинсона.
Паркинсонизм - тяжёлое нейродегенеративное заболевание, которое связано с разрушением особых клеток в мозгу, производящих нейромедиатор допамин, что прежде всего проявляется в неконтролируемых движениях больного, дрожании и т. д. Ежегодно только в США диагностируется около 60 тыс. новых случаев болезни Паркинсона. Существовали данные о том, что это расстройство возникает с большей вероятностью у людей, болеющих или переболевших язвой желудка и заражённых Helicobacter pylori, но достоверных свидетельств в пользу связи этой бактерии с паркинсонизмом до сего дня не было.
Оказалось, что бактерия даже не обязательно должна быть живой, чтобы вызвать болезнь Паркинсона: те же симптомы появлялись у животных, которых кормили мёртвыми хеликобактерами. Это заставило исследователей повнимательней присмотреться к биохимии H. pylori. Микроорганизм не может сам продуцировать холестерин, так что он заимствует его у хозяина, но при этом слегка модифицирует, добавляя углеводный остаток. Получающаяся в результате молекула становится похожа на токсин, принадлежащий одному из тропических саговников. Токсин этого дерева вызывает симптомы бокового амиотрофического склероза и болезни Паркинсона.
Оказалось, что модифицированный холестерин, синтезируемый хеликобактером, сам по себе (в чистом виде) способен вызывать симптомы паркинсонизма у мышей.
H. pylori живёт в желудке примерно у половины населения Земли. Но даже если колоссальными усилиями попытаться изгнать его из всех носителей, не очень понятно, как быть с отрицательными эффектами, которые неизбежно проявятся при отсутствии этой бактерии в человеческом организме. Хотя хеликобактер провоцирует язвенную болезнь и даже рак желудка, одновременно он защищает нас от некоторых аллергий, астмы, рака пищевода и отдельных расстройств, связанных с кислотным балансом. Очевидно, проще научиться смягчать нрав этого своеобразного симбионта, чем предпринимать в отношении него какие-то решительные и однозначные меры.

[1], [2], [3], [4], [5], [6], [7], [8], [9]

Аннотация. Раскрывается роль кишечной микробиоты в патогенезе функций нервной системы. Показано, что желудочно-кишечный микробиота играет роль в ряде неврологических заболеваний, таких как болезнь Паркинсона (БП), болезнь Альцгеймера, депрессия и рассеянный склероз. Анализ литературы показал, что пациенты с БП обычно страдают желудочно-кишечными расстройствами и дисбактериозом. В данном обзоре обобщаются сведения о корреляции между нарушениями микробиоты желудочно-кишечного тракта и БП, включая прямые и косвенные доказательства.
Ключевые слова: кишечная микробиота; болезнь Паркинсона; желудочно-кишечный тракт.
Многочисленные исследования выявили сопутствующую патологию неврологических, психических заболеваний и хронических кишечных расстройств, выявили взаимосвязь между расстройством микробиоты кишечника и биполярным расстройством, шизофренией, большим депрессивным расстройством и аутизмом [3]. Развитие нейро-дегенеративных заболеваний в том числе болезни Альцгеймера и болезни Паркинсона, также связано с дисбалансом оси микробиота – кишечник – мозг, который возникает, по-видимому, под влиянием неблагоприятной окружающей среды [4]. Степень участия кишечной микробиоты в патогенезе БП в настоящее время является одной из наиболее актуальных и дискуссионных тем в клинической и фундаментальной медицине. В связи с чем, цель исследования заключается в анализе роли микробиоты желудочно-кишечного тракта в патогенезе болезни Паркинсона.
Основная часть. Болезнь Паркинсона (БП) – это распространенное нейродегенеративное заболевание, возникающее в результате взаимодействия генетических факторов и факторов окружающей среды [4]. В дополнение к общеизвестным моторным симптомам брадикинезии, ригидности, тремора покоя и постуральной нестабильности, БП также включает различные немоторные симптомы, включая запор, депрессию, нарушение сна и гипосмию. Среди них запор является наиболее распространенным и может предшествовать развитию двигательных симптомов более чем на десять лет.
Желудочно-кишечные нарушения (ЖКН) обычно наблюдаются на всех стадиях болезни Паркинсона, почти 30% пациентов сообщают о симптомах ЖКН, включая слюнотечение, дисфагию, гастропарез и запоры. В работе Пфайффера Р.Ф. говориться, что распространенность слюнотечения при БП колеблется от 10% до 84% [5]. Проблема связана с глотательной дисфункцией в фазе ротоглотки и повышенной скоростью секреции околоушной железы, которая ухудшается в согнутом положении тела, непреднамеренном открытии рта [5]. Распространенность дисфагии колеблется от 9% до 82%, но в объективных исследованиях она достигала 97% [5]. Дисфагия обычно развивается у пациентов с прогрессирующим БП, которые имеют тяжелую брадикинезию и ригидность, которая, как считается, способствует дисфагии ротоглотки. Распространенность гастропареза колеблется от 70% до 100%, со средним временем полувыведения от 46 до 149 минут у пациентов с легким БП и от 55 до 221 минуты при БП средней / тяжелой степени, по сравнению с 43–107 минутами у здоровых людей [24]. Хотя точная патофизиология неясна, гастропарез является основным аспектом в развитии двигательных колебаний при БП [5].
Согласно исследованиям Фазано А., Висанджи Н.П., Лю Л.В., Ланг А.Е., Пфайффер Р.Ф. Одним из наиболее широко изученных примеров микробной ассоциации БП является Helicobacter pylori. Распространенность инфекции H. pylori высока среди пациентов с БП и вызывает двигательные нарушения, препятствуя всасыванию леводопы, основного препарата для лечения БП. Чрезмерный рост бактерий в тонкой кишке также был связан с БП. Избыточный бактериальный рост в тонкой кишке выявлен почти у четверти пациентов с БП, и было установлено, что он значительно выше, чем в контрольной группе. Это связывают с нарушениями перистальтики, при этом, устранение избыточного роста микробиоты привело к улучшению сокращения стенок кишечника [6].
В другом исследовании авторов Хитун З.С. и Куигли Э.М. пациенты с БП страдали повышенной проницаемостью слизистой оболочки и системным воздействием эндотоксина на кишечные бактерии [7]. Число бактерий, принадлежащих к роду Blautia, Coprococcus и Roseburia, было значительно снижено в кале пациентов с БП по сравнению со здоровыми. Также отмечено значительное снижение числа бактерий, принадлежащих к роду Faecalibacterium, а количество бактерий рода Ralstonia, наоборот, существенно увеличилось в слизистой оболочке пациентов с БП. На генетическом уровне значительная дисрегуляция в генах, вовлеченных в биосинтез и секрецию липополисахаридов, наблюдалась в фекальном микробиоме ФД [7].
У всех пациентов с БП перистальтика кишечника замедляется, и происходит увеличение времени прохождения пищи через ободочную кишку, что также наблюдалось у лиц с БП, которые не жалуются на запоры [8]. В тяжелых случаях такое замедление перистальтики может привести к мегаколону. При ПД диссинергия тазового дна может развиться у более чем 65% пациентов, что было подтверждено аноректальной манометрией, дефекографией и электромиографией анального сфинктера [8]. Кроме того, задержка опорожнения желудка потенциально может негативно повлиять на фармакокинетику лекарств, следовательно, увеличить риск двигательных и немоторных колебаний. Помимо запора, ощущения вздутия живота и тяжести в животе, следствием вышеуказанных желудочно-кишечных нарушений при БП может быть изменение массы тела: оно часто уменьшается, что не связано с длительностью заболевания, но зависит от степени выраженности двигательных проявлений. Углубленные исследования показали, что снижение массы тела в течение 6 месяцев после появления двигательных симптомов при БП было связано с высоким риском развития деменции у пациента [8].
Вовлечение кишечника в патологический процесс при БП отмечал еще сам Дж. Паркинсон в известной монографии (1817), посвященной этому заболеванию. Наиболее характерные особенности он считал запор и дефекаторная дисфункции. Жалобы больных обычно включают замедленное опорожнение желудка (гастропарез), раннее насыщение, анорексию, чувство переполнения в эпигастрии, тошноту и рвоту. По данным некоторых авторов, замедленное опорожнение желудка более выражено у пациентов с БП, не получавших противопаркинсонические препараты и на поздних стадиях БП. Электрогастрография позволяет выявить дизритмию желудочной моторики, при этом выраженность нарушений не зависит от возраста, пола и наличия жалоб со стороны ЖКТ, однако положительно коррелирует с выраженностью ригидности и тремора. При изучении препрандиальной двигательной активности ЖКТ была выявлена положительная связь между дизритмией, длительностью заболеваний, приемом препаратов леводопы и моторными флюктуациями. Распространенность запоров при БП варьирует от 20 до 29% (что значительно превышает распространенность этого симптома в контрольной группе), их выраженность коррелирует с длительностью и тяжестью заболевания [9].
Некоторые исследователи отмечают, что запоры могут проявляться задолго до развития моторных проявлений БП, и приписывают их к факторам риска. Эти клинические данные заставляют учитывать физиологические основы нервной регуляции желудочно-кишечной функции. Прежде всего, следует отметить значение внутренних и внешних компонентов, которые действуют согласованно благодаря многочисленным локальным и энтерально-центральным рефлекторным связям, обеспечивающим контроль моторики, секреции ферментов и биологически активных веществ, регуляцию местного кровотока, взаимодействие с иммунной системой и составом кишечной микрофлоры.
Иннервация желудочно-кишечного тракта осуществляется парасимпатическим и симпатическим отделами вегетативной нервной системы. Парасимпатический отдел нервной системы осуществляет свое воздействие через брюшную секцию блуждающего нерва, содержащую около 40-50 тысяч чувствительных и двигательных нервных волокон. Чувствительный компонент представлен механорецепторами слизистой оболочки, хеморецепторами, рецепторами растяжения пищевода, желудка, проксимального отдела тонкой кишки, а также нервными окончаниями капсулы печени и поджелудочной железы. Менее значимой является иннервация дистальных мелких и начальных отделов толстой кишки. Основными эфферентными проводниками являются немиелинизированные волокна типа С в крупных внутренних и поясничных внутренних нервах, нервные окончания которых разветвляются в слизистых и подслизистых слоях кишечника, вокруг артериол. Хроническое воспаление желудочно-кишечного тракта вызывает сенсибилизацию нейронов спинного мозга, получающих сигналы из этой области. Информация о составе кишечного содержимого поступает через энтерохромаффинные клетки слизистой оболочки, которые выделяют ваготропные гормоны, что важно для определения питательных веществ и потенциально токсичных веществ. Блуждающий нерв участвует в регуляции аппетита и ощущении сытости, моторики пищевода, сократительной активности мышечного слоя, секреции соляной кислоты, кишечных и панкреатических ферментов. Напомним, что двигательные волокна блуждающего нерва берут начало в дорсальных и двойных ядрах, большинство аксонов которых образуют синапсы на клетках кишечных ганглиев, но некоторые непосредственно иннервируют поперечно-полосатые мышцы пищевода. Их основная функция заключается в контроле моторики пищевода, расслаблении нижнего пищеводного сфинктера и преобразователя для прохождения пищи, контроле секреции желудка и экзокринной поджелудочной железы. Симпатическая иннервация желудочно-кишечного тракта имеет четыре основных точки действия: межмышечные ганглии, подслизистые ганглии, кровеносные сосуды и мышцы сфинктера. Тела преганглионарных симпатических нейронов расположены в промежуточных столбах серого вещества спинного мозга, постганглионарные симпатические вазоконстрикторные нейроны расположены в симпатической цепи и превертебральных ганглиях. Нейроны последних дают аксоны к внутримышечным и подслизистым ганглиям кишечной нервной системы. Их действие в обоих случаях носит тормозящий характер, стимуляция симпатических волокон замедляет прохождение кишечного содержимого и снижает секреторную активность желез слизистой оболочки, а также приводит к сокращению желудочно-кишечных сфинктеров.
Список литературы:
Читайте также:

