Хеликобактер и ревматоидный артрит
Обновлено: 23.04.2024
Человек постоянно контактирует с окружающей средой, а значит и с населяющими ее микроорганизмами, многие из которых являются патогенными, способными вызвать воспалительный процесс. Инфекционный артрит развивается при попадании инфекции в сустав. Предупредить тяжелые осложнения этого заболевания может только своевременное обращение за медицинской помощью.
Общие сведения о заболевании
Инфекционный артрит – это воспаление сустава, вызванное местной или общей инфекцией. Симптомы болезни и ее течение во многом зависят от вызвавшей инфекционный процесс инфекции.
Коды инфекционных артритов по МКБ-10:
- стафилококковый - M00.0;
- пневмококковый - M00.1;
- стрептококковые - M00.2;
- вызванные другими уточненными бактериальными возбудителями - M00.8;
- пиогенный неуточненный - M00.9;
- туберкулезный – М01.1;
- гонококковый - M01.3;
- вирусный – М01.5.
Заболевание очень распространено и может стать причиной стойкого нарушения суставной функции. Четверть пациентов, обращающихся по поводу заболеваний суставов, страдают инфекционными артритами.
Причины инфекционного артрита
Причиной заболевания является инфекция – гнойная инфекция из расположенных рядом очагов (флегмон, абсцессов) или занесенная с током крови при холециститах тонзиллитах, а также общие инфекционные заболевания. При попадании инфекционных возбудителей в сустав иммунная система начинает с ними бороться, вызывая воспалительный процесс, течение которого напрямую связано с особенностями инфекционного возбудителя.
Воспаление может быть:
- неспецифическим – то есть, иметь общие симптомы, характерные для воспалительных процессов; вызываются такие процессы гноеродной патогенной и условно-патогенной микрофлорой – стафилококками, стрептококками, синегнойной и кишечной палочками и др.; вызываемые ими воспалительные процессы носят обычно острый гнойный характер и протекают остро, особенно, у детей;
- специфическим – при таком воспалении развиваются, как общие симптомы, характерные для всех артритов, так и симптомы, свойственные данной инфекции; к таким инфекциям относят туберкулезный, бруцеллезный, гонорейный, вирусный, грибковый, паразитарный воспалительные процессы.
Инфекционные артриты имеют два механизма развития:
- бактериально-метастатический – воспаление начинается из-за присутствия в суставе инфекции;
- токсико-аллергический – воспаление развивается за счет общей интоксикации и неадекватного иммунного ответа на внедрение в организм инфекции;
- смешанный – действуют оба механизма.
Факторы, предрасполагающие к развитию инфекционного артрита: вредные привычки, поднятие тяжестей, наличие лишней массы тела, сахарного диабета. Гнойные поражения суставов особенно часто развиваются у женщин, страдающих ревматоидным артритом.
Симптомы инфекционного атрита
Инфекционный артрит обычно начинается и протекает остро, иногда подостро. Но при некоторых специфических инфекциях он имеет незаметное начало и длительное течение.
Начало болезни и первые симптомы
При остром начале основными симптомами инфекционного артрита являются: выраженная лихорадка, озноб, летучие мышечно-суставные боли в сочетании с резкой болезненностью в пораженном суставе, отеком и гиперемией кожи над ним. Практически всегда остро протекает инфекционный артрит у детей.
Подострое течение имеет не такое заметное начало, температура тела нормальная или субфебрильная. Отек, гиперемия и боль в суставах умеренные.
Самым опасным является скрытое, незаметное течение, характерное для туберкулезного артрита. Характерны неопределенные боли в суставах, похрустывание, снижение двигательной активности. Болезнь протекает на фоне туберкулеза, небольшое повышение температуры также может не привлечь внимания, поэтому туберкулезный артрит редко выявляется на ранних стадиях.
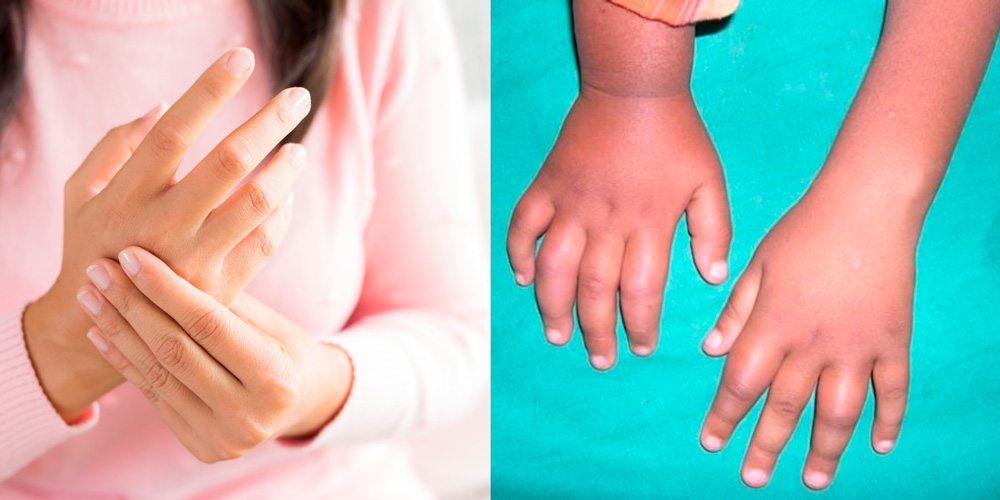
Боли и и отеки характерны для начальной стадии инфекционного токсико-аллергического артрита у детей и взрослых
Явные симптомы
Острый гнойный артрит развиваются очень быстро, состояние ухудшается с каждым днем, беспокоит лихорадка, отечность, гиперемия и боль нарастают. Не исключено, что больному потребуется хирургическая помощь.
При более медленном течении симптомы инфекционного артрита развиваются постепенно, появляется общее недомогание, слабость, суставные боли становятся постоянными, усиливаясь при движении. Постепенно нарушается функция конечностей: появляются трудности в их сгибании или разгибании.
Когда необходимо обращаться за медицинской помощью
К врачу нужно обращаться при появлении следующих симптомов:
- постоянных или регулярно повторяющихся болях в суставах;
- появлении лихорадки, недомогания в сочетании с болями в суставах;
- отека, гиперемии кожи над суставом в сочетании с лихорадкой у пациентов, уже страдающих хроническим артритом – возможно, к имеющемуся хроническому воспалению присоединилась инфекция;
- появление суставных болей при туберкулезе легких, гонорее, бруцеллезе и др. инфекционных заболеваниях.
Опасности
Заболевание часто протекает тяжело, с осложнениями.
Стадии заболевания
Течение болезни связано с ее клинической формой, поэтому стадии развития патологического процесса могут иметь значительные различия. Рассмотрим стадии развития острого гнойного артрита, разработанные НИИ им. Вишневского:
- Начальная – гнойный процесс без деструкции внутрисуставных тканей:
- А. - без поражения околосуставных тканей;
- В. – с развитием гнойных процессов в прилегающих тканях.
- Развернутая – гнойный артрит с деструкцией внутрисуставных тканей:
- А. - без поражения околосуставных тканей;
- В. – с гнойным поражением окружающих мягких тканей.
- Запущенная – с поражением костной и хрящевой ткани:
- А. - без поражения окружающих тканей;
- В. – с гнойным поражением данных тканей;
- С. – с выходом гноя на поверхность тела (свищами).
- Завершающая:
- при отсутствии адекватного лечения – деструкция, неподвижность сустава, инвалидизация;
- при правильном лечении – полное или частичное восстановление функции конечности.
Возможные осложнения
Инфекционный артрит может давать ранние и поздние осложнения. К ранним осложнениям относятся в основном осложнения гнойного артрита:
- нагноение околосуставных тканей;
- генерализация инфекции, сепсис.
Отдаленные последствия – это утрата функции конечности разной степени: от легкой до полной неподвижности.
Классификация
Происхождение и симптомы инфекционного артрита разных клинических форм имеют, как сходство, так и отличие. Рассмотрим наиболее распространенные формы.
Острый гнойный
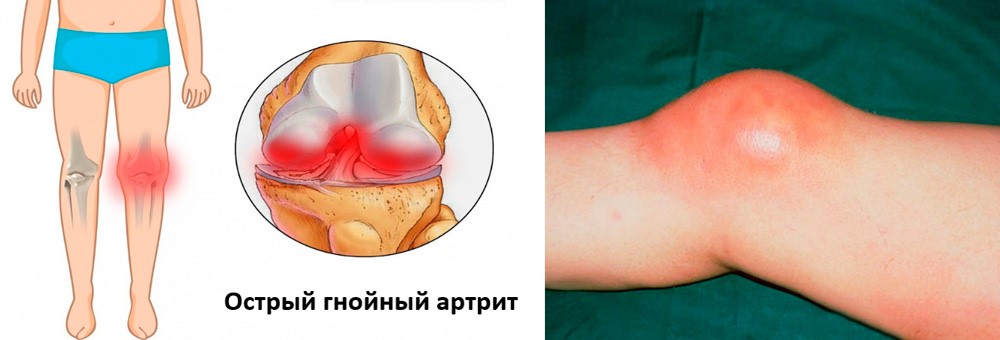
Острый гнойный артрит коленного сустава
Данная форма заболевания развивается при попадании в сустав гноеродной инфекции (синегнойной палочки, стафилококков, стрептококков и др.). Заражение может быть первичным при ранениях и вторичным – при переходе инфекции из окружающих тканей или отдаленных очагов инфекции. К группе риска относятся лица, страдающие ревматоидным артритом, особенно, женщины.
Начинается заболевание остро и протекает тяжело. Появляется лихорадка, головная боль, озноб. Пораженный сустав отекает, кожа над ним краснеет. Боль настолько сильная, что больной не может пошевелить конечностью и старается придать ей положение, вызывающее наименьшую болезненность.
Без оказания своевременной помощи суставные поверхности быстро разрушаются с ограничением подвижности конечности. При назначении адекватного лечения наступает полное выздоровление.
Септический
Развивается на фоне уже существующего сепсиса – генерализованного инфекционного процесса. Инфекция попадает в суставную полость гематогенным путем - с током крови. Заболевание может протекать в виде:
- бактериально-метастатической формы с симптомами острого гнойного артрита – состояние пациента может быть крайне тяжелым; прогноз заболевания зависит от своевременного лечения;
- токсико-аллергической формы – течение не всегда имеет острый характер, часто протекает подостро с множественным поражением суставов мигрирующего (чередующегося) характера; процесс носит негнойный характер и заканчивается выздоровлением на фоне излечения сепсиса.
Туберкулезный
Артрит в данном случае также протекает в виде бактериально-метастатической и токсико-аллергической форм. В первом случае поражаются в основном позвоночник и крупные суставы конечностей, а заболевание носит название костно-суставного туберкулеза. Протекает изначально хронически с нарастающими болями при движении, общим недомоганием. Основные изменения видны на рентгене в виде поражения суставной костной ткани от появления пятна с утратой костью кальция до разрушения кости. При отсутствии лечения приводит к инвалидности.
Токсико-аллергическая форма впервые описанная Понсе в начале 20-го века, протекает очень похоже на ревматоидный артрит с хроническим началом и поражением мелких суставов кисти и стоп. Возможна также их деструкция и инвалидизация. Поражение крупных суставов иногда протекает без последствий и проходит на фоне противотуберкулезной терапии.
Хондропротекторы что это как выбрать, насколько они эффективны
Боль в суставах в состоянии покоя
Гонорейный
Поражение суставов гонококковой инфекцией может иметь бактериально-метастатическую и токсико-аллергическую формы. В обоих случаях поражаются крупные суставы, чаще всего один коленный (голеностопный, лучезапястный). Протекает болезнь остро, с высокой температурой, интоксикацией и сильнейшими суставными болями. Колено отекает, краснеет, до него невозможно дотронуться из-за болей.
При проведении своевременного лечения болезнь имеет благоприятный исход. Если же не лечить, быстро наступает полная неподвижность конечности.
Боррелиозный
Боррелиоз или болезнь Лайма – это инфекция, вызываемая спиралевидными бактериями – спирохетами боррелиями. Передается она клещами и протекает в виде последовательной смены стадий:
- Через 1-2 недели после укуса клеща появляются повышение температуры тела, интоксикация, скованность мышц и появление на теле в месте укуса клеща покраснения - эритемы, окруженной концентрическими кольцами, распространяющейся на большие участки тела. При своевременном назначении антибактериальной терапии заболевание может закончиться на этой стадии.
- Развивается через 1 – 3 месяца после начала заболевания и проявляется в виде поражений нервной системы (менингитов, невритов с острыми болями) и сердца (сердечных блокад, миокардитов и др.).
- Поражение суставов начинается через полгода (иногда через 2 года) после начала заболевания у генетически предрасположенных людей и протекает в виде сильных суставных болей, доброкачественного рецидивирующего воспалительного процесса, протекающего по типу инфекционно-аллергического артрита с асимметричным поражением 1 – 2 суставов (чаще всего коленного) и заканчивающегося через несколько лет выздоровлением у большинства больных. Но у некоторых пациентов заболевание может переходить в хроническую форму с постепенным нарушением функции конечностей.
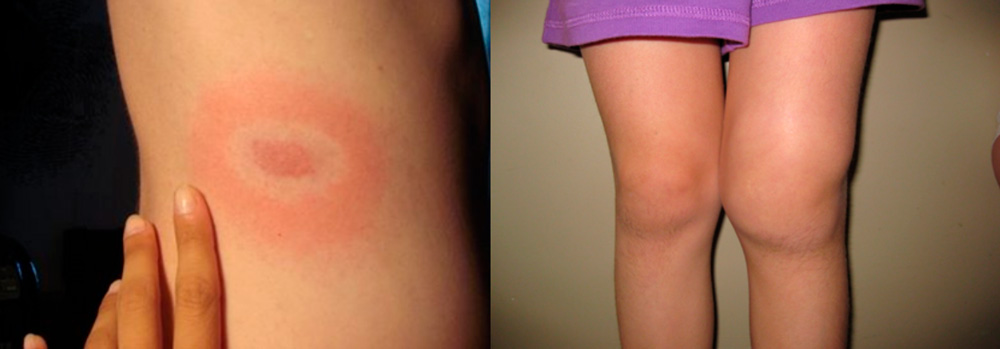
Начальная стадия боррелиоза – мигрирующая эритема и 3 стадия - хронический артрит колена
Вирусный
Развивается на фоне различных вирусных заболеваний:
- Парвовирусная инфекция, вызванная парвовирусом B19 – заболевание протекает с интоксикацией, лихорадкой, кожными проявлениями в виде красных пятен, возвышающихся над кожей папул и точечных подкожных кровоизлияний. Одновременно происходит симметричное поражение суставов. Могут вовлекаться мелкие суставчики кисти, лучезапястные, локтевые, коленные, голеностопные суставы. Симптомы похожи на ревматоидные поражения, но протекают от 3 месяцев до года и имеют благоприятный исход.
- Краснуха – артрит развивается чаще у взрослых женщин на фоне уже имеющихся симптомов краснухи или перед их появлением. У детей такие поражения встречаются редко. Околосуставные ткани отекают, краснеют, появляются сильные боли, нарушающие суставную функцию. Поражение асимметричное с вовлечением мелких суставов кисти, лучезапястных, коленных, локтевых суставов. Артрит продолжается две-три недели, после чего наступает полное выздоровление.
- Вирусные гепатиты В и С – артриты развиваются достаточно часто, но имеют доброкачественное течение и заканчиваются полным выздоровлением. Поражаются мелкие суставы кисти, локтевые, голеностопные и реже другие суставы. Воспаление в суставах обычно начинается до появления желтухи и заканчивается в период ее разгара.
Грибковый
Чаще всего грибковые поражения суставов развиваются при актиномикозе, но встречаются и при другой грибковой инфекции. Патогенные грибки попадают в суставную полость из расположенного рядом костного очага поражения или из отдаленных очагов (кариозные зубы) с током крови. Течение хроническое, с рецидивами и возможным присоединением бактериальной инфекции. Очень часто возникают свищи – ходы, по которым гной из сустава выделяется на поверхность кожи. При отсутствии адекватного лечения приводит к постепенной утрате суставной функции.
Паразитарный
Причиной артрита обычно является эхинококкоз, поражающий костную ткань позвонков, костей таза и длинных костей конечностей. В суставах обычно развивается токсико-аллергический воспалительный процесс. Часто вовлекаются суставы позвоночника, тазобедренные, коленные и локтевые суставы. Течение доброкачественное, но сопровождается сильными суставными болями. Выздоровление наступает при назначении полноценного лечения эхинококкоза.
Инфекционно-аллергический артрит
Инфекционно-аллергический артрит возникает, когда есть аллергия, на фоне которой развивается при неблагоприятных условиях воспалительный процесс в суставах. Заболевание протекает в бурной форме, сопровождается высокой температурой и сильными болевыми признаками. В области поражения наблюдается покраснение, отечность, припухлость. На разных участках кожи – кольцеобразная аллергическая сыпь. Лечением инфекционно-аллергического артрита занимаются ревматолог и аллерголог.
Локализация инфекционного артрита
При инфекционном поражении суставов локализация патологического процесса зависит от особенностей инфекции и ее клинической формы. При острых гнойных артритах – это в основном крупные суставы – коленный, голеностопный, локтевой. Мелкие суставы кисти и стопы поражаются при токсико-аллергической форме туберкулезного и некоторых вирусных артритах.
Асимметричное поражение одного-двух крупных суставов характерно для боррелиоза, чаще всего при этой инфекции в процесс вовлекаются коленные суставы.
Ключевые слова: H. pylori, НПВП, НПВП-гастропатия, эрадикация, нифурател.
Для цитирования: Каратеев А.Е., Цурган А.В., Мороз Е.В. Helicobacter pylori у больных ревматическими заболеваниями: частота инфицированности и оценка эффективности альтернативной схемы эрадикационной терапии. РМЖ. 2017;17:1220-1224.
Helicobacter pylori in patients with rheumatic diseases: the incidence of infection and evaluation of the effectiveness of the alternative scheme of eradication therapy
Karateev A.E. 1 , Tsurgan A.V. 1 , Moroz E.V. 2
1 Scientific Research Institute of Rheumatology named after V.A. Nasonovа, Moscow
2 The main military clinical hospital named after Acad. N.N. Burdenko, Moscow
Helicobacter pylori (H. pylori) is the main cause of peptic ulcer and chronic gastritis, and a serious risk factor for complications in the upper gastrointestinal tract caused by non-steroidal anti-inflammatory drugs (NSAIDs). Eradication of H. pylori is considered to be an important element of treatment and prevention of NSAID-gastropathy.
The aim of the study was to evaluate the infection of H. pylori in patients with rheumatic diseases (RDs), the effect of this microorganism on the development of NSAID- gastropathy and the possibility of its eradication by nifuratel.
Patients and methods: the urease test was used to assess the presence of H. pylori in patients who regularly took NSAIDs and underwent an endoscopic examination at the Clinic of Scientific Research Institute of Rheumatology named after V.A. Nasonovа for the period from 01.02.2017 to 31.03.2017 (2 months, total sampling). A total of 109 patients, 72.5% of women and 27.5% of men with an average age of 53.5 ± 13.6 years were examined. The frequency of erosions and gastric ulcers in patients with or without H. pylori was compared. After that, 32 patients infected with H. pylori with erosions, ulcers and / or ulcerative anamnesis received anti-Helicobacter therapy (omeprazole 20 mg + amoxicillin 1000 mg + nifuratel 400 mg 2 r. / day for 10 days). The achievement of eradication was evaluated by polymerase chain reaction (PCR) in the feces 6 weeks after completion of the course of treatment.
Results: H. pylori was detected in 56% of the examined patients. In infected patients erosion and ulcers were detected significantly more often than in uninfected patients: 47,5% и 23,0% (OR 3,68; 95% Cl 1,56–8,68), р Conclusion: most Russian patients with RDs are infected with H. pylori. The presence of H. pylori is associated with a greater incidence of NSAID-gastropathy. Eradication therapy with nifuratel is effective and well tolerated.
Key words: H. pylori, NSAIDs, NSAID-gastropathy, eradication, nifuratel.
For citation: Karateev A.E., Tsurgan A.V., Moroz E.V. Helicobacter pylori in patients with rheumatic diseases: the incidence of infection and evaluation of the effectiveness of the alternative scheme of eradication therapy // RMJ. 2017. № 17. P. 1220–1224.
Представлены результаты исследования частоты инфицированности и оценки эффективности альтернативной схемы эрадикационной терапии Helicobacter pylori у больных ревматическими заболеваниями
Материал и методы
Результаты исследования
Уреазный тест оказался положительным у 61 больного (56,0%). Эрозии и язвы верхних отделов ЖКТ выявлены у 40 пациентов (36,7%), причем единичные эрозии (менее 10) – у 23 (21,1%), множественные эрозии (более 10) – у 8 (7,3%), язвы желудка – у 9 больных (8,3%).
Группы больных, инфицированных и не инфицированных H. pylori, достоверно не различались по среднему возрасту и полу (p<0,05). Имелась четкая достоверная разница в частоте эрозий и язв у больных, инфицированных и не инфицированных H. pylori (рис. 1). Как видно, эти изменения гораздо чаще отмечались у пациентов с положительным уреазным тестом (p <0,001). В частности, язвы желудка были выявлены у 7 инфицированных больных и лишь у 2-х неинфицированных.
Суммарно риск (ОШ) выявления эрозии и/или язвы желудка у больных, инфицированных H. pylori, составил 3,68 (95% ДИ 1,56–8,68). Следует также отметить, что наличие гастралгий существенно чаще отмечалось у больных с H. pylori – у 19 (31,1%), чем у больных с отрицательным уреазным тестом – у 7 (14,6%), p=0,027.
Эрадикация H. pylori проводилась у 32 больных. Полный курс антибиотиков проведен практически у всех пациентов, лишь у одного из них лечение было прервано из-за развития кожной аллергической реакции. Кроме этого случая, других значимых НР не отмечено.
Через 6 нед. после окончания антихеликобактерной терапии эрадикация H. pylori (отрицательная ПЦР) была достигнута у подавляющего большинства больных (рис. 2). Инфицированность этим микроорганизмом сохранилась лишь в 4-х случаях. Результаты лечения еще 2-х пациентов остались неизвестными.
1. Маев И.В., Самсонов АА., Андреев Д.Н. и др. Клиническое значение инфекции Helicobacter pylori // Клиническая медицина. 2013. №8. С.4–12 [Maev I.V., Samsonov A.A., Andreev D. N. i dr. Klinicheskoe znachenie infekcii Helicobacter pylori // Klinicheskaja medicina. 2013. №8. S.4–12 (in Russian)].
2. Pilotto A., Franceschi M. Helicobacter pylori infection in older people // World J Gastroenterol. 2014. Jun 7. Vol. 20(21). P.6364–6373. doi: 10.3748/wjg.v20.i21.6364
3. Testerman T.L., Morris J. Beyond the stomach: an updated view of Helicobacter pylori pathogenesis, diagnosis, and treatment // World J Gastroenterol. 2014. Sep 28. Vol. 20(36). P.12781–1808. doi: 10.3748/wjg.v20.i36.12781
4. Malfertheiner P., Megraud F., O'Morain C.A. et al.Management of Helicobacter pylori infec-tion-the Maastricht V/Florence Consensus Report // Gut. 2017. Vol. 66(1). P. 6–30. doi: 10.1136/gutjnl-2016-312288. Epub 2016 Oct 5.
5. Лазебник Л.Б., Ткаченко Е.И., Абдулганиева Д.И. и др. Национальные рекомендации по диагностике и лечению кислотозависимых и ассоциированных с Helicobacter pylori заболеваний (V Московские соглашения) // Терапия. 2015. №2(2). С.9–18 [Lazebnik L.B., Tkachenko E.I., Abdulganieva D.I. i dr. Nacional'nye rekomendacii po diagnostike i lecheniju kislotozavisimyh i associirovannyh s Helicobacter pylori zabolevanij (V Moskovskie soglashenija) // Terapija. 2015. №2(2). S.9–18 (in Russian)].
6. McGeachie J., Robinson G., Black D. Antibacterial activity of nifuratel in urine and serum // J Clin Pathol. 1972, May. Vol. 25(5). P.447–449.
7. Nijevitch A.A., Sataev V.U., Akhmadeyeva E.N., Arsamastsev A.G. Nifuratel-containing initial anti-Helicobacter pylori triple therapy in children // Helicobacter. 2007, Apr. Vol. 12(2). P.132–135.
8. Успенский Ю.П., Барышникова Н.В. Использование препаратов нитрофуранового ряда в схемах эрадикационной терапии первой линии // РМЖ. 2012. №35. С.1694 [Uspenskij Ju.P., Baryshnikova N.V. Ispol'zovanie preparatov nitrofuranovogo rjada v shemah jeradikacionnoj terapii pervoj linii // RMZh. 2012. №35. S.1694 (in Russian)].
9. Абдулхаков Р.А., Абдулхаков С.Р. Эпидемиология Helicobacter pylori // Практическая медицина. 2006. №4(18). С.2–3 [Abdulhakov R.A., Abdulhakov S.R. Jepidemiologija Helicobacter pylori // Prakticheskaja medicina. 2006. №4(18). S.2–3 (in Russian)].
10. Герман С.В., Зыкова И.Е., Модестова А.В., Ермаков Н.В. Распространенность инфекции H. pylori среди населения Москвы // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2010. №2. С. 25–30 [German S.V., Zykova I.E., Modestova A.V., Ermakov N.V. Rasprostranennost' infekcii H. pylori sredi naselenija Moskvy // Rossijskij zhurnal gastrojenterologii, gepatologii, koloproktologii. 2010. №2. S.25–30 (in Russian)].
11. Huang J., Sridhar S., Hunt R. Role of Helicobacter pylori infection and non-steroidal anti-inflammatory drugs in peptic-ulcer disease: a meta-analysis // Lancet. 2002. Vol. 359. P.14–22.
12. Sostres C., Carrera-Lasfuentes P., Benito R. et al. Peptic Ulcer Bleeding Risk. The Role of Helicobacter Pylori Infection in NSAID/Low-Dose Aspirin Users // Am J Gastroenterol. 2015, May. Vol. 110(5). P.684–689. doi: 10.1038/ajg.2015.98. Epub 2015 Apr 21.
13. Vergara M., Catalán M., Gisbert J.P., Calvet X. Meta-analysis: role of Helicobacter pylori eradication in the prevention of peptic ul- cer in NSAID users // Aliment Pharmacol Ther. 2005. Vol. 21(12). P.1411–1418 [PMID: 15948807. doi: 10.1111/j.1365-2036.2005.02444.x]
14. Tang C.L., Ye F., Liu W. et al. Eradication of Helicobacter pylori infection reduces the incidence of peptic ulcer disease in patients using nonsteroidal anti-inflammatory drugs: a meta-analysis // Helicobacter. 2012. Vol. 17. P.286–296 [PMID: 22759329 doi: 10.1111/j.1523-5378.2012.00942.x]
15. Hawkey C., Tulassay Z., Szczepanski L. et al. Randomised controlled trial of Helicobacter pylori eradication in patients on non-steroidal anti-inflammatory drugs: HELP NSAIDs study. Helicobacter Eradication for Lesion Prevention // Lancet. 1998, Sep 26. Vol. 352(9133). P.1016–1021.
16. Каратеев А.Е., Муравьев Ю.В., Раденска-Лоповок С.Г., Насонова В.А. Эффективность антихеликобактерной терапии при НПВП-индуцированной гастропатии // Клин. мед. 2003. № 4. С.37–41 [Karateev A.E., Murav'ev Ju.V., Radenska-Lopovok S.G., Nasonova V.A. Jeffektivnost' antihelikobakternoj terapii pri NPVP-inducirovannoj gastropatii // Klin. med. 2003. № 4. S.37–41 (in Russian)].
17. Корниенко Е.А., Базрова Ф.В. Региональные особенности гастродуоденальной патологии, ассоциированной с инфекцией Helicobacter pylori у детей Северной Осетии // Журнал инфектологии. 2011. № 3(3). С.86–90. doi:10.22625/2072-6732-2011-3-3-86-90 [Kornienko E.A., Bazrova F.V. Regional'nye osobennosti gastroduodenal'noj patologii, associirovannoj s infekciej Helicobacter pylori u detej Severnoj Osetii // Zhurnal infektologii. 2011. № 3(3). S.86–90. doi:10.22625/2072-6732-2011-3-3-86-90 (in Russian)].
18. Шадрин О.Г., Зайцева Н.Е., Гарынычева Т.А. Helicobacter pylori у детей: современные подходы к диагностике и пути оптимизации терапии // Современная педиатрия. 2014. №5(61). С.119–127. doi 10.15574/SP.2014.61.119 [Shadrin O.G., Zajceva N.E., Garynycheva T.A. Helicobacter pylori u detej: sovremennye podhody k diagnostike i puti optimizacii terapii // Sovremennaja pediatrija. 2014. №5(61). S.119–127. doi 10.15574/SP.2014.61.119 (in Russian)].
19. Wallace J.L. Mechanisms, prevention and clinical implications of nonsteroidal anti-inflammatory drug-enteropathy // World J Gastroenterol. 2013, Mar 28. Vol. 19(12). P.1861–1876. doi: 10.3748/wjg.v19.i12.1861
20. Lué A., Lanas A. Protons pump inhibitor treatment and lower gastrointestinal bleeding: Balancing risks and benefits // World J Gastroenterol. 2016, Dec 28. Vol. 22(48). P. 10477–10481. doi: 10.3748/wjg.v22.i48.10477
21. Scarpignato C., Dolak W., Lanas A. et al. Rifaximin Reduces Number and Severity of Intestinal Lesions Associated With use of Non-steroidal Anti-inflammatory Drugs in Humans // Gastroenterology. 2016, Dec 19. Vol. 152(5). P.980–982. pii: S0016-5085(16)35504-4. doi: 10.1053/j.gastro.2016.12.007 [Epub ahead of print]
Ключевые слова: дерматология, гастроэнтерология, дерматозы, дермадромы, псориаз, атопический дерматит, Helicobacter pylori, гастроэзофагеальная рефлюксная болезнь, прокинетики, мукопротекторы, гепатопротекторы, нейролептики, кортикостероиды, нестероидные противовоспалительные препараты, язвенная болезнь, рак желудка, пищевод Барретта, неспецифический язвенный колит, болезнь Крона, уреазный дыхательный тест, гастропанель.
Для цитирования: Новоселов А.В., Новоселов В.С., Лебедева С.В. Патология желудочно-кишечного тракта у дерматологических пациентов // РМЖ. Дерматология. 2016. № 10. С. 636–641.
Для цитирования: Новоселов А.В., Новоселов В.С., Лебедева С.В. Патология желудочно-кишечного тракта у дерматологических пациентов. РМЖ. 2016;10:636-641.
Gastrointestinal disorders in dermatological patents
Novoselov A.V., Novoselov V.S., Lebedeva S.V.
I.M. Sechenov First Moscow State Medical University, Moscow, Russia
Skin is like an alarm system for the body which can alert to all kinds of health issues. Figuratively speaking, a human body is similar to a hollow tube: skin covers the external surface while gastrointestinal tract is the lumen. Makeup products are often used to hide skin problems. However, these external manifestations mask gastrointestinal problems. The task for a dermatologist is to identify primary cause of skin disorder, to provide primary health care, and to refer a patient to the specialist who will be able to eliminate the primary cause of the disease. The role of a dermatologist is to eradicate the consequences of skin comorbidities. Optimal algorithm of complex interdisciplinary treatment will result in maximum effect.
Gastrointestinal disorders (i.e., infection with Helicobacter pylori, gastroesophageal reflux disease, pancreatoduodenal and hepatobiliary disorders, changes of intestinal microbiocenosis etc.) play an important role in the development of certain dermatoses.
Dermadrome manifestations of gastrointestinal disorders, their diagnosis and therapy are discussed.
Key words: dermatology, gastroenterology, dermatoses, dermadrome, psoriasis, atopic dermatitis, Helicobacter pylori, gastroesophageal reflux disease, prokinetics, mucosal protective agents, hepatic protectors, neuroleptics, corticosteroids, nonsteroidal anti-inflammatory drugs, ulcer, stomach cancer, Barrett's esophagus, nonspecific ulcerative colitis, Crohn's disease, urea breath test, GastroPanel.
For citation: Novoselov A.V., Novoselov V.S., Lebedeva S.V. Gastrointestinal disorders in dermatological patents // RMJ. Dermatology. 2016. № 10. P. 636–641.
Статья посвящена патологии желудочно-кишечного тракта у дерматологических пациентов
Мукопротекторы
1. Висмута трикалия дицитрат. Соль висмута, действующая только в ЖКТ (биодоступность <1%). Оказывает антиульцерогенный, цитопротективный и хеликоцидный эффект. Может применяться в комплексной терапии, направленной на эрадикацию H. pylori, для лечения эрозивно-язвенных дефектов слизистой оболочки ЖКТ (в первую очередь верхних отделов ЖКТ) и для профилактики язвообразования при приеме системных НПВП, цитостатиков и кортикостероидов.
2. Сукральфат. Защищает слизистые оболочки верхних отделов ЖКТ от агрессивного влияния кислоты, желчи и ульцерогенных медикаментов.
3. Ребамипид. Обладает выраженным мукопротективным эффектом за счет стимуляции синтеза слизи на поверхности слизистых оболочек ЖКТ. Поскольку ульцерогенные медикаменты оказывают негативное влияние на слизистую оболочку не только верхних отделов ЖКТ, но и на кишечник, его применение особенно приоритетно при риске развития эрозивно-язвенных дефектов тонкой и толстой кишки.
Важно учитывать, что ульцерогенным эффектом обладают все вышеперечисленные системные препараты (НПВП, ГКС и т. д.), включая те, которые вводятся парентерально. Поэтому использование протекторов ЖКТ целесообразно не только в случае применения ГКС и НПВП, принимаемых внутрь, но и при назначении иных системных лекарственных форм вышеперечисленных групп препаратов.
Прокинетики
1. Метоклопрамид. Оказывает умеренное влияние на моторику пищевода, желудка, тонкой кишки, не влияет на моторику желчного пузыря и толстой кишки, вызывает экстрапирамидные расстройства, не является оптимальным прокинетиком для нормализации перистальтики ЖКТ.
2. Домперидон. Достаточно безопасен для применения у детей, имеет максимальное разнообразие лекарственных форм среди прокинетиков, не вызывает экстрапирамидных расстройств, но при этом ограниченно влияет только на перистальтику желудка.
3. Итоприд. Наиболее актуальный прокинетик, оказывает полноценное влияние на транзит пищи по пищеводу, желудку, тонкой кишке, потенцирует моторику желчного пузыря, улучшает толстокишечный транзит, не метаболизируется в печени, но имеет ограничения по применению у детей (в первую очередь из-за недостаточного количества информации о влиянии активного вещества на эту возрастную группу).
4. Прукалоприд. Прокинетик кишечного типа действия, оказывающий прямое влияние на толстокишечный транзит. Препарат выбора для устранения запоров.
Нейролептики
Сульпирид. Атипичный нейролептик, обладающий значительной терапевтической широтой (от 50 до 3200 мг/сут), в минимальных дозах используется в гастроэнтерологической практике с целью устранения воспалительных явлений по всей протяженности ЖКТ от пищевода до ампулы прямой кишки. Также в небольших дозах обладает кумулятивным эффектом, обеспечивая повышение стрессоустойчивости. В дозах более 600 мг используется вплоть до психиатрической практики с целью устранения продуктивной симптоматики (галлюцинации, бред).
1. Marshall B.J. Unidentified curved bacilli on gastric epithelium in active chronicgastritis // Lancet. 1983. Vol. 1 (8336). P. 1273–1275.
2. Marshall B.J., Warren J.R. Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration // Lancet. 1984. Vol. 1 (8390). Р. 1311–1315.
3. The Nobel Prize in Physiology or Medicine 2005.
4. Reimer C., Sondergaard B., Hilsted L. et al. Proton-pump inhibitor therapy induces acidrelated symptoms in healthy volunteers after withdrawal of therapy // Gastroenterology. 2009. Vol. 137. Р. 80–87.
Для цитирования: Лоранская И.Д., Ракитская Л.Г., Мамедова Л.Д. Проблемы лечения хеликобактерной инфекции. РМЖ. 2013;31:1638.
В настоящее время доказана роль выявленной в 1983 г. австралийскими учеными B.J. Marshall и R. Warren грамнегативной спиралевидной бактерии Heliсobaсter pylori (H. pylori) в развитии многих заболеваний желудочно-кишечного тракта (ЖКТ) [5, 6, 10]. Распространенность H. pylori среди населения в разных странах достигает 50–80%, в России инфицированность H. pylori в разных регионах составляет 70–80%, а в г. Москве – 60–70% [6, 15]. Пути передачи инфекции: оральный, через воду и пищу и контактный – от человека к человеку, чаще между членами одной семьи через предметы личной гигиены. Многими исследованиями подтверждена этиологическая роль Н. pylori в развитии хронического атрофического гастрита (90–100%), язвенной болезни (ЯБ) желудка (70–80%) и двенадцатиперстной кишки (90–100%), аденокарциномы (80%) и мальтомы желудка (40–75%) [4, 5, 7].
Литература
1. Бугаева И.О., Гречушников В.Б. и др. Helicobacter pylori: современная диагностика и терапия. Саратов, 2008. 105 с.
2. Вялов С.С. Язвенная болезнь и Маастрихт-4: внедрение в клиническую практику // Эффективная фармакотерапия. Гастроэнтерология. 2012. № 6. С. 16–23.
3. Зайцева Е.В., Антоненко О.М. Место коррекции дисбиозов в терапии ряда хронических заболеваний пищеварительного тракта // Consilium medicum. Гастроэнтерология. 2011. №1. С. 60–63.
4. Ивашкин В.Т., Шептулин А.А., Лапина Т.А. Хронический гастрит, вызванный инфекцией Helicobacter pylori: диагностика, клиническое значение, прогноз. Пособие для врачей. РГА. М., 2009. 23 с.
5. Исаков В.А., Доморадский И.В. Хеликобактериоз. М.: Медпрактика-М, 2003. 411 с.
6. Лазебник Л.Б., Васильев Ю.В и др. Helicobacter pylori: распространенность, диагностика, лечение // Экспериментальная и клиническая гастроэнтерология. 2010. № 2. С. 3–7.
7. Лазебник Л.Б., Бордин Д.С. и др. Хронический гастрит. Методические рекомендации. М.: ЦНИИГ, 2011. 34 с.
8. Лапина Т.Л. Эрадикационная терапия Helicobacter pylori // Медицинский вестник. 2006. № 6. С. 9–10.
9. Маев И.В., Вьючнова Е.С. и др. Побочные действия современной антихеликобактерной терапии // Клиническая медицина. 2002. № 6. С. 7–12.
10. Национальное руководство по гастроэнтерологии / под ред. Ивашкина В.Т., Лапиной Т.Л. М.: ГЭОТАР-Медиа, 2008. 704 с.
11. Самсонов А.А., Маев И.В. Современные стандарты диагностики и лечения заболеваний, ассоциированных с Helicobacter pylori. (анализ материалов 3-го Маастрихтского соглашения) // Медицинский вестник. 2006. № 4. С. 358.
12. Ткаченко Е.И., Авалуева Е.Б. и др. Эрадикационная терапия, включающая пробиотики: консенсус эффективности и безопасности // Клиническое питание. 2005. № 1. С. 14–20.
13. Успенский Ю.П., Барышникова Н.В. Мировые тенденции к расширению сферы использования пробиотиков: актуальность применения средств на основе Bacillus subtilis // Consilium medicum. Гастроэнтерология. 2012. №1. С. 40–44.
14. Хомерики Н.М., Хомерики С.Г. Некоторые механизмы развития побочных эффектов антихеликобактерной терапии и пути коррекции // Consilium medicum. Гастроэнтерология. 2005. Т. 7. № 2. С. 12.
15. Цуканов В.В. Клинико-эпидемиологические аспекты Helicobacter pylori // Экспериментальная и клиническая гастроэнтерология. 2006. № 1. С. 24–25.
16. Чичерин И.Ю., Погорельский И.П., Дармов И.В. Кишечная микрофлора: тезисы о главном. М., 2013. 21 с.
17. Чичерин И.Ю., Погорельский И.П. и др. Трансплантация кишечной микробиоты // Журнал инфектологии. 2013. № 2. С. 2–15.
18. Clostridium difficile: an old bug with new tricks? // DDW Clostridium difficile Symposium. 2007. May. 31 p.
19. Leonard J. Systematic review of the risk of enteric infection in patients taking acid suppression // American Journal of Gastroenterology. 2007. Vol. 102 (9). P. 2047–2056.
20. Malfertheiner P., Megraud F. et al. Current concept in the management of Helicobacter pylori infection: the Maasticht III - 2000 Consensus report // Gut. 2007. Vol. 56. P. 772–781.
21. Scaccianoce G., Hassan C. et al. Helicobacter pylori eradication with either 7-day or 10-day triple therapies, and with a 10 – day sequential regimen // Can. J. Gastroenterology. 2006. Vol. 20 (2). P. 113–117.
22. Szajewska H. et al. Meta-analysis: the effects of Saccharomyces boulardii supplementation on Helicobacter pylori eradication rates and side effects during treatment // Alimentary Pharmacology and Therapeutics. 2010. Vol. 32. P. 1069–1079.
23. Simren M., Dore J. Gut microbiota for health – current insights and understanding // European Gastroenterology & Hepatology Review. 2012. Vol. 8. P. 3–7.
24. Vaira D., Zullo A. et al. Sequential therapy versus standard triple-drug therapy for Helicobacter pylori eradication: a randomized trial // Ann Intern Med. 2007. Vol. 146 (8). P. 556–563.
25. Yang Y., Metz. D. Safety of proton pump inhibitor exposure // Gastroenterology. 2010. Vol. 139. P. 1115–1127.
26. Барышникова Н.В. Клинико-микробиологическая характеристика микробиоценоза кишечника и коррекция его нарушений у больных хроническим гастродуоденитом, ассоциированным с Helicobacter pylori: Автореф. дисс. … канд. мед. наук. СПб., 2006. 24 с.
Читайте также:

