Хеликобактер пилори и атопический дерматит у ребенка
Обновлено: 24.04.2024
Для цитирования: Маев И.В., Андреев Д.Н., Бордин Д.С. и др. Резистентность Helicobacter pylori к кларитромицину в Российской Федерации // Эффективная фармакотерапия. 2020. Т. 16. № 30. С. 16–22.
- Аннотация
- Статья
- Ссылки
- Английский вариант
Цель – систематизация данных резистентности Helicobacter pylori к кларитромицину в Российской Федерации.
Материал и методы. Поиск исследований проводился в электронных базах данных MEDLINE/PubMed, EMBASE, Cochrane, Российский индекс научного цитирования, опубликованных в период с января по сентябрь 2020 г. В финальный анализ вошли оригинальные публикации из периодических рецензируемых зарубежных и российских изданий, а также диссертационные работы, в которых применялись валидированные тесты оценки резистентности H. pylori с подробной описательной статистикой, позволяющей включить результирующие данные в метаанализ.
Результаты. В итоговый анализ было включено 16 исследований (1227 изолятов). Обобщенный показатель резистентности H. pylori к кларитромицину в Российской Федерации составил 11,85% (95%-ный доверительный интервал (ДИ) 7,315–17,302; I2 = 86,19%). При анализе работ, опубликованных за последние десять лет, резистентность H. pylori к кларитромицину составила 10,39% (95% ДИ 7,103–14,219; I2 = 61,29%). В Москве и Московской области обобщенный показатель резистентности H. pylori к кларитромицину составил 10,87% (95% ДИ 7,280–15,439; I2 = 50,57%), Санкт-Петербурге – 22,26% (95% ДИ 9,525–38,470; I2 = 84,75%), Смоленске – 5,74% (95% ДИ 3,511–8,789; I2 = 0,00%), Казани – 10,0% (95% ДИ 5,023–17,355; I2 = 45,22%).
Заключение. Полученные результаты свидетельствуют о том, что устойчивость H. pylori к кларитромицину в России не превышает регламентированный консенсусом Маастрихт-V порог 15%. Это позволяет рассматривать тройную схему противохеликобактерной терапии с кларитромицином в качестве терапии первой линии. Вместе с тем для достижения максимального эффекта при использовании классической тройной терапии и нивелирования риска дальнейшего прогрессирования кларитромициновой резистентности H. pylori в России целесообразно применять методы ее оптимизации.
- КЛЮЧЕВЫЕ СЛОВА: Helicobacter pylori, эрадикационная терапия, резистентность, устойчивость, чувствительность, антибактериальные препараты, кларитромицин
Цель – систематизация данных резистентности Helicobacter pylori к кларитромицину в Российской Федерации.
Материал и методы. Поиск исследований проводился в электронных базах данных MEDLINE/PubMed, EMBASE, Cochrane, Российский индекс научного цитирования, опубликованных в период с января по сентябрь 2020 г. В финальный анализ вошли оригинальные публикации из периодических рецензируемых зарубежных и российских изданий, а также диссертационные работы, в которых применялись валидированные тесты оценки резистентности H. pylori с подробной описательной статистикой, позволяющей включить результирующие данные в метаанализ.
Результаты. В итоговый анализ было включено 16 исследований (1227 изолятов). Обобщенный показатель резистентности H. pylori к кларитромицину в Российской Федерации составил 11,85% (95%-ный доверительный интервал (ДИ) 7,315–17,302; I2 = 86,19%). При анализе работ, опубликованных за последние десять лет, резистентность H. pylori к кларитромицину составила 10,39% (95% ДИ 7,103–14,219; I2 = 61,29%). В Москве и Московской области обобщенный показатель резистентности H. pylori к кларитромицину составил 10,87% (95% ДИ 7,280–15,439; I2 = 50,57%), Санкт-Петербурге – 22,26% (95% ДИ 9,525–38,470; I2 = 84,75%), Смоленске – 5,74% (95% ДИ 3,511–8,789; I2 = 0,00%), Казани – 10,0% (95% ДИ 5,023–17,355; I2 = 45,22%).
Заключение. Полученные результаты свидетельствуют о том, что устойчивость H. pylori к кларитромицину в России не превышает регламентированный консенсусом Маастрихт-V порог 15%. Это позволяет рассматривать тройную схему противохеликобактерной терапии с кларитромицином в качестве терапии первой линии. Вместе с тем для достижения максимального эффекта при использовании классической тройной терапии и нивелирования риска дальнейшего прогрессирования кларитромициновой резистентности H. pylori в России целесообразно применять методы ее оптимизации.
В настоящее время инфекция Helicobacter pylori остается одним из ведущих этиологических факторов заболеваний гастродуоденальной зоны, включая хронический гастрит, язвенную болезнь желудка и двенадцатиперстной кишки, а также рак (аденокарциному) желудка [1, 2]. Согласно последнему систематическому обзору, 44,3% (95%-ный доверительный интервал (ДИ) 40,9–47,7) мировой популяции инфицировано H. pylori [3]. По некоторым данным, Российская Федерация относится к странам с высокой распространенностью инфекции H. pylori в популяции в целом [4]. Так, согласно метаанализу J.K.Y. Hooi и соавт. (2017 г.), в нашей стране H. pylori инфицировано 78,5% (95% ДИ 67,1–89,9) населения, или более 112 млн человек [4]. Вместе с тем следует отметить, что в последнее время стали появляться публикации, демонстрирующие тренд к снижению распространенности инфекции H. pylori в Российской Федерации. Так, по данным D. Bordin и соавт. (2020 г.), полученным во всех федеральных округах России с использованием 13 С-уреазного дыхательного теста, распространенность инфекции H. pylori составляла 42,5% в 2017 г. и 35,3% – в 2019 г. [5].
В последних европейских и североамериканских рекомендациях по диагностике и лечению инфекции H. pylori сказано, что эрадикационная терапия (ЭТ) должна назначаться всем инфицированным взрослым пациентам, а выбор схемы лечения носит дифференцированный характер в зависимости от уровня региональной резистентности микроорганизма к кларитромицину и метронидазолу [6, 7]. В частности, экспертный совет консенсуса Маастрихт-V (2015 г.) не рекомендует использовать тройную схему противохеликобактерной терапии с кларитромицином в регионах, где показатель резистентности H. pylori к данному антибактериальному препарату превышает пороговый уровень 15% [6]. Между тем тройная противохеликобактерная терапия с кларитромицином, внедренная в клиническую практику в 1995 г., остается одной из наиболее распространенных схем ЭТ как во всем мире, так и в нашей стране [8–10]. Согласно последним клиническим рекомендациям Российской гастроэнтерологической ассоциации (2018 г.) по диагностике и лечению инфекции H. pylori у взрослых, тройная терапия с кларитромицином регламентируется в качестве терапии первой линии [11]. Тем не менее метаанализы 2020 г. демонстрируют, что частота неэффективного лечения при использовании данной комбинации высока – около 25–30% [12, 13]. Такой негативный тренд обусловлен ростом количества резистентных штаммов H. pylori к кларитромицину, который наблюдается в последние годы во многих регионах мира [14, 15].
Метаанализ Y. Zou и соавт. (2020 г.), обобщивший результаты 120 исследований (28 707 пациентов), показал, что наличие резистентности H. pylori к кларитромицину значительно снижает эффективность ЭТ первой линии (отношение шансов (ОШ) 0,682; 95% ДИ 0,636–0,731) [16]. В систематическом обзоре G.G. Kasahun и соавт. (2020 г.) обобщенный показатель первичной резистентности H. pylori к кларитромицину в мире составил 27,22% (95% ДИ 25,89–28,58), в Европейском регионе – 31,25% (95% ДИ 25,88–37,17) [17]. При этом метааналитических данных о частоте резистентности H. pylori к кларитромицину, позволяющих объективизировать данные об антибиотикорезистентности и приоритетном выборе схемы ЭТ в России, в настоящий момент нет. В отдельных работах, проведенных за последние 20 лет в нашей стране, показатели резистентности H. pylori к кларитромицину превышают 15%-ный пороговый уровень, установленный консенсусом Маастрихт-V [18–20].
Основной целью настоящего метаанализа стала систематизация данных резистентности H. pylori к кларитромицину в Российской Федерации.
Поиск исследований
Критерии отбора исследований
Критериями включения в метаанализ были оригинальные публикации в периодических рецензируемых зарубежных и российских изданиях, а также защищенные диссертационные работы, оригинальные публикации и диссертации с подробной описательной статистикой, позволяющей включить результирующие данные в метаанализ, исследования с применением валидированных тестов оценки резистентности H. pylori (метод серийного разведения, диско-диффузионный метод, молекулярно-генетический метод). В случае обнаружения дублирования результатов между двумя публикациями (из разных или одной электронной базы данных) в финальный анализ отбиралась только одна. Оценка методологического качества каждого из включенных в метаанализ исследований проводилась с использованием Newcastle-Ottawa Scale (NOS).
Статистический анализ
Статистическая обработка данных осуществлялась с помощью специального программного обеспечения MedCalc 19.5.3 (Бельгия) в среде Microsoft Windows 10 (США). Результаты представлены в виде обобщенной частоты резистентности H. pylori к кларитромицину (в процентах) и 95%-ного доверительного интервала (95% ДИ). Гетерогенность между различными работами оценивали по критериям Cochrane’s Q и I 2 . При р 2 > 50 констатировалось наличие значимой гетерогенности. Вероятность наличия публикационной ошибки оценивали с помощью воронкообразной диаграммы рассеяния, а также на основании расчета корреляционного теста Бегга – Мазумдара и теста регрессии Эггера.
Поиск исследований
Поиск в электронных базах данных выявил 65 работ для последующего анализа. Из них 39 исследований было исключено, поскольку они не являлись оригинальными работами (32 – обзоры, четыре – экспериментальные исследования, три – прочие нерелевантные работы). Отобранные 26 работ детально проанализированы на соответствие критериям включения, после чего десять исследований были исключены (рис. 1). В итоге 16 оригинальных исследований вошли в настоящий метаанализ (табл. 1) [18–33].
Характеристика отобранных исследований
В итоговый анализ было включено 16 исследований (1227 изолятов), выполненных в Москве и Московской области (n = 5) [21–23, 26, 33], Санкт-Петербурге (n = 4) [18, 19, 22, 29], Смоленске (n = 3) [25, 31, 33], Новосибирске (n = 1) [27], Казани (n = 2) [24, 28], Ярославле (n = 1) [33], Курске (n = 1) [20] и Владивостоке (n = 1) [30]. В качестве методики определения чувствительности H. pylori к антибактериальным препаратам в семи исследованиях использовали метод серийных разведений [19, 22, 23, 25, 30–32], в пяти – молекулярно-генетический метод [18, 20, 25, 26, 28], в четырех – диффузионную методику [21, 23, 24, 29].
Резистентность H. pylori к кларитромицину в России
В итоговом анализе использовали модель случайных эффектов, поскольку была выявлена значительная гетерогенность между результатами включенных в метаанализ исследований (p 2 = 86,19%). Обобщенный показатель резистентности H. pylori к кларитромицину в Российской Федерации составил 11,85% (95% ДИ 7,315–17,302) (рис. 2). При анализе работ, опубликованных за последние десять лет, резистентность H. pylori к кларитромицину составила 10,39% (95% ДИ 7,103–14,219; I 2 = 61,29%).
Дополнительно нами была рассчитана резистентность H. pylori к кларитромицину в отдельных агломерациях и городах России. В Москве и Московской области обобщенный показатель резистентности H. pylori к кларитромицину достиг 10,87% (95% ДИ 7,280–15,439; I 2 = 50,57%), Санкт-Петербурге – 22,26% (95% ДИ 9,525–38,470; I 2 = 84,75%), Смоленске – 5,74% (95% ДИ 3,511–8,789; I 2 = 0,00%), Казани – 10,0% (95% ДИ 5,023–17,355; I 2 = 45,22%) (табл. 2).
При оценке исследований, выполненных молекулярно-генетическим методом, показатель резистентности H. pylori к кларитромицину составил 19,08% (95% ДИ 7,781–33,905; I 2 = 89,62%), тогда как при использовании методов серийных разведений и диффузионных методик – 8,39% (95% ДИ 5,891–11,305; I 2 = 48,67%).
Вероятность наличия публикационного смещения оценивали с помощью воронкообразной диаграммы рассеяния, а также на основании расчета теста Бегга – Мазумдара и теста регрессии Эггера. При визуальном анализе воронкообразной диаграммы рассеяния (рис. 3) существенной асимметрии не выявлено. Помимо этого наличие значимого публикационного смещения исключено по результатам теста Бегга – Мазумдара (p = 0,1357) и теста регрессии Эггера (p = 0,9183).
Клиническое значение устойчивости H. pylori к кларитромицину для практической гастроэнтерологии существенно возросло за последние 15 лет [5, 14, 15]. Резистентность H. pylori к данному антибактериальному препарату детерминируется точечными хромосомными мутациями в регионе, кодирующем пептидил-трансферазу (основную мишень макролидов) в V домене 23S рРНК [33, 34]. Наиболее распространенными вариациями таких мутаций является замена нуклеотидных последовательностей в позициях 2142 (A2142G и A2142С), 2143 (A2143G) [34, 35]. Замещение нуклеотидов в данных последовательностях приводит к снижению аффинности всей группы макролидов, в состав которой входит в том числе кларитромицин, к рибосомам бактериальной клетки. Как следствие, формируется резистентность [34]. Согласно метаанализу A. Savoldi и соавт. (2018 г.), наличие резистентности H. pylori к кларитромицину многократно увеличивает риск неэффективной эрадикации при использовании кларитромицин-содержащих протоколов лечения (ОШ 6,97; 95% ДИ 5,23–9,28; p 2 = 86,19%). Полученные показатели резистентности H. pylori к кларитромицину ниже показателей, выявленных в европейских метаанализах. Это подтверждает позицию экспертов Российской гастроэнтерологической ассоциации, изложенную в клинических рекомендациях 2018–2020 гг., регламентирующую актуальность применения классической тройной противохеликобактерной терапии с кларитромицином в качестве эрадикационного протокола первой линии в нашей стране [11, 37]. Тем не менее обращает на себя внимание тот факт, что эффективность классической тройной терапии в реальной клинической практике в России относительно низка. Это создает определенный диссонанс с полученными в настоящем метаанализе данными. Так, по данным Европейского регистра ведения инфекции H. pylori (Hp-EuReg, 2020 г.), эффективность эрадикации при использовании 10–14-дневной тройной терапии в Москве при анализе ITT (intention-to-treat) достигает 70–79% [38]. По последним данным, такой субоптимальный профиль эффективности классической тройной терапии характерен для большинства регионов Европы [39]. Таким образом, для достижения максимальной эффективности лечения при использовании классической тройной терапии и нивелирования риска дальнейшей прогрессии резистентности H. pylori к кларитромицину в Российской Федерации целесообразно использовать методы ее оптимизации, регламентированные Российской гастроэнтерологической ассоциацией и позволяющие повысить эффективность стандартной тройной терапии [11]:
- подробное инструктирование пациента и контроль за точным соблюдением назначенного режима приема лекарственных средств;
- пролонгация курса лечения до 14 дней;
- назначение дважды в день повышенной дозы ингибиторов протонной помпы (ИПП) (удвоенной по сравнению со стандартной);
- использование ИПП последних поколений (рабепразол и эзомепразол);
- добавление к стандартной тройной терапии висмута трикалия дицитрата (240 мг два раза в сутки);
- добавление к стандартной тройной терапии цитопротектора ребамипида (100 мг три раза в сутки).
Следует отметить, что, по данным Европейского регистра ведения инфекции Helicobacter pylori (Hp-EuReg), основной схемой в России в 2013–2018 гг. считалась тройная терапия (ИПП, кларитромицин, амоксициллин), которая назначалась в 62,8–68,9% случаев. При этом наблюдалась тенденция к увеличению частоты назначения тройной терапии с добавлением висмута трикалия дицитрата (с 28,4 до 35,8%). Квадротерапия (ИПП, тетрациклин, метронидазол, висмута трикалия дицитрат) назначалась 0,5–7,8% больных. Эффективность 14-дневной тройной терапии у завершивших прием препаратов (per protocol, PP) составила 85%, при анализе начавших терапию (ITT) – 66%. Это свидетельствует о недостаточной эффективности тройной терапии. При добавлении к тройной терапии висмута трикалия дицитрата эффективность 14-дневного курса РР достигла 96%, ITT – 89% [40]. Подобные данные получены и при анализе международной когорты больных регистра Hp-EuReg [41].
В данном метаанализе имеется несколько недостатков. В частности, общий пул проанализированных изолятов относительно небольшой по сравнению с таковым в аналогичных метааналитических работах, проведенных во многих странах Европы, Северной Америки и Азии. Кроме того, имеется существенная гетерогенность между включенными исследованиями, заключающаяся в различных методиках определения чувствительности H. pylori к кларитромицину. На наш взгляд, интерпретация результатов данного метаанализа должна проводиться осторожно с учетом показателей эффективности классической тройной терапии в конкретном регионе нашей страны. Вместе с тем это первая работа подобного дизайна, позволяющая приблизиться к объективизации показателя резистентности H. pylori к кларитромицину в России. С учетом динамично меняющегося паттерна антибиотикорезистентности H. pylori эти данные требуют перманентной актуализации за счет проведения более крупных многоцентровых исследований с анализом значительно большего количества изолятов во всех федеральных округах нашей страны.
Настоящий метаанализ представляет собой первую аналитическую работу, которая позволяет объективизировать уровень резистентности H. pylori к кларитромицину в Российской Федерации. Полученные результаты свидетельствуют о том, что устойчивость H. pylori к кларитромицину в нашей стране не превышает регламентированный консенсусом Маастрихт-V пороговый уровень 15%. Таким образом, тройную схему противохеликобактерной терапии с кларитромицином можно рассматривать в качестве терапии первой линии. Тем не менее для достижения максимальной эффективности лечения при использовании классической тройной терапии и нивелирования риска дальнейшей прогрессии резистентности H. pylori к кларитромицину в Российской Федерации целесообразно применять методы ее оптимизации.
Атопический дерматит (АД) – хроническое рецидивирующее заболевание кожи, проявляющееся интенсивным зудом, высыпаниями в сочетании другими многочисленными признаками атопии (необычностью) – атопический ринит, бронхиальная астма, мигрень, гастродуоденит и др.
Атопический дерматит — симптомы
АД в мире страдают 5-15 % детей и 2-10 % взрослых, впервые выявленный в детстве АД продолжается у 45- 60 % взрослых пациентов. АД отличается хроническим рецидивирующим течением с возрастной динамикой клинических проявлений. По проявлениям заболевание возможно разделить на три периода.
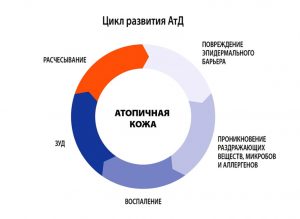
- В младенческом возрасте (до 1.5-2 лет) заболевание носит острый характер, преобладают явления покраснения, отечности, мокнутия и коркообразования.
- В период от 2 лет до полового созревания болезнь носит характер хронического воспаления, на коже на первый план выступают явления гиперемии (эритемы) и шелушения, признаки вегетососудистой дистонии. Кожа в очагах поражения гиперпигментирована, из-за сильного зуда появляются множественные расчесы.
- У детей старшего возраста и взрослых преобладают явления инфильтрации (уплотнения) на фоне гиперемии застойного характера. На коже могут появляться зудящие высыпания, имеющие цвет нормальной кожи, которые сливаются в очаги сплошной папулезной инфильтрации. Обычно к 50 годам заболевание самостоятельно регрессирует.
Атопический дерматит – многофакторное заболевание, характеризующееся аномальным иммунным ответом на аллергены природного происхождения, наследственной предрасположенностью к заболеванию, хроническим рецидивирующим течением. Большое внимание уделяется различным факторам, запускающим процесс в коже и длительно поддерживающим хроническое течение заболевания. К таким факторам относятся бактериальные, вирусные, грибковые, паразитарные и кишечные инфекции, продукты питания и химические вещества (добавки к пище, лекарства), клещи из домашней пыли.
Атопический дерматит и хеликобактер пилори
В последние годы доказана связь атопического дерматита с болезнями органов пищеварения. Установлено, что большинство больных, страдающих АД, имеют хронический гастрит, гастродуоденит, синдром раздраженного кишечника с запорами, заболевания печени и желчного пузыря, нарушение микрофлоры кишечника и др. Нередко существование этих сопутствующих болезней является пусковым фактором атопического дерматита, как у детей, так и у взрослых.
Так, в последние десятилетия в возникновении заболеваний желудка доказана роль специфического микроорганизма – Helicobacter pylori (НР), повреждающего слизистую оболочку желудка. Его наличие способствует активному поступлению токсинов и аллергенов в организм, развитию хронического воспаления слизистой желудка. У больных атопическим дерматитом в 90% случаев при проведении эндоскопического обследования желудка выявляется хронический гастрит и в 82.5% ассоциированный с НР. Отмечена связь между степенью обсеменения бактериями слизистой желудка, активностью хронического гастрита и степенью тяжести АД, что явилось обоснованием к включению в план обследования больных АД на хеликобактериоз и лечебных мероприятий антихеликобактерной терапии. Клинически гастриты у большей части больных АД протекают бессимптомно.
Эрадикация хеликобактера приводит к разрешению заболевания почти у трети больных АД, к улучшению течения АД у остальных пациентов, и самое главное, удлинению периода ремиссии заболевания АД и перехода непрерывного течения заболевания к рецидивирующему.
Обязательным условием профилактики АД у больных хроническим гастритом, ассоциированным с НР, учитывая оральный путь инфицирования, является обследование на хеликобактериоз контактных лиц в семье и вне ее!
Защитная роль кишечника
Здоровье невозможно без нормального функционирования кишечника, которому принадлежит большая роль в детоксикации и иммунологических процессах, которые протекают в организме человека. Слизистая кишечника представляет собой место контакта организма с окружающей средой. Для сравнения: поверхность кожи составляет около 2 квадратных метров, площадь же слизистой оболочки желудочно-кишечного тракта – около 400 квадратных метров. Поэтому слизистую кишечника считают самой большой частью защитной системы организма.
Для надежной защиты от внешнего вмешательства в пищеварительном тракте важнейшим оказался микробиологический барьер.
- Защитная микрофлора кишечника наиболее многочисленная (95%) и представлена в основном бифидобактериями, лактобактериями и кишечной палочкой. Эти микроорганизмы выделяют молочную и уксусную кислоты и другие вещества, которые обладают антимикробным действием и препятствуют проникновению и закреплению на слизистой кишечника вредных микроорганизмов, которые не свойственны человеку. Они стимулируют иммунную систему организма человека, являются сорбентами, которые способны накапливать значительное количество тяжелых металлов и других токсических веществ.
- Сапрофитная микрофлора кишечника представлена стафилококками, энтерококками и другими микроорганизмами, основная роль которых — утилизация конечных продуктов обмена организма человека.
- Оппортунистическая микрофлора представлена различными микроорганизмами (стрептококки, золотистый стафилококк, грамотрицательные энтерококки, грибы рода кандид и др.), которые при определенных условиях вызывают патологический процесс.
Для человеческого организма исключительно важно поддержание требуемого состава и количества кишечных бактерий. Оптимальные условия могут быть нарушены вследствие неправильного питания, возбудителями диареи (бактерии и паразиты), дополнительными отрицательными факторами могут быть токсические вещества, поступающие из окружающей среды, например, тяжелые вещества – кадмий, свинец, ртуть, а также путешествия в другие страны с иными микроорганизмами. Отрицательным действием на флору обладают многие лекарственные средства и методы лечения, непереносимость продуктов питания, вредно одностороннее и несбалансированное питание, недостаточность пищеварительных ферментов.
Атопический дерматит и дисбактериоз
Многие кожные болезни, и в том числе Атопический дерматит, сопровождаются дисбактериозом, и при этом считается, что отягощающим фактором при АД является недостаточное количество лактобактерий. Именно лактобактерии в значительной степени снижают всасывание аллергенов в кишечнике и стимулируют образование иммуноглобулинов класса А, которые, особенно в раннем возрасте, являются основными антителами против пищевых аллергенов.
В настоящее время считают, что возникновение кожных заболеваний в определенной мере связано с нарушением микроэкологического баланса кишечника. У 80-95% больных атопическим дерматитом отмечается дисбактериоз кишечника, при этом наряду с дефицитом лактобактерий и бифидобактерий наблюдается избыточный рост золотистого стафилококка, кишечной палочки с измененными свойствами, грибов роста кандид, выделяющих токсины.
Эти нарушения требуют санации кишечника от вредных бактерий, проведения детоксикационной терапии (энтеросорбции) и создания условий для развития собственной микрофлоры пациента, регуляции работы кишечника (борьба с запорами). Энтеросорбция – неинвазивный метод детоксикации и направлена она на выведение из организма различных эндогенных и экзогенных аллергенов, токсинов, условно-патогенных микроорганизмов и продуктов их жизнедеятельности. Одним из самых эффективных сорбентов являются природные органические на основе пищевых волокон, таких как лигнин, который не усваивается в пищеварительной системе и обладает высокой сорбционной активностью.
Новое направление лечения АД представляет собой применение пребиотиков (лактулоза), полученных из естественных источников и выступающих в качестве питательной среды для развития своей собственной нормальной флоры кишечника. Сочетание сорбента и пребиотика представлено в препарате Лактофильтрум, который производится из компонентов природного происхождения в таблетированной форме, прост в употреблении — по 2 таблетки 3 раза в день в течение 3-4 недель.
В клинической практике выявлена корреляция между степенью выраженности дисбактериоза и проявлений АД. Кроме прямого влияния дисбактериоза на сенсибилизацию организма при АД, в настоящее время доказано опосредованное влияние на состав аутомикрофлоры кожи у больного АД.
Образование токсических веществ в кишечнике в дальнейшем действует не только на иммунную систему, но и нарушает детоксикационную функцию печени, образование и выделение желчи из печени, желчевыводящих путей и желчного пузыря.
Атопический дерматит и желчный пузырь
При обследовании больных, страдающих атопическим дерматитом, в 60% случаев определяется дискинезия желчевыводящих путей, у взрослых по гипотоническому типу, т.е. желчный пузырь плохо сокращается, и не выводятся токсические вещества из организма.
У 31% пациентов в желчном пузыре определяется густая желчь, с хлопьями или мягкими конкрементами (сладж желчи), что свидетельствует о нарушении качественного состава желчи, продуцируемой печенью. Таким образом, нарушается еще одна функция органов пищеварения, осуществляющая детоксикационную функцию организма.
При этом в комплекс лечения больных АД добавляются желчегонные препараты (желчегонные сборы трав, Хофитол, Гепабене, настой шиповника или Холосас, Холит и др.), а также назначаются препараты, улучшающие функцию печени и качество желчи, продуцируемой печенью (Урсофальк, Урсосан, Уролесан), препараты расторопши, гептрал, гепатосан и др., проводятся гуманные тюбажи желчного пузыря (с растительными маслами, медом, минеральной водой).
Клинический опыт показывает, что улучшение состояния микрофлоры кишечника, регуляция работы кишечника без запоров и улучшение работы печени и желчевыводящей системы и желчного пузыря способствует более эффективному лечению больных с атопическим дерматитом.
Питание при атопическом дерматите
Несколько слов о питании у больных АД. Питание для больных АД во многих случаях не играет настолько большой роли, как часто полагают. Существует огромное количество продуктов питания, для которых выявлена взаимосвязь с АД, но в конечном счете реальным фактором является только индивидуальная чувствительность. Существует целый спектр потенциально опасных продуктов, и каждый пациент должен составить индивидуальный рацион питания. Пациентам с АД необходимо соблюдать полноценное питание, избегать строгих диет, особенно в детском возрасте.
Продукты питания, которые могут оказывать негативное воздействие на Атопический дерматит:
- Острые, копченые продукты,
- пряности,
- алкоголь,
- овощи (перец, редис, квашеная капуста, сельдерей, помидоры),
- орехи,
- сладости (мед, сахар, сушеные фрукты, шоколад),
- крепкие мясные бульоны,
- маринады,
- кофе, какао,
- яйца, молоко,
- рыба,
- пищевые добавки, консерванты, пищевые красители.
Пациент и сам должен активно участвовать в процессе оздоровления своего организма. Особенно следует обратить внимание на такие важные мероприятия как:
- полноценное питание,
- отказ от сахара,
- употребление в пищу пищевых волокон (отруби, пектины, сложные углеводы),
- употребление кисломолочных продуктов, заквашенных лактобактериями, или препараты с лактобактериями,
- отказ от свинины.
Атопический дерматит — фитотерапия
Важное место в лечении и профилактике обострений играет фитодиетология. Она включает использование соков из клюквы, черной смородины, красной и черноплодной рябины, свекольный, сливовый, яблочный, черничный, тыквенный, капустный соки.
Лечение Атопического дерматита травяными сборами
Несколько прописей травяных сборов, применяемых при АД.
- Сбор 1. Трава череды 10.0, листья подорожника 10.0, листья крапивы 10.0, трава полыни 5.0, трава тысячелистника 5.0, трава зверобоя 15.0, трава хвоща 10.0, листья толокнянки 20.0. Смешать, приготовить настой из 1 чайной/столовой ложки (в зависимости от возраста). Принимать по 1/3 стакана 3 раза в день до еды, прием 1-2 месяца.
- Сбор 2. Трава трехцветной фиалки 20.0, корень девясила 10.0, трава зверобоя 15.0, трава хвоща 10.0, шишки хмеля 10.0, трава душицы 10.0, цветки ромашки 15.0, трава мяты перечной 5.0. Смешать. Доза и способ приготовления настоя. Принимать по 1/3 стакана 3 раза в день после еды в течение 1-2 месяцев.
- Атопический дерматит с сопутствующими запорами. К 1и 2 настою добавить слабительный сбор, настой плодов фенхеля (5.0:200.0), настой листьев подорожника (10.0:200.0), настой плодов тмина (5.09:200.0) или препараты лактулозы (Дюфалак, Нормаза, лактусан)
- Атопический дерматит при длительном течении процесса, особенно в зимне-весеннем периоде. Используются растительные лекарственные препараты с витаминными свойствами. Это настой листьев крапивы (15.0:200.), плодов шиповника (10.0:200.0), листьев черной смородины и ее плодов.
- Атопический дерматит с выраженными мокнутиями, отечностью и инфильтраций кожных покровов. Полезны настои плодов можжевельника (5.0:200.0), листьев почечного чая (3.5:200.0), травы хвоща полевого (10.0:200.0), мочегонного сбора.
- В целях улучшения показателей неспецифического иммунитета применяют настой цветков черной бузины (5.0:200.0), настой корня солодки (10.0:200.0), экстракт элеутерококка или настойку аралии по 2-3 капли (в зависимости от возраста ребенка) утром и вечером в течение 2 недель.
- Сбор для нормализации углеводного обмена. Настой листьев крапивы (10.0:200.0), отвар корня одуванчика (10.0:200.), настой листьев черники (10.0:200.0), отвар корня лопуха (5.0:200.0). Эти настои обладают противовоспалительным, противозудным свойством, оказывают нормализующее действие на желчевыводящие пути и поджелудочную железу.
Местное лечение Атопического дерматита
Примеры повязок на мокнущие поверхности:
- Повязка с настоем коры дуба: 2 столовые ложки дубовой коры разводятся в 500 мл воды и кипятятся в течение 15 минут, после чего настой процеживают, остужают, в него опускают ткань для компресса и неплотно накладывают на больное место. Достаточно применять такие компрессы 3-4 дня, но ежедневно нужно готовить свежий отвар.
- С этой же целью можно использовать отвар лапчатки (15г:200.0), настой травы зверобоя или тысячелистника (15г:200.0).
- Компресс из трехцветных фиалок: 2 чайные ложки сухих фиалок настаивают в чашке кипятка, получившийся настой сливают, остужают и используют для компрессов на пораженные места.
- Очень широко используются растворы соли, например ванны с солями Мертвого моря. При правильном комплексном лечении мучительный зуд исчезает быстро, но если он сохраняется, то втирание разведенного яблочного уксуса может в значительной степени облегчить зуд.
- После прекращения мокнутий применяются мази, кремы. Пример мази следующего состава: сок подорожника 15 мл, настойка ландыша 5 мл, настойка валерианы 5 мл, настойка календулы 5 мл, димедрол 1 г, паста цинковая 79 г. Смешать. Наносить на пораженные участки 2-3 раза в день тонким слоем после удаления ранее нанесенной мази растительным маслом.
Для очистки кожи не использовать мыло! Можно использовать масляно-молочную ванну: 1 столовая ложка оливкового масла и 200 мл молока добавляются в ванну.
Следует придерживаться правила: каждые 3-4 дня препараты наружной терапии следует менять между собой для предупреждения развития побочных эффектов.
Неэффективность традиционного лечения

В последние годы отмечается снижение эффективности лечения хеликобактерной инфекции, связанной с несколькими причинами:
- нечувствительность хеликобактера к антибиотикам,
- большое количество побочных эффектов на прием ИПП и антибиотиков,
- активное нежелание пациентов принимать антибиотики.
Стандарты лечения регламентируются международными и российскими соглашениями, в основе которых лежит курс лечения с назначением препаратов, снижающих кислотность желудочного сока (антисекреторные препараты – ИПП, например, Омез, Париет и др.), двух антибиотиков (например, Клацид и Амоксициллин).
Лечение хеликобактерной инфекции в любой возрастной категории сопровождается большим количеством побочных, нежелательных реакций на применяемые препараты и то, что их применение не исключает повторения инфекции или повторного заражения препараты-ИПП).
Почему при лечении хеликобактера отказываются от антибиотиков
Наличие хеликобактера — не всегда хроническая инфекция.
Нечувствительность хеликобактера к антибиотикам приводит к уменьшению эффективности лечения – отмечено снижение эффективности с 80-90% до 30-60%, что является характерным для многих стран, для различных регионов в России.
Сегодня стоит еще раз напомнить о побочных эффектах применения антисекреторных препаратов и антибиотиков.
Так, при приеме антисекреторных препаратов (ИПП) нарушаются процессы переваривания пищи и всасывания кальция, железа, цинка, лекарственных препаратов при приеме внутрь. При длительном применении ИПП существует риск развития инфекций желудочно-кишечного тракта и легких, т. к. в желудок попадают микроорганизмы из ротовой полости, носоглотки, кишечника. Если они не инактивируются в условиях сниженной желудочной секреции, то некоторые из них могут вырабатывать вещества (канцерогены), которые могут вызывать онкологические заболевания. Длительный прием препаратов, снижающих желудочную секрецию, может привести к
- поносам, вызванным микроорганизмом клостридией,
- грибковому поражению желудочно-кишечного тракта,
- воспалению легких,
- перелому шейки бедра.
Применение антибиотиков в лечении различных заболеваний и, в том числе, хеликобактериозе, несколько ограничено при наличии заболеваний печени, почек, нарушений микрофлоры кишечника, аллергии на антибиотики
Лечение антибиотиками может привести к развитию антибиотико-ассоциированного поноса, ухудшению пищеварения, вызвать дисепсические жалобы – тошноту, рвоту, изменение вкуса, нередко головную боль. Особенно это характерно для пожилых людей. Кроме того, могут развиваться аллергические реакции, вплоть до формирования поливалентной аллергии. Эти побочные эффекты, знакомые нашим пациентам, заставляют многих отказаться от приема антибиотиков из-за риска их развития.
К сожалению, официальные стандарты-IV Маастрихтского соглашения продолжают рекомендовать применение этих схем, однако…
Лечение хеликобактер пилори по-новому
В последние годы официальные стандарты-IV Маастрихтского соглашения пополнились применением препаратов висмута (Денол), пробиотиком Saccharomyces boulardii (препарат Энтерол) – тропического штамма дрожжевых грибов, выделенных из сока личи и манго.
Наиболее перспективным направлением оптимизации лечения хеликобактериоза желудка являлось использование пробиотиков, в первую очередь, лактобацилл в виде монотерапии. Исследования, проведенные российскими, зарубежными учеными и собственные данные подтверждают эффективность пробиотиков для эрадикации хеликобактер пилори. Опыт показал, что применение молочно-кислых бактерий, лактобацилл ацидофилюс, сочетание нескольких штаммов лактобацилл (Трилакт), позволило получить достаточно высокий процент положительных результатов, (39 — 54%) у детей и взрослых. При таком подходе к лечению встает вопрос, какой пробиотик выбрать, при каких заболеваниях желудка и других ситуациях применить, в каком возрасте, какова продолжительность курса.
Как выбрать пробиотик для лечения хеликобактера
Важным условием применения пробиотика является кислотоустойчивость штамма живых микроорганизмов, которая доказана в отношении группы лактобацилл (L.rbamnosus, L.reuteri, L.plantarum, L.acidophilus, способных оказывать прямое действие на хеликобактер пилори. Эти штаммы лактобацилл вырабатывают вещества (метаболиты), которые подавляют рост, обладают антибактериальным действием, снижают активность ферментов хеликобактерий и других микроорганизмов, уменьшают воспаление слизистой оболочки желудка.
Кому показано лечение пробиотиками
Лечение хеликобактерной инфекции с применением только пробиотиков показано:
- лицам, у кого в анамнезе аллергия к антибиотикам,
- при категорическом отказе пациента от приема антибиотиков,
- лицам при выявленном хеликобактериозе без клинических проявлений и жалоб,
- членам семьи пациентов, инфицированных хеликобактером,
- пациентам с хроническим гастродуоденитом, язвенной болезнью вне обострения,
- пожилым людям,
- детям,
- лицам, имеющим поражения печени и почек.
Дальнейшие исследования показали, что положительно действуют не только пробиотики на основе живых микроорганизмов, но и продукты их метаболизма (обмена). На основе этого открытия был разработан в 2014 году в России новый препарат с уникальным антихеликобактерным действием.
Хелинорм – инновационное антихеликобактерное средство из группы метаболиков
Принцип действия

Хелинорм содержит в своем составе субстанцию Pylopass – специфический штамм Лактобациллы реутери, обладающий уникальной способностью специфически связываться с клетками хеликобактера, не влияя на нормальную флору.
Связывание снижает подвижность хеликобактерий — бактерии перестают связываться со слизистой оболочкой желудка и вымываются из желудка, что приводит к уменьшению бактерий в слизистой оболочке и снижают риск развития гастрита, язвенной болезни.
Хелинорм – разумная альтернатива антибиотикотерапии при хеликобактериозе.
Схема лечения
Курс лечения Хелинормом составляет 4 недели, по 1 капсуле во время еды 1 раз в день.

Курс пробиотиков занимает месяц, например, жидкий пробиотик Трилакт для взрослых 5 мл утром натощак, детям по возрасту, и далее короткими курсами по разработанной много лет назад методике — прием пробиотика по 10 дней каждого месяца, с контролем анализов на хеликобактерную инфекцию и дисбактериоз кишечника.
С профилактической целью в дальнейшем возможно использовать закваски Эвиталия или Нарине, которые позволяют готовить лечебный кисломолочный продукт в домашних условиях, в котором оптимальное сочетание и живых бактерий – лактобацилл, и продуктов их жизнедеятельности. Использовать его в натуральном виде, с добавлением растительных компонентов (овощи, фрукты, отруби), заправлять им разнообразные салаты.
Многочисленные исследования последних десятилетий показали, что Helicobacter pylori (НР), признаваемый большинством исследователей в качестве этиологического фактора развития хронического гастрита, язвенной болезни и ассоциированной с лимфоидной тканью о
Многочисленные исследования последних десятилетий показали, что Helicobacter pylori (НР), признаваемый большинством исследователей в качестве этиологического фактора развития хронического гастрита, язвенной болезни и ассоциированной с лимфоидной тканью опухоли MALTомы, может быть причиной заболеваний практически всех органов и систем. В последние годы пристально изучается роль НР в развитии ишемической болезни сердца, атеросклеротического поражения сосудов мозга, ряда аутоиммунных заболеваний, а также аллергических состояний.
Воздействие НР на макроорганизм может быть обусловлено различными механизмами. НР вызывает прямое повреждение слизистой оболочки желудочно-кишечного тракта, в результате которого повышается проницаемость его стенок для крупных молекул с развитием как истинной аллергии, так и псевдоаллергии. Изменение функции эпителия ведет к нарушению процессов переваривания и всасывания с изменением состава желудочного и кишечного содержимого, в том числе кишечной микрофлоры. Эти процессы усугубляют дисфункцию органов пищеварения, также способствуя развитию аллергии. Кроме того, возможна модификация поверхностных антигенов эпителиоцитов с последующей аутоиммунной реакцией. Показана определенная связь НР-инфицирования с развитием аутоиммунных процессов не только в желудочно-кишечном тракте, но и в других системах организма: сахарного диабета 1 типа, аутоиммунного тиреоидита, болезни Сьегрена, тромбоцитопенической пурпуры, аутоиммунных нефропатии и полинейропатии. Даже атеросклероз и ишемическая болезнь сердца могут рассматриваться как аутоиммунный процесс, индуцированный НР.
Чем более выражены факторы вирулентности НР, тем в большей степени вероятно развитие аллергического процесса у инфицированного больного. В то же время аллергические состояния, не связанные с НР, часто характеризуются повышенной проницаемостью кишечной стенки и снижением защитных механизмов, в том числе снижением уровня секреторного IgA. Последнее обстоятельство предрасполагает к инфицированию и колонизации НР в желудочно-кишечном тракте. Слизистая оболочка ЖКТ является барьером для алиментарных антигенов, и воспалительный процесс в желудочно-кишечном тракте любого происхождения может нарушать его целостность, повышать проницаемость слизистой оболочки и увеличивать прохождение через нее пищевых антигенов. Таким образом, НР-инфекция и аллергия представляют собой тесно связанные процессы.
В ряде исследований было показано, что воспалительный процесс в желудочно-кишечном тракте, связанный с НР, может быть причиной возникновения хронической крапивницы [1, 2, 3, 4, 5], которая, по разным данным,в 47% случаев сочетается с НР-инфекцией, в 50% — с выявлением антител к высокоафинному рецептору IgE, в 12–20% — с антитиреоидными антителами. Liutu M. и соавт. у 40 из 107 детей с хронической крапивницей выявили антитела класса IgG к НР. При этом активный гастрит был подтвержден у 30 из 32 НР-позитивных пациентов, а повышенный уровень IgE определялся у 64% НР-позитивных и у 39% НР-негативных пациентов [6]. Сочетание хронической крапивницы с аутоиммунным тиреоидитом достоверно ассоциируется с инфицированием CagA(+)-штаммами НР, но не CagA(-)-штаммами [7]. Эрадикация НР не приводит к полному излечению, но снижает тяжесть процесса и уменьшает потребность в антигистаминных препаратах, что, однако, может быть связано с излечением хеликобактерного гастрита [8].
Описана связь НР с развитием ангионевротического отека у детей, в основе которого лежат изменения в системе комплемента. Эрадикация НР приводит как к купированию клинических проявлений, так и к восстановлению иммунологических показателей [9].
У детей с атопическим дерматитом и пищевой аллергией очень часто встречаются антихеликобактерные антитела [10, 11, 12]. Показано также повышение эффективности лечения атопического дерматита при одновременной эрадикации НР [13].
Нами изучалась связь пищевой аллергии с язвенной болезнью двенадцатиперстной кишки (ЯДК) у 63 детей в возрасте 5–16 лет (средний возраст — 12,6±0,13 лет), а также у детей с хроническим гастродуоденитом. Мы дифференцировали явную и скрытую аллергию без клинических проявлений, но с повышением уровня IgE в крови, а также истинную и псевдоаллергию. Было установлено, что суммарная доля пациентов с явной истинной аллергией, со скрытой аллергизацией и с псевдоаллергическими реакциями среди детей с ЯДК в активной стадии заболевания достигает 71%, а при хроническом гастродуодените — 35%. Клинически аллергические проявления аллергии наблюдались у 23% детей с ЯДК в активной стадии и 14% — в стадии ремиссии. У большинства детей аллергия была вызвана пищевыми антигенами. Скрытая аллергия на фоне активной стадии язвенной болезни имела место у 48% больных, в период ремиссии — у 22%, псевдоаллергические реакции наблюдались у 14% детей в активной стадии и 8% — в стадии ремиссии (рис. 1). При этом для детей с ЯДК и пищевой аллергией характерна большая длительность болевого синдрома на фоне проводимого лечения, по сравнению с больными без пищевой аллергии.
Изучение кислотно-пептического фактора показало, что повышение его активности способствует развитию аллергических и, в большей степени, псевдоаллергических реакций, за счет прямого воздействия на слизистую оболочку желудочно-кишечного тракта. Важно также, что для инфицированных НР больных с пищевой аллергией характерны относительно более низкие значения антихеликобактерных IgA-антител в крови по сравнению с пациентами без пищевой аллергии, что говорит об относительном снижении барьерной функции слизистой оболочки желудочно-кишечного тракта у этих детей.
Связь НР и пищевой аллергии при ЯДК может быть представлена схематично (рис. 2 ). Как уже указывалось, пищевая аллергия характеризуется селективным снижением выработки антихеликобактерных IgA-антител, но значительным повышением в крови антихеликобактерных IgG-антител, что указывает на снижение барьерной функции слизистой оболочки желудочно-кишечного тракта, что само по себе провоцирует развитие аллергии. Воспалительный процесс на слизистой оболочке желудка и тонкой кишки (гастрит, дуоденит), индуцированный НР, способствует протеканию как аллергических, так и псевдоаллергических процессов за счет еще большего повышения проницаемости слизистой оболочки. Воспалительный процесс может быть связан как с прямым действием НР на слизистую оболочку желудка и, в меньшей степени, двенадцатиперстной кишки, так и возникать опосредованно, в результате повышения активности кислотно-пептического фактора. Последний механизм реализуется отчасти через активацию гастрин-продуцирующих клеток и повышение кислой секреции, а также секреции пепсиногена.
У многих инфицированных НР лиц отмечается положительный тест на специфические IgE. НР может индуцировать IgE-опосредованный выход гистамина из человеческих базофилов in vitro. Тучные клетки слизистой оболочки участвуют в пищевой аллергии. Ранее было показано, в частности, что у НР-позитивных больных ЯДК количество Ecl-клеток, продуцирующих гистамин, в 3 раза превышает таковое у НР-позитивных лиц без дуоденальной язвы. Уровень гастрина в крови и гистамина в слизистой оболочке желудка при ЯДК выше по сравнению с контрольной группой, тогда как у НР-позитивных лиц без дуоденальной язвы имеют место промежуточные значения. Наблюдения говорят о возможном гистамин-опосредованном действии НР [14].
В работе N. Figura et al. [15] исследовалось, в каких случаях НР-инфекция ассоциируется с пищевой аллергией у взрослых пациентов. Автор показал, что CagA-позитивные пациенты с пищевой аллергией достоверно преобладают по сравнению с инфицированными пациентами без аллергии (р = 0,030, Mantel-Haenszel test). Поскольку штаммы НР, экспрессирующие CagA, обладают более высоким провоспалительным потенциалом, правомерно сделать вывод, что выраженное воспалительное поражение слизистой оболочки желудка способно повышать трансэпителиальную проницаемость и способствовать неселективному пассажу аллергенов, которая у атопиков может прямо стимулировать IgE-опосредованный ответ. При этом CagA-положительная НР-инфекция способствует пищевой аллергии. Таким образом, с одной стороны, на фоне ЯДК или хронического гастродуоденита возможно обострение скрытой аллергии. С другой стороны, пищевая аллергия провоцирует развитие гастрита, дуоденита и поддерживает уже имеющийся процесс. В итоге замыкается порочный патогенетический круг.
На основании полученных данных можно утверждать, что у больных с ЯДК пищевая аллергия встречается достаточно часто и ее развитие непосредственно связано с НР-инфицированием. При этом истинно аллергический процесс регулируется существенно реже псевдоаллергического. ЯДК усугубляет течение пищевой аллергии, а успешное лечение язвенного процесса способствует снижению активности процесса аллергического. Хотя противоаллергическая терапия и не влияет на сроки заживления язвенного дефекта, однако она способствует улучшению самочувствия больного, уменьшая болевую симптоматику.
Исходя из этого, для лечения больных ЯДК в сочетании с ПА патогенетически обосновано проведение адекватной терапии язвенного процесса, включая, при необходимости, антихеликобактерную и антисекреторную терапию, в сочетании с противоаллергическими мероприятиями.
Таким образом, в настоящее время накоплены данные, указывающие на то, что инфицирование НР способствует развитию аллергии и псевдоаллергии как за счет прямого действия на слизистую оболочку, так и опосредованно, через активацию других патогенных факторов. Эрадикация НР способствует излечению больного, что следует учитывать при составлении плана диагностических и терапевтических мероприятий, включая тесты на НР-инфекцию, и назначении адекватных антихеликобактерных средств.
По вопросам литературы обращайтесь в редакцию.
С. В. Бельмер, доктор медицинских наук, профессор
Т. В. Гасилина, кандидат медицинских наук
М. Аль Хатиб, кандидат медицинских наук
РГМУ, Москва
Читайте также:

