Хилак форте бифидумбактерин при молочнице
Обновлено: 24.04.2024
Дисбактериоз у детей. Лактобактерин и бифидумбактерин - стоит ли мучить ребенка?
То, что в некоторых органах человека уже с момента рождения обитают различные виды бактерий, известно давно и никого не удивляет. Стерильными в норме остаются мочевой пузырь, легкие, внутреннее и среднее ухо и некоторые другие органы. Особенно много бактерий живет в кишечнике, и без них нормальный процесс пищеварения был бы полностью невозможен. Эти микроскопические помощники осуществляют огромную работу, они частично переваривают компоненты пищи, делая их пригодными для расщепления пищеварительными соками и дальнейшего всасывания. Удивительно, но общая масса нормальных бактерий, обитающих в организме взрослого человека, составляет почти целый килограмм!
Дисбактериоз - это существенное снижение числа необходимых бактерий в целом, либо преобладание одних видов микроорганизмов над другими, что плохо сказывается на работе и состоянии кишечника.
Бифидумбактерин и лактобактерин в лечении дисбактериоза
Устранение дисбактериоза производится сразу по нескольким "фронтам". Для начала устанавливается первопричина нарушения нормальной микрофлоры. Также производится симптоматическое лечение, снимаются болевые ощущения, решается вопрос с запорами или поносами и многое другое. Но одним из важнейших этапов является восстановление нормальной микрофлоры - численности и видов бактерий.
Их привносят в кишечник с капсулами, в которых содержатся высушенные, но жизнеспособные микроорганизмы. С этой целью новорожденным и грудным детям дают бифидумбактерин и лактобактерин - препараты, содержащие различные виды "нужных" бактерий. Прием этих препаратов осуществляется по своим правилам, которые повышают эффективность их воздействия. Если лекарства назначаются для предотвращения развития дисбактериоза в период лечения антибиотиками, то важно учитывать какие именно антибиотики получает ребенок, ведь многие из них губительны для бактерий, содержащихся в бифидумбактерине и лактобактерине. Таким образом, зачастую их просто нет смысла принимать одновременно с антибиотиками, и приходится ждать окончания антибактериальной терапии.
Очень важно правильно определиться с дозировкой в каждой конкретной ситуации, так как ряд исследований показал, что в случае превышения дозы подобных препаратов возникает немало побочных эффектов. Среди них отмечаются нарушение работы иммунитета, лихорадка, плохая реакция со стороны печени, воспаления суставов.
Механизм действия этих двух препаратов (и подобных им), содержащих сами бактерии, заключается, по мнению специалистов, в том, что микроорганизмы, попадая в кишечник, начинают там работать на благо организма и активно размножаться, восстанавливая таким образом баланс. Однако все оказалось не так просто. Некоторые исследования позволили абсолютно иначе посмотреть на эти лекарства и придумать нечто более эффективное. Выяснилось, что бактерии бифидумбактерина и лактобактерина плохо выдерживают кислые условия желудочного сока, а затем пищеварительные соки кишечника. Большинство из них в скором времени погибает, оставив после себя продукты жизнедеятельности. Последний факт особенно привлек внимание ученых, и они выяснили, что вещества, выделяемые бактериями, прекрасно способствуют восстановлению нормальной микрофлоры! Так появился новый препарат Хилак форте.

Хилак форте как более эффективное лечение дисбактериоза
В чем особенность этого препарата? Ключевое отличие заключается в том, что в его состав входят не жизнеспособные бактерии, а субстрат продуктов обмена наших нормальных бактерий. Благодаря этому решается сразу множество проблем. Облегчается вопрос с определением дозировки, и решается проблема передозировки.
Кроме того, препарат работает более эффективно, ведь продукты обмена бактерий не погибают в кислой среде, в отличие от самих бактерий. Хилак форте нормализует кислотность желудочно-кишечного тракта за счет молочной кислоты, входящей в его состав. Автоматически улучшается и среда обитания нормальной микрофлоры, и ее баланс восстанавливается, а болезнетворные микробы наоборот погибают, не выдерживая новых условий жизни.

Этот препарат действует на биологическом уровне, а это значит, что не нарушаются функции кишечника и его слизистый слой, также очень значимый для поддержания нормального бактериального фона. Более того, Хилак форте способствует уменьшению воспаления слизистой оболочки кишечника и заживлению его повреждений.
Поскольку препарат не содержит бактерий, чувствительных к антибиотикам, его можно с успехом применять прямо во время антибактериальной терапии.
Все это находит отражение в анализах маленьких пациентов. Нормализуются показатели анализа кала, вес приходит в норму, так как усваивается нужное количество питательных веществ, восстанавливается должный уровень гемоглобина, поскольку улучшается всасывание витаминов и микроэлементов, проходят запоры и поносы за счет восстановления адекватной моторики. И все это происходит в более короткие сроки, чем при приеме препаратов, описанных ранее. Побочные эффекты в виде зуда кожи, запоров и поносов наблюдаются крайне редко.
Перечисленные преимущества Хилака форте делают его наиболее безопасным и эффективным лекарством для устранения дисбактериоза у маленьких детей. Специалисты разрешают его прием даже грудным малышам, при этом им назначают по 15-20 капель 3 раза в день, предварительно их нужно растворить в небольшом количестве жидкости. Детям старшего возраста рекомендуют принимать уже по 20-40 капель 3 раза в день. Курс лечения во многом зависит от состояния микрофлоры. Но как только появляется улучшение самочувствия, дозу можно уменьшить наполовину. В среднем 2-4 недель бывает достаточно для нормализации микробного баланса. Капли нельзя растворять в молоке, нужно принимать лекарство до или во время еды. Также важно знать, что прием лекарств, снижающих кислотность желудочно-кишечного тракта (антацидов), может в разной степени нейтрализовать действие Хилака форте.
- Вернуться в оглавление раздела "Профилактика заболеваний"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Ключевые слова: кандидозный вульвовагинит, микробиоценоз влагалища, лактобактерии.
Combination of antifungal agent and prebiotic for acute vulvovaginal candidiasis
P.N. Krotin, O.V. Kirilenko
City Consultative Diagnostic Center “Juventa”, St. Petersburg, Russian Federation
Aim: To assess efficacy and safety of Ecofucin ® vaginal suppositories based on the time to clinical and microbiological remission in women with acute vaginal or vulvovaginal candidiasis.
Patients and Methods: The study enrolled women aged 18–45 with acute vaginal or vulvovaginal candidiasis. All patients were subdivided into 2 groups. Study group included 36 patients who received Ecofucin ® vaginal suppositories (natamycin 100 mg plus lactulose 300 mg) once a day for 6 days. Control group included 36 patients who received Pimafucin ® vaginal suppositories (natamycin 100 mg) once a day for 6 days. Efficacy and safety of medications were assessed by gynecological examination, laboratory tests, and patient diaries. Follow-up examinations were performed at days 4, 7, and 37 (±2 days) after treatment begins (30±2 days after treatment finishes).
Results: Combination of antifungal medication (natamycin) and prebiotic in a vaginal suppository provides more rapid clinical remission and complete elimination of VVC causative agent thus resulting in active growth of lactobacilli, principal competitors of yeasts in vaginal microbiocoenosis.
Conclusions: Good tolerability of Ecofucin ® was demonstrated, no adverse reactions were reported.
Keywords: vulvovaginal candidiasis, vaginal microbiocoenosis, lactobacilli.
For citation: Krotin P.N., Kirilenko O.V. Combination of antifungal agent and prebiotic for acute vulvovaginal candidiasis. Russian Journal of Woman and Child Health. 2019;2(2):120–125.
Статья посвящена оценки эффективности комбинации противогрибкового препарата и пребиотика в терапии острого кандидозного вульвовагинита.
Материал и методы
Результаты и обсуждение
В ходе исследования были отобраны и рандомизированы 72 пациентки, у которых обнаруживались дрожжеподобные грибы и почкующийся мицелий. При этом у 71 пациентки в бактериологических посевах образцов обнаружены Candida albicans и только у одной — Candida glabrata. Пациентки были разделены на 2 группы: основная группа — 36 человек — получала интравагинально Экофуцин ® (натамицин 100 мг с лактулозой 300 мг); контрольная группа — 36 пациенток — получала свечи Пимафуцин ® (натамицин 100 мг).
Поскольку одним из важных параметров эффективности лечения КВВ является срок наступления клинической ремиссии, первоначально была проведена оценка частоты жалоб в группах на 4, 7 и 37-й день наблюдения, результаты представлены в таблице 1.
Стоит заметить, что до начала терапии достоверных различий среди пациенток в группах по частоте встречаемости жалоб не отмечено. При этом уже через 4 дня после начала терапии исследуемыми препаратами в обеих группах у пациенток наблюдалось значимое уменьшение практически всех жалоб в сравнении с их частотой до начала терапии. В то же время не отмечено различий в частоте жалоб между группами на 4, 7 и 37-й день от начала терапии, что указывает на схожую эффективность обоих исследуемых препаратов. По всей видимости, это связано с наличием в их составе одинаковых дозировок натамицина. Как известно из данных литературы, натамицин проявляет высокую противогрибковую активность в отношении Candida albicans и Candida glabrata, которые были обнаружены у пациенток [20]. Действие натамицина привело к снижению численности грибов Candida во влагалище, что отразилось в уменьшении воспаления слизистой и соответственно уменьшении жалоб пациенток. Положительный эффект натамицина подтвержден результатами клинического осмотра. Результаты исследования представлены в таблице 2. Значение уровня значимости (p) оценивали при сравнении двух групп по двустороннему критерию Фишера.
Как видно из результатов, представленных в таблице 2, уже на 4-е сут от начала терапии наблюдалась высокая эффективность Экофуцина и Пимафуцина, которая выражалась в исчезновении клинических проявлений КВВ у 75 и 64% пациенток соответственно. Обращает также на себя внимание бóльшая эффективность препарата Экофуцин ® по сравнению с Пимафуцином на 7-е сут после начала терапии, поскольку в группе Экофуцина пациенток без клинических проявлений КВВ было на 25% достоверно больше, чем в группе Пимафуцина (p=0,022). По всей видимости, превосходство препарата Экофуцин ® над Пимафуцином на 7-е сут после начала терапии связано с тем, что лактулозе, содержащейся в составе препарата Экофуцин ® , для восстановления естественной микрофлоры влагалища 4 сут недостаточно, чтобы препарат мог проявить более выраженные лечебные свойства у большинства пациенток [19]. Вероятно, за 7 сут лактулоза более эффективно повлияла на восстановление микрофлоры и подавление роста болезнетворных грибов у большинства пациенток, что отразилось в преобладающем числе пациенток без клинических признаков КВВ в группе Экофуцина. На 37-е сут от начала терапии такой разницы между группами уже не наблюдали. Вероятно, это было связано с одновременным прекращением действия натамицина в обеих группах после его отмены на 7-й день от начала лечения, что подтверждает его основную роль в лечении КВВ. Такое предположение согласуется с данными других исследований, в которых изучалась частота наступления микробиологической ремиссии (табл. 3). Значение уровня значимости (p) оценивали при сравнении обеих групп по двустороннему критерию χ 2 Пирсона.
Как следует из таблицы 3, уже на 4-е сут от начала терапии наблюдалась высокая частота микробиологической ремиссии у пациенток, получавших Экофуцин ® и Пимафуцин ® , что выражалось в исчезновении возбудителя у 75 и 72% пациенток соответственно. При этом значимых отличий между группами по частоте элиминации Candida albicans не выявлено, что, по всей видимости, свидетельствует об отсутствии прямой противогрибковой активности лактулозы. Полученные результаты соответствуют данным других исследователей, которые оценивали эффективность интравагинально применяемого натамицина в схожей дозировке [20]. В целом в клинической практике лечения КВВ установленная в исследовании эффективность препаратов, содержащих натамицин, оценивается как высокая [20, 21].
При исследовании усредненного срока наступления клинической ремиссии в группах, получавших Экофуцин ® и Пимафуцин ® , наблюдается более выраженная эффективность Экофуцина (рис. 1).
В группе, получавшей Экофуцин ® , клиническая ремиссия наступала на 0,7 сут раньше, чем в группе Пимафуцина. Такая разница в скорости наступления ремиссии, вероятнее всего, связана с процессом восстановления микрофлоры влагалища за счет действия лактулозы в составе Экофуцина. Известно, что лактулоза способна стимулировать рост различных пробиотических бактерий, например тех, которые играют приоритетную роль в микробиоценозе влагалища и обеспечивают защиту от различных патогенов [19].
Содержание лактобактерий в мазках пациенток обеих групп показало существенное увеличение численности Lactobacillus spp. в группе, получавшей Экофуцин ® (рис. 2).
Как видно из рисунка 2, уровни Lactobacillus spp. у пациенток до начала терапии в обеих группах значимо не различались между собой. Тем не менее на 37-е сут после начала лечения в группе, получавшей Экофуцин ® , наблюдали достоверное увеличение числа Lactobacillus spp. практически в 100 раз по сравнению с группой пациенток, получавших Пимафуцин ® . Такое увеличение числа Lactobacillus spp., вероятно, связано с прямым действием лактулозы, которая, как известно, является предпочтительным субстратом для этих бактерий и усиливает их рост [19]. Также можно отметить тенденцию к увеличению числа Lactobacillus spp. в группе Пимафуцина, сопряженную, скорее всего, с естественным восстановлением микрофлоры, что подтверждается исследованиями других авторов [21]. Учитывая, что к 37-му дню после начала терапии лактулоза не поступала во влагалище пациенток вместе с препаратом более 30 дней, можно судить о стойком и длительном эффекте лактулозы. Уровни Lactobacillus spp., которые были выявлены в ходе исследования, не являются достаточными и соответствующими нормальному составу микрофлоры влагалища. Так, считается, что в норме содержание лактобактерий должно быть не менее 10 9 КОЕ/мл, т. е. в 1000–10000 раз больше, чем наблюдали в данном исследовании (в пересчете с количества КОЕ в мазке). По всей видимости, недостаточно высокий уровень лактобактерий во влагалище после терапии, который не может обеспечить надлежащую защиту от патогенов, может оказаться причиной развития рецидивов КВВ, обычно возникающих в 10% случаев [1]. Учитывая полученный в ходе данного исследования опыт интравагинального применения препарата Экофуцин ® , можно предположить, что местное применение препаратов, содержащих лактулозу, сразу после терапии КВВ противогрибковыми средствами, такими как натамицин, в течение дополнительных 7 дней позволит более существенно восстановить нормальную микрофлору влагалища и обеспечить значимое снижение риска развития рецидивов КВВ. Применение лактулозы с натамицином при КВВ также перспективно, поскольку дает более высокую эффективность и способствует более интенсивному восстановлению микрофлоры влагалища уже на этапе лечения.
Обращает на себя внимание хорошая переносимость препарата Экофуцин ® пациентками в течение всего курса терапии КВВ. В результате исследования не было отмечено ни одного случая нежелательных реакций на данный препарат, а также каких-либо местных или общих отклонений в здоровье пациенток, которые могли бы быть связаны с его использованием.
Заключение
Для цитирования: Бурова С.А. Комплексный подход к терапии больных с кандидозом органов пищеварительного тракта. РМЖ. 2015;13:760.
Грибы Candida – условно-патогенные микроорганизмы, заселяют пищеварительный тракт в норме, участвуют в процессе брожения, переваривания пищи и др. Этот феномен, называемый колонизацией, клинически протекает бессимптомно. Исследование взрослых здоровых добровольцев показало, что Candida albicans присутствует у них в орофарингеальной зоне в 20–30%, в тонком кишечнике – в 50–54%, в толстом кишечнике – в 55–70%, в фекалиях – в 65–70% случаев.
Итак, при физиологическом благополучии между макро- и микроорганизмами существует определенное равновесие, в котором играют роль, с одной стороны, факторы устойчивости организма к микроскопическим грибам, с другой – факторы патогенности грибов. Устойчивость организма зависит от принадлежности к группам риска и компетентности его иммунной системы. Для защиты важен также макрофагальный и нейтрофильный фагоцитоз, препятствующий диссеминации грибковой, особенно кандидозной инфекции.
По мнению большинства исследователей, бессимптомное пребывание грибов в желудочно-кишечном тракте (ЖКТ) может прекратиться, когда они приобретают патогенные свойства, а у пациента обнаруживается несостоятельность иммунной системы.
Наиболее частыми микозами пищеварительного тракта являются кандидоз пищевода и кандидоз кишечника, которые встречаются как у иммунокомпетентных, так и (гораздо чаще) у иммуносупрессированных лиц. Первичные микозы желудка, в т. ч. и кандидоз, диагностируют редко, что связано с физиологической кислотной средой желудка, где грибковые клетки погибают.
Факторами риска развития кандидоза пищевода и кишечника являются:
1. Заболевания ЖКТ:
- заболевания слизистых оболочек полости рта;
- гастроэзофагеальная рефлюксная болезнь;
- обсемененность желудка Helicobacter pylori;
- атрофический гастрит, гипоацидность желудка, ахалазия, бульбит;
- эрозивно-язвенные заболевания пищевода и кишечника;
- микст-инфекция кишки, дисбиоз;
- дивертикулез, полипоз;
- энтероколит, болезнь Крона, синдром раздраженного кишечника и др.
2. Другие заболевания:
- онкологические;
- гематологические;
- эндокринологические;
- аллергические;
- СПИД и ВИЧ-инфицированность.
3. Травмирование слизистой оболочки ЖКТ:
- пищеводно-желудочным зондом;
- ожоги пищевода;
- оперативные вмешательства.
4. Прием лекарственных препаратов:
- антибиотиков;
- цитостатиков;
- гормонов и других химиопрепаратов.
Нарушение питания, голодание, алкоголизм, курение, наркомания способствуют развитию кандидоза. К факторам риска относится также пожилой возраст, когда происходит старение иммунной системы, присоединяются многочисленные соматические заболевания, уменьшаются амплитуда продольных сокращений пищевода и сила сокращений сфинктеров, нарушаются процессы всасывания и т. д.
Клинически кандидоз пищеварительного тракта подразделяется на:
- орофарингеальный кандидоз (псевдомембранозный, атрофический, эритроматозный, ромбовидный глоссит, ангулярный хейлит);
- кандидозный эзофагит (эрозивный и без эрозий);
- кандидоз желудка (эрозивно-фибринозный и вторичный на фоне язвенной болезни);
- кандидоз кишечника (псевдомембранозный, коллагеновый, лимфоцитарный);
- кандидозный проктосигмоидит;
- перианальный кандидоз;
- секреторную диарею, ассоциированную с кандидозом.
Кандидозный эзофагит в стационарах общего профиля встречается у 1,3–2,8% больных, в отделениях трансплантации – до 4%, при диссеминированном карциноматозе – от 2,8 до 6,7%. Это заболевание протекает часто без субъективных жалоб и выявляется случайно при исследованиях населения в 1–7% случаев. Иногда больные отмечают боль и дискомфорт при прохождении твердой и жидкой пищи, дисфагию, гиперсаливацию. По глубине поражения эндоскопически выделяют 4 типа: от легкого отека, гиперемии, единичных белых налетов
Кандидоз желудка, как правило, развивается вторично на фоне язвенной и гастроэзофагеальной рефлюксной болезни. Ахлоргидрия в свою очередь способствует колонизации грибов на слизистой с последующей инвазией, особенно в зонах дефекта (язвы, эрозии), что замедляет репарацию (заживление), появляется болевой синдром, иногда кровоточивость язвы.
В большинстве случаев грибковые поражения ЖКТ сопровождаются изменением микробиоценоза и снижением колонизационной резистентности организма. Для лечения кандидоза ЖКТ применяют самые разнообразные антимикотики как системного, так и местного действия. Также одной из задач терапии является создание условий для роста и функционирования нормальной микрофлоры.
В современной научной литературе препараты для коррекции дисбиозов делят на 3 основные группы: пробиотики – содержат жизнеспособные микроорганизмы; пребиотики – содержат стимуляторы роста микрофлоры; синбиотики – содержат живые микроорганизмы и пребиотики. Существуют пробиотические комплексы, представляющие собой комбинацию из перечисленных выше компонентов, а также сорбентов, витаминов и микроэлементов. Средств коррекции нарушений микрофлоры кишечника достаточно много, постоянно появляются новые варианты и разновидности.
В состав комплекса Бактистатин включены дополняющие друг друга природные компоненты: сорбент, пробиотик, пребиотик. Одним из преимуществ комплекса Бактистатин является отсутствие живых бактерий, чужеродных для ЖКТ человека, длительное присутствие которых в больших количествах нежелательно. Вместо живых бактерий в состав комплекса Бактистатин включены продукты их жизнедеятельности – активные метаболиты. Поэтому Бактистатин начинает работать сразу, и его действие направлено на восстановление собственной нормальной микрофлоры, которая уникальна у каждого человека.
Нами проведено исследование по оценке эффективности и безопасности пробиотического комплекса Бактистатин в схемах терапии больных с кандидозным эзофагитом и энтероколитом.
В ходе исследования оценивались эффективность и безопасность 2-х схем лечения кандидоза пищевода и кишечника в 2-х группах: 1-я группа – контрольная, в которой пациенты получали этиотропную противогрибковую терапию; 2-я – основная группа пациентов, у которых в схему вышеназванной терапии включен комплекс Бактистатин.
В обеих группах больных проводили селективную деконтаминацию современными эффективными противогрибковыми препаратами направленного действия в течение 7–14 дней. Пациенты основной группы дополнительно получали Бактистатин по 2 капсулы 2 р./сут 20 дней.
Для изучения клинических, эндоскопических и лабораторных показателей в динамике на фоне лечения больных кандидозным эзофагитом и энтероколитом была разработана специальная анкета, включающая физикальное обследование, гастроскопию, колоноскопию, бактериологическое исследование кала.
Результаты сравнения балльной оценки клинической симптоматики показали, что на фоне приема комплекса Бактистатин быстрее уходили проявления кандидоза пищевода и кишечника. Так, до лечения общий балл выраженности симптоматики кандидозного эзофагита был 355, после лечения этот показатель снизился до 123 в контрольной группе и до 60 у пациентов основной группы, принимающих Бактистатин (рис. 1). В отношении кандидозного энтероколита до лечения общий балл выраженности симптоматики составлял 645, после лечения – 317 в контрольной группе и 120 в основной группе (рис. 2).
Кроме того, применение комплекса Бактистатин в лечении кандидоза ЖКТ существенно влияло на восстановление микробиоценоза толстой кишки за счет увеличения числа бифидо- и лактобактерий и уменьшения количества энтеробактерий, неферментирующих бактерий и грибов.
Полученные данные свидетельствуют, что использование метабиотика Бактистатин позволяет избежать побочного действия системных антимикотиков на микрофлору кишечника, улучшить состояние пищевода и кишечника в короткие сроки за счет более выраженного снижения степени тяжести заболевания.
Таким образом, применение комплекса Бактистатин в схемах терапии грибковых поражений ЖКТ способствует быстрому созданию условий для роста и функционирования нормальной микрофлоры и уменьшению побочных эффектов системных антимикотиков.
Лебедев Василий Васильевич- проректор по лечебной работе и последипломному обучению Кубанской государственной медицинской академии, заведующий кафедрой инфекционных болезней и эпидемиологии ФПК и ППС Кубанской государственной медицинской академии, профессор, доктор медицинских наук;
Голенская Лариса Игоревна – заведующая лабораторией ЗАО ПК “Кубаньтехносервис”, кандидат медицинских наук, старший научный сотрудник, гастроэнтеролог.
Макроорганизм, его микрофлора и окружающая среда являются единой экологической системой, которая находится в состоянии динамического равновесия, характеризуется единством, целостностью и способностью к саморегуляции. Гармония всех ее компонентов связывается со здоровьем макроорганизма и обозначается как эубиотическое состояние.
Различные неблагоприятные воздействия на макроорганизм: экологическое неблагополучие, возрастание стрессовых воздействий, повышенный радиационный фон, бесконтрольное применение антибиотиков, неполноценность питания приводят к сдвигу в микробной экологии человека, возникает дисбиоз, нарушения обмена веществ, иммуносупрессивные и аллергические состояния, инфекционные и онкологические заболевания. Проблема дисбиозов имеет общебиологическую значимость, и борьба с ними в настоящее время является одной из актуальных задач здравоохранения.
Очень часто дисбиоз является важным патогенетическим механизмом в развитии синдрома разждраженной кишки ( СРК).
Синдром раздраженной кишки (СРК) – комплекс функциональных ( то есть не связанных с органическим поражением кишечника) расстройств, длящихся свыше 3 месяцев, клинически проявляющихся болями в животе (обычно исчезающими после дефекации), сопровождающимися нарушениями функции кишечника ( запор, понос или их чередование), а также метеоризмом, урчанием, чувством неполного опорожнения кишечника или же императивными позывами на дефекацию.
Распространенность СРК, по данным различных авторов, колеблется от 14-22 до 30-48%, причем у женщин регистрируется в 2-4 раза чаще, чем у мужчин, а пик возрастной заболеваемости приходится на период от 30 до 40 лет.
По наблюдениям авторов П.Я Григорьева и Э.П.Яковенко (2000г.) у большинства больных СРК в 68,8% случаев имелась избыточная микробная контаминация тонкой кишки и в 98,4% случаев – дисбактериоз толстой кишки. При этом обнаруживались гемолизирующая флора, кишечные палочки со слабовыраженными ферментативными свойствами, энтеропатогенные кишечные палочки и другие изменения микрофлоры толстой кишки с преобладанием условно-патогенных микроорганизмов или их ассоциаций (стафилококки, протей, дрожжеподобные грибы, лактозонегативные или гемолитические ишерихии, синегнойная палочка, клебсиеллы и др.), то есть те или иные дисбиотические изменения микрофлоры толстой кишки в сочетании с избыточным бактериальным ростом в тонкой кишке. Изменения микробного биоценоза, выявленные у обследованных больных СРК, несомненно являются важнейшими патогенетическими механизмами в развитии этого синдрома. Так, в результате жизнедеятельности избыточного количества бактерий в тонкой кишке могут образовываться и накапливаться свободные (деконьюгированные) желчные кислоты, гидроксиды жирных кислот, бактериальные токсины, протеазы и различные метаболиты ( фенолы, биогенные амины и др.). Следствием этих процессов могут стать нарушения двигательной, секреторной, пищеварительной и других функций тонкой кишки, нарушения гидролиза дисахаридов (например, лактозная недостаточность), жиров, белков, всасывания витаминов, макро- и микроэлементов, аллергические проявления. Таким образом, в толстую кишку поступает химус, обладающий агрессивными свойствами, к тому же и в самой толстой кишке, особенно в ее начальных отделах, в силу дисбиотических изменений микрофлоры (отсутствие или дефицит основных бактериальных симбионтов – бифидобактерий, уменьшение количества молочно-кислых палочек) также редуцируются процессы пищеварения ( в основном нарушается гидролиз клетчатки) и всасывания, а оставшаяся “субстанция” в силу агрессивности приводит к расстройству моторно-секреторной функции ободочной и прямой кишки.
При дисбактериозе не только изменяется общее количество микроорганизмов за счет уменьшения или увеличения количества основных групп микроорганизмов, но и изменяются их свойства (усиливаются их инвазивность и агрессивность по отношению к слизистой оболочке), что в дальнейшем может привести к развитию воспалительного процесса.
Лечение больных СРК включает в себя нормализацию режима питания, проведение разъяснительных психотерапевтических бесед, назначение различных лекарственных препаратов с целью:
А) Устранения микробной контаминации тонкой кишки и восстановления нормальной кишечной микрофлоры в толстой кишке;
Для восстановления нарушенного микробиоценоза используются биопрепараты нескольких поколений:
1. классические ( бифидумбактерин, лактобактерин, колибактерин);
2. самоэлеминирующиеся антагонисты ( бактисубтил, бактиспорин, биобактон, энтерол, биоспорин, споробактерин);
- живые – бифилакт, бификол, биофлор
- лиофилизированные – бифиформ, бифилонг, аципол, ацилакт, линекс
4. иммобилизованные на сорбенте бактерии, представители нормальной микрофлоры (бифидумбактерин форте, пробифор);
5. комбинированные с лизоцимом ( бифилиз);
6. препараты, представляющие собой продукты метаболизма микрофлоры, в частности молочной кислоты ( хилак-форте);
7. препараты из антагонистических представителей рода Bacillus ( споробактерин живой, бактиспорин сухой);
8. рекомбинантные ( субамин).
Известно, что нормальная кишечная микрофлора способствует формированию защитно-адаптационных систем организма, она способствует реакции лимфатических узлов на антигенное раздражение (образование иммуноглобулинов, плазмоцитарная реакция, трансплантационный иммунитет, фагоцитоз). Физиологический уровень некоторых врожденных факторов – гликопротеидов и лизоцима – достигается стимуляцией организма нормальной микрофлорой. Отсутствие нормальной микрофлоры ведет к лимфопении, гиперкортицизму и угнетению образования лимфоидной ткани, что ведет к ослаблению защитно-приспособительной системы. Большой интерес представляет общая защитная реакция организма – канцеролитическая или цитолитическая ( лизис “чужих” клеток), свойственная нормальной микрофлоре.
Особого внимания заслуживают живые препараты бифидумбактерий и лактобактерий, т.е. функциогенные продукты питания, ферментированные этими представителями нормофлоры кишечника. Таким продуктом диетического лечебно-профилактического питания является БИФИЛАКТ, выпускаемый в Краснодарском крае. Функциогенные продукты питания, в том числе БИФИЛАКТ, должны соответствовать следующим требованиям:
- эти продукты должны содержать представителей нормальной микрофлоры кишечника ( бифи-думбактерии и лактобактерии), в активном колониеобразующем состоянии, в лечебных концентрациях, стабильно сохраняющихся в процессе хранения;
- очень важно соблюсти совместное культивирование в молоке бифидум- и лактобактерий, т.к. они яляются симбионтами и синергистами( они производят продукты жизнедеятельности друг для друга и значительно более эффективно приживаются в кишечнике совместно), что очень важно для их эффективной коллонизации в кишечнике. Кроме этого очень важно сочетание аэробной микрофлоры ( лактобактерий), которая нормализует процессы в тонком кишечнике и анаэробной микрофлоры ( бифидумбактерии), которые нормализуют процессы в толстом кишечнике;
- такие продукты должны содержать минимальное количество посторонней микрофлоры, которая может конкурировать за пищевую нишу и угнетать развитие бифидум- или лактобактерий, или вырабатывать продукты жизнедеятельности, нежелательные для лечебного продукта ;
- особое внимание в этих продуктах должно обращаться на дрожжевую микрофлору, которая при некоторых болезненных состояних организма может усугублять дискомфортные состояния желудочно-кишечного тракта ( гниение, брожение), вызывать аллергизацию;
- белок молока (казеин) в таких продуктах должен трансформироваться в легкоусваиваемые формы гидролизата казеина;
- у продукта должна быть высокая биологическая ценность, что определяет его диетические качества, т.к чем выше биологическая ценность белкового пищевого продукта, тем меньше в рацион можно вводить иных белоксодержащих компонентов с целью улучшения питательности рациона. В случае низкой биологической ценности продукта требуется излишнее введение бел- ковых веществ в рацион, что ведет к перенапряжению физиологических механизмов жизнедеятельности, снижает утилизацию белков организмом человека, а это может привести к накоплению и задержке в кишечнике шлаков, а вследствие этого к излишней аллергизации;
- в таких продуктах желательно незначительное содержание сахаров, т.к. они могут нарушать процессы пищеварения, приводить к аллергизации и раздражению рецепторов кишечника в связи с избыточным бактериальным ростом ;
- в таких продуктах желательна незначительная жирность, что увеличивает их диетические свойства и создает правильные условия для развития бифидумбактерий и лактобактерий;
- в таких продуктах желательно максимально снизить процент содержания токсических элементов.
В Краснодарском крае два производителя продукта Бифилакт ЗАО ПК “Кубаньтехносервис” г.Краснодар и ОАО “Белмолоко” г. Белореченск с различными технологиями его производства.
Бифилакт ЗАО ПК “Кубаньтехносервис” и Бифилакт ОАО “Белмолоко” были обследованы на соответствие вышеперечисленным требованиям и проведено их сравнение с целью выявления преимуществ для использования в качестве лечебно-профилактического средства.
Согласно экпертного заключения Краснодарского регионального института агробизнеса и Краевого Центра Госсанэпиднадзора в Краснодарском крае от 25.04.03 № 01/138 всем вышеперечисленным требованиям к продукту функциогенного назначения соответствует только Бифилакт , выпускаемый ЗАО ПК “Кубаньтехносервис”, что следует учитывать при назначении лечебного питания в лечебных и реабилитационных учреждениях, детских оздоровительных учреждениях и в качестве сопутствующего средства при лечении различных патологий, а также использования Бифилакта в учреждениях санаторного типа в качестве иммуностимулирующего и адаптогенного средства.
Антибактериальные препараты применяются в случае обильного роста условно-патогенной микрофлоры в посевах кишечного содержимого, а также избыточном бактериальном росте в тонкой кишке и наличии воспалительных изменений в слизистой оболочке . Иногда требуется 2-3 семидневных курса антибактериальной терапии. Применяются ципрофлоксацин, фуразолидон, эрсефурил, интетрикс и другие препараты.
Б) Нормализация процессов пищеварения и всасывания, а также устранения гипо- и авитаминоза и дефицита микро- и макроэлементов;
При назначении ферментотерапии следует опираться на результаты соответствующих лабораторных исследований. Для того чтобы произошло полное переваривание белков, жиров и углеводов необходимы ферменты с определенным временем воздействия. Например, для белков необходимы кислые ферменты ( с длительностью воздействия 1,5-2 часа), для переваривания и расщепления углеводов необходимы щелочные ферменты, амилаза, лизоцим (с длительностью воздействия 20 минут)- мезим-форте, креон, панцинтрат, панзинорм, панкреатин.
При наличиии выраженной сенсибилизации организма, изменений в иммунном статусе и сниженной детоксикационной способности организма показан короткий курс энтеросорбции (энтеросгель, энтерокар, ФАС, полифепам, полифам, смекта, пектин, лактулоза) на фоне витаминотерапии.
Для повышения защитных свойств организма при дисбиозе кишечника могут применяться : продигиозан, пентоксил, лизоцим, метилурацил, ретаболил, иммуноглобулин человеческий, тамерит, галавит, имунофан, ликопид, полиоксидоний, ронколейкин.
В) Обеспечения нормализации моторно-эвакуаторной функции толстой кишки и акта дефекации.
У группы больных с СРК с вариантом абдоминальной боли – пинавериум бромид ( дицетел) 0,3 г – 3 дня, далее 0,15 – 25 дней, тианептин ( коаксил) 0,025 – 28 дней; или мебеверин гидрохлорид ( дюспаталин) 0,4 – 28 дней, тианептин ( коаксил) 0,025 -28 дней.
У группы больных с СРК с вариантом запора – дицетел 0,3 г – 3 дня, далее 0,15 – 25 дней, коаксил 0.025 -28 дней, формлакс по 2 пак./сут.-10 дней; или дюспаталин 0,4 – 28 дней, коаксил 0,025 – 28 дней, лактулоза ( дюфалак) 45 мл/ сут. – 10 дней.
У группы болных с СРК с вариантом диареи – дицетел 0,3 г – 3 дня, далее 0,15 – 25 дней, коаксил 0,025 – 28 дней, смекта по 2 пак./ сут.- 10 дней; или дюспаталин 0,4 – 28 дней, коаксил 0,025 – 28 дней, смекта по 2 пак./ сут – 10 дней.
У больных с СРК с комбинацией абдоминальной боли и метеоризма- дицетел 0.3 г – 3 дня, далее 0.15 -25 дней, коаксил 0,025 – 28 дней; или дюспаталин 0,4 – 28 дней, коаксил 0,025 – 28 дней, эспумизан 0,12 – 10 дней.
Выводы:
По данным А.А. Яковлева (2002 г.), в группах больных, получавших схемы “оптимального выбора” к завершению 4-х недельного курса лечения улучшение было отмечено в 76,6 -93,3% случаев.
ПРОБИОТИКИ ПРОТИВ ГРИБКОВ…. ИЛИ КАК ВЫЛЕЧИТЬ МОЛОЧНИЦУ (КАНДИОЗ) РАЗ И НАВСЕГДА?
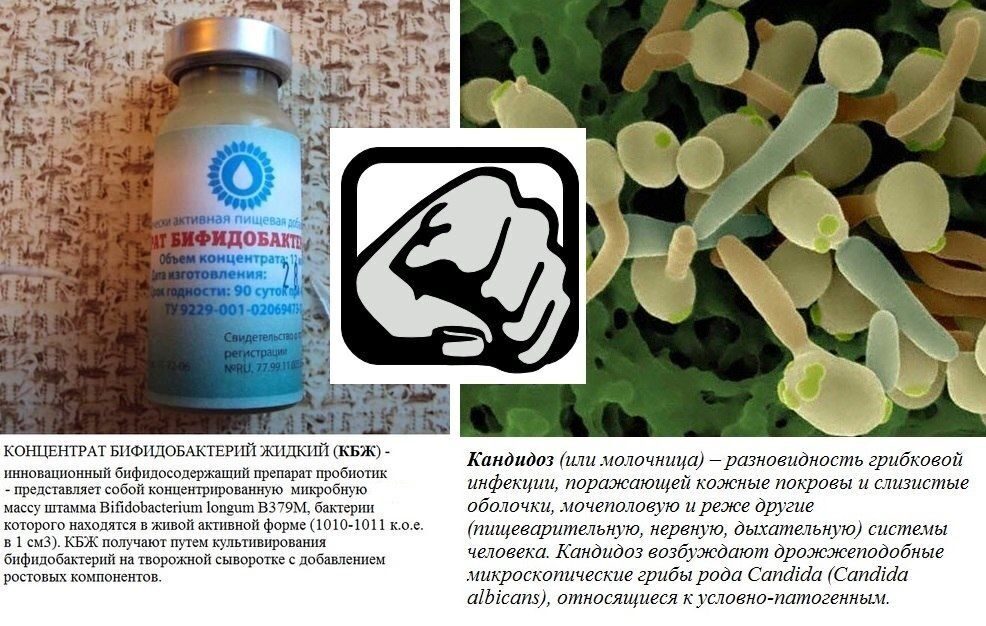
ПРИМЕНЕНИЕ КОНЦЕНТРАТА БИФИДОБАКТЕРИЙ ЖИДКОГО (КБЖ) ПРИ ЛЕЧЕНИИ МОЛОЧНИЦЫ
О кандиозе написано много…. По статистике, более 70% женщин болели кандидозным вагинитом или, так называемой молочницей как минимум один раз. Но до сих пор не многие знают, что эффективным и безопасным методом лечения молочницы (особенно при беременности) является применение бактериальных концентратов (жидких пробиотиков)…
Причины молочницы
Причиной молочницы принято считать неконтролируемый рост дрожжевых грибков, чаще всего вида Candida albicans. Реже при молочнице можно обнаружить другие виды грибов рода Candida.
Однако носительство этого грибка, который является представителем условно-патогенной микрофлоры, есть у большинства здоровых людей. Он может находиться на коже, в кишечнике, во влагалище и не вызывать заболевания. В окружающей нас среде так же очень распространены дрожжевые грибы. Почему же у здорового человека присутствие грибов рода Candida не является причиной молочницы и кандидозных поражений различной локализации?
Следовательно, причиной молочницы является так же ослабление этих механизмов.
В составе микрофлоры влагалища преобладают молочнокислые бактерии, называемые так же палочками Дедерлейна, а также присутствуют бифидобактерии и кокки. Всего может насчитываться до 40 видов микроорганизмов, количество каждого из которых строго контролируется друг другом. Микроорганизмы нормальной микрофлоры препятствуют росту болезнетворных микроорганизмов. Защита, обеспечиваемая микрофлорой, превосходит даже арсенал антибиотиков.
Однако, если микрофлора влагалища угнетена и ослаблена, например, после применения антибиотиков и гормональных препаратов, в результате стрессов и переутомления или в результате хронических заболеваний, нарушений гормонального фона, она становится неспособна выполнять свою защитную роль. Женщина в этом случае подвержена различным воспалительным заболеваниям, в том числе и кандидозному вагиниту (молочнице). Поэтому при воздействии на микрофлору влагалища этих негативных факторов желательно принять меры, направленные на восстановление микрофлоры даже с профилактической целью.
Ослабление иммунной системы так же может послужить причиной молочницы.
Лечение молочницы (кандидоза) при беременности
Лечение молочницы при беременности представляет сложность. Во время беременности изменяется гормональный фон, работа иммунной системы физиологически ослаблена, чтобы избежать отторжения плода при беременности. Во время беременности изменяется соотношение микроорганизмов микрофлоры влагалища.
В результате изменений, происходящих при беременности, заболевания молочницей (кандидозом) встречаются чаще и хуже поддаются лечению.
Многие лекарственные препараты, применяемые для лечения молочницы, во время беременности противопоказаны. Перечень лекарств, разрешенных для применения беременными, небольшой. Поэтому нередко молочница во время беременности поддается лечению очень плохо.
Восстановление микрофлоры при помощи жидких концентратов бактерий - хорошая альтернатива противогрибковым препаратам при лечении молочницы во время беременности.
Жидкие пробиотики могут применяться и в комплексе с традиционным медикаментозным лечением молочницы, значительно (по данным исследований в 12 раз!) снижая рецидивы молочницы. Местное применение концентрата бифидобактерий жидкого (КБЖ) при лечении молочницы во время беременности позволит в быстрые сроки избавиться от зуда и жжения, уменьшить воспаление слизистых.
Как избежать рецидивов молочницы?
Дело в том, что лечение заболевания должно быть комплексным и включать не только элиминацию возбудителя, но и восстановление естественного защитного барьера – микрофлоры, а также восстановление слаженной работы иммунной системы. Поэтому гинекологи все чаще включают в схемы лечения при кандидозном вагините препараты, восстанавливающие как вагинальную флору, так и флору желудочно-кишечного тракта.
Как правильно восстановить микрофлору влагалища при лечении молочницы?
Начинать восстановление микрофлоры влагалища нужно с пробиотиков, содержащих бифидобактерии.
По данным клинических исследований, применение жидкого концентрата бифидобактерий (КБЖ) внутрь и вагинально при лечении молочницы позволяет снизить рецидивы этого заболевания в 12 раз.
Жидкие пробиотики кроме самих бактерий содержат продукты их жизнедеятельности. Комплекс метаболитов бифидобактерий (веществ, которые бактерии выделяют в процессе роста) обладает одновременно выраженным противовоспалительным, противоотечным, регенерирующим, иммуномодулирующим, противомикробным действием, как при приеме препарата внутрь, так и при местном применении. Высокий титр КБЖ обеспечивает достаточную концентрацию метаболитов. Поэтому при местном применении препарата (тампоны и микроспринцевания) такие неприятные проявления молочницы как жжение и зуд, боли и выделения прекращаются уже после первых процедур. Необходимо провести полный курс процедур, так как при этом достигается восстановление микрофлоры влагалища, предупреждаются рецидивы заболевания.
Применять пробиотики нужно одновременно вагинально и внутрь (местно), т.к. этим достигается максимальный оздоровительный эффект от применения дружественных микроорганизмов, которые непосредственно (!) воздействуют на становление и укрепление иммунитета…
Применение Концентрата Бифидобактерий

При воспалительных заболеваниях женских гениталий и предродовой подготовки беременных группы "риска" разводят 1-2 мл КБЖ в столовой ложке (20 мл) кипяченой воды (около 37 о С) и пропитывают стерильный тампон. Вводят интравагинально на 2 часа 1 раз в день в течение недели под контролем.
Длительность курса использования КБЖ зависит от возраста и состояния человека.
При аллергии, диатезе и других иммунных нарушениях применение КБЖ желательно периодически повторять.
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ
Читайте также:

