Химико токсикологическая диагностика отравлений
Обновлено: 25.04.2024
1.Чрезвычайное многообразие и разнохарактерность объектов исследования: это биологические жидкости (кровь, моча), рвотные массы, внутренние органы трупов людей, волосы, ногти, остатки пищевых продуктов и напитков, лекарственных средств, пестициды, препараты бытовой химии, посуда, предметы домашнего обихода, одежда, вода, земля и т.д.
2. Необходимость изолирования (извлечения) малых количеств (от мкг до мг ) искомых химических веществ из сравнительно большого количества объекта исследования составляет вторую и главную специфическую особенность ХТА. От методов изолирования нередко зависит дальнейший ход химического анализа и даже его результаты.
3. В подавляющем большинстве случаев химику-токсикологу приходится работать со следовыми количествами химического вещества, как правило, не химически чистого, а находящегося в смеси с сопутствующими (соэкстрактивными, балластными) веществами, извлекающимися при изолировании, и оказывающими часто негативное влияние на результаты анализа. Приходится удалять эти балластные вещества введением дополнительных методов очистки.
4. Установление присутствия ядовитого вещества в организме и возможность суждения о его количестве требует соответствующих, иногда особых, но всегда максимально чувствительных и специфичных методов анализа.
5. Своего рода особенностью является необходимость правильной оценки результатов анализа - экспертное заключение. Эксперт имеет возможность говорить лишь об обнаружении или необнаружении искомого вещества, т.к., исходя из природы химического вещества, учета чувствительности применяемых методов, отрицательный результат исследования не всегда свидетельствует об отсутствии ядовитого вещества (следы его могут оставаться в объекте, но не обнаруживаться). И наоборот, некоторые из веществ, на которые токсикология указывает как на ядовитые, являются естественными составными частями организма (катионы Сu, As, Hg, Zn, Pb и др.). Они могут быть обнаружены и определены в процессе анализа, однако не являться причиной отравления.
Присутствие ядовитого вещества, не всегда является доказательством его введения в организм с целью отравления, т.к. многие из них, например, барбитураты, алкалоиды и другие азотсодержащие вещества основного характера, являются лекарственными. В этих случаях обязательна количественная оценка.
6. Трудности обнаружения и определения ядовитого вещества, особенно в органах трупа, обусловлены также поведением химического вещества в организме и трупе. Введенное в организм токсическое вещество распределяется по жидкостям и тканям чаще всего неравномерно. Многие вещества, особенно органической природы, подвергаются далее, главным образом, в печени, различным процессам биотрансформации (метаболизма) по пути гидролиза, окисления, восстановления, синтеза с биохимическими компонентами организма (конъюгация с глюкуроновой, серной кислотами), направленным, в основном, на обезвреживание вещества. Протекают процессы элиминирования (выделения) токсического вещества и его метаболитов почками с мочой и др. В зависимости от глубины биотрансформации большая или меньшая часть вещества остается неизмененной или метаболизирует,а в зависимости от интенсивности.и скорости элиминирования большая или меньшая часть вещества ускользает от исследователя. Эти факторы ооказывают значительное влияние на результаты анализа.
Химико-токсикологический анализ используется для решения задач в двух основных направлениях:
-- судебно-химическая экспертиза как приложение знаний токсикологической химии к практическому решению вопросов, выдвигаемых судебно-следственными органами (чаще всего при летальном исходе, объектами при этом являются внутренние органы трупа).
Уголовно-процессуальный кодекс Российской Федерации (УПК РФ) дает следующее определение:
Вещественными доказательствами являются предметы, которые служили орудиями совершения преступления или сохранили на себе следы преступления или были объектами преступных действий обвиняемого, а также деньги и иные ценности, нажитые преступным путем, и все другие предметы и документы, которые могут служить средствами к обнаружению преступления, установлению фактических обстоятельств дела, выявлению виновных, либо к опровержению преступления или смягчению вины обвиняемого.
В зависимости от характера вещественных доказательств и поставленных вопросов судебно-химическая экспертиза проводится либо в судебно-химических отделениях судебно-медицинских лабораторий бюро судебно-медицинской экспертизы органов здравоохранения, либо в специальных криминалистических лабораториях министерств юстиции и внутренних дел.
- аналитическая диагностика острых отравлений и наркоманий. Объектами в этом случае являются биологические жидкости организма человека (кровь, моча, слюна, спинномозговая жидкость), а также остатки лекарственных и химических веществ, посуда и другие предметы, растения и т.д..
Вопросы аналитической диагностики острых отравлений и наркоманий решаются в химико-токсикологических лабораториях центров по лечению острых отравлений, токсикологических центров и отделений, центров экстракорпоральной терапии, наркологических диспансеров и других учреждений здравоохранения.
Методы токсикологического скрининга (анализа) и их эффективность
Использовать токсикологический анализ без понимания его ограничений опасно. Токсикологический скрининг характеризуется хорошей специфичностью. Специфичность пропорциональна процентной доле пациентов, в организме которых токсичные вещества присутствуют, но результат анализа отрицательный (хорошая специфичность означает, что тест дает мало ложноположительных результатов).
Однако чувствительность его низка, поскольку многие случаи присутствия токсичных веществ не выявляются. Чувствительность — это доля больных с данным токсином, для которых получен положительный результат (если она высока, ложноотрицительных результатов мало).
Диагностическая ценность отрицательного результата (т. е. доля истинно отрицательных результатов среди всех отрицательных) составляет около 40 %. Для повышения чувствительности и диагностической ценности скрининга необходимы совершенствование аналитических методов, тесное взаимодействие между врачами и лабораториями, правильное взятие проб и понимание ограничений и ценности конкретных тестов.
Ограничения методов токсикологического скрининга
Для скрининга токсинов токсикологические лаборатории применяют несколько методов, поскольку единственного точного и недорогого метода для выявления всех токсинов не существует. Эти методы различаются по стоимости, точности, сложности, скорости и специфичности. Надежность отдельного теста зависит от опыта аналитика, оборудования, метода и числа обрабатываемых заказов.
Трудности возникают в связи с изменениями биологических жидкостей при их хранении, переносом веществ из пробирки в пробирку и стандартами, используемыми при анализе.
Порча колонок для газожидкостной хроматографии приводит к появлению неизвестных остатков, а ионизация газов чревата расщеплением химикатов. Кроме того, лабильные метаболиты подвергаются химическим изменениям, зависящим от используемой аналитической методики. Таким образом, для правильного использования лаборатории необходимо знакомство с ее специфическими потребностями, процессами и ограничениями. Для интерпретации результатов токсикологического скрининга важно знать ответы на следующие вопросы.
1. Какой метод используется для каждой категории веществ и какова его специфичность?
2. Какие вещества выявляются при токсикологическом скрининге и какие его варианты доступны (например, специально для агентов, вызывающих кому, эпилептические припадки; психоактивных средств)?
3. Какая информация необходима в запросе?
4. Какие образцы лучше всего подходят для конкретного анализа?
5. Какие тесты дают количественные и качественные результаты и насколько быстро?
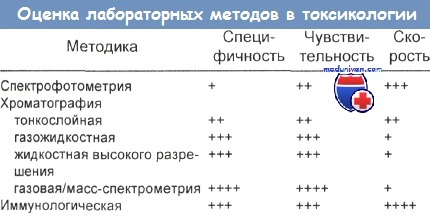
Сравнение аналитических методов токсикологического скрининга
Чаще всего используемая в качестве аналитического метода хроматография основана на разделении веществ при прохождении потока жидкости или газа через твердую (стационарную) фазу, содержащую неизвестный агент. Иммуноанализ (иммуноферментный, радиоиммуноанализ) чувствителен, но менее специфичен, чем хроматография или масс-спектрометрия.
Тонкослойная хроматография
Тонкослойная хроматография (ТСХ) — это простой и недорогой метод качественного скрининга, не дающий количественных результатов. Разделение фракций основано на различной абсорбции веществ при прохождении растворителя через стационарный сорбент (обычно кремниевую кислоту или оксид алюминия). Каждому веществу соответствуют характерное расстояние миграции после нанесения образца на исходную линию и применения соответствующего растворителя. Анализ занимает 2 ч, а его результаты должны интерпретироваться опытным персоналом.
В продаже имеются системы ТСХ для токсикологического скрининга, которые требуют меньше профессиональной подготовки, чем необходима для стандартной ТСХ.
Ультрафиолетовая спектрофотометрия
Ультрафиолетовая спектрофотометрия (УФС) — это простой, экономичный количественный метод, позволяющий выявить токсические уровни ацетаминофена и салицилата в крови, а также повышенный уровень фенотиазина в моче.
Однако точность результата сильно снижается при потреблении нескольких веществ, что в настоящее время ограничивает применимость данного анализа.
Газожидкостная хроматография
Газожидкостная хроматография (ГЖХ) — очень точный и специфичный метод, но требующий довольно много времени. Жидкий или растворенный образец впрыскивают в колонку, он переводится в пар нагреванием. Поток инертных газов пофракционно изгоняет образец из колонки, и появление на выходе различных фракций регистрируется химическими детекторами.
Сравнение времени удержания и площади пиков с известными стандартами позволяет идентифицировать вещества и определить их количества. Этим методом эффективно определяется уровень в крови летучих жидкостей (метанола, этанола, этиленгликоля).
Жидкостная хроматография высокого давления (разрешения)
Жидкостная хроматография высокого разрешения (ЖХВР) по скорости, специфичности и стоимости сходна с газожидкостной хроматографией, но позволяет определить не только летучие вещества. Высокое давление (7000—42 000 кПа) облегчает движение образца через колонку, что способствует разделению сложных соединений, включая конъюгированные метаболиты.
Радиоиммуноанализ
Радиоиммуноанализ самый медленный и дорогой метод, но зато очень точный. Смешивание известных количеств специфичного к веществу антитела с этим же веществом, несущим радиоактивную метку, позволяет анализировать осадок с помощью счетчиков гамма-квантов. Уровень излучения обратно пропорционален количеству выявляемого вещества. Этот тест прекрасно подходит для определения крайне низких концентраций, например каннабинолов, ЛСД, дигоксина, параквата.
Иммуноферментный анализ
Быстрый, дорогой и простой метод, обеспечивающий среднюю точность и специфичность результатов, иммуноферментный анализ (ИФА), основан на том, что количество присутствующего в образце вещества пропорционально степени ингибирования реакции фермента с субстратом. Известное количество искомого вещества метят, химически присоединяя к ферменту.
Специфичные к веществу антитела, добавляемые к образцу, связывают этот комплекс, снижая тем самым его ферментативную активность. Свободное вещество в составе образца конкурирует с тем, что помечено ферментом, а это ограничивает вызываемую антителом инактивацию последнего.
Ферментативная активность, коррелирующая с концентрацией вещества в образце, измеряется по изменению поглощения, происходящему при каталитическом действии фермента на субстрат. ИФА предпочтительнее радиоиммунологического метода в неотложных ситуациях благодаря своей простоте и быстроте получения данных о концентрации токсичного агента.
При его использовании не нужна сложная стадия разделения, обязательная для последнего метода. В мелких лабораториях применяется система st (single test) с компактным спектрофотометром, а в крупных больницах — система dan (drugs of abuse), предназначенная специально для случаев токсикомании. Отрицательный результат, впрочем, не исключает присутствия очень малых количеств искомого агента.
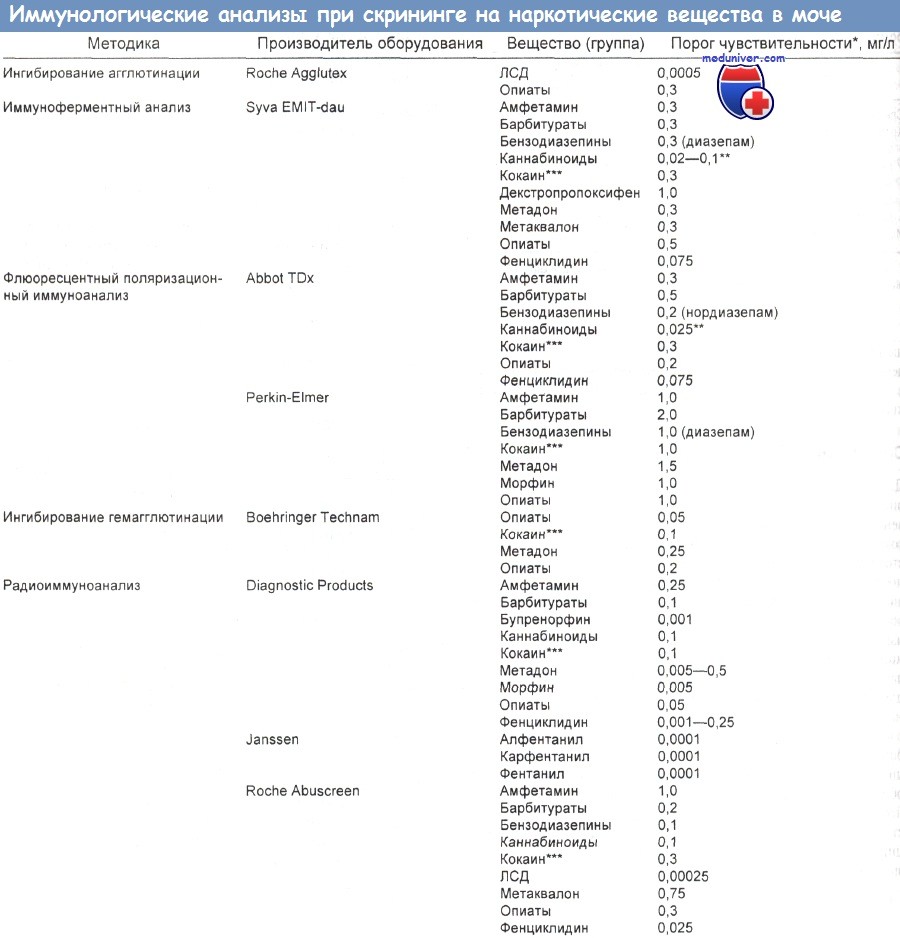
Перекрестные реакции с антителами, способные привести к ложноположительному результату, дают следующие вещества:
• наркотики:
маковое семя,
декстрометорфан,
хлорпромазин,
дифеноксилат;
• амфетамины:
эфедрин,
фенилэфрин,
псевдоэфедрин,
N-ацетилпрокаинамид,
хлорохин,
прокаинамид;
• фенциклидин:
декстрометорфан,
дифенгидрамин,
хлорпромазин,
доксиламин,
тиоридазин.
Самая распространенная причина ложноположительного результата — перекрестная реакция антитела с веществом, которое по структуре сходно с искомым агентом, например с компонентами макового семени, включающими опийные алкалоиды, что дает положительный результат скрининга на опиаты.
Хорошо известна также способность противозастойных капель для носа, в частности эфедрина и фенилпропаноламина, показывать при скрининге мочи положительную реакцию на амфетамины. К такому ложноположительному результату может привести перекрестная реакция антител с L-эфедрином и фенметразином.
Причины ложноотрицательного результата токсикологического скрининга
Причины ложноотрицательных результатов анализа можно разделить на три категории: технологические недостатки, токсикокинетические свойства и предумышленная порча или подмена образца.
Технологические недостатки:
— метод не рассчитан на данное вещество,
— вещество структурно не соответствует прототипу данного класса соединений, например фентанилу,
— низкое качество лабораторной работы.
Токсикокинетические свойства:
— большой объем распределения,
— короткое время полувыведения.
Предумышленная порча или подмена образца:
— предъявление "чистой" мочи другого человека,
— предъявление не мочи, а другой жидкости,
— питье большого количества жидкости,
— прием диуретиков,
— добавка в мочу отбеливателя, едкого агента, "чая" из желтокорня, лимонного сока, соли, мыла или уксуса.
Атомно-абсорбционная спектрофотометрия
Атомно-абсорбционная спектрофотометрия — это обычный метод выявления неорганических агентов (например, свинца, ртути, таллия, кадмия), плохо подходящий для токсикологического скрининга, поэтому большинство его вариантов тяжелых металлов не выявляют.
Плазменная атомно-эмиссионная спектроскопия с индуктивным сопряжением (ПАЭС-ИС) — новый метод, позволяющий проводить одновременный анализ нескольких элементов и полезный в промышленности. Он определяет содержание в одной пробе 17 элементов: алюминия, бария, кадмия, хрома, меди, железа, лантана, свинца, марганца, молибдена, никеля, платины, серебра, стронция, олова, титана и цинка.
Газовая хроматография — масс-спектрометрия
Вероятно, лучшим методом, определяющим присутствие в пробе определенного вещества, является газовая хроматография с масс-спектрометрией (ГХ-МС), однако высокие капитальные и эксплуатационные издержки ограничивают применение его эталонными центрами.
К веществам, знание уровня которых в крови может быть полезным для лечения отравлений, относятся ацетаминофен, салицилаты, карбоксигемоглобин, метгемоглобин, метанол, этиленгликоль, литий, железо, паракват, дигоксин, теофиллин и фосфорорганические соединения. Специфическое применение этой информации рассмотрено в соответствующих отдельных статьях на сайте (рекомендуем пользоваться формой поиска на главной странице сайта).
Гипокальциемия при отравлении
Гипокальциемия особенно часто наблюдается при отравлении фтороводородом, оксалатами, этиленгликолем и органическими соединениями олова, причем нередко у больных в критическом состоянии, сочетающемся с сердечно-сосудистой или нервно-мышечной недостаточностью.
Кристаллурия при отравлении
Кристаллурия может быть следствием отравления сульфаниламидами, четыреххлористым углеродом, примидоном и ампициллином. Массивная кристаллурия обычно связана с потреблением оксалатов или этиленгликоля.
Анализ пота при отравлении
К веществам, выявляемым путем анализа "пятен пота", относятся кокаин, героин, метамфетамин, фенциклидин и тетрагидроканнабинол.
Тесты у постели больного с отравлением
К тестам на присутствие в организме отравляющего вещества, не требующим отправки образцов в лабораторию, относятся определение специфического запаха, скрининг хлоридом трехвалентного железа на салицилаты (положительный результат подтверждает их наличие в сыворотке), нитропруссидная проба на кетоны (Ацетест), визуальное исследование крови на эритроцитарные аномалии, микроскопическое исследование мочи на кристаллы, проверка с помощью тест-палочки на острый некроз скелетных мышц или гемолиз, диагностическое использование налоксона, проверка тест-палочкой на этанол, применение индикаторной трубки для выявления этанола, метанола и изопропанола, а также некоторые другие тесты, ценность которых еще недостаточно изучена (на ацетаминофен, цианид, салицилат свинца, теофиллин — описаны в отдельных статьях на сайте (рекомендуем пользоваться формой поиска на главной странице сайта).
ЭКГ при отравлении
Электрокардиомониторинг полезен для обнаружения фармакогенных аритмий и нарушений калиевого, магниевого и кальциевого баланса.

Учебное видео расшифровки ЭКГ при электролитных нарушениях

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
- Также рекомендуем "N"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Токсикологическая оценка при отравлении
Mahoney и соавт. разделили подходы к лечению на четыре группы в соответствии с токсикологической оценкой:
1. Токсичность можно предсказать по уровню агента в сыворотке и, исходя из него, назначить специфическую терапию (примеры — ацетаминофен, салицилаты, литий, метанол, этиленгликоль, дигоксин, теофиллин).
2. Токсичность тесно коррелирует с уровнем агента в сыворотке, но требуется только неспецифическое лечение (примеры — этанол, барбитураты, фенитоин).
3. Токсичность и необходимость специфической терапии зависят от клинических показателей, а токсикологический анализ служит только для подтверждения сложившегося на их основе впечатления (примеры — трициклические антидепрессанты, наркотики, цианид, фосфорорганические соединения).
4. Токсичность слабо коррелирует с сывороточным уровнем агента, и требуется неспецифическое лечение на основе клинических показателей (бензодиазепины, нейролептики, галлюциногены, фенциклидин, амфетамины, кокаин, фенилпропаноламин).
Многие вещества при токсикологическом скрининге часто не выявляются.
Соединения, обычно невыявляемые при стандартном токсикологическом скрининге:
1. Гемоглобины: карбоксигемоглобин, сульфогемоглобин, метгемоглобин.
2. Неорганические вещества
- Металлы: мышьяк, висмут, ртуть, свинец, селен, литий
- Диуретики: соединения ртути и аммония
- Галогены: бромиды, фториды
3. Растворители
4. Пестициды
5. Радиоактивные вещества
6. Антибиотики
7. Витамины
8. Нестероидные противовоспалительные средства (кроме аспирина и ацетаминофена)
9. Блокаторы кальциевых каналов
10. Бета-блокаторы
Некоторые типичные аналитические методы, используемые для токсикологической оценки проб сыворотки, представлены ниже в таблице.
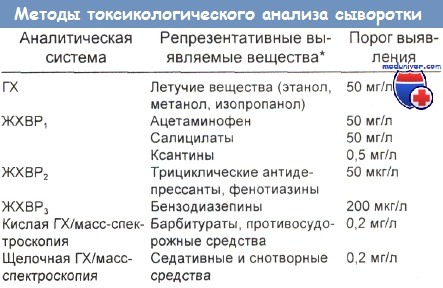
ГХ — газовая хромотография, ЖХВР — жидкостная хроматография высокого разрешения (давления).
* Приведенные вещества и пороги выявления — просто типичные примеры, не исчерпывающие набора веществ, выявляемых данной системой.
Измерения, применимые в производственной токсикологии, перечислены в таблице ниже.

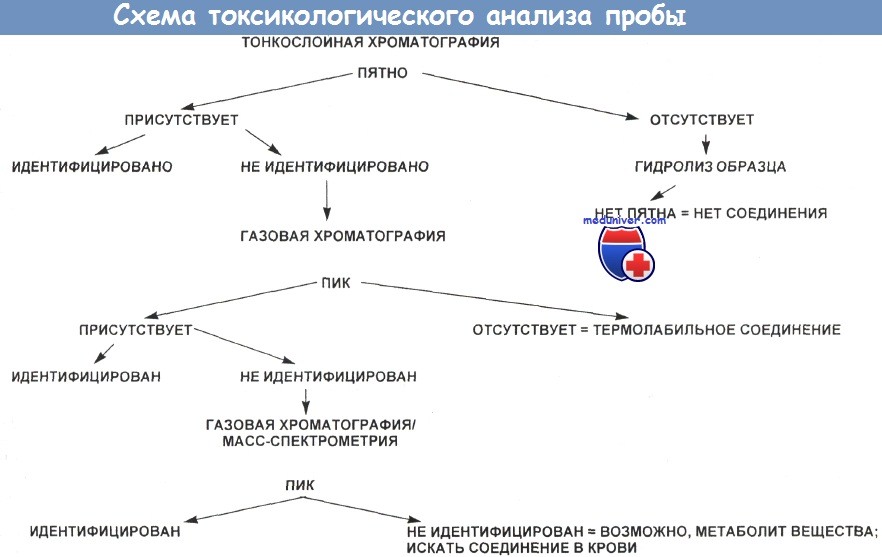
Схема токсикологического анализа пробы изображена на рисунке ниже.
Количественные данные и правильное время взятия проб указаны в таблице ниже.
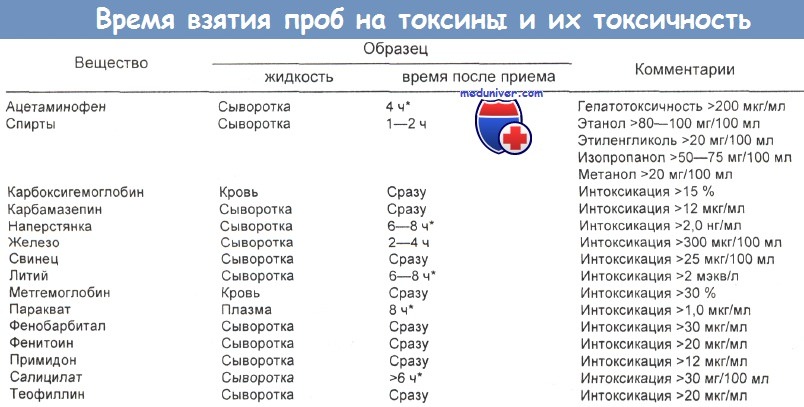
* Для этих веществ сывороточную концентрацию измеряют дважды: сразу при поступлении больного в отделение неотложной помощи и по истечении времени, указанного в таблице.
Эти измерения рекомендуются по двум причинам. Во-первых, у некоторых веществ (например, наперстянки, лития) фаза распределения длительная, и сывороточная концентрация не отражает тканевой, пока не прошло 6—8 ч.
Во-вторых, интерпретация сывороточной концентрации других веществ с помощью номограммы (например, салицилата, ацетаминофена) возможна только по истечении определенного периода времени.
Gaudreault и Timberlake сравнили относительные специфичность, чувствительность и скорость анализа при использовании различных лабораторных методик.

Клиницист должен передать в клиническую лабораторию следующую информацию о больном, указав:
1) специфику случая,
2) все возможные агенты отравления и медикаменты,
3) показатели жизненно важных функций, потерю сознания, поведенческие аномалии,
4) уже известные лабораторные результаты,
5) медикаменты, используемые хронически или при оказании неотложной помощи.
Оптимальное время для токсикологического скрининга — при поступлении больного и повторно через несколько часов. Врачу отделения неотложной помощи полезно встретиться с лабораторным персоналом и уточнить, какие необходимы анализы, когда нужны результаты, когда их можно получить, какой анализ требуется (количественный или качественный), когда и какой тип образца нужно прислать, каковы природа и чувствительность используемой аналитической методики.
При скрининге мочи на вызывающие зависимость психоактивные вещества применяют иммунологические тесты.
Трудности токсикологической оценки отравления
Некоторые соединения бывают активны в слишком низких для обнаружения концентрациях. Токсикологический скрининг не выявляет агентов, разрушающихся при нагревании до обнаружения (ЛСД, псилоцибин), распределенные в нетестируемых тканях (пестициды, ЛСД), испаряющихся на стадии экстрагирования или концентрирования (растворители); некоторые неорганические, слишком полярные вещества, а также элементы, не включенные в схему анализа (Hg, Р).
Ряд веществ быстро метаболизируется, и выявляются только их метаболиты, а некоторые соединения просто трудно обнаружить (галоперидол, оксикодон).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Основной задачей химико-токсил. анализа является установление
природы яда (общие исследования на неизвестный яд или частное исследование на
Этапы химико-токсил. анализа.
1. Выбор объекта исследования
2. Определение количества расходуемого объекта.
3. Выбор метода изолирования
4. Очистка яда от эндогенных соединений
5. Проведение идентификации и количественного определения.
6.Оценка результатов проведенного анализа
Особенности химико-токсил. анализа.
1. Характеристика объекта исследования
2. Разнообразие ядов, встречаемых при отравлениях по мере поступления в организм и
нахождения в нем.
3. Значительные изменения объекта во времени
4. Изменение токсического вещества в объекте
5. Близость структуры яда и эндогенного соединения
6.Разнообразие объектов исследования :органы трупов, моча и кровь трупов, рвотные массы, экскременты, волосы, ногти, промывные воды желудка, остатки пищи, напитки, пестициды, части растений, обработанные пестицидами, вода водоемов, пробы воздуха промышленных предприятий, почва, предметы домашнего обихода, одежда и др.
Химико-токсикологический анализ характеризуется разнообразием объектов исследования, содержащих незначительные количества токсических веществ. Эти вещества являются микрокомпонентами в большом количестве биол. м-ла. Прежде чем приступить к обнаружению и количественному определению токсических веществ, необходимо выделить их из соответствующих объектов. Выбор методов выделения токсических веществ зависит от характера объекта исследования. При использовании неподходящего метода выделения токсического вещества из исследуемого объекта оно может быть частично или полностью потеряно в ходе химико-токсил. анализа. Причем в ряде случаев для выделения одного и того же вещества из различных объектов необходимо применять разные методы.
Одной из особенностей химико-токсил. анализа является и то, что наряду с исследованием веществ, вызвавших отравление, необходимо выделять из биол. м-ла и определять их метаболиты.
14. Острая алкогольная интоксикация.
Эта патология обусловлена приемом этанола или различных алкогольных напитков с содержанием этанола более 12%. При поступлении в организм этанол претерпевает две четко выраженные фазы распределения: резорбциии (всасывание) и элиминации (выделение). Легко проникая через тканевые мембраны, алкоголь быстро всасывается в желудке: около 20% и в тонком кишечнике - около 80%. В среднем через 1,5 часа после поступления этанола в организм, его концентрация в крови достигает максимального уровня. Конц. спиртовые напитки с концентрацией этанола более 30%, всасываются быстрее. Пищевые массы в желудке замедляют всасывание вследствие своих адсорбционных свойств. При приеме алкоголя натощак, при повторных приемах, а также у людей с заболеваниями желудка (гастрит, язва), скорость всасывания значительно выше. 90% поступающего в организм алкоголя подвергается окислению в печени. Скорость окисления -6-7 г/ч. В окислении принимает участие алкогольдегидрогеназа. В обычных условиях незначительная часть этанола (1 - 2%) окисляется до ацетальдегида ферментом каталазой, которая находится во всех тканях организма. Около 10% всосавшегося этанола выделяется в неизменном виде через легкие и с мочой в течении 7-12 часов. Этанол обладает психотропным действием, связанным с наркотическим эффектом на ЦНС. Наркотический эффект зависит от фазы интоксикации. Так, в фазе резорбции эффект больше, чем в фазе элиминации, несмотря на то, что концентрация этанола в крови в обеих фазах будет одинаковой. Наркотический эффект также зависит от концентрации этанола в крови, от степени развития толерантности больного к алкоголю. Смертельная доза этанола при однократном приеме составляет 4 - 12 г на 1 кг веса тела. В среднем это 300 мл 96% спирта при отсутствии толерантности. Алкогольная кома развивается при концентрации алкоголя в крови около 3 г/л, а смертельная концентрация - 5 - 6 г/л. В течении острого алкогольного отравления можно выделить следующие характерные патологические синдромы. В токсикогенном периоде это: коматозное состояние, невралгические расстройства, нарушение дыхания, нарушение функций сердечно-сосудистой системы (ССС). В соматогенный период проявляются психоневрологические расстройства, воспалительные поражения органов дыхания.
В токсикогенный период тяжесть состояния больного определяется глубиной комы и сопутствующими осложнениями. Существует 2 стадии алкогольной комы: 1) поверхностная и 2) глубокая кома. Стадия поверхностной комы характеризуется потерей сознания, снижением зрачковых рефлексов, резким угнетением болевой чувствительности и отсутствием контакта. Стадия глубокой комы выражается утратой болевой чувствительности, отсутствием или резким снижением зрачковых и сухожильных рефлексов, мышечной атонии и снижением температуры тела. Диагностика алкогольной комы основывается на :
1. клинической картине отравления;
3. лабораторных данных;
Наибольшие трудности представляет дифференцированная диагностика алкогольной комы от коматозных состояний, вызванных следующей патологией, сочетающейся с алкогольным опьянением: черепно-мозговая травма, острое нарушение мозгового кровообращения, отравление ложными суррогатами алкоголя, галогенпроизводными, метанолом, этиленгликолем, снотворными препаратами и транквилизаторами, а также диабетическая кома.
15-16.Острые отравления лекарственными препаратами. Экпресс-методы.
Как и в случае любых химических токсикантов, специфическое ток¬сическое действие лекарственных веществ проявляется на ранней стадии острых отравлений — в токсикогенном периоде. Неспецифиче¬ское действие характерно для соматогенного периода. Специфическое действие токсиканта приводит к многочисленным патологическим про¬цессам, поэтому важно определить природу лекарственного вещества в начале токсикогенного периода.В настоящем разделе рассматриваются результаты химико-токсил. исследования лекарственных средств, отравления которы¬ми происходят наиболее часто.
Производные барбитуровой кислоты оказывают тормозящее действие на ЦНС. Лекарственные средства этой группы используют в качестве ус¬покоительных, снотворных, противосудорожных и средств для наркоза. Барбитураты быстро всасываются из желудочно-кишечного тракта. Для скринингового определения барбитуратов используют иммуно-химические методы (ИФА, РИА, ПФИА). При определении барбитуратов методом ТСХ их экстрагируют из биожидкости, которую предварительно подкисляют. В качестве экстрагентов применяют различные растворители, а также двух- и трехкомпонентные смеси: бензол-этилацетат (2:1), хлороформ-изопропанол-аммиак (5:5:1) И качестве реагентов для проявления используют сернокислый раствор сульфата ртути и дифенилкарбазон. Сине-фиолетовое окрашивание пятен, совпадающих по Rf со стандартами определяемых веществ, позволяет сделать вывод о присутствии барбитуратов в анализируе¬мой пробе. Количественное определение производных барбитуровой кислоты можно проводить спектрофотометрически в ультрафиолетовой области по полосе поглощения с ^тах = 260 нм, измеряя разность абсорбции щелочного раствора барбитурата (тетраборатный буфер) при рН среды 10,0 и 13,0.Производные барбитуровой кислоты определяют также методом ГЖХ с использованием полярных и неполярных жидких фаз. Опреде¬ление осложняется адсорбцией барбитуратов на твердых носителях. Для подготовки пробы в образец вводят 0,25 М серную кислоту и очи¬щенный хлороформ. Проводят экстракцию и центрифугируют (8000 об/мин). Для анализа отбирают 1—5 мкл хлороформного извлечения. Используют ступенчатые температурные режимы колонки, например 180, 200 °С для барбитала, барбамила, нембутала и 230 °С для фено-барбитала.
Отравления лекарственными средствами группы бензодиазепинов
Лекарственные средства группы бензодиазепинов например хлордиазепоксид (хлозепид), медазепам, диазепам (сибазон), оксазепам, нитразепам, феназепам, алпрозолам — высокоактивные транквилизаторы с относительно малой токсичностью. Эта группа лекарственных средств ежегодно пополняется вновь синтезиро¬ванными соединениями с раз-личными заместителями. Относительная доступность бензодиазепинов приводит к злоупот-реблениям и передозировкам.Производные бензодиазепина легко всасываются из желудочно-ки¬шечного тракта, максимальное количество в крови обнаруживается че¬рез 1—3 ч. Степень связывания с белками плазмы высокая (например для диазепама степень связывания достигает 98%). Производные бензо¬диазепина как липофильные вещества депонируются в жировой ткани с последующим постепенным высвобождением в кровь. По этой причи¬не бензодиазепины имеют довольно большой период полувыведения, например, для диазепама он составляет около 98 ч. Экскреция веществ этой группы — почечная (более 60% дозы) и кишечная.Экспресс-анализ бензодиазепинов проводят имунными методами (ИФА, РИА, ПФИА), оценивая общее содержание этих соединении.Определение бензодиазепинов проводят или по продуктам гидролиза — бензофенонам, или по исходным веществам и их метаболитам. Для проведения гидролиза анализируемую пробу биожидкости помещпнп и 6 М НС1 и нагревают при 140 °С в течение 60 мин. Экстракцию образующихся в процессе гидролиза аминобензофенонов проводят гептаном при рН 6,0—8,0. Анализ экстрактов проводят хроматографическими методами.При определении бензодиазепинов методом ТСХ в качестве подвиж¬ной фазы используют бензол. Обнаружение после разделения проводят по собственной желтой окраске с флюоресценцией в ультрафиолетовом свете. Предел обнаружения составляет 1—5 мкг в пятне. Элюаты хрома-тограмм используют для снятия электронного спектра или газохромато-графического исследования. Основные полосы поглощения аминобензо¬фенонов в этаноле 230—240 и 390—400 нм. Количественное определение можно проводить фотоколориметрическим методом по окрашенным продуктам реакции бензофенона с образованием азокрасителя.Анализ биологической пробы без предварительного гидролиза поз¬воляет обнаружить индивидуальные вещества и их метаболиты. Для этого проводят экстракцию бензодиазепинов из биообъектов органиче¬скими растворителями при рН 6,0—8,0 и последующее хроматографи-ческое определение.Для определения методом ТСХ применяют системы хлороформ-метанол (9:1), этилацетат—метанол—аммиак (85:10:5). Используя элю¬аты с ТСХ-пластин, проводят определение методом ГХ-МС по нативным соединениям или их летучим производным (дериватам).Возможно ВЭЖХ-определение производных бензодиазепина по нативным веществам или продуктам гидролиза. В качестве подвижной фазы можно использовать смесь ацетонитрил—0,05 М водный двузамещенный фосфат аммония (35:65 для нативных соединений или 55:45 для бензофенонов). Детектирование в ультрафиолетовых лучах прово-дят при 230—220 нм.
Отравление лекарственными средствами группы фенотиазинов
Лекарственные средства группы фенотиазина используются как транквилизаторы, антидепрессанты, антигистаминные и антиангинальные средства. Из алкильных производных фенотиазина наиболее известны аминазин (хлорпромазин), пропазин (промазин), левомепразин (тизерцин), метеразин (прохлорперазин), тиоридазин, хлорпротиксен, трифтазин.Из ацильных производных фенотиазина широко применяются этацизин, этмозин, нонахлазин и др.Производные фенотиазина химически очень лабильны и в орга¬низме подвергаются биотрансформации. Для экспресс-определения фенотиазинов в моче используют реак¬цию с FNP-реактивом, который состоит из смеси водного раствора хлорида железа (III), хлорной кислоты (НСЮ4) и азотной кислоты (1:9:10). Появляющаяся окраска от розовой до сине-фиолетовой свидетельствует о присутствии фенотиазинов или их метаболитов. Вслед¬ствие недостаточной специфичности реакции возможно получение ложноположительных результатов. Определению мешают салицилаты, желчные пигменты и другие соэкстрактивные вещества биологической пробы.Дальнейшее определение проводят методами ТСХ, ГЖХ, ВЭЖХ. При подготовке проб мочи и крови для ана¬лиза проводят гидролиз. Затем экстрагируют фенотиазины смесью гептан—3% изопентанол. Для ТСХ используют системы бензол— диоксан—25% аммиак (60:35:5) и этилацетат—ацетон—25% аммиак в этаноле 1:1 (50:45:4). Применяют также системы толуол—ацетон-этанол—25% аммиак (45:45:7,5:2,5) и диоксан—хлороформ—аце¬тон—25% аммиак (47,5:45:5:2,5). Детектирование проводят спирто¬вым раствором конц. серной кислоты (9:1) или реактивом Марки (H2SO4 + СН2О). Все фенотиазины дают красное или темно-красное окрашивание, кроме левомепразина, имеюще¬го голубую окраску. Количественное определение проводят фото¬метрическим методом по окрашенному продукту взаимодействия производного фенотиазина с метиленовым оранжевым или кисло¬тами.Для определения фенотиазинов методом ГЖХ используют тот же экстракт, температура колонки 230 °С или программирование от 130 до 290 °С со скоростью 20 °С/мин при температуре испарителя 250 °С.Для определения фенотиазинов используют ГХ-МС элюатов с ТСХ-пластин по нативным соединениям или ацето- и фторзамещенным де¬риватам.Возможно ВЭЖХ-определение производных фенотиазина в моче и сыворотке крови с использованием автоматических анализаторов; пре¬дел обнаружения 0,1 мкг/мл.
Отравление лекарственными средствами группы трициклических антидепрессантов
К группе трициклических антидепрессантов относятся амитриптилин, имизин, соответствующие N-дезметильные аналоги нортриптилин и дезипрамин. В анализе химико-токсикологические лаборатории вы¬полняют качественное обнаружение амитриптилина в моче методом ТСХ. При скрининговых исследованиях проводят экстракцию из мочи хлороформом или эфиром при рН 10,5—11,0. Упаренный экстракт на¬носят на пластинку и проводят хроматографирование в различных сис¬темах, например этилацетат—ацетон—раствор аммиака в этаноле (50:45:5), бензол—диоксан—аммиак (60:35:5). Проявление проводят оп¬рыскиванием конц. серной кислотой; наблюдается оран¬жево-кирпичная окраска. Предел обнаружения составляет 0,1 мкг в пятне.Количественное определение амитриптилина и нортриптилина про¬водят экстракционно-фотометрическим методом по комплексу с бром-феноловым синим после экстракционной и хроматографической очи¬стки. Предел обнаружения составляет 1 мкг/мл (в случае смертельных отравлений). Для экспресс-диагностики антидепрессантов в крови и моче ис¬пользуют также иммунохимические методы, например ПФИА. При этом удается снизить предел обнаружения на порядок — до 0,01 мкг/мл. Таким образом, иммунохимический метод позволяет выявить передо¬зировку лекарственного средства, что особенно важно в связи с малой широтой терапевтического интервала (близость терапевтических и ток¬сических доз).Для дифференциальной диагностики, изучения фармако- и токсикокинетики используют методы ГЖХ и ВЭЖХ (предел обнаружения 1 мкг/мл). При определении токсических концентраций в крови для снижения предела обнаружения (до 0,2 мкг/мл) проводят предвари¬тельное превращение в трифторацетатные производные.
Отравление антигистаминными лекарственными средствами
К антигистаминным средствам относятся вещества, блокирующие Н-гистаминовые рецепторы. Это представители разных химических классов органических веществ (например, димедрол, супрастин, тавегил, диазолин), что объясняет применение различных методик для их определения. Дифенилгидрамин довольно легко всасывается после приема внутрь (биодоступность 50%). Связывание с белками плазмы достига¬ет 72—98%, период полувыведения из крови 3—10 ч. Основные пути метаболизма - N-дезалкилирование, окислительное дезаминирование, конъюгация. Лишь 2-4% дозы выводится в неизмененном виде с мочой.Анализ на дифенилгидрамин проводится после экстракции веществ основного характера. Определение методом ТСХ проводят в общих си¬стемах, например бензол—диоксан—аммиак (60:35:5); проявляют оп¬рыскиванием конц. серной кислотой - образуется лимонно-желтое окрашивание.Для ГЖХ-анализа используют тот же экстракт; температура колонки 230 °С или программирование от 130 до 290 °С со скоростью 20 °С/мин, температура испарителя 250 °С.
Отравление лекарственными средствами группы сердечных гликозидов
К группе сердечных гликозидов относятся дигитоксин и другие кардиотоксичные гликозиды, которые содержатся, например, в наперстян¬ке. Их применяют как антиаритмические средства. Из структуры дигоксина следует, что гликозиды имеют высокую молярную массу, химически неустойчивы. Их терапевтические и токсические концент¬рации очень низкие, в связи с чем определение этих веществ, особенно в биологических м-лах, представляет определенные трудности. Доля связывания с бел¬ками 20-40%, доля выведения с мочой 60-90%, период полувыведения из плазмы 4—100 ч. Методы ВЭЖХ, ТСХ можно применять для определения сердечных гликозидов в сырье или в вещественных доказательствах, но не в биоло¬гических жидкостях, где их концентрация очень мала. Для определения гликозидов в моче используют иммунохимические методы.
Цель: Ознакомить студентов с методами химико-токсикологического анализа острых отравлений.
Тезисы лекции
Острые отравления развиваются в результате однократного, реже повторного воздействия токсичного вещества и характеризуются быстрым проявлением клинической картины. Симптомы отравления и тяжесть течения заболевания зависят от вида, дозы токсиканта и других причин. При острых отравлениях необходимо немедленно оказать медицинскую помощь пострадавшему, начиная с догоспитального этапа и продолжая в стационаре токсикологического или реанимационного профиля.
В тех случаях, когда клинические проявления на ранних стадиях развития интоксикации не позволяют установить причину отравления, проводят качественные и количественные исследования в возможно короткие сроки (максимум в течение 1—2 ч после поступления больного в стационар). Успех проведения ХТА при диагностике острых отравлений и, в конечном счете, успех лечения в значительной степени зависят от качества и скорости обмена информацией между клиницистом и химиком. Объем и глубина проведения ХТА в большинстве случаев определяется потребностями клиницистов. Подробное изучение клинической картины отравления, характерных симптомов отравления отдельными ядами является одним из основных условий адекватного выбора методов ХТА. Поэтому химик-токсиколог должен знать главные симптомы острых отравлений различными токсикантами.
Для исследования биологических жидкостей, поступивших в химико-токсикологические или судебно-химические лаборатории, на каждое вещество потребовалось бы много времени и очень большое количество анализируемых объектов. Чтобы, во-первых, рационально расходовать биологические жидкости, присланные на исследование, во-вторых, сохранить время анализа химик-токсиколог должен составить хорошо продуманный план исследования и исключить многие вещества из этого плана.
Для составления плана ХТА большое значение имеют результаты предварительных проб, так называемые методы аналитического "скрининга" на наличие токсических веществ в исследуемых объектах. На основании результатов предварительных проб можно исключить ряд веществ из плана ХТА и предположить, какие вещества могут быть в биологическом материале.
На основании только предварительных проб нельзя сделать окончательный вывод о наличии предполагаемого вещества в исследуемом объекте. Для этой цели в ходе ХТА необходимо провести дополнительные исследования на это вещество с помощью соответствующих реакций и методов.
Поэтому при положительных результатах предварительных проб на определенные вещества исследование этих веществ, включается в план ХТА.
При отрицательном результате предварительных проб на соответствующие вещества дальнейшее исследование их не проводят и не включают в план ХТА.
Для обнаружения токсичных веществ в объектах, взятых у живых лиц, требуются быстровыполнимые методы анализа, т.к. результаты этих анализов необходимы не только судебным химикам, но и лечащим врачам для решения вопроса об оказании срочной медицинской помощи пострадавшим.
За последние годы разработан ряд реакций и методов, позволяющих быстро определять некоторые лекарственные вещества непосредственно в биологических жидкостях – эти реакции и методы встречаются под названием "предварительные пробы" или "скрининг тесты".
Предварительные пробы на наличие токсических веществ в моче и крови являются чувствительными, но не специфическими. Ввиду высокой чувствительности проб в биологических жидкостях можно обнаружить не только токсические, но и терапевтические дозы принятых веществ.
Проведение предварительного отбора или "скрининга" исследуемых веществ на основе хроматографических методов (ГЖХ И ХТСС) позволяет за минимальное время выявить из большого круга лекарственных соединений, подлежащих ХТИ, одно или несколько веществ и в дальнейшем более целенаправленно подойти к выбору схемы ХТИ.
При экспресс-диагностике острых отравлений применяют различные методы.
• Иммунохроматографические и иммуноферментные.
— определение активности алкогольдегидрогеназы по скорости окисления
этанола до ацетальдегида;
— определение активности ацетилхолинэстеразы и др.
• Спектофотометрическое определение общей концентрации пептонов, низкомолекулярных белков.
• Цветные реакции непосредственно с биообъектами:
— определение фенотиазинов в моче по реакции с FPN-реактивом [хлорид
железа (III) в смеси перхлорной и азотистой кислотами];
— определение салицилатов, параквата, цианидов и других токсикантов в
— определение оксида углерода (II) в цельной крови.
— определение глюкозы в плазме крови;
— определение кетонов в моче.
Иллюстративный материал
1. При острых отравлениях чаще всего проводят ХТА на следующие группы токсикантов или их отдельные представители.
• Лекарственные препараты психотропного действия: барбитураты, бензодиазепины. Фенотиазины, лепонекс, противосудорожные и другие трициклические антидепрессанты, наркотические аналгетики (опиаты и опиоиды).
• Лекарственные препараты и другие вещества кардиотоксичного действия: адреноблокаторы. антагонисты кальциевых каналов, сердечные гликозиды. антиаритмические препараты, клофелин.
• Лекарственные препараты и другие вещества судорожного действия: тубазид. трициклические антидепрессанты.
• Лекарственные препараты и другие вещества антихолинергического (холинолитического) действия: антигистаминные. противопаркинсонические. алкалоиды белладонны.
• Алкоголь и суррогаты алкоголя, другие спирты: метиловый, этиленгликоль. изопропило-вый.
• Органические растворители: дихлорэтан, четыреххлористый углерод, трихлорэтилен. бензол.
• Прижигающие жидкости: кислоты, щелочи, окислители.
• Яды метгемоглобинобразуюшего действия: анилин, нитраты, нитриты.
• Соединения металлов (меди, ртути, железа, свинца и др.), мышьяка и селена.
• Оксид углерода (II). другие газы, включая токсичные дымы.
• Газы раздражающего, прижигающего, удушающего действия: хлор, аммиак, оксиды азота и серы, сероводород.
• Антихолинестеразные яды: фосфорорганические инсектициды, карбаматы. пиретроиды. физостигмин.
• Токсины (яды животного и растительного происхождения).
2. Таблица 1. Изменения цвета кожи при острой интоксикации (примеры)

Токсикологическая химия: метаболизм и анализ токсикантов: учебное пособие + СD/ под ред. Н.И. Калетиной. – М., 2008. – 1016 с. Переплет.
Токсикологическая химия: учебник / под ред. Т.В. Плетеневой. – 2-ое изд. – М., 2008. – 512 с. Переплет.
4 Лужников Е.А. Клиническая токсикология Е.А. Лужников.-М.,"Медицина", 1994. –189 с.
Контрольные вопросы (обратная связь)
Требования к химико-токсикологическому анализу.
Выбор методов. Направленность анализа в зависимости от клинических данных.
Особенности проведения направленного анализа.
Перечислите группы токсикантов при острых отравлениях, на которые проводят ХТА.
Методы анализа при экспресс-диагностике острых отравлений.
1. Тема 1 – Введение в наркологию. Организация службы аналитической диагностики наркомании, токсикомании. Основные документы, регламентирующие деятельность химико-токсикологических лабораторий. Задачи химико-токсикологической службы при оказании наркологической помощи.
2. Цель: Ознакомить студентов с организацией службы аналитической диагностики наркомании, основными документами, регламентирующими деятельность ХТЛ и задачами химико-токсикологической службы при оказании наркологической помощи, чтобы студент знал и мог руководствоваться ими в своей практической деятельности.
Читайте также:

