Хирургические гнойно септические осложнения
Обновлено: 25.04.2024
Гнойная инфекция - наиболее распространенный вид осложнений в хирургической практике, включающий раневую, внутри- или забрюшинную инфекцию, инфекции мочевыводящих путей, легочных осложнений, гнойный тромбофлебит и другие. Ее частота варьирует в зависимости от характера операции и способа профилактики. За счет относительной герметичности брюшной полости и снижения травматичности вмешательства в эндоскопической хирургии инфицирование ран встречается относительно редко. Однако полностью избежать подобных осложнений невозможно. В зависимости от потенциальной вероятности инфицирования раны принята следующая классификация оперативных вмешательств:
1. Чистые (асептичные) - операции при отсутствии воспаления и без вмешательства на желудочно-кишечном тракте, дыхательных и мочевыводящих путях. Рану при этом не дренируют, накладывают первичные швы.
2. Условно-инфицированные - операции на дыхательном или желудочно-кишечном трактах без загрязнения раны их содержимым, вмешательства на влагалище, моче- и желчевыводящих путях, не сопровождающиеся воспалением, аппендэктомия с минимальными нарушениями правил асептики.
3. Инфицированные - вмешательства, при которых имеет место значительное нарушение правил асептики с массивным истечением кишечного содержимого в рану, и операции, сопровождающиеся травмой или вскрытием мочевого пузыря или желчных протоков с инфицированным содержимым.
4. Гнойные - вмешательства, которые сопряжены с острым воспалением (даже если нет гноя), перфорацией внутренних органов, травматические раны с некрозом тканей, присутствием инородных тел, кишечного содержимого, а также случаи, когда лечение воспалительного заболевания было начато поздно.
Патогенные микроорганизмы, вызывающие инфекцию, обычно проникают в рану интраоперационно. Возбудителями могут быть бактерии самого пациента и/или штаммы, находящиеся в окружающей среде.
Для профилактики гнойных осложнений рекомендуется:
1. Дооперационная санация местных очагов инфекции.
2. Сокращение периода пребывания пациента в стационаре перед операцией (профилактика госпитальной инфекции).
3. Подготовку операционного поля следует проводить с минимальной травматизацией наружного слоя эпителия (электрической бритвой или методом химической эпиляции).
4. Тщательно контролировать полноту гемостаза.
5. При катетеризации мочевого пузыря использовать закрытые дренажные системы. Продолжительность дренирования, в зависимости от ситуации, следует сократить до минимума.
6. Разумная и обоснованная антибиотикотерапия.
7. Профилактическая антибиотикотерапия. Профилактическая антибиотикотерапия рекомендуется при следующих эндохирургических (лапароскопических) вмешательствах:
- холецистэктомия при остром холецистите или эмпиеме желчного пузыря;
- холецистэктомия, сопровождающаяся вскрытием просвета желчного пузыря по ходу вмешательства;
- аппендэктомия при остром аппендиците;
- операции на толстой кишке;
- гнойно-воспалительные заболевания брюшной полости ("second-look" в лечении перитонита, ушивание перфоративной язвы, покрытие внутрибрюшных абсцессов и др.);
- гнойно-воспалительные заболевания придатков матки;
- цистэктомия, сопровождающаяся вскрытием дермоидной или любой инфицированной кисты придатков матки;
- при исходной анемии,
- при гипопротеинемии,
- при снижении иммунитета вследствие длительной болезни,
- при локальных травмах тканей с образованием гематомы, некроза.
Известно, что профилактическое использование антибиотиков сокращает в послеоперационном периоде:
- в 2 раза - количество больных с лихорадкой,
- в 3 раза - частоту гнойных осложнений.
Лечение гнойных и септических осложнений ранений: устранение очага инфекции, антибиотикотерапия
Лечение любого гнойно-септического осложнения является комплексным и включает в себя следующие мероприятия:
1) Устранение первичного очага инфекции хирургическим путем. Хирургическое вмешательство прекращает дальнейшее поступление микроорганизмов. Это может быть ушивание дефекта стенки полого органа, его резекция или удаление. После этого следует санация очага гнойной инфекции, которая заключается в механическом удалении гнойного экссудата, пропитанных гноем некротических тканей из серозных полостей, средостения и забрюшинного пространства. Заключительным этапом хирургического метода лечения является полноценное дренирование гнойного очага.
Наиболее эффективным мы считаем метод активного дренирования с аспирацией и промыванием, принципы и детали которого изложены ниже, в разделах, посвященных специфическим осложнениям ранений.
2) Устранение расстройств внешнего дыхания достигается:
— обогащением кислородом вдыхаемой смеси;
— ИВЛ с положительным давлением в конце выдоха;
— постоянной санацией трахеобронхиального дерева.
Для предупреждения пневмонии применяют аэрозольные ингаляции с антибиотиками, парокислородные ингаляции, муколитики, вибромассаж груди (при отсутствии противопоказаний).
3) Коррекция расстройств системного кровообращения достигается:
— устранением дефицита объема внеклеточной жидкости (кристаллоиды, коллоиды, альбумин, кровь, по показаниям — вазопрессоры);
— снижением вязкости циркулирующей крови.
При проведении инфузионно-трансфузиониой терапии нельзя допускать возникновения легочной артериальной гипертензии.
4) Антибактериальная терапия. На протяжении нескольких десятилетий при лечении гнойных осложнений применялась эскалационная (восходящая) методика антибактериальной терапии, когда при неэффективности препаратов первого ряда назначались более мощные антибиотики.
Так, в прошлом достаточно эффективным было применение амоксициллина или ампициллина с сульбактамом, цефалоспоринов второго поколения (цефуроксима, цефокситина), третьего (цефтриаксона, цефоперазона) или четвертого (цефенима) поколений, фторхинолонов (ципрофлоксацина, левофлоксацина).
Эти препараты обычно применяли в комбинации с аминогликозидами, ванкомицином и антиаэробными средствами (метронидазол, линкомицин, клиндамицин).
Такой подход был клинически и экономически оправдан в условиях низкого уровня резистентности микроорганизмов. Однако во второй половине 80-х и в 90-х годах XX в. отмечен повсеместный рост резистентности, обусловленный как неблагоприятными изменениями внешней среды обитания (экология, социальные условия, алкоголизм, наркомания), так и бесконтрольным употреблением антибиотиков.
В настоящее время устойчивость микроорганизмов объявлена угрозой для человечества в целом. В таких условиях для лечения гнойно-септических осложнений приходится применять деэскалационную методику, которая заключается в максимально раннем назначении массивных доз антибиотика, спектр действия которого максимально охватывает всех возможных возбудителей с последующим (при получении результатов микробиологического исследования) переходом па препараты более узкого спектра.
В этом плане наиболее эффективными в настоящее время являются антибиотики из группы карбоненемов. Несмотря на более чем 20-летнее использование, уровень устойчивости к ним клинически значимых возбудителей остается низким, возможно из-за их устойчивости к бета-лактамазам, выделяемым микроорганизмами для разрушения антибиотиков.
5) Интенсивное парентеральное и энтералъное питание. В первую очередь необходимо обеспечить введение аминокислот, вследствие их усиленного потребления для сохранения барьерной функции кишечника и клеток иммунной системы. Наиболее эффективными в этом смысле являются смеси для энтерального введения, содержащие омега-3 жирные кислоты, глютамин, аргинин, а также пектин.
6) Активные методы детоксикации. Среди методов экстракорпоральной детоксикации у пострадавших с множественными и сочетанными ранениями шеи, груди и живота, осложненными сепсисом, самым распространеным и хорошо изученным является плаз-маферез.
Положительный эффект плазмафереза основан на удалении высокомолекулярных белков острой фазы воспаления, а также нормализации реологических свойств крови. Метод позволяет быстро удалять из циркулирующей крови токсины (как водорастворимые, так и связанные с белками), свободный миоглобин, активированные компоненты свертывающей системы крови, С-реактивный белок, цитокины, комплемент, лизосомальные ферменты, аутоантитела, иммунные комплексы и просто обломки разрушенных клеток и клеток в состоянии апоптоза.
Метод существует в двух модификациях: прерывистый и непрерывный. Не останавливаясь на деталях этих модификаций, необходимо подчеркнуть, что у пострадавших в критическом состоянии используют непрерывную технологию, которая меньше оказывает отрицательное влияние на гемодинамику.
7) Торможение образования медиаторов воспалительной реакции. В настоящее время большие надежды возлагаются на восполнение дефицита селена — микроэлемента, входящего в состав фермента (глютатионпероксидазы), отвечающего за антиоксидантную систему защиты клеток. В частности, достаточное количество этого фермента обеспечивает преобразование свободных радикалов в спирты и таким образом сохраняет целость клеточной мембраны.
Препараты селена при лечении гнойно-септических осложнений применяются в виде пентагидрата селенита натрия. К сожалению, в настоящее время пока нет возможности четко определить закономерности в реакциях и взаимодействиях сотен различных медиаторов, а следовательно, и избирательную нейтрализацию активности циркулирующих в крови медиаторов, как воспалительных, так и противовоспалительных.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Диагностика гнойных и септических осложнений ранений шеи, груди и живота
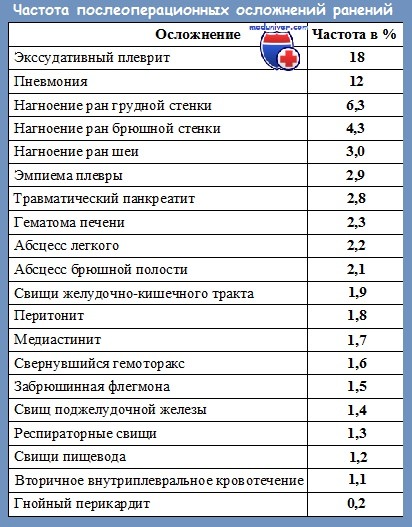
Послеоперационные осложнения при сочетанных ранениях шеи, груди и живота в наших наблюдениях имели место у 18,7 % пациентов, причем у одного пациента наблюдали от 1 до 5 различных осложнений.
Причиной острой дыхательной недостаточности, развивающейся в раннем послеоперационном периоде, чаще всего являются ателектазы ткани легкого, гипергидратация, острый респираторный дистресс-синдром и пневмония.
Острая сердечно-сосудистая недостаточность развивается вследствие некомпенсированной гиповолемии. Позже может наблюдаться развитие почечной, печеночной недостаточности, тромбоэмболических осложнений и полиорганной недостаточности.
Гнойно-септические осложнения ранений шеи, груди и живота
Гнойные осложнения, как известно, проходят неспецифическую стадию острой фазы воспаления, которая характеризуется усиленной продукцией гормонов, активизацией нейтрофилов и макрофагов. Течение процесса определяется балансом воспалительных и противовоспалительных медиаторов. Существование механизма сохранения такого баланса создает предпосылки для заживления ран, сохранения гомеостаза и уничтожения микроорганизмов в очаге воспаления.
Однако если на фоне декомпенсированной кровопотери и иммунодефицита превалируют медиаторы воспалительного каскада, их деструктивное действие начинает доминировать.
Нейтрофилы и макрофаги, активизированные в результате жизнедеятельности бактерий, выделяют чрезмерное количество биологически активных веществ, которые повреждают клетки путем пероксидации мембранных фосфолипидов, денатурации ферментов, нуклеиновых кислот базальных мембран и полисахаридных комплексов межуточной ткани. Основная роль в этом процессе принадлежит синтезу простагландинов и лейкотриенов из арахидоновой кислоты и оксида азота, в результате чего образуются свободные радикалы, легко соединяющиеся с любыми белковыми структурами.

Нарушается функция эндотелия капилляров с повышением проницаемости, формируется системная воспалительная реакция с дизрегуляцией метаболизма. Прогрессирование (генерализация) воспалительных реакций приводит к сепсису, проявлением которого служит резкое нарастание эндогенной интоксикации, гиперметаболизм, синдром диссеминированного внутрисосудистого свертывания и полиорганная недостаточность.
Клинические проявления гнойно-септических послеоперационных осложнений на фоне интенсивной инфузионной и антибактериальной терапии появляются поздно и в стертой форме. Действительно, появление на фоне нормальной температуры тела энцефалопатии, жажды, тахикардии, болевых ощущений в области шеи, груди и живота при глубоком дыхании свидетельствует о развернутой воспалительной реакции и хирургическое вмешательство по поводу этого гнойного осложнения может быть запоздалым. Поэтому главное внимание должно быть уделено следующим лабораторным показателям:
• появление сдвига лейкоцитарной формулы влево со снижением процентного содержания лимфоцитов;
• нарастание количества средних молекул;
• изменения иммунограммы;
• повышение содержания С-реактивного белка, интерлейкина и прокальцитонина.
Высокое содержание в крови С-реактивного белка, интерлейкина-6 и прокальцитонина с большой достоверностью свидетельствует о наличии у пострадавшего сепсиса: уровень прокальцитонина при этом может повышаться (в прямой зависимости от тяжести течения гнойного процесса) до 500 нг/мл (при норме — 0,5 нг/мл).
В то время как содержание в крови только прокальцитонина в первые несколько суток после сочетанных ранений груди и живота может повышаться, по данным М. Maier и соавт., до 9-11 нг/мл.
С появлением таких объективных методов, как УЗИ и КТ, диагностика послеоперационных осложнений стала возможной на самых ранних этапах.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лечение гнойных и септических осложнений ранений: иммунная терапия
Как известно, гнойно-септические процессы сопровождаются угнетением функциональной активности иммунокомпетентных клеток за счет иммуносупрессивного действия экзо- и эндотоксинов микроорганизмов, которое может усилиться под влиянием антибиотикотерапии. При этом уровень свободного эндотоксина увеличивается в плазме крови до 200 раз, вследствие его высвобождения из погибших бактерий, что, несмотря на уменьшение бактериемии, вносит свой вклад в усугубление симптомокомплекса гнойного процесса, провоцируя развитие генерализованной воспалительной реакции [Shenep J.L. et al., Talan D. A.].
Неэффективная терапия антибиотиками без учета спектра микрофлоры пострадавших и при несоблюдении оптимальных сроков ее проведения не только утяжеляет общее состояние больного и способствует формированию резистентных штаммов, но и увеличивает продолжительность лечения и его общую стоимость в среднем на 30%. По данным ВОЗ, летальность в группе больных с гнойно-септическими осложнениями значительно (в 10 и более раз) превышает летальность в группе больных с аналогичными исходными состояниями, но не имевших инфекционных осложнений.
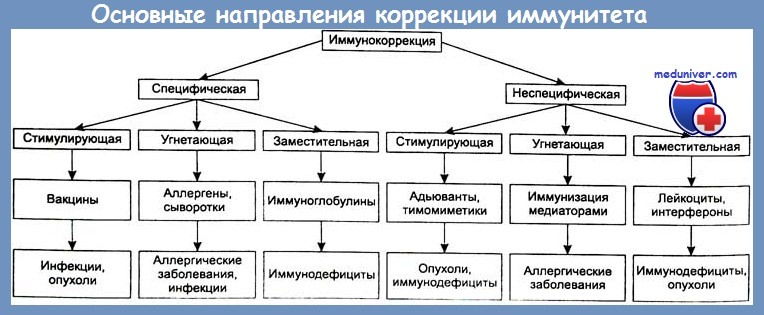
Важную роль в предотвращении генерализации местного гнойного осложнения играет адекватная иммунная терапия. Согласно современным представлениям, используются два вида воздействия на иммунный статус пострадавшего — стимулирующая и заместительная терапия.
Что касается применения иммуностимуляторов (иммуномодуляторов) при гнойно-септических осложнениях, то рядом серьезных исследований доказано, что не всегда их включение в комплекс лечения осложнений сопровождается заметным клиническим эффектом. Как справедливо отметили И. А. Ерюхин и соавт., включение иммунокорригирующих препаратов в комплексное лечение гнойно-септических осложнений хорошо обосновано теоретически, но не всегда имеет яркое клиническое подтверждение их эффективности, особенно при лечении сепсиса. Возможно, как считают авторы, это происходит потому, что учитывается тяжесть процесса, а не его причины. Кроме того, отсутствуют простые и теоретически обоснованные лабораторные и клинические методы исследований, позволяющие идентифицировать динамику воспалительного и иммунного ответа, в том числе -динамику системной воспалительной и противовоспалительной реакций [Bone R. С.].
Более эффективными являются иммуноглобулиновые препараты и иммунные антибактериальные плазмы, целесообразность применения которых обусловлена механизмами их действия, а также патогенезом иммунодефи-цитных состояний при тяжелой травме и гнойно-септических осложнениях [Румянцев А. Г. и др., Mitov I.G., Terziiski D.G., Zanetti G. et al., Talan D.A.].
Иммуноглобулин для внутривенного введения имеет ряд существенных преимуществ по сравнению с иммуноглобулинами для внутримышечного введения, так как позволяет в течение короткого времени создать в крови эффективные терапевтические концентрации антител при минимальном риске развития побочных действий. Первичным эффектом иммуноглобулинов является их способность к специфическому распознаванию чужеродных агентов и связывание с ними. Часто само связывание антителами антигенов ведет к выраженному защитному эффекту и не требует активного подключения механизмов неспецифической защиты, как это бывает в случаях нейтрализации токсинов антитоксическими иммуноглобулинами.
Высокоэффективны также и нейтрализующие антитела, которые распознают и нейтрализуют антигены возбудителей, обеспечивающих инвазивность, т. е. способствуют прекращению распространения инфекции. Следует отметить, что не всегда специфическое взаимодействие антител с антигеном приводит к выраженному защитному эффекту. В этих случаях подключаются вторичные неспецифические механизмы, которые, в свою очередь, также стимулируются антителами.
Эффективность иммунотерапии гнойно-воспалительных осложнений в зависимости от сроков её проведения
| Сроки проведения иммунотерапии от первых признаков гнойного осложнения (недели) | % хороших и отличных результатов санации ран и полостей | % хороших и отличных результатов нормализации иммунограммы | Длительность стационарного лечения (дни) |
| 1-я | 885 | 92 | 32+1,8 |
| 3-4-я | 48 | 58 | 49+3,4 |
Вторичные (неспецифические) эффекты иммуноглобулинов — это активизация неспецифических защитных процессов, направленных на нейтрализацию и выведение чужеродных антигенов. Одним из этих механизмов является взаимодействие одного из фрагментов молекулы иммуноглобулина (Fc-фрагмент) с компонентами системы комплемента. За счет активации комплемента происходит лизис комплекса антиген-антитело.
Имуноглобулипы не только связывают генетически чужеродные организму молекулы и клетки, но и выполняют эффекторные и иммуномодулирующие функции, обусловленные усилением физиологических последствий связывания антигена. Кроме того, иммуноглобулины способны регулировать активность Т- и В-лимфоцитов, макрофагов, многократно усиливать антигенспецифический ответ, опосредованный Т-лимфоцитами и комплементом [Климович В.Б., Imbach P. et al.].
Положительный результат от включения в комплексное лечение как стандартного донорского иммуноглобулина, так и обогащенного IgM — пентаглобина — зависит от дозы и сроков их применения. Лишь при условии нейтрализации бактериальных эндотоксинов в течение первых суток после тяжелой травмы или от начала септического процесса можно рассчитывать на уменьшение биологических последствий эндотоксемии.
Одним из препаратов заместительного действия, компенсирующего функциональную недостаточность нейтрофилов у пациентов с гнойно-воспалительными осложнениями, является лейкокоицентрат донорской крови. Приемлемой считается терапевтическая доза, включающая более 1010 клеток, предпочтительнее доза, близкая к 1011 клеток. Трансфузии меньшего количества лейкоцитов не сопровождаются выраженным клиническим эффектом [Hubel K.D.C. et al., Van Buzik J.-A.H., Weisdorf D. J., Ying-Wei Lin et al.].
Несмотря на определенные успехи клинического использования лейкоцитной массы при лечении септических больных, переливание гранулоцитов не вошло в широкую практику лечения инфицированных пациентов с лейкопенией или фагоцитарной недостаточностью. Это обусловлено прежде всего тем, что имеются трудности получения этого компонента крови и его хранения. Установлено, что гранулоциты начинают терять свои функциональные свойства уже через 6 ч после их выделения, поэтому перелиты они должны быть в течение 12 ч после заготовки.
Важным условием применения лейкоцитной массы является строгое соблюдение схемы введения: интервал между трапсфузиями не должен быть более 2 сут. В противном случае можно спровоцировать иммунизирующий эффект, сопровождающийся выработкой противолсйкоцитарных антител. В то же время введение лейкоцитов иммунокомпрометированным пациентам с Т-лимфопенией и относительной недостаточностью Т-хелперов не сопровождается образованием противолейкоцитарных антител.
Суммируя накопленный опыт применения иммунных препаратов в лечении гнойно-воспалительных осложнений в послеоперационном периоде у пострадавших с множественными и сочетанными ранениями груди, следует признать, что использование иммунотропных препаратов существенно улучшает результаты лечения. Наиболее высокая эффективность лечения гнойно-воспалительных осложнений отмечена при проведении иммунотерапии на фоне адекватной антибактериальной, инфузионной, трансфузионной терапии, направленной на улучшение микроциркуляции, уменьшение интоксикации и способствующей выведению иммунных комплексов.
Сравнительный анализ таких показателей, как продолжительность периода санации гнойного очага, улучшение состояния больного, длительность стационарного лечения и положительная динамика параметров иммунограм-мы, свидетельствует о необходимости применения иммунотропных препаратов в ранние сроки развития гнойных осложнений. В наших наблюдениях при таком подходе удалось существенно сократить период купирования гнойного процесса у 88% больных, в результате чего средняя продолжительность лечения больных этой группы составила 32±1,8 дней. Назначение иммунотропных препаратов позже 20-х суток от начала гнойно-воспалительного процесса сопровождалось улучшением состояния и ускорением процесса очищения гнойных полостей только у 48 % больных. Длительность стационарного лечения у этих пациентов была значительно большей и составила в среднем 49+3,4 дня.
Положительная динамика параметров иммунограммы и клинического анализа крови выявлена у 92% больных при назначении иммунотерапии в ранние сроки и у 58% больных — при её проведении в поздние сроки от начала гнойно-воспалительного осложнения.
Необходимо отметить, что не во всех случаях применения иммунопрепаратов в оптимальные сроки были отмечены положительные сдвиги иммунного гомеостаза. В трех наблюдениях после применения тактивина и в двух - - миелопида в составе комплексного лечения пострадавших с гнойными осложнениями вопреки ожидаемому эффекту было отмечено усиление дисбаланса клеточных звеньев иммунной системы со снижением числа Т- и В-клеток и более выраженное подавление кислородного метаболизма нейтрофилов, обеспечивающего бактерицидность в процессе фагоцитоза.
Как правило, отрицательная динамика параметров иммунограммы имелась при проведении иммунотерапии на фоне сохраняющегося гнойного очага, в том числе и при его неадекватном дренировании. В таких случаях иммуносупрессивное действие гнойной интоксикации превалировало над иммуностимулирующим влиянием использованных препаратов. У этих пациентов с помощью иммунотерапии удавалось лишь предупредить развитие фатальной иммунодепрессии при продолжающейся гнойной интоксикации. Отсутствие положительной динамики иммунограммы на фоне лечения является прогностически неблагоприятным признаком и свидетельствует о том, что характер гнойного процесса приобретает признаки хронического. Это заставляет хирурга совместно с клиническим иммунологом искать причины неблагоприятного развития событий, в первую очередь — исключая наличие недренированных очагов гнойной инфекции.
Таким образом, выбор иммунопрепаратов определяется направленностью и степенью изменения параметров отдельных звеньев иммунной системы. Лейкопения и снижение фагоцитарной активности нейтрофилов при наличии гнойного процесса диктуют необходимость применения препаратов, активирующих лейкопоэз и созревание лейкоцитов, а также проведение заместительной терапии донорской лейкоцитной массой. Если на ранней стадии развития гнойного процесса имеется лимфопения и снижение фагоцитарной активности нейтрофилов, показана комбинация тимических пептидов или миелопептидов с иммуноглобулином для внутримышечного введения. При сочетанной недостаточности фагоцитарного и лимфоцитарного звеньев иммунной системы на фоне сохраняющейся интоксикации и повышения уровня циркулирующих иммунных комплексов эффективно (помимо использования иммунокорригирующих препаратов) проведение лечебного плазмафереза.
Видео иммунограмма в норме и при патологии
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Акушерский сепсис – это системное осложнение инфекций женской мочеполовой системы и молочной железы, развившееся во время беременности, изгнания плода и в послеродовом (послеабортном) периоде. Проявляется тяжёлым общим состоянием, нарастающей слабостью, лихорадкой, сердцебиением, одышкой, снижением артериального давления. По мере прогрессирования присоединяются помутнение сознания, выраженное затруднение дыхания, резкое уменьшение объёма отделяемой мочи. Диагноз устанавливается на основании данных физикального осмотра, УЗИ, лабораторных исследований крови. Лечение комплексное: хирургическая санация гнойников, антибиотикотерапия, интенсивная терапия.
МКБ-10
Общие сведения

Причины
Акушерский сепсис всегда вторичен, его источником является локальная инфекция. Основные возбудители гнойно-воспалительных заболеваний – представители оппортунистической флоры (пиогенный стрептококк, стрептококк группы B, золотистый стафилококк, кишечная палочка, клебсиелла, протей, пептококк, пептострептококк, бактероид, грибок кандида), чаще всего населяют нижние отделы мочеполовой сферы и кишечника и приводят к патологии только под воздействием определённых факторов. К основным причинам и источникам инфицирования относятся:
- Хирургические операции и травмы тканей. Раневая поверхность служит воротами инфекции и способствует значительному снижению местного иммунитета. Гнойный процесс может стать исходом кесарева сечения, раннего отхождения околоплодных вод (при неправильном положении плода, многоплодии), полученных в родах разрывов и оперативных вмешательств на промежности.
- Лечебно-диагностические манипуляции. Возбудитель передаётся при контакте с обсеменённым инструментом, кроме того, микротравмы, полученные при исследовании, создают благоприятные условия для лимфо- и гематогенного заражения. В группе факторов риска - цервикальный серкляж, амниоцентез, кордоцентез, уретральная катетеризация, экстракорпоральное оплодотворение, многократные влагалищные исследования в ходе родов.
- Физиологические изменения, вызванные беременностью. Растущая матка сдавливает и смещает окружающие анатомические структуры, а прогестерон снижает тонус гладкой мускулатуры. Эти факторы приводят к нарушению уродинамики и создают предпосылки для развития гестационного пиелонефрита и уросепсиса.
- Застой грудного молока. В результате лактостаза происходит активный рост стафилококков, вызывающих мастит. Нарушение оттока молока – основная причина послеродовых абсцессов и флегмон.
С другой стороны, гнойные процессы могут осложниться сепсисом лишь при условии гипо- или гиперреактивности иммунного ответа. Функциональные расстройства иммунной системы приводят к усилению активности оппортунистических микроорганизмов и формированию патологической реакции на гнойное воспаление. К факторам риска относятся ожирение, сахарный диабет, анемия, острые и хронические воспаления (генитальные и экстрагенитальные), недостаток питания, возраст старше 35 лет.
Патогенез
Массивное поражение ткани инфекцией сопровождается перманентным или периодическим выбросом в кровоток медиаторов воспалительного ответа, что истощает регуляторную функцию иммунной системы и запускает ряд неконтролируемых реакций в дистантных органах и тканях. В результате повреждается эндотелий, ухудшается микроциркуляция (перфузия), снижается транспорт кислорода. Эти изменения приводят к нарушениям гомеостатической регуляции, развитию синдрома острой полиорганной недостаточности (СПОН) и ДВС-синдрома.
Желудочки сердца расширяются, происходит снижение сердечного выброса, нарушается сосудистый тонус. В лёгких образуются ателектазы, развивается респираторный дистресс-синдром. В результате снижения объёма циркулирующей крови (ОЦК) и гемостатических нарушений ухудшается микроциркуляция почечной ткани и кровоснабжение коркового слоя с последующей острой функциональной недостаточностью. В печени нарушаются обменные процессы, а недостаток кровоснабжения влечёт формирование некротических участков. Гипоперфузия приводит к патологической проницаемости слизистой оболочки кишечника с выбросом токсинов и микроорганизмов в лимфатическую систему, в результате ишемии на стенках органов ЖКТ образуются стрессовые язвы. Нарушение обменных процессов и микроциркуляции головного мозга обусловливает неврологические расстройства.
Классификация
Акушерский сепсис классифицируют по разным критериям: по возбудителю, по метастатическому распространению (септицемия, характеризующаяся наличием лишь первичного очага, и септикопиемия – наличие гнойных отсевов в других тканях и органах) или по клиническому течению. В современном акушерстве принята классификация, отражающая последовательные этапы формирования системной воспалительной реакции:
- Синдром системного воспалительного ответа (ССВО). Предвестник септического состояния – системная реакция на воспалительный процесс любой этиологии. Устанавливается при наличии воспалительного заболевания и на основании не менее двух клинических проявлений ССВО: тахикардии, тахипноэ или гипервентиляции, гипо- или гипертермии, лейкоцитоза (лейкопении) или повышения доли незрелых нейтрофилов. У 12% больных сепсисом признаки ССВО отсутствуют.
- Сепсис. Патологический системный ответ на первичную или присоединившуюся инфекцию. Диагноз выставляется при наличии инфекционного очага или на основании верифицированной бактериемии и остро развившихся признаков функциональной недостаточности двух и более органов (СПОН).
- Септический шок. Крайняя форма патологической реакции. Сопровождается выраженными, стойкими, плохо поддающимися медикаментозной коррекции гипотензией и нарушением перфузии.
Симптомы акушерского сепсиса
Послеродовый сепсис манифестирует на второй-третий день после изгнания плода сукровично-гнойными выделениями, явлениями общей интоксикации (тахикардией, одышкой, слабостью, потерей аппетита, иногда рвотой и диареей) и повышением температуры до 39-40°C с ознобами. Гипертермия обычно устойчивая, однако могут наблюдаться формы с постепенным повышением или большим разбросом суточной температуры и редкими приступами ознобов. Отмечаются боли в животе или молочных железах, могут регистрироваться генерализованные высыпания. Выраженность симптомов и длительность заболевания различны в зависимости от формы клинического течения.
Для молниеносного акушерского сепсиса нарастание симптоматики характерно в течение суток, при острой форме клиническая картина разворачивается в течение нескольких дней. При подострой форме признаки выражены менее ярко, процесс развивается неделями. Хрониосепсис характеризуется слабо выраженными изменениями (субфебрилитетом, повышенным потоотделением, головной болью и головокружениями, сонливостью, диареей) и вялым течением в течение многих месяцев. Рецидивирующая форма представляет череду затуханий (периодов ремиссии без заметных проявлений) и обострений (периодов с яркой симптоматикой) и характерна для септикопиемии, когда ухудшение состояния обусловлено повторными эпизодами образования вторичных гнойников.
Особенно тяжёлым течением и рядом специфических признаков отличается анаэробный сепсис, ассоциированный с гангреной матки. Заболевание протекает молниеносно или остро, сопровождается интенсивной некупируемой болью внизу живота, крепитацией и усилением боли при пальпации матки, выделением из влагалища газа и зловонной жидкости с пузырьками воздуха, бронзовой окраской кожи, бурым цветом мочи. Явления септического шока проявляются уже в самом начале болезни.
Осложнения
У больных, переживших острый период, может развиться тяжёлое, нередко летальное осложнение – суперинфекция. Значительное ухудшение качества жизни или гибель пациентки часто влекут другие последствия сепсиса: сопряжённые с ишемией или гнойным метастазированием необратимые органные изменения почек, печени, лёгких, сердца, головного мозга, прободение и кровотечения из гастроэнтеральных стресс-язв, артериальная тромбоэмболия и флеботромбоз. Сепсис у беременных может вызвать преждевременные роды, гибель плода, энцефалопатию и ДЦП рожденного ребенка.
Диагностика
В диагностике акушерского сепсиса участвуют акушер-гинеколог, терапевт, реаниматолог, микробиолог, осложнённые формы требуют привлечения нефролога, кардиолога, невролога, гепатолога. В ходе гинекологического исследования и общего осмотра по наличию очага гнойного воспаления в органах малого таза или молочной железе, а также признакам ССВО можно заподозрить септическое состояние. Проводятся следующие исследования:
- Определение возбудителя. Культуральный анализ крови и влагалищного мазка позволяют выявить инфекционный агент и подобрать эффективный препарат для лечения инфекции. Бактериемия подтверждает наличие септического процесса. При отсутствии бактериемии для дифференцирования локальной и генерализованной инфекции проводится тест на прокальцитонин.
- Инструментальные исследования. УЗИ малого таза и почек подтверждает (выявляет) наличие первичного гнойного очага в мочеполовых органах. УЗИ органов брюшной полости, рентгенография органов грудной клетки, ЭхоКГ позволяют обнаружить вторичные абсцессы в печени, лёгких, сердце.
- Клинико-биохимические анализы крови. Общий анализ крови обнаруживает лейкоцитоз, лейкопению, сдвиг лейкоцитарной формулы влево – значения, косвенно подтверждающие септическое состояние. Данные биохимического исследования говорят о нарушениях водно-электролитного баланса и функций почек, печени. Анализ газов крови выявляет нарушения КЩС и дыхательную недостаточность. По результатам коагулограммы определяются нарушения свёртывания крови. Тестирование уровня лактата в плазме позволяет обнаружить тканевую гипоперфузию и оценить тяжесть шока. Иммунограмма свидетельствует о расстройствах иммунной активности.
Акушерский сепсис следует дифференцировать с гестозами, амниотической эмболией и тромбоэмболией лёгочной артерии, острыми инфекциями (тяжёлым гриппом, бруцеллёзом, тифом, малярией, милиарным туберкулёзом), острым панкреатитом, лейкозами, лимфогранулематозом. Для дифференциальной диагностики может потребоваться консультация кардиохирурга, инфекциониста, фтизиатра, онкогематолога.
Лечение акушерского сепсиса
Лечебные мероприятия проводятся в условиях гинекологического или обсервационного акушерского отделения, больные с тяжёлыми формами сепсиса переводятся в отделение реанимации и интенсивной терапии. Лечение комплексное, включает хирургические и консервативные методы и направлено на борьбу с инфекцией и коррекцию витальных функций:
- Инфузионная терапия. Лечение предусматривает коррекцию гомеостатических расстройств (гипотонии, коагулопатии, нарушений кислотно-щелочного и водно-солевого и обмена, дефицита ОЦК), восстановление тканевой перфузии, дезинтоксикацию. С этими целями вводятся солевые и коллоидные растворы, альбумин, криоплазма, инотропы и вазопрессоры.
- Антибактериальная терапия. Направлена на уничтожение инфекционного агента с целью блокировки воспалительного каскада. Стартовое лечение включает внутривенное введение комбинации препаратов широкого спектра. После выделения возбудителя приступают к этиотропной антибиотикотерапии.
- Хирургическое лечение. Ликвидация гнойных очагов повышает эффективность интенсивной терапии и улучшает прогноз. Лечение предполагает санацию первичного и вторичных очагов – вскрытие и опорожнение абсцессов, кюретаж, вакуум-аспирацию или удаление матки (гистерэктомию).
В случае необходимости проводится искусственная вентиляция лёгких, энтеральное питание пациентки. Дополнительные методы интенсивной терапии включают применение кортикостероидов, выполнение хирургической детоксикации (плазмаферез, гемосорбция, гемофильтрация) после оперативного лечения нагноений, иммунотерапию.
Прогноз и профилактика
На ранних стадиях, когда не развились выраженные признаки СПОН, устойчивая гипотензия и ДВС-синдром, прогноз благоприятный. При развитии септического шока смертность может достигать 65% (в среднем – 45%). Профилактические мероприятия состоят в своевременном лечении воспалительных заболеваний (как на этапе планирования, так и в течение беременности), борьбе с внебольничными вмешательствами (внутриматочными и вагинальными манипуляциями, криминальными абортами, домашними родами), рациональной превентивной антибиотикотерапии при оперативных вмешательствах, полноценном питании, стабилизации уровня глюкозы в крови при сахарном диабете.
3. Клинические рекомендации по диагностике и лечению тяжелого сепсиса и септического шока в лечебно-профилактических организациях Санкт-Петербурга. – 2016.
4. Гнойно-воспалительные заболевания и сепсис в акушерстве. Клинические рекомендации (протокол лечения)/ Коллектив авторов. – 2015.
Читайте также:

