Хирургическое вмешательство инфекционного эндокардита
Обновлено: 23.04.2024
Лечение септического эндокардита (СЭ), главным образом, является задачей терапевтов. В тех случаях, когда повреждение клапана прогрессирует или подавить инфекционный процесс антибиотиками не представляется возможным, показано срочное оперативное лечение, даже до полного завершения курса антибиотикотерапии. Летальность при таких операциях до настоящего времени остается достаточно высокой, так как в данной ситуации хирурги сталкиваются с двумя основными проблемами: нарушением центральной гемодинамики, обусловленной повреждением клапана и острой инфекционной интоксикацией. Кроме того, всегда остается высоким риск реинфекции.
В настоящее время выполнено множество исследований по различным аспектам лечения данной патологии, поэтому, в основном, показания к операции послеоперационное ведение больных СЭ стандартизованы. В данной работе мы представили наш опыт хирургического лечения септического эндокардита. В период с 1982 по 1998 годы оперировано 212 больных СЭ. Мужчин оперировано 148 (69,8%), женщин 64 (30,2%) в возрасте от 18 до 61 года (в среднем, 39,9+6,3 года).
У 91 (42,9%) больного выявлен первичный СЭ, у 101 (47,6%) – вторичный СЭ, главным образом на фоне ревматического порока сердца (кроме того, вторичный СЭ наблюдался у больных с врожденными пороками сердца и после закрытых операций). Протезный эндокардит наблюдался у 20 больных (9,4%).
Таблица 1 Данные о пациентах.
Всего
Количество больных СЭ
Основная локализация СЭ – аортальный клапан (113 больных), второе место по частоте занимает митральный клапан, СЭ трикуспидального клапана встречается реже, однако, следует заметить некоторое увеличение частоты данной патологии в последнее время. Абсолютное большинство больных находилось в IV-ом и в III-ем функциональном классе (NYHA). Некоторые больные поступали в клинику в состоянии кардиогенного шока. Всем больным при поступлении начиналась массивная двух-трехкомпонентная антибактериальная терапия. Длительность антибактериальной терапии колебалась от 2 до 6 недель (в среднем 2,5 недели), кроме тех случаев, когда больные оперированы по экстренным или неотложным показаниям через 6-48 часов после поступления в клинику (7 больных).
Диагноз ставился на основании клинических данных и данных эхокардиографии (после 1984 года, когда появилась возможность выполнения данного метода исследования). Анализ крови на бактериологическое исследование брали из артерии и вены. Чаще положительная гемокультура обнаруживалась в артериальной крови, положительные результаты не превышали 40%. Наиболее частым этиологическим фактором был золотистый и эпидермальный стафилококк, реже – грамм-отрицательные микроорганизмы и грибковая флора. Наиболее информативным методом в диагностике СЭ является эхокардиография, при которой выявляются вегетации, их локализация, распространенность и другие морфологические и функциональные признаки СЭ. В ранний период наблюдения многим больным выполнялось инвазивное исследование сердца (катетеризация камер, аортография, вентрикулография).
Основным показанием к операции была прогрессирующая сердечная недостаточность, которая наблюдалась у 90% больных, наличие вегетаций, перфораций створок, дисфункция протезов клапанов.
Виды оперативных вмешательств представлены в таблице 2.
Таблица 2 Виды выполненных операций при СЭ
Всего
Все операции выполнялись в условиях гипотермического искусственного кровообращения с умеренной гемодилюцией, в КХЦ ММА им. И.М. Сеченова применяется изолированная коронарная перфузия, в НИИТиИО МЗ РФ защита миокарда осуществляется с применением кристаллоидной кардиоплегии. Протезирование трикуспидального клапана выполняется без пережатия аорты при нормотермии.
После резекции створок клапана производится обязательная ревизия и санация фиброзного кольца, очаги инфекции максимально возможно санируются. На ранних этапах выполнялись удаления вегетаций и ушивание парапротезных фистул при протезном эндокардите, но все подобные попытки закончились плачевно – либо потребовалось повторное протезирование клапана, либо больные погибли. Это было связано с неполной санацией инфекции в ложе и манжете протеза. В настоящее время при протезном эндокардите мы придерживаемся тактики репротезирования и максимальной санации фиброзного кольца.
Следует отметить, что при протезировании клапанов у больных СЭ существуют определенные трудности – истонченное или полностью разрушенное фиброзное кольцо требует наложения швов на прокладках (тефлоновых или специальных из полихлорвиниловых трубочек), перед имплантацией протез и шовный материал замачиваются в растворе антисептика. Все инфицированные или некротизированные структуры необходимо резецировать. После резекции стенок абсцесса необходима обработка антисептиком. Дефекты межжелудочковой перегородки закрывались заплатами из аутоперикарда или тефлона, также обработанного антисептиком.
Для протезирования клапанов в абсолютном большинстве случаев использовались механические протезы (ЭМИКС, МЕДИНЖ, КАРБОМЕДИКС). Для протезирования трикуспидального клапана в последнее время мы применяем биологические протезы, в связи с высокой частотой дисфункции механических протезов.
В послеоперационном периоде основные усилия были направлены на ликвидацию инфекции. До определения гемокультуры применялась двух- и трехкомпонентная антибактериальная терапия, проводилась коррекция гомеостаза.
На ранних этапах изучения данной проблемы летальность была достаточно высокой, это, в общем, соответствует данным литературы. В этот период времени хирургическая тактика в отношении СЭ только разрабатывалась (выполнялись попытки клапансохраняющих операций (удаление гнойно-некротических масс, вегетаций), в предоперационном периоде старались консервативными методами купировать инфекционный процесс, при протезном эндокардите не всегда сразу выполняли репротезирование клапанов). Поэтому основным осложнением операции на ранних этапах являлся рецидив СЭ или развитие протезного эндокардита, что приводило к еще большему утяжелению и без того достаточно сложных больных. В большинстве таких случаев усугублялась сердечная недостаточность на фоне септического шока и послеоперационной травмы, развивалась полиорганная недостаточность, ДВС и т.д.
КХЦ ММА им. И.М. Сеченова ММА
Из операционных осложнений следует отметить раннее кровотечение, мы связываем это, в основном, с грубыми нарушениями в системе гемостаза, анемией, гипопротеинемией, поэтому коррекция этих нарушений на операционном столе и в раннем послеоперационном периоде является важным фактором, определяющим дальнейший прогноз.
Адекватная защита миокарда также является очень важным фактором для определения прогноза развития сердечной недостаточности. Кристаллоидная кардиоплегия имеет явное преимущество перед изолированной коронарной перфузией. Это наглядно демонстрирует разница в результатах между КХЦ ММА им. И.М. Сеченова и НИИТиИО МЗ РФ, когда при прочих равных условиях, защита миокарда осуществляется по-разному.
При анализе факторов риска, мы обнаружили высокую прогностическую значимость исходного состояния больного (функциональный класс, возраст, почечная недостаточность, использование прямых катехоламинов в предоперационном периоде), поэтому мы воздерживаемся в последнее время от операций у больных с неконтролируемой сердечной недостаточностью. Также важное значение имеет как можно более срочная операция при установлении диагноза СЭ. Мы назначали больного на операцию при обнаружении одного из следующих признаков: прогрессирующая сердечная недостаточность, наличие морфологических признаков СЭ (вегетаций на клапанах или протезе, перфорации створок, абсцессы фиброзного кольца) по данным эхокардиографии, признаки дисфункции протеза по данным ЭХОКГ.
Локализация очага СЭ, наличие абсцесса фиброзного кольца клапана или интрамиокардиального абсцесса, многоклапанное поражение в нашем наблюдении не оказали существенного влияния на результат операции.
Полная АВ-блокада развилась у 3 больных, их них у 2 – после протезирования трикуспидального клапана (в одном случае кроме протезирования клапана выполнялась пластика межжелудочковой перегородки), что потребовало, в дальнейшем, имплантации ЭКС.
Протезный эндокардит развился у 12 больных, 11 из которых оперированы в 1982-1987 годах, что мы связываем с неправильной тактикой ведения, недостаточно радикальной санацией очага СЭ и отсутствием профилактики (обработки протеза, шовного материала и фиброзного кольца антисептиком).
Хирургическое лечение СЭ до настоящего времени остается наиболее сложной проблемой клапанной хирургии. Не смотря на значительные успехи в антибактериальной терапии, летальность при лечении данной патологии остается достаточно высокой, кроме того, имплантация протезов клапанов сердца в ткани, пораженные инфекционным процессом, сопряжена с высоким риском рецидива СЭ. Тем не менее, мы считаем, что своевременна операция, возможно более радикальная санация очага инфекции, адекватная антибактериальная терапия позволяют снизить риск операции и рецидива СЭ.
СПИСОК ЛИТЕРАТУРЫ.
1. Г.И. Цукерман, И.И.Скопин и др. Реконструктивные вмешательства на трикуспидальном клапане при активном септическом эндокардите //Грудн. и сердечно-сосудистая хирургия.-1993.-5.-С.53-57.
2. Шевченко Ю.Л. Хирургическое лечение инфекционного эндокардита // Дис. д-ра мед. Наук. Л. 1986. 447 с.
3. Aranki SF, Santini F & Adams DH et al.. Aortic valve endocarditis. Determinants of early survival and late morbidity. Circulation 1990, 90:Suppl 2:175-182.
Arbulu A & Asfaw I. Management of infective endocarditis: 17 years' experience. Ann Thorac Surg 1987, 43:144-149.
4. Mullany CJ, McIsaacs AI, Rowe MH & Hale GS. The surgical treatment of infective endocarditis. World J Surg 1989, 13:132-136.
5. Verheul HA, van den Brink RBA, van Vreeland T, Moulijn AC, Duren DR & Dunning AJ. Effects of changes in management of active infective endocarditis on outcome in a 25-year period. Am J Cardiol 1993, 72: 682-687.
Данные об авторах:
1) Владимир Александрович Чернов – доктор медицинских наук, профессор Научно-исследовательского института трансплантологии и искусственных органов МЗ РФ.
Шевченко Ю.Л., Попов Л.В., Тюрин В.П., Гороховатский Ю.И., Василашко В.И., Назаров В.А., Гудымович В.Г., Асташев П.Е., Мамадалиев Д.М.
Национальный медико-хирургический Центр им. Н.И. Пирогова, Москва
Инфекционный эндокардит (ИЭ) — это заболевание сердца, обусловленное воспалительными изменениями его внутренней выстилки, с появлением в зоне деструкции вегетаций микроорганизмов [Шевченко Ю.Л., 2015]. ИЭ является одним из наиболее тяжелых инфекционных заболеваний.
Ежегодно в мире появляются 200000 больных ИЭ. Летальность при консервативном лечении достигает ввиду быстро прогрессирующей сердечной недостаточности. Именно поэтому современное лечение этого заболевания немыслимо без раннего оперативного вмешательства, которое целесообразно выполнять в условиях многопрофильного стационара [Wallace A.G., et. al., 1965; Шевченко Ю.Л., 2015].
Абсцессы сердца при ИЭ возникают в случаев. При поражении клапана аорты (АК) частота их возникновения может достигать 40% и более, сочетаясь при этом с плохим клиническим прогнозом. Более частое поражение АК связано с такими его анатомическими особенностями, как бо́льшая гемодинамическая нагрузка и отсутствие кровеносных сосудов на полулунных заслонках, что делает инфекционный очаг недоступным для антибактериальной терапии.
Несмотря столь на далеко шагнувшие достижения кардиохирургического направления, не все особенности этого опасного состояния — гнойника в сердце — доступны для понимания. Даже сейчас столь грозная находка может перечеркнуть все старания оператора.
Для операций на открытом сердце при обширной деструкции структур левого желудочка (ЛЖ) и корня аорты характерна крайняя техническая сложность фиксации, обусловленная воспалением прилежащих тканей, что приводит к грандиозной реконструкции, увеличению длительности искусственного кровообращения (ИК) и операции в целом, повышенному риску массивной инвазии инфекционного агента. Нестандартность в выборе хирургической тактики и разнообразие реконструктивных приемов превращает операцию при абсцедирующей инфекции в искусство — искусство, как полагается, с муками поиска оптимального и наиболее простого решения. Современное лечение инфекционного эндокардита немыслимо без раннего оперативного вмешательства, которое целесообразно выполнять в условиях многопрофильного стационара, используя все преимущества коллективного опыта, накопленного за долгие годы практики.
В отделение кардиологии Пироговского Центра поступил пациент П., 43 лет с жалобами на общую слабость, одышку, учащенное сердцебиение и повышение температуры тела до 39,4ºС. Из анамнеза удалось выяснить, что больной с 2013 года отмечал склонность к повышению артериального давления (АД) до 170 и 90 mm Hg. Впервые обратился за помощью через 2 года, когда при обследовании и был выявлен порок АК.
Пациент был проконсультирован кардиохирургом Пироговского Центра. При подготовке к операции у стоматолога по месту жительства подвергся лечению пульпита одного из моляров, после чего появилась фебрильная лихорадка с ознобом. Больной был госпитализирован в отделение кардиологии городской больницы, где и выявили ИЭ с поражением АК. После безуспешной двухнедельной антибактериальной терапии пациент переведен в отделение кардиологии Пироговского Центра.
При объективном обследовании выявлены: петехиальная сыпь на коже предплечий, голеней и стоп; повышение температуры тела до 39,5ºС; увеличенная частота дыхательных движений (24/мин), ослабление везикулярного дыхания и влажные мелкопузырчатые хрипы в нижних отделах легких; патогномоничное для недостаточности АК повышение систолического и снижение диастолического АД (140/50 mm Hg); приглушенность основных тонов сердца и систоло-диастолический шум во всех точках аускультации, который проводился на сосуды шеи.
При эхокардиографии (ЭхоКГ) выявлен врожденный порок сердца — двустворчатый АК, а также вегетации как признак инфекционного процесса. У основания АК лоцировалось образование округлой формы — обширный абсцесс корня аорты, полость которого дренировалась как в ЛЖ, так и в аорту, что свидетельствовало о деструкции фиброзного основания клапана (рис. 1).
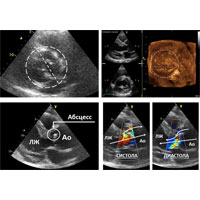
Рис. 1. Ультразвуковая картина левого желудочка сердца (ЛЖ) и корня аорты (Ао) в разных проекциях при трансторакальной ЭхоКГ с допплерографией и 3-D реконструкцией.
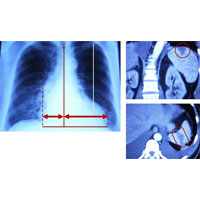
По данным рентгенографии органов грудной клетки отмечалось значительное расширение тени сердца и признаки застоя в малом круге кровообращения (рис. 2). При УЗИ органов брюшной полости и спиральной компьютерной томографии верхнем полюсе селезенки обнаружен очаг деструкции в виде равностороннего треугольника (инфаркт? септический метастаз?).
По результатам лабораторных исследований отмечалось повышение активности печеночных ферментов, концентрации амилазы, мочевины и креатинина; снижение концентрации альбумина; увеличение концентрации NT-proBNP; лейкоцитоз, увеличение СОЭ; нормохромная анемия средней степени тяжести. Таким образом, в динамике наблюдались признаки нарастающей сердечной и полиорганной недостаточности, сепсиса.
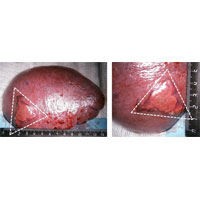
Первым этапом выполнена лапароскопическая спленэктомия. На рис. 3 удаленная селезенка с очагом деструкции, который, как показало дальнейшее гистологической исследование, был представлен инфарктом. Второй этап был кардиохирургическим.
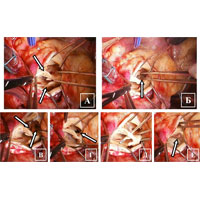
У пациента в условиях ИК рассечена аорта и обнаружен двустворчатый АК (рис. 4 А). В области основания левой коронарной створки выявлена полость абсцесса (рис. 4 Б), а также зона отрыва створки с участком фиброзного кольца (рис. 4 В, Г, Д). На желудочковой поверхности створок выявлены вегетации и участки кальциноза (рис. 4 Е).
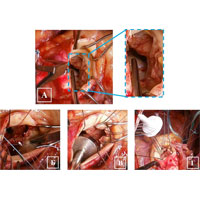
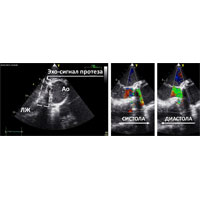
Рис. 6. Данные ЧПЭхоКГ: при допплерографии обнаруживается движение крови в систолу через протез и парапротезно в диастолу.
После иссечения АК было обнаружено, что дном абсцесса является расплавленный миокард межжелудочковой перегородки (рис. 5 А). Принято решение выполнить фиксацию протеза в области переднего сектора к стенке аорты ввиду высокого риска прорезывания швов. В аортальную позицию имплантирован механический двустворчатый протез (рис. Б, В, Г).
Однако при чреспищеводной эхокардиографии (ЧПЭхоКГ) была обнаружена обширная парапротезная фистула (рис. 6). Предположен отрыв протеза в области переднего сектора и принято решение выполнить ревизию корня аорты.
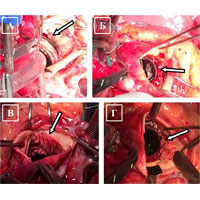
При ревизии подтвердились сомнения: произошел отрыв протеза в области переднего сектора (рис. 7 А). Было найдено нестандартное и рискованное решение: протез фиксирован отдельными узловыми швами на прокладках из ксеноперикарда непосредственно к миокарду (рис. 7 Б). Заплатой из ксеноперикарда устранена полость абсцесса (рис. 7 В), а затем повторно выполнена фиксация переднего сектора протеза (рис. 7 Г).
После остановки ИК контрольная эхокардиография подтвердила успешность хирургического вмешательства. Суммарная длительность этой тяжелой операции составил 10,5 часов, включая 4 часа ИК и 3 часа кардиоплегии.
Чтобы добиться улучшения в послеоперационном периоде, были задействованы силы 9 клинических подразделений Пироговского Центра: отделения кардиология для больных с нарушением ритма, кардиохирургическое отделение, кардиореанимация, второе хирургическое отделение, отделение радионуклидной и функциональной диагностики, отделение ультразвуковых и рентгенохирургических методов диагностики и лечения, отделение рентгено-хирургических методов диагностики и лечения нарушений ритма сердца, терапевтическое отделение, отделение восстановительного лечения. Пациент провел 13 дней в реанимации, из которых 6 дней проводилась искусственная вентиляция легких. Было перелито около 50 литров растворов и крови, применено 7 классов антимикробных препаратов, за время лечения больной принял более двухсот таблеток.
На 31 сутки после операции пациент в удовлетворительном состоянии переведен в отделение кардиологии городской больницы по месту жительства, где после еще 1 месяца реабилитации больной был окончательно выписан для дальнейшего лечения под контролем кардиолога по месту жительства.
Пациент наблюдается специалистами Пироговского Центра. При контрольных осмотрах через 5 и 9 месяцев чувствует себя хорошо, признаков рецидива инфекции не выявлено.
Таким образом, данное клиническое наблюдение является ярким примером особенностей оперативных вмешательств у больных ИЭ, абсцедирующим поражением выходного отдела ЛЖ сердца и корня аорты. К таковым следует отнести непредсказуемость степени и объема деструкции при внутрисердечной инфекции, что влечет за собой нестандартный интраоперационный подход и необходимость принятия экстренных и порой рискованных решений. Течение послеоперационного периода часто крайне тяжелое, требует привлечения максимальных возможностей лечебного учреждения. Только консолидация широкого круга специалистов по ИЭ может обеспечить успешный результат лечения данной категории тяжелобольных.
Несмотря на все трудности лечебного процесса, описанные в данном клиническом наблюдении, коллективный опыт специалистов Пироговского Центра позволил остановить опасный инфекционный процесс и спасти жизнь пациента.
-
— круглосуточно. — понедельник-пятница, с 08:00 до 21:00; суббота, с 09:00 до 18:00; воскресенье, с 09:00 до 18:00.
В летний период: понедельник-пятница, с 08:00 до 21:00; суббота, с 09:00 до 18:00; воскресенье, с 09:00 до 15:00.
В летний период: понедельник-пятница, с 08:00 до 21:00; суббота, с 09:00 до 18:00; воскресенье, с 09:00 до 15:00.
Ни одно заболевание сердца не может сравниться с инфекционным эндокардитом по частоте, разнообразию и тяжести неврологических осложнений. Не случайно, что более ста лет назад Ослер описал инфекционный эндокардит как триаду, состоящую из лихорадки, сердечного шума и гемиплегии [1]. Инфекционный эндокардит является чрезвычайно тяжелым заболеванием с летальностью, достигающей при консервативном лечении 80% (общая летальность составляет [2, 3]. В настоящее время инфекционный эндокардит вышел на четвертое место по уровню смертности среди инфекционных синдромов после уросепсиса, пневмонии и перитонита и занял нишу социально обусловленных заболеваний [4]. Несмотря на успехи в диагностике и лечении инфекционного эндокардита частота неврологических осложнений заболевания остается в последние три десятилетия на уровне (по нашим данным — около 25%) [5, 6, 7, 8, 9, 10, 11]. Присоединение неврологических осложнений значительно увеличивает летальность. При мозговой эмболии на фоне инфекционного эндокардита она колеблется между 20% и 80% (по нашим данным — около 60%), а в доантибиотическую эру она составляла 100% [5, 11, 12, 13, 14]. Основными этиопатогенетическими факторами при инфекционном эндокардите являются: травма эндокарда, бактериемия и ослабление резистентности организма. Спектр наиболее частых возбудителей и предрасполагающих кардиальных повреждений к настоящему времени претерпел некоторые изменения. Ревматическое заболевание сердца было одним из наиболее распространенных заболеваний сердца, предрасполагающих к эндокардиту (вторичный инфекционный эндокардит), но сейчас чаще развивается первичный инфекционный эндокардит, то есть поражение условно неизмененных клапанов сердца. Вместе с изменениями предрасполагающих условий изменились и возбудители эндокардита. Наиболее частыми остаются стрептококки и стафилококки, однако, частота стрептококковой этиологии снижается, а стафилококковой — растет, кроме того, в последние годы продолжает расти доля энтерококка, а также грамотрицательной флоры, микоплазм, вирусов, грибов, риккетсий, вероятно, вследствие иммуносупрессии, изменения клапанного субстрата и использования антимикробных средств. Неврологические осложнения у больных инфекционным эндокардитом чаще развиваются при поражении золотистым стафилококком [3, 11, 12, 15, 16]. Характерный патологический признак инфекционного эндокардита — это наличие вегетаций на створках клапанов. Вегетации состоят из аморфного фибрина и тромбоцитов вместе с возбудителями и лейкоцитами, являясь, таким образом, инфицированными белыми фибрин-тромбоцитарными тромбами. Возбудители, как правило, локализуются глубоко внутри вегетации и, таким образом, надежно защищены от антибактериальных факторов крови. Для обнаружения вегетаций используют эхокардиографию. Трансэзофагеальная эхокардиография значительно превосходит трансторакальное исследование — чувствительность достигает специфичность — [3]. У обследованных нами пациентов вегетации имели существенные различия: по размеру — от очень мелких до массивных (24 мм); по форме — шаровидные, булавовидные, лентовидные, дольчатые; по характеру прикрепления к клапану — на узком основании, на широком основании; по подвижности — флотирующие, фиксированные; по структуре — рыхлые, организованные. Очень важной является последняя характеристика, поскольку она отражает активность инфекционного процесса в сердце и эмбологенный потенциал вегетаций. Шестидесятиминутный транскраниальный допплеровский мониторинг кровотока по средней мозговой артерии позволяет детектировать микроэмболические сигналы (МЭС) у больных инфекционным эндокардитом. В нашем исследовании все пациенты с МЭС имели свежий инфекционный эндокардит (давность не более 2 месяцев) и рыхлые вегетации по данным эхокардиографии. При давности эндокардита более 2 месяцев МЭС не обнаруживались. Появление МЭС связано с пассажем мелких фрагментов рыхлых клапанный вегетаций, а также агрегатов тромбоцитов, образующихся в турбулентном потоке вблизи пораженного клапана. Неврологические осложнения наиболее часто возникают до начала антибактериальной терапии и в первую неделю ее проведения. В подавляющем большинстве случаев церебральная эмболия развивается в течение первого месяца от момента появления симптомов эндокардита. В этот период вегетации являются рыхлыми и могут легко фрагментироваться, вызывая эмболизацию. Затем в процессе адекватной антибактериальной терапии происходит уплотнение вегетаций. По данным эхокардиографии, выполненной в динамике, вегетации становятся плотными и прочными, они организуются, покрываются эндотелием и уже реже вызывают эмболии. Неврологические осложнения инфекционного эндокардита связаны с количеством, размером, локализацией и инфицированностью эмболов. Пациенты с инфекционным эндокардитом могут переносить инфаркт головного мозга, интрацеребральную и субарахноидальную геморрагию, микотическую аневризму, энцефалопатию, внутримозговой абсцесс, менингит и менингоэнцефалит. Ишемический инсульт является наиболее частой неврологической манифестацией инфекционного эндокардита (по данным литературы — у пациентов с инфекционным эндокардитом, по нашим данным — у 20%). Методы нейровизуализации демонстрируют в большинстве случаев множественные ишемические очаги, из которых примерно половина — корковые, локализующиеся в бассейнах концевых ветвей мозговых артерий, а другая половина представляет собой лакунарные очаги, располагающиеся в глубине полушарий мозга на границе серого и белого вещества. При небольших размерах очагов течение инсульта является достаточно доброкачественным. МРТ является более информативным методом исследования, чем КТ, в выявлении очагового поражения головного мозга у больных инфекционным эндокардитом. Наиболее часто поражается бассейн левой средней мозговой артерии. Церебральная геморрагия имеет место приблизительно у пациентов с инфекционным эндокардитом (по нашим данным — у 5%), чаще при поражении Staphylococcus aureus, и происходит вследствие трех отдельных патофизиологических механизмов. Церебральная септическая эмболия с последующим эрозивным артериитом является причиной и ранней геморрагии, и образования микотических аневризм с их последующим разрывом. Геморрагическая трансформация ишемического инфаркта дополняет данную триаду. Экспериментальные исследования церебральной септической эмболии документируют появление септического артериита в течение 1 дня после эмболии. Считается, что сосудистая деструкция возникает вследствие проникновения микроорганизмов из просвета сосуда в пространства Вирхова-Робена через vasa vasorum окклюзированного сосудистого сегмента. Микроорганизмы затем проникают в адвентицию сосуда, разрушая более медиальные слои до тех пор, пока не достигнут внутренней эластической пластинки. Микотические аневризмы по данным литературы имеют место у 5%-12% пациентов с эндокардитом (по нашим данным — около 1%). Примерно половина микотических аневризм разрывается с развитием интрацеребральной геморрагии или субарахноидального кровоизлияния. Иногда разрыв аневризм происходит спустя месяцы после излечения эндокардита. Летальность при разрыве достигает 80%. У 30% больных при антибиотикотерапии аневризмы подвергаются обратному развитию, а также менее вероятен разрыв аневризмы. Острая энцефалопатия — второе по частоте неврологическое осложнение эндокардита (по данным литературы и нашим данным ее переносят около 20% пациентов с инфекционным эндокардитом). Патофизиологическими механизмами являются мультифокальная септическая микроэмболия с последующим образованием микроинфарктов и микроабсцессов, изменения интракраниальных артерий (периваскулярная пролиферация), мозговая дисциркуляция и интоксикация. Аутопсические исследования пациентов с неврологическими осложнениями эндокардита показывают множественные микроинфаркты у 23%, микроабсцессы — у 26%. Большие абсцессы головного мозга редки. Они имеют место менее чем в 1% случаев при эндокардите. Менингит и менингоэнцефалит развиваются примерно у 4% пациентов с инфекционным эндокардитом, являются, как правило, дебютом заболевания, и поражение клапанов сердца выявляется уже после постановки неврологического диагноза. Таким образом, неврологические осложнения при инфекционном эндокардите представляют собой довольно пеструю картину. Инфекционный эндокардит до сегодняшнего дня остается одним из наиболее трудно диагностируемых заболеваний, несмотря на хорошо известные клинические и лабораторные признаки. Особенно затруднена постановка правильного диагноза в случае дебюта заболевания неврологическими осложнениями. По нашим данным примерно у 10% больных инфекционный эндокардит дебютировал развитием неврологических осложнений в виде ишемического, геморрагического инсультов или субарахноидального кровоизлияния. В этом случае имеются некоторые отличительные особенности течения неврологической патологии, которые позволяют заподозрить инфекционный эндокардит в качестве причинного фактора.
- Начало развития неврологической симптоматики является острым, с захватом нескольких бассейнов кровоснабжения головного мозга. Очаговые симптомы поражения нервной системы часто не достигают выраженной степени. Более часто, чем при инсультах иного генеза, встречается общемозговая симптоматика (головная боль, оглушение и др.).
- При нейровизуализации выявляются множественные инфаркты мозга.
- Часто наблюдается повышение температуры тела еще до развития симптомов поражения нервной системы.
- При лабораторных исследованиях выявляется: снижение уровня гемоглобина, снижение количества эритроцитов, лейкоцитоз, увеличение СОЭ.
- При УЗИ часто обнаруживается увеличение селезенки.
- При эхокардиографии выявляются клапанные вегетации.
СПИСОК ЛИТЕРАТУРЫ
- Osler W. Gulstonian lectures on malignant endocarditis // Lancet.- 1885.- Vol. 1.- P.
- Шевченко Ю.Л. Хирургическое лечение инфекционного эндокардита.- СПб.: Наука, 1995.- 230 с.
- Mylonakis E., Calderwood S.B. Infective endocarditis in adults // N. Engl. J. Med.- 2001.- Vol. 345.- P.
- Bayer A.S., Bolger A.F., Taubert K.A., et al. Diagnosis and management of infective endocarditis and its complications // Circulation.- 1998.- Vol. 98.- P.
- Arauz-Gongora A.A., Souta-Meirino C.A., Cotter-Lemus L.E., et al. The neurological complications of infectious endocarditis // Arch. Inst. Cardiol. Mex.- 1998.- Vol. 68.- P.
- Jones H.R., Siekert R.G., Ceraci J.E. Neurologic manifestations of bacterial endocarditis // Ann. Int. Med.- 1969.- Vol. 71.- P.
- Millaire A., Leroy O., Gaday V., et al. Incidence and prognosis of embolic events and metastatic infections in infective endocarditis // Europ. Heart J.- 1997.- Vol. 18.- P.
- Pruitt A.A., Rubin R.H., Karchmer A.W., Duncan G.W. Neurologic complications of bacterial endocarditis // Medicine.- 1978.- Vol. 57.- P.
- Salgado A.V., Furlan A.J., Keys T.F., et al. Neurologic complications of endocarditis: A experience // Neurology.- 1989.- Vol. 39.- P.
- Кузнецов А.Н. Кардиогенная и артерио-артериальная церебральная эмболия: Этиология, патогенез, клиника, диагностика, лечение и профилактика: Автореф. дис. : д-ра мед. наук.- СПб., 2001.- 32 с.
- Климов И.А. Автореф. Дис.
- Heiro M., Nikoskelainen J., Engblom E., et al. Neurologic manifestations of infective endocarditis: A experience in a teaching hospital in Finland // Arch. Intern. Med.- 2000.- Vol. 160.- P.
- Herrschaft H. Herzkrankheiten als Ursache zerebraler Symptome und Syndrome // Fortschr. Neurol. Psychiatr.- 1990.- Jg.58.- S.
- Rabinovich S., Evans J., Smith J.M., January L.E. A long term view of bacterial endocarditis: 337 cases // Ann. Int. Med.- 1965.- Vol. 63.- P. 185.
- Hanna J.P., Furlan A.J. Cardiac disease and embolic sources // Brain ischemia: Basic concepts and clinical relevance / Ed. by Caplan L.R.- London, etc.: Springer-Verlag, 1995.- P.
-
— круглосуточно. — понедельник-пятница, с 08:00 до 21:00; суббота, с 09:00 до 18:00; воскресенье, с 09:00 до 18:00.
В летний период: понедельник-пятница, с 08:00 до 21:00; суббота, с 09:00 до 18:00; воскресенье, с 09:00 до 15:00.
… инфекционный эндокардит продолжает представлять серьезную социальную проблему.
ВВЕДЕНИЕ
Инфекционный (бактериальный) эндокардит является тяжелым инфекционным процессом, который в отсутствие лечения всегда приводит к летальному исходу.
Современная лечебная программа инфекционного эндокардита включает антибактериальную, патогенетическую, симптоматическуютерапию и экстракорпоральную гемокоррекцию, также современная терапия инфекционного эндокардита не мыслима без своевременного оперативного лечения, которое при остром инфекционном эндокардите выполняется в ранние сроки при сохраняющейся лихорадке и бактериемии после непродолжительного курса антибактериальной терапии. Указанный подход позволяет снизить госпитальную летальность до 11,5%, увеличить пятилетнюю выживаемость больных с инфекционным эндокардитом до 76,8%.
Вообще же, всегда лучше вылечить инфекционный эндокардит антибиотиками, без протезирования клапана, однако клиническая ремиссия должна быть достигнута достаточно быстро. В противном случае наступает генерализация процесса, развитие общего сепсиса, и прибегать к хирургическому лечению становится слишком поздно.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Лечение инфекционного эндокардита невозможно без своевременной операции, которая выполняется в ранние сроки или по завершении 4-6-недельного курса антибактериальной терапии. Недостаточность кровообращения при современном инфекционном эндокардите чаще всего связана с быстрым разрушением клапанного аппарата, поэтому хирургическое лечение в последнее десятилетие применяется все чаще. Хирургическое вмешательство является эффективным методом восстановления внутрисердечной гемодинамики и санации полостей сердца, без чего больные погибали бы.
Хирургический метод лечения, как правило, заключается в удалении пораженного клапана и имплантации искусственного механического или биологического протеза. Новыми методами хирургического лечения являются применение криосохраненных аллографтов, ксенографтов и разработка реконструктивных вмешательств на клапанах сердца, что снижает частоту реинфекции.
По данным Ю.Л.Шевченко, Г.Г.Хубулава, Н.Н.Шихвердиева, С.А.Матвеева (Клиника хирургии усовершенствания врачей имени П.А. Куприянова Военно-медицинской академии): «… в основу хирургического лечения инфекционного эндокардита должна быть положена щадящая по своему характеру операция на сердце с целью санации его камер и радикальной коррекции нарушений внутрисердечной гемодинамики. Щадящий принцип операции продиктован особой тяжестью состояния таких больных и заключается в максимальном уменьшении всех видов лекарственной и общей хирургической агрессии по отношению к пациентам. Этот принцип начинает реализоваться уже с оперативного доступа. Несмотря на то, что во всем мире стандартным доступом к сердцу является срединная стернотомия, мы в клинике используем правостороннюю передне-боковую торакотомию. Как доказывает наш многолетний клинический опыт, этот доступ менее травматичен, лучше переносится больными и в последующем дает меньше осложнений. Из этого доступа возможно выполнение протезирования практически любого клапана сердца, которые пока остаются наиболее частыми вариантами коррекции нарушений внутрисердечной гемодинамики при инфекционном эндокардите.
Более выгодным для больного вариантом является клапаносохраняющая операция. Но пластические клапаносохраняющие операции требуют опыта, хороших мануальных навыков и творчества в их выполнении. Тем не менее, именно эти виды коррекции нарушений внутрисердечной гемодинамики (клапаносохраняющие операции) дают наиболее благоприятные результаты. Однако такие вмешательства, как правило, возможны у больных на относительно ранней стадии заболевания, когда клапанные разрушения еще не столь обширные. Чаще, чем при других локализациях, возможны пластические вмешательства при инфекционном поражении трикуспидального клапана.
В Национальном институте сердечно-сосудистой хирургии им. Н.М. Амосова АМН Украины выработаны такие подходы к хирургическому лечению инфекционного эндокардита: (1) раннее хирургическое вмешательство; (2) радикальное иссечение инфицированных тканей; (3) выполнение реконструктивных пластических операций; (4) использование аутотканей для реконструкции; (5) применение общей управляемой гипертермической перфузии.
Количество больных, нуждающихся в оперативном лечении, зависит от своевременной диагностики, эффективности антибактериальной терапии, осложнений, вида возбудителя. При стрептококковом инфекционном энокардите протезирование клапанов сердца выполняют 17% больных, при стафилококковом - 51,7-70%. Лечение инфекционного эндокардита на современном этапе состоит в расширении показаний к хирургическому вмешательству и, соответственно, уменьшении ограничений для его проведения.
Основными показаниями к проведению хирургического лечения при остром инфекционном эндокардите являются: (1) острая аортальная и митральная недостаточность; (2) деструкция клапанного аппарата (разрыв хорд, разрушение или отрыв створки, перфорации); (3) прогрессирующая сердечная недостаточность; (4) неконтролируемая инфекция, в том числе диагностика абсцесса фиброзного кольца; (5) также хирургическое вмешательство показано и тогда, когда течение эндокардита естественных клапанов осложняется повторными системными эмболиями, аневризмой синуса Вальсальвы, прогрессирующими нарушениями проводимости.
Показаниями для операции по поводу инфекционного эндокардита на фоне протезированного клапана считаются: (1) развитие инфекционного эндокардита менее чем через год после протезирования; (2) развитие осложнений с дисфункцией протеза – стенозирование или существенная регургитация; (3) персистирующая бактериемия, формирование абсцессов, нарушения проводимости и крупные вегетации, особенно если они вызваны стафилококком.
По данным Крикунова А. А. (кандидат медицинских наук, заведующий отделением хирургии инфекционного эндокардита Национального института сердечно-сосудистой хирургии им. Н.Н. Амосова АМН Украины): «… в настоящее время абсолютными показаниями к хирургическому лечению инфекционного эндокардита считаются: (1) отсутствие эффекта от проводимой антибиотикотерапии в течение двух недель; (2) развитие выраженных нарушений гемодинамики (хроническая недостаточность кровообращения, острая сердечная недостаточность, сепсис-индуцированная гипотензия); (3) наличие внутрисердечного абсцесса, микотических аневризм корня аорты; (4) повторные эмболии.
Эхокардиографические данные, указывающие на необходимость хирургического лечения: ЭхоКГ позволяет оценить гемодинамический статус и выявить внутрисердечные осложнения инфекционного эндокардита, что может быть важно при определении показаний к хирургическому лечению.
Основными моментами являются следующие: (1) количественная оценка степени регургитации через поврежденные клапаны, оценка функциональных возможностей левого желудочка; (2) мониторинг преждевременного закрытия клапана (до начала систолы), что является признаком острого переполнения левого желудочка и тяжелой декомпенсации сердца, указывает на необходимость хирургического лечения; (3) появление патологических фистул, указывающих на неклапанные поражения сердца; (4) трансэзофагеальная ЭхоКГ позволяет более точно выявлять абсцессы, расположенные около клапанов и в перегородке (перикардит является косвенным указанием на формирование абсцесса кольца аортального клапана); (5) обнаружение вегетаций, особенно значительного размера, может указывать на возможность массивной эмболии (во многих исследованиях показана прямая корреляционная зависимость между частотой обнаружения вегетаций и частотой сердечной недостаточности, тяжелых эмболических поражений; критическим является размер вегетаций более 10 мм в диаметре; подвижность вегетаций и их локализация также имеют определенное значение с точки зрения возможности эмболии).
Полный курс антимикробной терапии должен быть проведен в течение не менее 7–15 дней после оперативного вмешательства независимо от длительности терапии до операции.
Очень важным является время проведения оперативного вмешательства при остром инфекционном эндокардите: желательно провести какое-то время антибактериальную терапию с целью уменьшения микробного инфицирования ткани, куда будет имплантироваться клапан (и тем самым уменьшить риск реинфекции на протезе), а с другой стороны – при неэффективности медикаментозной терапии необходимо оперировать до развития полиорганной недостаточности. В современных условиях основной тенденцией в хирургическом лечении инфекционного эндокардита стало раннее проведение операции на сердце при минимальных внутрисердечных разрушениях, а порой и без них до развития других тяжелых осложнений. К сожалению, до сих пор доля таких операций невелика. Больше поступает больных с развившимися тяжелыми осложнениями.
Инфекционный эндокардит – заболевание, угрожающее жизни пациента. Поэтому, наличие онкологических заболеваний, внесердечных осложнений (эмболических инсультов, ишемий) при инфекционном эндокардите не являются противопоказанием к операции на сердце. При наличии экстракардиальных осложнений инфекционного эндокардита тактика лечения должна быть активной. В случае возникновения эмболии в сосуды головного мозга, например, операция на сердце может быть выполнена уже через две недели после возникновения данного эпизода (при отсутствии геморрагии в зоне поражения). Но даже в случаях развития геморрагического инсульта через два месяца возможно проведение операции в условиях искусственного кровообращения.
Развитие острой аортальной или митральной недостаточности является показанием к неотложному хирургическому вмешательству, а отсутствие эффекта от проводимой антибактериальной терапии в течение 10-14 дней (сохранение лихорадки, лейкоцитоза, бактериемии) диктуют необходимость раннего оперативного вмешательства до развития гнойных очагов других органах и тканях.
Также раннее хирургическое вмешательство может рассматриваться и при крупных вегетациях митрального клапана – более 10 мм; при продолжающемся росте вегетаций на фоне антибиотикотерапии и при наличии соприкасающихся вегетаций створок митрального клапана. Прогноз при инфекционном эндокардите правых отделов более благоприятен и хирургическое вмешательство требуется только при вегетациях размером более 20 мм и после повторных легочных эмболий.
В связи с этим лечение больных острым инфекционным эндокардитом должно проводиться совместно терапевтами (кардиологами, ревматологами) и кардиохирургами с целью выработки оптимальной тактики лечения.
Таким образом, инфекционный эндокардит в значительной степени является хирургической проблемой и требует для своего лечения интеграции усилий специалистов самых различных направлений: кардиологов, кардиохирургов, микробиологов, инфекционистов, специалистов по лучевой диагностике, реаниматологов и многих других. Основой успешного хирургического лечения этого тяжелого недуга является ранняя диагностика и ранняя операция. Поэтому необходимо расценивать инфекционный эндокардит как хирургическую патологию, включая рассмотрение этой нозологической формы во всех учебниках по общей хирургии, а также включить в программу подготовки врачей изучение инфекционного эндокардита на хирургических циклах.
Теги:
234567 Описание для анонса:
234567 Начало активности (дата): 25.06.2013 06:35:00
234567 Кем создан (ID): 1
234567
Инфекционный эндокардит (ИЭ, бактериальный эндокардит) — воспаление эндокарда микробной этиологии, ведущее к нарушению функций и деструкции клапанного аппарата; при поражении инфекционным процессом артериовенозного шунта (например, открытого артериального протока) или участка коарктации аорты говорят об инфекционном эндартериите. Характерное проявление воспаления — вегетации, располагающиеся на створках клапанов или на эндокарде свободных стенок сердца. Различают острый (длительностью от нескольких дней до 1–2 нед) и подострый ИЭ.
Статистические данные. Распространённ ость составляет 14–62 случая на 1 млн человек в год (по данным США).
Этиология
• При остром ИЭ причиной воспаления обычно бывает золотистый стафилококк, поражающий нормальные створки (первичный ИЭ), что быстро приводит к их деструкции и возникновению метастатических очагов.
• Подострый ИЭ вызывается обычно зеленящим стрептококком и возникает на поражённых створках (т.е. вторичный ИЭ, например, при недостаточности клапанов или стенозе отверстия). Для него не характерно образование метастатических очагов.
• Отмечены особенности клинического течения и различия в этиологических факторах обычного ИЭ, ИЭ у наркоманов, употребляющих наркотики внутривенно, а также ИЭ клапанных протезов.
• В 30–40% случаев ИЭ развивается первично на неизменённых клапанах. Возбудители первичного ИЭ обычно более вирулентны (стафилококки, грамотрицательные микроорганизмы), поэтому он хуже поддаётся антибактериальной терапии.
Патогенез
• Преходящая бактериемия: часто появляется при обычной чистке зубов, сопровождающейся кровотечением, удалении зубов, прочих стоматологических вмешательствах; причиной бактериемии могут быть вмешательства на мочеполовой сфере, жёлчных путях, ССС , ЛОР-органах, ЖКТ .
• Первичное повреждение эндотелия в результате воздействия на него высокоскоростного и турбулентного потока крови (наиболее подвержены травматическому воздействию участки эндотелия в области изменённых клапанов сердца).
• Адгезия тромбоцитов с отложнеием фибрина (небактериальный эндокардит). Циркулирующие бактерии оседают в области небактериального тромботического эндокардита и размножаются.
• Размножившиеся бактерии, продолжающие оседать тромбоциты и нити фибрина формируют вегетации, создавая защитную зону, куда не могут проникнуть фагоциты и одновременно из кровотока диффундируют питательные элементы, что в совокупности формирует идеальные условия для роста микробных колоний.
• Активная инфекция распространяется в соединительную ткань сердца, приводя к её деструкции, что проявляется отрывом и прободением створок клапанов, отрывом сухожильных нитей.
• Фиксирующиеся на клапанах микроорганизмы вызывают иммунные нарушения •• Появление в крови ЦИК (90–95%), снижение содержания комплемента •• В почках часто выявляют отложения иммуноглобулинов на базальных мембранах, исчезающие после успешного лечения •• Иммунопатологические реакции, приводящие к развитию гломерулонефрита, миокардита, васкулита и дистрофическим изменениям внутренних органов.
• Метастазы инфекции с возникновением микроабсцессов в различных органах.
• Тромбоэмболии в различные органы.
Факторы риска • Искусственные клапаны сердца • ВПС • Ревматические и другие приобретённ ые поражения клапанов • Гипертрофическая кардиомиопатия • Пролапс митрального клапана с клапанной регургитацией • Любые диагностические и лечебные процедуры с применением катетеров, эндоскопических инструментов • Стоматологические процедуры • Операции, затрагивающие слизистую оболочку дыхательных путей, ЖКТ , мочевых путей при наличии инфекции данных органов • Физиологические роды при наличии инфекции родовых путей • Наркомания.
Патоморфология • Вегетации чаще располагаются в левых отделах сердца — на митральном и аортальном клапанах. У лиц, внутривенно применяющих наркотики, преимущественно поражается трёхстворчатый клапан. Необходимо учитывать, что вегетации возникают чаще при наличии недостаточности клапана, чем стеноза. При этом они располагаются преимущественно на предсердной стороне митрального клапана или желудочковой стороне аортального клапана • Вегетации эндокарда представлены организованным фибрином, осевшими тромбоцитами, колониями микроорганизмов • Часто поражён аортальный клапан, реже митральный (деструкция клапана — перфорация, отрыв створок, разрыв сухожильных хорд) • Характерны микотические аневризмы как результат прямой инвазии микроорганизмами стенки аорты, сосудов внутренних органов, нервной системы • Инфаркты, абсцессы и микроабсцессы обнаруживают в сердце и в различных органах.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ
Симптоматика обычно развивается через 2 нед после эпизода бактериемии
Общие проявления. Интоксикационный синдром: лихорадка, озноб, ночная потливость, повышенная утомляемость, анорексия, снижении массы тела, артралгии, миалгии.
Сердечные проявления. Шумы недостаточности клапанов в результате деструкции створок, сухожильных нитей или стеноза отверстий из-за обструкции отверстий клапанов вегетациями больших размеров. Появление новых или изменение характера имевшихся ранее шумов в сердце отмечают у 50% больных, причём значительно реже у пожилых людей. Необходимо учитывать, что шум может отсутствовать в течение длительного времени при наличии других проявлений. Шума обычно не бывает при поражении трёхстворчатого клапана.
Внесердечные проявления
• Иммунопатологические реакции в виде •• гломерулонефритов •• полиартритов •• кровоизлияний •• пятен Рота (кровоизлияний в сетчатку глаза с белым центром) •• узелков Ослера (болезненных очагов уплотнения в коже и подкожной клетчатке красноватого цвета, представляющие собой воспалительные инфильтраты, обусловленные поражением мелких сосудов) •• пятен Джейнуэя (красные пятна или болезненные экхимозы на подошвах и ладонях).
• Гепатоспленомегалия и лимфаденопатия.
• Тромбоэмболии, приводящие к инфарктам различных органов ( лёгк их при правосторонних ИЭ, головного мозга, почек, селезёнки при левосторонних ИЭ). Частота их появления при подостром ИЭ составляет 12–40%, при острой форме заболевания — 40–60% (инфаркт мозга возникает у 29–50% больных ИЭ).
• Нагноительные осложнения в виде абсцессов (3–15% больных), микотических аневризм при грибковой этиологии.
• У 20% больных ИЭ поражается центральная или периферическая нервная система в результате разрыва сосуда или тромбоэмболий, менингита, энцефалита. Описаны случаи эмболических абсцессов мозга и субдуральной эмпиемы. Иногда возникает поражение глаз, связанное с эмболиями, васкулитом сосудов сетчатки, иридоциклитом, панофтальмитом, отёком диска зрительного нерва.
Лабораторная диагностика
• Анализ крови: •• умеренная нормохромная анемия (чаще при подострой форме заболевания) •• увеличение СОЭ , иногда до 70–80 мм/ч (несмотря на эффективное лечение увеличение СОЭ сохраняется в течение 3–6 мес; наличие нормальной СОЭ не исключает диагноза ИЭ) •• лейкоцитоз со сдвигом лейкоцитарной формулы влево •• диспротеинемия с увеличением уровня g -глобулинов, реже a 2 -глобулинов •• ЦИК •• СРБ •• РФ (y 35–50% больных подострым ИЭ, в большинстве случаев острого ИЭ остаётся отрицательным) •• увеличение концентрации сиаловых кислот.
• В анализах мочи обнаруживают микрогематурию и протеинурию, несмотря на отсутствие клинических проявлений поражения почек. При развитии гломерулонефрита возникает выраженная протеинурия и гематурия.
• Гемокультура. Бактериемия при подостром ИЭ является постоянной. Количество бактерий в венозной крови составляет от 1/мл до 200/мл при подострой форме заболевания. Для выявления бактериемии рекомендуют трижды производить забор венозной крови в объём е 16–20 мл с интервалом 1 ч между первой и последней венепункциями. При выявлении возбудителя необходимо определить его чувствительность к антибиотикам.
• ЭКГ . Могут быть выявлены нарушения проводимости ( АВ -блокада, синоатриальная блокада) у 4–16% больных, возникающие в результате очагового миокардита или абсцесса миокарда на фоне ИЭ. При эмболическом поражении венечных артерий могут быть выявлены инфарктные изменения ЭКГ .
• ЭхоКГ — вегетации (выявляют при их размере не менее 4–5 мм). Более чувствительным методом выявления вегетаций считают чреспищеводную ЭхоКГ . Кроме вегетаций, с помощью данного метода можно выявить перфорацию створок, абсцессы, разрыв синуса Вальсальвы . ЭхоКГ используют также для наблюдения за динамикой процесса и эффективностью лечения.
Диагностика
• Ранее классическими признаками ИЭ считалась триада: лихорадка, анемия и шум в сердце. В настоящее время данное мнение изменилось. Это связано со своевременной диагностикой и лечением ИЭ (до появления выраженной анемии), а также с особенностями клинического течения ИЭ.
• В типичных случаях диагностика ИЭ не представляет существенных трудностей. Лихорадка, субфебрилитет с ознобом и познабливанием, появление шумов в сердце или их изменение, увеличение селезёнки, изменение формы пальцев или ногтей, эмболии, изменения в моче, а также анемия, увеличение СОЭ позволяют заподозрить это заболевание. Большое значение имеет выделение возбудителя ИЭ, позволяющее не только подтвердить диагноз, но и выбрать противомикробную терапию.
ЛЕЧЕНИЕ
Тактика ведения. Необходима госпитализация пациента с обязательным соблюдением постельного режима вплоть до разрешения острой фазы воспалительной реакции. Лечение в стационаре проводят до полной нормализации температуры тела и лабораторных показателей, отрицательных результатов бактериологического исследования крови и исчезновения клинических проявлений активности заболевания.
Антибактериальная терапия
• Основные принципы применения антибиотиков •• Назначение препарата, оказывающего бактерицидное действие •• Создание высокой концентрации антибиотиков в вегетациях •• Введение антибиотиков в/в , длительная антибактериальная терапия •• Соблюдение режима введения антибиотика для предупреждения рецидива заболевания и резистентности микроорганизмов.
• При отсутствии данных о возбудителе инфекции, невозможности его идентификации проводят эмпирическую терапию. При острой форме ИЭ назначают оксациллин в комбинации с ампициллином (2 г в/в каждые 4 ч) и гентамицином (1,5 мг/кг в/в каждые 8 ч). При подостром ИЭ используют следующую комбинацию: ампициллин по 2 г в/в каждые 4 ч в сочетании с гентамицином по 1,5 мг/кг в/в каждые 8 ч.
• В зависимости от вида микроорганизма применяют различные антибиотики •• Пенициллинчувствительные стрептококки: минимально ингибирующая концентрация менее 0,1 мкг/мл, зеленящий стрептококк, S . bovis , pneumoniae , pyogenes групп А и С — продолжительность лечения — 4 нед ••• Бензилпенициллин (натриевая соль) по 4 млн ЕД каждые 4 ч в/в ••• Цефтриаксон в дозе 2 г в/в 1 р/сут ••• Ванкомицин в дозе 15 мг/кг в/в каждые 12 ч •• Относительно пенициллинустойчивые стрептококки: минимально ингибирующая концентрация более 0,1 и менее 1 мкг/мл — продолжительность лечения — 4 нед ••• Бензилпенициллин (натриевая соль) по 4 млн ЕД в/в каждые 4 ч + гентамицин по 1 мг/кг каждые 12 ч в/в ••• Ванкомицин в дозе 15 мг/кг в/в каждые 12 ч •• Пенициллинустойчивые стрептококки: минимально ингибирующая концентрация более 1 мкг/мл; E. faecalis , faecium, другие энтерококки — длительность лечения 4–6 нед ••• Бензилпенициллин (натриевая соль) по 18–30 млн ЕД в день в/в непрерывно или разделённый на равные дозы каждые 4 ч + гентамицин 1 мг/кг в/в каждые 8 ч ••• Ампициллин в дозе 12 г/сут в/в непрерывно или разделённый на равные дозы каждые 4 ч + гентамицин по 1 мг/кг в/в каждые 8 ч ••• Ванкомицин по 15 мг/кг в/в каждые 12 ч + гентамицин в дозе 1 мг/кг в/в каждые 8 ч •• Стафилококки — продолжительность лечения 4–6 нед ••• Метициллинчувствительные (цефазолин по 2 г в/в каждые 8 ч, ванкомицин в дозе 15 мг/кг в/в каждые 12 ч) ••• Метициллинрезистентные — ванкомицин по 15 мг/кг в/в каждые 12 ч •• Стафилококки на клапанных протезах — продолжительность лечения 4–6 нед: ванкомицин в дозе 15 мг/кг в/в каждые 12 ч + гентамицин по 1 мг/кг в/в каждые 8 ч + рифампицин по 300 мг перорально каждые 8 ч •• Группа HACEK — продолжительность лечения 4 нед ••• Цефтриаксон по 2 г в/в 1 р/сут ••• Ампициллин в дозе 12 г/сут в/в непрерывно или разделённый на равные дозы каждые 4 ч + гентамицин по 1 мг/кг в/в каждые 12 ч •• Neisseria — продолжительность лечения 3–4 нед ••• Бензилпенициллин (натриевая соль) по 2 млн ЕД в/в каждые 6 ч ••• Цефтриаксон по 1 г в/в 1 р/сут •• Pseudomonas aeruginosa , другие грамотрицательные микроорганизмы — продолжительность лечения 4–6 нед ••• Пенициллины широкого спектра действия ••• Цефалоспорины третьего поколения ••• Имипенем+циластатин + аминогликозид
Хирургическое лечение. Несмотря на правильное лечение ИЭ у 1/3 пациентов приходится прибегать к хирургическому лечению (протезирование клапанов и удаление вегетаций), независимо от активности инфекционного процесса.
• Абсолютные показания •• Нарастание сердечной недостаточности или её рефрактерность к лечению •• Устойчивость к антибактериальной терапии в течение 3 нед •• Абсцессы миокарда, фиброзного клапанного кольца •• Грибковая инфекция •• Эндокардит искусственного клапана.
• Относительные показания •• Повторные эмболизации вследствие деструкции вегетаций •• Сохранение лихорадки, несмотря на проводимую терапию •• Увеличение размеров вегетаций в ходе лечения.
Осложнения • При прогрессировании заболевания возможно развитие других осложнений со стороны сердца •• Абсцесс фиброзного кольца в результате распространения инфекции со створок; может заканчиваться разрушением фиброзного кольца •• Диффузный миокардит в результате иммунного васкулита. Помимо сердечной недостаточности, возможны различные аритмии и другие изменения ЭКГ •• Сердечная недостаточность (55–60% больных), которая при остром ИЭ возникает внезапно или значительно усиливается (следствие деструкции створки или отрыва сухожильных нитей). Сердечная недостаточность может появиться и у больных с подострой формой заболевания •• ИМ в результате тромбоэмболии венечных артерий •• Абсцесс миокарда (септический инфаркт) вследствие метастазирования, характеризуется признаками, напоминающими ИМ • Эмболия сосудов головного мозга, лёгк их, сонных артерий • Менингит • Септические инфаркты и абсцессы лёгк их • Инфаркты селезёнки • Гломерулонефрит • ОПН .
Диспансеризация. Осмотры нужно проводить 1 р/мес в течение 6 мес а затем 2 р/год с обязательным проведением ЭхоКГ .
Течение современного ИЭ имеет следующие особенности • Лихорадка может отсутствовать • Возможно начало с длительной лихорадки без явного поражения клапанов • Длительное течение с поражением одного органа, например почек, печени, миокарда • Более часто возникает у пожилых людей, наркоманов, больных с протезированными клапанами сердца • У лиц группы высокого риска возможна эффективная антибиотикопрофилактика ИЭ.
У ряда больных возможен рецидив ИЭ с появлением соответствующей симптоматики.
Прогноз. При отсутствии лечения острая форма ИЭ заканчивается летально в течение 4–6 нед, при подостром течении — через 6 мес (основа деления ИЭ на острый и подострый). Неблагоприятными прогностическими признаками ИЭ считают следующие • Нестрептококковая этиология заболевания • Наличие сердечной недостаточности • Вовлечение аортального клапана • Инфекция клапанного протеза • Пожилой возраст • Вовлечение фиброзного клапанного кольца или абсцесс миокарда.
Профилактика. При наличии предрасполагающих факторов к развитию ИЭ (пороки сердца, протезы клапанов, гипертрофической кардиомиопатии) рекомендуют проводить профилактику при ситуациях, вызывающих преходящую бактериемию.
• При стоматологических и других манипуляциях на ротовой, носовой полостях, среднем ухе, сопровождающихся кровотечением, рекомендуют проводить профилактику гематогенного распространения зеленящего стрептококка. Для этого применяют амоксициллин в дозе 3 г внутрь за 1 ч до вмешательства и 1,5 г через 6 ч после него.
• При аллергии на пенициллины используют 800 мг эритромицина или 300 мг клиндамицина за 2 ч до процедуры и 50% от первоначальной дозы через 6 ч после неё.
• При желудочно-кишечных и урологических вмешательствах проводят профилактику энтерококковой инфекции. С этой целью назначают ампициллин в дозе 2 г в/м или в/в в сочетании с гентамицином в дозе 1,5 мг/кг в/м или в/в и амоксициллин в дозе 1,5 г внутрь.
Сокращение. ИЭ — инфекционный эндокардит
МКБ-10 • I33 Острый и подострый эндокардит
Читайте также:

