Hla что это такое при вич
Обновлено: 19.04.2024
Морфология вируса иммунодефицита человека. Антигены вируса иммунодефицита человека.
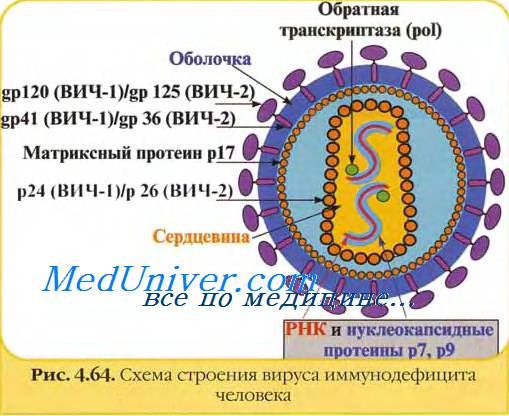
Зрелые вирионы вируса иммунодефицита человека имеют сферическую форму, их размеры не превышают 100-120 им в диаметре. Геном вируса иммунодефицита человека образуют две нити +РНК; их связывают белки рб и р7 (цифра соответствует молекулярному весу в кД).
Капсид вируса иммунодефицита человека образует белок р24. Сердцевина вириона вируса иммунодефицита человека имеет цилиндрическую или конусовидную формы; её формируют белки р18 и р24.
В сердцевине вируса иммунодефицита человека располагаются РНК, внутренние белки (р7 и р9), обратная транскриптаза (димер из белков р66 и p51) и эндонуклсаза (р31). Матричный белок р17 формирует прослойку между сердцевиной вириона и внешней оболочкой.
Суперкапсид вируса иммунодефицита человека образован двойным липидным слоем, который пронизывают гликопротсиновыс шипы. Каждый шип состоит из белков gp41 и gp 120. Гликопротеины gpl20 локализованы в выступающей части шипа и взаимодействуют с молекулами CD4 на мембранах клеток.
Гликопротеины gp41 (белки слияния) вируса иммунодефицита человека располагаются внутри оболочки и обеспечивают её слияние с клеточной мембраной.
Антигенная структура вируса иммунодефицита человека
У вируса иммунодефицита человека главными антигенами выступают группо- и видоспецифичные антигены [сердцевинные (gag-) белки p24; типоспецифичные антигены [оболочечные (env-) белки gp41 и gp120].
В соответствии с их структурой выделяют два типа и более 10 сероваров вируса иммунодефицита человека. Вирус иммунодефицита человека отличается высокой антигенной изменчивостью, и в результате сбоев обратной транскриптазы из организма больного можно выделить серологически различные вирусы.
Главные антигены вируса иммунодефицита человека — поверхностные gp41 и gpl20, a также сердцевинный (ядерный) gp24.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Инфекционные болезни:
Популярные разделы сайта:
Влияние HLA на прогноз выживания при ВИЧ
Значительное внимание уделяется возможной связи определенных аллелей МНС человеческих лейкоцитарных антигенов (HLA) I или II класса (например, HLA-B35, HLA-B27, HLA-AI и HLA-DR5) с задержкой или ускорением прогрессирования заболевания.
Влияние полиморфизма HLA на развитие ВИЧ-инфекции и клиническое течение заболевания зависит от субтипов инфицирующего вируса и от генетики конкретного инфицированного человека.
При изучении инфицирования вирусом субтипа В, который преимущественно распространен среди населения США и Северной Европы, была обнаружена отчетливая связь между специфичностью HLA-B57 и HLA-B27 и выживанием в течение длительного времени, что наблюдалось у инфицированных людей, не получавших лечения, со стабильной концентрацией CD4+-клеток и количеством вирусной РНК < 50 копий/ мл в течение более чем 10 ле.
Кроме того, у таких инфицированных пациентов также реже встречался острый ретровирусный синдром с выраженными симптомами (3,4%). Частота встречаемости HLA-B57 у хронически инфицированных лиц составляет 9,6%. HLA-B57 связан с ранним развитием реакции организма на ВИЧ, в результате чего происходит быстрое установление контроля над инфекцией, уменьшается репликация вируса и сохраняется количество CD4+-клеток.
Напротив, при наличии HLA-B27 не наблюдается выраженной противовирусной реакции со стороны CD8+-клеток, и его генетическое влияние можно видеть только на поздних клинических стадиях заболевания. Последнее, возможно, связано с отбором резистентных вирусов, обладающих меньшей репликативной активностью. Некоторые исследования показали, что замена одной аминокислоты в молекуле HLA I класса, например в HLA-B35, может коррелировать с быстрой прогрессией заболевания и развитием СПИДа.
Преимущественное значение аллелей HLA-B, а не HLA-A в отношении контроля ВИЧ-инфекции в организме также отмечалось при исследовании реакций CD8+-Т-клеток на вирус субтипа С среди африканского населения. Результат может быть связан с большим разнообразием пептидов, которые могут быть представлены в качестве антигенов в комплексах с молекулами HLA-B.
Кроме того, было выявлено, что гомозиготность по HLA-Bw4 коррелирует с защитой от СПИДа. Это, скорее всего, связано с усилением функций NK-клеток. Напротив, было показано, что гомозиготность по HLA-Bw6 коррелирует с ускоренным прогрес-сированием заболевания.
Задержка развития заболевания может быть связана с эффективной презентацией антигена в комплексах с молекулами МНС. Это вызывает мощную активацию ЦТЛ или клеточно-опосредованного иммунного ответа. Еще одной причиной зависимости клинического течения ВИЧ от определенных аллелей HLA может быть развитие иммунной защиты, вызванное частым контактированием с белками HLA, которые присутствуют на поверхности вирионов или на клетках, несущих инфекционный вирус, при передаче ВИЧ половым путем.
Наконец, при проведении исследований женщин в Зимбабве были обнаружены разновидности генов HLA-E и HLA-G, которые, по-видимому, независимо и синергично уменьшали чувствительность к передаче ВИЧ-инфекции при гетеросексуальных контактах.
Определение основных популяций (Т-клетки, В-клетки, натуральные киллеры) и субпопуляций Т-лимфоцитов (Т-хелперы, Т-ЦТЛ). Для первичного исследования иммунного статуса и выявления выраженных нарушений иммунной системы ВОЗ рекомендовано определение CD3, CD4, CD8, CD19, CD16+56, соотношение CD4/CD8. Исследование позволяет определить относительное и абсолютное количество основных популяций лимфоцитов: Т-клетки – CD3, В-клетки – CD19, натуральные киллеры (NK) – CD3- CD16++56+, субпопуляции Т лимфоцитов (Т-хелперы CD3+ CD4+, Т-цитотоксические CD3+ CD8+ и их соотношение).
Метод исследования
Иммунофенотипирование лимфоцитов проводится c использованием моноклональных антител к поверхностным дифференцировочным ангинам на клетках иммунной системы, методом проточной лазерной цитофлуорометрии на проточных цитофлуориметрах.
Выбор зоны анализа лимфоцитов производится по дополнительному маркеру CD45, который представлен на поверхности всех лейкоцитов.
Условия взятия и хранения образцов
Невыполнение этих условий приводит к некорректным результатам.
Интерпретация результатов
Т-лимфоциты (CD3+ клетки). Повышенное количество свидетельствует о гиперактивности иммунитета, наблюдается при острых и хронических лимфолейкозах. Увеличение относительного показателя встречается при некоторых вырусных и бактериальных инфекциях в начале заболевания, обострениях хронических заболеваний.
Снижение абсолютного количества Т-лимфоцитов свидетельствует о недостаточности клеточного иммунитета, а именно о недостаточности клеточно-эффекторного звена иммунитета. Выявляется при воспалениях разнообразной этиологии, злокачественных новообразованиях, после травмы, операций, инфаркта, при курении, приеме цитостатиков. Повышение их числа в динамике заболевания – клинически благоприятный признак.
В-лимфоциты (CD19+ клетки) Снижение наблюдается при физиологических и врожденных гипогаммаглобулинемиях и агаммаглобулинемиях, при новообразованиях иммунной системы, лечении иммунодепрессантами, острой вирусной и хронической бактериальной инфекциях, состоянии после удаления селезенки.
Увеличение отмечается при аутоиммунных заболеваниях, хронических заболеваниях печени, циррозе, муковисцедозе, бронхиальной астме, паразитарных и грибковых инфекциях. Характерно в период реконвалесценции после перенесенных острых и хронических вирусных и бактериальных инфекций. Выраженное увеличение наблюдается при хроническом В-лимфолейкозе.
NK-лимфоциты с фенотипом CD3-CD16++56+ Натуральные киллеры (NK-клетки) – популяция больших гранулярных лимфоцитов. Они способны лизировать клетки-мишени, инфицированные вирусами и другими внутриклеточными антигенами, опухолевые клетки, а также другие клетки аллогенного и ксеногенного происхождения.
Увеличение количества NK-клеток связано с активацией антитрансплантационного иммунитета, в некоторых случаях отмечается при бронхиальной астме, встречается при вирусных заболеваниях, повышается при злокачественных новообразованиях и лейкозах, в периоде реконвалесценции.
Снижение наблюдается при врожденных иммунодефицитах, паразитарных инфекциях, аутоиммунных заболеваниях, облучении, лечении цитостатиками и кортикостероидами, стрессе, дефиците цинка.
Т-лимфоциты хелперы с фенотипом CD3+CD4+ Увеличение абсолютного и относительного количества наблюдается при аутоиммунных заболеваниях, может быть при аллергических реакциях, некоторых инфекционных заболеваниях. Это увеличение свидетельствует о стимуляции иммунной системы на антиген и служит подтверждением гиперреактивных синдромов.
Снижение абсолютного и относительного количества Т-клеток свидетельствует о гипореактивном синдроме с нарушением регуляторного звена иммунитета, является патогномичным признаком для ВИЧ-инфекции; встречается при хронических заболеваниях (бронхитах, пневмониях и т.д.), солидных опухолях.
Т-цитотоксические лимфоциты с фенотипом CD3+ CD8+ Повышение выявляется практически при всех хронических инфекциях, вирусных, бактериальных, протозойных инфекциях. Является характерным для ВИЧ-инфекции. Снижение наблюдается при вирусных гепатитах, герпесе, аутоиммунных заболеваниях.
Соотношение CD4+/CD8+ Исследование соотношения CD4+/CD8+ (CD3, CD4, CD8, CD4/CD8) рекомендовано только для мониторинга ВИЧ-инфекции и контроля эффективности АРВ терапии. Позволяет определить абсолютное и относительное количество Т-лимфоцитов, субпопуляций Т-хелперов, ЦТЛ и их соотношение.
Диапазон значений – 1,2–2,6. Снижение наблюдается при врожденных иммунодефицитах (синдром Ди-Джоржи, Незелофа, Вискотта-Олдрича), при вирусных и бактериальных инфекциях, хронических процессах, воздействии радиации и токсических химических веществ, множественной миеломе, стрессе, снижается с возрастом, при эндокринных заболеваниях, солидных опухолях. Является патогномичным признаком для ВИЧ-инфекции (менее 0,7).
Увеличение значения более 3 – при аутоиммунных заболеваниях, остром Т-лимфобластном лейкозе, тимоме, хроническом Т-лейкозе.
Изменение соотношения может быть связано с количеством хелперов и ЦТЛ у данного пациента. Например, снижение количества CD4+ Т-клеток при острой пневмонии в начале заболевания ведет к снижению индекса, а ЦТЛ при этом могут не измениться.
Для дополнительного исследования и выявления изменений иммунной системы при патологиях требующих оценки наличия острого или хронического воспалительного процесса и степени его активности, рекомендуется включать подсчет количества активированных Т-лимфоцитов с фенотипом CD3+HLA-DR+ и ТNK–клеток с фенотипом CD3+CD16++56+.
Т-активированные лимфоциты с фенотипом CD3+HLA-DR+ Маркер поздней активации, показатель гиперреактивности иммунитета. По экспрессии данного маркера можно судить о выраженности и силе иммунного ответа. Появляется на Т-лимфоцитах после 3-го дня острого заболевания. При благоприятном течении заболевания снижается до нормы. Увеличение экспрессии на Т-лимфоцитах может быть при многих заболеваниях, связанных с хроническим воспалением. Отмечено его повышение у пациентов с гепатитом С, пневмониями, ВИЧ-инфекцией, солидными опухолями, аутоиммунными заболеваниями.
ТNK-лимфоциты с фенотипом CD3+CD16++CD56+ Т-лимфоциты, несущие на своей поверхности маркеры CD16++ CD 56+. Эти клетки имеют свойства как Т-, так и NK-клеток. Исследование рекомендовано как дополнительный маркер при острых и хронических заболеваниях.
Снижение их в периферической крови может наблюдаться при различных органоспецифических заболеваниях и системных аутоиммунных процессах. Увеличение отмечено при воспалительных заболеваниях разной этиологии, опухолевых процессах.
Исследование ранних и поздних маркеров активации Т-лимфоцитов (CD3+CD25+, CD3-CD56+, CD95, CD8+CD38+) дополнительно назначают для оценки изменений ИС при острых и хронических заболеваниях, для диагностики, прогноза, мониторинга течения заболевания и проводимой терапии.
Т-активированные лимфоциты с фенотипом CD3+CD25+, рецeптор к ИЛ2 CD25+ – маркер ранней активации. О функциональном состоянии Т-лимфоцитов (CD3+) свидетельствует количество экспрессирующих рецепторов к ИЛ2 (CD25+). При гиперактивных синдромах количество этих клеток возрастает (острые и хронические лимфолейкозы, тимома, отторжение трансплантата), кроме того, повышение их может свидетельствовать о ранней стадии воспалительного процесса. В периферической крови их можно выявить в первые три дня болезни. Снижение числа этих клеток может наблюдаться при врожденных иммунодефицитах, аутоиммунных процессах, ВИЧ-инфекции, грибковых и бактериальных инфекциях, ионизирующей радиации, старении, отравлении тяжелыми металлами.
Т-цитотоксические лимфоциты с фенотипом CD8+CD38+ Присутствие CD38+ на ЦТЛ лимфоцитах отмечено у пациентов с разными заболеваниями. Информативный показатель при ВИЧ-инфекции, ожоговой болезни. Увеличение числа ЦТЛ с фенотипом CD8+CD38+ наблюдается при хронических воспалительных процессах, онкологических и некоторых эндокринных заболеваниях. При проведении терапии показатель снижается.
Субпопуляция натуральных киллеров с фенотипом CD3- CD56+ Молекула CD56 – адгезивная молекула, широко представленная в нервной ткани. Кроме натуральных киллеров, экспрессируется на многих типах клеток, в том число на Т-лимфоцитах.
Увеличение данного показателя свидетельствуют о расширении активности специфического клона клеток киллеров, которые имеют меньшую цитолитическую активность, чем NK-клетки с фенотипом CD3- CD16+. Количество этой популяции возрастает при гематологических опухолях (ЕК-клеточная или Т-клеточная лимфома, плазмоклеточная миелома, апластическая крупноклеточная лимфома), хронических заболеваниях, некоторых вырусных инфекциях.
Снижение отмечается при первичных иммунодефицитах, вирусных инфекциях, системных хронических заболеваниях, стрессе, лечении цитостатиками и кортикостероидами.
Рецептор CD95+ – один из рецепторов апоптоза. Апоптоз – сложный биологический процесс, необходимый для удаления из организма поврежденных, старых и инфицированных клеток. Рецептор CD95 экспрессируется на всех клетках иммунной системы. Он играет важную роль в контроле функционирования иммунной системы, так как является одним из рецепторов апоптоза. Его экспрессия на клетках определяет готовность клеток к апоптозу.
Снижение доли CD95+-лимфоцитов в крови пациентов свидетельствует о нарушении эффективности последнего этапа выбраковки дефектных и инфицированных собственных клеток, что может привести к рецидиву заболевания, хронизации патологического процесса, развитию аутоиммунных заболеваний и повышению вероятности опухолевой трансформации (к примеру, рака шейки матки при папилломотозной инфекции). Определение экспрессии CD95 имеет прогностическое значение при миело- и лимфопролифератиных заболеваниях.
Повышение интенсивности апоптоза наблюдается при вирусных заболеваниях, септических состояниях, при употреблении наркотических средств.
Активированные лимфоциты CD3+CDHLA-DR+, CD8+CD38+, CD3+CD25+, CD95. Тест отражает функциональное состояние Т-лимфоцитов и рекомендован для контроля за течением заболевания и контроля иммунотерапии при воспалительных заболеваниях разной этиологии.
Решающее значение в постановке диагноза ВИЧ-инфекции играет лабораторная диагностика, которая заключается в обнаружении АТ к ВИЧ в крови методом ИФА с последующим подтверждением положительных результатов методом ИБ. Такой метод диагностики ВИЧ-инфекции позволяет выявлять ВИЧ-инфицированных лиц с эффективностью 99%.
Показания к применению различных лабораторных исследований и особенности интерпретации результатов
В настоящее время для скринингового этапа диагностики ВИЧ-инфекции используются наборы реагентов третьего и четвертого поколений, основанные на методе ИФА. Отличительной особенностью тестов четвертого поколения является возможность одновременного выявления АГ (p24) и суммарных АТ, в то время как тесты третьего поколения позволяют определять только АТ. По возможности, предпочтение должно отдаваться тестам четвертого поколения, ввиду их более высокой диагностической чувствительности и возможности выявления инфекции у лиц в период серологического окна.
Отрицательный результат при выявлении АТ к ВИЧ методом ИФА не всегда свидетельствует об отсутствии заражения. Серьезную проблему представляют те случаи, когда тест проведен в период серологического окна, т.е. в первые недели после заражения, когда еще не выработались в достаточном количестве АТ к ВИЧ. У отдельных лиц период серологического окна может затянуться на несколько месяцев, поэтому при наличии данных, свидетельствующих о контакте с инфицированными ВИЧ, обычно проводят повторные исследования через 2–3 месяца. Ложноотрицательные результаты выявления АТ к ВИЧ при использовании ИФА могут быть получены в терминальной стадии болезни, характеризующейся тяжелым поражением иммунной системы с глубоким нарушением процесса образования АТ.
Положительный результат выявления АТ методом ИФА указывает на вероятность заражения ВИЧ-инфекцией, но иногда этот результат может быть ложноположительным, например, при наличии у человека опухолей, аллергических заболеваний, во время беременности, при аутоиммунных заболеваниях, существенных изменениях показателей биохимического исследования крови, ряде хронических заболеваний. В таких случаях требуются дополнительные исследования в экспертной лаборатории.
В случае получения положительного результата выявления АТ к ВИЧ методом ИФА требуется его подтверждение. На первом этапе подтверждения анализ повторяют в той же тест-системе в двух лунках — это позволяет исключить технические ошибки. Если результат подтвердился, определение АТ методом ИФА в сыворотке пациента повторяют, используя два референтных набора реагентов. Если хотя бы в одном из таких исследований получен положительный результат, предпринимают третью стадию подтверждения: исследование методом ИБ, который позволяет выявить АТ к отдельным белкам-антигенам ВИЧ.
Результаты, полученные методом ИБ, интерпретируются как положительные, сомнительные и отрицательные. Отрицательными (негативными) считают результаты, если в исследуемой сыворотке не обнаружены АТ ни к одному из АГ ВИЧ или имеется слабая реакция с белком р17. Наиболее веским основанием для положительной реакции является обнаружение АТ к белкам оболочки ВИЧ (гликопротеидам gp41, gp120, gp160). Результат считается положительным в случае обнаружения АТ к каким-либо двум гликопротеидам ВИЧ. При наличии реакции только с одним из белков оболочки, в сочетании с реакцией с другими белками или без нее, результат считается сомнительным, в этом случае рекомендуется провести исследования для обнаружения АГ р24 или ДНК/РНК ВИЧ. Если выявлен АГ р24 или ДНК/РНК ВИЧ, повторное обследование с использованием ИБ проводится через 2 недели после получения первого неопределенного результата и в дальнейшем через каждые 2 недели до получения положительного результата в подтверждающем тесте. Если через 6 месяцев после первого обследования вновь будут получены неопределенные результаты, а у пациента не будут выявлены факторы риска заражения и клинические симптомы ВИЧ-инфекции, результат расценивается как ложноположительный.
Нередко по прошествии 1–3–6 месяцев с момента получения сомнительного результата в сыворотке крови появляются одно за другим АТ ко всем АГ ВИЧ. В этом случае сомнительный результат – свидетельство начальной стадии ВИЧ-инфекции. В ряде случаев сомнительные результаты ИБ наблюдаются у неинфицированных лиц, в организме которых есть АТ, схожие с истинными АТ к ВИЧ.
Одним из косвенных признаков ВИЧ-инфекции является избирательное уменьшение CD4+ Т-клеток хелперов в связи с тем, что ВИЧ обладает тропностью к клеточному рецептору CD4. Однако эти изменения могут отсутствовать на определенных стадиях ВИЧ-инфекции, иметь индивидуальные колебания у разных пациентов, а также встречаться при других заболеваниях. Так, у взрослых пациентов, находящихся в латентной стадии заболевания, количество CD4+ лимфоцитов обычно превышает 0,5 . 109/л, что соответствует значениям у здоровых людей.
Главный комплекс гистосовместимости (HLA): структура, гены
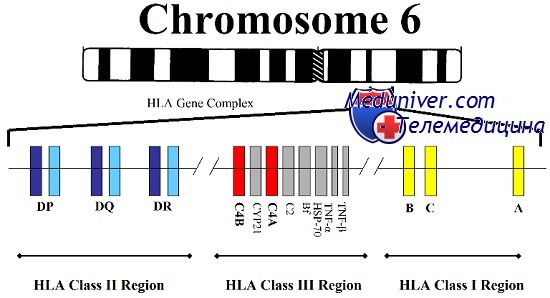
МНС формируется большой группой генов, расположенных на коротком плече хромосомы 6. На основе структурных и функциональных различий эти гены подразделяют на три класса, два из которых, класс I и класс II, относятся к генам HLA, первоначально обнаруженных благодаря их значению в пересадке тканей между неродственными индивидуумами.
Гены класса I (HLА-А, HLA-B и HLA-C) кодируют белки, выступающие неотъемлемой частью плазматической мембраны всех ядерных клеток. Белки класса I состоят из двух полипептидных субъединиц: вариабельной тяжелой цепи, кодируемой в пределах МНС, и неполиморфного полипептида, b2-микроглобулина, кодируемого геном, расположенным за пределами МНС и картированным на хромосоме 15. Производные от внутриклеточных белков пептиды образуются путем протеолитического расщепления большими многофункциональными протеазами; затем пептиды перемещаются на поверхность клетки и прикрепляются к молекулам класса I, формируя пептидный антиген для цитотоксических Т-клеток.
Регион класса II состоит из нескольких локусов, таких как HLA-DP, HLA-DQ и HLA-DR, кодирующих поверхностные белки клеточной оболочки. Каждая молекула класса II — гетеродимер, сформированный из а- и b-субъединиц, закодированных в МНС. Молекулы класса II представляют пептиды, производные от внеклеточных белков, которые захватываются лизосомами и перерабатываются в пептиды, узнаваемые Т-клетками.
В пределах МНС присутствуют локусы и других генов, но не имеющих функционального отношения к генам HLA класса I и II и не определяющих гистосовместимость или иммунные ответные реакции. Некоторые из этих генов, тем не менее, связаны с болезнями, например врожденной гиперплазией надпочечников, вызываемую недостаточностью 21-гидроксилазы, и гемохроматозом, болезнью печени, вызванной накоплением железа.
Аллели и гаплотипы главного комплекса гистосовместимости (HLA)
Система HLA сначала может показаться запутанной, поскольку номенклатура, используемая для определения и описания разных аллелей HLA, подвергалась фундаментальным изменениям по мере распространения секвенирования ДНК МНС. Согласно более старой, традиционной системе номенклатуры HLA, разные аллели отличались друг от друга серологически. Индивидуальные типы HLA определялись тем, как панель различных антисывороток или чувствительных лимфоцитов реагирует на клетки.
Антисыворотки и клетки получали от сотен беременных, развивших иммунный ответ против отцовских антигенов I и II типа, экспремируемых плодами в ходе беременности. Если клетки от двух не связанных родственными отношения индивидуумов вызывали ту же реакцию при внесении в панель антител и клеток, считали, что они имеют те же типы и аллели HLA, обозначаемые их номером, например В27 в локусе HLA-B класса I или DR3 в локусе DR класса II.
Тем не менее после идентификации и секвенирования генов, ответственных за кодирование цепей МНС класса I и класса II, отдельные первоначально определенные серологически аллели HLA даже в пределах одного серологического аллеля оказались состоящими из многочисленных аллелей, определяемых различными вариантами последовательности ДНК. 100 серологически определяемых типов HLA-A, В, С, DR, DQ и DP теперь включают более 1300 аллелей, определяемых на уровне последовательности ДНК.
Например, в гене HLA-B, прежде определявшемся серологической реакцией как единый аллель В27, обнаружено более 24 различных вариантов последовательности нуклеиновых кислот. Большинство, хотя и не все, варианты ДНК представляют изменение кодона триплета и, следовательно, аминокислоты в пептиде, кодируемом этим аллелем. Каждый аллель, изменяющий аминокислоту в пептиде HLA-B, получает свой дополнительный последовательный номер, например аллель1, 2, и так далее в группе аллелей, соответствующих ранее единственному аллелю В27, и теперь называется HLA-B*2701, HLA-B*2702 и так далее.
Набор аллелей HLA в различных локусах класса I и II в данной хромосоме формирует гаплотип. Аллели кодоминантны; каждый из родителей имеет два гаплотипа и экспрессирует их оба. Эти локусы располагаются достаточно близко друг к другу, так что в конкретной семье гаплотип может передаваться ребенку как единый блок. В результате родитель и ребенок имеют общий гаплотип, а шанс, что два сибса унаследуют один гаплотип HLA, равен 25%.
Поскольку приживление пересаженных тканей в основном согласуется со степенью сходства между HLA гаплотипами донора и реципиента (и группы крови АВО), лучший донор костного мозга или органа — АВО-совместимый и HLA-идентичный сибс реципиента.
В любой этнической группе некоторые аллели HLA обнаруживаются часто, а другие — редко или никогда. Аналогично некоторые гаплотипы встречаются чаще, чем ожидалось, тогда как другие — исключительно редко или не встречаются вовсе. Например, большинство из Зх107 теоретически возможных комбинаций аллелей в гаплотипе в белой популяции никогда не встречаются. Это ограничение в разнообразии гаплотипов в популяции, возможно, вызвано ситуацией, получившей название неравновесного сцепления и может объясняться сложным взаимодействием множества факторов.
Эти факторы включают низкие показатели мейотической рекомбинации из-за небольшого расстояния между локусами HLA; влияние окружающей среды, обеспечивающее положительный отбор для конкретных комбинаций аллелей HLA, формирующих гаплотип; и исторические факторы, например, как давно образовалась популяция, число основателей и интенсивность происходившей иммиграции (см. далее в этой главе).
Между популяциями также существуют значительные различия в частоте аллелей и гаплотипов. То, что бывает частым аллелем или гаплотипом в одной популяции, может оказаться очень редким в другой. Различия в распределении и частоте аллелей и гаплотипов в пределах МНС — результат сложного взаимодействия генетических, средовых и исторических факторов в каждой конкретной популяции.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

