Хламидии микоплазмы цитомегаловирус у ребенка
Обновлено: 19.04.2024
Cреди всех видов пневмоний практическому врачу наиболее часто приходится сталкиваться с внебольничной пневмонией. По данным официальной статистики МЗ РФ, заболеваемость внебольничной пневмонией в России среди лиц старше 18 лет составляет
Cреди всех видов пневмоний практическому врачу наиболее часто приходится сталкиваться с внебольничной пневмонией. По данным официальной статистики МЗ РФ, заболеваемость внебольничной пневмонией в России среди лиц старше 18 лет составляет 3,9%. Зарубежные исследователи установили, что заболеваемость внебольничной пневмонией среди лиц молодого и среднего возраста варьирует от 1 до 11,6%, а в старшей возрастной группе достигает 25–44% [11, 13].
Наиболее распространенной причиной внебольничных пневмоний является Streptococcus pneumoniae (30–50%) [5, 11, 13]. Однако все большее значение среди этиологических факторов внебольничной пневмонии в последние годы придается так называемым атипичным микроорганизмам, прежде всего Mycoplasma pneumoniae и Chlamydophila (Chlamidia) pneumoniae, на долю которых приходится от 8 до 25% случаев заболевания [5, 9, 12].
Mycoplasma pneumoniae в структуре внебольничных пневмоний варьирует в пределах 5–50% [7, 11, 13]. Наиболее часто микоплазменная пневмония диагностируется у детей старше 5 лет и лиц молодого возраста (до 25 лет) [3, 4, 7, 10]. Каждые 3–5 лет наблюдаются эпидемиологические подъемы заболеваемости, которые длятся несколько месяцев. Вспышки заболевания характерны для изолированных и полуизолированных групп населения (военнослужащие, студенты, школьники и др., семейные вспышки) [10, 11]. Признается наличие сезонных колебаний, а именно большая распространенность инфекции в осенне-зимний период [6, 10, 13]. Источником инфекции являются как больные, так и носители. Механизм передачи инфекции — аэрогенный, путь передачи — воздушно-капельный. Инкубационный период длится 2–3 нед. Летальность при микоплазменной пневмонии составляет 1,4% [4, 11].
Mycoplasma pneumoniae занимает промежуточное положение между вирусами, бактериями и простейшими и является мембрано-ассоциированным (но может быть и внутриклеточным) анаэробом, имеет трехслойную цитоплазматическую мембрану вместо клеточной стенки, что обусловливает резистентность к различным агентам, подавляющим синтез клеточной стенки, прежде всего к пенициллину и другим β-лактамам [6, 10]. С помощью терминальной структуры микоплазма прикрепляется к клеткам хозяина (эритроцитам, клеткам реснитчатого эпителия бронхов и др.) [6]. Микоплазма также обладает механизмом мимикрии под антигенный состав клетки-хозяина, что способствует длительной персистенции возбудителя и вызывает образование аутоантител и развитие аутоиммунных процессов при микоплазменной инфекции [6, 10]. Предполагается, что именно с формированием аутоантител связано развитие нереспираторных проявлений Mycoplasma pneumoniae-инфекции.
Считается, что от 5 до 15% внебольничных пневмоний вызываются хламидиями, а в период эпидемии эти показатели могут увеличиваться до 25% [4, 5, 10]. Наиболее часто хламидийная пневмония встречается у взрослых, особенно у лиц среднего и пожилого возраста [2, 10]. Описаны эпидемиологические вспышки в изолированных и полуизолированных коллективах, случаи внутрисемейной передачи хламидийной инфекции [7, 10, 13]. Сезонной закономерности распространения этой инфекции не выявлено. Единственным известным резервуаром инфекции является человек. Механизм передачи — аэрогенный, путь передачи — воздушно-капельный. Инкубационный период составляет 2–4 нед. Летальность при хламидийных пневмониях достигает 9,8% [4, 5, 13].
Chlamydophila pneumoniae — это патогенные облигатные внутриклеточные грамотрицательные бактерии, способные к латентному существованию или персистенции в организме хозяина. Характеризуются двухфазным циклом развития, состоящим из чередования функционально и морфологически различных форм — элементарных и ретикулярных телец [2, 4, 7, 10].
Клинические проявления микоплазменнойи хламидийной пневмоний
У 30–40% пациентов, заболевших микоплазменной и/или хламидийной пневмонией, диагноз ставится лишь в конце первой недели болезни; первоначально у них чаще всего ошибочно диагностируются бронхит, трахеит или ОРЗ. Это связано с тем, что, в отличие от бактериальных пневмоний, микоплазменная и хламидийная не имеют отчетливых физикальных и рентгенологических признаков инфильтрации, а культуральная диагностика их невозможна, так как микоплазмы и хламидии являются внутриклеточными возбудителями. Поэтому диагностика микоплазменной и хламидийной пневмоний основывается в первую очередь на выявлении особенностей клинико-рентгенологических данных и подтверждается серологически или с помощью полимеразно-цепной реакции (ПЦР).
Обычно микоплазменная и хламидийная пневмонии начинаются с респираторного синдрома, проявляющегося трахеобронхитом, назофарингитом, ларингитом; протекают с субфебрильной температурой, малопродуктивным, мучительным кашлем, скудными аускультативными данными; характеризуются наличием внелегочных проявлений — кожных, суставных, гематологических, гастроэнтерологических, неврологических и других, а также нетипичными лабораторными показателями — отсутствием лейкоцитоза и нейтрофильного сдвига в периферической крови [3, 4, 7, 10, 11]. Рентгенологические изменения в легких отмечаются усилением легочного рисунка, перибронхиальной или субсегментарной инфильтрацией [5, 10, 11, 13].
Нами были обследованы 60 пациентов: 44 — с микоплазменной пневмонией и 16 — с хламидийной пневмонией. Анализ клинического материала показал, что начало заболевания при микоплазменной и хламидийной пневмониях может быть как острым, так и постепенным (табл. 1). При подостром течении пневмония начинается с поражения верхних дыхательных путей, ухудшения общего состояния и познабливания. Температура тела может быть нормальной или субфебрильной в течение 6–10 дней и лишь потом повышается до 38–39,9°С при микоплазменной и до 38–38,9°С при хламидийной пневмонии. При остром начале симптомы интоксикации появляются уже в первый день и достигают максимума к 3-му дню болезни. У пациентов с постепенным началом болезни интоксикация наиболее выражена на 7–12-й день от начала заболевания. Характерными признаками интоксикации для микоплазменной и хламидийной пневмоний являются умеренная головная боль, миалгия, общая слабость.
Одним из постоянных признаков микоплазменной и хламидийной пневмоний, по нашим данным, является кашель, который возникает одновременно с лихорадкой. У больных микоплазменной пневмонией, в отличие от хламидийной, наблюдается частый, преимущественно непродуктивный, навязчивый, мучительный, приступообразный кашель (см. табл. 1). Наряду с кашлем, у пациентов с хламидийной и микоплазменной пневмониями наблюдаются умеренные признаки поражения верхних дыхательных путей — ринит, фарингит, ларингит. Ринит чаще всего встречается у больных хламидийной пневмонией (75,0 ± 10,8%, р < 0,001) и проявляется заложенностью носа и нарушением носового дыхания, у части больных наблюдаются небольшие либо умеренные слизисто-серозные или слизисто-гнойные выделения из носа. У пациентов же с микоплазменной пневмонией чаще регистрируются явления фарингита и ларингита, проявляющиеся гиперемией ротоглотки и осиплостью голоса (77,3 ± 6,3%, р < 0,05).
Из внелегочных проявлений при микоплазменной пневмонии чаще отмечались миалгия (63,6%), макуло-папулезная сыпь (22,7%), явления желудочно-кишечного дискомфорта (25%), при хламидийной — артралгия (18,8%) и миалгия (31,3%).
Изменения в легких, характерные для уплотнения легочной ткани, при физикальном обследовании пациентов с пневмониями, вызванными атипичными возбудителями (в отличие от больных с бактериальными пневмониями), определялись не всегда. В частности, укорочение перкуторного звука у больных микоплазменной и хламидийной пневмониями наблюдалось в 68,2 и 68,8% случаев соответственно (табл. 1). Этот признак всегда выявлялся у больных с сегментарной, полисегментарной, долевой пневмонией и лишь у 1/3 пациентов с перибронхиальной инфильтрацией. У больных микоплазменной пневмонией над зоной поражения чаще выслушивались ослабленное дыхание (40,9%), сухие и влажные хрипы (47,7%), у пациентов с хламидийной пневмонией — как ослабленное (37,5%), так и бронхиальное дыхание (31,2%) и влажные хрипы (62,5%).
При рентгенографии органов грудной клетки у больных микоплазменной и хламидийной пневмониями выявлялись и типичные пневмонические инфильтрации и интерстициальные изменения. При микоплазменной пневмонии чаще наблюдается двустороннее поражение легких (40,9%) с усилением легочного рисунка (22,7%) и перибронхиальной инфильтрацией (50%), при хламидийной пневмонии — наоборот, чаще полисегментарная инфильтрация (43,7%) и реже интерстициальные изменения (31,3%).
В общем анализе крови у больных микоплазменной и хламидийной пневмониями чаще отмечается нормальное количество лейкоцитов и умеренное повышение СОЭ (в среднем 37,1 ± 1,9 мм/ч).
По нашим наблюдениям, для микоплазменной и хламидийной пневмоний характерно затяжное рецидивирующее течение.
Таким образом, согласно клинико-рентгенологическим данным и с учетом эпидемиологической ситуации, из общего числа пациентов с внебольничными пневмониями можно выделить больных с микоплазменной и/или хламидийной пневмониями. В нашем исследовании таких больных оказалось 80, из них у 60 (75%) в дальнейшем лабораторным методом была установлена микоплазменная или хламидийная этиология пневмонии.
Диагностика микоплазменной и хламидийной пневмоний
Решающая роль в выявлении микоплазменной и хламидийной инфекции отводится лабораторной диагностике.
Также в последнее время для этиологической диагностики микоплазменной и хламидийной инфекции используется ПЦР, основанная на определении ДНК возбудителя с применением метода генных зондов [3, 4, 5, 7, 10]. С помощью ПЦР возможна быстрая диагностика микоплазменной и хламидийной инфекции, но этот метод не позволяет отличить активную инфекцию от персистирующей [1, 7, 10, 11].
Таким образом, для достоверной этиологической идентификации микоплазменной и хламидийной пневмоний необходимо проведение серологических тестов в комплексе с методами, основанными на выявлении ДНК микроорганизма.
Лечение микоплазменной и хламидийной пневмоний
Рассмотренные выше микробиологические особенности Mycoplasma pneumoniae и Chlamydophila pneumoniae (главным образом внутриклеточный цикл развития) объясняют неэффективность широко используемых в клинической практике β-лактамных антибиотиков (пенициллины и цефалоспорины) и обусловливают необходимость применения антимикробных препаратов, способных проникать и накапливаться в пораженных клетках, а также блокировать внутриклеточный синтез белка. Такими свойствами обладают макролиды, фторхинолоны и тетрациклины, которые и являются средствами эрадикационной терапии при Mycoplasma pneumoniae- и Chlamydophila pneumoniae-инфекции [3, 4, 7, 10, 11].
В России макролиды представлены широким спектром препаратов (см. табл. 3). Среди них наиболее активным в отношении Mycoplasma pneumoniae признан азитромицин, имеющий ряд преимуществ перед эритромицином и кларитромицином [4, 10, 11]. В отношении Chlamydophila pneumoniae наиболее активным средством признается кларитромицин [10]. Также эффективны в отношении этих внутриклеточных патогенов и некоторые другие представители макролидов: джозамицин, спирамицин. Старый антимикробный препарат из этой группы — эритромицин — также обладает антимикоплазменной и антихламидийной активностью, но, несомненно, уступает в этом отношении вышеперечисленным антибиотикам, обладая при этом целым рядом побочных эффектов [5, 10, 11].
Значительной активностью по отношению к Mycoplasma pneumoniae и Chlamydophila pneumoniae обладают фторхинолоны — офлоксацин (заноцин, таривид, офло), ципрофлоксацин (ципробай, ципролет, цифран, сифлокс, медоциприн, цифлоксинал), в связи с чем эти антимикробные препараты рассматриваются в качестве альтернативы макролидам при данной инфекции. Высокую активность проявляют новые фторхинолоны — левофлоксацин (таваник) и моксифлоксацин (авелокс). Моксифлоксацин и левофлоксацин успешно подавляют практически любую флору, вызывающую пневмонии.
При лечении микоплазменных и хламидийных пневмоний эффективны и тетрациклины, однако антибиотики этой группы не применяются при беременности, а также печеночной недостаточности. Вероятность проявления побочных эффектов при их применении может быть выше. Из тетрациклинов активны в отношении атипичных микроорганизмов доксициклин и моноциклин (см. табл. 3).
Продолжительность антимикробной терапии неосложненных бактериальных внебольничных пневмоний составляет 5–10 дней. Для лечения микоплазменной и хламидийной пневмоний рекомендуется применять антимикробные средства не менее 2–3 нед [4, 5, 10, 11]. Сокращение сроков лечения чревато развитием рецидива инфекции [4, 10].
При нетяжелом течении микоплазменной и хламидийной пневмоний антимикробные препараты назначаются внутрь в среднетерапевтических дозах. Естественно, при тяжелых пневмониях предпочтение следует отдавать внутривенному применению антибиотика. Эритромицин фосфат назначается до 1–2 г/сут в 2–3 введения (максимально по 1 г каждые 6 ч). Спирамицин используется внутривенно по 1,5 млн МЕ 3 раза в сутки, а кларитромицин — по 250 мг 2 раза в сутки с равными интервалами. Для разведения спирамицина и кларитромицина следует применять 5%-ный раствор глюкозы.
Стоимость внутривенного лечения антибиотиками (в частности, макролидами) весьма высока, поэтому используют ступенчатую терапию, при которой лечение начинается с внутривенного применения антибиотиков, а по достижении клинического эффекта (обычно через 2–3 дня) пациент переводится на пероральную терапию тем же препаратом или другим макролидом. Ступенчатая монотерапия макролидами может проводиться эритромицином, кларитромицином, спирамицином, т. е. препаратами, которые выпускаются в двух формах: для внутривенного введения и для приема внутрь.
Несмотря на большой спектр противомикробных препаратов, эффективное лечение микоплазменных и хламидийных пневмоний представляет до настоящего времени большую проблему [2, 6, 10, 11]. Это связано с тем, что их развитие, как правило, происходит на фоне снижения антиинфекционной резистентности организма, обусловленного угнетением иммунитета [8, 9, 10, 12]. Проведенное нами исследование показателей иммунограммы у пациентов с внебольничной пневмонией микоплазменной и хламидийной этиологии выявило снижение абсолютного числа лимфоцитов, зрелых Т-лимфоцитов (CD3+), Т-хелперов (CD4+), абсолютного числа Т-супрессоров (CD8+), угнетение функциональной активности Т-системы, проявляющееся снижением плотности рецепторов к IL-2 (CD25+), способности к бласттрансформации (CD71+ — лимфоциты) и апоптозу (CD95+), а также активацию гуморального иммунитета, что проявлялось повышением числа В-лимфоцитов (CD20+), уровня IgM и ЦИК.
Микоплазмы и хламидии на разных стадиях развития располагаются как внутриклеточно, так и внеклеточно, что требует для их элиминации участия гуморальных и клеточных механизмов иммунитета [8, 9, 10, 12]. Большинство антимикробных средств действует преимущественно на внеклеточную форму возбудителей. Это приводит к персистенции возбудителей, диссеминации ее в организме, хронизации процесса, формированию осложнений. Применение лишь антимикробных средств означает лишь временное подавление возбудителей, так как на фоне такой терапии происходит сохранение и даже усугубление иммунологических расстройств, что повышает риск рецидива заболеваний [14]. Так, по результатам наших исследований, к концу курса традиционной терапии происходило усугубление Т-клеточной депрессии: снижалось относительное и абсолютное количество Т-лимфоцитов (CD3+), Т-хелперов (CD4+), Т-супрессоров (CD8+) на фоне повышения уровня IgG, ЦИК, фагоцитарного индекса и уменьшения IgA.
В связи с этим хотелось бы подчеркнуть, что терапия микоплазменной и хламидийной пневмоний должна быть комплексной и включать, помимо антимикробных средств, препараты, действие которых направлено на коррекцию иммунного ответа.
С этой целью у больных микоплазменной и хламидийной пневмониями нами применяются иммуномодуляторы (ронколейкин, ликопид, тималин, тимоген).
Включение иммуномодуляторов в комплексное лечение микоплазменных и хламидийных пневмоний позволяет добиться ярко выраженного иммунологического эффекта. Последний сочетается с выраженным клиническим воздействием, проявляющимся сокращением сроков достижения клинико-лабораторной ремиссии в среднем на 3 койко-дня, уменьшением интоксикационных симптомов через 1–3 сут после начала лечения, сокращением лихорадочного периода в 2 раза, четкой положительной рентгенологической динамикой к 12-му дню лечения у 76,7% больных; значительным уменьшением вероятности развития повторных рецидивов и хронизации процесса.
Литература
- Бочкарев Е. Г. Лабораторная диагностика хламидийной инфекции // Иммунопатология, аллергология, инфектология. — 2000. — № 4. — С. 65–72.
- Гранитов В. М. Хламидиозы. — М., 2000. — 48 с.
- Новиков Ю. К. Атипичные пневмонии // Русский медицинский журнал. — 2002. — Т. 10. — № 20. — С. 915–918.
- Ноников В. Е. Диагностика и лечение атипичных пневмоний // CONSILIUM medicum. — 2001. — T. 3. — № 12. — C. 569–574.
- Проект практических рекомендаций МЗ РФ. Внебольничная пневмония у взрослых: диагностика, лечение, профилактика. — М., 2002. — 51 с.
- Прозоровский С. В., Раковская И. В., Вульфович Ю. В. Медицинская микоплазмология. — М.: Медицина, 1995. — 285 с.
- Синопальников А. И. Атипичная пневмония // Русский медицинский журнал. — 2002. — Т. 10. — № 23. — С. 1080–1085.
- Справочник по иммунотерапии для практического врача / Под ред. А. С. Симбирцева. — СПб.: Диалог, 2002. — 480 с.
- Хаитов Р. М., Игнатьева Г. А., Сидорович И. Г. Иммунология. — М.: Медицина, 2000. — 432 с.
- Хаитов Р. Ф., Пальмова Л. Ю. Mycoplasma pneumoniae и Chlamydophila pneumoniae инфекции в пульмонологии: актуальные вопросы клиники, диагностики и лечения. — Казань, 2001. — 64 с.
- Чучалин А. Г., Синопальников А. И, Чернеховская Н. Е. Пневмония. — М.: Экономика и информатика, 2002. — 480 с.
- Boym A. Separation of leucocytes from blood und bone marrow // Scand J Clin. Lad. Jnvest. — 1968. — V. 21. — Suppl. 87. — P. 77–82.
- Guidelines for management of adult community-acquired lower respiratory tract infections. European Study in Community-acquired Pneumonia (ESOCAP) Committee // Eur Resp J. — 1998. — № 11. — Р. 986–991.
- Kawamoto M., Oshita Y., Yoshida H. et al. Two cases hypoxemic acute broncholitis due to Mycoplasma pneumoniae // Kansenshogaku Zasshi. — 2000. — V. 74. — № 3. — P. 259–263.
Г. Г. Мусалимова, кандидат медицинских наук
В. Н. Саперов, доктор медицинских наук, профессор
Т. А. Никонорова
Чувашский ГМУ, г. Чебоксары
За последние пять лет увеличилось число детей в возрасте до одного года, умерших от генерализованных вирусных инфекций [4]. Велика роль герпес-вирусных инфекций, особенно цитомегаловирусной, в формировании перинатальной патологии и младенческой смертности. Риск развития внутриутробной инфекции зависит от характера взаимоотношений между организмом беременной женщины и микроорганизмом (первичное заражение во время беременности или реактивация ранее приобретенной инфекции).
Проблема врожденной инфекционной патологии является приоритетной для России [5].
Иммуногенез герпес-вирусной инфекции. Длительное нахождение герпес-вируса в организме человека становится возможным благодаря сложной стратегии противоборства и ускользания от иммунной системы хозяина. В достижении этого состояния можно выделить три пути стратегии возбудителя:
Вирус простого герпеса. В инфицированных клетках вирус простого герпеса образует внутриядерные включения и гигантские клетки, оказывает выраженное цитопатическое действие, проявляющееся округлением и образованием многоядерных клеток. Вирус является слабым индуктором интерферона, в связи с чем инактивация вирусной ДНК внутри клеток не наступает и он сохраняется внутри клеток длительное время, периодически вызывая рецидивы заболевания.
ЦМВ. Сущность проблемы ЦМВ-инфекции в том, что последняя относится к так называемым оппортунистическим инфекциям, клинические проявления которых возможно в условиях первичного или вторичного иммунодефицита.
ЦМВ поражает разнообразные клетки, чаще всего лейкоциты (лимфоциты, моноциты), эпителиальные клетки (дыхательных путей, слюнных желез, почек). С клеток крови ЦМВ с большим постоянством переходит на эндотелий, тропизм к которому у него весьма выражен. Поврежденные эндотелиальные клетки постоянно обнаруживаются в токе крови при активной/реактивированной ЦМВ-инфекции. Повреждение эндотелия сосудов имеет собственное патогенетическое значение в формировании органных поражений, так как вызывает ишемию или кровоизлияния в различные ткани [6].
В раннем неонатальном периоде (0–7 дней) у детей с ЦМВ-инфекцией наблюдались симптомы интоксикации, серый колорит кожи, выраженная мышечная гипотония, большая первоначальная потеря массы тела, синдром рвоты или срыгиваний, признаки угнетения ЦНС. В позднем неонатальном периоде (от 7 дней до одного мессяца) анализ клинических проявлений острой ЦМВ-инфекции выявляет поражение многих органов и систем. Так, у всех детей обнаруживаются гипоксически-ишемическая энцефалопатия с трансформацией синдрома угнетения в синдром гипервозбудимости, проявления анемии, патологическая гипербилирубинемия, увеличение печени и селезенки.
ВЭБ относится к подсемейству бета-герпес-вирусов. Вирусный геном заключен в нуклеокапсид, который покрыт гликопротеидным тегументом gp350, являющимся фактором рецепторного взаимодействия [7]. Проникновение вируса в В-лифоциты осуществляется через рецептор этих клеток CD21-рецептор к C3d-компоненту комплемента. ВЭБ-инфекция широко распространена среди людей, причем первичное инфицирование, как правило, происходит в антенатальном или детском возрасте, но манифестация ВЭБ-инфекции в виде отчетливых клинических проявлений инфекционного мононуклеоза в большинстве случаев происходит в школьном возрасте при различного рода иммунопатологических реакциях. Манифестация инфекции в виде инфекционного мононуклеоза может осложняться поражением печени, слизистой оболочки желудка, ткани почек, лимфоидного аппарата.
Особый характер взаимодействия микро- и макроорганизма при хронических персистирующих инфекциях обусловливают трудности лабораторной диагностики. Обнаружение возбудителя не может быть единственным критерием подтверждения диагноза. Необходима комплексная оценка клинических и лабораторных данных для постановки диагноза.
Цель исследования. Определить клинические особенности течения персистирующих герпес-вирусных инфекций у детей и оценить значимость комплекса лабораторных исследований, в том числе показателей общей иммунологической реактивности у больных при персистирующем у них инфекционном процессе.
Материал и методы исследований. Под наблюдением находилось 63 пациента в возрасте от одного месяца до 7 лет, из них детей до одного года было 25, от одного года до трех лет — 22 и старше трех лет — 15 больных. Среди обследованных детей преобладали пациенты первых двух лет жизни — 47 детей (74,6%) и старше двух лет было 15 больных (25,4%).
Результаты. В клинической диагностике персистирующих инфекций у детей следует отводить первостепенное значение неблагополучию акушерского анамнеза матерей больных детей.
Беременность и роды были осложненными у большинства матерей наблюдаемых детей, чаще всего у них отмечались гестозы и угроза выкидыша, рождение недоношенных, в родах гипоксия плода, преждевременная отслойка плаценты, кесарево сечение и др. У 32 женщин из 63 (50,7%) были различные соматические заболевания (хронический пиелонефрит, кольпит, анемия, аутоиммунный тиреоидит и др.). При обследовании беременных женщин было выявлено как моноинфицирование (у 30 из 63–47,6%), так и сочетания инфекций (у 16 из 63–25,4%). Наиболее часто обнаруживались герпес-вирусы и цитомегаловирусы (суммарно у 27 женщин из 63–43%) и реже другие возбудители — хламидии, микоплазмы (у 11 беременных — 17,4%). Высокая частота вышеуказанных осложнений свидетельствует о несомненной роли инфекции как отягощающего фактора в течение гестационного периода и родов.
Заподозрить внутриутробную или персистирующую инфекцию у детей можно было по высокой степени поражения у детей различных органов и систем: ЦНС (71,4%), органов дыхания (88,8%), желудочно-кишечного тракта (95,2%), поражению глаз (31,7%), лимфатического аппарата (15,9%).
В процессе наблюдения за детьми в недалеком прошлом все дети обследовались на состояние микробиоценоза кишечника.
У всех детей обнаруживались нарушения как в основных компонентах биоценоза, так и в составе условно-патогенной флоры. Следует отметить, что у всех пациентов проводилась коррекция микробиоценоза повторными курсами пре- и пробиотиков, однако восстановления микрофлоры до нормобиоценоза не наблюдалось ни у одного пациента. Следовательно, без выявления и адекватного лечения основного заболевания не удается курировать дисбиотические нарушения в организме ребенка.
Закономерен вопрос о правильности выбора комплекса диагностики внутриутробной и персистирующей инфекции у детей. В зависимости от возраста пользуются разными методами диагностики. Важное значение отводится сбору семейного анамнеза. Диагностика внутриутробных инфекций у детей должна опираться на клинические проявления как общего характера, так и на типоспецифические ее признаки, а также основываться на анализе комплекса лабораторных методов обследования [8].
При оценке клинических анализов крови у наблюдаемых детей обращали на себя внимание значительные отклонения в различных показателях гемограммы: выраженная анемизация (у 31,7% пациентов), нейтропения (у 19%), лимфоцитоз (у 27%), лейкопения с лимфоцитопенией (36,5%), ускорение СОЭ (у 27%), что в совокупности свидетельствовало о наличии воспалительного процесса в организме с выраженным снижением иммунореактивности у детей.
При скрининговом серологическом обследовании методом ИФА на внутриутробные инфекции у детей наиболее часто выявлялись положительные титры типоспецифических антител класса IgM и/или IgG к герпес-вирусам. Диагностические титры антител класса IgM и IgG определялись к ЦМВ (у 9 детей), к HV 1-го, 2-го типа (у 9 детей). Антитела к антигенам ВЭБ обнаруживались у 20 детей, из них у 10 детей были антитела класса IgG к раннему антигену ВЭБ и антитела класса IgM к капсидному антигену ВЭБ, что свидетельствовало об активной фазе ВЭБ-инфекции. Остальные 10 пациентов имели антитела класса IgG к нуклеарному (ядерному) антигену ВЭБ, что расценивалось как поздняя стадия инфекции.
У детей при персистирующем течении с реактивацией инфекции, которое чаще возникало после провоцирующих воздействий (ротавирусные диареи, ОРВИ, профилактические прививки) ПЦР-тесты при исследовании биосубстратов: кровь, осадок мочи, секрет из зева давали положительные результаты с последующим нарастанием титра типоспецифических антител по данным ИФА.
Совокупность проведенных исследований позволила выделить у обследованных больных следующие формы инфекций: моноинфекции были у 21 пациента — 31,8% (ЦМВ — у 5 детей, HV 1-го, 2-го типа — у 6 детей и ВЭБ — у 10), у 42 детей из 63 (68,2%) обнаруживались микст-инфекции. У 23 детей была ассоциация ЦМВ с герпес-вирусами (у 9 детей с HV 1-го, 2-го типа, у 3 детей — с HV 6-го типа и у 11 детей — с C. albicans и хламидиями). Микст-формы герпеса 1-го, 2-го типа были выявлены у 9 больных, у них были ассоциации с микоплазмами и хламидиями. Ассоциации ВЭБ были обнаружены у 10 детей (5 больных имели ассоциацию с ЦМВ, пациента — с HV 6-го типа и 2 больных — с Yersinia pseudotuberculosis).
Из 63 больных у 21 (33,3%) с моноинфекцией течение заболевания расценивалось как латентное (с ЦМВ-инфекцией у 5 и HV 1-го, 2-го типа у 6) и как персистирующее (у 10 детей с ВЭБ-инфекцией). У 14 детей из 42 с микст-инфицированием (у 1/3) было персистирующее течение инфекционного процесса (у 3 детей с ЦМВ-инфекцией в ассоциации с HV 6-го типа и у 11 детей с ЦМВ-инфекцией в ассоциации с C. albicans и хламидиями). У 28 детей из 43 (у 2/3) наблюдалось персистирующее течение с реактивацией инфекции (у 9 детей с ЦМВ-инфекцией в ассоциации с HV 1-го, 2-го типа; у 9 детей с HV 1-го, 2-го типа в ассоциации с хламидиями или микоплазмами и у 10 детей с ВЭБ инфекцией в ассоциации с ЦМВ, HV 6-го типа и ВЭБ в ассоциации с Y. pseudotuberculosis).
Коэффициент фагоцитарной защиты у детей с моноинфицированием и микст-формами герпесвирусной инфекции оказался достоверно сниженным по сравнению со средневозрастной нормой для здоровых детей (0,634 ± 0,05 усл. ед. и 0,540 ± 0,03 усл. ед. соответственно при норме 0,946 ± 0,03, Р1–2 и Р2–3 < 0,001 и < 0,001 соответственно). При микст-инфицировании герпес-вирусами КФЗ имел более низкие значения по сравнению с таковым у детей с -моноинфекцией, однако разница недостоверна (Р1–2 > 0,05). Недостаточность защиты клеточно-фагоцитарного звена иммунитета играет важную роль в патогенезе герпес-вирусных инфекций, что должно учитываться в лечении этих заболеваний.
Отклонение величины показателя ИЛМП имело противоположную направленность, она оказывалась достоверно повышенной как при моноинфекции, так и при микст-формах герпес-вирусных инфекций по сравнению с контролем (Р1–3 и Р2–3 < 0,001 и < 0,001 соответственно). Величины показателя ИЛМП у детей с микст-инфицированием была большей по сравнению с таковой при моноинфекции, однако разница недостоверна Р1–2 > 0,05. Увеличение показателя ИЛМП у детей с герпес-вирусной инфекцией еще раз подтверждает лимфотропность вирусных антигенов.
ЛИИ оказался достоверно повышенным у больных с микст-формами герпес-вирусной инфекции по сравнению со средневозрастной нормой в контроле (Р2–3 < 0,001). Средние значения ЛИИ у детей с моноинфекцией достоверно не отличались от норматива (Р1–3 > 0,05), они имели лишь тенденцию к повышению. Однако при оценке индивидуальных показателей ЛИИ у детей с моноинфицированием герпес-вирусами выявились существенные особенности. У 13 детей из 21 (61,9%) ЛИИ был ниже возрастной нормы, что отражало фазу положительной анергии к совершенно определенному антигену. Это свидетельствует, что организм защищен сейчас только от специфических антигенов, однако он остается уязвимым в отношении других патогенов, то есть низкий индекс интоксикации отнюдь не указывает на полное благополучие организма.
Полученные результаты исследований подтверждают выраженность иммунного дисбаланса как в клеточно-фагоцитарном звене иммунитета, так и в гуморальном, а также свидетельствуют о значимости эндогенной интоксикации у больных с микст-формами герпес-вирусной инфекции и уязвимости иммунной защиты у детей и при моноинфицировании.
Клинический пример. Андрей С., 2 года 5 мес., поступил в стационар с жалобами на высокую температуру — 39 °С, однократную рвоту, сниженный аппетит и жидкий стул 5 раз в сутки. Болен в течение двух недель ОРВИ, получил амбулаторно симптоматическое лечение. К концу второй недели ухудшилось состояние, рецидив лихорадки — 39 °C и дисфункция кишечника. Направлен на госпитализацию.
Анамнез жизни. От первой беременности, протекала с угрозой выкидыша, нефропатией, преэклампсией в родах. Во время беременности перенесла ОPВИ с лимфаденитом. Обследование на пренатальные инфекции, обнаруживались антитела класса IgG к антигенам ЦМВ и вирусу герпеса 1-го, 2-го типа. Лечение не проводилось. Роды в срок, масса при рождении 3500 г, длина 51 см. К груди приложен сразу, сосал активно, грудное вскармливание до года, прикормы вводились в 5 и 6 месяцев. Адаптация к пище нормальная. В массе прибавки достаточные, в 2 г. 5 мес — масса 14 кг 810 г, рост 93 см.
Состояние здоровья в течение первого года жизни неблагополучное. Длительно держалась желтуха, в возрасте 3 недель: общий билирубин — 315,1 мкмоль/л, непрямой — 297,3 мкмоль/л, прямой — 17,8 мкмоль/л. Одновременно с желтухой был неустойчивый стул. В 1-месячном возрасте неврологом установлен диагноз перинатального поражения ЦНС, гипоксическо-ишемического генеза, гипертензионный синдром.
К возрасту 6 мес были обнаружены изменения в гемограмме: гемоглобин — 112 г/л, эритроциты — 4,2 × 10 12 /л, лейкоциты — 7,8 × 10 9 /л, сегментоядерные нейтрофилы — 12%, лимфоциты — 67%, моноциты — 12%, эозинофилы — 8%, базофилы — 1%, СОЭ — 3 мм/час. В повторных анализах крови во 2-м полугодии продолжала выявляться нейтропения. Консультирован гематологом, установлен диагноз доброкачественной нейтропении детского возраста. В 10 мес в анализе крови выявлена анемия (гемоглобин — 107 г/л, эритроциты — 3,81 × 10 12 /л, цветовой показатель — 0,84, тромбоциты — 280 × 10 9 /л, сегментоядерные нейтрофилы — 11%, лимфоциты — 76%, моноциты — 90%, эозинофилы — 3%, базофилы — 1%). Гематологом назначено лечение Сорбифером дурулесом, курс 1 месяц.
Осмотрен ортопедом: отмечено ограниченное отведение бедер. В один год на УЗИ органов брюшной полости определялся перегиб в области шейки желчного пузыря, холестаз. Осмотр генетика: диагностирована недифференцированная дисплазия соединительной ткани с поражением костно-мышечной системы. В 1 г. 5 мес перенес острый энтероколит неуточненной этиологии, госпитализировался в стационар на 10 дней, получал лечение метронидазолом и Энтеролом. В течение 1,5 лет переносит частые ОРВИ с повышением температуры до 38,8 °С в течение 3–4 дней и катаральными явлениями.
Объективные данные. При последней госпитализации отмечались явления назофарингита в течение 5 дней, лихорадка до 39 °С 2 дня, кожные покровы без сыпи. При осмотре — гиперемия зева и увеличение подчелюстных, передних и заднешейных лимфоузлов, стул учащенный до 3 раз в сутки, с 5 дня лечения — оформленный. ЛОР-врачом диагностирован хронический тонзиллит и аденоидит, в фазе обострения.
Обследование. В мазке из зева — высев гемолитического стрептококка. Посевы на патогенную кишечную флору отрицательные. ИФА на ротавирус — отрицательный. Реакция непрямой гемагглютинации (РНГА) с кишечными диагностикумами — отрицательные.
Гемограмма при поступлении: гемоглобин 104 г/л, эритроциты — 3,7 × 10 12 /л, цветовой показатель — 0,85, лейкоциты — 6,4 × 10 9 /л, палочкоядерные нейтрофилы — 4%, сегментоядерные — 72%, лимфоциты — 18%, моноциты — 4%, эозинофилы — 2%, СОЭ — 4 мм/час.
Гемограмма в динамике: гемоглобин — 109 г/л, эритроциты — 3,4 × 10 12 /л, лейкоциты — 7,8 × 10 9 /л, палочкоядерные нейтрофилы — 19%, сегментоядерные — 42%, лимфоциты — 28% (широкоплазменные лимфоциты), моноциты — 8%, плазматические клетки — 1%, эозинофилы — 2%, СОЭ — 13 мм/час. В дальнейшем — красная кровь оставалась без динамики, число лейкоцитов не изменялось, нарастал лимфоцитоз до 43% (широкоплазменные формы), моноцитов до 12%, СОЭ повысилась до 20 мм/час.
Анализ мочи без отклонений от нормы (пятикратно). В биохимическом анализе крови — умеренная гипоальбуминемия, печеночные пробы — в норме. ИФА на специфические антитела к антигенам ЦМВ класса IgM — отрицательный, класса IgG — положительный. Маркеры ДНК-ЦМВ в осадке мочи и в секрете из зева методом ПЦР не найдены. ИФА на специфические антитела к хламидийному антигену (Chlamydia pneumoniae) — положительный в титре 1:80. Маркеры ДНК Ch. pneumoniae в мазке из носоглотки методом ПЦР — положительный. ИФА с микоплазменным антигеном — IgM и IgG — отрицательные, с герпес-вирусами 1-го, 2-го типа — IgM и IgG отрицательные. ИФА на специфические антитела к антигенам ВЭБ: IgM к капсидному антигену — отрицательный, IgG к раннему антигену — положительный и IgG к ядерному антигену (IgGNA) — положительный (> 0,5 ед.). Совокупность данного анализа была индикатором активной фазы мононуклеозной инфекции.
После проведенного обследования ребенку была назначена адекватная комплексная терапия (Cумамед, Ликопид с последующим переходом на Виферон, витамины А, Е, Пиридоксин, пробиотики — курс Примадофилуса). Наблюдение за ним продолжается.
Выводы
- В пользу диагностики персистирующих инфекций у детей свидетельствует отягощенный акушерско-гинекологический и соматический анамнез, а также инфекционный фактор беременных женщин.
- Заподозрить внутриутробное инфицирование у детей раннего возраста можно по высокой степени поражения различных органов и систем: ЦНС, органов дыхания, пищеварения, лимфатического аппарата.
- Диагностика внутриутробных инфекций должна базироваться на клинических проявлениях болезни и основываться на комплексе лабораторных и иммунологических методов исследования с их оценкой в динамике (в 1 мес, 3 мес, 6 мес и в 1 год жизни).
- Правильность выбора комплекса клинических и лабораторных тестов (ИФА в динамике, ПЦР-тесты с различными биосубстратами) приводит к своевременной диагностике внутриутробных инфекций и позволяет выявить моноинфицирование или микст-формы при их длительной персистенции.
- Для суждения о состоянии общей иммунологической реактивности детей с персистирующими герпесвирусными инфекциями может использоваться оценка интегральных показателей (КФЗ и ИЛМП): чем меньше величина КФЗ, тем больше выражен риск прорыва защитного барьера на пути инфекции.
- Наиболее неблагоприятное персистирующее течение имеют микст-формы герпесвирусной инфекции (ЦМВ, герпес, ВЭБ) или их сочетания с внутриклеточными возбудителями.
Литература
Ф. Н. Рябчук, кандидат медицинских наук, доцент
З. И. Пирогова, кандидат медицинских наук, доцент
СПбМАПО, Санкт-Петербург
ЦМВИ у детей. Что делать если у ребенка обнаружили цитомегаловирусную инфекцию?
Цитомегаловирусная инфекция (ЦМВИ) во многом остается "темной лошадкой" для современных инфекционистов. Обладателям вируса-возбудителя в теории может быть кто угодно, но далеко не каждый об этом догадывается. Дело обстоит таким образом, во-первых, потому что довольно часто носительство бывает бессимптомным, во-вторых, в связи с тем что возможности передачи вируса весьма широкие. Возбудитель ЦМВИ попадает в организм через плаценту, вертикально (когда плод проходит через родовые пути), при грудном вскармливании с молоком, при переливании крови и в процессе полового контакта. В отношении детей большую роль играют первые три способа передачи вируса.
Цитомегаловирус в организме может вести себя по-разному, собственно, именно это во многом затрудняет его диагностику. Как уже говорилось выше, он может вообще никак себя не проявлять, но лишь при одном условии - прочной и хорошо функционирующей иммунной системе, которая активное размножение вируса в клетках организма может подавить. Однако в условиях иммунодефицита этот вирус становится по-настоящему опасен. Поэтому от него страдают помимо больных СПИДом и людей пожилого возраста еще и дети.
ЦМВИ выявляется особенно часто у детей до двух лет - это период становления иммунитета ребенка. Его иммунная система не в столько в дефиците, сколько супрессирована, то есть в некоторой степени подавлена, особенно на первых месяцах жизни. Таким образом природа защищает новорожденного от чрезмерно сильных реакций иммунитета на огромное множество чужеродных агентов. После года та защита, которую малыш получал с молоком матери, начинает исчезать, а свои противовирусные частицы вырабатываться в должной мере пока не могут. В связи с этим дети нередко страдают от ЦМВИ.

Проявления ЦМВИ достаточно широко варьируют, так как вирус способен проникать практически во все клетки организма и вызывать цитопатический эффект. Проще говоря, клетки меняются и утрачивают способность нормально функционировать. Что говорит о врожденной ЦМВИ, которую ребенок получил либо через плаценту еще в утробе, либо в процессе родов?
1. У таких детей имеется желтушность кожных покров и склер глаз. Печень значительно увеличена, так как цитомегаловирус имеет склонность поселяться сразу в клетки этого органа.
2. Из-за нарушения работы печени страдает и свертываемость крови, на основании этого дети с ЦМВИ страдают от повышенной кровоточивости (на коже появляются синячки, сыпь, плохо заживает пупочная ранка, кровь может появиться в стуле).
3. Также значительно увеличивается селезенка.
4. Помимо этого есть ряд других признаков: страдают легкие (вплоть до развития пневмонии), нарушена центральная нервная система (менингит, энцефалит, гидроцефалия характеризуются судорогами, повышенной возбудимостью). Изменено состояние органов ЖКТ, что характеризуется колитами, энтеритами, недостаточностью поджелудочной железы. Вирус не обходит стороной и почки, приводя к развитию нефрита.
К сожалению, выхаживать таких новорожденных чрезвычайно трудно, ведь на фоне такого "букета" к ослабленному организму присоединяются другие инфекционные заболевания. Поэтому тяжело текущие ЦМВИ часто заканчиваются гибелью новорожденного еще в первые недели его жизни, либо вовсе приводят к выкидышу, если женщина заразилась на ранних сроках беременности.
К счастью, такое тяжелое течение заболевания бывает далеко не у всех новорожденных (всего у 10 %), так что причина тяжести ЦМВИ в этом случае во многом остается загадкой. Те же дети, которые относительно легко переживают инфекцию, нередко впервые сталкиваются с ней через месяц-два после рождения. И в этом случае симптомы могут быть самыми разными. Обычно снижается слух или зрение, нарушается работа нервной системы, страдает физическое развитие. Вот с такими проблемами родители приходят к педиатру, и установить истинную причину - ЦМВИ удается не всегда.
Стоит помнить о и передаче вируса ребенку с материнским молоком. Когда инфицирование происходит таким путем, у ребенка часто возникает пневмония, которая лечению антибактериальными препаратами не поддается.

Дети старшего возраста и подростки с ЦМВИ сталкиваются еще реже в силу прочности их иммунной системы. Но если вирус все же активизировался, то проявляет он себя обычно снижением работоспособности, болью в суставах, лихорадкой и головными болями. Вывод таков, что по одним признакам установить наличие ЦМВ невозможно, всегда требуется лабораторное подтверждение. Оно заключается в поиске специфических антител, которые наш организм вырабатывает в ответ на наличие конкретных вирусных частиц. Есть специфические антитела - есть и вирус. Что же делать, если у ребенка обнаружили ЦМВИ?
1. Обнаружение ЦМВИ возможно еще в процессе беременности, посредством УЗИ, ведь вирус может приводить к формированию множественных видимых пороков у плода. Поскольку такие дети в будущем практически не жизнеспособны, беременность предлагается прервать.
2. В том случае, когда ЦМВИ выявляется у ребенка через некоторое время после рождения (не в первые дни), тактика врача будет зависеть от течения инфекционного процесса. Есть конкретные лекарственные средства, которые назначают для подавления ЦМВ - Ганцикловир, Фоскарнет. Однако принимать решение об их применении самостоятельно нельзя, так как эти лекарственные средства обладают рядом очень серьезных побочных эффектов. Они негативно сказываются на состоянии крови и токсичны для почек. В связи с этим их применяют только при острой необходимости, когда цитомегаловирус выходит из-под контроля. Новый препарат Цитотект, тоже подходит для лечения ЦМВИ, но вводится он также исключительно по назначению специалиста.
3. Нужно добиваться, чтобы признаки ЦМВИ не появлялись у ребенка. А для этого очень важно укреплять его иммунитет, который самостоятельно способен подавлять вирус и не давать ему негативно влиять на здоровье малыша. Есть множество природных иммуностимуляторов, которые разрешено давать детям (настойка эхинацеи, элеутерококка), Иммунал, Иммудон и другие средства, которые можно использовать курсами после консультации у педиатра с целью улучшения работы иммунной системы. Не последнюю роль играет питание. Не забывайте, что оно должно привносить в организм нужное количество белков, углеводов и жиров, микроэлементов, витаминов. Следите за тем, чтобы ребенок соблюдал режим, не переутомлялся, регулярно бывал на свежем воздухе и физически был активен.
- Вернуться в оглавление раздела "Микробиология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Что такое микоплазмоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Игнатенко Татьяны Алексеевны, гинеколога со стажем в 14 лет.
Над статьей доктора Игнатенко Татьяны Алексеевны работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Микоплазма (лат. Mycoplasma) — род микроорганизмов, включающий более сотни видов, как вредоносных, так и мирно сосуществующих с хозяином. Это одноклеточные микроорганизмы, не имеющие клеточной стенки. Паразитируют они внутриклеточно или на ряде клеток (сперматозоиды, эритроциты крови, фибробласты, макрофаги и пр.).
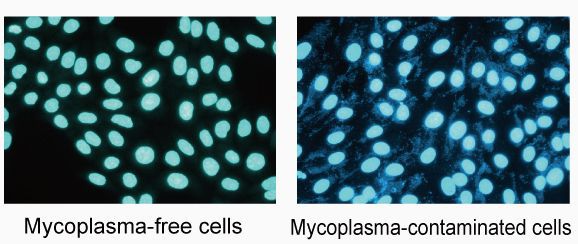
Встречаются микоплазмы у людей и животных. У человека обнаруживают по меньшей мере 14 видов микоплазм. И принципиально различают 2 вида микоплазм, обнаруживаемых при обследовании половых органов человека.
Выявленная в 1980 году Mycoplasma genitalium является так называемым абсолютным патогеном наряду с возбудителями гонореи, трихомоноза, хламидиоза. [1]
Mycoplasma genitalium является недооценённой причиной заболевания репродуктивной системы человека, стойкой, часто бессимптомной инфекцией. [2]
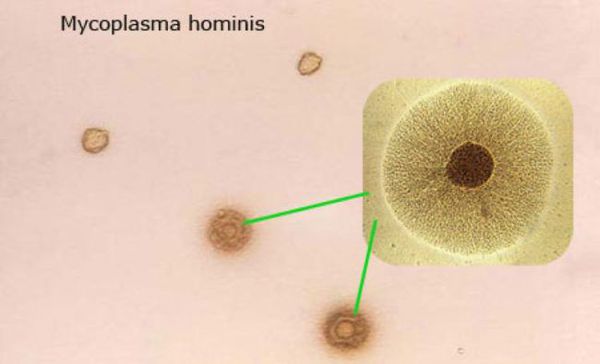
Mycoplasma hominis, описанную ещё в 1937 году, по современным представлениям относят к представителям нормальной флоры половых путей мужчин и женщин. И лишь в условиях иммунодефицита она способна к неконтролируемому размножению с формированием воспалительных заболеваний мочеполовых путей и их осложнений.
Опасен ли микоплазмоз кошек для людей
Описаны случаи инфекционных заболеваний человека, вызванные M. gatae и M. felis. Они наблюдались при иммунодефиците (у ВИЧ-инфицированных, пациентов с аутоиммунными заболеваниями и тяжёлыми формами почечной и печёночной недостаточности). У таких больных воспалялись суставы и кости (артрит и остеомиелит), возникали инфекционные осложнения беременности, выкидыши [14] .
Микоплазмоз у детей
Mycoplasma pneumoniae вызывает респираторные инфекции у детей и взрослых. Помимо респираторных заболеваний, M. pneumoniae также приводит к многочисленным внелёгочным заболеваниям. У детей они носят преимущественно аллергический и аутоиммунный характер.
Опасен ли микоплазмоз при беременности
Mycoplasma genitalium является причиной преждевременных родов и выкидышей у беременных. Mycoplasma hominis связана с ранним и поздним выкидышем особенно при наличии аномальной микрофлоры влагалища (бактериального вагиноза, дефицита лактофлоры, кандидоза) [15] .
Респираторный микоплазмоз
Респираторный микоплазмоз — это инфекционно-воспалительное заболевание органов дыхания, вызываемое бактериями рода Mycoplasma, преимущественно M. pneumoniae. Респираторный микоплазмоз широко распространён, он становится причиной 10–16 % острых респираторных заболеваний. Чаще всего респираторный микоплазмоз встречается у детей, подростков и людей молодого возраста [16] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы микоплазмоза
Микоплазмоз часто протекает бессимптомно. [2] Около 20% инфицированных генитальными микоплазмами или носителей Mycoplasma hominis не предъявляют никаких специфических жалоб.
Симптомы микоплазмоза у мужчин и женщин
К симптомам микоплазмы относятся периодически возникающий умеренный зуд и жжение в области половых органов, выделения из половых путей, нарушение мочеиспускания. Течение заболевания зачастую рецидивирующее, особенно при сочетании с другими патогенными или условно патогенными микроорганизмами (чаще анаэробами при бактериальном вагинозе или вирусами), при устойчивости к лечению.
Патогенез микоплазмоза
Вопреки представлениям о чисто генитальном пути заражения микоплазмозом, есть данные о возможности передачи микроорганизмов не только в генитальных, но и в оро-генитальных и ано-генитальных контактах, причем в гомосексуальных парах отмечено преобладание ректальной инфекции над уретральной. [4] Распространение микоплазм зачастую осуществляется восходяще (например, у женщин от шейки матки через полость матки, маточные трубы в брюшную полость). Плод, проходя по родовым путям матери, инфицированной микоплазмами, имеет высочайшие риски инфицирования. Возможность гематогенной (через кровь) и трансплантационной (при пересадке органов) передачи инфекции доказана во многих преимущественно зарубежных исследованиях. [6]
Классификация и стадии развития микоплазмоза
По типу течения выделяют:
По локализации возможны:
- уретрит (воспаление мочеиспускательного канала) у мужчин и женщин;
- вагинит (воспаление влагалища);
- цервицит (воспаление шейки матки);
- эндометрит (воспаление внутренней выстилки матки);
- сальпингит (воспаление маточных труб);
- бартолинит (воспаление большой железы преддверия влагалища);
- баланит/баланопостит (воспаление головки полового члена); (воспаление предстательной железы);
- орхит (воспаление яичка);
- эпидидимит (воспаление придатка яичка);
- пиелонефрит (воспаление почек);
- проктит (воспаление слизистой оболочки прямой кишки).
Осложнения микоплазмоза
Среди потенциальных осложнений течения генитального микоплазмоза у мужчин и женщин выделяют:
- женское и мужское бесплодие;
- невынашивание плода;
- хронический эндометрит и ассоциированная с ним маточная форма бесплодия;
- первичная плацентарная и вторичная фетоплацентарная недостаточность, задержка роста плода;
- высокая перинатальная заболеваемость и смертность (патология плода или ребёнка, возникшая внутриутробно, в период родов или в новорожденности);
- аномалии развития плода;
- преждевременные роды и патологическое течение послеродового периода (кровотечения, инфекционные осложнения и прочее). [8]
Наблюдается высокая взаимосвязь между микоплазменной инфекцией и различными видами рака органов, потенциально поражаемых микоплазмами. [11]
Последнее время всё больше исследований, доказывающих взаимосвязь Mycoplasma hominis с формированием онкопроцессов репродуктивной сферы, в частности, рака предстательной железы, [7] гнойными воспалительными заболеваниями малого таза у женщин. [10]
Диагностика микоплазмоза
В каких случаях обращаться к врачу
Обследованию на микоплазмы подлежат пациенты с воспалительным заболеванием таза, стойким уретритом или цервицитом, бесплодием, привычным невынашиванием беременности, перед планированием беременности или перед участием в программах вспомогательных репродуктивных технологий. [5]
При лабораторной диагностике микоплазмоза у мужчин исследуют материал из уретры (мочеиспускательного канала), у женщин — шейки матки (цервикального канала). Также исследуется первую порцию свободно выпущенной мочи, секрет простаты, аспират из полости матки. Посев на микоплазмы с определением чувствительности к антибиотикам является оптимальным методом поиска Mycoplasma hominis. Поиск Mycoplasma genitalium осуществляется методом ПЦР. Обнаружение антител к Mycoplasma genitalium и Mycoplasma hominis в крови пациента считается недопустимым методом диагностики ассоциированных с микоплазмами заболеваний.
Обследование на микоплазмоз у женщин проводится в первой половине менструального цикла, не ранее пятого дня с начала менструации.
Допускается и во второй половине цикла, не позднее, чем за пять дней до предполагаемого начала менструации.
Если имеются выраженные симптомы воспаления, диагностический материал собирается в день обращения.
Минимум трое суток до взятия материала на микоплазмоз женщинам рекомендуется воздержаться от спринцевания влагалища.
Не рекомендуется взятие биоматериала ранее 24-48 часов после полового контакта, интравагинального УЗИ и кольпоскопии.
Рекомендуется брать материал не ранее, чем через 14 дней после применения местных антибиотиков и антисептиков (свечи, кремы, гели), и не ранее, чем через 1 месяц после применения антибиотиков перорально.
Если для исследования берут соскоб из уретры, сбор материала проводят до или не ранее 2-3 часов после мочеиспускания. [13]
Перед взятием секрета предстательной железы рекомендуется половое воздержание в течение не менее двух дней. Взятие биологического материала должно проводиться строго до начала применения антибактериальных препаратов или не ранее, чем через 10-14 дней после их отмены (для местных антибиотиков), и не ранее, чем через один месяц после применения антибиотиков перорально. [13]
Эякулят пациент собирает в стерильный контейнер самостоятельно методом мастурбации. Сбор секрета простаты выполняется подготовленным медицинским персоналом после массажа предстательной железы.
Если исследовать планируется мочу, следует собирать первую утреннюю порцию мочи в количестве 20-30 мл в стерильный контейнер. Не рекомендуется сдавать анализ на фоне приёма антибиотиков. [13]
Лечение микоплазмоза
Mycoplasma genitalium является микробом, обнаружение которого в мазке из половых путей является абсолютно ненормальным, а вызванное им заболевание "урогенитальная микоплазменная инфекция" (ранее именовавшаяся генитальным микоплазмозом) подлежит обязательному лечению вне зависимости от жалоб пациентов.
Медикаментозное лечение микоплазмоза
Препаратами выбора считаются доксициклина моногидрат и джозамицин, [12] хотя в последнее время появляются исследования, показывающие плохие результаты лечения доксициклином и рекомендующие неоднократный прием азитромицина в качестве первичного лекарственного средства. [5] [3]
Во избежание хронизации инфекции, возникновения осложнений и резистентности микроба к антибиотикам, когда повторно обострившуюся инфекцию будет просто нечем лечить, целесообразно проходить курс лечения заболевания строго по рекомендации лечащего врача с адекватными дозировками препарата и длительностью курса лечения не менее 10 дней.
Обнаружение Mycoplasma hominis заставляет врача назначать антибактериальную терапию в случаях:
- клинических проявлений заболевания;
- выделения микроорганизмов у пациентов с бесплодием, потерями беременности или в рамках подготовки к беременности;
- выделения микоплазм при осложнённом течении беременности, если есть высокий риск инфицирования плода.
Антибиотики назначают с учётом чувствительности микоплазмы по результатам бакпосева с антибиотикограммой. Курс лечения — 7-14 дней. [12]
Одновременно с антибактериальными препаратами назначают противопротозойные средства (метронидазол) и противогрибковые средства, средства для восстановления микрофлоры кишечника и влагалища, нормализующие pH влагалищного секрета.
Эффективность лечения заболеваний, вызванных Mycoplasma genitalium, оценивают через 4 недели после окончания лечения методом ПЦР. При лечении заболеваний, вызванных Mycoplasma hominis, контроль количества микоплазм определяют методом бакпосева. [12]
Что немаловажно, обследованию и лечению подлежат партнёры заболевшего или нуждающегося в лечении человека.
Народные средства лечения микоплазмоза
Эффективность лечения микоплазмы народными методами научно не доказана. Без адекватной терапии инфекция может привести к осложнениям, например к бесплодию у мужчин и женщин.
Прогноз. Профилактика
При своевременном лечении прогноз благоприятный. Профилактика заключается в использовании презерватива при всех видах половых контактов, особенно с новым, необследованным половым партнёром. Для женщин немаловажно поддерживать здоровый баланс и кислотность влагалищной микрофлоры, нарушению которых способствуют неконтролируемое, излишнее и неправильное использование антибактериальных, противогрибковых, гормональных препаратов, нарушение личной гигиены половых органов, частые и чрезмерные влагалищные души, спринцевания, использование спермицидов, кишечные дисбактериозы, практики незащищённых ано-генитальных контактов и прочее.
Читайте также:

