Холинергическая интоксикация что это такое
Обновлено: 19.04.2024
Отравление м-холиноблокаторами (антимускариновыми средствами) и их побочные эффекты
Антимускариновые средства конкурентно подавляют действие ацетилхолина на мускариновые рецепторы. Эти вещества называют также парасимпатолитическими, атропиновыми, атропиноподобными и антихолинергическими средствами. Их прототипом считают атропин. Антимускариновые средства можно классифицировать по их источнику (природные, полусинтетические, синтетические) и/или катионной структуре (третичные амины или четвертичные аммонийные соединения).
К природным третичным аминам относятся атропин, гиосциамин и скополамин.
а) Применение. Антимускариновые средства применяют главным образом для лечения пептической язвы и синдрома раздраженной толстой кишки (слизистого колита). Атропин используется для диагностики дисфункции синусного узла (см. "Атропин"). Атропин, скополамин и гликопирролат назначают предоперационно для подавления слюноотделения и ослабления чрезмерной секреции дыхательных путей.
Атропином, оксибутинином и пропантелином лечат такие расстройства мочеполовых путей, как их стойкое сокращение и нейрогенный мочевой пузырь. Антимускариновые средства являются сильными бронхолитиками. Бензтропин и бензгексол (тригексифенидил) применяются для лечения паркинсонизма и ятрогенных экстрапирамидных реакций.
б) Клиническая картина отравления антимускариновыми средствами. К периферическим симптомам передозировки относятся расширенные и нереагирующие зрачки; затуманенное зрение; горячая, сухая, покрасневшая кожа; сухость слизистых оболочек; затрудненное глотание; ослабление или отсутствие кишечных шумов; задержка мочи; тахикардия; гипертермия; гипертензия; повышенная частота дыхания.
Проявления на уровне центральной нервной системы могут напоминать острый психоз (дезориентация, бессвязность и спутанность сознания, галлюцинации, бред, паранойя, нарушения речи, перемежающаяся гиперактивность, состояние тревоги, двигательные аномалии и беспокойство). При тяжелой передозировке наблюдаются угнетение центральной нервной системы, сердечно-сосудистый коллапс и гипотензия. За комой и параличом скелетных мышц могут последовать смерть от дыхательной недостаточности, гипертермия (особенно у детей), угнетение сердечной деятельности или экспозиции летальным средовым факторам у делириозных лиц (например, от утопления).
К электрокардиографическим аномалиям относятся расширение комплекса QRS, удлинение интервала Q—T, подавление сегмента ST, желудочковые аритмии, ранние экстрасистолы, синусовая и наджелудочковая тахикардии.
в) Лечение отравления антимускариновыми рецепторами. Лечение передозировки в основном симптоматическое и поддерживающее. Пациентам необходимы госпитализация и тщательное наблюдение с непрерывным мониторингом ЭКГ. Применяются промывание желудка с эндотрахеальной интубацией (с надувной манжетой), активированный уголь и солевые слабительные. Гемодиализ и перитонеальный диализ неэффективны. По показаниям назначают инфузионную терапию и шокотерапию.
С гипертермией борются холодным обертыванием, механическими охлаждающими установками и обтиранием влажной губкой. Диазепам помогает при сильном возбуждении, делирии и симптомах острого психоза. Фенотиазины противопоказаны, поскольку они могут усугубить антихолинергический эффект. Важными моментами являются обеспечение проходимости дыхательных путей, адекватной вентиляции, а также катетеризация мочевого пузыря.
По поводу применения физостигмина мнения расходятся. Он может индуцировать судороги, бронхоспазм и асистолию. Его использовали для лечения пациентов с сильным делирием, возбуждением, рецидивирующими или длительными эпилептическими припадками, тяжелой синусовой или наджелудочковои тахикардией и чрезмерной гипертермией, рефрактерной к механическому охлаждению. Обычная терапевтическая доза для взрослых — 2 мг внутривенно.
Если реакции не наступает, 1 —2 мг можно вводить каждые 20 мин до исчезновения токсических антимускариновых или развития нежелательных холинергических эффектов. Стандартная внутривенная доза физостигмина салицилата, рекомендуемая изготовителем для детей, составляет 0,02 мг/кг. Физостигмин нельзя применять для лечения дефектов сердечной проводимости или желудочковых тахиаритмий. Его передозировка чревата холинергической интоксикацией (брадикардия, слюнотечение, диарея, эпилептические припадки, остановка дыхания и др.).
Индуцированные физостигмином опасные для жизни бронхостеноз, брадикардию и судороги можно купировать внутривенным введением 0,5—1,0 мг сульфата атропина.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Ингибиторы холинэстеразы также имеют названия ингибиторов ацетилхолинэстеразы (AChE) или антихолинэстераз.Они представляют собой группу препаратов, которые блокируют нормальное расщепление ацетилхолина (АХ) на ацетат и холин и тем самым увеличивают как уровни, так и продолжительность действия ацетилхолина в центральной и периферической нервной системе. Ингибиторы ацетилхолинэстеразы чаще всего используют при лечении нейрогенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона и деменция тела Леви. Различные физиологические процессы при этих дегенеративных нарушениях разрушают клетки, которые продуцируют АХ, и тем самым снижают холинергическую передачу в разных областях мозга. Препараты, ингибирующие холинэстеразу, ингибируют активность AChE и поддерживают уровень ACh, уменьшая скорость его распада.
Кроме того, ингибиторы холинэстеразы часто используются у пациентов с миастенией. Повышенный уровень ацетилхолина в нервно-мышечном соединении, следовательно, приводит к повышенной активации рецепторов ACh, обнаруженных на постсинаптических мембранах, что приводит к улучшению мышечной активации, сокращения и силы. В конце терапии вводят ингибиторы холинэстеразы, чаще всего неостигмин, чтобы обратить вспять эффекты недеполяризующих мышечных агентов, таких как рокуроний.
Ингибиторы холинэстеразы также необходимы для применения при подозрении на антихолинергическое отравление. Симптомы антихолинергического отравления включают вазодилатацию, ангидроз, мидриаз, бред и задержку мочи. Другие менее распространенные показания к применению ингибиторов холинэстеразы включают лечение пациентов с диагнозом определенных психических расстройств, таких как шизофрения, и лечение глаукомы путем сброса давления водянистой влаги.
Ингибиторы холинэстеразы функционируют, подавляя холинэстеразу от гидролиза ацетилхолина до компонентов ацетата и холина, что позволяет увеличить доступность и продолжительность действия ацетилхолина в нервно-мышечных соединениях. Фермент холинэстераза имеет два активных сайта: анионный сайт, образованный триптофаном, и эстерактический сайт, образованный серином. Ингибиторы холинэстеразы, такие как органофосфаты, препятствуют расщеплению холинэстеразы ацетилхолином путем взаимодействия с сайтинэстерактическим сайтом. В результате ацетилхолин будет продолжать накапливать и активировать связанные рецепторы.
Ингибиторы холинэстеразы классифицируют как обратимые, необратимые или псевдообратные. Обратимые ингибиторы холинэстеразы обычно используются в терапевтических целях. Напротив, необратимые и псевдообратимые ингибиторы часто используются в пестицидах и для биологической войны (нервные агенты).
Ингибиторы холинэстеразы бывают разных форм для введения . Введение многих доступных ингибиторов холинэстеразы происходит внутримышечно, внутривенно или перорально. Различные формы могут быть доступны для разных типов ингибиторов холинэстеразы. Например, неостигмин имеет форму раствора, используемую для противодействия миорелаксанту в конце операции. Для пациентов с миастенией, пероральная форма неостигмина доступна для лечения. Ривастигмин, используемый у пациентов с деменцией, имеет форму трансдермального пластыря, которая также часто используется.
Ингибиторы холинэстеразы увеличивают общее количество доступного ацетилхолина. Таким образом, могут присутствовать симптомы чрезмерной стимуляции парасимпатической нервной системы, такие как повышенная гиперчувствительность, гиперсекреция, брадикардия, миоз, диарея и гипотония.
Основной проблемой при назначении ингибиторов холинэстеразы или воздействии фосфорорганических соединений потенциально является развитие холинергического криза, также известного как синдром SLUDGE ( S: слюноотделение; L: слезотечение; U: мочеиспускание; D: диафорез; G: желудочно-кишечные расстройства; E: эмесис). Временные побочные эффекты при назначении пациентам ингибиторов холинэстеразы включают головную боль, бессонницу и незначительные проблемы с желудочно-кишечным трактом . Другие более важные эффекты включают слабость и потерю веса. Длительное сокращение мышц также может быть характерной особенностью у пациентов, подвергающихся воздействию ингибиторов холинэстеразы. Ингибиторы холинэстеразы, такие как неостигмин, используемые после операции для отмены нервно-мышечной блокады, могут привести к потенциальной остаточной нервно-мышечной блокаде.
Из-за способности повышать тонус блуждающего нерва через активацию парасимпатической нервной системы необходимо соблюдать осторожность при назначении ингибиторов холинэстеразы лицам, страдающим брадикардией или заболеваниями сердечной проводимости, такими как синдром слабости синусового узла. Эти люди подвергаются риску обморока и падений. Осторожность также рекомендуется пациентам, принимающим антигипертензивные препараты в связи с возможностью развития тяжелой гипотонии. Кроме того, ингибиторы холинэстеразы также противопоказаны пациентам с язвой желудка из-за повышенного риска желудочно-кишечных кровотечений. Пациенты с задержкой мочи также не должны получать ингибиторы холинэстеразы из-за риска повышенной задержки. Этот эффект особенно заметен у пациентов, проходящих лечение от деменции и болезни Альцгеймера, поскольку недержание мочи является частой клинической особенностью у этих пациентов. Назначение пациентам с предшествующими аллергиями или повышенной чувствительностью к ингибиторам холинэстеразы и ее производным также противопоказано.

Индексы и показатели показывают существенное, но незначительное превосходство нейролептиков над плацебо, поэтому нередко отмена нейролептиков представляется для врача и пациента важной целью оказания помощи последнему .
Мы рассмотрим с читателем моего Блога отмену наиболее эффективного препарата для лечения шизофрении - клозапина . В то время как гиперболическое снижение дозы рекомендуется для предотвращения симптомов отмены при приеме многих психиатрических препаратов, особенно , нейролептиков неясно, снижает ли это риск холинергического рикошета, вызванного клозапином.
Клозапин
Клозапин — дибензодиазепиновый антипсихотик, впервые разработанный в 1959 году . Это единственный эффективный метод лечения шизофрении, резистентной к терапии и наиболее эффективный метод лечения шизофрении в целом. Однако в определенных клинических ситуациях, таких как появление серьезных побочных эффектов, необходимо отменить клозапин , при этом частота отмены колеблется от 16% до 66%. Прекращение лечения клозапином представляет собой особую проблему из-за риска рецидива психоза, а также развития симптомов отмены. Несмотря на эти проблемы для клинициста, в настоящее время нет официального руководства по безопасному прекращению приема клозапина.
Вообще я неохотно начинаю лечение больных нейролептиками , особенно, клозапином из-за опасений, что после начала лечения прекращение лечения опасно и трудно поддается лечению. В отличие от начала приема клозапина, существует очень мало рекомендаций по безопасному прекращению приема клозапина.
Варианты отмены нейролептика по клиническим показаниям
Экстренная отмена нейролептика
Перед врачом , решившимся на отмену антипсихотиков встают вопросы по (1) минимизации риска синдрома отмены, (2) управлению явлениями отмены и (3) началу альтернативного лечения после прекращения приема определенного нейролептика. Экстренная отмена нейролептика обычно показана, когда у пациентов возникают потенциально опасные для жизни побочные эффекты, такие как агранулоцитоз, миокардит или злокачественный нейролептический синдром, кишечная непроходимость, удлинение интервала QTc (>500 мс).
В некоторых ситуациях антипсихотик можно возобновить после того, как клиническая проблема разрешилась или была смягчена
Плановая отмена нейролептика
.Примеры случаев, когда прием нейролептика может быть отменен по выбору, включают непереносимые (но не угрожающие жизни) побочные эффекты, отсутствие ответа на лечение, предпочтение пациента и плохую приверженность лечению. В отличие от прекращения приема клозапина в экстренных случаях плановое прекращение обычно предусматривает период консультаций, сбора информации и подготовки, а также возможность более постепенного прекращения приема нейролептика.
Отмена нейролептика после выздоровления
В некоторых случаях прием нейролептика можно прекратить после достижения полного выздоровления.
Основные феномены отмены нейролептиков
Прекращение приема нейролептиков у пациентов с шизофренией связано с повышенным риском рецидива психотических симптомов. Это особенно проблематично у пациентов с резистентной к лечению шизофренией, поскольку эффективность большинства антипсихотических препаратов маловероятна, особенно, после отмены клозапина. Кроме того, клозапин может быть связан с рядом симптомов отмены. К ним относятся кататония, нарушение сна, спутанность сознания, вегетативная дисфункция, нервно-мышечные и желудочно-кишечные симптомы, а также психотические симптомы, которые могут быть хуже основного состоянияНедавнее международное исследование по фармаконадзору показало, что на симптомы отмены приходится значительная часть всех побочных реакций, связанных с приемом клозапина.
Гиперболическая отмена нейролептиков рекомендуется для снижения риска рецидива. Это включает в себя снижение доз на все более мелкие приращения, что позволяет более линейное снижение блокады рецепторов. Пациенты с резистентной к лечению шизофренией подвержены усилению симптомов психоза.
Абстинетный синдром
Механизмы холинергического рикошета
Описаны симптомы холинергического рикошета после прекращения приема клозапина в дозах всего 50 мг в сутки. Данные небольшого проспективного исследования показывают, что распространенность симптомов отмены холинергических средств после резкой отмены клозапина может достигать 50%. Наиболее вероятным механизмом холинергического рикошета является активация мускариновых ацетилхолиновых рецепторов нейролептиком , что приводит к сверхчувствительности после прекращения приема препарата. Клозапин имеет большее сродство к мускариновым рецепторам, чем другие нейролептики с антихолинергическими свойствами, такие как оланзапин и кветиапин.Это может объяснить, почему переход с клозапина на эти нейролептики, по-видимому, не предотвращает симптомы отмены холинергических препаратов.
Механизмы двигательных нарушений при отмене нейролептиков
Острые двигательные расстройства после отмены клозапина, в частности экстрапирамидные симптомы, могут быть связаны с дисбалансом ацетилхолина и дофамина в базальных ганглия, хотя постулируются и другие механизмы. Пациенты, перенесшие экстрапирамидную симптоматику при приеме других нейролептиков, по-видимому, подвергаются особому риску. Сообщалось об экстрапирамидной симптоматики в течение двух недель после прекращения приема клозапина, и они могут сосуществовать с другими симптомами холинергического рикошета. Данные клинических случаев свидетельствуют о том, что острые двигательные расстройства могут возникать с большей вероятностью при одновременной отмене других антихолинергических средств
Стратегии снижения риска симптомов отмены холинергических препаратов
В то время как гиперболическое снижение дозы рекомендуется для предотвращения симптомов отмены при приеме других психиатрических препаратов, неясно, снижает ли это риск холинергического рикошета, вызванного клозапином. Точно так же клиническая польза профилактических антихолинергических препаратов остается неизвестной. Однако оптимальный препарат, доза и продолжительность остаются неизвестными.
Ретроспективные данные свидетельствуют о том, что повторное назначение клозапина эффективно при лечении холинергического рикошета. В одной серии случаев повторного введения клозапина в относительно низких дозах (25–50 мг в день) было достаточно для улучшения симптомов.
Кататония в структуре синдрома отмены нейролептиков
Кататония представляет собой психомоторное расстройство, характеризующееся ступором, застыванием в определенных позах и эхо-феноменами и, как полагают, возникает из-за гипоактивности гамкергической системы. Сообщалось о кататонии у части пациентов, резко прекративших прием нейролептиков , и, хотя считается, что она возникает редко, частота ее возникновения неизвестна. В основном это наблюдалось у пациентов без кататонии в анамнезе, которые лечились клозапином в течение нескольких лет, при этом симптомы появлялись в течение недели после отмены. Кататония не связана с отменой других нейролептиков, но наблюдается после отмены бензодиазепинов. Сходство между прекращением приема клозапина и бензодиазепинов, провоцирующим кататонию, предполагает возможную общую патофизиологию, опосредованную эффектами ГАМК ( GABA). Хотя известно, что бензодиазепины непосредственно модулируют ГАМКергическую систему, было показано, что длительное применение клозапина косвенно приводит к адаптации ГАМКергических рецепторов и снижению ГАМКергических эффектов.
Стратегии снижения риска и лечения кататонии, вызванной отменой нейролептика
Чем заменить нейролептик ?
Несмотря на наличие данных, подтверждающих превосходство клозапина над другими нейролептиками, эмпирических данных о том, какой антипсихотик следует использовать после прекращения приема клозапина, недостаточно. Прямых исследований потенциальных альтернативных методов лечения не публиковалось. Одно рандомизированное клиническое исследование показало, что переход с клозапина на зотепин приводит к ухудшению симптомов по сравнению с продолжением приема клозапина. Единственное рандомизированное плацебо-контролируемое исследование показало, что после резкой отмены клозапина введение оланзапина снижает риск психоза, связанного с отменой, в течение 3–5 дней после отмены по сравнению с плацебо
. Исследование национального регистра Финляндии показало, что самый низкий риск госпитализации в психиатрическое отделение и смертности связан с повторным началом приема клозапина с последующим переходом на оланзапин. Аналогичным образом, исследование национального реестра Нидерландов показало, что повторное начало приема клозапина было связано с самым низким риском неэффективности лечения с последующим переходом на оланзапин или рисперидон. Хотя молекулярная структура оланзапина наиболее близка к клозапину среди антипсихотиков, открытые исследования неизменно показывают, что переход с клозапина на оланзапин приводит к повышенному риску рецидива, особенно при резком переходе. При переходе с клозапина на другой антипсихотик история лечения пациента может указывать на то, что какие-либо предшествующие нейролептики были клинически эффективны. Хотя клозапин обычно вводят из-за отсутствия ответа на лечение другими нейролептиками, оценка ответа часто затруднена и может быть затруднена субтерапевтическими уровнями в плазме (например, в результате плохой приверженности, использования низких доз или быстрого метаболизма). или незаконное употребление психоактивных веществ.
Быстрая или медленная отмена ?
На сегодняшний день исследования, как правило, сосредоточены на быстром переходе с клозапина на другие нейролептики, поэтому нельзя исключать роль психотических симптомов, связанных с отменой. В одном испытании, в котором была предпринята попытка постепенного снижения дозы нейролептиков, у пациентов с первым эпизодом психоза, которым дозу постепенно снижали или прекращали, наблюдалась более высокая частота рецидивов по сравнению с пациентами, продолжавшими принимать ту же дозу в краткосрочной перспективе. Однако в долгосрочной перспективе у этих пациентов не наблюдалось ухудшения симптомов и даже наблюдалось большее социальное выздоровление. Таким образом, для части пациентов возможно постепенное снижение дозы клозапина без необходимости назначения альтернативного антипсихотического препарата.
Признание того, что резкое прекращение приема может привести к симптомам отмены, привело к рекомендации постепенного снижения дозы в 1995 г., а последующие руководящие документы рекомендовали прекращение приема в течение одной-двух недель. Тем не менее, есть основания полагать, что этот период снижения может быть слишком коротким.
Купирование рецидив психоза, возникшего на фоне отмены нейролептика
Возобновление приема клозапина является наиболее эффективным средством предотвращения психоза, связанного с отменой. Уровни в плазме могут быть особенно информативными для обеспечения достижения терапевтических уровней.
Защита от обострений психоза после отмены нейролептика с помощью других препаратов
Исследования, оценивающие лекарства, которые можно использовать вместе с нейролептиками для снижения риска психоза, связанного с отменой после отмены последних , немногочисленны, и нет никаких конкретных лекарств, лицензированных для этой цели. Однако есть некоторые свидетельства того, что антагонисты серотониновых рецепторов и рецепторов глутамата могут быть полезны. Небольшое открытое исследование показало, что ципрогептадин вместе с антипсихотическими препаратами был связан с более низкой частотой психоза, связанного с отменой. Другое небольшое открытое исследование показало, что пимавансерин, лицензированный для лечения психозов при болезни Паркинсона, является эффективным дополнением к антипсихотикам у пациентов с резистентной к лечению шизофренией. Имеются также данные небольшого ретроспективного исследования о том, что антихолинергические препараты связаны со сниженной вероятностью рецидива психоза у пациентов, резко прекративших прием клозапина. Тем не менее, общие доказательства того, что усиление антипсихотиков антагонистами серотониновых рецепторов или антихолинергическими препаратами снижает риск психоза, связанного с отменой, ограничены.
Рекомендации по ведению психоза, связанного с отменой нейролептика
1. Избегайте резкого прекращения приема клозапина, чтобы свести к минимуму риск психоза, связанного с отменой нейролептика
2. Стремитесь к гиперболической отмене. При плановой остановке скорость гиперболической отмены следует титровать до скорости, с которой пациент может терпеть, путем совместного принятия решений.
3. Если возможно, возобновите прием того нейролептика, на котором шло лечение , а не переходите на другой нейролептик.
4. Если повторное назначение нейролептика невозможно, рассмотрите возможность возобновления приема антипсихотических препаратов, которые ранее были эффективными или частично эффективными.
5. При отсутствии в анамнезе предшествующего эффективного лечения нейролептиками рассмотрите возможность перехода на атипичный антипсихотик в соответствии с установленными рекомендациями (например, Руководство по назначению Модсли) и принимая во внимание факторы пациента.
6. При переходе на другой антипсихотик стремитесь к постепенному снижению дозы, принимая во внимание потенциальные эффекты лекарственного взаимодействия.
7. При переходе на другой антипсихотик рассмотрите возможность измерения уровня нейролептика в крови, чтобы убедиться, что он находится в терапевтическом диапазоне.
8. Рассмотрите возможность усиления нейролептиков антагонистами серотониновых рецепторов или антихолинергическими препаратами, чтобы снизить риск рецидива психоза.
Клиника отравления трициклическими антидепрессантами. Причины антихолинергического синдрома
Распространенные лекарственные средства и растения, которые могут индуцировать антихолинергический синдром, перечислены в таблице ниже. Необходимо помнить, что потенциально все ТЦА способны вызывать припадки и аритмии при передозировках.

- Центральная нервная система. У пациентов с пониженным клиренсом лекарственных средств, включая пожилых людей и алкоголиков, могут наблюдаться признаки спутанности сознания, возбуждения и нервозности без выраженных антихолинергических симптомов.
Длительность комы обычно невелика: в одной серии наблюдений средняя продолжительность комы составила 6,4 ч. Случаи комы, длящейся более 24 ч. редки, являются свидетельством осложнений и бывают обусловлены одновременным приемом депрессантов центральной нервной системы.
У пожилых пациентов, принимающих антидепрессанты, может ухудшиться память. Пациенты с комой, достаточно глубокой, чтобы привести к утрате функции ствола мозга, редко выздоравливают, однако пациенты после передозировок лекарства могут полностью выздороветь, независимо от неврологических проявлений.
Это говорит о том, что необходимо продолжать интенсивное лечение любого пациента, принявшего сверхвысокие дозы трициклических антидепрессантов (ТЦА), если даже по проявлениям или по данным первоначальных оценок у пациента необратимый инсульт.
Терапевтическое применение амитриптилина вызывает острую дистонию и экстрапирамидные симптомы. Внутривенное введение 10 г проциклидина может прекратить приступ.
Большинство припадков, сопутствующих интоксикации циклическими антидепрессантами, наблюдается вскоре после поступления пациентов в стационар. Они непродолжительны и прекращаются без специальной противосудорожной терапии. Однако даже кратковременные припадки могут иногда вызывать гипотензию, внезапное ухудшение деятельности сердечно-сосудистой системы и смерть.
При припадках, индуцированных трициклическими антидепрессантами (ТЦА), отмечается повышение общей концентрации трициклических антидепрессантов (ТЦА) в плазме. Факторы риска, предрасполагающие к возникновению припадков, перечислены в таблице ниже.
Сообщалось, что после применения терапевтических доз трициклических антидепрессантов (ТЦА) наблюдались тремор, акатизия, миоклонус, дискинезия, делирий, седативный эффект, нарушения памяти, нейролептический синдром и мания.

- Периферическая нервная система. Передозировки амитриптилина вызывали невропатии и полирадикулоневропатию (например, при дозах 1,25 и 2,2 г).
В число средств, вызывающих и припадки, и тахикардию, входят амфетамины, алкалоиды белладонны, кокаин, симпатомиметические лекарственные средства, ксантины и антихолинергические лекарственные средства. Примерно у 1/3 пациентов через 2—5 ч после проглатывания сверхвысоких доз мапротилина (тетрациклический антидепрессант) появляются припадки. Припадки возникают примерно у 10 % из числа этих пациентов с нормальными электрокардиограммами.
- Рабдомиолиз. Припадки и кома являются факторами риска, предрасполагающими к развитию рабдомиолиза. Наличие только припадков или только комы не позволяет с уверенностью прогнозировать риск.
- Отек легких. Отек легких, индуцируемый трициклическими антидепрессантами, может развиться через 5—48 ч после приема лекарства. Существует сходство между респираторным дистресс-синдромом взрослых, вызванным передозировкой трициклических антидепрессантов (ТЦА), "синдромом героиновых легких" и поражением легких, обусловленным проглатыванием метадона.
В число сходных признаков входят диффузные двусторонние легочные инфильтраты на рентгенограммах грудной клетки, гипоксемия, некардиогенный отек легких и данные посмертного исследования, включающие утолщение межальвеолярных перегородок, лимфоцитарные инфильтраты и отек.
Рентгенографические свидетельства отека легких наблюдаются примерно у 10 % пациентов, получивших сверхвысокие дозы трициклических антидепрессантов (ТЦА). По данным одного из исследований, у пациентов, в плазме которых средний уровень трициклических антидепрессантов при поступлении в стационар превышал 2000 нг/мл, отмечается повышенная тенденция образования двусторонних альвеолярных инфильтратов, сопутствующих острому поражению легких.
Если у пациентов высокая пиковая концентрация трициклических антидепрессантов (ТЦА) в плазме, может быть рекомендована повторная рентгенограмма грудной клетки, даже если при поступлении пациента в стационар она была нормальной. Рентгенографические аномалии могут выявляться у некоторых пациентов с относительно низким уровнем трициклических антидепрессантов (ТЦА) в плазме при поступлении в стационар.
Смертные случаи, отмечаемые при некардиогенном отеке легких, подчеркивают возможность развития респираторного дистресс-синдрома у взрослых после сильных передозировок трициклических антидепрессантов (ТЦА). Такой отек легких может не коррелировать с гипо-тензией при поступлении в стационар. Shannon и Lovejoy считают, что у каждого третьего пациента с тяжелыми передозировками трициклических антидепрессантов (ТЦА) развиваются легочные осложнения; у каждого шестого — аспирационная пневмония и у каждого седьмого — отек легких.
В одной серии наблюдений у 9 % пациентов с передозировками трициклических антидепрессантов (ТЦА) отмечены клинические и рентгенографические показатели, соответствующие респираторному дистресс-синдрому взрослых.
- Состояние сердечно-сосудистой системы. Большинство случаев смерти после передозировок трициклических антидепрессантов (ТЦА) происходит до или вскоре после поступления пациента в больницу. Опасные для жизни аритмии и/или остановка сердца обычно наблюдаются на фоне выраженных электрокардиографических изменений, гипотензии, угнетения дыхания, комы или судорог и редко в виде единичных явлений.
Гипотензия типична после сильных передозировок трициклических антидепрессантов (ТЦА). 22-Летняя женщина проглотила 300 мг амитриптилина, что привело к инфаркту миокарда. Женщина выздоровела. Гипотензия, по-видимому, является прогностическим фактором. Гипотензия часто развивается независимо от концентрации трициклических антидепрессантов (ТЦА) в крови и ширины комплекса QRS. Гипотензия может быть тесно связана с развитием аритмий и отека легких. Гипотензия при поступлении в стационар может отмечаться после применения терапевтических доз трициклических антидепрессантов (ТЦА).
Сама по себе она не имеет большой прогностической ценности. Потенциальные электрокардиографические показатели передозировок циклических антидепрессантов представлены в таблице ниже.
Распространенными причинами летального исхода являются сердечно-сосудистая интоксикация с устойчивым угнетением функции миокарда, желудочковая тахикардия и фибрилляция желудочков. При передозировках, приведших к летальному исходу, перед смертью наблюдаются главным образом брадикардии; однако чаще всего в качестве причин смерти называют тахиаритмии и фибрилляцию желудочков. Тяжелые аритмии могут внезапно развиться у пациентов, у которых по прибытии в стационар было нормальное кровяное давление и отмечались лишь незначительные электрокардиографические изменения.

- Функция печени. Холестатические и гепатические реакции, обусловленные применением ТЦА, представляют собой идиосинкразические реакции гиперчувствительности и обычно являются слабовыраженными и обратимыми. Сообщалось о тяжелом поражении печени с молниеносным развитием печеночной недостаточности и летальным исходом.
- Состояние желудочно-кишечного тракта. Передозировка трициклических антидепрессантов (ТЦА) может вызвать ишемию кишечника, требующую резекции. У пожилых людей и у пациентов с неврологическими заболеваниями передозировка трициклических антидепрессантов (ТЦА) способна привести к псевдообструкции, спонтанной перфорации слепой кишки и фекальному перитониту. Многократное применение активированного угля в качестве лечебного средства после передозировки амитриптилина привело к образованию угольного безоара и незначительной закупорке кишечника.
- Синдромы отмены. Отмена трициклических антидепрессантов (ТЦА) может привести к развитию следующих синдромов, связанных с холинергиче-ским "рикошетом":
1) анорексии, тошноты, рвоты, диареи, профузного потоотделения, миалгии, недомогания, головной боли, озноба, утомляемости и беспокойства;
2) бессонницы, сопровождающейся "сновидениями наяву";
3) акатизии или паркинсонизма и
4) гипомании или мании.
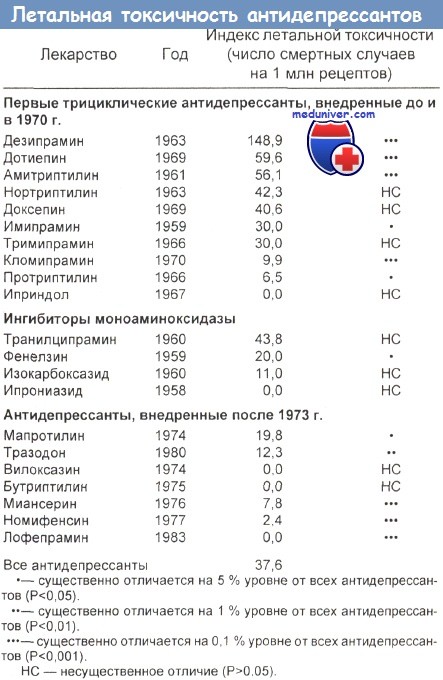
- Смертные случаи. В Великобритании проводилось исследование, в ходе которого сравнивалось число смертных случаев после отравления разными антидепрессантами. Сделанный при этом анализ выписанных рецептов позволил сделать вывод, что вероятность летального исхода при передозировках амитриптилина, дотиепина, доксепина, тримипрамина и мапротилина во всех возрастных группах выше, чем после передозировки миансерина и карпипрамина.
У такого рода исследований есть определенные методологические слабости (различные популяционные группы, данные наблюдений в больницах сопоставляются с данными наблюдений обще практикующих врачей, использование более одного вещества и т. д.). Сопоставление индексов летальной токсичности некоторых трициклических антидепрессантов и антидепрессантов второго поколения показало, что старые трициклические антидепрессанты (ТЦА) токсичнее, чем лекарства второго поколения того же терапевтического класса.
Ценность подобных данных об индексах летальной токсичности будет выше, если они будут дополнены данными исследований, проводимых в других странах.

Клиника отравления новыми циклическими антидепрессантами
- Амоксапин и локсапин. Передозировки амоксапина могут нарушить рефлексы ствола головного мозга, после чего наступает выздоровление. Роговичные рефлексы восстанавливаются через 24 ч после проглатывания лекарства; окулоцефалическая и окуловестибулярная реакции иногда не восстанавливаются в течение 36—48 ч.
Скрининг пациентов, у которых отсутствовали окулоцефалические и роговичные рефлексы, показал, что больные страдали персистентными неврологическими расстройствами, у 37-летней женщины, проглотившей около 875 мг амоксапина, развился нейролептический синдром. Хотя утверждается, что амоксапин оказывает меньшее воздействие на сердечную функцию, чем другие ТЦА, передозировки амоксапина могут вызвать обострение и сердечной недостаточности, и аритмии.
- Мапротилин. Сочетание высоких доз мапротилина с синусовой тахикардией и патологическими электрокардиограммами предопределяет высокий риск возникновения единичных и множественных припадков. Минимальная токсическая доза мапротилина — 425—750 мг. Считают, что самая низкая летальная доза мапротилина равна 3 г, но известны случаи выживания даже после проглатывания 5 г препарата. У 50-летней женщины, найденной мертвой, содержание мапротилина в крови составляло 1 мкг/мл.
- Миансерин. Хотя применение миансерина редко вызывает сердечные аритмии, передозировка миансерина (количество препарата неизвестно) в одном случае привела к опасным для жизни желудочковым аритмиям, в том числе к полиморфной желудочковой тахикардии, при этом концентрация миансерина в сыворотке в 20—50 раз превышала терапевтический уровень.
Терапевтическая концентрация миансерина (плюс деметилмиансерин) — 100 нг/мл, а тяжелая интоксикация отмечается при концентрациях выше 500 нг/мл. Резкое сужение зрачков наблюдалось при передозировке миансерина, составившей 1200 мг. Применение налоксона не привело к нормализации зрачков. В течение 6 ч больной был в сознании, диаметр его зрачков при этом был равен 2 мм. Спустя 24 ч величина зрачков нормализовалась.
Через 2 ч после передозировки концентрация миансерина в крови составляла 390 нг/мл, а уровень деметилмиансерина — 7 нг/мл. После симптоматического лечения пациент выздоровел.
Сообщалось о случае возникновения припадков после применения терапевтической дозы — 300 мг/сут. Не сообщалось о случаях летального исхода после передозировок вилоксазина. Седативный эффект, гипотензия, нежелательные антихолинергические эффекты и увеличение массы тела обычно не представляли собой проблемы, если вилоксазин применяли в терапевтических дозах. Тошнота отмечается у 20—50 % пациентов и является главной причиной, по которой пациенты прекращают прием этого лекарства.
- Каприпрамин. Острое отравление каприпрамином изучалось парижской группой исследователей. Клинические проявления были такими же, как при передозировках ТЦА: много антихолинергических симптомов и замедление внутрижелудочкового проведения. Такие нарушения проведения отмечаются после проглатывания 1 г или большего количества каприпрамина. Описан случай летального исхода после проглатывания каприпрамина и этилового спирта, концентрация каприпрамина в крови при этом составляла 2,0 мг/л (2 мкг/мл).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Миастенический криз при миастении. Холинергический криз при миастении.
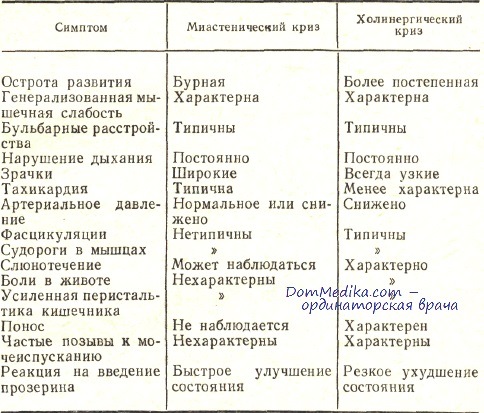
Наиболее опасным, угрожающим жизни состоянием при миастении являются кризы — миастенический и холинергический.
Миастенический криз при миастении обычно связан с ухудшением нервно-мышечной передачи. Это может быть обусловлено изменением функционального состояния синаптического аппарата под влиянием разных факторов: недомогания, лихорадочного состояния, менструации, переутомления и т. д. или уменьшения по той или иной причине дозы АХЭП. Основная опасность — ухудшение бульбарных функций, вплоть до афагии, а также слабость дыхательной мускулатуры с нарастанием дыхательной недостаточности. На догоспитальном этапе необходимо немедленное подкожное или даже внутривенное введение 0,05 % раствора прозерина; через 30 мин прозерин вводится повторно подкожно; обязательно внутривенное введение метилпреднизолона — до 1,5—2 г или преднизолона 1,5-2 мг/кг.
Больные с осложнениями миастении госпитализируются в центры нервно-мышечной патологии или реанимационные, нейрореанимационные отделения, либо отделения интенсивной терапии, где обычно им проводится плазмаферез, а при необходимости и возможности (препарат очень дорог!) — внутривенно вводится иммуноглобулин G — 0,4 мг/кг, по показаниям применяется ИВЛ.
Холинергический криз при миастении связан с передозировкой антихолинэстеразных препаратов, в результате чего возникают симптомы мускари-новой и никотиновой интоксикации: фасцикуляции мышц, птоз, гиперсекреция слюны, потливость, бледность, брадикардия, боли в животе, понос. АХЭП немедленно временно отменяются. В угрожающей ситуации внутривенно медленно вводится 0,5—1,0 мл 0,1 % раствора атропина. Больные доставляются в указанные выше отделения, где им по показаниям назначается ИВЛ, проводится плазмаферез.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

