Хроническая инфекция опухолевой природы
Обновлено: 22.04.2024
Хронический лимфолейкоз — злокачественное лимфопролиферативное заболевание, при котором опухолевыми клетками являются патологические В-лимфоциты, способные накапливаться в костном мозге, периферической крови и лимфатических узлах. В норме В-лимфоциты в течение своей жизни превращаются в иммуноглобулинсекретирующую клетку, которая обеспечивает приобретённый иммунитет. Опухолевые В-лимфоциты такой функции лишены, и, таким образом, иммунитет больного страдает, и повышается риск присоединения инфекционных заболеваний. Помимо этого, по мере прогрессирования заболевания нарушается выработка эритроцитов, нейтрофилов и тромбоцитов, возможно развитие аутоиммунных процессов. Наконец, хронический лимфолейкоз может трансформироваться в В-клеточный пролимфоцитарный лейкоз, в высокодифференцированную неходжкинскую лимфому, в частности — в диффузную В-крупноклеточную лимфому.
Причины развития лимфолейкоза
Хронический лейкоз является самым распространённым видом лейкоза, составляя до 30% в общей структуре заболеваемости. Частота встречаемости составляет 4 случая на 100 тысяч населения; у лиц старше 80 лет частота составляет более 30 случаев на 100 тысяч населения.
Факторами риска развития хронического лимфолейкоза являются:
- Пожилой возраст. До 70% всех выявленных случаев приходится на людей старше 60 лет,
- Мужской пол. Мужчины заболевают в два раза чаще женщин,
- Воздействие ионизирующего излучения,
- Контакт с бензолом и бензином.
Симптомы
Для хронического лимфолейкоза характерно длительное бессимптомное течение; основной причиной обращения к врачу являются изменения в общем анализе крови, сданном в рамках профилактического осмотра или по поводу иного заболевания. Активных жалоб на момент первичного осмотра пациент может и не предъявлять, но при этом зачастую даже в этой ситуации уже выявляется увеличение лимфатических узлов и изменение их консистенции до тестоватой. Сами лимфоузлы не уплотнены, сохраняют подвижность относительно окружающих тканей. В случае присоединения инфекции лимфатические узлы значительно увеличиваются; по мере прогрессирования хронического лимфолейкоза лимфоузлы — в первую очередь брюшной полости — способны
образовывать конгломераты.
Первые возникающие жалобы обычно не носят специфического характера: повышенная утомляемость, слабость, выраженная потливость. По мере развития заболевания могут возникнуть аутоиммунные проявления, в первую очень гемолитические анемии (в 10-25% случаев) и тромбоцитопении (в 2-3% случаев). Гемолитическая анемия развивается в связи с разрушением самим организмом эритроцитов; чаще всего развивается, как и сам хронический лимфолейкоз, постепенно, но может проявиться и острым кризом — с повышением температуры, появлением желтухи, потемнения мочи. Тромбоцитопения может быть гораздо более опасным состоянием в связи с развитием кровотечений, в том числе и жизнеугрожающих (например, кровоизлияния в головной мозг).
Кроме того, так как В-лимфоциты относятся к клеткам, обеспечивающим иммунитет, типичным является присоединение инфекционных осложнений, в том числе оппортунистических, то есть вызванных микроорганизмами, постоянно находящимися в человеческом организме и не проявляющими себя при адекватном иммунном ответе. Чаще всего оппортунистическими инфекциями поражаются лёгкие.
Диагностика хронического лимфолейкоза
В биохимическом анализе крови может быть выявлено снижение общего белка и количества иммуноглобулинов, но это характерно для более поздних стадий заболевания. Обязательным этапом в диагностическом поиске является трепанбиопсия костного мозга. При гистологическом исследовании полученного пунктата на ранних этапах заболевания так же, как и в общем анализе крови, обнаруживается небольшое содержание лимфоцитов (40–50%), но при высоком лейкоцитозе лимфоциты могут составлять 95–98% костномозговых элементов.
Так как изменения в костном мозге являются неспецифическими, окончательный диагноз хронического лимфолейкоза устанавливается на основании данных иммуногистохимического исследования. Характерный иммунофенотип хронического лимфолейкоза включает экспрессию антигенов CD19, CD5, CD20, CD23, также отмечается слабая экспрессия на поверхности клеток иммуноглобулинов IgM (нередко одновременно с IgD) и антигенов CD20 и CD22. Главным цитогенетическим маркером, непосредственно влияющим на выбор терапии, является делеция 17p. Желательно выполнять анализ, направленный на выявлении этой делеции, до начала лечения, так как её выявление приводит к изменению тактики ведения пациента. Помимо биопсии костного мозга, в случае значительного увеличения отдельных лимфатических узлов показана пункция и их с целью исключения лимфомы.
Из инструментальных методов диагностики проводятся рентгенография органов грудной клетки и УЗИ наиболее часто поражаемых групп лимфоузлов и органов брюшной полости – в первую очередь печени и селезёнки, так как именно эти органы чаще всего поражаются при хроническом лимфолейкозе.

Стадии заболевания
В настоящее время стадирование осуществляется согласно классификации, предложенной Binet:
- A — содержание гемоглобина более 100 г\л, тромбоцитов — более 100×10 9 \л, поражено менее трёх лимфатических областей (к ним относятся: шейные лимфоузлы, подмышечные лимфоузлы, паховые лимфоузлы, печень, селезёнка),
- B — содержание гемоглобина более 100 г\л, тромбоцитов — более 100×10 9 \л, поражено более трёх лимфатических областей,
- C — содержание гемоглобина менее 100 г\ или тромбоцитов — менее 100×10 9 \л.
Помимо классификации по Binet, используется классификация по Rai, используемая преимущественно в США. Согласно ей, выделяют четыре стадии заболевания:
- 0 — клинические проявления включают в себя только повышение лимфоцитов более 15×10 9 в периферической крови и более 40% в костном мозге,
- I — повышено количество лимфоцитов, диагностируется увеличение лимфоузлов,
- II — повышено количество лимфоцитов, диагностируется увеличение печени и\или селезёнки вне зависимости от увеличения лимфоузлов,
- III — наблюдается повышение количества лимфоцитов и снижение уровня гемоглобина менее 110 г\л вне зависимости от увеличения селезёнки, печени и лимфоузлов,
- IV — наблюдается повышение количества лимфоцитов и снижение числа тромбоцитов менее 100×10 9 вне зависимости от уровня гемоглобина, увеличения органов и лимфоузлов.
0 стадия характеризуется благоприятным прогнозом, I и II — промежуточным, III и IV — неблагоприятным.
Лечение
В настоящее время хронический лимфолейкоз хорошо поддаётся лечению благодаря широкому спектру химиотерапевтических препаратов. Важно отметить, что современные руководства не рекомендуют начинать агрессивное лечение сразу же после установки диагноза — в случаях, когда клинические проявления минимальны, возможно активное динамическое наблюдение до момента возникновения показаний к проведению специфического лечения, к коим относятся:
- Возникновение или нарастание интоксикации, которая проявляется потерей массы тела более чем на 10% за полгода, ухудшением общего состояния; появление лихорадки, субфебрильной температуры, ночных потов.
- Нарастание явлений анемии и/или тромбоцитопении;
- Аутоиммунная анемия и/или тромбоцитопения — в случае, если состояние не корректируется преднизолоном;
- Значительные размеры селезёнки — нижний край на расстоянии >6 см и более ниже рёберной дуги;
- Размер поражённых лимфатических узлов более 10 см или его прогрессивное увеличение;
- Увеличение количества лимфоцитов более, чем на 50% за 2 месяца, или вдвое за 6 месяцев.
Основным методом лечения хронического лимфолейкоза на данный момент является химиотерапия. Один из первых химиотерапевтических агентов, показавших свою эффективность в лечении хронического лимфолейкоза, хлорамбуцил, используется и в настоящее время, хоть и ограниченно. С течением времени вместо хлорамбуцила стали использовать циклофосфамид, в комбинации с другими препаратами, и соответствующие схемы (например, CHOP, COP, CAP) на данный момент применяются у пациентов молодого возраста с хорошим соматическим статусом.
Впервые введённый в клиническую практику в 80-х годах прошлого века флударабин показал эффективность в отношении достижения стойкой ремиссии, превышающую эффективность хлорамбуцила, особенно в сочетании с циклофосфамидом. Важно отметить, что эта схема эффективна даже в случае развития рецидива заболевания. Последним словом в лечении хронического лейкоза в настоящее время является применение иммунотерапевтических средств — препаратов из группы моноклональных тел. В рутинную клиническую практику прочно вошел ритуксимаб. Данный препарат взаимодействует с антигеном CD20, который ограниченно экспрессируется при хроническом лимфолейкозе, поэтому для эффективного лечения требуется сочетание ритуксимаба с какой-либо из принятых схем химиотерапии, чаще всего с флударабином или COP. Ритуксимаб в монорежиме может применяться как поддерживающая терапия при частичном ответе на лечение.
Перспективным выглядит применение препарата алемтузумаб, который взаимодействует с антигеном CD52. Его также используют как в монорежиме, так и в комбинации с флударабином.
Отдельно хотелось бы упомянуть хронический лимфолейкоз с делецией 17p. Этот подтип лимфолейкоза часто бывает резистентен к стандартным схемам химиотерапии.
Определённые успехи в лечении этого подвида лимфолейкоза достигнуты благодаря применению упомянутого выше алемтузумаба. Кроме того, перспективным средством в этой ситуации является ибрутиниб. В настоящее время этот препарат применяется в монорежиме, сочетание его с различными схемами химиотерапии исследуется; определённое преимущество показала схема, включающая ибрутиниб, ещё одно моноклональное тело — ритуксимаб, и бендамустин.

Лучевая терапия, которая столетие назад была практически единственной возможностью лечения таких больных, и по сей день не утратила актуальности: рекомендуется её проведение в рамках комплексного подхода на область поражённых лимфоузлов, если наблюдается их продолженный рост на фоне стабилизации остальных проявлений заболевания. В этом случае необходимая суммарная доза составляет 20-30 Гр. Также лучевой метод может быть применён при рецидивах заболевания.
В лечении хронического лимфолейкоза нашёл своё место и хирургический метод, заключающийся в удалении поражённой селезёнки. Показаниями к данному вмешательству являются:
- Увеличение селезёнки в сочетании с тяжелой анемией и/или тромбоцитопенией, особенно если наблюдается химиорезистентность,
- Массивное увеличение селезёнки при условии отсутствия ответа на химиотерапию,
- Тяжёлая аутоиммунная анемия и/или тромбоцитопения при резистентности к медикаментозному лечению.
При развитии резистентности к применяемым ранее химиотерапевтическим агентам или же при быстром прогрессировании после проведённого лечения может быть проведена трансплантация костного мозга. Трансплантация костного мозга показана в первой ремиссии пациентам из группы высокого риска, молодым пациентам в отсутствие эффекта от проводимого лечения, пациентам с делецией 17p/мутацией TP53 при наличии прогрессии заболевания. Важно отметить, что после проведённой трансплантации рекомендуется применение ритуксимаба и леналидомида в качестве поддерживающей терапии с целью предотвращения рецидива.
Наконец, пациентам требуется проведение и поддерживающей терапии, которая включает:
- Переливание эритроцитарной массы при анемии;
- Переливание тромбоцитарной массы при кровотечении, вызванном тромбоцитопенией;
- Противомикробные средства при присоединении бактериальной, грибковой или вирусной инфекции, а также для её профилактики;
- Применение преднизолона в дозе 1-2 мг/кг при развитии аутоиммунных процессов.
В случае развития рецидива заболевания тактика лечения зависит от ряда факторов, таких как: проведённая ранее терапия, срок наступления рецидива, клиническая картина. В случае раннего (то есть возникшего в периоде 24 месяцев и ранее) рецидива основным препаратом является ибрутиниб. Он применяется как самостоятельно, так и в составе упомянутой выше схемы лечения (ибрутиниб+ритуксимаб+бендамустин).
Альтернативным препаратом выбора может быть алемтузумаб. Демонстрируя сопоставимую с ибрутинибом эффективность, он, однако, демонстрирует значительно большую токсичность.
Наконец, у ряда пациентов по поводу раннего рецидива хронического лимфолейкоза может быть выполнена трансплантация костного мозга.
В случае позднего (возникшего в срок более 24 месяцев с момента завершения лечения) рецидива основным критерием выбора является проведённая ранняя терапия.
- Если проводимая ранее терапия на основе флударабина не сопровождалась значительной токсичностью, то можно вернуться к этой схеме, а также дополнить её ритуксимабом.
- В случае выявления цитопении возможно применение ритуксимаба в сочетании с высокими дозами глюкокортикостероидов.
- При проведённом ранее лечении хлорамбуцилом показано применение схем с флударабином или сочетанием бендамустина и ритуксимаба.
- Монотерапия ибрутинибом или его сочетание с одной из схем полихимиотерапии также может быть эффективна при рецидиве хронического лимфолейкоза.
Оценка эффективности лечения
Диагностические исследования, направленные на оценку эффекта от проведённого лечения, проводятся не ранее, чем через 2 месяца после окончания последнего курса химиотерапии. Результат может быть оценён следующим образом:
- Полная ремиссия: уменьшение до нормальных размеров печени, селезёнки, лимфоузлов (допустимо их увеличение в размере не более чем 1,5 см), снижение числа лимфоцитов менее 4×10 9 \л в периферической крови и менее 30% в костном мозге, повышение числа тромбоцитов более 100×10 9 \л, гемоглобина — более 110 г\л, нейтрофилов — более 1,54×10 9 \л.
- Частичная ремиссия: уменьшение размеров лимфоузлов, печени и селезёнки на 50% и более, снижение количества лимфоцитов в периферической крови на 50%, повышение числа тромбоцитов более 100×10 9 \л, гемоглобина — более 110 г\л, нейтрофилов — более 1,54×10 9 \л или же повышение любого из этих параметров более чем на 50% от исходного уровня.
- Признаками прогрессирования заболевания являются, напротив, увеличение размеров лимфоузлов, печени и селезёнки на 50% и более, а также уменьшение количества тромбоцитов на 50% и более от исходного уровня и уменьшение количества тромбоцитов на 20 г\л и более.
Для установления полной ремиссии необходимо соблюдение всех перечисленных критериев, частичной — по крайней мере 2 критерия, касающихся состояния внутренних органов, и минимум одного критерия, касающегося клеточного состава крови.
Следует учитывать, что терапия ибрутинибом может привести к полному ответу со стороны лимфатических узлов и селезёнки, но с сохранением лейкоцитоза в периферической крови. Это состояние обозначается, как частичный ответ с лимфоцитозом.
Прогноз
Значительные успехи в терапии хронического лимфолейкоза позволили сделать это заболевание потенциально излечимым или же достаточно долго поддерживать жизнь человека без прогрессирования основного заболевания с сохранением её качества.
Напротив, без лечения заболевание медленно, но неуклонно прогрессирует, что способно стать причиной гибели пациента спустя несколько лет после дебюта заболевания, поэтому своевременное обращение к врачу и начало адекватной терапии очень важны.
Что такое папилломавирусная инфекция (ВПЧ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Борисова Э. В., гинеколога со стажем в 35 лет.
Над статьей доктора Борисова Э. В. работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Папилломавирусная инфекция — это состояние, развивающееся при заражении какой-либо разновидностью вируса папилломы человека (ВПЧ). Возбудители данной группы могут существовать только в человеческом организме, поражая кожу и слизистые оболочки, приводя к появлению папиллом, бородавок, плоских и остроконечных кондилом. [1] [2] [4]
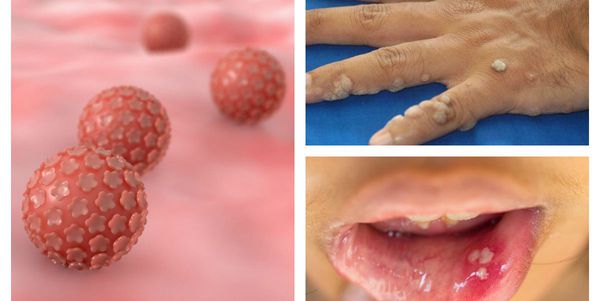
ВПЧ довольно широко распространён в человеческой популяции, особенно среди сексуально активных людей, а это свыше 80% всего населения. До недавнего времени вирусы этой группы считались относительно безобидными, вызывающими лишь косметические дефекты, но последние научные исследования показывают, что проблема гораздо серьёзнее. [9]
На сегодняшний день науке известно несколько сотен штаммов (типов) папилломавирусов . Около 40 из них преимущественно поражают аногенитальную область и передаются половым путём. Особую опасность представляют штаммы высокого онкогенного риска, так как они могут спровоцировать развитие онкологических заболеваний, в том числе рака шейки матки.
Чаще всего заражение происходит в молодом возрасте, как правило, с началом половой жизни, при этом возможно неоднократное инфицирование. Наиболее уязвимой группой в плане вероятности заражения ВПЧ и развития неблагоприятных последствий являются молодые женщины в возрасте 15-30 лет.
Помимо этого ВПЧ может перейти от инфицированной матери к ребёнку, например, при родах. Не исключается и контактно-бытовой способ передачи возбудителя, например, при соприкосновениях и даже при совместном использовании предметов личной гигиены.
К факторам риска, способствующим заражению ВПЧ, развитию хронической папилломавирусной инфекции и её переходу в предраковые состояния с потенциальным перерождением в злокачественную опухоль, относятся:
- иммунодефицит любого происхождения, в том числе вследствие ВИЧ-инфекции, лучевых поражений, применения иммунодепрессантов при трансплантации органов и тканей, лечения цитостатиками и других причин;
- подавленное состояние иммунитета во время беременности;
- раннее начало половой жизни;
- частая смена половых партнёров, незащищённый секс;
- инфицированность высокоонкогенными штаммами ВПЧ;
- заражение одновременно несколькими типами ВПЧ;
- наличие других инфекций, передающихся половым путём, например, герпесвирусной и цитомегаловирусной инфекции, вируса Эпштейна — Барр, гепатитов В и С, гонореи и трихомониаза;
- стресс, истощение, гиповитаминоз, гормональный дисбаланс;
- многократные роды и аборты;
- тяжёлые хронические заболевания, в том числе сахарный диабет;
- вредные привычки (курение, злоупотребление спиртным);
- низкий социальный статус, плохие условия жизни, неудовлетворительная интимная гигиена;
- пренебрежение регулярными профилактическими обследованиями (один из важнейших факторов риска);
- низкий уровень развития медицины в регионе проживания.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы папилломавирусной инфекции
Далеко не всегда человек догадывается о наличии в своём организме папилломавирусной инфекции, оставаясь при этом источником заражения для потенциальных партнёров. [1] [2] Дело в том, что заболевание может долгое время протекать бессимптомно: вирус скрыто существует в организме от нескольких месяцев до нескольких лет, никак себя не проявляя. Кроме того, уже имеющиеся проявления инфекции не всегда доступны для наружного обзора. Например, если папилломы, бородавки и кондиломы на открытых участках тела и поверхности гениталий ещё можно заметить самостоятельно, то патологические изменения, локализующиеся на шейке матки, сможет обнаружить только специалист в ходе осмотра с применением соответствующих инструментов.
И всё же существует несколько симптомов, которые прямо или косвенно могут указывать на наличие папилломавирусной инфекции и её неблагоприятных последствий. [3] К ним относятся:
- появление на коже и/или слизистых оболочках каких-либо разрастаний различных форм (на тонкой ножке или с широким основанием, нитевидной, округлой или плоской конфигурации, в форме цветной капусты или петушиного гребня) и размеров (от образований в несколько миллиметров до разрастаний, занимающих всю промежность);
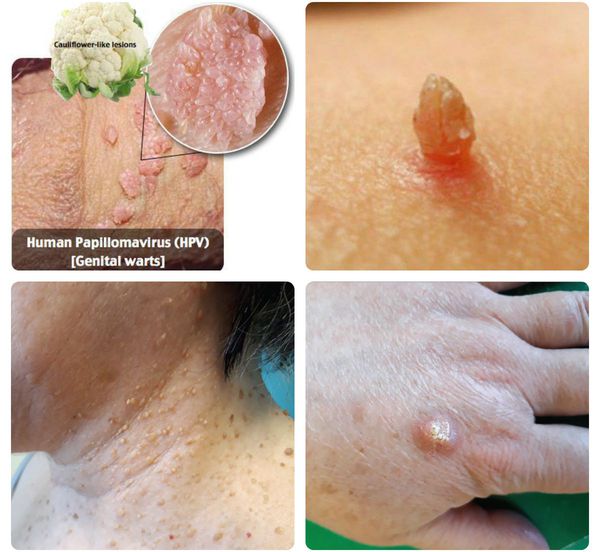
- отёчность и воспалительная инфильтрация папилломатозных разрастаний (остроконечных кондилом), их ранимость и кровоточивость, что приводит к присоединению вторичной инфекции с появлением гнойного отделяемого с неприятным запахом;
- зуд, жжение, мокнутие в области промежности, появление обильных белей, даже при отсутствии видимых патологических образований;
- межменструальные кровянистые выделения, в том числе появляющиеся в результате полового контакта:
- дискомфорт во время полового акта.
Наиболее тревожными признаками заболевания являются:
- постоянные боли в области спины и таза;
- слабость;
- беспричинная потеря веса;
- опухание одной или обеих ног.
Патогенез папилломавирусной инфекции
Заражение папилломавирусной инфекцией происходит при попадании вирусных частиц на кожу или слизистую оболочку. [1] [2] Излюбленная локализация инфекции на теле женщины — промежность, большие и малые половые губы, вульва, влагалище и шейка матки, у мужчин — половой член. Может также произойти поражение слизистой полости рта, пищевода, мочевого пузыря, трахеи, конъюнктивы и других органов и тканей.
Заражению способствуют микротравмы и потёртости. Особенно благоприятные для инфицирования условия создаются при половом акте. В 60–80% случаев достаточно однократного сексуального контакта с больным папилломавирусной инфекцией или бессимптомным носителем ВПЧ. К развитию заболевания может привести попадание в организм буквально единичных вирусных частиц.
При наличии предрасполагающих факторов (микроповреждения, слабого иммунитета и других) возбудитель проникает в эпителиальную ткань до её базального слоя. Там он прикрепляется к оболочке незрелой клетки и внедряется сначала в её цитоплазму, а затем и в ядро, где повреждает генетический аппарат. После этого начинается деление клеток с изменённым геномом, что приводит к появлению в месте внедрения вируса генитальных кондилом (образований, которые постепенно разрастаются), а, например, на шейке матки — к развитию диспластических процессов различной степени тяжести (дисплазия шейки матки).
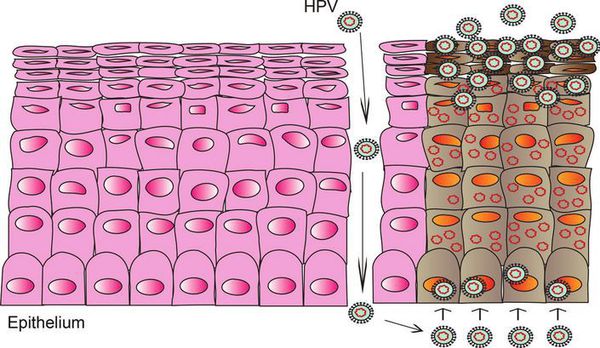
В случае ВПЧ высокого онкогенного риска определённые гены в вирусной ДНК кодируют синтез специфических белков-онкопротеинов (Е6 и Е7), которые подавляют противораковую защиту клеток. Под действием онкопротеинов нарушается стабильность генома клеток, стимулируется их размножение и снижается способность к дифференцировке — всё это со временем может привести к онкопатологии. [12]
Формирование новых полноценных вирусных частиц, способных инфицировать другого человека, происходит уже не в базальном, а в самых поверхностных слоях поражённого эпителия. Возбудитель может содержаться в слущивающихся отмирающих клетках, которые отделаются слизистой оболочкой. Таким образом они переходят к новому хозяину при тесном (сексуальном или бытовом) контакте.
Классификация и стадии развития папилломавирусной инфекции
По способности индуцировать развитие злокачественных новообразований ВПЧ подразделяют на четыре группы: [8]
- неонкогенные штаммы ВПЧ (типы 1-5);
- ВПЧ низкого онкогенного риска (типы 6, 11, 40, 42-44, 54, 61, 70, 72, 81);
- ВПЧ среднего онкогенного риска (типы 26, 31, 33, 35, 51-53, 58, 66);
- ВПЧ высокого онкогенного риска (типы 16, 18, 39, 45, 56, 59, 68, 73, 82).
Клинические формы папилломавирусной инфекции: [5]
- латентная — скрытая форма, не имеющая клинических и морфологических признаков, но обнаруживаемая иммунохимическими и молекулярно-биологическими методами;
- субклиническая — возникает у лиц с нормальным иммунитетом, определяется только специальными диагностическими методами (пробы с растворами-индикаторами, гистологические и цитологические исследования);
- манифестная — появляется у лиц с временным или стойким снижением иммунитета, в случае генитальной папилломавирусной инфекции характеризуется появлением кондилом.
Латентная инфекция может переходить в субклиническую и манифестную форму в случае возникновения предрасполагающих условий (факторов риска), но чаще всего она протекает бессимптомно, не манифестируя.
Клинические проявления папилломавирусной инфекции:
- кожные поражения: подошвенные, плоские и обычные (вульгарные) бородавки, бородавчатая эпидермодисплазия, бородавки Бютчера и небородавчатые поражения кожи;
- поражения слизистых оболочек гениталий: кондиломы, некондиломатозные поражения, карциномы;
- поражения слизистых вне гениталий: папилломатоз гортани, карциномы шеи, языка и другое.
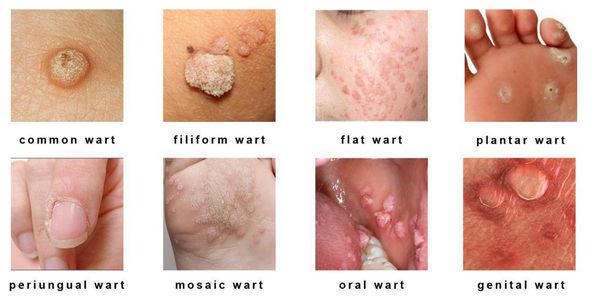
Разновидности поражений:
- экзофитные — видимые разрастания в виде папиллом и бородавок;
- эндофитные — образования, располагающиеся в толще ткани, которые не видны невооружённым глазом.
Осложнения папилломавирусной инфекции
Основными наиболее опасными осложнениями папилломавирусной инфекции являются злокачественные новообразования. Но возможны и другие серьёзные последствия:
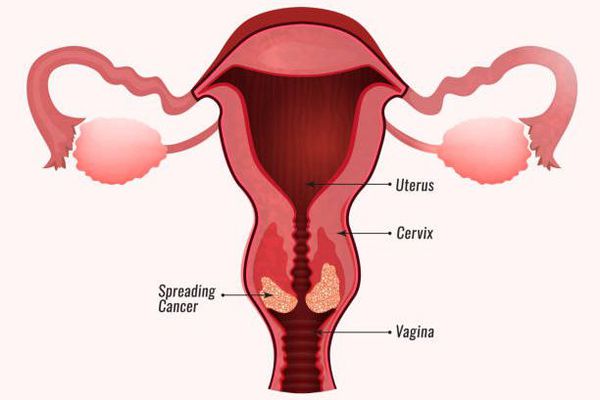
- Злокачественные новообразования заднего прохода, вульвы, полового члена и ротоглотки. Повышение риска их развития также связывают с высокоонкогенными штаммами ВПЧ. [6]
- Остроконечные кондиломы на гениталиях, папилломатоз верхних дыхательных путей (рецидивирующий респираторный папилломатоз, веррукозный ларингит). Причиной возникновения могут стать 6-й и 11-й типы вируса, несмотря на свой низкий онкогенный риск. В случае папилломатоза есть вероятность полной потери голоса, обструкции (перекрытия) гортани с развитием асфиксии. Это довольно редкое заболевание может возникать у детей, рождённых женщинами с папилломавирусной инфекцией. По разным данным, заражение может происходить как во время родов, так и внутриутробно. Как правило, респираторный папилломатоз начинает проявляться в детском и подростковом возрасте, он склонен к неоднократным рецидивам после удаления множественных папиллом, перекрывающих дыхательные пути.
- Гнойно-септические осложнения. Папилломатозные разрастания на слизистых оболочках очень ранимы, легко травмируются, и через участки мокнутия, расчёсов и потёртостей может проникать вторичная инфекция, которая в свою очередь и вызывает нагноение.
Диагностика папилломавирусной инфекции
Основные цели диагностических мероприятий: [3]
- ранняя диагностика папилломавирусной инфекции для динамического наблюдения и лечения;
- своевременное обнаружение и лечение предраковых изменений, что позволяет на 80% предотвратить развитие злокачественных новообразований;
- выявление онкологических новообразований на ранних стадиях, что в большинстве случаев даёт хороший прогноз эффективного излечения;
- решение вопроса о целесообразности вакцинации.
Для выявления папилломавирусной инфекции на сегодняшний день существует целый комплекс диагностических процедур:
- Гинекологический осмотр в зеркалах — позволяет увидеть папилломатозные разрастания (аногенитальные кондиломы) и другие изменения.
- Классический тест Папаниколау (мазки с поверхности шейки матки и стенок влагалища для цитологического исследования) — обнаруживает ранние признаки дисплазии и злокачественного перерождения.
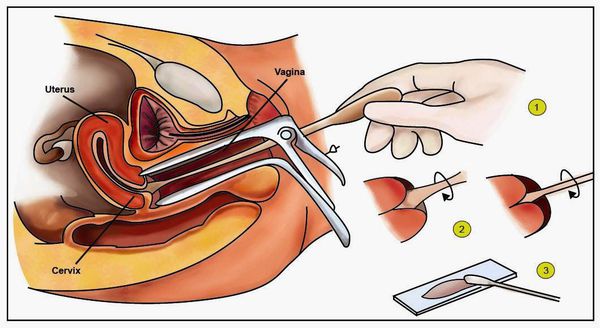
- Пробы с уксусной кислотой и раствором Люголя — выявляют участки поражения слизистой шейки матки.
- Кольпоскопия, в том числе с биопсией подозрительных участков и их гистологическим исследованием, — определяет характер имеющегося новообразования.
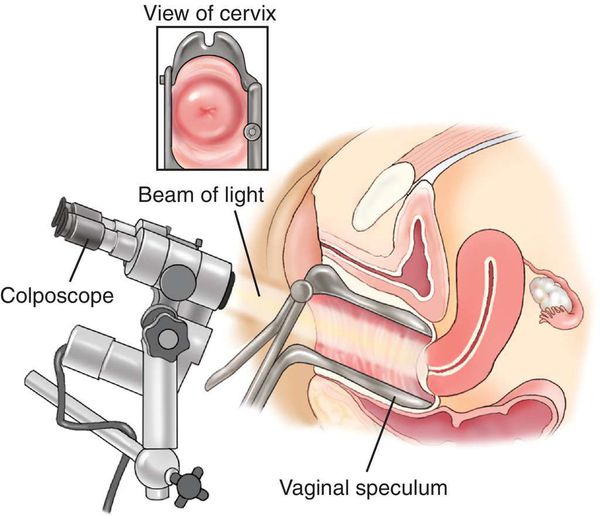
- Иммунофлюоресцентный анализ (ИФА) обнаруживает в цервикальном соскобе онкопротеины (Е7 и Е6). Этот метод достаточно новый, с его помощью можно различить носительство ВПЧ и первые признаки злокачественного перерождения в клетках, [12] оценить агрессивность данного процесса, сделать предположения относительно прогноза заболевания.
- Полимеразная цепная реакция (ПЦР) находит вирусную ДНК в биологическом материале (соскоб со слизистой), определяет тип ВПЧ, степень его онкогенности, а также количество вирусных частиц, что косвенно позволяет судить о характере течения папилломавирусной инфекции у данного пациента, возможности спонтанного излечения или высокого риска прогрессирования. Обнаружение ВПЧ с помощью этого возможно даже при латентном течении болезни, когда цитологические и гистологические методы не эффективны.
Целесообразно дополнительное обследование пациента на наличие других инфекций, передающихся половым путём, так как папилломавирус в 90% случаев с ними сочетается, и это может осложнять течение заболевания.
Лечение папилломавирусной инфекции
Лечение папилломавирусной инфекции должно быть комплексным и включать следующие составляющие: [3] [5]
- деструкцию (удаление) видимых проявлений (аногенитальных кондилом и др.);
- иммуномодулирующую терапию;
- противовирусную терапию;
- лечение сопутствующих инфекций, передающихся половым путём.
Деструктивные методы делятся на две основные группы:
- химические — с применением трихлоруксусной кислоты, а также таких препаратов, как "Солкодерм", "Колломак", "Ферезол" и др.;
- физические — хирургическое удаление, электрокоагуляция, криодеструкция, радиоволновая и плазменная коагуляция, лазеротерапия.
Лечение сопутствующих половых инфекций проводят до начала деструктивной терапии на фоне адекватной иммунокоррекции.
Удаление видимых проявлений папилломавирусной инфекции должно сочетаться с противовирусной терапией — как с общей, так и с применением препаратов местного действия после удаления кондилом.
Следует помнить, что успешно проведённое лечение не исключает развитие рецидивов в дальнейшем, особенно у пациентов с нарушениями иммунитета. Поэтому за ними устанавливается динамическое наблюдение в течение как минимум 1-2 лет.
Прогноз. Профилактика
В 90% случаев здоровая иммунная система человека справляется с папилломавирусной инфекцией самостоятельно за период от полугода до двух лет с момента инфицирования, после чего происходит полное выздоровление с исчезновением вируса из организма. При этом не формируется напряжённого пожизненного иммунитета, то есть человек может заразиться повторно.
В других случаях, при наличии предрасполагающих факторов, заболевание приобретает хроническую форму, склонную к длительному скрытому течению с периодическими рецидивами и возможным развитием тяжёлых осложнений.
От момента попадания вируса в организм до развития предраковых состояний и тем более возникновения рака может пройти достаточно много времени, иногда десятки лет. Поэтому регулярные профилактические обследования, своевременное выявление и лечение предраковых состояний — вполне реальный и эффективный способ избежать самого неблагоприятного варианта развития событий. [13] С этой целью Всемирная организация здравоохранения рекомендует всем женщинам старше 30 лет при первичном скрининге проходить не только “рутинное” цитологическое исследование, но и делать тест на наличие ВПЧ. [10]
Регулярное посещение гинеколога (при отсутствии каких-либо жалоб — раз в год) с проведением теста Папаниколау позволяет своевременно обнаружить начальные признаки дисплазии и предпринять все необходимые меры для предотвращения прогрессирования процесса и его перехода в онкологическое заболевание.
Использование методов барьерной контрацепции хоть и не полностью защищает от инфицирования, но несколько снижает его вероятность.
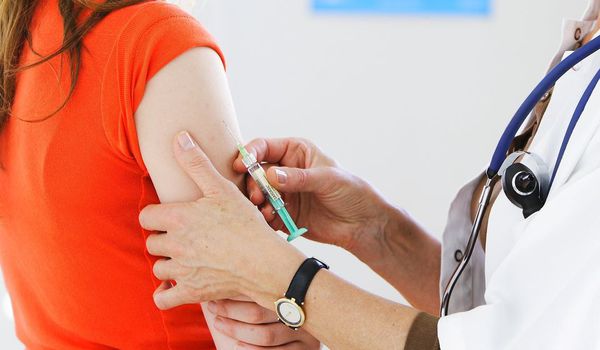
Главным методом первичной профилактики папилломавирусной инфекции считается вакцинация. [11] Современные вакцины разработаны с целью защиты от наиболее опасных, высокоонкогенных штаммов ВПЧ, ответственных за 70-80% случаев развития рака шейки матки. Стандартный курс, состоящий из трёх прививок, даёт вполне надёжную защиту.

Воспаление – нормальный физиологический процесс, в ходе которого организм пытается устранить причину, вызвавшую повреждение тканей и устранить полученные повреждения. В норме после этого процесс воспаления останавливается, но в некоторых случаях развивается хроническое воспаление.
Хроническое воспаление
В случае хронического воспаления процесс воспаления может начаться даже без явного воздействия внешнего повреждающего фактора и может продолжаться в течение длительного времени. Это может происходить под влиянием некоторых микроорганизмов (вирусов, бактерий, грибов и т.д.) или, например, как следствие ненормальной реакции организма на собственные ткани, что приводит к развитию различных аутоиммунных реакций (болезнь Крона, язвенный колит, атрофический гастрит и т.д.).
Под длительным воздействием воспалительных факторов происходит постоянное повреждение тканей на фоне которого возможно появление злокачественных клеток. Некоторые микроорганизмы-возбудители инфекционных болезней могут повышать риск развития рака. Ниже перечислены наиболее изученные из них.
Вирус папилломы человека (ВПЧ, HPV)
ВПЧ - причина развития практически всех случаев рака шейки матки (РШМ). Кроме того, у носителей данной инфекции значимо повышается риск развития других опухолей наружных половых органов, а также рака головы и шеи. Эта инфекция очень широко распространена в человеческой популяции, так, в США ВПЧ ежегодно поражает около 79 млн. человек. В настоящий момент известно более 150 штаммов этого вируса, при этом только около 15 из них являются онкогенными, т.е. способными приводить к развитию злокачественных новообразований.
В мире РШМ является второй по частоте встречаемости опухолью у женщин. Внедрение повсеместного обследования (скрининга), включающего в себя регулярные осмотры гинекологом со взятием цитологических мазков из шейки матки (цервикального канала), а также определение наличия ДНК ВПЧ в крови позволило резко снизить заболеваемость и смертность от РШМ в развитых странах. На сегодняшний день 9 из 10 случаев смерти от РШМ приходится на бедные регионы и страны.
На сегодняшний день не существует способов лечения ВПЧ, однако в клиническую практику уже внедрены вакцины, которые позволяют резко снизить вероятность развития РШМ, защищая человека от наиболее распространенных штаммов HPV. Очень важно, чтобы вакцинация проводилась до момента первого контакта человека с возбудителем этой инфекции, рекомендуется прививать детей в возрасте от 11 до 12 лет.
Вирусные гепатиты С и В (HCV и HBV)
Хроническая инфекция, вызванная этими возбудителями, может приводить к развитию цирроза и рака печени, кроме этого доказана их связь с развитие некоторых лимфом. В настоящее время широко применяются вакцины против вирусного гепатита B, они позволяют эффективно предотвращать заражение и развитие хронической HBV инфекции, снижая тем самым вероятность развития рака печени.
К сожалению, не существует профилактических вакцин против вируса гепатита С. Это обусловлено высокой мутационной изменчивостью этого вируса, что резко затрудняет разработку и создание таких препаратов. Тем не менее, в настоящее время разработаны весьма эффективные противовирусные лекарственные препараты, которые могут подавить размножение или полностью уничтожить вирус в организме.
Вирус иммунодефицита человека (ВИЧ, HIV)
Этот широко известный вирус вызывает развитие СПИД – синдрома приобретенного иммунодефицита. ВИЧ ослабляет иммунную систему организма, делая её неспособной сопротивляться воздействиям различных микроорганизмов (например тех, что перечислены в этом разделе). Люди, инфицированные ВИЧ, характеризируются повышенным риском развития саркомы Капоши, лимфом, РШМ, печени, легких и других опухолей. Вакцины от ВИЧ не существует, но разработаны специальные препараты для противовирусной терапии, которые позволяют подавить размножение этого вируса и значительно продлить жизнь пациентам.
На фоне подавления иммунитета другого происхождения, например у пациентов, получающих длительное лечение иммуносупрессивными препаратами после трансплантации органов или высокими доза глюкокортикостероидов (например, преднизолон, дексаметазон и т.д.) также повышается риск развития множества опухолей.
Вирусы герпеса
К наиболее онкогенным видам этих вирусов относят вирус Эпштейн-Барр (EBV), который повышает риск развития лимфомы и рака желудка, а также носоглотки. Штамм 8 вируса герпеса ассоциирован с развитием саркомы Капоши.
Бактерии и грибы
Helicobacter pylori (HP) – бактерия, которая может колонизировать слизистую оболочку желудка. На фоне вызванной ей инфекции повышается риск развития язвенной болезни желудка и двенадцатиперстной кишки, а также рака желудка. HP инфекция хорошо поддается лечению антибактериальными препаратами.
Кроме того, некоторые грибки (например, Aspergillus flavus и Aspergillus parasiticus) в процессе своей жизнедеятельности вырабатывают афлатоксины – вредные ещества, которые могут загрязнять сельскохозяйственную продукцию. Распространенность этих грибков велика в жарких и влажных странах, афлатоксины могут попадать в пищу в поле, в процессе сбора урожая и во время её хранения. Употребление в пищу афлатоксинов повышает риск развития рака печени.
Паразиты
К наиболее онкогенным паразитам относят Schistosoma hematobium (возбудитель шистосомоза), который может вызывать рак мочевого пузыря и Opisthorchis viverrini (возбудитель описторхоза), на фоне которого повышается риск развития рака желчевыводящих путей (холингиокарциномы).
Следует помнить, что отсутствие симптомов инфекции не означает отсутствия самой инфекции.
Состоялась встреча группы взаимопомощи Красноярского РО "Здравствуй!"
Прошёл мастер-класс для онкопациентов Кемеровского-Кузбасс РО Ассоциации "Здравствуй" по изготовлению "Воздушного зефира" в преддверии праздника Пасхи
Общая информация
Данная патология относится к неходжкинским лимфомам. Женщины болеют несколько чаще мужчин. В большинстве случаев болезнь развивается после 50-60 лет. Обычно процесс протекает локализовано (один очаг) в антральном отделе желудка (реже поражается тело или кардия). Чаще болезнь диагностируется на начальных стадиях (около 70%).
Причины malt-лимфомы желудка
Malt лимфома появляется вследствие длительного хронического воспаления, протекающего в желудке. В ответ на постоянное присутствие инфекционных агентов происходит пролиферация экстранодальной лимфатической ткани, расположенной в слизистых оболочках пищеварительного тракта. Повышается продукция В-лимфоцитов, которые затем подвергаются множественным мутациям. В результате генных поломок клетки приобретают атипичные свойства, начинается рост опухоли.
Более 90% всех malt лимфом возникает из-за негативного влияния хеликобактер пилори. В остальных случаях заболевание развивается из-за систематического действия других инфекционных или иных агентов на слизистую желудка.
Симптомы
На начальном этапе клиническая картина при лимфомах желудка отсутствует или соответствует таковой при хроническом гастрите или язвенной болезни. Преимущественно наблюдаются диспепсические расстройства (изжога, отрыжка, тошнота, рвота, иногда с прожилками крови) и периодические болезненные ощущения в эпигастрии, ноющего характера, не зависящие от приёма еды.
Классификация
Среди всех неходжкинских первичных лимфом, возникающих в желудке, наиболее часто регистрируются именно malt лимфомы. Их классификация была разработана специальной группой исследователей и врачей. Выделяют следующие стадии болезни:
- I стадия — патология ограничена желудком:
- 1 — опухоль в пределах слизистого или с проникновением в подслизистый слой;
- 2 — лимфома поражает мышечный, субсерозный и/или наружный слой;
- 1 — поражены парагастральные лимфатические узлы;
- 2 — вторичные очаги роста лимфомы есть в отдалённых лимфоузлах;
- Е — проникновение опухоли в окружающие органы и структуры;
Последние две стадии были объединены, так как предполагают одинаковый прогноз. Также malt лимфомы различаются по степени злокачественности и своей агрессивности.
![]()
Диагностика
Диагностические мероприятия начинаются со стандартного опроса и осмотра пациента. При диагностике malt-лимфомы основное значение имеет эндоскопическое исследование с забором гистологического материала из разных участков желудка. Полученный биоптат изучают, с помощью следующих методов:
- морфологическая оценка;
- иммуногистохимический анализ;
- молекулярно-генетическое исследование методом FISH или ПЦР.
Наличие активной инфекции Helicobacter pylori обязательно подтверждается с помощью иммуногистохимического, серологического, антигенового калового или уреазного дыхательного тестов.
Кроме того, в комплекс обследований при лимфоме желудка входят:
- анализ крови с определением общих и биохимических параметров (лейкоцитарная формула, b2-микроглобулин, лактадегидрогеназа и т.д.)
- рентгеноскопия ЖКТ;
- эндоскопическое УЗИ желудка и близлежащих лимфоузлов;
- КТ брюшной полости, малого таза и лёгких;
- забор аспирационного материала из костного мозга.
Особую сложность для врача представляет дифференциальная диагностика malt-лимфом желудка с другими лимфомами. Также иногда бывает трудно отличить данную злокачественную опухоль от хронических заболеваний органа, так как новообразование часто возникает на фоне язвенной болезни или гастрита.
Нередко при гастроскопии лимфомы выглядят, как язвы слизистой или участки гиперплазировнной ткани. Поэтому так важно всегда делать забор гистологического материала из нескольких точек (не менее 6-8) для правильной постановки диагноза пациенту.
Лечение malt-лимфомы желудка
Так как лимфома желудка маргинальной зоны примерно в 90% ассоциирована с инфицированием хеликобактер пилори, лечение начинают с антибактериальной терапии, направленной на устранение данного возбудителя. Даже у тех пациентов, у которых причиной болезни послужили другие инфекции, иногда наблюдается положительный эффект от приёма препаратов против хеликобактера.
Многие клинические исследования, проводимые по поводу лимфом желудка, доказали результативность эрадикационного лечения у 80% больных с первой стадией и подтверждённым заражением хеликобактер пилори. При второй стадии заболевания антибактериальная терапия была успешной у 40% пациентов. Таким образом, лечением 1 линии при лимфоме желудка маргинальной зоны является именно данный метод.
После полного курса эрадикационной терапии, через 1 год проводится комплексное обследование больного с оценкой эффективности проведенного лечения. Обязательно проводится эндоскопическое исследование желудка с биопсией. При подтверждении резистентности (устойчивости) микроорганизмов к проводимому лечению, назначают вторую линию терапии — облучение.
Лимфома маргинальной зоны очень чувствительна к лучевому воздействию. Для достижения лечебного эффекта назначают суммарную общую дозу от 30 до 35 Гр. Важным моментом является то, что ионизирующее излучение должно воздействовать только на желудок и парагастральные лимфоузлы. Для того чтобы уберечь соседние органы (печень, поджелудочная железа, почки) используют высокоточное облучение, либо снижают общую нагрузку до 25 Гр.
![]()
Если пациент с лимфомой желудка маргинальной области не ответил на антибактериальное лечение и лучевую терапию и при диссеминированных процессах, назначают химиопрепараты. К применяемым медикаментам относят:
- химерное моноклональное антитело к CD-20 рецепторам В-лимфоцитов (ритуксимаб);
- антрациклин-содержащие схемы;
- пуриновые аналоги нуклеозидов (кладрибин, флударабин);
- схемы с митоксантроном и преднизолоном;
- алкилирующие средства, применяемые при неходжкинских лимфомах (хлорамбуцил, циклофосфан).
Для каждого больного с лимфомой желудка подбирается своя схема терапии. По показаниям возможно проведение хирургического вмешательства, которое является методом выбора для лечения данной патологии. Чаще проводится резекция желудка.
Ещё несколько лет назад операция считалась приоритетным направлением для устранения желудочных лимфом маргинальной зоны. Однако высокая вероятность послеоперационных осложнений и летального исхода ограничивают возможность проведения хирургических вмешательств.
Процесс восстановления после лечения
После антибактериального курса, химиотерапии или облучения по поводу лимфомы, как правило, пациенты восстанавливаются быстро, если следуют всем рекомендациям врача и придерживаются правил здорового образа жизни. Если была проведена операция, все врачебные предписания выполняются в обязательном порядке. В послеоперационном периоде нельзя нарушать диету, поднимать тяжести, нервничать, заниматься физическим трудом и т.д.
Диета
Метастазирование
Лимфома желудка маргинальной зоны редко даёт отдалённые метастазы. Наиболее часто наблюдаются метастатические отсевы в регионарные лимфатические узлы. Значительно реже процесс распространяется на далеко расположенные лимфоузлы.
При выходе опухоли за серозную оболочку желудка могут поражаться рядом расположенные ткани и органы. Чаще лимфома метастазирует в печень, поджелудочную железу и почки. Нередко у пациентов с 4 стадией процесса наблюдается поражение костного мозга.
Осложнения и рецидив
После лечения лимфомы желудка риск возникновения осложнений и рецидива будет зависеть от того, какие именно методы применялись. После длительного приёма антибиотиков может появиться резистентность к лекарствам, аллергические реакции, дисбактериоз кишечника, интоксикация всего организма или отдельных органов. При использовании химиопрепаратов токсическое поражение будет в несколько раз сильнее с учётом применяемых схем и доз. Может наблюдаться снижение количества клеток крови, угнетение иммунитета, поражение периферических нервов и т. д.
Если во время облучения желудка воздействию лучей подверглись соседние органы и ткани, будут наблюдаться типичные постлучевые осложнения. После операции возможно появление ранних и поздних нежелательных последствий. В послеоперационном периоде не исключены:
- кровотечение;
- инфицирование швов;
- несостоятельность культи желудка;
- шоковое состояние;
- перитонит;
- тромбоэмболия;
- пневмония;
- инфаркт миокарда и прочие осложнения, связанные с вмешательством по поводу лимфомы или наркозом.
При обращении в профильную клинику, где используется современное оборудование и работают квалифицированные врачи, риск осложнений и рецидива лимфомы желудка значительно снижается.
Прогноз
В большинстве случаев при грамотном лечении лимфома желудка имеет благоприятный прогноз. При диссеминированной стадии процесса перспектива резко ухудшается, однако помощь пациенту можно оказать при любом диагнозе.
Профилактика
Предупреждение появления и роста злокачественных опухолей, в том числе лимфом желудка, является приоритетным направлением для врачей всех специальностей. Если человек ведёт здоровый образ жизни, не контактирует с канцерогенными факторами и не допускает стрессовых ситуаций, риск появления атипичных клеток в организме значительно снижается. Так как лимфома желудка связана с инфекцией хеликобактер пилори, основой профилактики будет раннее выявление и избавление от данного возбудителя.
![]()
Рак — это злокачественная опухоль, при которой происходит бесконтрольное размножение клеток, сопровождающееся инвазией в подлежащие ткани и метастазированием в отдаленные органы с током лимфы и/или крови. В народе раком называют любую злокачественную опухоль, но ученые сюда относят только карциномы — опухоли, произрастающие из эпителиальных тканей. Злокачественные новообразования из других тканей называют саркомами, злокачественные новообразования лимфатической системы называют лимфомами, а кроветворной — лейкозами.
Зачастую онкология воспринимается пациентами, как смертный приговор. Однако в реальности далеко не все злокачественные опухоли приводят к гибели человека. Более половины всех пациентов благополучно излечиваются и люди забывают о перенесенном заболевании навсегда.
Несмотря на значительные успехи в лечении онкологии, все же данная патология характеризуется достаточно высоким уровнем летальности и, безусловно, для успешного лечения требует к себе самого пристального внимания со стороны высококвалифицированных докторов.
Механизм возникновения рака
В основе онкологического заболевания лежит нарушение процессов регуляции тканевого роста.
Клетки нашего организма постоянно обновляются. В процессе их деления всегда существует вероятность возникновения ошибок в генах (мутации). Это происходит и в норме, но их частота значительно возрастает при воздействии на организм таких неблагоприятных факторов, как канцерогенные вещества, ионизирующее излучение и др.
![]()
![]()
Злокачественные опухоли характеризуются тремя ключевыми отличиями от доброкачественных:
- Неконтролируемый бесконечный рост.
- Прорастание (инвазия) в соседние ткани и органы с нарушением их функционирования.
- Способность к метастазированию — процессу миграции раковых клеток с током крови или лимфы в другие части тела
Именно данные характеристики определяют агрессивность процесса и его злокачественность.
Опухоль может состоять из плотной ткани и тогда говорят о солидном образовании. Однако она может иметь и жидкую консистенцию, как при лейкозах и лимфомах.
Трудности в лечении рака
Онкологическое заболевание может возникнуть у любого живого организма в любом возрасте. Однако данный риск увеличивается с возрастом. Считается, что более 64% случаев заболевания выявляются у людей старше 65 лет. Тем не менее, в настоящее время онкологи говорят об омоложении таких пациентов. Все чаще болезнь диагностируется в возрасте до 40 лет.
Существуют две основные проблемы в лечении данной патологии:
- Распространенность опухолевого процесса, что ограничивает возможности радикального хирургического лечения.
- Гетерогенность клеточного состава опухоли. Можно подобрать препараты, которые убьют 99% опухолевых клеток, но если хотя бы несколько из них уцелеют, то они снова будут делиться, и разовьется рецидив
заболевания.
![]()
Причины появления рака
Причины онкологических заболеваний очень разнообразны, но все они приводят
к тому, что в клетках организма возникает мутация, которая приводит к их
бесконтрольному размножению. Спровоцировать образование и размножение
таких клеток могут следующие факторы:Неправильное питание
Оно является одной из главных причин возникновения рака. И здесь есть несколько аспектов. Во-первых, во многих продуктах, которые люди употребляют ежедневно, содержится определенное количество пищевых канцерогенов. К таким продуктам относят копчености, маринады и другие консервированные и жареные блюда, овощи и фрукты, выращенные с применением химических удобрений и пестицидов и др. Во-вторых, имеет значение сбалансированность питания. Например, есть данные, что избыток мяса в рационе приводит к увеличению риска развития колоректального рака, в то же время большое количество растительных волокон и клетчатки снижает эти риски. Несбалансированное питание может привести к развитию ожирения, которое является фактором риска таких злокачественных новообразований как рак поджелудочной железы.
Старение
В подавляющем большинстве случаев злокачественные опухоли возникают у людей старше 50 лет. Это связывают с накоплением действия факторов риска и ослаблением механизмов защиты и уничтожения мутировавших клеток.
Наследственность
Когда говорят о наследственных причинах онкологии, имеют ввиду два аспекта — генетическую предрасположенность и наследственные формы злокачественных новообразований. В целом вероятность заболеть той или иной формой рака в течение жизни составляет 5-10%. Однако при наличии в семье случаев злокачественных новообразований, эта вероятность увеличивается более, чем в два раза. Это называется генетической предрасположенностью. Помимо этого, есть наследственные формы рака, при которых имеются мутации в определенных генах. В качестве примера можно привести мутации в генах BRCA, при наличии которых вероятность развития рака молочной железы или яичников составляет около 80%.
Вирусы
Вирус папилломы человека высокого онкогенного риска вызывает рак шейки матки. Вирусы гепатитов В и С увеличивают вероятность возникновения рака печени. Инфицирование вирусом Эпштейна-Барр может привести к развитию лимфомы, а Т-лимфотропный вирус может вызвать развитие лейкоза.
Вредные привычки и химическая зависимость
Курение, злоупотребление алкоголем и наркомания также являются серьезными причинами развития рака. Например, каждый пятый случай развития злокачественного новообразования связывают именно с курением. Причем речь идет не только о раке легких. Табачный дым увеличивает риск развития рака ЛОР-органов и органов пищеварительной системы, то же касается и алкоголя. Наркомания приводит к серьезным нарушениям обмена веществ и работы всех систем организма, в том числе и иммунной. На этом фоне развиваются неоплазии, характерные для иммунодефицитов — лимфомы, лейкозы, саркомы.
Ионизирующее излучение
Когда говорят об ионизирующем излучении как о причине развития онкологии на постсоветском пространстве, большинство людей имеет ввиду катастрофу на ЧАЭС. И с этим сложно спорить, поскольку после взрыва отмечалось увеличение случаев развития злокачественных неоплазий, в том числе лейкозов, лимфом и рака щитовидной железы. Однако, помимо этого, нельзя забывать об опасности воздействия солнечного излучения, которое может неблагоприятно воздействовать на кожу и органы зрения. Также увеличивает риск развития вторичных раковых опухолей прохождение лучевой терапии.
Предраковые заболевания
Некоторые виды рака развиваются на фоне имеющейся патологии. Например, колоректальный рак в большинстве случае происходит из аденоматозных кишечных полипов, рак эндометрия может происходить на фоне миом или эндометриоза, раку кожи могут предшествовать пигментный кератоз, лейкоплакия или кожный рог, раку легкого — некоторые профессиональные заболевания легких, раку шейки матки — воспалительные и диспластические процессы. Поэтому важно регулярно проходить скрининговое обследование для своевременного выявления предраковых заболеваний и их лечения.
Неблагоприятная экологическая обстановка и воздействие промышленных и химических канцерогенов
Наиболее агрессивные канцерогены — это асбест, сажа, выхлопные газы автомобилей, некоторые виды продуктов переработки нефти.
Читайте также: