Хроническая внутриматочная инфекция что это такое
Обновлено: 24.04.2024
В настоящее время накоплено достаточное количество убедительных данных о роли инфекционных процессов репродуктивного тракта в развитии акушерских осложнений [1, 2]. Инфекционные агенты могут стать причиной формирования плацентарной недостаточности, невынашивания беременности, патологии плода и новорожденного вследствие развития локального или системного воспалительного ответа [3, 4]. Инфекционный процесс, выступая триггером, запускает цепочку иммунопатохимических реакций или участвует в поддержании ранее индуцированных патофизиологических изменений, внося свой вклад в генез больших акушерских синдромов [5].
Большинство современных публикаций посвящено в основном изучению инфекционной патологии нижнего отдела репродуктивного тракта, а именно дисбиотическим и воспалительным процессам влагалища и шейки матки. Повышенный интерес к изучению нарушений микробиоценоза влагалища у беременных женщин связан, прежде всего, с появлением в последние годы новых диагностических возможностей, а также с накопленной доказательной базой влияния дисбиотических процессов на исходы гестации. Так, у женщин с невынашиванием беременности установлены выраженные нарушения микробиоценоза влагалища, включая различия в видовом составе лактобацилл, по сравнению со здоровыми [6, 7].
Самой обсуждаемой формой генитальной инфекции у беременных женщин остается бактериальный вагиноз, роль которого рассматривается в развитии таких осложнений, как интраамниальная инфекция, преждевременный разрыв плодных оболочек (ПРПО), преждевременные роды [8, 9]. В меньшей степени представлены сведения о воспалительном процессе шейки матки у беременных женщин. Однако есть исследования, в которых цервицит выступает, как одна из самых часто встречающихся форм генитальной инфекции у женщин с осложненным течением беременности [10]. При этом в развитии инфекционного процесса в репродуктивном тракте женщин подтверждена роль практически всех микроорганизмов, тропных к его эпителию.
В последнее время в срезе большого круга акушерских и перинатальных осложнений все чаще обсуждается роль внутриматочной инфекции (ВМИ) у беременных [11–14]. До настоящего времени отсутствует общепринятая терминология для обозначения данного осложнения. Romero R. et al. (2019) определяют ВМИ, как наличие в матке у беременных женщин инфекционно-воспалительного процесса. Данный процесс может быть локализован между материнскими тканями и фетальными оболочками, непосредственно в плодовых оболочках, в плаценте, в амниотической жидкости, в пределах пуповины. Также возможно поражение плода с развитием внутриутробной инфекции [11]. Но термины ВМИ и внутриутробная инфекция не эквивалентны, так как наличие инфекции у матери не всегда приводит к инфицированию плода. В большинстве случаев инфекционный процесс ограничивается поражением плаценты с развитием в ней компенсаторно-приспособительных реакций [15]. Таким образом, ВМИ можно рассматривать, как спектр инфекционно-воспалительных процессов в различных структурах последа.
Что такое цервицит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Батаршиной О. И., гинеколога со стажем в 18 лет.
Над статьей доктора Батаршиной О. И. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Цервицит — это воспалительное заболевание шейки матки, которое развивается под влиянием различных агентов (как инфекционных, так и неинфекционных) [2] .
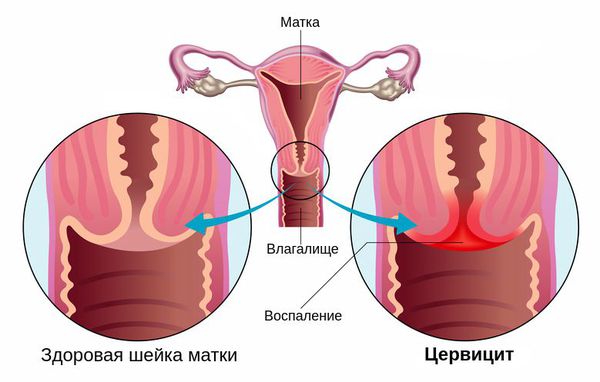
Распространённость цервицита у женщин достигает 10-45 %. Наиболее часто его вызывают возбудители, передаваемые половым путём, такие как гонокок, хламидия, трихомонада, вирус герпеса, бледная трепонема и др. [7] [8] [11] . Также причиной возникновения цервицита являются различные заболевания, аллергические реакции на противозачаточные спермициды, латекс в составе презервативов или продукты женской гигиены, такие как мыла, гели для душа или дезодоранты.
Длительный и вялотекущий дисбиоз влагалища (бактериальный вагиноз) также рассматривается как одна из возможных причин цервицита, поскольку на фоне изменения уровня кислотности влагалища меняется и соотношение видов влагалищной микрофлоры.
В зоне риска по возникновению цервицита находятся женщины, которые:
Также доказано, что фоном для развития воспаления шейки матки и его хронизации является местный иммунодефицит, связанный с нарушением защитной функции слизистой оболочки.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы цервицита
Возможно как симптомное, так и бессимптомное течение заболевания [31] .
При бессимптомном процессе диагноз "цервицит" может быть поставлен:
- при неудовлетворительных результатах мазков — повышенном уровне лейкоцитов (клеток крови, отвечающих за иммунный ответ на внедрение инфекционных агентов);
- на основан ии визуального осмотра шейки матки врачом-гинекологом — покраснения и отёка шейки матки.
При симптомном течении заболевания женщину могут беспокоить:
- сероватые или бледно-жёлтые выделения из влагалища;
- аномальные кровянистые выделения во время или после полового контакта, а также в перерывах между менструациями [31] ;
- боль во время секса;
- затруднённое, болезненное или частое мочеиспускание;
- тазовая боль или, в редких случаях, лихорадка.
Патогенез цервицита
Когда речь идет о патогенезе цервицита, прежде всего необходимо обозначить понятия, о которых пойдёт речь.
Шейка матки представляет собой гладкомышечный орган длиной 2-3 см, образованный соединительной тканью. Основная функция данной части матки — барьерная. Она реализуется за счёт секрета (выделений) слизистой , которая препятствует попаданию патогенных возбудителей в матку, маточные трубы и малый таз. В состав секрета входят как иммуноглобулины всех классов ( IgG, IgM, IgA и др. ), так и вещества, обладающие высокой расщепляющей и бактерицидной активностью.
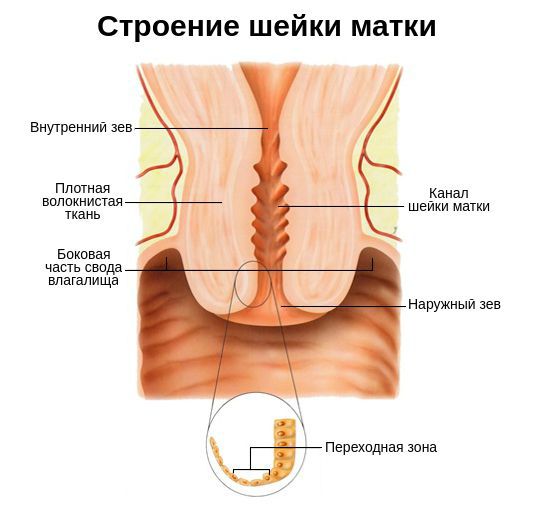
Также шейку матки защищает микрофлора влагалища . Она состоит из анаэробных и аэробных бактерий, причём первых в десять раз больше, чем вторых. Такое соотношение создаёт определённый уровень кислотности слизистой, который не позволяет патогенным микроорганизмам внедряться в полость матки [8] .
Циклическое воздействие половых гормонов на женский организм позволяет сохранять микрофлору влагалища в норме, тем самым защищать шейку матки:
- в первой фазе менструального цикла под воздействием эстрогенов синтезируется гликоген, стимулируется выработка слизистого секрета, выполняющего барьерную функцию [4][17][27] ;
- во второй фазе цикла под воздействием прогестерона происходит подкисление среды влагалища и размножение лактобактерий.
При снижении барьерных свойств микрофлоры влагалища и слизистой шейки матки в организм женщины проникают различные патогенные возбудители, которые приводят к развитию цервицита. Их активному проникновению и распространению в полости малого таза способствуют сперматозоиды в качестве клеток-переносчиков инфекционных агентов, а также трихомонады и установка внутриматочной спирали на фоне воспалительного процесса.
Острый цервицит
Чаще возникает при поражении шейки матки специфическими возбудителями (например, гонококком), а также после искусственного прерывания беременности, в осложнённом послеродовом периоде (возбудителями чаще становятся стафилококковая и стрептококковая инфекции) и при вирусном поражении шейки матки. На ранней стадии заболевания возникают:
- полнокровие сосудов;
- повышение уровня лейкоцитов (лейкоцитарная инфильтрация);
- просачивание крови сквозь стенки сосудов в зону воспаления (экссудация);
- дистрофические изменения с вакуолизацией цитоплазмы и ядер клеток.
В результате дистрофических изменений клеток на поверхности слизистой оболочки шейки матки появляется гнойный и серозно-гнойный экссудат — сероватые или бледно-жёлтые выделения.
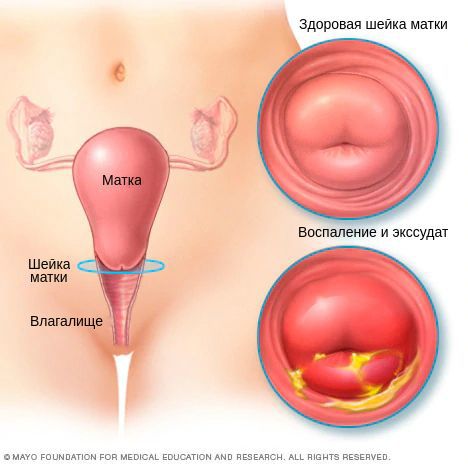
Хронический цервицит
При проникновении возбудителей в межклеточное пространство крипт шейки матки (небольших трубчатых углублений), труднодоступных для лечения, возникает хронический цервицит. Причиной хронизации заболевания нередко является поражение шейки матки хламидийной инфекцией. В 24-40 % случаев хронический цервицит возникает на фоне длительного и вялотекущего бактериального вагиноза. При осмотре гинекологом шейка матки выглядит покрасневшей, отёчной, легко травмируется. Микроскопически наблюдается инфильтрация подэпителиальной ткани лимфоцитами, плазмоцитами, полнокровие сосудов. Наряду с дистрофическими процессами в ткани преобладают процессы непрямого деления клеток, разрастания ткани и замещения одного вида клеток другим. Часто при хроническом цервиците нарушаются процессы ороговения клеток, что проявляется уплотнением тканей и изменением процесса гликогенизации клеток [6] [11] .
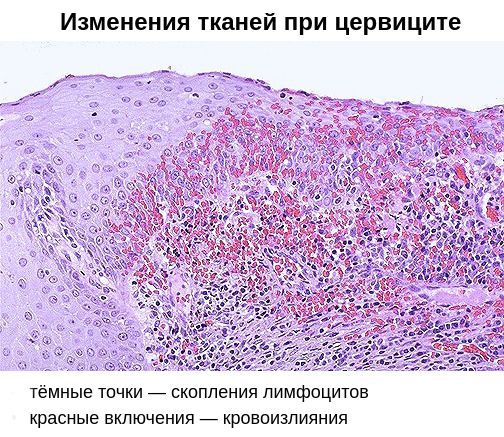
Помимо специфического возбудителя, немалую роль в возникновении хронического цервицита играет вторичный иммунодефицит. Он заключается в неполноценности клеточного и гуморального иммунитета. На клеточном уровне снижается количество Т- и В-лимфоцитов, а также нарушается фагоцитарная активности клеток, позволяющая им поглощать и переваривать патогенные микроорганизмы. В результате возбудители остаются в организме, снижается содержание антител IgG и IgM, увеличивается выработка антител IgA, что ведёт к изменению качества цервикальной слизи.
Послеродовой цервицит
Отдельно такую форму не выделяют, цервицит после родов ничем не отличается от обычного. Разница может быть лишь в лечении: не все антибиотики можно принимать при грудном вскармливании.
Классификация и стадии развития цервицита
Классификация цервицита зависит от типа возбудителей, локализации и давности патологических процессов. Так, в зависимости от типа возбудителя цервициты подразделяют на инфекционные и неинфекционные. Инфекционные цервициты бывают:
- гонококковыми;
- хламидийными;
- трихомонадными;
- кандидозными;
- вирусными.
Неинфекционные цервициты рассматриваются и классифицируется в зависимости от причины, вызвавшей воспаление. Они бывают аллергическими, атрофическими (сенильными) и др. [8] .
Кроме того, по локализации цервицит подразделяют на:
- экзоцервицит — протекает преимущественно на поверхности шейки матки;
- эндоцервицит — в основном затрагивает эпителий канала шейки матки (цервикальный канал).
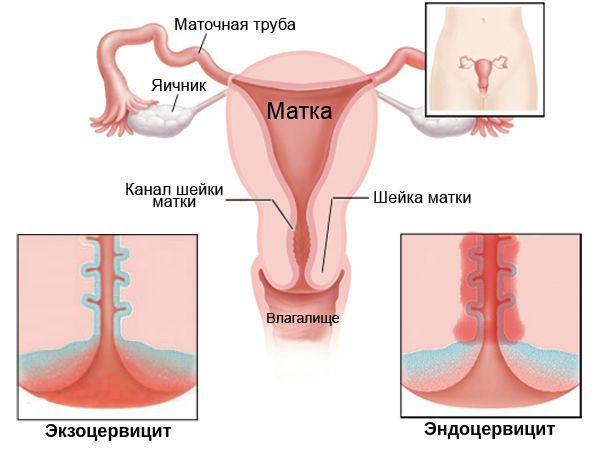
По длительности протекания процесса цервицит может быть:
- острым — процесс воспаления длится не более шести недель;
- хроническим — болезнь протекает с периодическими ремиссиями и обострениями.
Осложнения цервицита
Выявление причины цервицита имеет важное значение, поскольку при наличии инфекционного агента возбудитель способен распространяться за пределы шейк и матки и вызывать эндометрит , а также воспаление в теле матки, маточных трубах и малом тазе. В ряде случаев это приводит к бесплодию или препятствует вынашиванию плода [25] [27] .
Цервицит и беременность
Если беременность возникла на фоне цервицита, возбудитель заболевания может привести к преждевременному прерыванию беременности в связи с проникновением инфекции в водную оболочку, обращённую к плоду, затем в хорион (плаценту), околоплодные воды и сам плод.
При инфицировании ребёнка на ранних сроках беременности могут сформироваться врождённые пороки развития, возникает риск первичной плацентарной недостаточности и внутриутробной гибели плода. При позднем инфицировании наблюдаются следующие осложнения беременности:
- внутриутробная задержка развития плода;
- вторичная плацентарная недостаточность (часто на фоне плацентита — воспаления плаценты);
- локальные и генерализованные (распространённые) инфекционные поражения плода.
Генерализованные формы внутриутробной инфекции чаще развиваются в первом триместре беременности, так как плод ещё не может препятствовать распространению воспалительного процесса. В третьем триместре воспалительные изменения вызывают сужение или обтурацию (закрытие просвета) каналов и отверстий, что ведёт к аномальному развитию уже сформировавшегося органа — псевдоуродствам ( гидроцефалии , гидронефрозу и др.) [29] .
Длительное воспаление шейки матки становится фоном для развития злокачественных процессов . Это связано с нарушением регенерации слизистой оболочки шейки матки, которое наблюдается при хроническом цервиците. Наиболее значимыми факторами, влияющими на регенерацию, являются вирусы и хламидии [10] . Учёные доказали, что формирование рака шейки матки происходит только на фоне сохранившейся в криптах вирусной инфекции, которая активируется более чем через год после первичного обнаружения возбудителя [30] .
Диагностика цервицита
Диагностическими критериями цервицита при осмотре в зеркалах являются:
- покраснение слизистой, отёк;
- обильные выделения грязно-серого или зеленоватого цвета;
- творожистое отделяемое (при грибковом поражении шейки матки и влагалища).
При микроскопическом исследовании наблюдается увеличение количества лейкоцитов, также можно обнаружить возбудителей трихомониаза и гонореи.
Однозначными признаками цервицита при вульвоцервикоскопии служат:
- фолликулярный кольпит, "лунный ландшафт" — для хламидиоза;
- очаговый кольпит — для трихомониаза;
- диффузный кольпит — для неспецифической бактериальной инфекции;
- симптом "манной крупы" — для герпетической инфекции [17] .
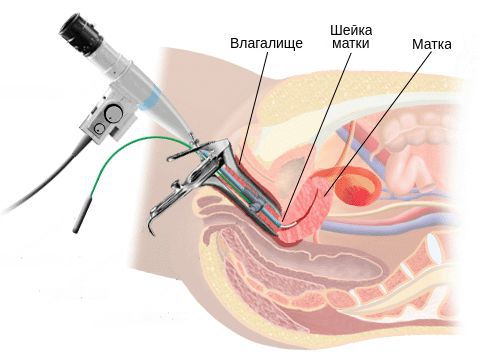
Бактериологическое исследование с поверхности шейки матки и заднего свода влагалища позволяет оценить не только соотношение лактофлоры, создающей нормальную кислотность влагалища, но и выявить рост условно-патогенных возбудител ей, таких как кишечные палочки, стрептококки, стафилококки, анаэробные кокки и др. Причём клинически значимым является рост микроорганизмов в колич естве более чем 10 4 КОЕ/мл.
ПЦР-диагностика позволяет обнаружить специфических возбудителей, вызвавших воспалительный процесс, таких как микоплаз мы, уреаплазмы, гарднереллы, хламидии, вирус герпеса и др. [31] . Для этого исследования врач-гинеколог должен взять мазок из шейки матки.
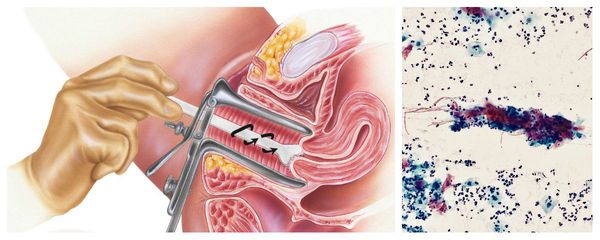
Цитологическое исследование клеточного материала позволяет оценить структуру клеток, характер и уровень их повреждения, а также эффективность лечения в динамике. При длительно текущем воспалении шейки матки в цитограмме преобладают гистиоциты, плазмациты, фибробласты и лимфоидные элементы. При продуктивном воспалении (защитной реакции организма) преобладают клеточные инфильтраты — макрофагальные, г игантоклеточные, плазмоклеточные, лимфоцитарно-моноцитарные. В 40 % случаев цитологическая диагностика позволяет выявить возбудителя заболевания (хламидии, кандиды, трихомонады, цитомегаловирус), более чем в 50 % случаев диагностируется папилломавирус и вирус простого герпеса.
При ультразвуковом исследовании признаками эндоцервицита являются увеличение толщины М-эхо шейки матки более 4 мм и реактивный отёк подэпителиальных о тделов УЗИ. рекомендуется выполнять на 5-7 день менструального цикла.
Следует помнить, что обследование гинекологом и взятие мазков проводятся перед началом менструации или через несколько дней после её окончания: оптимальный срок — пятый день, когда нет мажущих кровянистых выделений. Накануне и в день процедуры не следует использовать вагинальные свечи, тампоны, мази, средства интимной гигиены, поскольку это может стать причиной получения недостоверных данных. Кроме того, необходимо отказаться от спринцевания и воздержаться от половых контактов в течение одного-двух дней до сдачи анализа.
Лечение цервицита
Препараты для лечения цервицита
Определяющим звеном при выборе тактики лечения является природа возбудителя цервицита: вирусные воспаления шейки матки предполагают использование противовирусных препаратов, бактериальные воспаления — приём антибактериальных средств. При этом важно учитывать чувствительность выявленных инфекционных агентов к антибиотикам [1] [2] [3] .
Главной проблемой лечения цервицита шейки матки являются наличие нескольких возбудителей (микст-инфекции) и устойчивость возбудителей к антибактериальным препаратам. В таких случаях необходимо прибегнуть к приёму комбинации антибиотиков. Конкретные препараты назначает врач.
Иногда антибиотикотерапия сопровождается назначением фитопрепаратов, биологически активных добавок. Также рекомендуются общеукрепляющие физические нагрузки, нормализация режима труда и отдыха [9] [24] .
Помимо лечения пациентки параллельно в обязательном порядке проводится лечение её полового партнёра. Во время терапии необходимо пользоваться барьерной контрацепцией.
Нормали зация микробиоценоза влагалища с помощью пробиотиков [15] в сочетании с иммунокоррекцией (с учётом данных иммунограммы) [5] [16] [19] также целесообразны, поскольку изменённый уровень кислотности среды и возникающий дефицит иммунных факторов способствуют частым рецидивам воспалительного процесса [40] [43] [44] .
Физиотерапия
Кроме того, в ряде случаев назначается физиолечение:
- ДМВ-терапия — лечение дециметровыми волнами частотой от 300 МГц до 3 ГГц, проводится каждый день, предполагает 10-15 процедур продолжительностью 10 минут;
- магнитотерапия — воздействие магнитного поля низкой или высокой частоты, проводится каждый день, предполагает 10-20 процедур продолжительностью 10-20 минут;
- диадинамотерапия — лечение высокочастотным электрическим током, проводится каждый день до появления ощущения болезненной вибрации, предполагает 12-15 процедур;
- СМТ-терапия — лечение низкочастотным электрическим током, проводится каждый день, предполагает 12-15 процедур;
- электрофорез с солями магния — воздействует на область малого таза, проводится каждый день, предполагает 10-15 процедур продолжительностью 20 минут;
- дарсонвализация и лазеротерапия с использованием влагалищных датчиков — проводятся каждый день, предполагает 10-12 процедур [32] .
Деструктивные методы лечения цервицита
Цервицит — это воспалительный процесс, поэтому его лечат медикаментозно. Физические или химические методы применяются при атипии в клетках, покрывающих шейку матки или выстилающих цервикальный канал. Прижигание кислотами, жидким азотом, лазерная вапоризация, аргоноплазменная абляция, электрохирургическая эксцизия для лечения цервицита не используются .
Прогноз. Профилактика
Прогноз заболевания при своевременно начатом лечении благоприятный. При бессимптомном цервиците и отсутствии инфекций, передаваемых половым путём, у пациенток остаётся риск появления выраженных клинических признаков заболевания [30] .
Помимо основного лечения назначаются консультации других специалистов для коррекции различных нарушений (нейроэндокринных, гормональных, иммунных), выявления соматических заболеваний и факторов риска. Это позволит предотвратить повторное развитие цервицита [28] .
С целью профилактики воспаления шейки матки рекомендуется:
- один раз в шесть месяцев посещать гинеколога;
- использовать барьерные средства контрацепции;
- не допускать хронизации заболеваний мочеполовой системы.
Внутриутробные инфекции – группа заболеваний плода и новорожденного, развивающихся вследствие заражения в дородовом периоде или в родах. Внутриутробные инфекции могут приводить к гибели плода, самопроизвольному аборту, задержке внутриутробного развития, преждевременным родам, формированию врожденных пороков, поражению внутренних органов и ЦНС. Методы диагностики внутриутробных инфекций включают микроскопические, культуральные, иммуноферментные, молекулярно-биологические исследования. Лечение внутриутробных инфекций проводится с использованием иммуноглобулинов, иммуномодуляторов, противовирусных, антибактериальных препаратов.

Общие сведения
Внутриутробные инфекции – патологические процессы и заболевания, обусловленные антенатальным и интранатальным инфицированием плода. Истинная распространенность внутриутробных инфекций не установлена, однако, согласно обобщенным данным, с врожденными инфекциями рождается не менее 10% новорожденных. Актуальность проблемы внутриутробных инфекций в педиатрии обусловлена высокими репродуктивными потерями, ранней неонатальной заболеваемостью, приводящей к инвалидизации и постнатальной гибели детей. Вопросы профилактики внутриутробных инфекций лежат в плоскости рассмотрения акушерства и гинекологии, неонатологии, педиатрии.

Причины внутриутробных инфекций
Внутриутробные инфекции развиваются в результате инфицирования плода в дородовом периоде или непосредственно во время родов. Обычно источником внутриутробной инфекции для ребенка выступает мать, т. е. имеет место вертикальный механизм передачи, который в антенатальном периоде реализуется трансплацентарным или восходящим (через инфицированные околоплодные воды) путями, а в интранатальном - аспирационным или контактным путями.
Реже происходит ятрогенное инфицирование плода в период беременности при проведении женщине инвазивной пренатальной диагностики (амниоцентеза, кордоцентеза, биопсии ворсин хориона), введении плоду препаратов крови через сосуды пуповины (плазмы, эритроцитарной массы, иммуноглобулинов) и т. д.
В антенатальном периоде инфицирование плода обычно связано с вирусными агентами (вирусами краснухи, герпеса, цитомегалии, гепатита В и С, Коксаки, ВИЧ) и внутриклеточными возбудителями (токсоплазмоза, микоплазмоза).
В интранатальном периоде чаще происходит микробная контаминация, характер и степень которой зависит от микробного пейзажа родовых путей матери. Среди бактериальных агентов наиболее распространены энтеробактерии, стрептококки группы В, гонококки, синегнойная палочки, протей, клебсиелла и др. Плацентарный барьер непроницаем для большинства бактерий и простейших, однако при повреждении плаценты и развитии фетоплацентарной недостаточности, может произойти антенатальное микробное инфицирование (например, возбудителем сифилиса). Кроме этого, не исключается и интранатальное вирусное заражение.
Факторами возникновения внутриутробных инфекций служат отягощенный акушерско-гинекологический анамнез матери (неспецифические кольпиты, эндоцервициты, ЗППП, сальпингофориты), неблагополучное течение беременности (угроза прерывания, гестозы, преждевременная отслойка плаценты) и инфекционная заболеваемость беременной. Риск развития манифестной формы внутриутробной инфекции существенно выше у недоношенных детей и в том случае, когда женщина инфицируется первично во время беременности.
Известно, что тяжесть проявлений инфекционного процесса у беременной и у плода может не совпадать. Бессимптомное или малосимптомное течение инфекции и у матери может вызвать тяжелые поражения плода, вплоть до его гибели. Это связано с повышенным тропизмом вирусных и микробных возбудителей к эмбриональным тканям, преимущественно ЦНС, сердца, органа зрения.
Классификация
Этиологическая структура внутриутробных инфекций предполагает их деление на:
- вирусные (вирусный гепатит, герпес, краснуха, ОРВИ, цитомегалия, эпидемический паротит, энтеровирусная инфекция)
- бактериальные (туберкулез, сифилис, листериоз, сепсис)
- паразитарные и грибковые (микоплазмоз, токсоплазмоз, хламидиоз, кандидоз и др.)
Для обозначения группы наиболее распространенных внутриутробных инфекций используется аббревиатура TORCH-синдром, объединяющий токсоплазмоз (toxoplasmosis), краснуху (rubella), цитомегалию (cytomegalovirus), герпес (herpes simplex). Буквой О (other) обозначаются другие инфекции, в числе которых - вирусные гепатиты, ВИЧ-инфекция, ветряная оспа, листериоз, микоплазмоз, сифилис, хламидиоз и др.).
Симптомы внутриутробных инфекций
Наличие внутриутробной инфекции у новорожденного может быть заподозрено уже во время родов. В пользу внутриутробного инфицирования может свидетельствовать излитие мутных околоплодных вод, загрязненных меконием и имеющих неприятный запах, состояние плаценты (полнокровие, микротробозы, микронекрозы). Дети с внутриутробной инфекцией часто рождаются в состоянии асфиксии, с пренатальной гипотрофией, увеличенной печенью, пороками развития или стигмами дисэмбриогенеза, микроцефалией, гидроцефалией. С первых дней жизни у них отмечается желтуха, элементы пиодермии, розеолезных или везикулезных высыпаний на коже, лихорадка, судорожный синдром, респиратрные и кардиоваскулярные расстройства.
Ранний неонатальный период при внутриутробных инфекциях нередко отягощается интерстициальной пневмонией, омфалитом, миокардитом или кардитом, анемией, кератоконъюнктивитом, хориоретинитом, геморрагическим синдромом и др. При инструментальном обследовании у новорожденных могут обнаруживаться врожденная катаракта, глаукома, врожденные пороки сердца, кисты и кальцификаты мозга.
В перинатальном периоде у ребенка отмечаются частые и обильные срыгивания, мышечная гипотония, синдром угнетения ЦНС, серый цвет кожных покровов. В поздние сроки при длительном инкубационном периоде внутриутробной инфекции возможно развитие поздних менингитов, энцефалитов, остеомиелита.
Рассмотрим проявления основных внутриутробных инфекций, составляющих TORCH-синдром.
Врождённый токсоплазмоз
Внутриутробное инфицирование одноклеточным протозойным паразитом Toxoplasma Gondii приводит к тяжелым поражениям плода – задержке развития, врожденным порокам развития мозга, глаз, сердца, скелета.
После рождения в остром периоде внутриутробная инфекция проявляется лихорадкой, желтухой, отечным синдромом, экзантемой, геморрагиями, диареей, судорогами, гепатоспленомегалией, миокардитом, нефритом, пневмонией. При подостром течении доминирую признаки менингита или энцефалита. При хронической персистенции развивается гидроцефалия с микроцефалией, иридоциклит, косоглазие, атрофия зрительных нервов. Иногда встречаются моносимптомные и латентные формы внутриутробной инфекции.
К числу поздних осложнений врожденного токсоплазмоза относятся олигофрения, эпилепсия, слепота.
Врождённая краснуха
Внутриутробная инфекция возникает из-за заболевания краснухой при беременности. Вероятность и последствия инфицирования плода зависят от гестационного срока: в первые 8 недель риск достигает 80%; последствиями внутриутробной инфекции могут служить самопроизвольное прерывание беременности, эмбрио- и фетопатии. Во II триместре риск внутриутробного инфицирования составляет 10-20%, в III – 3-8%.
Дети с внутриутробной инфекцией обычно рождаются недоношенными или с низкой массой тела. Для периода новорожденности характерна геморрагическая сыпь, длительная желтуха.
Классические проявления врожденной краснухи представлены триадой Грега: поражением глаз (микрофтальмией, катарактой, глаукомой, хориоретинитом), ВПС (открытым артериальным протоком, ДМПП, ДМЖП, стенозом легочной артерии), поражением слухового нерва (сенсоневральной глухотой). В случае развития внутриутробной инфекции во второй половине беременности у ребенка обычно имеется ретинопатия и глухота.
Кроме основных проявлений врожденной краснухи, у ребенка могут выявляться и другие аномалии: микроцефалия, гидроцефалия, расщелины нёба, гепатит, гепатоспленомегалия, пороки развития мочеполовой системы и скелета. В дальнейшем внутриутробная инфекция напоминает о себе отставанием ребенка в физическом развитии, ЗПР или умственной отсталостью.
Врождённая цитомегалия
Внутриутробное заражение цитомегаловирусной инфекцией может приводить к локальному или генерализованному поражению многих органов, иммунодефициту, гнойно-септическим осложнениям. Врожденные дефекты развития обычно включают микроцефалию, микрогирию, микрофтальмию, ретинопатию, катаракту, ВПС и др. Неонатальный период врожденной цитомегалии осложняется желтухой, геморрагическим синдромом, двусторонней пневмонией, интерстициальным нефритом, анемией.
К отдаленным последствиям внутриутробной инфекции относятся слепота, нейросенсорная глухота, энцефалопатия, цирроз печени, пневмосклероз.
Врождённая герпетическая инфекция
Внутриутробная герпес-инфекция может протекать в генерализованной (50%), неврологической (20%), слизисто-кожной форме (20%).
Генерализованная внутриутробная врожденная герпетическая инфекция протекает с выраженным токсикозом, респираторным дистресс-синдромом, гепатомегалией, желтухой, пневмонией, тромбоцитопенией, геморрагическим синдромом. Неврологическая форма врожденного герпеса клинически проявляется энцефалитом и менингоэнцефалитом. Внутриутробная герпес-инфекция с развитием кожного синдрома сопровождается появлением везикулярной сыпи на кожных покровах и слизистых оболочках, в т. ч. внутренних органов. При наслоении бактериальной инфекции развивается сепсис новорожденных.
Внутриутробная герпес-инфекция у ребенка может приводить к формированию пороков развития - микроцефалии, ретинопатии, гипоплазии конечностей (кортикальной карликовости). В числе поздних осложнений врожденного герпеса - энцефалопатия, глухота, слепота, задержка психомоторного развития.
Диагностика
В настоящее время актуальной задачей является пренатальная диагностика внутриутробных инфекций. С этой целью на ранних сроках беременности проводится микроскопия мазка, бактериологический посев из влагалища на флору, ПЦР-исследование соскоба, обследование на TORCH-комплекс. Беременным из группы высокого риска по развитию внутриутробной инфекции показана инвазивная пренатальная диагностика (аспирация ворсин хориона, амниоцентез с исследованием амниотической жидкости, кордоцентез с исследованием пуповинной крови).
Возможно выявление эхографических маркеров внутриутробных инфекций с помощью акушерского УЗИ. К косвенным эхографическим признакам внутриутробного инфицирования относятся маловодие или многоводие; наличие гиперэхогенной взвеси в околоплодных водах или амниотических тяжей; гипоплазия ворсин хориона, плацентит; преждевременное старение плаценты; отечный синдром плода (асцит, перикардит, плеврит), гепатоспленомегалия, кальцификаты и пороки развития внутренних органов и др. В процессе допплерографического исследования кровотока выявляются нарушения плодово-плацентарного кровотока. Кардиотокография обнаруживает признаки гипоксии плода.
После рождения ребенка с целью достоверной верификации этиологии внутриутробной инфекции используются микробиологические (вирусологические, бактериологические), молекулярно-биологические (ДНК-гибридизация, ПЦР), серологические (ИФА) методики обследования. Важное диагностическое значение имеет гистологическое исследование плаценты.
По показаниям новорожденные с внутриутробными инфекциями в первые сутки жизни должны быть осмотрены детским неврологом, детским кардиологом, детским офтальмологом и др. специалистами. Целесообразно провести ЭхоКГ, нейросонографию, офтальмоскопию, исследование слуха методом вызванной отоакустической эмиссии.
Лечение внутриутробных инфекций
Общие принципы лечения внутриутробных инфекций предполагают проведение иммунотерапии, противовирусной, антибактериальной и посиндромной терапии.
Иммунотерапия включает применение поливалентных и специфических иммуноглобулинов, иммуномодуляторов (интерферонов). Противовирусная терапия направленного действия осуществляется, главным образом, ацикловиром. Для противомикробной терапии бактериальных внутриутробных инфекций используются антибиотики широкого спектра действия (цефалоспорины, аминогликозиды, карбапенемы), при микоплазменной и хламидийной инфекциях – макролиды.
Посиндромная терапия внутриутробных инфекций направлена на купирование отдельных проявлений перинатального поражения ЦНС, геморрагического синдрома, гепатита, миокардита, пневмонии и т. д.
Прогноз и профилактика
При генерализованных формах внутриутробных инфекций летальность в неонатальном периоде достигает 80%. При локальных формах возникают серьезные поражения внутренних органов (кардиомиопатии, ХОБЛ, интерстициальный нефрит, хронический гепатит, цирроз и т. д.). Практически во всех случаях внутриутробные инфекции приводят к поражению ЦНС.
Профилактика внутриутробных инфекций заключается в проведении предгравидарной подготовки, лечении ЗППП до наступления беременности, исключении контактов беременной с инфекционными больными, коррекции программы ведения беременности у женщин групп риска. Женщины, ранее не болевшие краснухой и не получавшие прививки против краснухи, должны быть вакцинированы не позднее, чем за 3 месяца до предполагаемой беременности. В ряде случаев внутриутробные инфекции могут являться основанием для искусственного прерывания беременности.
Что такое синдром Ашермана? Причины возникновения, диагностику и методы лечения разберем в статье доктора Дурасов В. В., гинеколога со стажем в 34 года.
Над статьей доктора Дурасов В. В. работали литературный редактор Вера Васина , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Синдром Ашермана — это заболевание, при котором происходит сращение стенок матки между собой и возникают внутриматочные спайки (синехии).
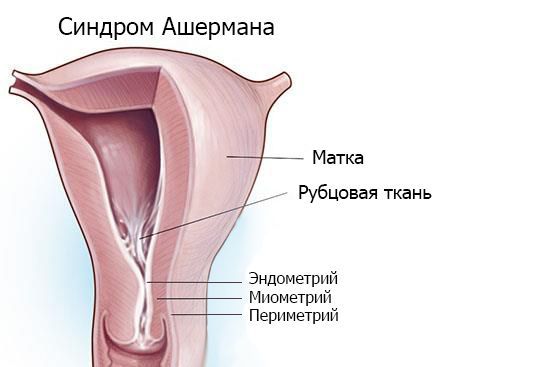
Основная причина патологии — травма эндометрия , особенно на фоне инфекции, которая ведёт к воспалению в полости матки и формированию спаек. Наиболее опасны выскабливания между второй и четвёртой неделей после родов.
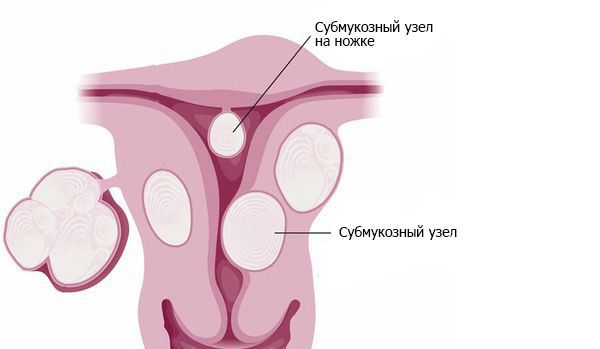
Примерно в 90 % случаев синдром Ашермана возникает в результате постабортных или послеродовых вмешательств [4] . В 40 % случаев спайки образуются п осле повторных выскабливаний при неполном аборте и удалении остатков плацентарной ткани [5] . Нередко сращения возникают после гистероскопических вмешательств по удалению субмукозных узлов — доброкачественных образований в подслизистом слое матки. Удаление сразу нескольких узлов повышает вероятность образования спаек [6] .
Синдром Ашермана иногда встречается после наложения шва Линча (процедура для остановки послеродового кровотечения) и после эмболизации маточных артерий (операции по искусственной закупорке сосудов). К редким причинам относят воспаление половых органов при использовании внутриматочной спирали, генитальном туберкулёзе и шистоматозе (токсико-аллергическом заболевании, вызванном гельминтами).
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы синдрома Ашермана
Как правило, женщины самостоятельно замечают заболевание, когда после медицинского аборта или другой внутриматочной процедуры менструации стали скудными ( гипоменоррея ) или исчезли совсем ( аменорея ) [8] . Вместо них внизу живота возникают схваткообразные интенсивные боли, вызванные затруднением оттока менструальной крови. Эти боли появляются каждый месяц, соответствуя фазе менструального цикла, однако выделений при этом нет. К другим симптомам синдрома относят:
- бесплодие;
- выкидыши;
- нарушение плацентации (врастание плаценты и её предлежание ) [9] ;
При патологии кровь скапливается главным образом не в матке (поскольку там нет свободного пространства из-за сращения), а в маточных трубах. Всасывание менструальной крови может приводить к повышению температуры до субфебрильных величин (чуть больше 37 ° ).
Патогенез синдрома Ашермана
Внутриматочные сращения возникают в ответ на травму или удаление эндометрия противоположных стенок полости матки. После травмы в считаные минуты начинается острое воспаление . Воспалительный процесс активирует комплекс биохимических реакций, похожих на те, которые возникают при кровотечении:
- Тромбоциты прилипают к повреждённой поверхности.
- Местный кровоток усиливается, расширяются мелкие сосуды, по которым течёт артериальная кровь (артериолы).
- Клетки, которые помогают организму бороться с воспалением (нейтрофилы и макрофаги), перемещаются к месту травмы.
- Формируется фибриновая плёнка. Поначалу она тонкая, как паутинка, и располагается в зонах, поверхность которых наиболее повреждена, чаще в месте перехода шейки в тело матки (область внутреннего зева), хотя может покрывать и всю полость матки.
- На третий день после травмы начинают расти клетки, формирующие соединительнотканный рубец, а на пятый в фибриновой плёнке развивается сосудистая сеть, что неотвратимо ведёт к образованию сращений в полости матки [7] .
Таким образом, сращения можно обнаружить на пятый день после вмешательства. Следует отметить, что фибриновая плёнка появляется после травмы у всех пациентов — это защитная реакция организма для ограничения повреждённого участка. У многих женщин к пятому дню плёнка рассасывается, и они выздоравливают, но у части запускается процесс образования спаек.
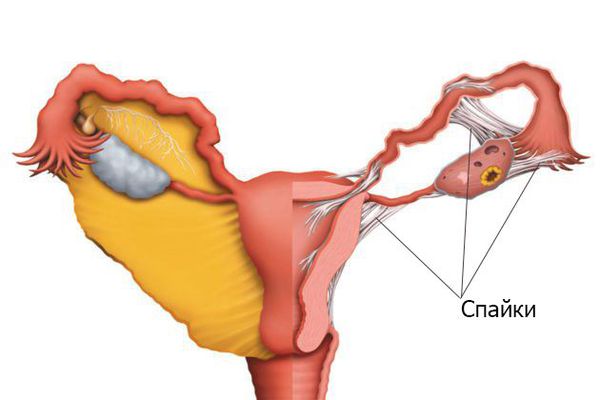
Формирование спаек зависит от степени травмы, состояния иммунной системы, врождённых особенностей и других факторов, многие из которых непонятны до сих пор. Развитию патологии способствуют:
- наличие сгустков крови или остатков плодного яйца в полости матки, что является хорошей питательной средой для микробов;
- заболевания, передающиеся преимущественно половым путём;
- ослабленный иммунитет;
- перенесённое в прошлом вмешательство на шейке матки, ухудшившее её барьерную функцию и другие факторы.
Классификация и стадии развития синдрома Ашермана
Существует несколько классификаций синдрома Ашермана. Одна из самых простых и удобных — классификация по March (2011), который разделял внутриматочные сращения на 3 группы:
- Умеренные — нежные и тонкие спайки, которые занимают менее 25 % полости матки. Устья маточных труб и дно матки свободны или минимально вовлечены.
- Средние — спайками покрыто от 25 до 75 % полости матки, устья маточных труб и дно частично заращены;
- Выраженные — дно и устья маточных труб полностью заращены, спайками покрыто более 75 % полости матки [10] .
Степени развития заболевания более подробно рассмотрены в классификации European Society of Gynecological Endoscopy (1995) [11] .
| Степень | Распространённость внутриматочных спаек |
|---|---|
| 1 | - тонкие и/или плоскостные спайки в устьях маточных труб, которые легко разрушаются тубусом гистероскопа; |
| 2а | - единичные плотные сращения соединяют противоположные зоны полости матки; - устья маточных труб визуализируются; - спайки не могут быть разделены тубусом гистероскопа. |
| 2б | - полное заращение внутреннего зева, при этом верхняя часть полости матки выглядит нормально; |
| 3 | - множественные плотные сращения соединяют противоположные зоны полости матки; - устье одной маточной трубы полностью заращено; |
| 4 | - выраженные плотные сращения с частичным заращением полости матки и устьев обеих маточных труб; |
| 5а | -выраженное рубцевание и разрастание или замещение плотной соединительной тканью внутреннего слоя матки в сочетании со спайками 1 или 2 степени; - аменорея или выраженная гипоменорея; |
| 5б | - выраженное рубцевание и фиброз эндометрия в комбинации со спайками 3 или 4 степени; - аменорея. |
По классификации Американского Общества Репродуктивной Медицины оцениваются данные рентгенодиагностики маточных труб (гистеросальпингографии), гистероскопии, тип спаек, степень нарушений менструальной функции и формируется долгосрочный прогноз по возможности зачать и выносить ребёнка [12] .
| Степень вовлечения полости матки | Менее 1/3 – 1 балл | 1/3-2/3 – 2 балла | 2/3 – 4 балла |
|---|---|---|---|
| Тип спаек | Нежные – 1 балл | Нежные и плотные – 2 балла | Плотные – 4 балла |
| Нарушение менструаций | Норма – 0 баллов | Гипоменоррея – 2 балла | Аменорея – 4 балла |
Суммируя баллы, выделяют 3 стадии:
- слабая — 1-4 балла;
- средняя — 5-8 баллов;
- тяжёлая — 9-12 баллов.
Осложнения синдрома Ашермана
Заболевание может вызывать следующие осложнения:
1. Бесплодие . Беременность возможна только после удачно проведённой операции, при которой удаётся восстановить полноценный объём полости матки и освободить устья маточных труб.
2. Циклические ежемесячные боли. Возникают при заращивании внутреннего зева и нижней трети полости матки.
3. Эндометриоз. Выражается в том, что клетки эндометрия (внутреннего слоя стенки матки) разрастаются за пределами этого слоя . Согласно имплантационной теории, заболевание вызвано тем, что большое количество менструальной крови через маточные трубы попадает в брюшную полость. Отток во влагалище при этом затруднён. Обилие крови в брюшной полости приводит к тому, что защитные силы организма не успевают подавлять активность и разрушать клетки эндометрия.
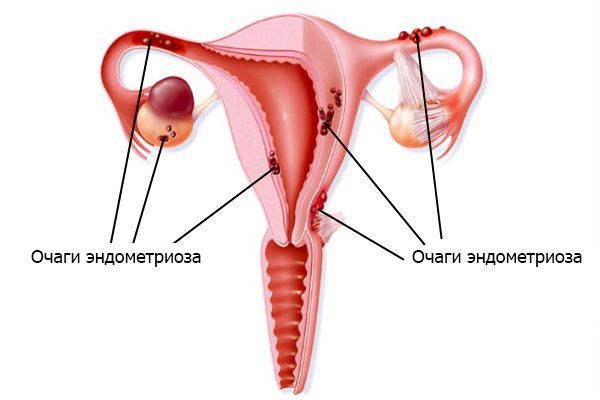
4. Невынашивание беременности, выкидыши . Основная причина состоит в том, что сращения ограничивают функциональный объём полости матки и не дают ей растягиваться.
5. Гипоменструальный синдром (скудные менструации — 1-2 дня, меньше 25 мл, а порой несколько дней в виде "мазни"). Возникает при частичном заращении полости матки.
6. Неправильное прикрепление (врастание в стенку матки) плаценты . Осложнение проявляется, когда плацента не отделяется после родов. Это может вызвать кровотечение и в ряде случаев приводит к удалению матки.
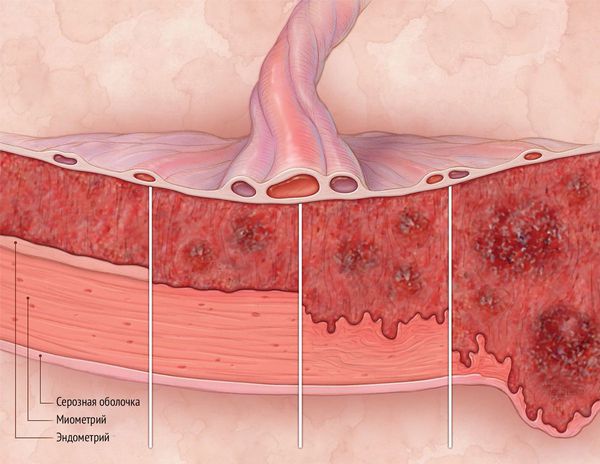
Диагностика синдрома Ашермана
Основные методы диагностики:
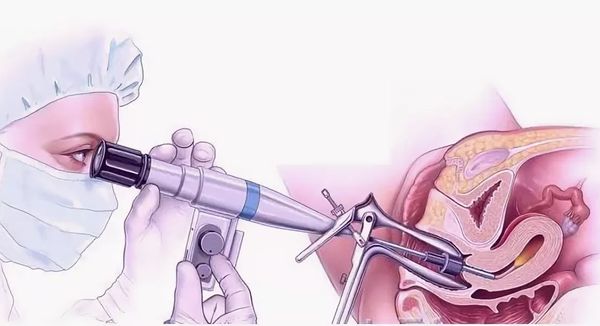
- Диагностическая гистероскопия . Метод позволяет визуально оценить степень поражения эндометрия и является золотым стандартом выявления синдрома Ашермана [13] .
- Гистеросальпингография — исследование, при котором в полость матки вводят рентгеноконтрастный раствор и выполняют рентгеновские снимки для получения изображения полости матки и просвета маточных труб. Имеет лишь историческое значение, потому что точность метода невелика, а лучевая нагрузка на гениталии существенна. Облучение может спровоцировать злокачественные заболевания половых органов или ухудшить работу яичников.
- Зондирование полости матки — метод гинекологического исследования, который проводят с помощью специального маточного зонда.
- Ультразвуковое исследование. Если есть спайки, то на снимках видны эхогенные, нерегулярные эксцентричные линейные сигналы — беловатые плотные участки рубцовой ткани или локальное истончение эндометрия. Исследование проводят в лютеиновую фазу (период с момента овуляции и до начала менструаций).
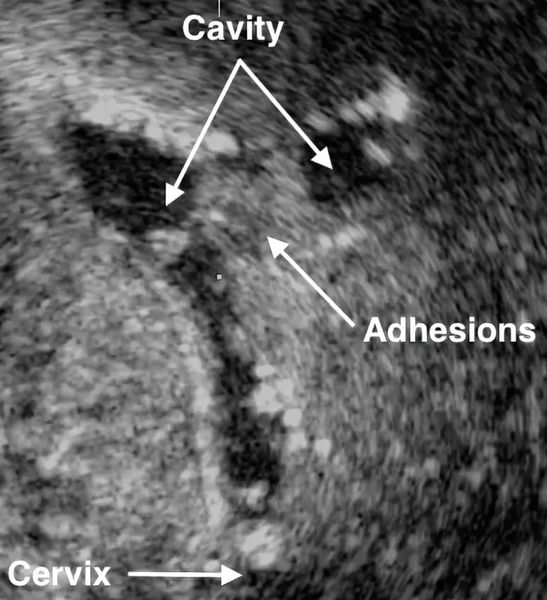
- Соногистерография — ультразвуковое исследование, во время которого в полость матки вводят физиологический раствор.
- Допплеровское исследование— ультразвуковая оценка органических изменений, нарушающих кровоток. Метод позволяет оценить функциональное состояние эндометрия.
- Магнитно-резонансная томография — применяется в случаях тотального поражения полости матки при невозможности провести гистероскопию.
Гистероскопия является самым точным и надёжным методом диагностики синдрома Ашермана . Другие техники выполняют вспомогательное значение и часто дают противоречивые результаты при субмукозных миомах (узлах, растущих в полость матки) и при гиперпластических процессах эндометрия.
Лечение синдрома Ашермана
Операция показана при бесплодии, невынашивании беременности и циклические болях, возникающих из-за затруднения оттока менструальной крови. В последнем случае цель операции состоит в удалении жидкого содержимого из полости матки.
Первые попытки лечить синдром Ашермана заключались в проведении лапаротомии (операции, которая производится путем рассечения передней брюшной стенки скальпелем), утеротомии ( рассечении стенки матки) и пальцевом разрушении спаек. Данные методики имеют лишь историческое значение, поскольку появление гистероскопии значительно улучшило результаты терапии.
Перед операцией, как правило, проводят профилактическое лечение антибиотиками широкого спектра действия. Цель операции — полностью восстановить полость матки. К сожалению, при обширном поражении часто невозможно обнаружить устья маточных труб и найти правильное направление для рассечения сращений. Тогда задача состоит в создании объёма полости матки, достаточного для применения методов вспомогательной репродукции.

Важные аспекты хирургического вмешательства:
- За несколько минут до операции проводят трансвлагалищное УЗИ, чтобы чётко представлять изгиб полости матки. Для навигации в сложных случаях используют ультразвук и лапароскопию, хотя эти методы не могут гарантированно предотвратить разрыв стенок матки, если хирург потеряет правильное направление при рассечении сращений.
- Рассечение сращений производят от центра полости матки латерально (в боковую сторону) и в сторону устьев маточных труб. Рубцовая ткань, в отличие от миометрия, не кровоточит — это является критерием правильности выбранного курса.
- Часто достаточно рассечь плотные сращения в области внутреннего зева и нижней трети полости матки. Это поможет получить доступ ко дну матки, где сращения обычно не очень плотные, и без затруднений освободить устья маточных труб.
Если операция прошла удачно и пациентка чувствует себя хорошо, то уже вечером она может быть выписана. Если процедура была сложной или потребовалось проведение лапароскопии, придётся провести ночь в стационаре.
Прогноз. Профилактика
Прогноз не всегда благоприятен, поэтому особое внимание следует обратить на профилактические меры. Их можно разделить на две группы:
1. Методы первичной профилактики развития спаек в полости матки:
- Бережное отношение к матке при выскабливании, снижение числа повторных вмешательств. Этого можно добиться применением гемостатиков (препаратов, останавливающих кровотечение) после абортов, что уменьшит риск повторного выскабливания. При наличии остатков плодного яйца в полости матки не следует торопиться с выскабливанием, так как 95 % плацентарных полипов (остатков беременности) спонтанно разрушаются в течение трёх месяцев на фоне приёма оральных контрацептивов. Если же повторное опорожнение полости матки необходимо, то выполнить это можно деликатно: методом вакуум-аспирации при ультразвуковой навигации.
- Чтобы предотвратить развитие спаек после внутриматочной хирургии следует ограничить использование электрохирургии в пользу методики Cold Loop ("Холодная петля") . Технология заключается в том, что при удалении субмукозных узлов 1 и 2 типов (когда часть узла находится в полости матки, а часть в стенке) часть узла в матке постепенно удаляется по кусочкам с помощью высокотемпературной петли. Далее узел извлекается из стенки матки с помощью специальных механических устройств, при этом миометрий сокращается и выталкивает остатки узла в просвет полости матки. Очень важно при этом находиться в правильном слое — между псевдокапсулой (растянутыми тканями матки, покрывающими миоматозный узел) и самой миомой. Это позволяет бескровно выделить узел из ложа и обойтись без прижигания тканей, либо использовать её в минимальном объёме на последнем этапе [15] . Это очень важно, поскольку на обожжённой поверхности полости матки легко образуются спайки, а эндометрий восстанавливается очень медленно, да и высокая температура может повредить нижележащий слой миометрия и возникает риск разрыва матки при последующей беременности.
2. Вторичная профилактика — комплекс мер, направленных на снижение риска повторного появления спаек в полости матки после их рассечения:
- После рассечения спаек для стимуляции роста эндометрия следует принимать эстрогены и ввести в полость матки гелевый противоспаечный агент [16][17] . Гель позволяет временно, на пять суток, разобщить противоположные стенки матки и не дать им срастись.
- Применение катетера Фолея (трубки для выведения мочи из мочевого пузыря) — заполненный катетер разобщает стенки матки, он может находиться в полости матки до двух недель. С этой же целью применяют различные пластиковые устройства и внутриматочные спирали. Вероятность повторного образования спаек снижается, но остаётся риск инфицирования [18] .
- Согласно последним исследованиям, для регенерации эндометрия перспективно применение стволовых клеток[20] .
Несмотря на профилактику спаек, они повторно образуются у 25 % женщин с умеренной степенью синдрома Ашермана и у 75 % с тяжёлой. Беременность наступает у 25-75 % оперированных женщин, доношенные дети рождаются в 26-79 % случаях . Разница в данных связана с тем, что не существует общепризнанной классификации синдрома и единого подхода ко вторичной профилактике заболевания.
В дополнение к вышеперечисленным методикам в послеоперационном периоде используют программируемую газовую дистензию . Метод заключается в том, что для разобщения стенок полость матки заполняют углекислым газом. Под давлением газа полость матки растягивается, что приводит к разрушению нежных спаек. Процедуру проводят последовательно на 3, 7 и 10 день после операции. Дополнительным преимуществом является то, что газ, в отличие от жидкости, не переносит в полость матки микроорганизмы, находящиеся на шейке, это делает процедуру более безопасной.
Рассмотрена проблема внутриутробного инфицирования и внутриутробной инфекции (ВУИ) плода, факторы риска внутриутробных инфекций, патогенетические механизмы возникновения, развития и воздействия ВУИ, подходы к диагностике и лечению.
The issue of fetal intrauterine infecting and intrauterine infection (IUI) was considered, as well as the risk factors of intrauterine infections, pathogenic mechanisms of their occurrence, development and effect of IUI, and approaches to the diagnostics and treatment.
Проблема внутриутробной инфекции особо актуальна в современных условиях в связи с распространенностью и тяжестью воспалительных процессов. Проблема внутриутробного инфицирования и внутриутробной инфекции (ВУИ) плода является одной из ведущих в акушерской практике и в перинатологии в связи с высоким уровнем инфицирования беременных, рожениц и родильниц, опасностью нарушения развития плода и рождения больного ребенка. Наличие инфекции у матери является фактором риска ВУИ плода, но не всегда означает его заболевание [1, 5–7, 13].
Внутриутробная инфекция — группа инфекционно-воспалительных заболеваний плода и детей раннего возраста, которые вызываются различными возбудителями, но характеризуются сходными эпидемиологическими параметрами и нередко имеют однотипные клинические проявления. Заболевания развиваются в результате внутриутробного (анте- и/или интранатального) инфицирования плода. При этом в подавляющем большинстве случаев источником инфекции для плода является мать. Истинная частота врожденных инфекций до настоящего времени не установлена, но, по данным ряда авторов, распространенность данной патологии в человеческой популяции может достигать 10%. В структуре перинатальной смертности ВУИ составляет более 30% [1, 5–7].
Кроме этого, ВУИ относятся к тяжелым заболеваниям и во многом определяют уровень младенческой смертности.
Согласно данным многих авторов, причиной внезапной смерти грудных детей является инфекционное заболевание, протекающее без ясной симптоматики. В числе причин или фоновых состояний скоропостижной смерти могут быть ВУИ [2].
Под внутриутробным инфицированием понимают процесс внутриутробного проникновения микроорганизмов к плоду, при котором отсутствуют признаки инфекционной болезни плода. Как правило, инфекционный процесс затрагивает плаценту, в которой развивается плацентит, хориоамнионит и т. д. Диагноз внутриутробного инфицирования у новорожденного устанавливается на основании выделения возбудителя из клеток крови, ликвора и других источников, выявления IgM и низкоавидных IgG в пуповинной крови, а также при морфологическом исследовании плаценты [1, 5–7].
Внутриутробное инфицирование не означает неизбежного развития инфекционного заболевания. Для выявления ВУИ необходимо наличие данных лабораторного исследования в сочетании с клинической картиной инфекционного заболевания. Под ВУИ подразумевают не только процесс распространения инфекционных агентов в организме плода, но и вызванные ими морфофункциональные нарушения различных органов и систем, характерные для инфекционной болезни (сепсис, пневмония, менингит, гепатит и т. д.), возникшей анте- или интранатально и выявляемой пренатально или после рождения [10, 11].
Инфекционно-воспалительные заболевания во время беременности имеют особенности: инфицирование плода и новорожденного может быть вызвано как острой инфекцией матери, так и активацией хронической, персистирующей инфекции во время беременности; большая часть заболеваний беременных, приводящих к внутриматочной инфекции, протекает в латентной или субклинической форме; активация персистирующей инфекции возможна при любом нарушении гомеостаза в организме беременной (стресс, острые респираторные вирусные инфекции, переохлаждение и др.) [1, 2].
Возможный спектр возбудителей внутриутробной инфекции весьма разнообразен и широк. Это бактерии (грамположительные и грамотрицательные; аэробные и анаэробные), грибы, простейшие, внутриклеточные микроорганизмы (микоплазмы, хламидии), вирусы. Чаще всего наблюдается сочетание возбудителей — бактериально-вирусная смешанная инфекция [3, 4, 10, 11].
Зачастую ВУИ ассоциируются с наличием инфекций TORCH — то есть синдромом комплекса. Данный термин образован первыми буквами латинских названий наиболее часто верифицируемых врожденных инфекций: T — токсоплазмоз (Тoxoplasmоsis), R — краснуха (Rubella), С — цитомегалия (Cytomegalia), Н — герпес (Herpes) и О — другие инфекции (Оther). К последним относят сифилис, листериоз, вирусные гепатиты, хламидиоз, ВИЧ-инфекцию, микоплазмоз и др. [9, 11].
Принимая во внимание, что источником инфекции для плода всегда является его мать, особое значение приобретают следующие факторы риска внутриутробных инфекций:
- хронические очаги инфекции в организме матери (в том числе наличие воспалительных заболеваний органов малого таза, урогенитальные инфекции);
- первичное инфицирование во время беременности, активация инфекционного процесса;
- патологическое снижение общего и местного иммунитета;
- наличие экстрагенитальной патологии (анемия, тромбофилии, аутоиммунные заболевания);
- повышение проницаемости плацентарного барьера во II и III триместрах беременности при невынашивании беременности и плацентарной недостаточности;
- отягощенный акушерско-гинекологический диагноз;
- неблагоприятные социально-бытовые факторы [1, 9, 11].
Патогенетические механизмы возникновения, развития и воздействия ВУИ разнообразны и зависят от многих факторов:
- срока беременности, при котором происходит инфицирование (чем раньше, тем прогноз будет более неблагоприятным);
- вида возбудителя, его вирулентности, массивности обсеменения;
- первичности или вторичности инфекционного процесса у беременной;
- путей проникновения инфекции к плоду (восходящий, нисходящий, гематогенный);
- степени распространенности и интенсивности воспалительного процесса;
- состояния организма матери, его иммунологической толерантности.
Влияние инфекции на эмбрион и плод заключается в воздействии комплекса следующих факторов:
- патологическое воздействие микроорганизмов и их токсинов (инфекционное заболевание, гипоксия плода, задержка развития плода);
- нарушение процесса имплантации и плацентации (низкая плацентация, предлежание плаценты);
- снижение метаболических процессов и иммунологической защиты плода [1, 9, 11].
Таким образом, реализуется ли внутриутробное инфицирование в ВУИ или нет, зависит от ряда факторов, которые мы представили выше.
Учитывая неспецифичность клинических проявлений ВУИ во время беременности, диагностика данной патологии в большинстве случаев затруднена и возможна лишь в результате сочетания клинических и лабораторно-диагностических методов обследования.
Клинический метод исследования позволяет выявить различные осложнения гестационного периода, такие как невынашивание беременности и синдром задержки роста плода (СЗРП). Кроме этого, немаловажное значение имеет наличие проявлений инфекции у матери (отит, гайморит, пиелонефрит, цистит и т. д.).
Методы, позволяющие оценить состояние фетоплацентарной системы:
- эхография (плацентометрия, поведенческая активность плода, его тонус, количество околоплодных вод, степень зрелости плаценты);
- допплерография (МПК, ФПК);
- кардиотокография (КТГ).
Микробиологические и серологические исследования:
- микроскопия влагалищных мазков (повышенное содержание лейкоцитов, кокковая флора, признаки дисбиоза, грибковая флора);
- бактериальный посев (наличие анаэробных и аэробных бактерий, грибковой флоры);
- ПЦР-диагностика (геномы ВПГ-1, ВПГ-2, ЦМВ, микоплазмы, уреаплазмы, хламидии);
- иммуноферментный анализ (ИФА): обнаружение в сыворотке специфических антител к возбудителям (IgM, IgG, IgA) в диагностически значимых титрах.
Исследование хориона (биопсия хориона): бактериологический метод, ПЦР-диагностика.
Исследование околоплодных вод (амниоцентез): бактериологический метод, ПЦР-диагностика.
Исследование пуповинной крови плода (кордоцентез): бактериологический метод, ПЦР-диагностика и специфический иммунный ответ (IgM) плода.
Морфологическое исследование плаценты, данные аутопсии.
Предположительный диагноз внутриутробного инфицирования и ВУИ помогают поставить косвенные методы:
- наличие у матери клиники инфекционного заболевания;
- наличие специфического иммунного ответа;
- результаты УЗИ, допплерометрии, КТГ.
К прямым методам диагностики внутриутробного инфицирования и ВУИ относятся: выявление возбудителя в материале, полученном при биопсии хориона, амниоцентезе (ПЦР, бактериологический метод), кордоцентезе (ПЦР, бактериологический метод и определение уровня специфических IgM).
Характер течения беременности при внутриутробной инфекции зависит от срока воздействия возбудителя.
На ранних этапах зародыша (1–3 недели беременности) из-за отсутствия механизмов взаимодействия инфекционного агента и плодного яйца реализации воспалительной реакции чаще всего не происходит. Контакт с инфекцией может закончиться альтернативным процессом и гибелью плодного яйца. Повреждение эмбриона инфекцией на 4–12 неделях беременности связано с вирусной инфекцией, проникновением микроорганизмов через хорион. Плод еще не имеет защитных механизмов. Нарушение закладки органов и систем вызывает тератогенный и эмбриотоксический эффект [13, 15].
В I триместре беременности специфических клинических признаков наличия ВУИ нет, косвенно о ней свидетельствуют некоторые эхографические признаки:
- повышенный локальный тонус матки;
- отслойка хориона;
- изменение формы плодного яйца (деформация);
- прогрессирование истмико-цервикальной недостаточности (функционального характера);
- гипоплазия хориона;
- увеличение или персистенция желточного мешка;
- несоответствие размеров эмбриона размерам полости плодного яйца (увеличение, уменьшение);
- отсутствие редукции хорионической полости.
Инфекционные фетопатии возникают с 16-й недели, когда происходит генерализация инфекции у плода. Могут возникать такие пороки развития, как фиброэластоз эндокарда, поликистоз легких, микро- и гидроцефалия (ранние фетопатии) [12–15].
В III триместре плод реагирует на внедрение возбудителя локальной реакцией. Могут возникнуть энцефалит, гепатит, пневмония, интерстициальный нефрит. Влияние вирусов чаще всего проявляется признаками незрелости, дисэмбриогенетическими стигмами, затяжным адаптационным периодом, значительной потерей массы тела в раннем постнатальном периоде. Данные эхографии во II и III триместрах беременности, указывающие на развитие инфекции у плода:
- СЗРП;
- гипоксия плода;
- фетоплацентарная недостаточность;
- многоводие или маловодие;
- неиммунная водянка плода;
- увеличение или уменьшение толщины плаценты, наличие патологических включений;
- контрастирование базальной мембраны;
- наличие взвеси в околоплодных водах;
- кальцификаты в печени и селезенке и головном мозге плода;
- поликистоз легких, почек плода;
- эхогенные фиброзные включения на папиллярных мышцах и створках клапанов сердца плода;
- расширение петель кишечника плода (гипоксия, энтерит) [12–15].
После верификации диагноза ВУИ лечебные мероприятии проводят с помощью этиотропной, антимикробной терапии: препараты пенициллинового ряда и макролиды. Целесообразность назначения антимикробных препаратов не вызывает сомнения, если ВУИ обусловлено наличием патогенных возбудителей (бледная спирохета, токсоплазма, хламидии, гонококк и т. д.) [8, 14].
В настоящее время одним из наиболее дискутабельных вопросов в акушерстве является выяснение истинной этиологической роли генитальных микоплазм (Mycoplasma hominis, Mycoplasma genitalis, Ureaplasma urealyticum) в развитии патологии матери и плода. Инфицирование плода генитальными микоплазмами происходит преимущественно интранатально: в 18–55% — у доношенных новорожденных и в 29–55% — у недоношенных [3, 16, 20].
Актуальность проблемы урогенитального микоплазмоза обусловлена не только значительным распространением этой инфекции в популяции, но и неоднозначностью ее оценки как эпидемиологами, так и клиницистами [16].
По данным различных исследователей, микоплазмы являются возможной причиной развития конъюнктивитов, врожденных пневмоний, респираторного дистресс-синдрома, хронических заболеваний легких, менингита и неонатального сепсиса. Вопрос о терапии микоплазменной инфекции до настоящего времени остается открытым. В схемах терапии предусматривается 7–10-дневные курсы макролидов [1, 3, 21, 22].
Во время беременности противовирусная терапия при генитальном герпесе, цитомегаловирусной инфекции, вирусе ветряной оспы проводится с помощью этиотропных препаратов (ацикловир) начиная со II триместра гестационного периода. Целью лечения является профилактика рецидивирования и антенатального инфицирования [14, 17, 19].
Трихомонадная инфекция относится к группе негонококковых воспалительных заболеваний мочеполовых органов. Лечение трихомониаза во время беременности осуществляется с помощью метронидазол-содержащих препаратов начиная со II триместра гестационного периода [8].
Появление новых методов диагностики, разработка и внедрение новых лекарственных средств не изменяют ситуацию с внутриутробными инфекциями, оставляя это по-прежнему актуальной проблемой в акушерстве. Все это обуславливает неуклонный рост инфекции в человеческой популяции, высокий процент рецидивов инфекции даже у пациентов, получавших курс антибиотикотерапии в соответствии с действующими инструкциями и схемами лечения. Проблема осложняется тем, что в настоящее время отсутствует единая концепция механизма рецидивирования, недостаточно изучена роль микст-инфекции в возникновении, течении и персистировании инфекции, не учитываются особенности гормонального и иммунного статуса больного, не сформированы диагностические критерии контроля излеченности патологического процесса. Это все вместе взятое является стимулом для продолжения исследований, направленных на решение данных проблем. Несмотря на то что роль вирусных и бактериальных инфекций в этиологии и патогенезе многих патологических процессов не вызывает сомнений, вопрос о значении инфекций в качестве моновозбудителя на сегодняшний день окончательно не решен. Актуальным по-прежнему остается вопрос разработки алгоритма лабораторной диагностики заболеваний.
Только совершенствование диагностических подходов, разработка оптимальных алгоритмов и методов обследования и предупреждение распространения резистентных штаммов путем адекватного отношения к каждому пациенту индивидуально (обязательное проведение посевов на определение чувствительности к антибиотикам до назначения терапии) может изменить данную ситуацию.
Исследование выполнено за счет гранта Российского научного фонда (проект № 15-15-00109).
Литература
В. Н. Кузьмин 1 , доктор медицинских наук, профессор
К. Н. Арсланян, кандидат медицинских наук
Э. И. Харченко, кандидат медицинских наук
ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
Читайте также:

