Хронические очаги инфекции и жкт
Обновлено: 25.04.2024
Какие классификации гастрита существуют в настоящее время?
Каковы схемы лечения хронического гастрита?
Понятие
В РФ статистических данных относительно распространенности хронического гастрита нет. В странах с развитой статистикой хронический гастрит фиксируется у 80—90% больных, причем атрофический гастрит встречается в 5% случаев — у лиц моложе 30 лет, в 30% случаев у лиц в возрасте от 31 до 50 лет и в 50—70% случаев — у лиц старше 50 лет.
Согласно выводам ленинградской школы гастроэнтерологов, этиологические факторы развития первичного (или собственного) хронического гастрита носят экзогенный характер (Helicobacter pylori (НР), желчные кислоты и лизолецитин в желудочном содержимом, погрешности в диете, курение и злоупотребление алкоголем, длительный нервно-психический стресс, продолжительный прием лекарственных средств, повреждающих слизистую оболочку, профессиональные вредности: металлическая и хлопковая пыль, пары концентрированных щелочей и кислот и т. д. (их около 30)) и эндогенный характер (наследственная предрасположенность, хронические инфекции, аутоимммунные заболевания, патология эндокринной системы, болезни обмена веществ, хроническая пищевая аллергия; хронические заболевания сердца, протекающие с декомпенсацией по большому кругу кровообращения и последующей тканевой гипоксией слизистой оболочки желудка и т. д. (их около 45)).
Патогенез хронического гастрита представлен бактериальными, иммунологическими и нейрогуморальными нарушениями, проявляющимися на уровне слизистой оболочки желудка в виде поверхностного и атрофического гастрита. Учитывая, что патогенез хронического гастрита для каждой формы и типа заболевания имеет свои особенности, необходимо рассмотреть классификацию хронического гастрита и в первую очередь остановиться на морфологической классификации. Согласно последней, выделяют острый, хронический, а также особые формы хронического гастрита.
Острый гастрит, как правило, является следствием острой инфекции и острого повреждения слизистой оболочки желудка химическими и токсическими факторами (концентрированными щелочами и кислотами, большими дозами алкоголя и т. д.). Эти формы гастрита нередко протекают с тяжелыми осложнениями, в связи с чем лечением острого гастрита занимаются не гастроэнтерологи, а инфекционисты, наркологи, хирурги.
Пилорическая метаплазия фундальных желез внешне напоминает пилорические железы желудка. Однако имеется и различие — отсутствие шеечных отделов желез, высокая устойчивость к атрофии, G-клетки встречаются крайне редко, на порядок больше суммарного белка. Пилорическую метаплазию обнаруживают, как правило, при атрофическом гастрите на месте зажившей эрозии или язвы. Реснитчатая метаплазия — это скопления клеток поверхностного или железистого эпителия, имеющего длинные и тонкие реснички. Впервые она была описана профессором Шивасаки в 1986 г. Эту метаплазию часто обнаруживают на участках с кишечной метаплазией, однако ее связь с раком желудка не подтверждена.
В 1993 г. профессор C. Doglioni с соавт. впервые описал панкреатическую метаплазию слизистой оболочки желудка. Клетки панкреатической метаплазии похожи на ацинарные клетки поджелудочной железы. В подслизистом слое и мышечной оболочке желудка часто обнаруживают гетеротопическую ткань поджелудочной железы, которую обозначают как хористома. Хористома и панкреатическая метаплазия клеток поверхностного эпителия представляют собой разные структуры. Связи панкреатической метаплазии с опухолями желудка не установлено.
Истинным предраковым изменением слизистой оболочки желудка считается дисплазия эпителия, при этом выделяют три степени дисплазии [1]: слабую, умеренную и выраженную (или тяжелую). Наиболее опасной в плане трансформации в рак желудка считается тяжелая дисплазия эпителия. Слабая и умеренная дисплазии эпителия трудно отличимы от воспалительной дисплазии, обнаруживаемой в краях эрозий и язв (при воспалительной дисплазии, в отличие от истинной, в эпителии обнаруживаются многочисленные лейкоциты). При заживлении эрозий и язв воспалительная дисплазия исчезает, а истинная всегда остается. Проспективное мультицентровое изучение дисплазии [4] дало основание для объединения слабой и умеренной дисплазии в одну группу.
В классификации оставлены только две степени — слабая и тяжелая. При слабой дисплазии, выявленной у больных старше 60 лет на фоне выраженного гастрита, рекомендуется проведение повторных ЭГДС и биопсий каждые 6—12 месяцев [1]. Тактика ведения больных с тяжелой дисплазией определена в монографии Л. И. Аруина и соавт. [1]. При обнаружении тяжелой дисплазии больному необходимо в течение 10 дней повторить ЭГДС одним и тем же эндоскопистом со взятием множественных биопсий. При определении тяжелой дисплазии вновь рекомендовано каждые три месяца в течение года делать ЭГДС со взятием многочисленных биопсий. Если при одном из иследований в биопсиях тяжелой дисплазии не обнаружено, динамическое наблюдение с трехмесячным проведением ЭГДС в течение года тем не менее следует продолжить. Ибо известно, что тяжелая дисплазия эпителия трансформируется в рак in situ в сроки от трех месяцев до 20—30 лет [1]. Существует другая классификация дисплазий эпителия, в которой выделяют дисплазию низкой степени и дисплазию высокой степени [1]. Известно, что дисплазия — это истинная неоплазия, только без признаков инвазии.
В 2000 г. появилась новая классификация дисплазий слизистой оболочки желудка — согласованная Международная (Венская) классификация эпителиальных неоплазий пищеварительного тракта [2].
Лимфоцитарный гастрит возникает на фоне аутоиммунного хронического гастрита тела желудка (или смешанного хронического пангастрита) и характеризуется многочисленными интраэпителиальными лимфоцитами, которые обнаруживаются среди клеток поверхностного эпителия (на 100 эпителиальных клеток фиксируется 30 и более лимфоцитов, в норме они не определяются). Патогенез этой формы гастрита до конца неясен. Полагают, что это особая иммунологическая реакция на НР, который в слизистой оболочке желудка не обнаруживается.
Гранулематозный гастрит характеризуется наличием мелких гранулем в собственной пластинке слизистой оболочки желудка на фоне поверхностного или атрофического гастрита. Чаще всего речь идет о болезни Крона, саркоидозе, болезни Вегенера желудочной локализации. Аналогичную картину могут дать паразиты или инородные тела желудка.
Эозинофильный гастрит возникает на фоне поверхностного или атрофического гастрита и характеризуется очаговыми и/или диффузными скоплениями эозинофилов в собственной пластинке слизистой оболочки желудка. Этот гастрит встречается, как правило, при аллергических заболеваниях и аллергозах. Нередко в качестве причинного фактора выступают пищевые аллергены или паразиты.
Инфекционный гастрит характеризуется очаговыми и/или диффузными скоплениями бактерий (гастроспириллы), вирусов (цитомегаловирусы), грибов (типа Candida) и моноцитарной реакцией на них в собственной пластинке слизистой оболочки желудка.
С 1968 г. отечественные гастроэнтерологи при постановке диагноза берут на вооружение клинико-морфологический подход, предполагающий выделение хронического гастрита с сохраненной, повышенной функцией желудка (в теле желудка — неизмененная слизистая оболочка, поверхностный гастрит), с умеренной или выраженной секреторной недостаточностью (в теле желудка — мультифокальный или очаговый, диффузный атрофический гастрит).
Для оценки Сиднеевской классификации в конце 1994 г. в Хьюстоне (США) была выделена рабочая группа, в которую вошли 20 ведущих морфологов-гастроэнтерологов, специализирующихся в области изучения патологии желудка. В результате Сиднеевская классификация была принята в качестве основной. Дополнения же сводились к следующему:
Согласно предложенным классификационным дополнениям, в качестве основной формы хронического гастрита выделяют аутоиммунный хронический гастрит тела желудка, который характеризуется очаговым или диффузным атрофическим гастритом тела желудка и неизмененной слизистой оболочкой или поверхностным гастритом антрума желудка (НР-негативный). У этой группы больных определяются: аутоантитела типа IgG к париетальным клеткам (в 95% случаев), аутоантитела типа IgG к ферменту К/Na-АТФазе в париетальной клетке (в 70% случаев) с развитием умеренной или выраженной секреторной недостаточности; аутоантитела типа IgG к внутреннему фактору Кастла
Клинические проявления хронического гастрита
Клиническая картина хронического гастрита характеризуется как местными, так и общими расстройствами, как правило, появляющимися в периоды обострений. Местные признаки характеризуются симптомами желудочной диспепсии (тяжесть и чувство давления, полноты в подложечковой области, появляющиеся или усиливающиеся во время еды или вскоре после еды; отрыжка, срыгивание, тошнота, неприятный привкус во рту, жжение в эпигастрии, нередко изжога, свидетельствующая о нарушении эвакуации из желудка и забросе желудочного содержимого в пищевод). Эти проявления чаще возникают при определенных формах хронического антрального гастрита, которые ведут к нарушению эвакуации из желудка, повышению внутрижелудочкового давления, усилению желудочно-пищеводного рефлюкса и обострению всей перечисленной симптоматики.
При хроническом гастрите тела желудка проявления встречаются нечасто и сводятся преимущественно к тяжести в эпигастральной области, возникающей во время или вскоре после еды.
Все эти проявления могут служить основой для диагностики хронического гастрита либо оценки стадии болезни или ее осложнений.
Диагностика хронического гастрита включает:
- эндоскопический метод со взятием диагностических биопсий;
- морфологические методы: гематоксилином и эозином, гистохимические окраски, окраска по Гимзе без дифференцировки на НР, иммуноморфологический с окраской антисыворотками к гастрину, соматостатину и гистамину;
- методы, направленные на выявление НР: морфологический, уреазный (кло-тест, дыхательный), иммуноморфологический на антигены НР, иммунологический, бактериальный с посевами на среды;
- радиоиммунологический метод с определением в крови гастрина и пепсиногена 1;
- иммунологический метод с применением иммуносорбентов: АТ к париетальным клеткам, АТ к ферменту К/Na-АТФазы в париетальных клетках, АТ к внутреннему фактору Кастла, АТ к НР;
- определение кислотной продукции: фракционное желудочное зондирование, виды рН-метрии;
- лабораторный метод: общий анализ крови, определение уровня уропепсина в моче.
Примеры формулировки диагноза
- Острый геморрагический гастрит [К 29.0].
- Хронический гастрит антрума желудка (хронический антральный гастрит) хеликобактерный* с повышенной секреторной функцией* (или нормальной секреторной функцией*) в фазе обострения (затухающего обострения или ремиссии) [К.29.5].
- Хронический гастрит тела желудка (хронический фундальный гастрит) аутоиммунный* с умеренной (или выраженной) секреторной недостаточностью* в фазе обострения (затухающего обострения или ремиссии) [К 29.5].
- Хронический смешанный пангастрит хеликобактерный*
- нормальной секреторной функцией* (или умеренно выраженной секреторной недостаточностью*) в фазе обострения (затухающего обострения или ремиссии) [К 29.5].
Принципы лечения хронического гастрита
Учитывая наличие клинически и морфологически различающихся форм хронического гастрита, способы лечения также варьируют в зависимости от этиологии, морфологии, стадии болезни.
Диетические мероприятия должны включать в себя: назначение щадящей диеты в период обострения заболевания, подразумевающей механические, химические, объемные ограничения. Эти ограничения действуют только в период обострения; по мере его купирования питание должно становиться полноценным с соблюдением стимулирующего принципа в период ремиссии у больных с подавленной или с пониженной кислотной продукцией.
Лечение отдельных форм хронического гастрита
Аутоиммунный фундальный атрофический гастрит (тип А)
Условно выделяют следующие стадии болезни:
- начальную;
- развернутую (активную, прогрессирующую);
- стадию стабилизации процесса;
- стадию осложнений (ахилию с проявлениями нарушенного желудочного пищеварения; с нарушением моторики выходного отдела желудка; с нарушением кроветворения и развитием В12-дефицитной анемии иногда в сочетании с фуникулярным миелозом; с выраженной гиперфункцией и гиперплазией антральных G-клеток и развитием нейроэндокринных опухолей (карциноидных).
Если диагноз аутоиммунного фундального гастрита подтвержден и фиксируется начальная стадия болезни с сохраненной секреторной функцией желудка при серьезном нарушении иммунных процессов, может быть предпринята попытка лечения глюкокортикоидными гормонами (короткими курсами, средними дозами, не превышающими 30 мг преднизолона в сутки при условии проведения иммунных тестов). При отсутствии эффекта проведения повторного курса такой терапии нецелесообразно, так как повторное или продолжительное лечение глюкокортикоидными гормонами индуцирует атрофию слизистой оболочки желудка [3].
Подобная возможность лечения сохраняется и в прогрессирующей стадии болезни, а также у больных с сохраненной секреторной функцией желудка.
На стадии стабилизации процесса, при отсутствии клинических проявлений, больные в лечении не нуждаются.
При развитии осложнений при нарушенном желудочном пищеварении может быть назначен желудочный сок по одной столовой ложке на полстакана воды, небольшими глотками во время еды в сочетании с полиферментными препаратами (лучше креон или панцитрат).
При развитии В12-дефицитной анемии проводится лечение витамином В12 (начальный курс по 2000 мкг, восемь—десять инъекций ежедневно). Эта норма, по существу, покрывает годовую потребность в витамине В12. При анемии с явлениями фуникулярного миелоза ежедневная доза увеличивается до 400—500 мкг. В периоде ремиссии проводится поддерживающая терапия по 100 мкг два раза в неделю. Спустя четыре—шесть месяцев от начала лечения витамином В12 может развиться или проявиться дефицит железа, в этом случае в комплекс терапевтических мер необходимо ввести препараты железа (короткими курсами).
При установлении факта гиперфункции и гиперплазии антральных G-клеток необходимо фиксировать внимание на очаговых фовеолярных гиперплазиях слизистой оболочки желудка и, при обнаружении карциноидных опухолей — удалить их (способ удаления должен соответствовать локализации, размерам, активности и распространенности в толщу стенки).
Хронический антральный гастрит, НР-ассоциированный (тип В)
Хронический химико-токсикоиндуцированный или желчный рефлюкс-гастрит (тип С)
Этот диагноз объединяет большую группу больных, включающую пациентов с резецированным желудком, людей, получавших нестероидные противовоспалительные препараты, а также пациентов с рефлюксом дуоденального содержимого, страдающих алкогольной болезнью. Терапия зависит от основного причинного фактора. Так как желчные кислоты и лизолецитин оказывают повреждающее действие только при наличии соляной кислоты, то, в зависимости от выраженности клинических проявлений, могут быть использованы блокаторы кислотной секреции (выбор которых зависит от кислотной продукции). При рефлюкс-гастрите препаратом выбора является магалфил 800 (в суточной дозе 3200—4800 мг или четыре—шесть таблеток); полные лечебные дозы больной получает до фиксации стадии ремиссии, затем необходимо продолжить прием препарата в поддерживающих дозах: одну-две таблетки в сутки (связывающая способность препарата желчных кислот не уступает холестирамину). Следовательно, в данной ситуации магалфил 800 является препаратом выбора. Если решается вопрос о целесообразности длительного лечения НПВС и обнаруживается НР-ассоциированный, антральный гастрит, то следует провести эрадикационное лечение — это уменьшает количество осложнений, либо проводить данную терапию на фоне блокаторов кислотной продукции. Симптоматическая терапия проводится по обычным принципам и включает как диетические мероприятия, так и прием прокинетиков (мотилак, мотилиум), нормализацию пассажа химуса по кишечнику, использование препаратов поглощающих газ (кремний-содержащих), нормализацию дисбиоза и стула при наклонности к запору.
Прочие формы хронического гастрита
Литература.
О. Н. Минушкин, доктор медицинских наук, профессор
И. В. Зверков,
УНЦ МЦ УД Президента РФ, Москва
Установлена доля острых респираторных вирусных инфекций с гастроинтестинальным синдромом в структуре заболеваемости у детей в возрасте от 6 мес. Доказана лечебная эффективность и безопасность включения анаферона детского в комплексную терапию острых респираторных вирусных инфекций с сопутствующим поражением желудочно-кишечного тракта и более быстрая ликвидация всех симптомов с улучшением показателей иммунного статуса.
Ключевые слова: сочетанное поражение, респираторный тракт, желудочно-кишечный тракт, индуктор интерферона, иммунный статус
В дальнейшем появление современных методов лабораторной диагностики, а также вспышки новых, ранее неизвестных заболеваний (SARS, птичий грипп, Norwalk), расширили круг вирусных инфекций, в клиническом течении которых возможно острое сочетанное поражение РТ и ЖКТ [6,11,12]. Причиной симптомокомплекса может быть как моноинфекция, когда возбудитель репродуцируется в эпителиальных клетках и РТ, и ЖКТ, так и микст-инфекция с различной локализацией места репродукции возбудителей [2,8].
Значимость данной проблемы для детей объясняется также необходимостью совершенствования методов лечения. Учитывая полиэтиологичность изучаемой патологии и преимущественно ранний возраст пациентов, одним из наиболее перспективных путей является использование в терапии препаратов ИФН, которые, в отличие от химиопрепаратов, имеют значительно меньше противопоказаний и более широкий спектр показаний к применению [3]. К ним относится и анаферон детский (АД), созданный на основе сверхмалых доз антител к ИФН-γ в гомеопатических разведениях С12, С30 и С50, успешно применяемый при лечении гриппа и респираторно-синцитиально-вирусной инфекции [9].
Методика исследования
С целью установления удельного веса ОРВИ с гастроинтестинальным синдромом в структуре острых респираторных заболеваний (ОРЗ) проведен анализ 15 785 историй болезней детей, находившихся в инфекционно-боксовых отделениях Детской инфекционной больницы № 5 им. Н.Ф.Филатова (Санкт-Петербург) с симптомами ОРЗ в период с 2003 по 2006 г.
Лечебная эффективность АД изучена в двойном слепом плацебоконтролируемом, рандомизированном клиническом исследовании у 150 детей в возрасте от 6 мес, госпитализированных с симптомами острого сочетанного поражения РТ и ЖКТ. Из них 100 детей получили препарат, 50 - плацебо.
АД и плацебо назначали по лечебной схеме согласно инструкции в течение 7-14 сут в зависимости от клинической выраженности заболевания [7]. Кроме того, по показаниям дети получали патогенетически обусловленную базисную терапию.
В обеих группах преобладали дети первых 3 лет жизни (в 83 и 82% случаев). Мальчиков было больше, чем девочек (55 и 45% соответственно). У большинства пациентов заболевание протекало на неблагополучном преморбидном фоне, представленном, в основном, проявлениями дермато- или респираторного аллергоза, хроническими заболеваниями уха, горла, носа и других органов, частыми ОРЗ в анамнезе и т.п. В целом сравниваемые группы были репрезентативными по основным данным.
С целью установления этиологии заболевания, помимо рутинного бактериологического, мы проводили комплексное вирусологическое исследование в лабораториях ГУ НИИ гриппа РАМН. Вирусные антигены и их нуклеиновые кислоты в материалах из носоглотки определяли методами иммунофлюоресценции, ПЦР, ИФА и реакцией непрямой гемагглютинации; в фекалиях - методами ИФА и просвечивающей электронной микроскопии. Завершающим этапом диагностики было выявление нарастания титров специфических противовирусных антител в серологических реакциях парных сывороток методами реакций торможения и непрямой гемагглютинации, реакции связывания комплемента и ИФА.
У части пациентов в динамике наблюдения оценивали иммунологические показатели: содержание общего IgE в сыворотке крови, секреторного IgA в носовых смывах, сывороточного, спонтанного и индуцированного in vitro ИФН-α и ИФН-γ, а также маркеров иммунокомпетентных клеток CD3, CD4, CD8, CD20 и CD16 [1,5].
Результаты исследования
По данным стационара, за 4 года сочетанное поражение РТ и ЖКТ официально регистрировалось у каждого 4-5-го ребенка, находящегося на стационарном лечении с симптомами ОРЗ (в 2003 г. - в 22%, 2004 г. - в 16.6%, 2005 г. - в 19.3%, 2006 г. - в 26.2% случаев).
В отличие от данных стационара, где причина дисфункции ЖКТ осталась не расшифрованной в 69.1% случаев, включение в спектр исследования пациентов вирусологических методов резко изменило представления об этиологической структуре заболевания. У большинства наблюдаемых детей доминировала вирусная инфекция: по данным исследования материалов из носа - в 7488% случаев, фекалий - в 45.5-50.0%, по результатам серологических исследований - в 49-40%. В целом причина заболевания осталась неизвестной только в 9% случаев и в половине случаев она была представлена микст-вариантом с преобладанием вирусных ассоциаций.
Наиболее часто (у каждого 3-4-го пациента) регистрировались адено-, рота- и коронавирусная инфекции в виде моно- или микст-вариантов. Несколько реже регистрировалась респираторно-синцитиальная (в 21.5% случаев, в основном в виде микст), гриппозная (в 15.3% случаев), а также норо- и энтеровирусная инфекции.
Из бактериальных возбудителей в 12% случаев выявлена условно-патогенная флора, в том числе золотистый стафилококк, протей, клебсиелла и грибы рода Candida.
Таблица 1. Лечебная эффективность АД у детей с острым сочетанным поражением РТ и ЖКТ (M±m)
| Клинические симптомы | Продолжительность симптомов, дни | |
| АД (n=100) | плацебо (n=50) | |
| Лихорадочная реакция | 2.10±0.06* | 3.37±0.19 |
| Интоксикация | 2.68±0.08* | 4.63±0.19 |
| Катаральные явления в носоглотке | 4.33±0.10* | 6.79±0.23 |
| Дисфункция ЖКТ | 3.29±0.12* | 4.65±0.26 |
| Острый период заболевания | 4.68±0.08* | 6.78±0.22 |
Заболевание у всех детей имело среднетяжелую форму течения с острым началом и повышением температуры тела выше 37.5°С (в половине случаев выше 38.6°С). Выраженность симптомов зависела от этиологии. Так, катаральные явления в носоглотке были наиболее значимыми при аденовирусной инфекции, при коронавирусной в трети случаев в процесс вовлекались бронхи и легкие. Максимальная выраженность симптомов поражения ЖКТ наблюдалась при рота- и норовирусной инфекциях. Они были основной причиной развития эксикоза у детей.
Рис. Продолжительность обнаружения антигенов в носовых ходах (а) и частота внутрибольничных инфекций (б) на фоне АД (светлые столбики) или плацебо (темные столбики) при остром сочетанном поражении РТ и ЖКТ у детей.
Таблица 2. Динамика уровня ИФН разных типов у детей с острым сочетанным поражением РТ и ЖКТ на фоне АД и плацебо (M±m)
| Показатель | Время исследования | Уровень ИФН, пг/мл | |
| АД (n=70) | плацебо (n=26) | ||
| Сывороточный ИФН-α | При поступлении На 2-3-и сутки При выписке | 44.8±2.9 64.5±2.4* + 48.0±2.0* | 40.8±4.5 40.0±4.0 34.8±3.8 |
| Сывороточный ИФН-γ | При поступлении На 2-3-и сутки При выписке | 59.2±2.9 77.2±4.2* + 58.7±3.4* | 54.4±5.1 55.0±4.0 42.5±4.0 |
| Спонтанная продукция ИФН-α | При поступлении На 2-3-и сутки При выписке | 75.5±3.9 92.0±3.9* + 66.2±2.8 | 73.3±5.6 77.7±5.8 64.0±5.1 |
| Спонтанная продукция ИФН-γ | При поступлении На 2-3-и сутки При выписке | 45.5±2.4 63.1±2.6* + 50.0±2.9 | 43.3±4.0 47.5±4.5 43.8±4.0 |
| Индуцированная продукция ИФН-α | При поступлении На 2-3-и сутки При выписке | 115.0±4.8 159.3±8.9* + 139.0±6.3* + | 127.9±0.7 126.5±8.8 104.4±5.9 |
| Индуцированная продукция ИФН-γ | При поступлении На 2-3-и сутки При выписке | 91.5±5.4 123.5±7.4* + 101.6±4.5* | 89.8±5.6 91.3±5.6 75.4±3.0 |
Включение АД в комплексную терапию способствовало достоверному увеличению уровня секреторного IgA - фактора местной защиты в носовых смывах детей, в отличие от пациентов контрольной группы (в 72.6 и 32.9% случаев соответственно). Вероятно, активизация местного иммунитета способствовала сокращению периода выделения вирусных антигенов, обнаруживаемых методом иммунофлюоресценции в носовых ходах больных и, в конечном счете, уменьшению частоты развития внутрибольничных инфекций (рисунок).
Заболевания сопровождались изменением содержания большинства Т-лимфоцитов, в частности, снижением уже при первом обследовании числа CD3, CD4 и CD8. На 2-3-и сутки у пациентов, принимавших АД, достоверно увеличивалось относительное содержание CD3 (в основном за счет субпопуляции CD4 с 34.6+1.6 до 40.1+1.3%) и CD16 (с 14.3+0.9 до 17.0+1.1%), которые уменьшались или оставались на прежнем уровне в группе плацебо (CD4 - с 31.0+1.1 до 26.3+1.3%; CD16 - с 16.8+1.4 до 14.6+1.4%), что явилось показателем уменьшения числа клеток, принимающих непосредственное участие в формировании гуморального иммунитета.
На фоне приема АД наблюдалось достоверное увеличение индуцированной и спонтанной продукции ИФН-α и ИФН-γ, в отличие от детей контрольной группы, как и общего содержания данных цитокинов в сыворотке крови (табл. 2). Кроме того, несмотря на дальнейшее снижение уровня ИФН к моменту выздоровления, у детей, получавших препарат, он сохранялся на достоверно более высоком уровне.
Применение АД не вызывало каких-либо нежелательных явлений, в том числе аллергических реакций, что подтверждалось отсутствием повышения в сыворотке крови уровня общего IgE, а в ряде случаев - даже его снижением, в отличие от детей контрольной группы.
Таким образом, сочетанное поражение РТ и ЖКТ регистрируется у каждого 4-5-го пациента, госпитализированного по поводу ОРЗ, преимущественно у детей первых 3 лет жизни. В этиологии симптомокомплекса лидирует вирусная инфекция (адено-, рота- и коронавирусная в виде как моно-, так и микст-вариантов). Терапия должна быть комплексной, зависящей от ведущего синдрома и может включать индуктор ИФН - АД.
Современные методы диагностики, в частности определение антител в крови методом ИФА и определение ДНК возбудителя методом ПЦР, продемонстрировали, что инфицированность людей оппортунистическими инфекциями достигает 90–99%.
Что такое оппортунистические инфекции
Так обозначаются распространенные хронические инфекционные заболевания, вызываемые условно патогенными микроорганизмами разных типов (вирусы, бактерии, простейшие, внутриклеточные микробы), поражающими преимущественно слизистые оболочки и лимфатическую систему, передающимися разными путями и имеющими ряд закономерностей.
Формирование очагов хронических (оппортунистических) инфекций происходит так, как изображено на рисунке 2. Инфицирование становится заболеванием, если нарушается баланс между количеством возбудителя, попавшего в организм, и состоянием иммунной системы. При ослабленном иммунитете даже небольшое количество микроба может создать проблемы, а большое количество микроорганизмов вызовет заболевание и при неослабленном иммунитете. Некоторые микроорганизмы могут вызвать острое заболевание, а потом перейти в хроническую форму; например, это характерно для вируса Эпштейн Барр – возбудителя инфекционного мононуклеоза. Другие возбудители могут формировать хроническое заболевание без стадии острой болезни, например лямблии (острая форма лямблиоза встречается очень редко). Активизация хронической инфекции может произойти на фоне инфицирования любым другим микробом, тогда к клиническим проявлениям, характерным для этого микроорганизма, присоединяются клинические проявления, характерные для хронического очага. Например, ребенок заболевает ОРВИ, через несколько дней присоединяются симптомы кишечных нарушений. Это может быть активизацией очага хронической инфекции в ЖКТ, спровоцированной ОРВИ.
Эпидемиология
Для оппортунистических инфекций характерны всевозможные пути заражения:
- воздушно капельный (хламидии, легочные микоплазмы); передаваться могут как активные, так и неактивные формы, если человек является не только носителем, но и выделителем микроба в окружающую среду (большинство людей являются носителями, примерно 15% – выделители);
- фекально оральный (хламидии – Ch. psittaci, лямблии); хламидийная инфекция характерна для птиц, животных. Экскременты перемешиваются с землей, загрязняют руки и продукты, при попадании загрязненных и инфицированных элементов в кишечник там может сформироваться очаг хронической инфекции;
- половой (урогенитальный хламидиоз, оппортунистические инфекции); вертикальный (трансплацентарно, во время родов); за счет того, что хронические инфекции существуют в виде активных и неактивных форм (рис. 1), возможен такой способ передачи инфекции от матери плоду: у беременной женщины существует оппортунистическая инфекция в латентной форме, клинических проявлений нет, антитела в крови – в пределах нормы или не выявляются. Происходит вертикальная передача инфекции плоду (передаются неактивные формы), у родившегося ребенка в какой-то момент происходит активизация инфекции;
- трансмиссивный (через кровь и насе комых).
Закономерности влияния на организм
Любой очаг хронической инфекции может вызвать следующие нарушения в организме:
Наличие даже одного направления клинической картины должно наводить педиатра на предположение о поиске хронических (оппортунистических) инфекций.
Принципы диагностики
Выявление инфекционного фактора может идти по двум направлениям.
Трактовка результатов анализов представлена в таблице 2. В двух последних строках – ситуации, не требующие лечения.
| IgG | IgM | IgA | ПЦР | Трактовка |
| ↑ | N | N | ↑ или N | Инфекция есть (или есть иммунная память) |
| ↑ или N | ↑ | N | — | Активная фаза (недавнее первичное инфицирование) |
| ↑ или N | ↑ или N | ↑ | — | Активизация хронической инфекции |
| N | N | N | ↑ | Инфекция неактивна (или убитые микробы) |
| N | N | N | N | Инфекции нет (или нет клинически значимой) |
Повышение антител класса G выше диагностически значимых титров к какой либо хронической инфекции при первичной диагностике должно трактоваться как наличие этой инфекции и требует терапевтических действий: иммунокоррекции или активной этиотропной терапии.
Актуальные в педиатрии хронические инфекции
Бактериальные инфекции, вызванные условно патогенной флорой (УПФ)
Возбудители: гемолизирующая кишечная палочка, золотистый стафилококк, гемолизирующие стрептококки, клебсиеллы, лактозонегативные энтеробактерии и др. Живут на слизистых оболочках и в просвете ЖКТ, дыхательных, мочевыводящих путей.
Тактика педиатра: иммунокоррекция, применение фаготерапии, антисептиков. Применение антибиотиков показано в острую фазу (фебрильная температура, выраженность клинических проявлений).
Хламидийная инфекция
Возбудители: Ch. trachomatis, Ch. pneumoniae, Ch. psittaci. Вызывают внутриклеточные инфекции, поражающие слизистые оболочки и лимфатическую систему. Могут поражать все системы, где есть слизистая оболочка: конъюнктива глаза (интранатальное инфицирование); верхние дыхательные пути (ВДП), нижние дыхательные пути (воздушно капельный путь); слизистая ЖКТ (фекально оральный путь); мочеполовая система (половой путь или занос через лимфатическую систему);
Источники заражения:
- Человек, как здоровые носители, так и те, у кого активная форма болезни, при условии локализации на слизистых, сообщающихся с окружающей средой. Считается, что носителями хламидий являются более 90% людей.
- Птицы (попугаи, голуби, воробьи и др.). Хламидии выделяются с птичьим пометом, помет попадает в почву и на продукты питания, заражение человека происходит фекально оральным или воздушно-капельным путем.
- Кошки, мелкий рогатый скот (козы).
Инфицирование – еще не заболевание. Клинические признаки появляются при ослаблении иммунитета.
Клиническая картина зависит от локализации и активности хламидий:
- конъюнктивит (бывает у новорожденных детей при интранатальном инфицировании);
- хронические рецидивирующие заболевания ВДП (тонзиллит, фарингит), а также острые заболевания (ангина);
- рецидивирующие бронхиты или пневмонии, бронхообструкция, астма;
- хроническая дисфункция ЖКТ, дисбактериоз, не поддающийся лечению;
- атопический дерматит (хламидии, будучи внутриклеточной инфекцией, могут приводить к повреждению гистаминобразующих тучных клеток слизистых оболочек) с торпидным течением без эффекта от лечения;
- острые и рецидивирующие заболевания мочевыводящих путей, вульвиты и другие поражения половой системы.
- у детей диагноз подтверждается методом ИФА по выявлению антител;
- метод ПЦР и другие исследования, направленные на выявление возбудителя, практически не имеют смысла, поскольку локализация инфекции происходит чаще всего в труднодоступных для исследования местах (например, глубоко в бронхах или в слизистой оболочке кишечника);
- мазок из зева на выявление хламидий (методом ПЦР) нужен только для выявления степени эпидемиологической опасности, но не может быть основанием для назначения лечения;
- направление на анализы крови для выявления антител к хламидиям – по клинической картине и при наличии эпидемиологических указаний (при выявлении хламидийной инфекции в близком окружении).
Врачебная тактика при хламидийной инфекции. Применение антибактериальной терапии показано только при наличии признаков активности хламидийной инфекции, иначе не будет эффекта.
Показания для антибактериальной терапии:
- любое острое состояние, требующее назначения антибиотика: ангина, пневмония, острый бронхит, гнойный отит, гнойный тонзиллит, гайморит в стадии обострения;
- ОРЗ с высокой температурой (более 38,0 °С) более 3–5 дней;
- ОРЗ с температурой выше 37,0 °С, если она держится более 7–10 дней подряд;
- бронхообструктивный синдром; приступ бронхиальной астмы (если наличие хламидийной инфекции подтверждено анализами);
- затяжной кашель более 3 недель;
- обострение дерматита (если наличие хламидийной инфекции подтверждено анализами);
- неэффективность лечения аллергических болезней.
Примерная схема лечения в острый период хламидийной инфекции:
- Свечи Виферон и/или КИПферон для укрепления иммунной системы и повышения эффективности антибиотика, 10 дней.
- Антибиотик – макролид (кларитромицин, рокситромицин, мидекамицин, джозамицин, спирамицин), курс 10 дней.
Вне периода активности применяются общеукрепляющие средства и иммунокоррекция.
Микоплазменная инфекция
Возбудители: М. pneumoniae, М. hominis. Вызывают внутриклеточные инфекции, поражающие слизистые оболочки. Излюбленная локализация: дыхательные пути (как верхние, так и нижние) и мочеполовая система (МПС).
Источники заражения: человек – как здоровые носители, так и те, у кого активная форма при условии локализации на слизистых, сообщающихся с окружающей средой. Считается, что носителями микоплазм являются более 90% людей.
Клиническая картина – заболевания дыхательных путей и МПС. До 30% бронхиальной астмы ассоциировано с наличием микоплазменной инфекции, удачное лечение которой может избавить человека от заболевания или существенно улучшить его течение.
Диагностика и лечебная тактика при микоплазменной инфекции не отличаются от таковой при хламидийной инфекции.
Вирусные хронические инфекции Возбудители: вирус Эпштейн Барр (ВЭБ), вирусы простого герпеса 1 го, 2 го, 6 го типов (ВПГ), цитомегаловирусы (ЦМВ) и др.
Для ВЭБ характерны как острое заболевание (инфекционный мононуклеоз), так и хроническое течение по типу оппортунистической инфекции. Для ВПГ 6 го типа характерны острые состояния по клинической картине, напоминающие инфекционный мононуклеоз.
Диагностика. Исследование крови на антитела (ИФА), диагностически значимым критерием является повышение уровня IgG; возможно также выявление методом ПЦР со слизистых зева.
Лечебная тактика. При выявленном носительстве ВЭБ в период протекания ОРЗ нужно проводить противовирусную терапию (Арбидол, Виферон, Изопринозин) в сочетании с иммунокоррекцией; лечебные мероприятия наиболее эффективны в период обострения.
Д.Т. Абдурахманов
Кафедра терапии и профболезней ГБОУ ВПО "Первый МГМУ им. И.М. Сеченова" Минздравсоцразвития РФ, Москва
Обсуждается проблема железодефицитной анемии (ЖДА), развивающейся в т. ч. при заболеваниях желудочно-кишечного тракта. Представлены сведения, касающиеся причин возникновения ЖДА, патогенеза, симптоматики, диагностики и лечения данной патологии. Особое внимание уделено препарату Феринжект (железа карбоксимальтозат), который применяется в комплексной терапии пациентов с ЖДА, обусловленной воспалительными заболеваниями кишечника.
Ключевые слова: железодефицитная анемия, дефицит железа, ферротерапия, железа карбоксимальтозат
The article discusses the problem of iron deficiency anemia (IDA), which develops against the background of many diseases, including gastrointestinal diseases. The data on the causes of IDA, pathogenesis, symptoms, diagnosis and treatment of this disease are presented. Particular attention is paid to the drug Ferinject (ferric carboxymaltosate) used for the treatment of IDA in patients with inflammatory bowel diseases.
Key words: iron deficiency anemia, iron deficiency, ferrotherapy, ferric carboxymaltosate
Наиболее частая в популяции причина анемии — дефицит железа в организме. По данным отчета Всемирной организации здравоохранения (ВОЗ) о состоянии здоровья за 2002 г., железодефицитная анемия (ЖДА) входит в десятку глобальных факторов риска развития нетрудоспособности. Так, показано, что ЖДА встречается среди 30 % населения планеты [1]. В США ЖДА наблюдается среди 5-12 % небеременных женщин и 1-5 % мужчин [2].
Метаболизм железа в организме
Общее количество железа в организме взрослого человека составляет около 3,5-4,0 г, в среднем 50 и 40 мг/кг у мужчин и женщин соответственно. Основная часть железа входит в состав гемоглобина эритроцитов (около 2,5 г), значительная часть железа (около 0,5—1,0 г) депонируется в составе ферритина или входит в состав гемсодержащих и других ферментов (миоглобина, каталазы, цитохромов) организма (около 0,4 г) и небольшая часть железа (0,003—0,007 г) находится в связанном с трансферрином состоянии в крови.
Баланс железа в организме поддерживается соответствием количества поступающего железа его потерям. В пище железо присутствует в составе гема или как негемовое железо. Ежедневно с пищей (стандартный пищевой рацион) в организм человека поступает 10—20 мг железа, из которого в норме в кишечнике всасывается около 10 % (от 3 до 15 %), что компенсирует суточные потери железа, главным образом при слущивании эпителиальных клеток. Организм обеспечивает баланс железа в организме, регулируя процесс его всасывания в кишечнике. В случае развития дефицита железа организм увеличивает процент всасываемого железа (может достигать 25 %), при избытке — уменьшает [3]. В этом процессе ключевое значение придают гепсидину — белку, который синтезируется в печени. Поступление с пищей или выведение железа, как правило, вне контроля организма.
Около 25—30 мг железа ежедневно реутилизируется после разрушения (вследствие старения) эритроцитов в селезенке и поступает снова в костный мозг для синтеза новых эритроцитов. Железо, которое всасывается в кишечнике, предварительно на поверхности энтероцита восстанавливается с участием ферроредуктаз из трехвалентного (Fe 3+ ) в двухвалентнтное (Fe 2+ ), затем с помощью специфического переносчика — транспортера двухвалентных металлов (DMT1) поступает в цитоплазму [4]. Железо в составе гема (содержится в мясе, рыбе) всасывается напрямую. В дальнейшем двухвалентное железо с помощью другого переносчика, ферропортина (также мобилизует железо из ферритина), секретируется в кровь, где снова окисляется до трехвалентного (при участии белка гефестина) и связывается с плазменным белком трансферрином [5]. Трансферрин осуществляет транспорт железа в костный мозг, где оно утилизируется для синтеза эритроцитов, или преимущественно в печень, где железо депонируется в составе ферритина (рис. 1) [6].
При снижении запасов железа, гипоксии, анемии, усиленном эритропоэзе в печени снижается синтез гепсидина, что усиливает всасывание железа в кишечнике, при хроническом воспалении синтез гепсидина в печени увеличивается и, соответственно, всасывание железа в кишечнике снижается.
Рис 1. Регуляция всасывания железа в кишечнике [Guidi G.C., Santonastaso C.L., 2010]
Ферритин — ключевой белок, отражающий запасы железа в организме. Он депонирует железо в нетоксической форме, которое при необходимости мобилизуется. В среднем одна молекула ферритина содержит до 4500 атомов железа. Главным образом железо депонируется в печени, костном мозге и селезенке. Снижение уровня ферритина в сыворотке крови является достаточно надежным показателем дефицита железа в организме, его увеличение, как правило, указывает на перегрузку организма железом. В то же время необходимо помнить, что ферритин относится к белкам острой фазы воспаления, поэтому увеличение его содержания в крови может быть следствием активного воспалительного процесса, а не телько избытка железа. В ряде случаев некоторые злокачественные опухоли обладают способностью синтезировать и секретировать в кровь большое количество ферритина (в рамках паранеопластического синдрома). В норме содержание ферритина в сыворотке крови составляет 30-300 нг/мл.
Причины железодефицитной анемии
Выделяют три глобальные причины развития дефицита железа в организме (рис. 2):
1. Недостаточное поступление с пищей или повышенная потребность.
2. Нарушение всасывания железа в кишечнике.
3. Хронические потери крови.
Рис 2. Основные причины железодефицитной анемии
В популяции наиболее частой причиной ЖДА является недостаточное поступление с пищей: по данным ВОЗ, от четверти до трети населения в мире хронически голодают из-за нехватки продуктов питания, особенно мясной пищи. Однако в клинической практике среди основных причин ЖДА выделяют хронические потери крови, прежде всего из желудочно-кишечного тракта.
Клиническая картина
При ЖДА наблюдаются общие для всех анемий проявления циркуляторно-гипоксического синдрома:
Кроме того могут встречаться специфические признаки тканевого дефицита железа:
Диагностика
Лабораторная диагностика ЖДА основана на изучении обмена железа и выявлении его дефицита. Выделяют ряд признаков, указывающих на железодефицитный характер анемии (табл. 1).
Таблица 1
Лабораторные признаки дефицита железа и ЖДА
| Параметры | Значения при ЖДА | Норма |
| Железо сыворотки, мкг/дл | < 50 | 50-180 |
| Насыщение трансферрина железом, % | < 20 | 20-50 |
| Ферритин сыворотки, нг/мл | 30-300 | |
| Средний объем эритроцита (MCV), мкм 3 | < 80 | 80-100 |
| Гипохромные эритроциты, % | > 5 | < 5 |
| Ретикулоциты, тыс/мкл | < 40 | 40-100 |
| Растворимые рецепторы к трансферрину (sTfR), мг/л | Повышены | 0,76-1,76 |
Как правило, клинико-лабораторные проявления анемии (главным образом снижение гемоглобина) развиваются при потере организмом не менее 20— 30 % запасов железа.
Дифференциальный диагноз
ЖДА наиболее часто необходимо дифференцировать с анемией хронических заболеваний и талассемией. Кроме того, могут наблюдаться смешанные формы анемии (сочетание дефицита железа с дефицитом фолиевой кислоты и/или витамина В12, сочетание ЖДА и анемии хронических заболеваний и др.).
Выявление анемии, а также установление ее железодефицитного характера, как правило, в большинстве случаев не представляет сложностей. Наиболее трудным может оказаться установление причины дефицита железа, которое часто требует длительного дифференциально-диагностического поиска, но является необходимым условием успешного лечения и улучшения прогноза заболевания. Сам по себе дефицит железа и вызванная им анемия, как правило, не угрожают жизни больного (за исключением анемической комы, которая, впрочем, в настоящее время встречается достаточно редко). Организм достаточно хорошо адаптируется к развитию дефицита железа, и клинические проявления анемии обычно развиваются только при повышенных функциональных потребностях организма (стрессе, повышенной физической нагрузке, беременности, у девушек в период становления менструального цикла и др.). Поэтому очень часто анемия протекает бессимптомно и в большинстве случаев выявляется при случайном или профилактическом обследовании. Однако заболевания, которые обусловливают развитие ЖДА, в частности злокачественные опухоли, могут быть опасными, угрожающими здоровью и жизни пациента. Поэтому независимо от выраженности клинических проявлений и тяжести ЖДА выявление причины дефицита железа является обязательным условием полноценного обследования пациента.
ЖДА при заболеваниях желудочно-кишечного тракта
Заболевания желудочно-кишечного тракта (ЖКТ) являются одной из основных причин развития ЖДА, что обусловлено нарушением всасывания железа в кишечнике или его потерями вследствие эрозивно-язвенных, опухолевых или аутоиммунных воспалительных поражений слизистой оболочки кишечника (табл. 2) [7].
Таблица 2
Заболевания ЖКТ, сопровождающиеся развитием ЖДА [Zhu A. и соавт., 2010]
| Верхние отделы ЖКТ | Нижние отделы ЖКТ | Весь ЖКТ |
| Язва желудка Язва 12-перстной кишки Рак желудка Грыжа пищеводного отверстия Эрозивный эзофагит Эрозивный гастрит Целиакия Атрофический гастрит Хронический гастрит, ассоциированный с Helicobacter pylori Операции на желудке | Аденома толстой кишки Рак толстой кишки Язвенный колит Идиопатическая язва слепой кишки | Болезнь Крона Телеангиэктазии сосудов ЖКТ Застойная гастро- и колонопатия при портальной гипертензии Паразитарные инфекции НПВС-ассоциированные гастропатия и энтеропатия |
Среди причин ЖДА (почти 30-50 % всех случаев) прежде всего рассматривают острые или хронические кровопотери из ЖКТ. Основной причиной ЖДА у женщин до менопаузы являются беременность и менструации, у женщин после менопаузы и у мужчин — хронические (латентные) потери крови из ЖКТ. Анализ кала на скрытую кровь — основной скрининговый метод выявления скрытого желудочно-кишечного кровотечения (тест положительный при выделении не менее 10 мл крови в сутки). При потере не менее 30 мл крови в сутки тест на скрытую кровь бывает положительным в 93 % случаев [8]. Наиболее часто при хронической ЖДА и особенно в случаях положительного результата кала на скрытую кровь выполняют эзофагогастродуодено- (ЭФГДС) и колоноскопию. В 5-10 % случаев анемий, связанных с заболеваниями ЖКТ, при ЭФГДС и колоноскопии не удается выявить очага поражения [9]. В 25 % случаев это обусловлено небольшим размером пораженного участка, который обнаруживается при повторном осмотре, в остальных случаях необходимо обследование тонкой кишки. В последние годы наиболее часто для выявления источника кровотечения из тонкой кишки используется беспроводная капсульная эндоскопия.
В 10-17 % случаев причиной ЖДА у мужчин и женщин старше 40 лет являются онкологические заболевания ЖКТ; прежде всего колоректальный рак. ЖДА в течение длительного времени может быть единственным проявлением рака толстой кишки правосторонней локализации, при этом размер опухоли обычно превышает 3 см. Другая наиболее частая причина ЖДА -язвенная болезнь желудка и двенадцатиперстной кишки.
При скрытых кровопотерях, обусловленных поражением тонкой кишки, наиболее часто в возрасте до 40 лет выявляют опухоли (лимфому, карциноид, аденокарциному, полипоз), ангиоэктазию артерий (Dieulafoy’s поражение), целиакию и болезнь Крона, в возрасте старше 40 лет -патологию сосудов различной природы и прием НПВС.
У трети больных воспалительными заболеваниями кишечника (болезнь Крона, язвенный колит) выявляется анемия, имеющая сложный генез (сочетание ЖДА и анемии хронических заболеваний).
При этом дефицит железа становится следствием нескольких причин:
Лечение
Лечение ЖДА включает прежде всего устранение причины дефицита железа (если это возможно) и прием препаратов железа (ферротерапия). Существует более 100 различных препаратов железа, в РФ наиболее часто используют около 10-15 лекарственных форм.
Суточная терапевтическая доза элементарного железа при лечении ЖДА для взрослых составляет в среднем 100— 200 мг в 2—3 приема. Поливитаминные комплексы, содержащие железо, не рекомендуют в качестве лечения ЖДА, т. к. они содержат недостаточное количество железа либо оно плохо всасывается в кишечнике.
При адекватном лечении уже в течение первых 3 суток наблюдается увеличение числа ретикулоцитов в крови, на 7—10-й день отмечается ретикулоцитарный криз (пик ретикулоцитоза). К 3—4-й неделе лечения имеет место увеличение уровня гемоглобина на 20 г/л. Прием препаратов железа необходимо продолжать еще в течение 3—6 месяцев после нормализации уровня гемоглобина — пока насыщение трансферрина железом не превысит 30 % и концентрация ферритина не достигнет 50 нг/мл (показатель восстановления тканевых запасов железа).
Среди 20—30 % пациентов в результате приема препаратов железа отмечаются различные диспептические расстройства (тошнота, дискомфорт в эпигастрии, диарея или запор). Риск развития желудочно-кишечных расстройств можно снизить, принимая препарат во время еды или на ночь, а также при постепенном увеличении дозы.
Среди причин неэффективности пероральных форм железа рассматривают целый ряд факторов [10]:
недостаточное поступление железа;
нерегулярный прием препаратов железа;
недостаточное содержание железа в принимаемом препарате.
Нарушение всасывания железа:
Продолжающиеся потери крови или повышенная потребность в железе:
Сопутствующие заболевания или состояния:
Неправильный диагноз или наличие других причин анемии:
Выделяют следующие показания к парентеральному введению, преимущественно внутривенному, препаратов железа:
Основная опасность при парентеральном введении железа — развитие тяжелых аллергических реакций, включая анафилактических шок с летальным исходом, которые наблюдаются в 0,6—1,0 % случаев. Данные реакции, в основном, характерны для препаратов железа, содержащих декстран.
Эффективность и безопасность Феринжекта при внутривенном введении были продемонстрированы при лечении ЖДА и в ряде других клинических ситуаций (у больных на гемодиализе, в послеродовом периоде, при тяжелом маточном кровотечении) 18.
Переливание компонентов крови (эритроцитарной массы) для лечения ЖДА применяется только при угрожающей жизни (анемической коме) или тяжелой анемии (Hb < 60 г/л), сопровождающейся признаками декомпенсации.
ЛИТЕРАТУРА
Что принято считать хроническим невоспалительным заболеванием кишечника? Какими методами можно подтвердить диагноз? Какая терапия наиболее эффективна? Рисунок 1. Слизистая кишечника при болезни Крона Хроническим воспалительным забо
Что принято считать хроническим невоспалительным заболеванием кишечника?
Какими методами можно подтвердить диагноз?
Какая терапия наиболее эффективна?
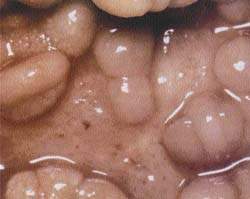 |
| Рисунок 1. Слизистая кишечника при болезни Крона |
Хроническим воспалительным заболеванием кишечника принято считать каждый длительный энтерит — как инфекционной, так и иммуноаллергической этиологии, который ведет к хроническому воспалительному процессу в кишечнике.
Помимо целиакии, эти заболевания включают в себя язвенный ректоколит, болезнь Крона и другие более редкие заболевания: колит при болезни Бехчета, некротизирующий энтероколит у детей младшего возраста. Все эти заболевания характеризуются:
— неизвестной этиологией (кроме целиакии);
— воспалительным характером поражений;
— хроническим течением и возможными рецидивами;
— ассоциацией с другими некишечными заболеваниями;
— хорошей реакцией на кортикостероидную терапию;
— возможностью хирургического разрешения (лечения).
В возникновении данных заболеваний большую роль играют как географический (встречаются чаще в Северной Европе), так и генетический факторы.
Болезнь Крона встречается чаще в западных странах и среди городского населения.
Этиология неизвестна, можно лишь предположить влияние инфекционных заболеваний и питания. Патогенез связан с нарушением ответной иммунной реакции со стороны слизистой кишечника, характер которой недостаточно изучен, известно лишь, что происходит активация Т- и В-лимфоцитов, увеличивается производство цитокинов и комплемента.
Гистопатологические наблюдения позволяют выявить два основных и множество промежуточных типов нарушений при хроническом воспалении кишечника.
Болезнь Крона. Характеризуется четко отграниченными трансмуральными сегментарными поражениями, разделенными между собой внешне неизмененной слизистой. Поражение распространяется на мезентериальные лимфоузлы. Может быть затронут любой участок желудочно-кишечного тракта, но чаще поражается кишечный отдел подвздошной кишки. Типично формирование стенозов, абсцессов и фистул. Характерны отек слизистой, изъязвления, атрофия и утолщение кишечной стенки, гиперплазия лимфоузлов.
Наблюдается гранулематозное поражение. В 60-70% случаев гранулема обнаруживается на хирургическом материале и лишь в 30-40% при биопсии. Гранулема состоит из эпителиоидных и гигантских клеток. Несмотря на тенденцию к некрозу, казеозного некроза не отмечается. Легко формируются язвы и фистулы.
Язвенный ректоколит. Это заболевание ободочной кишки. Начинается с ректального уровня и распространяется вверх. Процесс поверхностный, затрагивает подслизистую, слизистую и редко более глубокие слои. Для острой стадии характерны гиперемия слизистой, отек, легко кровоточащие эрозии и язвы. В промежутках между язвенными поражениями слизистая гипертрофирована, нередко образуются псевдополипы. Описанные поражения могут сочетаться с перианальными трещинами. Гистологически характерно образование крипт и абсцессов, в которых накапливаются лимфоциты, эозинофилы, нейтрофилы, плазматические клетки. Гранулематозная ткань отсутствует.
Варианты вышеописанных двух основных типов хронических воспалительных заболеваний кишечника:
1. Язвенный энтероколит. Некоторыми авторами считается врожденной формой болезни Крона. Поражения затрагивают весь пищеварительный тракт, но преимущественно локализуются в конечной части подвздошной кишки и в начальном участке ободочной кишки.
2. Синдром Бехчета, при котором к кишечным поражениям присоединяются ретинит, слепота, болезненные язвенные и некротические поражения слизистой рта и гениталий.
3. Некротизирующий энтероколит у грудных детей часто приводит к летальному исходу. Клинические проявления болезни приходятся на первую неделю жизни: диарея с примесью крови, признаки перитонита и шок. Характерны множественные язвенные поражения с перфорацией.
Классически хронические заболевания кишечника характеризуются как желудочно-кишечными (диарея, боли в животе, наличие крови в кале), так и общими (температура, потеря веса, задержка физического развития) симптомами.
Болезнь Крона: на фоне анорексии, типичной для этого заболевания, преобладают общие симптомы. Боли в животе напоминают приступы аппендицита. Кровь в кале обнаруживается редко. При осмотре отмечается болезненность в правой подвздошной области, там же иногда пальпируется масса.
Язвенный ректоколит: преобладают кишечные симптомы — тенезмы, диарея с примесью крови. При пальпации живота отмечается болезненность по ходу ободочной кишки.
Стенозы, абсцессы и фистулы, трещины, мегаколон, перфорации с массивным кровотечением, карцинома ободочной кишки, энтеропатия с потерей белка. Характерны такие общие осложнения, как воспаление радужки, сосудистой оболочки глаза, афтозный стоматит, артрит, перихолангит, склерозирующий холангит.
Хроническая диарея с болями в животе, кал с примесью крови позволяют думать о хроническом воспалительном заболевании кишечника.
Для подтверждения диагноза необходимо оценить данные лабораторного анализа: общий анализ крови; сидеремию; трансферинемию; иммуноглобулины; время свертываемости крови; содержание в крови кальция, фосфора, цинка, меди; костный возраст; С-реактивный белок, a1-антитрипсин; анализ кала. Особо важную роль для постановки диагноза приобрела контрастная рентгенография с барием. Широко используется рентгенография с двойным контрастированием, при которой отмечается:
— уменьшение просвета кишечной стенки;
— неоднородность рисунка;
— кистовидные участки.
Наличие этих трех признаков в терминальной части подвздошной кишки образует триаду Bodart, типичную для болезни Крона.
О распространении воспалительного процесса позволяют судить участки, заполненные лейкоцитами, меченными радиоактивным йодом I111. Компьютерная томография незаменима для выявления осложнений (фистул, абсцессов).
Окончательный диагноз ставится на основе биопсии.
Дифференциальный диагноз проводится с
— аллергическим колитом;
— узловой лимфоидной гиперплазией;
— хроническим гранулематозным заболеванием;
— аппендицитом;
— полипозом и лимфомой кишечника;
—болезнью Шенлейна — Геноха.
За последние годы значительно улучшился. Детская смертность практически исчезла (от 15 до 2%).
Большую тенденцию к рецидивам имеет язвенный ректоколит. Наблюдение за детьми заключается в
— контроле за ростом;
— контроле за показателями воспалительного процесса;
— за терапией [10].
Диетотерапия играет важную роль, особенно при болезни Крона, для которой характерна потеря веса и задержка роста [1, 2, 10, 15, 17].
Новый подход к терапии заключается в возможности достигнуть ремиссии с помощью диеты без гормональной терапии [1, 18, 21, 23, 24, 25].
Фармакотерапия основана на применении кортикостероидов [26], сульфасалазина, салазопирина [27, 28, 29], метронидазола [30]. Иммуносупрессоры малоприменимы из-за их токсичности.
Хирургическое лечение возможно при тяжелых осложнениях (мегаколон, стенозы, абсцессы, фистулы) и в случаях задержки роста в пубертатном и препубертатном периодах [13, 14].
Из клинической практики
Поражение печени, хотя и без явных клинических проявлений, встречается довольно часто при хронических заболеваниях кишечника. У взрослых в 70% случаев развивается перихолангит с портальной триадой. У 50% отмечаются жировые изменения печени. 10% приобретают заболевания печени. Цирроз печени развивается у 5%.
Другие, более тяжелые и редкие осложнения — это хронический активный гепатит, склерозирующий холангит и карцинома желчевыводящих путей.
Необходимо отметить, что у детей частым осложнением является хронический активный гепатит, в то время как перихолангит и склерозирующий холангит встречаются очень редко и протекают бессимптомно.
Представляем клинический случай язвенного колита у девочки трех лет. Начальная фаза заболевания протекала бессимптомно. Впоследствии развилась ярко выраженная гепатомегалия.
Девочка была госпитализирована в трехлетнем возрасте. За 8 месяцев до госпитализации отмечались раздражительность, потеря аппетита, непостоянные боли в животе, кал с примесью алой крови. С вышеописанной симптоматикой девочка была госпитализирована. При осмотре отмечалась значительная гепатомегалия (+4 см из-под реберной дуги по правой среднеключичной линии). В анализе крови СОЭ 104 мм в час; общий белок крови 9,9 гр%; альбумин 2,5 гр%; a1-глобулин 0,3; a2-глобулин 1,1; b-глобулин 1,0; g-глобулин 5,0; IgG 4810 мг%; щелочная фосфатаза 1273 МЕ; антитела противоядерные и против гладких мышц отсутствуют.
В период госпитализации девочка жаловалась на частые боли в животе. В кале примесь слизи и алой крови. При анализе слизи кала выявлено множество нейтрофильных лейкоцитов. Эндоскопически выявлен обширный воспалительный процесс по всей ободочной кишке с отеком слизистой. При контакте с инструментом слизистая легко кровоточила.
При множественных биопсиях проводился гистологический анализ, который выявил изрежение железистых протоков с моно- и полинуклеарной инфильтрацией.
Чрескожная печеночная биопсия выявила воспалительные и грануломатозные изменения преимущественно в портобилиарных пространствах. Более того, отмечался воспалительный процесс типа перихолангита и начального холангита в межлобулярных протоках.
Лечение преднизолоном в начальной стадии и далее салазопиридином (SAZP) привело к полной ремиссии кишечной симптоматики. Клиническая ремиссия с полной регрессией гепатомегалии (печень пальпировалась у реберной дуги) была подтверждена гистологически. Нормализовались и лабораторные показатели (IgG 997 мг%).
Известно, что язвенный колит нередко сопровождается непереносимостью белка коровьего молока, поэтому были проведены кожный тест и тест на определение специфичных IgE. IgE были значительно увеличены.
Быстрая клиническая ремиссия была обусловлена двумя факторами: назначением салазопиридина (SAZP) и одновременным исключением из диеты коровьего молока.
Chronic inflammatory bowel diseases
Summary
Chronic inflammatory bowel diseases are commonly believed to present in the form of two diseases with aetiologies of unknown origin, Ulcerative Rectocolitis and Chron’s Disease, which are characterised by important inflammatory events affecting the normal structure of the intestinal wall, with a tendency to relapse.
Both diseases share a variety of common characteristics and are thus considered by many as one single clinical entity.
The common features are the following:
- unknown aetiology
- inflammatory aspect of the lesions
- chronicity of the course of disease, with possible relapses
- association with extra-intestinal symptoms
- good response to corticosteroid therapy
- recourse to surgery (for a limited number of cases).
The aforenamed two paradigmatical pictures constitute the essentials of a spectrum comprising an indefinite number of intermediate pictures, for example Behcet’s Colitis, similar to Ulcerative Colitis but where ulcers can be found in the area of the mouth and the genitals, or Ulcerative Enterocolitis of the infant, thought to be a congenital form of Chron’s Disease.
Both pictures display gastrointestinal symptoms such as diarrhoea, tenesmus and bloody stools, usually prevailing in Ulcerative Colitis, and are accompanied by general symptoms such as fever and weight loss, usually found in Chron’s Disease.
One of the recent and most interesting aspects of Chron’s disease is the possibility to induce remission as well as restoration of the patient’s growth by administration of an elementary diet. The administration of a hypercaloric diet has also proved useful in correcting growth speed and in reducing the need of steroids, which also play an important role in inducing disease remission.
In order to further maintain remission, the administration of salazopirina (sulfosalazina) and corresponding salacylates, as well as of immunosoppressors such as azathioprine and cyclosporins, have proved useful. The administration of metronidazolo is indicated in the case of perineal injuries only. The use of surgery should be limited to complications and, in the presence of failure to thrive, only if the lesions are well delimited.
Читайте также:

