Иерсиниозы микробиология мед колледж
Обновлено: 19.04.2024
Род Yersinia содержит семь видов, из которых патогенными для человека являются Y. pestis (возбудитель чумы), Y. pseudotuberculesis (возбудитель псевдотуберкулеза), Y. enterocolitica – возбудитель острых кишечных инфекций, кишечного иерсиниоза.
Y. enterocolitica – это грамотрицательные подвижные палочки, не образующие спор и капсул. Культивируются на простых питательных средах при температуре 20–26 °C.
1) ферментируют сорбозу, инозит с образованием кислоты;
2) образуют уреазу.
По специфичности О-антигены делятся на 30 сероваров. Чаще всего заболевание вызывают серовары О3 и О9.
Иерсинии устойчивы и способны к размножению во внешней среде, выдерживают низкие температуры. Способны размножаться в молоке, овощах, фруктах, мороженом при низкой температуре. В открытых водоемах они выживают и размножаются.
Иерсиниозы – зооантропонозные заболевания. Резервуар – различные грызуны, которые выделяют бактерии с фекалиями и мочой. Путь заражения алиментарный. Заболевания регистрируются в виде вспышек или спорадических случаев.
Y. enterocolitica – факультативные внутриклеточные паразиты. Патогенность иерсиний связана с инвазивными свойствами и действием цитокинов, вирулентные штаммы обладают устойчивостью к фагоцитозу и бактерицидному действию сыворотки. Эти свойства кодируют гены плазмид. Маркерами вирулентности являются кальцийзависимость и аутоагглютинация.
Заражение может реализоваться по-разному: от бессимптомного носительства и легких форм до тяжелых и генерализованных, септических (чаще у пожилых, страдающих хроническими заболеваниями).
В патогенезе различают четыре фазы.
1. Внедрение. Иерсинии обладают тропизмом к эпителиальным клеткам тонкого кишечника, проникают в лимфатический аппарат.
2. Энтеральная. Размножение сопровождается гибелью микроорганизмов, выделением эндотоксина. Клинически выражается явлениями энтероколита и лимфаденита. На этой стадии процесс может заканчиваться, тогда развивается типичная кишечная инфекция. Если происходит прорыв лимфатического барьера, то следует третья фаза.
3. Бактериемия: развиваются сепсис и скарлатиноподобная лихорадка.
4. Вторичноочаговые и аллергические проявления. Регистрируются гепатиты, артриты, крапивница. Могут быть поражения любых органов.
1) бактериологическое исследование; материал – испражнения, кровь, моча; посев на среду Серова; посевы подвергаются холодовому обогащению неделю;
2) серологическое исследование (РПГА);
Специфическая профилактика не проводится.
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРес
30. Род сальмонеллы, род иерсинии. Их характеристики
30. Род сальмонеллы, род иерсинии. Их характеристики Бактерии подвижны, спор и капсул не образуют.На простых питательных средах. Образуют небольшие прозрачные колонии.Антигенная структура:1) О-антиген;2) Н-антиген.Cальмонеллы могут вызывать две группы
Возбудитель иерсиниоза. Yersinia enterocolitica. Иерсиниоз. Морфология возбудителя иерсиниоза. Культуральные свойства возбудителя иерсиниоза.
Иерсиниоз — инфекционное заболевание, сопровождающееся диареей, энтеритом, псевдоаппендицитом, илеитом, узловатой эритемой и (иногда) септицемией или острым артритом. Ведущий симптом заболевания — гастроэнтерит.
Возбудитель иерсиниоза (Yersinia enterocolitica) широко распространён в природе, его выделяют от насекомых, моллюсков, ракообразных, птиц, грызунов, собак, кошек, домашних сельскохозяйственных животных (основные хозяева).
Возбудитель иерсиниоза (Yersinia enterocolitica) также обнаруживают в пресной воде. Инфицирование человека происходит фекально-оральным путём. Точные значения распространённости иерсиниоза до сих пор не установлены, так как высеваемость возбудителя из фекалий при гастроэнтеритах не превышает 3%. Подъём заболеваемости отмечают в осенне-зимний период.
В Европе основной резервуар возбудителя иерсиниоза — свиньи, поэтому большинство достоверных случаев заражения связано с употреблением плохо термически обработанной свинины.
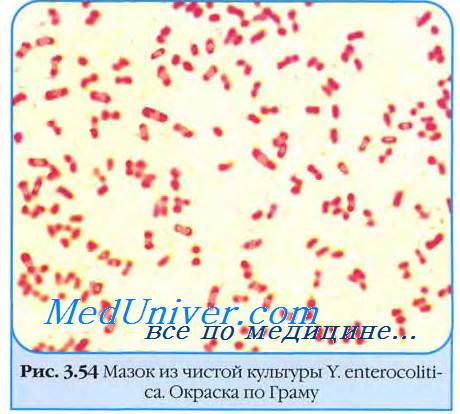
Морфология возбудителя иерсиниоза. Культуральные свойства возбудителя иерсиниоза.
Бактерии возбудителя иерсиниоза хорошо растут на простых питательных средах, на плотных средах образуют мелкие блестящие, часто выпуклые S-колонии с голубоватым оттенком в проходящем свете. Образование R-колоний для бактерий возбудителя иерсиниоза нехарактерно.
При культивировании на среде Эндо (48 ч при 37 "С) вырастают колонии возбудителя иерсиниоза розоватого оттенка. Бактерии иерсиниоза проявляют пектиназную активность, на пектиновом агаре колонии окружены зоной разжижения. При культивировании в жидких питательных средах микроорганизм вызывает их помутнение.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Основные различия между возбудителями чумы, псевдотуберкулеза и кишечного иерсиниоза представлены в табл. 29.
Все три вида иерсиний отличаются и по антигенным свойствам.
Возбудитель псевдотуберкулеза по О-антигенам разделяется на восемь групп (I – VIII) с 20 О-факторными антигенами (1 – 20). По О– и Н-антигенам (а – е) этот вид подразделяют на 13 сероваров и подсероваров (Ia, Ib, IIa, IIb, IIc, III, IVa, IVb, Va, Vb, VI, VII, VIII).
Y. enterocolitica характеризуется неоднородностью по О-антигену. Различают 34 серовара этого вида. Большинство из них адаптированы к некоторым видам животных или широко распространены во внешней среде. Подавляющее большинство штаммов, выделенных от человека, принадлежит к сероварам О3 и О9, реже встречаются серовары О6, О8, О5 и очень редко серовары О1, О2, О10, О11, О13 – О17.
От больных псевдотуберкулезом чаще всего выделяются штаммы сероваров I (Ib), III и IV.
Основные различия между возбудителями чумы, псевдотуберкулеза и кишечного иерсиниоза
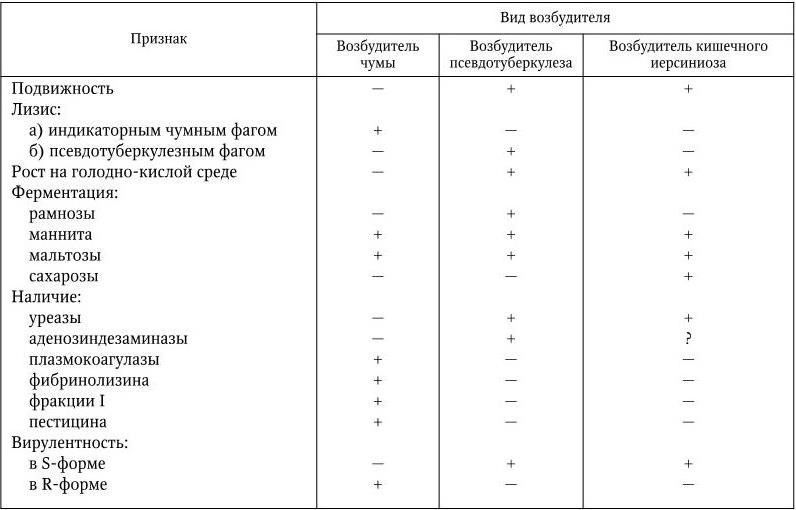
Примечание. (+) – признак положительный; ( – ) – признак отсутствует;? – не известно.
В ходе эволюции у иерсиний закрепилась необходимость существования в двух средах обитания – внешней (сапрофитическая фаза) и в организме теплокровных животных и человека (паразитическая фаза). Для осуществления паразитической фазы иерсинии должны проникнуть в организм теплокровного животного. Заражение возбудителем псевдотуберкулеза чаще всего происходит при употреблении в пищу инфицированных иерсиниями продуктов, хранившихся при пониженной температуре (4 – 12 °C) в холодильниках и овощехранилищах. В этих условиях в силу своей психрофильности бактерии могут размножаться и накапливаться в пищевых субстратах. Примером такого способа заражения является заболевание в 1988 г. псевдотуберкулезом 106 человек в Краснодарском крае, связанное с употреблением капусты, инфицированной Y. pseudotuberculosis. Основным резервуаром ее служит почва. Иерсинии при пониженной температуре обладают высоким потенциалом клеточной и тканевой инвазивности и способны сохранять высокий уровень вирулентности, однако возбудитель может проникнуть в организм человека и через любые слизистые оболочки, вероятно, за счет неспецифических механизмов. Источником иерсиниозов являются также дикие и синантропные грызуны, домашние и сельскохозяйственные животные. Возможно заражение человека от человека.
Штаммы Y. pseudotuberculosis выделены от 175 видов млекопитающих, 124 видов птиц, 7 видов рыб. Зараженные грызуны, животные и люди выделяют возбудителя с испражнениями и мочой, загрязняя воду, растения и другие объекты внешней среды, а через них заражается и человек. Таким образом, пищевой путь в передаче возбудителей псевдотуберкулеза и кишечного иерсиниоза является ведущим: заражение происходит в результате употребления в пищу сырых или недостаточно термически обработанных продуктов (мяса, мясных продуктов, молока, овощей, фруктов, зелени). Оба вида возбудителя способны размножаться не только на растениях, но и внутри них (салата, гороха, овса и т. п.).
Заболевания, вызываемые иерсиниями, характеризуются полиморфностью клинических проявлений, поражением желудочно-кишечного тракта, тенденцией к генерализации, септикопиемии и поражению различных органов и систем.
Y. enterocolitica вызывает у человека гастроэнтерит с повреждением стенок тонкого кишечника. Нередко после перенесенной болезни наблюдаются аутоиммунные спондилоартриты типа синдрома Рейтера и реактивного артрита. Полагают, что эти последствия связаны с наличием у Y. enterocolitica суперантигенов. Свойствами суперантигенов обладают мембранные белки этих бактерий.
Псевдотуберкулез людей на Дальнем Востоке описан как Дальневосточная скарлатиноподобная лихорадка. Она протекает тяжелее, чем псевдотуберкулез в западных областях, и характеризуется более сильными аллергическими и токсическими проявлениями, особенно на 2-й стадии болезни.
Патогенные свойства иерсиний обоих видов, как и возбудителя чумы, определяются не только хромосомными, но и плазмидными генами. У них обнаружены плазмиды, очень сходные с плазмидами Y. pestis, которые кодируют синтез антигенов V – W и наружных белков (Yop), таких же, как у Y. pestis, и других факторов вирулентности. Они имеют общий с Y. pestis кластер генов, связанных с системой транспорта железа. Установлено, что Y. pseudotuberculosis синтезирует термостабильный токсин, вызывающий гибель морских свинок при внутрибрюшинном заражении. Важную роль в патогенезе псевдотуберкулеза играет способность возбудителя к адгезии и колонизации слизистой кишечника.
Микробиологическая диагностика иерсиниозов включает использование бактериологических методов и серологических реакций. При бактериологическом методе исследуемый материал от больного (испражнения, кровь, слизь из зева), а также подозрительные продукты или воду засевают на среды Эндо, Плоскирева, Серова (индикаторную и дифференциальную) и инкубируют при 37 °C в течение 48 – 72 ч. Подозрительные колонии (мелкие бесцветные на средах Эндо и Плоскирева и окрашенные колонии двух различных форм на средах Серова) пересевают для получения чистых культур, которые идентифицируют по биохимическим признакам и окончательно типируют с помощью диагностических агглютинирующих сывороток.
Для серологической диагностики псевдотуберкулеза и кишечного иерсиниоза используют развернутую реакцию агглютинации (по типу реакции Видаля) с соответствующими диагностикумами или РПГА с антигенным эритроцитарным диагностикумом. Положительными считают реакции при титре антител 1: 400 и выше. Реакции рекомендуется ставить с парными сыворотками с интервалом в несколько дней. Нарастание титра антител свидетельствует о специфичности инфекционного процесса.
Чума (pestis) – острое инфекционное заболевание, протекающее по типу геморрагической септицемии. В прошлом чума была грозным бичом для человечества. Известны три пандемии чумы, которые унесли миллионы человеческих жизней.
Возбудитель чумы был открыт в 1894 г. французским ученым А. Иерсеном, в честь которого и получил название Yersinia pestis. Род Yersiniа относится к семейству Enterobacteriaceae и включает 11 видов, из них патогенными для человека являются три: Y. pestis, Y. pseudotuberculosis и Y. enterocolitica; патогенность остальных пока еще не ясна.
Резистентность. В мокроте палочка чумы может сохраняться до 10 дней; на белье и одежде, испачканных выделениями больного, сохраняется неделями (белок и слизь охраняют ее от губительного действия высыхания). В трупах людей и животных, погибших от чумы, выживает с начала осени до зимы; низкая температура, замораживание и оттаивание не убивают ее. Солнце, высыхание, высокая температура губительны для Y. pestis. Нагревание до 60 °C убивает через 1 ч, при температуре 100 °C погибает через несколько минут; 70° спирт, 5 % раствор фенола, 5 % раствор лизола и некоторые другие химические дезинфектанты убивают за 5 – 10 – 20 мин.
Антигенный состав. У Y. pestis, Y. pseudotuberculosis и Y. enterocolitica обнаружено до 18 сходных соматических антигенов. Для Y. pestis характерно наличие капсульного антигена (фракция I), антигенов T, V – W, белков плазмокоагулазы, фибринолизина, белков наружной мембраны и pH6-антигена. Однако в отличие от Y. pseudotuberculosis и Y. enterocolitica, Y. pestis в антигенном отношении более однородна;
серологической классификации этого вида нет.
1. Способность клеток сорбировать экзогенные красители и гемин. Она связана с функцией системы транспорта железа и обеспечивает Y. pestis возможность размножаться в тканях организма.
2. Зависимость роста при температуре 37 °C от наличия в среде ионов Ca 2+ .
5. Синтез капсулы (фракции I – FraI). Капсула угнетает активность макрофагов.
6. Синтез пестицина – видовой признак Y. pestis.
7. Синтез фибринолизина.
8. Синтез плазмокоагулазы. Оба эти белка локализованы в наружной мембране и обеспечивают высокие инвазивные свойства Y. pestis.
9. Синтез эндогенных пуринов.
10. Синтез термоиндуцибельных белков наружной мембраны – Yop-белков (англ. Yersinia outer proteins). Белки YopA, YopD, YopE, YopH, YopK, YopM, YopN подавляют активность фагоцитов.
11. Синтез нейраминидазы. Она способствует адгезии (высвобождает рецепторы для Y. pestis).
13. Синтез пилей адгезии. Они угнетают фагоцитоз и обеспечивают внедрение Y. pestis, как внутриклеточного паразита, в макрофаги.
14. Синтез аминопептидаз широкого спектра действия.
15. Эндотоксин (ЛПС) и другие компоненты клеточной стенки, обладающие токсическим и аллергенным действием.
16. pH6-антиген. Он синтезируется при температуре 37 °C и низкой рН, подавляет фагоцитоз и обладает цитотоксическим действием на макрофаги.
Значительная часть факторов патогенности Y. pestis контролируется генами, носителями которых являются следующие 3 класса плазмид, обнаруживаемых обычно вместе у всех патогенных штаммов:
1) рYP (9,5 т. п. н.) – плазмида патогенности. Несет 3 гена:
pst – кодирует синтез пестицина;
pim – определяет иммунитет к пестицину;
pla – определяет фибринолитическую (активатор плазминогена) и плазмокоагулазную активность.
3) pYV (110 т. п. н.) – плазмида вирулентности. Она определяет зависимость роста Y. pestis при 37 °C от присутствия в среде ионов Ca 2+ , поэтому имеет другое название – Lcr-плазмида (англ. low calcium response). Гены этой, особенно важной, плазмиды кодируют также синтез антигенов V и W и термоиндуцируемых белков Yop. Их синтез осуществляется под сложным генетическим контролем при температуре 37 °C и в отсутствие в среде Ca 2+ . Все типы Yop-белков, кроме YopM и YopN, гидролизуются за счет активности активатора плазминогена (ген pla плазмиды pYP). Белки Yop во многом определяют вирулентность Y. pestis. YopE-белок обладает антифагоцитарным и цитотоксическим действием. YopD обеспечивает проникновение YopE в клетку-мишень; YopH обладает антифагоцитарной и протеин-тирозин-фосфатазной активностью; белок YopN – свойствами кальциевого сенсора; YopM связывается с ?-тромбином крови человека.
Эпидемиология. Круг теплокровных носителей чумного микроба чрезвычайно обширен и включает более 200 видов 8 отрядов млекопитающих. Основным же источником чумы в природе являются грызуны и зайцеобразные. Естественная зараженность установлена у более чем 180 их видов, свыше 40 из них входят в состав фауны России и сопредельных территорий (в пределах бывшего СССР). Из 60 видов блох, для которых в экспериментальных условиях установлена возможность переноса возбудителя чумы, на этой территории обитают 36.
Основные (главные) носители Y. pestis на территории России и Средней Азии – суслики, песчанки и сурки, в некоторых очагах также пищухи и полевки. С ними связано существование следующих очагов чумы:
1) 5 очагов, в которых основным носителем чумного микроба выступает малый суслик (Северо-Западный Прикаспий; Терско-Сунженское междуречье; Приэльбрусский очаг; Волго-Уральский и Зауральский полупустынные очаги).
2) 5 очагов, в которых носители – суслики и сурки (на Алтае – пищухи): Забайкальский, Горно-Алтайский, Тувинский и высокогорные Тянь-Шанский и ПамироАлайский очаги.
3) Волго-Уральский, Закавказский и Среднеазиатский пустынные очаги, где основные носители – песчанки.
4) Высокогорные Закавказский и Гиссарский очаги с основными носителями – полевками.
Разные классификации Y. pestis основываются на разных группах признаков – биохимических особенностях (глицерин-позитивные и глицерин-негативные варианты), области распространения (океанические и континентальные варианты), видах основных носителей (крысиный и сусликовый варианты). По одной из наиболее распространенных классификаций, предложенной в 1951 г. французским исследователем чумы Р. Девинья (R. Devignat), в зависимости от географического распространения возбудителя и его биохимических свойств различают три внутривидовые формы (биовара) Y. pestis (табл. 28).
По классификации отечественных ученых (Саратов, 1985), вид Y. pestis разделен на 5 подвидов: Y. pestis subsp. pestis (основной подвид; он включает все три биовара классификации Р. Девинья), Y. pestis subsp. altaica (алтайский подвид), Y. pestis subsp. caucasica (кавказский подвид), Y. pestis subsp. hissarica (гиссарский подвид) и Y. pestis subsp. ulegеica (улэгейский подвид).
Заражение человека происходит через укус блох, при прямом контакте с заразным материалом, воздушно-капельным, редко алиментарным путем (например, при употреблении мяса верблюдов, больных чумой). В 1998 – 1999 гг. чумой в мире переболело 30 534 человека, из них 2 234 умерли.
Дифференциальные признаки биоваров Y. pestis
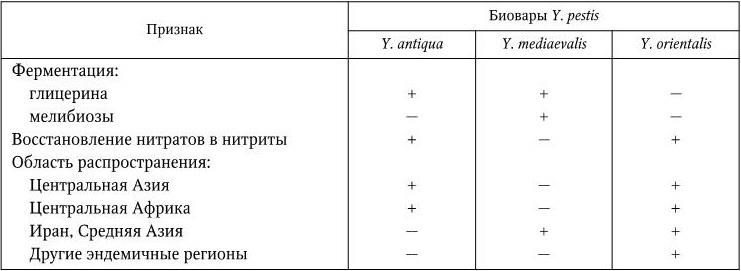
Примечание. (+) – признак положительный; ( – ) – признак отсутствует.
Постинфекционный иммунитет прочный, пожизненный. Повторные заболевания наблюдаются крайне редко. Природа иммунитета клеточная. Хотя антитела появляются и играют определенную роль в приобретенном иммунитете, он опосредуется главным образом Т-лимфоцитами и макрофагами. У лиц, переболевших чумой или вакцинированных, фагоцитоз имеет завершенный характер. Он и обусловливает приобретенный иммунитет.
Лабораторная диагностика. Используются бактериоскопический, бактериологический, серологический и биологический методы, а также аллергическая проба с пестином (для ретроспективной диагностики). Материалом для исследования служат: пунктат из бубона (или его отделяемое), мокрота, кровь, при кишечной форме – испражнения. Y. pestis идентифицируют на основании морфологии, культуральных, биохимических признаков, пробы с чумным фагом и с помощью биологической пробы. Простым и надежным методом определения антигенов чумной палочки в исследуемом материале является применение РПГА, особенно с использованием эритроцитарного диагностикума, сенсибилизированного моноклональными антителами к капсульному антигену, и ИФМ. Эти же реакции могут быть использованы для обнаружения антител в сыворотке больных.
Биологический метод диагностики заключается в заражении исследуемым материалом (когда он очень загрязнен сопутствующей микрофлорой) морской свинки накожно, подкожно или, реже, внутрибрюшинно.
При работе с материалом, содержащим возбудителя чумы, требуется соблюдение строгого режима, поэтому все исследования проводятся только хорошо обученным персоналом в специальных противочумных учреждениях.
Профилактика. Постоянный контроль за природными очагами чумы и организация мероприятий по предупреждению заболеваний людей в стране осуществляется специальной противочумной службой. Она включает в себя пять противочумных институтов и десятки противочумных станций и отделений.
Несмотря на наличие природных очагов, с 1930 г. на территории России в них не было ни одного случая заболевания людей чумой. Для специфической профилактики чумы используется живая ослабленная вакцина из штамма EV. Она вводится накожно, внутрикожно или подкожно. Кроме того, предложена сухая таблетированная вакцина для перорального применения. Поствакцинальный иммунитет формируется к 5 – 6-му дню после прививки и сохраняется в течение 11 – 12 мес. Для его оценки и ретроспективной диагностики чумы предложена внутрикожная аллергическая проба с пестином. Реакция считается положительной, если на месте введения пестина через 24 – 48 ч образуется уплотнение не менее 10 мм в диаметре и появляется краснота. Аллергическая проба положительна и у лиц, имеющих постинфекционный иммунитет.
Читайте также:

